Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Интегрированная фотоакустическая, ультразвуковая и ангиографическая томография (PAUSAT) для неинвазивной визуализации всего мозга при ишемическом инсульте
В этой статье
Резюме
Эта работа демонстрирует использование мультимодальной платформы визуализации на основе ультразвука для неинвазивной визуализации ишемического инсульта. Эта система позволяет количественно определять оксигенацию крови с помощью фотоакустической визуализации и нарушение перфузии в головном мозге с помощью акустической ангиографии.
Аннотация
Здесь представлено экспериментальное исследование ишемического инсульта с использованием нашей недавно разработанной неинвазивной системы визуализации, которая объединяет три акустические технологии визуализации: фотоакустическую, ультразвуковую и ангиографическую томографию (PAUSAT). Сочетание этих трех методов помогает получить мультиспектральную фотоакустическую томографию (ПАТ) оксигенации крови головного мозга, высокочастотную ультразвуковую визуализацию тканей головного мозга и акустическую ангиографию перфузии церебральной крови. Мультимодальная платформа визуализации позволяет изучать изменения церебральной перфузии и оксигенации во всем мозге мыши после инсульта. Были оценены две широко используемые модели ишемического инсульта: модель постоянной окклюзии средней мозговой артерии (pMCAO) и модель фототромботической (PT). PAUSAT использовался для визуализации одного и того же мозга мыши до и после инсульта и количественного анализа обеих моделей инсульта. Эта система визуализации смогла четко показать сосудистые изменения головного мозга после ишемического инсульта, включая значительное снижение перфузии крови и оксигенации в области инсульта инфаркта (ипсилатерально) по сравнению с неповрежденной тканью (контралатерально). Результаты были подтверждены как лазерной спекл-контрастной визуализацией, так и окрашиванием хлоридом трифенилтетразолия (ТТС). Кроме того, объем инсульта инфаркта в обеих моделях инсульта был измерен и подтвержден окрашиванием TTC в качестве основной истины. Благодаря этому исследованию мы продемонстрировали, что PAUSAT может быть мощным инструментом в неинвазивных и продольных доклинических исследованиях ишемического инсульта.
Введение
Кровь транспортирует кислород (через белок гемоглобин) и другие важные питательные вещества к тканям нашего организма. Когда поток крови через ткани прерывается (ишемия), может произойти серьезное повреждение тканей, самые непосредственные последствия которого обусловлены недостатком кислорода (гипоксия). Ишемический инсульт является результатом прерванного притока крови к определенной области мозга. Повреждение головного мозга в результате ишемического инсульта может произойти в течение нескольких минут после закупорки сосуда и часто может иметь изнурительные и длительные последствия 1,2. Очень ценной стратегией оценки физиопатологии после ишемического инсульта, а также выявления и тестирования новых методов лечения является использование моделей мелких животных в лаборатории. Методы лечения, обнаруженные в лаборатории, направлены на то, чтобы быть переведенными на клиническое использование и улучшить жизнь пациентов. Тем не менее, использование животных в биомедицинских исследованиях должно быть тщательно оценено в соответствии с принципами 3R Рассела и Берча: замена, сокращение и уточнение3. Цель компонента сокращения состоит в том, чтобы сократить количество животных без ущерба для сбора данных. Имея это в виду, возможность продольной оценки эволюции поражения с помощью неинвазивной визуализации дает большое преимущество в сокращении количества необходимых животных, а также в максимальном увеличении информации, полученной от каждого животного4.
Фотоакустическая томография (ПАТ) представляет собой гибридный метод визуализации, который сочетает в себе контраст оптического поглощения с пространственным разрешениемультразвуковой визуализации 5. Механизм визуализации ПАТ заключается в следующем. На изображаемой цели подсвечивается возбуждающий лазерный импульс. Предполагая, что мишень поглощает свет на длине волны возбуждающего лазера, ее температура будет увеличиваться. Это быстрое повышение температуры приводит к термоупругому расширению мишени. Расширение приводит к тому, что ультразвуковая волна распространяется от мишени. Детектируя ультразвуковую волну во многих положениях, время, необходимое для распространения волны от мишени к детекторам, может быть использовано для создания изображения с помощью алгоритма реконструкции. Способность ПАТ обнаруживать оптическое поглощение в глубоких областях тканей отличает ПАТ от ультразвуковой визуализации, которая обнаруживает границы различных акустических импедансов тканей5. В видимом и ближнем инфракрасном спектрах основными биомолекулами с высокой степенью поглощения, которые в изобилии присутствуют в организмах, являются гемоглобин, липиды, меланин и вода7. Особый интерес при изучении инсульта представляет гемоглобин. Поскольку оксигемоглобин и дезоксигемоглобин имеют разные спектры оптического поглощения, PAT можно использовать с несколькими длинами волн возбуждающего лазера для определения относительной концентрации двух состояний белка. Это позволяет количественно оценить насыщение гемоглобина кислородом (sO2) или оксигенацию крови в области инфаркта 8,9 и за ее пределами. Это важный показатель при ишемическом инсульте, так как он может указывать на уровень кислорода в поврежденной ткани мозга после ишемии.
Акустическая ангиография (АА) - это метод ультразвуковой визуализации с контрастным усилением, который особенно полезен для визуализации морфологии сосудистой сети in vivo10. Метод основан на использовании двухэлементного воблера-преобразователя (низкочастотный элемент и высокочастотный элемент) в сочетании с микропузырьками, вводимыми в кровеносную систему объекта визуализации. Низкочастотный элемент преобразователя используется для передачи на резонансной частоте микропузырьков (например, 2 МГц), в то время как высокочастотный элемент используется для приема супергармонических сигналов микропузырьков (например, 26 МГц). При возбуждении на резонансной частоте микропузырьки имеют сильный нелинейный отклик, что приводит к выработке супергармонических сигналов, которые окружающие ткани организма не производят11. При приеме с помощью высокочастотного элемента это гарантирует, что будут обнаружены только сигналы микропузырьков. Поскольку микропузырьки ограничены кровеносными сосудами, результатом является ангиографическое изображение морфологии кровеносных сосудов. АА является мощным методом визуализации ишемического инсульта, так как микропузырьки, которые протекают через систему кровообращения, не могут течь через заблокированные сосуды. Это позволяет АА выявлять участки мозга, которые не перфузируются из-за ишемического инсульта, что указывает на область инфаркта.
Доклинические исследования ишемического инсульта обычно основаны на использовании гистологии и поведенческого тестирования для оценки локализации и тяжести инсульта. Окрашивание хлоридом трифенилтетразолия (ТТС) является распространенным гистологическим анализом, используемым для определения объема инфаркта инсульта. Однако его можно использовать только в конечной точке, так как он требует эвтаназииживотного 12. Поведенческие тесты могут быть использованы для определения нарушения двигательной функции в несколько моментов времени, но они не могут обеспечить количественные анатомические или физиологические значения13. Биомедицинская визуализация обеспечивает более количественный подход к изучению эффектов ишемического инсульта неинвазивно и продольно 9,14,15. Однако существующие технологии визуализации (такие как магнитно-резонансная томография мелких животных [МРТ]) могут стоить дорого, быть неспособными предоставить одновременную структурную и функциональную информацию или иметь ограниченную глубину проникновения (как большинство методов оптической визуализации).
Здесь мы комбинируем фотоакустическую, ультразвуковую и ангиографическую томографию (PAUSAT; см. системную схему на рисунке 1), что позволяет получить дополнительную структурную и функциональную информацию о перфузии крови и оксигенации после ишемического инсульта16. Это два важных аспекта в оценке тяжести травмы и мониторинге выздоровления или реакции на лечение. Использование этих интегрированных методов визуализации может увеличить объем информации, получаемой каждым животным, уменьшая количество необходимых животных и предоставляя больше информации для изучения потенциальных методов лечения ишемического инсульта.
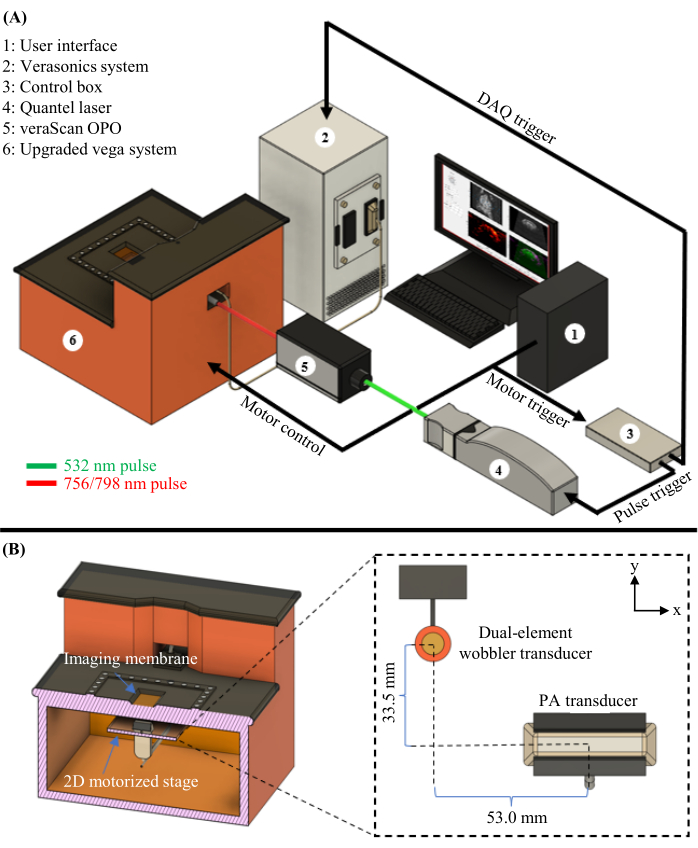
Рисунок 1: Диаграмма PAUSAT. (A) Полная схема системы PAUSAT, включая лазер и OPO, используемые для PAT. (B) Внутренний вид системы PAUSAT, включая два ультразвуковых преобразователя. Двухэлементный преобразователь воблера используется как для ультразвука в B-режиме, так и для АА, а преобразователь с линейной матрицей используется для PAT. Оба преобразователя установлены на одном и том же 2D-моторизованном столике, что позволяет сканировать его для получения объемных данных. Эта цифра была изменена с16. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
Все процедуры на животных были одобрены Комитетом по уходу за животными и их использованию Медицинского центра Университета Дьюка и проводились в соответствии с Политикой Службы общественного здравоохранения США по гуманному уходу и использованию лабораторных животных. Для этих исследований использовали самцов и самок мышей C57BL/6J (см. Таблицу материалов). В каждой модельной группе инсульта было изображено не менее трех животных. На рисунке 2 показан рабочий процесс, используемый в этом протоколе.
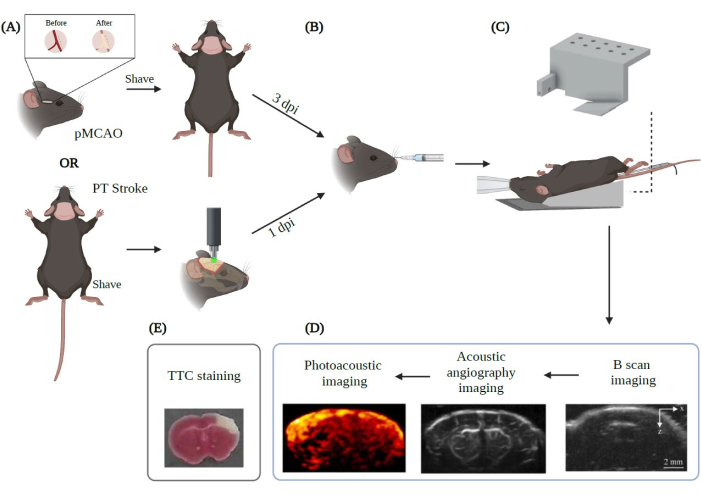
Рисунок 2: Краткое изложение экспериментальной процедуры визуализации PAUSAT применительно к инсульту. Создано с помощью Biorender.com. На рисунке показан рабочий процесс процедуры визуализации, начиная с (A) двух основных моделей инсульта (pMCAO и PT инсульта). (B) Ретроорбитальная инъекция микропузырьков должна быть выполнена до размещения животного на мембране PAUSAT. (C) В этой установке требуется маска, обеспечивающая непрерывную анестезию, и грелка для поддержания стабильной температуры тела животного. Тело животного помещается на грелку, в то время как голова опирается на мембрану системы. (D) Порядок получения изображения также показан на рисунке. (E) Окрашивание TTC проводится для подтверждения наших результатов в этом исследовании. DPI: дни после травмы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
1. Индуцирование модели мыши с обводкой
- Постоянная окклюзия средней мозговой артерии (pMCAO) с перевязкой общей сонной артерии (CCA).
ПРИМЕЧАНИЕ: Вкратце, выполните постоянную перевязку правой CCA и заднюю электрокоагуляцию правой средней мозговой артерии (MCA)17. Эта процедура ограничивает мозговой кровоток в правой коре головного мозга, вызывая ишемический инсульт18.- Индуцируют анестезию в индукционной камере с помощью ингаляционной смеси 5,0% изофлурана в 30% O2/70%N2 до потери сознания (распознается как потеря педального рефлекса).
- Интубируют животное с помощью катетера 20 G (Таблица материалов) и подключают его к автоматическому аппарату искусственной вентиляции легких. Установите скорость потока в зависимости от массы тела животного и держите животное под наркозом, используя 1,5-2,0% изофлурана в 30% O 2/70% N2.
- С помощью нагревательной лампы и ректального зонда, подключенного к устройству контроля температуры, поддерживайте температуру тела животного на уровне 37 °C.
- Нанесите каплю смазывающей глазной мази на глаза мыши.
- Поместите животное в положение лежа на спине и удалите шерсть с области шеи с помощью триммера для волос.
- Очистите участок кожи, сначала используя ватный тампон с повидон-йодом, а затем стерильный тампон с 70% этанолом. Выполните это трижды.
- Убедиться в глубине анестезии и отсутствии болевых ощущений можно, слегка ущипнув заднюю лапу животного.
- Сделайте сагиттальный разрез 0,8 см по средней линии шеи и обнажите правый КЦА.
- Подготовьте шов для перевязки CCA, разделив шелковый шов 4-0 на более тонкие нити, составляющие основную нить. Используйте длину 1,5 см одного из поднитей, чтобы навсегда перевязать CCA.
ПРИМЕЧАНИЕ: После затягивания узла удалите лишнюю нить, разрезав удлинитель на расстоянии 1-2 мм от узла. - Нанесите каплю бупивакаина перед закрытием раны.
- Закройте разрез прерванными шелковыми хирургическими швами 4-0 и нанесите на поверхность мазь с тройным антибиотиком, чтобы предотвратить инфекцию.
- Переместите мышь, чтобы обнажить правую боковую сторону тела животного.
-
Удалите волосы в области между ухом и областью вокруг глаз с помощью триммера для волос.
-
Продезинфицируйте операционную область с помощью ватного тампона с повидон-йодом, а затем стерильной прокладки с 70% этанолом. Повторите этот шаг три раза.
-
Поместите стерильную простыню, чтобы закрепить операционную область. Затем сделайте разрез 0,5 см между правым глазом и ухом животного, обнажив сустав между черепом и височной мышцей.
- Используя петлю прижигания, прижигайте мышцу, чтобы отделить ее от черепа и обнажить область MCA.
- Просверлите окно 0,2 мм2 , чтобы обнажить MCA с помощью электрической дрели, и используйте электрокоагуляцию на MCA, чтобы перекрыть кровоток.
ПРИМЕЧАНИЕ: Одного импульса при 80% интенсивности мощности достаточно, чтобы прижечь MCA. - Используя шприц объемом 1 мл, прикрепленный к игле 27 г, нанесите каплю бупивакаина (таблица материалов) на место операции.
- Закройте разрез кожи прерывистыми прозрачными монофиламентными швами 6-0 и нанесите на поверхность мазь с тройным антибиотиком, чтобы предотвратить инфекцию.
- После завершения операции переведите животное в инкубатор с контролируемой температурой (32 °C) и дайте животному восстановиться.
- Через 2 часа переведите животное в домашнюю клетку и обеспечьте еду и воду ad libitum.
- Фототромботический инсульт (ПТ-инсульт)
ПРИМЕЧАНИЕ: Вкратце, PT-инсульт выполняется путем освещения бенгальской розы в сосудах головного мозга. Бенгальская роза вводится внутрибрюшинно, и после того, как она хорошо распределена по всему телу (5 минут), она освещается зеленым холодным светом, который активирует бенгальскую розу для генерации активных форм кислорода (АФК). Эти АФК повреждают мембрану эндотелиальных клеток, создавая тромбы во всей освещенной области и приводя к локальному нарушению мозгового кровотока19.- Индуцируют анестезию в индукционной камере с помощью ингаляционной смеси 5,0% изофлурана в 30% O2/70%N2 до потери сознания (распознается как потеря педального рефлекса).
- Установите животное в стереотаксическую рамку, сохраняя животное под наркозом с помощью маски и 1,5%-2,0% изофлурана в 30% O 2/70% N2.
- Держите животное при температуре 37 °C, используя рециркуляционный нагреватель горячей воды и ректальный зонд для измерения температуры тела животного.
- Нанесите каплю смазывающей глазной мази на глаза мыши.
- Побрейте голову животного с помощью триммера для волос.
- Трижды очистите выбритую область кожи головы, сначала с помощью ватного тампона с повидон-йодом, а затем с помощью стерильного тампона с 70% этанолом.
- Убедиться в отсутствии болевых ощущений можно, слегка пощипав заднюю лапу животного.
- Сделайте сагиттальный разрез 1,4 см на средней линии кожи головы с помощью скальпеля и обнажьте череп.
- Острым карандашом сделайте отметку на расстоянии 1,5 мм от брегмы в сторону правой стороны.
- Поместите круглое отверстие диаметром 2,5 мм по центру метки 1,5 мм.
ПРИМЕЧАНИЕ: Квадрат, содержащий круглое точечное отверстие, можно сделать с помощью двусторонней черной ленты и сделать отверстие диаметром 2,5 мм в центре с помощью перфоратора с одним отверстием указанного размера. - Поместите зеленый холодный свет на круглое отверстие, сведя зазор между светом и отверстием к минимуму.
- Накройте область алюминиевой фольгой, чтобы избежать распространения света.
- Как только установка будет готова, введите животному внутрибрюшинно 10 мг / кг бенгальской розы (10 мг / мл в 1x фосфатно-буферном физиологическом растворе [PBS]) и подождите 5 минут.
- Через 5 минут включите источник холодного света (интенсивность: 4,25) и поддерживайте экспозицию в течение 15 минут.
- Затем выключите холодный свет и проверьте инсульт либо невооруженным глазом (ожидается, что область будет белее, чем окружающая область), либо с помощью внешних устройств для измерения мозгового кровотока (например, с помощью лазерной спекл-контрастной визуализации (таблица материалов; см. шаг 5.1).
- Используя шприц объемом 1 мл, прикрепленный к игле 27 г, нанесите каплю бупивакаина (таблица материалов) на место операции.
- Закройте разрез кожи прерывистыми прозрачными монофиламентными швами 6-0 и нанесите на поверхность мазь с тройным антибиотиком, чтобы предотвратить инфекцию.
- После завершения операции переведите животное в инкубатор с контролируемой температурой (32 °C) и дайте животному восстановиться.
- Через 2 часа переведите животное в домашнюю клетку и обеспечьте еду и воду ad libitum.
2. Подготовка PAUSAT к визуализации
- Включите лазер с длиной волны 532 нм и оставьте его включенным на 15 минут для разогрева.
- Подготовьте платформу визуализации для анестезированного животного.
- Установите индивидуальную рампу (рис. 2C), прикрепленную к регулируемому вручную столику (таблица материалов), рядом с мембраной визуализации.
- Прикрепите держатель зубов мыши с дыхательной трубкой, подключенной к индивидуальной рампе, и закрепите грелку на поверхности рампы.
- После того, как лазер нагреется, убедитесь, что путь лазера и соединение с оптоволоконным пучком хорошо выровнены, используя карту детектора ближнего инфракрасного диапазона (таблица материалов), поместив карту перед входом оптоволоконного пучка и убедившись, что лазерный свет попадает в пучок.
ПРИМЕЧАНИЕ: При необходимости отрегулируйте все зеркала лазерного пути, чтобы убедиться, что вход лазера центрирован по отношению к входу оптоволокна.
3. Подготовка животного к PAUSAT
ПРИМЕЧАНИЕ: PAUSAT выполняется через 1 день после операции по удалению инсульта или через 3 дня после операции pMCAO. Подготовка PAUSAT к визуализации (шаг 2) занимает около 20 минут и должна быть выполнена непосредственно перед подготовкой животного к PAUSAT.
- Индуцируют анестезию в индукционной камере с помощью ингаляционной смеси из 5% изофлурана, смешанного с 30% O2/70%N2 до потери сознания (распознаваемой как потеря педального рефлекса).
- Перенесите животное на подогреваемую платформу с держателем для зубов и маской и поддерживайте анестезию на уровне 1,5%-2,0% изофлурана в 30% O 2/70% N2.
- Используйте нагревательную лампу и ректальный зонд, подключенный к устройству контроля температуры, чтобы поддерживать температуру тела животного на уровне 37 °C.
- Подстригите шерсть на макушке головы животного с помощью электробритвы. Включите область от глаз до ушей.
- Сбрейте шерсть на макушке головы животного, нанеся коммерческий крем для удаления волос, чтобы полностью удалить оставшиеся короткие волосы. Оставьте на коже на 5-6 минут, затем вытрите ватным тампоном, смоченным в воде, чтобы полностью удалить крем. Повторяйте до тех пор, пока кожа не очистится от волос.
ПРИМЕЧАНИЕ: Для визуализации через 1 день после операции эти шаги могут быть выполнены до начала операции; через 1 день после инсульта ПТ их можно опустить. Когда получение изображения PAUSAT выполняется через несколько дней после операции, этот шаг критически необходим. - Как только животное и система будут готовы к визуализации, и непосредственно перед переносом животного на платформу системы, введите 100 мкл раствор микропузырьков с исходной концентрацией (таблица материалов) на ретроорбитальной орбите с помощью иглы 27 G.
ПРИМЕЧАНИЕ: После того, как пузырьки циркулируют в кровотоке, существует ограниченное количество времени для получения изображения без значительной потери сигнала (~ 10 минут). - Нанесите каплю лосьона для защиты глаз на глаза мыши.
ПРИМЕЧАНИЕ: Не рекомендуется наносить смазку для глаз до тех пор, пока не будет выполнена ретроорбитальная инъекция, чтобы избежать попадания посторонних веществ в кровоток животного. Поэтому нанесение крема для удаления волос должно выполняться медленно и осторожно, чтобы не подходить слишком близко к глазам (но достаточно, чтобы обнажить интересующую область, где ожидается инсульт). Кремовая эпиляция выполняется ватным тампоном, предварительно смоченным в воде, чтобы крем не капал, что может повредить глаза.
4. Визуализация PAUSAT
ПРИМЕЧАНИЕ: Это делается для визуализации контра- и ипси-латеральных областей мозга после инсульта
- Переместите мышь на интегрированную платформу изображений PAUSAT (Table of Materials), поместив мышь в положение лежа на спине на настраиваемой рампе (рис. 2C).
- Заполните окно визуализации достаточным количеством дистиллированной воды на поверхности для акустической связи.
ПРИМЕЧАНИЕ: Рекомендуется дополнительная рампа, напечатанная с помощью 3D-принтера, чтобы предотвратить намокание тела животного во время получения изображения и повысить комфорт животного. Это также помогает поддерживать стабильную температуру тела. Кроме того, рампа может быть прикреплена к ручному столику (Таблица материалов) для регулировки глубины фокусировки двухэлементного воблера-преобразователя относительно головки мыши. Файл индивидуального дизайна рампы предоставляется авторам по запросу. - Закрепите головку мыши в зубодержателе и обеспечьте надлежащую анестезию и приток воздуха.
- С помощью нагревательной лампы и ректального зонда, подключенного к устройству контроля температуры, поддерживайте температуру тела животного на уровне 37 °C.
- Откройте приложение для визуализации (Таблица материалов) и перейдите к УЗИ в режиме B.
- Используйте окно УЗИ в реальном времени, чтобы вручную отрегулировать головку мыши в нужное положение.
- Используйте окно УЗИ в реальном времени, чтобы отрегулировать высоту столика таким образом, чтобы фокусная глубина датчика (19 мм) находилась примерно посередине области, подлежащей визуализации.
- Визуализация с помощью ультразвука в режиме B
- Отрегулируйте значение частоты передачи ультразвука в B-режиме (для этих исследований используйте 16 МГц).
- Введите сведения о каталоге сохранения в приложении для создания образов.
- Используйте плавающее поле, чтобы выбрать нужную область для сканирования мозга в режиме B.
- Нажмите кнопку Получить статику .
- Проверьте результаты сканирования в приложении после завершения получения изображения, чтобы убедиться, что нужная область была сфотографирована.
ПРИМЕЧАНИЕ: Избегайте ненужных задержек при получении изображений в B-режиме, чтобы убедиться, что в кровотоке остается достаточно высокая концентрация микропузырьков для АА.
- Визуализация с помощью АА
- Вернитесь к разделу «Получение изображений».
- Переключитесь в режим акустической ангиографии в приложении для визуализации (таблица материалов).
- Введите желаемые параметры протокола сканирования (наиболее важными из которых являются интервал между кадрами и количество кадров на позицию, которое для этих исследований было установлено равным 0,2 мм и 10 соответственно).
- Нажмите кнопку Получить статику .
ПРИМЕЧАНИЕ: Получение АА занимает больше времени, чем ультразвук в B-режиме. - После завершения сканирования проверьте результаты сканирования в разделе «Анализ изображений », чтобы убедиться, что качество изображения соответствует ожидаемому.
ПРИМЕЧАНИЕ: Для режима АА более репрезентативный объем всего мозга можно получить, повторив второе сканирование на другой глубине фокуса внутри мозга и позже рекомбинировав изображения с надлежащей постобработкой (см. рис. 3).
- Визуализация с помощью фотоакустической томографии
- Откройте приложение оптического параметрического генератора (OPO) (Таблица материалов) и установите его на 756 нм.
ПРИМЕЧАНИЕ: OPO могут легко выйти из калибровки, поэтому перед экспериментом убедитесь, что OPO откалиброван правильно с помощью независимого спектрометра. - Вручную преобразуйте преобразователь линейной решетки в ранее определенные координаты, чтобы обеспечить автоматическую совместную регистрацию томов воблера и объемов линейного массива.
ПРИМЕЧАНИЕ: Крайне важно, чтобы эксперимент по совместной регистрации с использованием фантомной сетки был проведен заранее, чтобы определить точное расстояние, необходимое для перевода ступени, чтобы полученные данные от обоих преобразователей были совместно зарегистрированы в 3D. - Откройте приложение лазера и включите лазер с длиной волны 532 нм.
- Используя измеритель мощности лазера, измерьте энергию выхода лазера и убедитесь, что это желаемая энергия (для этих исследований использовалось ~ 10 мДж на импульс).
- Выберите желаемые параметры сканирования для PAT (размер шага 0,4 мм, длина сканирования 20 мм и 10 кадров, усредненных по позиции).
- Откройте программу системы сбора ультразвуковых данных MATLAB (Таблица материалов) и нажмите кнопку «Выполнить ».
- Получите сканирование PAT, нажав кнопку «Пуск ».
- После завершения сканирования откройте программу сохранения MATLAB. Измените имя сохранения на нужное имя файла и нажмите кнопку «Выполнить ».
- Измените длину волны OPO на 798 нм и повторите шаги с 4.10.3 по 4.10.8.
ПРИМЕЧАНИЕ: Для лонгитюдного исследования рекомендуется дать животному восстановиться, поместив его в инкубатор и под наблюдением в течение нескольких часов (следуя шагам 1.1.18 и 1.1.19). Если требуется проверка результатов, перейдите к разделу 5 сразу после визуализации PAUSAT.
- Откройте приложение оптического параметрического генератора (OPO) (Таблица материалов) и установите его на 756 нм.
5. Необязательно: проверка результатов
- Лазерная спекл-контрастная томография (LSCI).
- Обезболивают животное, используя 1,5%-2,0% изофлурана в 30% O2/70%N2.
- Установите животное в стереотаксическую раму, держа животное под наркозом с помощью маски и вышеупомянутой ингаляционной анестезии.
- Держите животное при температуре 37 °C, используя рециркуляционный нагреватель горячей воды и ректальный зонд для измерения температуры тела животного.
- Нанесите каплю лосьона для защиты глаз на глаза мыши.
- Убедиться в отсутствии болевых ощущений можно, слегка пощипав заднюю лапу животного.
- Удалите шерсть на коже головы животного с помощью триммера для волос.
- Продезинфицируйте операционную область с помощью ватного тампона с повидон-йодом, а затем стерильной прокладки с 70% этанолом. Повторите этот шаг три раза.
- Сделайте сагиттальный разрез 1,4 мм по средней линии волосистой части головы и обнаживите череп. Используйте щипцы, чтобы удерживать кожу головы и не позволять ей занимать область мозга для сканирования.
- Нанесите несколько капель физиологического раствора на череп и поместите устройство лазерной системы спекл-контраста (таблица материалов) над головой животного.
- В меню « Файл » установите устройство в онлайн-режим, содержащийся в подменю «Рабочий режим».
- Выберите папку хранилища изображений по умолчанию в меню « Файл » и подменю « Сохранить настройки ».
- В меню «Источник света » соедините направляющий лазер («Лазер включен») и белый свет («Белый свет включен»), чтобы найти окно изображения в правильном положении.
- В меню «Настройки» выберите «Параметры увеличения», вручную переместите курсор в положение 2,5 и нажмите «Применить» и «ОК», чтобы сохранить настройки.
- Отрегулируйте фокус, вручную перемещая панель фокусировки, расположенную в верхнем подменю главной страницы.
- В меню «Настройка» выберите «Настройка псевдоцветового порога», отрегулируйте порог по своему усмотрению и нажмите «Применить» и «ОК», чтобы сохранить настройки.
- В меню «Источник света » отключите направляющий лазер («Лазер выключен») и белый свет («Белый свет выключен») перед захватом изображения.
- Захватите изображение, выбрав символ «Воспроизвести » в верхнем подменю главной страницы.
- Окрашивание хлоридом трифенилтетразолия (TTC)
- Глубоко обезболивают животное, используя 5% изофлуран в 30% O2/70%N2.
- Как только животное перестало дышать, обезглавьте его острыми ножницами.
- Удалите всю кожу вокруг головы и мышцы в области шеи.
- Сделайте сагиттальный разрез в затылочной части черепа, пока он не достигнет теменной кости.
- Сделайте горизонтальный разрез (~5 мм) в левой и правой части под кровеносным сосудом. Удаляют затылочную кость черепа с помощью прямых щипцов.
- Сделайте разрез (~5 мм) на лобнолазном шве черепа.
- Сделайте сагиттальный разрез (~ 10-15 мм) по средней линии черепа - между полушариями - и убедитесь, что они полностью разделены.
- Используя изогнутые ножницы размера #7, удалите теменные левую и правую кости черепа от центра к бокам.
- Перенесите мозг в контейнер, наполненный 5 мл ледяного 1x PBS, и держите его на льду в течение 10 минут.
- Перевести мозг на мозговую матрицу из нержавеющей стали (сечения толщиной 1 мм).
- Разрезают мозг на корональные срезы диаметром 1 мм с помощью одноразовых бритвенных лезвий (Таблица материалов).
- Держа лезвия за бока, переложите в емкость, наполненную ледяным 1x PBS.
- Аккуратно отделите секции от лезвий одну за другой.
- Перенесите срезы мозга в чашку Петри диаметром 70 мм, содержащую 5 мл 2% TTC (Таблица материалов, 3) в 1x PBS.
- Инкубировать в течение 15 минут в темноте при комнатной температуре (R/T).
- Через 15 минут выбросьте ТТС, замените его 3 мл формалина и инкубируйте в темноте не менее 30 минут при R / T.
- Наконец, перенесите срезы мозга на прозрачную пластиковую пленку и отсканируйте образцы, включая линейку на сканированном изображении в качестве эталона для будущих измерений.
Результаты
Визуализация морфологии кровеносных сосудов головного мозга
АА генерирует изображения морфологии кровеносных сосудов, возбуждая микропузырьки в системе кровообращения на их резонансной частоте и получая супергармонический отклик микропузырьков. Используя настраиваему?...
Обсуждение
Есть несколько жизненно важных аспектов этого метода, которые, если все сделано неправильно, могут привести к значительному снижению качества изображения и количественного анализа. Наиболее часто встречающимся результатом ошибки пользователя в изображениях PAUSAT является либо отсутс?...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов в этой работе.
Благодарности
Авторы выражают благодарность команде инженеров SonoVol Inc. за техническую поддержку. Эта работа была частично спонсирована премией Американской кардиологической ассоциации (18CSA34080277) Дж. Национальные институты здравоохранения США (NIH) предоставляют гранты R21EB027981, R21 EB027304, RF1 NS115581 (BRAIN Initiative), R01 NS111039, R01 EB028143; Премия Национального научного фонда США (NSF) CAREER 2144788; грант Инициативы Чана Цукерберга (2020-226178) Дж. и NIH предоставляет R21NS127163 и R01NS099590 В. Янгу.
Материалы
| Name | Company | Catalog Number | Comments |
| 20 GA catheter | BD Insyte Autoguard Winged | 381534 | For mouse intubation |
| 2,3,5-Triphenyltetrazolium chloride | Sigma | T8877 | Necessary for TTC-staining brain for validation |
| 532nm Laser | Quantel | Q-smart 850 | Laser used to pump the OPO for PAT |
| Automatic Ventilator Rovent Jr. | Kent Scientific | RV-JR | To keep mice under anesthesia during surgical procedure |
| Black braided silk 4-0 USP | Surgical Specialties | SP116 | Used for sutures on the neck for pMCAO surgery |
| Bupivacaine | Hospira | 0409-1159-18 | Used prior to closing wounds during surgical procedure |
| C57BL/6 Mice | Jackson Lab | #000664 | Mice used for studying ischemic stroke (2-6 month old male/female) |
| Clear suture | Ethicon | 8606 | Used for closing wound (PT stroke and pMCAO). A clear suture won't interfere with PAT |
| Cold Light LED | Schott | KL 1600 | Needed to create PT stroke |
| Disposable Razor Blade | Accutec Blades | 74-0002 | For sectioning mouse brain |
| Electric drill | JSDA | JD-700 | Used to expose MCA during pMCAO procedure |
| Electrocauterization tool | Wet-Field | Wet-Field Bipolar-RG | Stops blood flow after drilling during pMCAO procedure |
| Hair removal gel | Veet | 8282651 | Used to remove hair from mouse prior to imaging |
| High Temperature Cautery Loop Tip | BOVIE Medical Corporation | REF AA03 | Used to avoid bleeding when separating the temporal muscle from the skull |
| IR Detector Card | Thorlabs | VRC5 | Used to ensure light path is aligned |
| Laser Power Meter | Ophir | StarBright, P/N 7Z01580 | Can be used to calibrate the laser energy prior to imaging |
| Laser Speckle Imaging System | RWD Life Science Co. | RFLSI-III | Can be used to validate stroke surgery success |
| Lubricant Eye Ointment | Soothe | AB31336 | Can be used to avoid drying of the eyes |
| Manually adjustable stage | Thorlabs | L490 | Used with custom ramp for multiple focal depth AA imaging |
| Modified Vega Imaging System | Perkin Elmer | LLA00061 | System containing both B-mode/AA and PAT transducers |
| Optical Parametric Oscillator | Quantel | versaScan-L532 | Allows for tuning of excitation wavelength in a large range |
| Programmable Ultrasound System | Verasonics | Vantage 256 | Used for PAT part of system |
| Rose Bengal | Sigma | 330000 | Necessary to induce PT stroke |
| Suture | LOOK | SP116 | Used for permanent ligation of CCA |
| Temperature Contoller | Physitemp | TCAT-2 | Used to maintain stable body temperature of mice during procedures |
| VesselVue Microbubbles | Perkin Elmer | P-4007001 | Used for acoustic angiography (2.43 × 10^9 microbubbles/mL) |
Ссылки
- Durukan, A., Tatlisumak, T. Acute ischemic stroke: overview of major experimental rodent models, pathophysiology, and therapy of focal cerebral ischemia. Pharmacology Biochemistry and Behavior. 87 (1), 179-197 (2007).
- Vander Worp, H. B., van Gijn, J. Clinical Practice. Acute ischemic stroke. The New England Journal of Medicine. 357 (6), 572-579 (2007).
- Tannenbaum, J., Bennett, B. T. Russell and Burch's 3Rs then and now: the need for clarity in definition and purpose. Journal of the American Association for Laboratory Animal Science. 54 (2), 120-132 (2015).
- Hochrainer, K., Yang, W. Stroke proteomics: from discovery to diagnostic and therapeutic applications. Circulation Research. 130 (8), 1145-1166 (2022).
- Wang, L. V., Yao, J. A practical guide to photoacoustic tomography in the life sciences. Nature Methods. 13 (8), 627-638 (2016).
- Aldrich, J. E. Basic physics of ultrasound imaging. Critical Care Medicine. 35 (5), S131-S137 (2007).
- Jacques, S. L. Optical properties of biological tissues: a review. Physics in Medicine and Biology. 58 (11), R37-R61 (2013).
- Li, M., Tang, Y., Yao, J. Photoacoustic tomography of blood oxygenation: a mini review. Photoacoustics. 10, 65-73 (2018).
- Menozzi, L., Yang, W., Feng, W., Yao, J. Sound out the impaired perfusion: Photoacoustic imaging in preclinical ischemic stroke. Frontiers in Neuroscience. 16, 1055552 (2022).
- Gessner, R. C., Frederick, C. B., Foster, F. S., Dayton, P. A. Acoustic angiography: a new imaging modality for assessing microvasculature architecture. International Journal of Biomedical Imaging. 2013, 936593 (2013).
- Dayton, P. A., Rychak, J. J. Molecular ultrasound imaging using microbubble contrast agents. Frontiers in Bioscience. 12, 5124-5142 (2007).
- Isayama, K., Pitts, L. H., Nishimura, M. C. Evaluation of 2, 3, 5-triphenyitetrazolium chloride staining to delineate rat brain infarcts. Stroke. 22 (11), 1394-1398 (1991).
- Ruan, J., Yao, Y. Behavioral tests in rodent models of stroke. Brain Hemorrhages. 1 (4), 171-184 (2020).
- Parthasarathy, A. B., Kazmi, S. M. S., Dunn, A. K. Quantitative imaging of ischemic stroke through thinned skull in mice with Multi Exposure Speckle Imaging. Biomedical Optics Express. 1 (1), 246-259 (2010).
- Hingot, V., et al. Early ultrafast ultrasound imaging of cerebral perfusion correlates with ischemic stroke outcomes and responses to treatment in mice. Theranostics. 10 (17), 7480-7491 (2020).
- Menozzi, L., et al. Three-dimensional non-invasive brain imaging of ischemic stroke by integrated photoacoustic, ultrasound and angiographic tomography (PAUSAT). Photoacoustics. 29, 100444 (2022).
- Llovera, G., Roth, S., Plesnila, N., Veltkamp, R., Liesz, A. Modeling stroke in mice: permanent coagulation of the distal middle cerebral artery. Journal of Visualized Experiments. (89), e51729 (2014).
- Trotman-Lucas, M., Kelly, M. E., Janus, J., Fern, R., Gibson, C. L. An alternative surgical approach reduces variability following filament induction of experimental stroke in mice. Disease Models & Mechanisms. 10 (7), 931-938 (2017).
- Labat-Gest, V., Tomasi, S. Photothrombotic ischemia: a minimally invasive and reproducible photochemical cortical lesion model for mouse stroke studies. Journal of Visualized Experiments. (76), e50370 (2013).
- Matsumoto, Y., et al. Visualising peripheral arterioles and venules through high-resolution and large-area photoacoustic imaging. Scientific Reports. 8 (1), 14930 (2018).
- Xu, Y., Wang, L. V., Ambartsoumian, G., Kuchment, P. Reconstructions in limited-view thermoacoustic tomography. Medical Physics. 31 (4), 724-733 (2004).
- Yal Tang, ., et al. High-fidelity deep functional photoacoustic tomography enhanced by virtual point sources. Photoacoustics. 29, 100450 (2023).
- Zheng, W., Huang, C., Zhang, H., Xia, J. Slit-based photoacoustic tomography with co-planar light illumination and acoustic detection for high-resolution vascular imaging in human using a linear transducer array. Biomedical Engineering Letters. 12 (2), 125-133 (2022).
- Wang, Y., et al. Slit-enabled linear-array photoacoustic tomography with near isotropic spatial resolution in three dimensions. Optics Letters. 41 (1), 127-130 (2016).
- Vu, T., Li, M., Humayun, H., Zhou, Y., Yao, J. A generative adversarial network for artifact removal in photoacoustic computed tomography with a linear-array transducer. Experimental Biology and Medicine. 245 (7), 597-605 (2020).
- Zhang, H., et al. Deep-E: A fully-dense neural network for improving the elevation resolution in linear-array-based photoacoustic tomography. IEEE Transactions on Medical Imaging. 41 (5), 1279-1288 (2022).
- Hauptmann, A., et al. Model-based learning for accelerated, limited-view 3-D photoacoustic tomography. IEEE Transactions on Medical Imaging. 37 (6), 1382-1393 (2018).
- Li, M., et al. Three-dimensional deep-tissue functional and molecular imaging by integrated photoacoustic, ultrasound, and angiographic tomography (PAUSAT). IEEE Transactions on Medical Imaging. 41 (10), 2704-2714 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены