Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Photoacoustique, échographie et tomographie angiographique intégrée (PAUSAT) pour l’imagerie non invasive du cerveau entier de l’AVC ischémique
Dans cet article
Résumé
Ce travail démontre l’utilisation d’une plateforme d’imagerie multimodale basée sur les ultrasons pour l’imagerie non invasive de l’AVC ischémique. Ce système permet de quantifier l’oxygénation du sang par imagerie photoacoustique et la perfusion altérée dans le cerveau par angiographie acoustique.
Résumé
Nous présentons ici une étude expérimentale sur l’AVC ischémique utilisant notre nouveau système d’imagerie non invasive qui intègre trois technologies d’imagerie acoustique : photoacoustique, échographie et tomographie angiographique (PAUSAT). La combinaison de ces trois modalités permet d’acquérir la tomographie photoacoustique multispectrale (PAT) de l’oxygénation du sang cérébral, l’imagerie par ultrasons à haute fréquence du tissu cérébral et l’angiographie acoustique de la perfusion sanguine cérébrale. La plateforme d’imagerie multimodale permet d’étudier les changements de perfusion cérébrale et d’oxygénation dans l’ensemble du cerveau de la souris après un AVC. Deux modèles d’AVC ischémique couramment utilisés ont été évalués : le modèle d’occlusion permanente de l’artère cérébrale moyenne (pMCAO) et le modèle photothrombotique (PT). PAUSAT a été utilisé pour imager les mêmes cerveaux de souris avant et après un AVC et analyser quantitativement les deux modèles d’AVC. Ce système d’imagerie a permis de montrer clairement les changements vasculaires cérébraux après un AVC ischémique, y compris une réduction significative de la perfusion sanguine et de l’oxygénation dans la région de l’infarctus de l’AVC (ipsilatéral) par rapport au tissu non blessé (controlatéral). Les résultats ont été confirmés par imagerie de contraste par moucheturation laser et coloration au chlorure de triphényltétrazolium (TTC). De plus, le volume de l’infarctus de l’AVC dans les deux modèles d’AVC a été mesuré et validé par la coloration TTC comme la vérité sur le terrain. Grâce à cette étude, nous avons démontré que PAUSAT peut être un outil puissant dans les études précliniques non invasives et longitudinales de l’AVC ischémique.
Introduction
Le sang transporte l’oxygène (via la protéine d’hémoglobine) et d’autres nutriments importants vers les tissus de notre corps. Lorsque le flux sanguin à travers les tissus est interrompu (ischémie), de graves dommages aux tissus peuvent survenir, dont les effets les plus immédiats sont dus à un manque d’oxygène (hypoxie). L’AVC ischémique est le résultat d’une interruption du flux sanguin vers une certaine région du cerveau. Les lésions cérébrales résultant d’un AVC ischémique peuvent survenir dans les minutes suivant le blocage d’un vaisseau et peuvent souvent avoir des effets débilitants et durables 1,2. Une stratégie très utile pour évaluer la physiopathologie après un AVC ischémique et identifier et tester de nouveaux traitements est l’utilisation de modèles de petits animaux en laboratoire. Les traitements découverts en laboratoire visent à être traduits en utilisation clinique et à améliorer la vie des patients. Cependant, l’utilisation d’animaux dans la recherche biomédicale doit être soigneusement évaluée selon les principes 3R de Russell et Burch: remplacement, réduction et raffinement3. L’objectif du volet réduction est de réduire le nombre d’animaux sans compromettre la collecte de données. Dans cette optique, le fait de pouvoir évaluer longitudinalement l’évolution de la lésion via l’imagerie non invasive permet un grand avantage dans la réduction du nombre d’animaux nécessaires, ainsi que dans la maximisation des informations obtenues de chaque animal4.
La tomographie photoacoustique (PAT) est une modalité d’imagerie hybride qui combine le contraste d’absorption optique avec la résolution spatiale de l’imagerie par ultrasons5. Le mécanisme d’imagerie de PAT est le suivant. Une impulsion laser d’excitation est allumée sur la cible photographiée. En supposant que la cible absorbe la lumière à la longueur d’onde du laser d’excitation, sa température augmentera. Cette augmentation rapide de la température entraîne une expansion thermoélastique de la cible. L’expansion provoque la propagation d’une onde ultrasonore hors de la cible. En détectant l’onde ultrasonore à de nombreuses positions, le temps nécessaire à l’onde pour se propager de la cible aux détecteurs peut être utilisé pour créer une image grâce à un algorithme de reconstruction. La capacité de la PAT à détecter l’absorption optique dans les régions des tissus profonds différencie la PAT de l’imagerie par ultrasons, qui détecte les limites des différentes impédances acoustiques des tissus5. Dans les spectres visible et proche infrarouge, les biomolécules primaires hautement absorbantes qui sont abondantes dans les organismes sont l’hémoglobine, les lipides, la mélanine et l’eau7. L’hémoglobine est particulièrement intéressante dans l’étude de l’AVC. Étant donné que l’oxyhémoglobine et la désoxyhémoglobine ont des spectres d’absorption optique différents, la PAT peut être utilisée avec plusieurs longueurs d’onde laser d’excitation pour déterminer la concentration relative des deux états de la protéine. Cela permet de quantifier la saturation en oxygène de l’hémoglobine (sO2), ou oxygénation du sang, à l’intérieur et à l’extérieur de la région de l’infarctus 8,9. Il s’agit d’une mesure importante dans l’AVC ischémique, car elle peut indiquer le niveau d’oxygène dans le tissu cérébral endommagé après une ischémie.
L’angiographie acoustique (AA) est une méthode d’imagerie par ultrasons à contraste amélioré qui est particulièrement utile pour l’imagerie de la morphologie du système vasculaire in vivo10. La méthode repose sur l’utilisation d’un transducteur oscillant à deux éléments (un élément basse fréquence et un élément haute fréquence) en conjonction avec des microbulles injectées dans le système circulatoire du sujet imageur. L’élément basse fréquence du transducteur est utilisé pour transmettre à la fréquence de résonance des microbulles (par exemple, 2 MHz), tandis que l’élément haute fréquence est utilisé pour recevoir les signaux super harmoniques des microbulles (par exemple, 26 MHz). Lorsqu’elles sont excitées à une fréquence de résonance, les microbulles ont une forte réponse non linéaire, ce qui entraîne la production de signaux super harmoniques que les tissus corporels environnants ne produisent pas11. En recevant avec un élément haute fréquence, cela garantit que seuls les signaux de microbulles sont détectés. Puisque les microbulles sont confinées aux vaisseaux sanguins, le résultat est une image angiographique de la morphologie des vaisseaux sanguins. L’AA est une méthode puissante pour l’imagerie de l’AVC ischémique, car les microbulles qui circulent dans le système circulatoire ne peuvent pas circuler à travers les vaisseaux bloqués. Cela permet aux AA de détecter les régions du cerveau qui ne sont pas perfusées en raison d’un AVC ischémique, ce qui indique la région de l’infarctus.
La recherche préclinique sur l’AVC ischémique repose généralement sur l’utilisation de l’histologie et des tests comportementaux pour évaluer l’emplacement et la gravité de l’AVC. La coloration au chlorure de triphényltétrazolium (TTC) est une analyse histologique courante utilisée pour déterminer le volume de l’infarctus de l’AVC. Cependant, il ne peut être utilisé qu’à un point final, puisqu’il nécessite l’euthanasie de l’animal12. Les tests comportementaux peuvent être utilisés pour déterminer la déficience de la fonction motrice à plusieurs moments, mais ils ne peuvent pas fournir de valeurs anatomiques ou physiologiques quantitatives13. L’imagerie biomédicale offre une approche plus quantitative pour étudier les effets de l’AVC ischémique de façon non invasive et longitudinale 9,14,15. Cependant, les technologies d’imagerie existantes (telles que l’imagerie par résonance magnétique [IRM] pour petits animaux) peuvent avoir un coût élevé, être incapables de fournir des informations structurelles et fonctionnelles simultanées ou avoir une profondeur de pénétration limitée (comme la plupart des techniques d’imagerie optique).
Ici, nous combinons la photoacoustique, l’échographie et la tomographie angiographique (PAUSAT; voir schéma du système à la figure 1), ce qui permet d’obtenir des informations structurelles et fonctionnelles complémentaires sur la perfusion sanguine et l’oxygénation après un AVC ischémique16. Ce sont deux aspects importants dans l’évaluation de la gravité de la blessure et le suivi du rétablissement ou de la réponse aux traitements. L’utilisation de ces méthodes d’imagerie intégrées peut augmenter la quantité d’information obtenue par chaque animal, réduire le nombre d’animaux requis et fournir plus d’information dans l’étude des traitements potentiels de l’AVC ischémique.
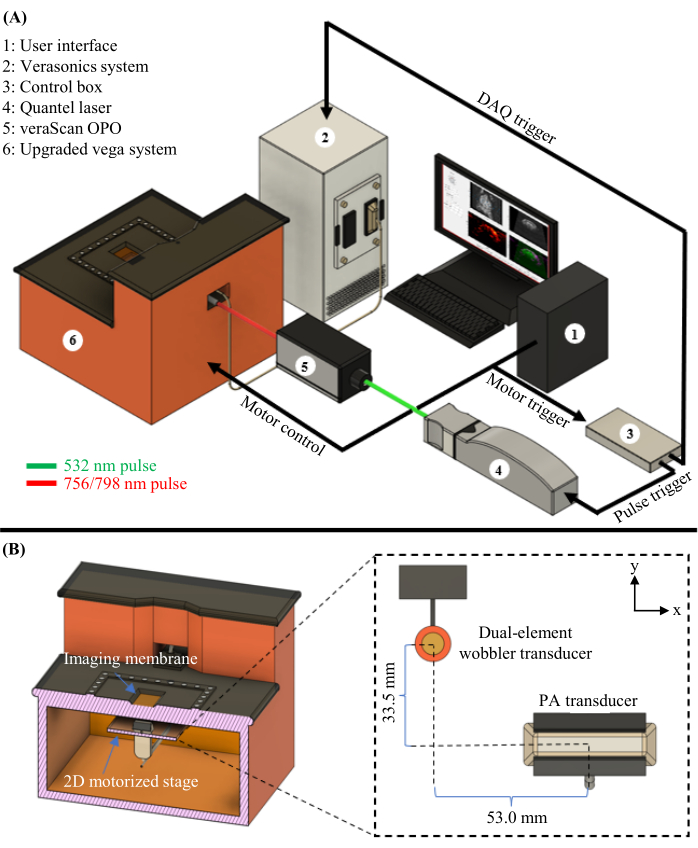
Figure 1 : Diagramme PAUSAT. (A) Schéma complet du système PAUSAT, y compris le laser et l’OPO utilisés pour le PAT. (B) Vue intérieure du système PAUSAT, y compris deux transducteurs à ultrasons. Le transducteur oscillant à double élément est utilisé à la fois pour les ultrasons en mode B et AA, et le transducteur linéaire est utilisé pour le PAT. Les deux transducteurs sont montés sur le même étage motorisé 2D, ce qui permet de numériser des données volumétriques. Ce chiffre a été modifié par rapport à16. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocole
Toutes les procédures animales ont été approuvées par le Comité de soin et d’utilisation des animaux du Duke University Medical Center et ont été menées conformément à la politique du Service de santé publique des États-Unis sur les soins et l’utilisation sans cruauté des animaux de laboratoire. Des souris C57BL/6J mâles et femelles (voir le tableau des matériaux) ont été utilisées pour ces études. Un minimum de trois animaux ont été photographiés par groupe modèle d’AVC. Voir la figure 2 pour le flux de travail suivi dans ce protocole.
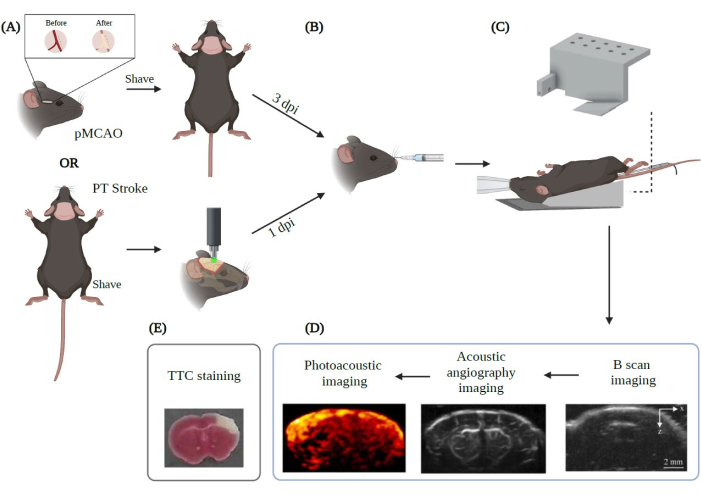
Figure 2 : Résumé de la procédure expérimentale d’imagerie PAUSAT appliquée à l’AVC. Créé avec Biorender.com. La figure montre le flux de travail de la procédure d’imagerie à partir de (A) les deux principaux modèles d’AVC (pMCAO et PT stroke). (B) Une injection rétro-orbitale des microbulles doit être effectuée avant de positionner l’animal sur la membrane PAUSAT. (C) Un masque assurant une anesthésie continue et un coussin chauffant pour maintenir la température corporelle de l’animal stable sont requis dans cette configuration. Le corps de l’animal est placé sur le coussin chauffant tandis que la tête repose sur la membrane du système. (D) L’ordre d’acquisition de l’image est également affiché dans la figure. (E) La coloration TTC est effectuée pour valider nos résultats dans cette étude. DPI : jours après la blessure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Induction du modèle de souris de course
- Occlusion permanente de l’artère cérébrale moyenne (pMCAO) avec ligature de l’artère carotide commune (ACC).
REMARQUE : En bref, effectuez une ligature permanente de l’ACC droite et une électrocautérisation postérieure de l’artère cérébrale moyenne droite (ACM)17. Cette procédure limite le flux sanguin cérébral dans le cortex droit du cerveau, provoquant un accident vasculaire cérébral ischémique18.- Induire l’anesthésie dans une chambre d’induction en utilisant un mélange inhalé de 5,0% d’isoflurane dans 30% O 2/70% N2 jusqu’à perte de conscience (reconnue comme une perte du réflexe de pédale).
- Intuber l’animal à l’aide d’un cathéter de 20 G (tableau des matériaux) et le connecter à un ventilateur automatique. Réglez le débit en fonction du poids corporel de l’animal et maintenez l’animal anesthésié en utilisant 1,5%-2,0% d’isoflurane dans 30% O 2/70% N2.
- À l’aide d’une lampe chauffante et d’une sonde rectale reliée à un régulateur de température, maintenir la température corporelle de l’animal à 37 °C.
- Mettez une goutte de pommade pour les yeux de lubrifiant sur les yeux de la souris.
- Placez l’animal en décubitus dorsal et retirez les poils de la région du cou à l’aide d’une tondeuse à poils.
- Nettoyez la zone de la peau en utilisant d’abord un coton-tige avec de la povidone iodée, puis en utilisant un tampon stérile avec de l’éthanol à 70%. Effectuez cette opération trois fois.
- Vérifiez la profondeur de l’anesthésie et l’absence de douleur en pinçant légèrement la patte postérieure de l’animal.
- Faites une incision sagittale de 0,8 cm sur la ligne médiane du cou et exposez le CCA droit.
- Préparez une suture pour la ligature CCA en dissociant une suture de soie 4-0 en fils plus fins qui composent le fil principal. Utilisez une longueur de 1,5 cm de l’un des sous-fils pour ligaturer de façon permanente le CCA.
REMARQUE: Après avoir serré le nœud, retirez l’excès de filetage en coupant l’extension à une distance de 1-2 mm du nœud. - Appliquez une goutte de bupivacaïne avant de refermer la plaie.
- Fermez l’incision à l’aide de sutures chirurgicales en soie 4-0 interrompues et appliquez une pommade antibiotique triple sur la surface pour prévenir l’infection.
- Déplacez la souris pour exposer le côté latéral droit du corps de l’animal.
-
Enlevez les poils dans la région située entre l’oreille et le contour des yeux à l’aide d’une tondeuse à cheveux.
-
Désinfectez la zone chirurgicale à l’aide d’un coton-tige avec de la povidone iodée, suivi d’un tampon stérile contenant de l’éthanol à 70%. Répétez cette étape trois fois.
-
Placez un champ stérile pour sécuriser la zone chirurgicale. Ensuite, faites une incision de 0,5 cm entre l’œil droit et l’oreille de l’animal, exposant l’articulation entre le crâne et le muscle temporal.
- À l’aide d’une boucle de cautérisation, cautériser le muscle pour le séparer du crâne et exposer la zone du MCA.
- Percez une fenêtre de 0,2 mm2 pour exposer le MCA à l’aide d’une perceuse électrique et utilisez l’électrocautérisation sur le MCA pour obstruer le flux sanguin.
REMARQUE: Une seule impulsion à 80% d’intensité de puissance suffit pour cautériser le MCA. - À l’aide d’une seringue de 1 ml fixée à une aiguille 27G, appliquer une goutte de bupivacaïne (table des matériaux) sur le site chirurgical.
- Fermez l’incision cutanée à l’aide de sutures monofilament transparentes 6-0 interrompues et appliquez une pommade antibiotique triple sur la surface pour prévenir l’infection.
- Une fois la chirurgie terminée, transférez l’animal dans un incubateur à température contrôlée (32 °C) et laissez-le récupérer.
- Après 2 h, transférez l’animal dans sa cage d’origine et fournissez de la nourriture et de l’eau ad libitum.
- AVC photothrombotique (AVC PT)
REMARQUE: Brièvement, l’AVC PT est effectué en éclairant Rose Bengal dans les vaisseaux du cerveau. Rose Bengal est administré par voie intrapéritonéale, et une fois qu’il a été bien distribué dans tout le corps (5 min), il est éclairé par une lumière froide verte, qui active le Rose Bengal pour générer des espèces réactives de l’oxygène (ROS). Ces ROS endommagent la membrane des cellules endothéliales, créant des thrombus dans toute la zone éclairée et entraînant une perturbation locale du flux sanguincérébral 19.- Induire l’anesthésie dans une chambre d’induction en utilisant un mélange inhalé de 5,0% d’isoflurane dans 30% O 2/70% N2 jusqu’à perte de conscience (reconnue comme une perte du réflexe de pédale).
- Réglez l’animal sur un cadre stéréotaxique, en gardant l’animal anesthésié à l’aide d’un masque et 1,5%-2,0% d’isoflurane dans 30% O 2/70% N2.
- Maintenir l’animal à 37 °C à l’aide d’un appareil de chauffage à recirculation d’eau chaude et d’une sonde rectale pour mesurer la température corporelle de l’animal.
- Mettez une goutte de pommade pour les yeux de lubrifiant sur les yeux de la souris.
- Rasez la tête de l’animal à l’aide d’une tondeuse à poils.
- Nettoyez la zone rasée du cuir chevelu trois fois, d’abord à l’aide d’un coton-tige avec de la povidone iodée, puis à l’aide d’un tampon stérile contenant de l’éthanol à 70%.
- Vérifiez l’absence de douleur en pinçant légèrement la patte postérieure de l’animal.
- Faites une incision sagittale de 1,4 cm sur la ligne médiane du cuir chevelu à l’aide d’un scalpel et exposez le crâne.
- À l’aide d’un crayon pointu, faites une marque à 1,5 mm du bregma vers le côté droit.
- Placez un trou d’épingle circulaire de 2,5 mm de diamètre centré sur la marque de 1,5 mm.
REMARQUE: Un carré contenant un trou d’épingle circulaire peut être réalisé en utilisant du ruban noir double face et en faisant une ouverture de 2,5 mm de diamètre au centre en utilisant un outil de poinçonnage à trou unique de la taille mentionnée. - Placez la lumière froide verte sur le trou d’épingle circulaire, en réduisant au minimum l’écart entre la lumière et le trou d’épingle.
- Couvrez la zone avec du papier d’aluminium pour éviter la propagation de la lumière.
- Une fois que l’installation est prête, injecter à l’animal par voie intrapéritonéale 10 mg/kg de Rose Bengal (10 mg/mL dans 1x solution saline tamponnée au phosphate [PBS]) et attendre 5 minutes.
- Après 5 min, allumez la source de lumière froide (intensité : 4,25) et maintenez l’exposition pendant 15 min.
- Ensuite, éteignez la lumière froide et vérifiez le trait à l’œil nu (la zone devrait être plus blanche que la zone environnante) ou à l’aide d’appareils externes pour mesurer le débit sanguin cérébral (par exemple, en utilisant l’imagerie de contraste par mouchetage laser (Tableau des matériaux; voir l’étape 5.1).
- À l’aide d’une seringue de 1 ml fixée à une aiguille 27G, appliquer une goutte de bupivacaïne (table des matériaux) sur le site chirurgical.
- Fermez l’incision cutanée à l’aide de sutures monofilament transparentes 6-0 interrompues et appliquez une pommade antibiotique triple sur la surface pour prévenir l’infection.
- Une fois la chirurgie terminée, transférez l’animal dans un incubateur à température contrôlée (32 °C) et laissez-le récupérer.
- Après 2 h, transférez l’animal dans sa cage d’origine et fournissez de la nourriture et de l’eau ad libitum.
2. Préparation de PAUSAT pour l’imagerie
- Allumez le laser 532 nm et laissez-le allumé pendant 15 minutes pour l’échauffer.
- Préparer la plateforme d’imagerie pour l’animal anesthésié.
- Placez une rampe personnalisée (figure 2C) fixée à la platine réglable manuellement (tableau des matériaux) à côté de la membrane d’imagerie.
- Fixez un porte-dents de souris avec le tube respiratoire relié à la rampe personnalisée et fixez un coussin chauffant à la surface de la rampe.
- Une fois le laser réchauffé, vérifiez que le chemin laser et le couplage dans le faisceau de fibres sont bien alignés à l’aide d’une carte détecteur proche infrarouge (Tableau des matériaux) en plaçant la carte devant l’entrée du faisceau de fibres et en vous assurant que la lumière laser pénètre dans le faisceau.
REMARQUE: Ajustez les miroirs de chemin laser si nécessaire pour vous assurer que l’entrée laser est centrée avec l’entrée du faisceau de fibres.
3. Préparation de l’animal pour PAUSAT
REMARQUE: PAUSAT est effectué 1 jour après la chirurgie de l’AVC PT ou 3 jours après la chirurgie pMCAO. La préparation de PAUSAT pour l’imagerie (étape 2) prend environ 20 minutes et doit être effectuée immédiatement avant de préparer l’animal pour PAUSAT.
- Induire l’anesthésie dans une chambre d’induction en utilisant un mélange d’inhalation de 5% d’isoflurane mélangé à 30% O 2/70% N2 jusqu’à perte de conscience (reconnue comme une perte du réflexe de pédale).
- Transférer l’animal sur une plate-forme chauffée avec un porte-dents et un masque, et maintenir l’anesthésie à 1,5%-2,0% d’isoflurane dans 30% O 2/70% N2.
- Utilisez une lampe chauffante et une sonde rectale reliée à un régulateur de température pour maintenir la température corporelle de l’animal à 37 °C.
- Coupez les poils sur le dessus de la tête de l’animal à l’aide d’un rasoir électrique. Inclure la région de près des yeux à derrière les oreilles.
- Rasez les poils sur le dessus de la tête de l’animal en appliquant une crème dépilatoire commerciale pour enlever complètement les poils courts restants. Laisser sur la peau pendant 5-6 min, puis essuyer à l’aide d’un coton-tige tamponné dans l’eau pour aider à éliminer complètement la crème. Répétez jusqu’à ce que la peau soit débarrassée des poils.
REMARQUE: Pour l’imagerie 1 jour après la chirurgie, ces étapes peuvent être effectuées avant de commencer la chirurgie; 1 jour après l’AVC du PT, ils peuvent être omis. Lorsque l’acquisition d’images PAUSAT est effectuée plusieurs jours après la chirurgie, cette étape est absolument nécessaire. - Une fois que l’animal et le système sont prêts pour l’imagerie, et juste avant de transférer l’animal sur la plate-forme du système, injectez une solution de microbulles de 100 μL à la concentration du stock (Table of Materials) rétro-orbitale à l’aide d’une aiguille de 27 G.
REMARQUE: Une fois que les bulles sont en circulation dans la circulation sanguine, il y a un temps limité pour l’image sans perte significative de signal (~ 10 min). - Mettez une goutte de lotion de protection des yeux sur les yeux de la souris.
REMARQUE: Il n’est pas recommandé d’appliquer un lubrifiant pour les yeux jusqu’à ce que l’injection rétro-orbitaire soit effectuée pour éviter que des substances étrangères n’atteignent la circulation sanguine de l’animal. Par conséquent, l’application de crème dépilatoire doit être effectuée lentement et soigneusement pour éviter de trop s’approcher des yeux (mais suffisamment pour exposer la région d’intérêt où l’AVC est attendu). L’élimination de la crème capillaire est effectuée avec un coton-tige préalablement tamponné dans l’eau, empêchant la crème de couler, ce qui peut endommager les yeux.
4. Imagerie PAUSAT
REMARQUE: Ceci est fait pour imager les régions con- et ipsi-latérales du cerveau après un AVC
- Transférez la souris sur la plate-forme d’images PAUSAT (Table of Materials) intégrée, en plaçant la souris en décubitus dorsal sur la rampe personnalisée (Figure 2C).
- Remplissez la fenêtre d’imagerie avec suffisamment d’eau distillée à la surface pour le couplage acoustique.
REMARQUE: Une rampe optionnelle, imprimée à l’aide d’une imprimante 3D, est recommandée pour éviter que le corps de l’animal ne soit mouillé pendant l’acquisition de l’image et améliorer le confort de l’animal. Il aide également à maintenir une température corporelle stable. De plus, la rampe peut être fixée à une platine manuelle (tableau des matériaux) pour ajuster la profondeur focale du transducteur oscillant à deux éléments par rapport à la tête de la souris. Le fichier de conception de rampe personnalisée est disponible sur demande aux auteurs. - Fixez la tête de souris dans le porte-dent et assurez-vous d’une anesthésie et d’une circulation d’air appropriées.
- À l’aide d’une lampe chauffante et d’une sonde rectale reliée à un régulateur de température, maintenir la température corporelle de l’animal à 37 °C.
- Ouvrez l’application d’imagerie (Tableau des matériaux) et accédez à l’échographie en mode B.
- Utilisez la fenêtre d’échographie en direct pour ajuster manuellement la tête de la souris à la position souhaitée.
- Utilisez la fenêtre d’échographie en direct pour ajuster la hauteur de la scène, de sorte que la profondeur focale du transducteur (19 mm) soit approximativement au milieu de la zone à imimager.
- Imagerie par échographie en mode B
- Ajustez la valeur de la fréquence de transmission des ultrasons en mode B (pour ces études, utilisez 16 MHz).
- Entrez les informations du répertoire de sauvegarde dans l’application de création d’image.
- Utilisez la boîte flottante pour sélectionner la région souhaitée pour le balayage du cerveau en mode B.
- Appuyez sur le bouton Acquérir statique .
- Vérifiez les résultats de l’analyse dans l’application une fois l’acquisition de l’image terminée pour vous assurer que la région souhaitée a été imagée.
REMARQUE: Évitez les retards inutiles dans l’acquisition de l’imagerie en mode B pour vous assurer qu’une concentration suffisamment élevée de microbulles reste dans la circulation sanguine pour l’AA.
- Imagerie avec AA
- Retour à Acquisition d’images.
- Passez en mode Angiographie acoustique dans l’application d’imagerie (Tableau des matériaux).
- Entrez les paramètres du protocole de balayage souhaités (dont le plus important est l’espacement des images et le nombre d’images par position, qui a été fixé à 0,2 mm et 10, respectivement, pour ces études).
- Appuyez sur le bouton Acquérir statique .
REMARQUE: L’acquisition AA prend plus de temps que l’échographie en mode B. - Une fois l’analyse terminée, vérifiez les résultats de l’analyse sous Analyse d’image pour vous assurer que la qualité d’image est conforme aux attentes.
REMARQUE: Pour le mode AA, un volume cérébral entier plus représentatif peut être acquis en répétant un deuxième balayage à une profondeur focale différente à l’intérieur du cerveau et en recombinant ultérieurement les images avec un post-traitement approprié (voir Figure 3).
- Imagerie par tomographie photoacoustique
- Ouvrez l’application de l’oscillateur paramétrique optique (OPO) (Table des matériaux) et réglez-la sur 756 nm.
REMARQUE: Les OPO peuvent facilement sortir de l’étalonnage, donc avant l’expérience, assurez-vous que l’OPO est correctement étalonné en utilisant un spectromètre indépendant. - Traduisez manuellement le transducteur linéaire aux coordonnées précédemment déterminées pour vous assurer que les volumes wobbler et linear-array volumes sont automatiquement co-enregistrés.
REMARQUE: Il est essentiel qu’une expérience de co-enregistrement utilisant une grille fantôme soit effectuée au préalable pour déterminer la distance exacte nécessaire pour traduire l’étape, de sorte que les données résultantes des deux transducteurs soient co-enregistrées en 3D. - Ouvrez l’application laser et allumez le laser 532 nm.
- À l’aide d’un capteur de puissance laser, mesurer l’énergie de la sortie laser et s’assurer qu’il s’agit de l’énergie souhaitée (~10 mJ par impulsion ont été utilisés pour ces études).
- Sélectionnez les paramètres de numérisation souhaités pour PAT (taille de pas de 0,4 mm, longueur de numérisation de 20 mm et moyenne de 10 images par position).
- Ouvrez le programme MATLAB (Table of Materials) du système d’acquisition de données par ultrasons et appuyez sur le bouton Exécuter .
- Obtenez le PAT scan en appuyant sur le bouton Démarrer .
- Une fois l’analyse terminée, ouvrez le programme de sauvegarde MATLAB. Remplacez le nom d’enregistrement par le nom de fichier souhaité et appuyez sur le bouton Exécuter .
- Changez la longueur d’onde OPO à 798 nm et répétez les étapes de 4.10.3 à 4.10.8.
NOTE : Pour une étude longitudinale, il est recommandé de permettre à l’animal de récupérer en le plaçant dans un incubateur et en observation pendant quelques heures (en suivant les étapes 1.1.18 et 1.1.19). Si la validation des résultats est souhaitée, passez à la section 5 immédiatement après l’imagerie PAUSAT.
- Ouvrez l’application de l’oscillateur paramétrique optique (OPO) (Table des matériaux) et réglez-la sur 756 nm.
5. Facultatif : Validation des résultats
- Imagerie par contraste de moucheturation laser (LSCI).
- Anesthésier l’animal en utilisant 1,5%-2,0% d’isoflurane dans 30% O 2/70% N2.
- Réglez l’animal sur un cadre stéréotaxique, en gardant l’animal anesthésié à l’aide d’un masque et de l’anesthésie par inhalation mentionnée ci-dessus.
- Maintenir l’animal à 37 °C à l’aide d’un appareil de chauffage à recirculation d’eau chaude et d’une sonde rectale pour mesurer la température corporelle de l’animal.
- Mettez une goutte de lotion de protection des yeux sur les yeux de la souris.
- Vérifiez l’absence de douleur en pinçant légèrement la patte postérieure de l’animal.
- Enlevez les poils sur le cuir chevelu de l’animal à l’aide d’une tondeuse à cheveux.
- Désinfectez la zone chirurgicale à l’aide d’un coton-tige avec de la povidone iodée, suivi d’un tampon stérile contenant de l’éthanol à 70%. Répétez cette étape trois fois.
- Faites une incision sagittale de 1,4 mm sur la ligne médiane du cuir chevelu et exposez le crâne. Utilisez des forceps pour tenir le cuir chevelu et l’empêcher d’occuper la zone du cerveau à scanner.
- Appliquez quelques gouttes de solution saline sur le crâne et placez le dispositif de contraste par mouchetage laser (Table of Materials) sur la tête de l’animal.
- Dans le menu Fichier , définissez l’appareil en mode en ligne, contenu dans le sous-menu Mode de fonctionnement.
- Sélectionnez le dossier de stockage d’images par défaut dans le menu Fichier et le sous-menu Paramètres d’enregistrement .
- Dans le menu Source lumineuse, connectez le laser de guidage (« Laser activé ») et la lumière blanche (« Lumière blanche activée ») pour localiser la fenêtre d’imagerie à la bonne position.
- Dans le menu Paramètre , sélectionnez Paramètres d’agrandissement, déplacez manuellement le curseur sur 2.5, puis appuyez sur Appliquer et OK pour enregistrer les paramètres.
- Ajustez la mise au point en déplaçant manuellement la barre de mise au point située dans le sous-menu supérieur de la page principale.
- Dans le menu Paramètre , sélectionnez Paramètre de seuil de pseudo-couleur, ajustez le seuil comme vous le souhaitez, puis appuyez sur Appliquer et OK pour enregistrer les paramètres.
- Dans le menu Source lumineuse, déconnectez le laser de guidage (« Laser désactivé ») et la lumière blanche (« Lumière blanche désactivée ») avant de capturer l’image.
- Capturez l’image en sélectionnant le symbole Lecture dans le sous-menu supérieur de la page principale.
- Coloration au chlorure de triphényltétrazolium (TTC)
- Anesthésier profondément l’animal en utilisant 5% d’isoflurane dans 30% O 2/70% N2.
- Une fois que l’animal a cessé de respirer, décapitez-le à l’aide de ciseaux tranchants.
- Enlevez toute la peau autour de la tête et les muscles de la région du cou.
- Faites une coupe sagittale dans la partie occipitale du crâne jusqu’à ce qu’elle atteigne l’os pariétal.
- Faites une coupe horizontale (~5 mm) dans les côtés gauche et droit sous le vaisseau sanguin. Enlevez l’os occipital du crâne à l’aide d’une pince droite.
- Faites une incision (~5 mm) à la suture frontonasale du crâne.
- Faites une coupe sagittale (~10-15 mm) dans la ligne médiane du crâne - entre les hémisphères - et assurez-vous qu’ils sont complètement séparés.
- À l’aide de ciseaux incurvés de taille #7, retirez les os pariétaux gauche et droit du crâne du centre vers les côtés.
- Transférer le cerveau dans un récipient rempli de 5 ml de 1x PBS glacé et le garder sur de la glace pendant 10 minutes.
- Transférer le cerveau dans une matrice cérébrale en acier inoxydable (sections de 1 mm d’épaisseur).
- Couper le cerveau en sections coronales de 1 mm à l’aide de lames de rasoir jetables (Tableau des matériaux).
- En tenant les lames par les côtés, transférer dans un récipient rempli de 1x PBS glacé.
- Séparez soigneusement les sections des lames une par une.
- Transférer les tranches de cerveau dans une boîte de Petri de 70 mm de diamètre contenant 5 ml de 2% TTC (Table of Materials, 3) dans 1x PBS.
- Incuber pendant 15 min dans l’obscurité à température ambiante (R/T).
- Après 15 min, jeter le TTC, le remplacer par 3 mL de formol et incuber dans l’obscurité pendant au moins 30 min à R/T.
- Enfin, transférez les tranches de cerveau sur un film plastique transparent et scannez les échantillons, y compris une règle dans l’image numérisée comme référence pour les mesures futures.
Résultats
Imagerie de la morphologie des vaisseaux sanguins dans le cerveau
AA génère des images de morphologie des vaisseaux sanguins en excitant des microbulles dans le système circulatoire à leur fréquence de résonance et en recevant la réponse super harmonique des microbulles. En utilisant la rampe personnalisée (Figure 2C) fixée à une platine réglable manuellement, nous pouvons imager le cerveau de la souris avec le mode AA à deux profondeurs focales différentes. ...
Discussion
Il y a quelques aspects essentiels de cette méthode qui, s’ils sont mal exécutés, peuvent entraîner une diminution significative de la qualité de l’image et de l’analyse quantitative. Le résultat le plus courant de l’erreur de l’utilisateur dans les images PAUSAT est soit un manque de signal, soit une très faible intensité du signal, qui peuvent tous deux se produire pour diverses raisons. L’une de ces raisons est un problème avec le couplage acoustique. De grosses bulles d’air dans l’eau entoura...
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts dans ce travail.
Remerciements
Les auteurs tiennent à remercier l’équipe d’ingénierie de SonoVol Inc. pour son soutien technique. Ce travail a été partiellement parrainé par l’American Heart Association Collaborative Sciences Award (18CSA34080277), à J. Yao et W. Yang; Les subventions des National Institutes of Health (NIH) des États-Unis R21EB027981, R21 EB027304, RF1 NS115581 (BRAIN Initiative), R01 NS111039, R01 EB028143; Le prix CAREER de la National Science Foundation (NSF) des États-Unis 2144788; la subvention de l’Initiative Chan Zuckerberg (2020-226178), à J. Yao; et les NIH accordent des R21NS127163 et des R01NS099590 à W. Yang.
matériels
| Name | Company | Catalog Number | Comments |
| 20 GA catheter | BD Insyte Autoguard Winged | 381534 | For mouse intubation |
| 2,3,5-Triphenyltetrazolium chloride | Sigma | T8877 | Necessary for TTC-staining brain for validation |
| 532nm Laser | Quantel | Q-smart 850 | Laser used to pump the OPO for PAT |
| Automatic Ventilator Rovent Jr. | Kent Scientific | RV-JR | To keep mice under anesthesia during surgical procedure |
| Black braided silk 4-0 USP | Surgical Specialties | SP116 | Used for sutures on the neck for pMCAO surgery |
| Bupivacaine | Hospira | 0409-1159-18 | Used prior to closing wounds during surgical procedure |
| C57BL/6 Mice | Jackson Lab | #000664 | Mice used for studying ischemic stroke (2-6 month old male/female) |
| Clear suture | Ethicon | 8606 | Used for closing wound (PT stroke and pMCAO). A clear suture won't interfere with PAT |
| Cold Light LED | Schott | KL 1600 | Needed to create PT stroke |
| Disposable Razor Blade | Accutec Blades | 74-0002 | For sectioning mouse brain |
| Electric drill | JSDA | JD-700 | Used to expose MCA during pMCAO procedure |
| Electrocauterization tool | Wet-Field | Wet-Field Bipolar-RG | Stops blood flow after drilling during pMCAO procedure |
| Hair removal gel | Veet | 8282651 | Used to remove hair from mouse prior to imaging |
| High Temperature Cautery Loop Tip | BOVIE Medical Corporation | REF AA03 | Used to avoid bleeding when separating the temporal muscle from the skull |
| IR Detector Card | Thorlabs | VRC5 | Used to ensure light path is aligned |
| Laser Power Meter | Ophir | StarBright, P/N 7Z01580 | Can be used to calibrate the laser energy prior to imaging |
| Laser Speckle Imaging System | RWD Life Science Co. | RFLSI-III | Can be used to validate stroke surgery success |
| Lubricant Eye Ointment | Soothe | AB31336 | Can be used to avoid drying of the eyes |
| Manually adjustable stage | Thorlabs | L490 | Used with custom ramp for multiple focal depth AA imaging |
| Modified Vega Imaging System | Perkin Elmer | LLA00061 | System containing both B-mode/AA and PAT transducers |
| Optical Parametric Oscillator | Quantel | versaScan-L532 | Allows for tuning of excitation wavelength in a large range |
| Programmable Ultrasound System | Verasonics | Vantage 256 | Used for PAT part of system |
| Rose Bengal | Sigma | 330000 | Necessary to induce PT stroke |
| Suture | LOOK | SP116 | Used for permanent ligation of CCA |
| Temperature Contoller | Physitemp | TCAT-2 | Used to maintain stable body temperature of mice during procedures |
| VesselVue Microbubbles | Perkin Elmer | P-4007001 | Used for acoustic angiography (2.43 × 10^9 microbubbles/mL) |
Références
- Durukan, A., Tatlisumak, T. Acute ischemic stroke: overview of major experimental rodent models, pathophysiology, and therapy of focal cerebral ischemia. Pharmacology Biochemistry and Behavior. 87 (1), 179-197 (2007).
- Vander Worp, H. B., van Gijn, J. Clinical Practice. Acute ischemic stroke. The New England Journal of Medicine. 357 (6), 572-579 (2007).
- Tannenbaum, J., Bennett, B. T. Russell and Burch's 3Rs then and now: the need for clarity in definition and purpose. Journal of the American Association for Laboratory Animal Science. 54 (2), 120-132 (2015).
- Hochrainer, K., Yang, W. Stroke proteomics: from discovery to diagnostic and therapeutic applications. Circulation Research. 130 (8), 1145-1166 (2022).
- Wang, L. V., Yao, J. A practical guide to photoacoustic tomography in the life sciences. Nature Methods. 13 (8), 627-638 (2016).
- Aldrich, J. E. Basic physics of ultrasound imaging. Critical Care Medicine. 35 (5), S131-S137 (2007).
- Jacques, S. L. Optical properties of biological tissues: a review. Physics in Medicine and Biology. 58 (11), R37-R61 (2013).
- Li, M., Tang, Y., Yao, J. Photoacoustic tomography of blood oxygenation: a mini review. Photoacoustics. 10, 65-73 (2018).
- Menozzi, L., Yang, W., Feng, W., Yao, J. Sound out the impaired perfusion: Photoacoustic imaging in preclinical ischemic stroke. Frontiers in Neuroscience. 16, 1055552 (2022).
- Gessner, R. C., Frederick, C. B., Foster, F. S., Dayton, P. A. Acoustic angiography: a new imaging modality for assessing microvasculature architecture. International Journal of Biomedical Imaging. 2013, 936593 (2013).
- Dayton, P. A., Rychak, J. J. Molecular ultrasound imaging using microbubble contrast agents. Frontiers in Bioscience. 12, 5124-5142 (2007).
- Isayama, K., Pitts, L. H., Nishimura, M. C. Evaluation of 2, 3, 5-triphenyitetrazolium chloride staining to delineate rat brain infarcts. Stroke. 22 (11), 1394-1398 (1991).
- Ruan, J., Yao, Y. Behavioral tests in rodent models of stroke. Brain Hemorrhages. 1 (4), 171-184 (2020).
- Parthasarathy, A. B., Kazmi, S. M. S., Dunn, A. K. Quantitative imaging of ischemic stroke through thinned skull in mice with Multi Exposure Speckle Imaging. Biomedical Optics Express. 1 (1), 246-259 (2010).
- Hingot, V., et al. Early ultrafast ultrasound imaging of cerebral perfusion correlates with ischemic stroke outcomes and responses to treatment in mice. Theranostics. 10 (17), 7480-7491 (2020).
- Menozzi, L., et al. Three-dimensional non-invasive brain imaging of ischemic stroke by integrated photoacoustic, ultrasound and angiographic tomography (PAUSAT). Photoacoustics. 29, 100444 (2022).
- Llovera, G., Roth, S., Plesnila, N., Veltkamp, R., Liesz, A. Modeling stroke in mice: permanent coagulation of the distal middle cerebral artery. Journal of Visualized Experiments. (89), e51729 (2014).
- Trotman-Lucas, M., Kelly, M. E., Janus, J., Fern, R., Gibson, C. L. An alternative surgical approach reduces variability following filament induction of experimental stroke in mice. Disease Models & Mechanisms. 10 (7), 931-938 (2017).
- Labat-Gest, V., Tomasi, S. Photothrombotic ischemia: a minimally invasive and reproducible photochemical cortical lesion model for mouse stroke studies. Journal of Visualized Experiments. (76), e50370 (2013).
- Matsumoto, Y., et al. Visualising peripheral arterioles and venules through high-resolution and large-area photoacoustic imaging. Scientific Reports. 8 (1), 14930 (2018).
- Xu, Y., Wang, L. V., Ambartsoumian, G., Kuchment, P. Reconstructions in limited-view thermoacoustic tomography. Medical Physics. 31 (4), 724-733 (2004).
- Yal Tang, ., et al. High-fidelity deep functional photoacoustic tomography enhanced by virtual point sources. Photoacoustics. 29, 100450 (2023).
- Zheng, W., Huang, C., Zhang, H., Xia, J. Slit-based photoacoustic tomography with co-planar light illumination and acoustic detection for high-resolution vascular imaging in human using a linear transducer array. Biomedical Engineering Letters. 12 (2), 125-133 (2022).
- Wang, Y., et al. Slit-enabled linear-array photoacoustic tomography with near isotropic spatial resolution in three dimensions. Optics Letters. 41 (1), 127-130 (2016).
- Vu, T., Li, M., Humayun, H., Zhou, Y., Yao, J. A generative adversarial network for artifact removal in photoacoustic computed tomography with a linear-array transducer. Experimental Biology and Medicine. 245 (7), 597-605 (2020).
- Zhang, H., et al. Deep-E: A fully-dense neural network for improving the elevation resolution in linear-array-based photoacoustic tomography. IEEE Transactions on Medical Imaging. 41 (5), 1279-1288 (2022).
- Hauptmann, A., et al. Model-based learning for accelerated, limited-view 3-D photoacoustic tomography. IEEE Transactions on Medical Imaging. 37 (6), 1382-1393 (2018).
- Li, M., et al. Three-dimensional deep-tissue functional and molecular imaging by integrated photoacoustic, ultrasound, and angiographic tomography (PAUSAT). IEEE Transactions on Medical Imaging. 41 (10), 2704-2714 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon