Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İskemik İnmenin Nonİnvaziv Tüm Beyin Görüntülemesi için Entegre Fotoakustik, Ultrason ve Anjiyografik Tomografi (PAUSAT)
Bu Makalede
Özet
Bu çalışma, iskemik inmenin noninvaziv görüntülenmesi için multimodal ultrason tabanlı bir görüntüleme platformunun kullanımını göstermektedir. Bu sistem, fotoakustik görüntüleme yoluyla kan oksijenasyonunun ölçülmesine ve akustik anjiyografi ile beyindeki bozulmuş perfüzyonun ölçülmesine izin verir.
Özet
Burada, üç akustik tabanlı görüntüleme teknolojisini birleştiren yeni geliştirilen noninvaziv görüntüleme sistemimizi kullanan deneysel bir iskemik inme çalışması sunulmaktadır: fotoakustik, ultrason ve anjiyografik tomografi (PAUSAT). Bu üç modalitenin birleştirilmesi, beyin kan oksijenasyonunun multispektral fotoakustik tomografisinin (PAT), beyin dokusunun yüksek frekanslı ultrason görüntülemesinin ve serebral kan perfüzyonunun akustik anjiyografisinin elde edilmesine yardımcı olur. Multi-modal görüntüleme platformu, inme sonrası tüm fare beynindeki serebral perfüzyon ve oksijenasyon değişikliklerinin incelenmesine izin verir. Yaygın olarak kullanılan iki iskemik inme modeli değerlendirildi: kalıcı orta serebral arter tıkanıklığı (pMCAO) modeli ve fototrombotik (PT) model. PAUSAT, bir inmeden önce ve sonra aynı fare beyinlerini görüntülemek ve her iki vuruş modelini de nicel olarak analiz etmek için kullanıldı. Bu görüntüleme sistemi, iskemik inme sonrası beyin vasküler değişikliklerini, inme enfarktüs bölgesinde (ipsilateral) yaralanmamış dokuya (kontralateral) kıyasla önemli ölçüde azalmış kan perfüzyonu ve oksijenasyon da dahil olmak üzere açıkça gösterebildi. Sonuçlar hem lazer benek kontrast görüntüleme hem de trifeniltetrazolyum klorür (TTC) boyaması ile doğrulandı. Ayrıca, her iki inme modelinde de inme enfarktüsü hacmi, TTC boyama ile temel gerçek olarak ölçülmüş ve doğrulanmıştır. Bu çalışma sayesinde, PAUSAT'ın iskemik inmenin noninvaziv ve uzunlamasına preklinik çalışmalarında güçlü bir araç olabileceğini gösterdik.
Giriş
Kan, oksijeni (hemoglobin proteini yoluyla) ve diğer önemli besinleri vücudumuzdaki dokulara taşır. Dokulardan kan akışı kesildiğinde (iskemi), dokularda ciddi hasarlar meydana gelebilir, bunların en acil etkileri oksijen eksikliğinden (hipoksi) kaynaklanır. İskemik inme, beynin belirli bir bölgesine kesilen kan akışının bir sonucudur. İskemik inmeden kaynaklanan beyin hasarı, damar tıkanmasından birkaç dakika sonra ortaya çıkabilir ve genellikle zayıflatıcı ve kalıcı etkilere sahip olabilir 1,2. İskemik inme sonrası fizyopatolojiyi değerlendirmek ve yeni tedavileri tanımlamak ve test etmek için son derece değerli bir strateji, laboratuarda küçük hayvan modellerinin kullanılmasıdır. Laboratuvarda keşfedilen tedaviler, klinik kullanıma çevrilmeyi ve hastaların yaşamlarını iyileştirmeyi amaçlamaktadır. Bununla birlikte, biyomedikal araştırmalarda hayvanların kullanımı, Russell ve Burch'un 3R ilkelerine göre dikkatlice değerlendirilmelidir: değiştirme, azaltma ve iyileştirme3. İndirgeme bileşeninin amacı, veri toplamadan ödün vermeden hayvan sayısını azaltmaktır. Bunu akılda tutarak, lezyon evrimini noninvaziv görüntüleme yoluyla uzunlamasına değerlendirebilmek, gerekli hayvan sayısını azaltmanın yanı sıra her bir hayvandan elde edilen bilgileri en üst düzeye çıkarmada büyük bir avantaj sağlar4.
Fotoakustik tomografi (PAT), optik absorpsiyon kontrastını ultrason görüntüleme uzamsal çözünürlük5 ile birleştiren hibrid bir görüntüleme yöntemidir. PAT'ın görüntüleme mekanizması aşağıdaki gibidir. Görüntülenen hedef üzerinde bir uyarma lazer darbesi aydınlatılır. Hedefin uyarma lazerinin dalga boyundaki ışığı emdiğini varsayarsak, sıcaklık artacaktır. Sıcaklıktaki bu hızlı artış, hedefin termoelastik bir genişlemesine neden olur. Genişleme, bir ultrason dalgasının hedeften dışarı yayılmasına neden olur. Ultrason dalgasını birçok pozisyonda tespit ederek, dalganın hedeften dedektörlere yayılması için gereken süre, bir rekonstrüksiyon algoritması aracılığıyla bir görüntü oluşturmak için kullanılabilir. PAT'ın derin doku bölgelerinde optik absorpsiyonu tespit etme yeteneği, PAT'ı dokuların farklı akustik empedanslarının sınırlarını tespit eden ultrason görüntülemeden ayırır5. Görünür ve yakın kızılötesi spektrumlarda, organizmalarda bol miktarda bulunan birincil yüksek emici biyomoleküller hemoglobin, lipitler, melanin ve su7'dir. İnme çalışmasında özellikle ilgi çekici olan hemoglobindir. Oksihemoglobin ve deoksihemoglobin farklı optik absorpsiyon spektrumlarına sahip olduklarından, PAT, proteinin iki durumunun nispi konsantrasyonunu belirlemek için çoklu uyarma lazer dalga boyları ile kullanılabilir. Bu, hemoglobinin oksijen doygunluğunun (sO2) veya kan oksijenasyonunun, enfarktüs bölgesi 8,9'un içinde ve dışında ölçülmesini sağlar. Bu, iskemik inmede önemli bir önlemdir, çünkü iskemi sonrası hasarlı beyin dokusundaki oksijen seviyesini gösterebilir.
Akustik anjiyografi (AA), vaskülatürün morfolojisini in vivo10 olarak görüntülemek için özellikle yararlı olan kontrastlı bir ultrason görüntüleme yöntemidir. Yöntem, görüntüleme konusunun dolaşım sistemine enjekte edilen mikro kabarcıklarla birlikte çift elemanlı bir sallanan dönüştürücünün (düşük frekanslı bir eleman ve yüksek frekanslı bir eleman) kullanılmasına dayanır. Transdüserin düşük frekanslı elemanı, mikrokabarcıkların rezonans frekansında (örneğin, 2 MHz) iletmek için kullanılırken, yüksek frekanslı eleman mikro kabarcıkların süper harmonik sinyallerini almak için kullanılır (örneğin, 26 MHz). Bir rezonans frekansında uyarıldığında, mikrokabarcıklar güçlü bir doğrusal olmayan tepkiye sahiptir, bu da çevredeki vücut dokularının11 üretmediği süper harmonik sinyallerin üretilmesine neden olur. Yüksek frekanslı bir elemanla alarak, bu sadece mikro kabarcık sinyallerinin algılanmasını sağlar. Mikrokabarcıklar kan damarlarıyla sınırlı olduğundan, sonuç kan damarı morfolojisinin anjiyografik bir görüntüsüdür. AA, iskemik inmeyi görüntülemek için güçlü bir yöntemdir, çünkü dolaşım sisteminden akan mikro kabarcıklar tıkanmış damarlardan akamaz. Bu, AA'nın beynin enfarktüs bölgesini gösteren iskemik inme nedeniyle perfüze edilmeyen bölgelerini tespit etmesini sağlar.
Preklinik iskemik inme araştırmaları genellikle inmenin yerini ve şiddetini değerlendirmek için histoloji ve davranış testlerinin kullanımına dayanır. Trifeniltetrazolyum klorür (TTC) boyaması, inme enfarktüs hacmini belirlemek için kullanılan yaygın bir histolojik analizdir. Bununla birlikte, hayvanın ötenazi yapılmasını gerektirdiğinden yalnızca bir uç noktada kullanılabilir12. Davranış testleri, birden fazla zaman noktasında motor fonksiyon bozukluğunu belirlemek için kullanılabilir, ancak nicel anatomik veya fizyolojik değerler sağlayamazlar13. Biyomedikal görüntüleme, iskemik inmenin etkilerini noninvaziv ve boyuna incelemek için daha nicel bir yaklaşım sağlar 9,14,15. Bununla birlikte, mevcut görüntüleme teknolojileri (küçük hayvanlı manyetik rezonans görüntüleme [MRG] gibi) yüksek bir maliyetle gelebilir, eşzamanlı yapısal ve fonksiyonel bilgi sağlayamaz veya sınırlı penetrasyon derinliğine sahip olabilir (çoğu optik görüntüleme tekniği gibi).
Burada, fotoakustik, ultrason ve anjiyografik tomografiyi (PAUSAT; Şekil 1'deki sistem diyagramına bakınız) birleştiriyoruz, bu da iskemik inme16 sonrası kan perfüzyonu ve oksijenasyonun tamamlayıcı yapısal ve fonksiyonel bilgilerini sağlıyor. Bunlar, yaralanmanın ciddiyetini değerlendirmede ve iyileşmeyi veya tedavilere yanıtı izlemede iki önemli husustur. Bu entegre görüntüleme yöntemlerinin kullanılması, her hayvan tarafından elde edilen bilgi miktarını artırabilir, gerekli hayvan sayısını azaltabilir ve iskemik inme için potansiyel tedavilerin incelenmesinde daha fazla bilgi sağlayabilir.
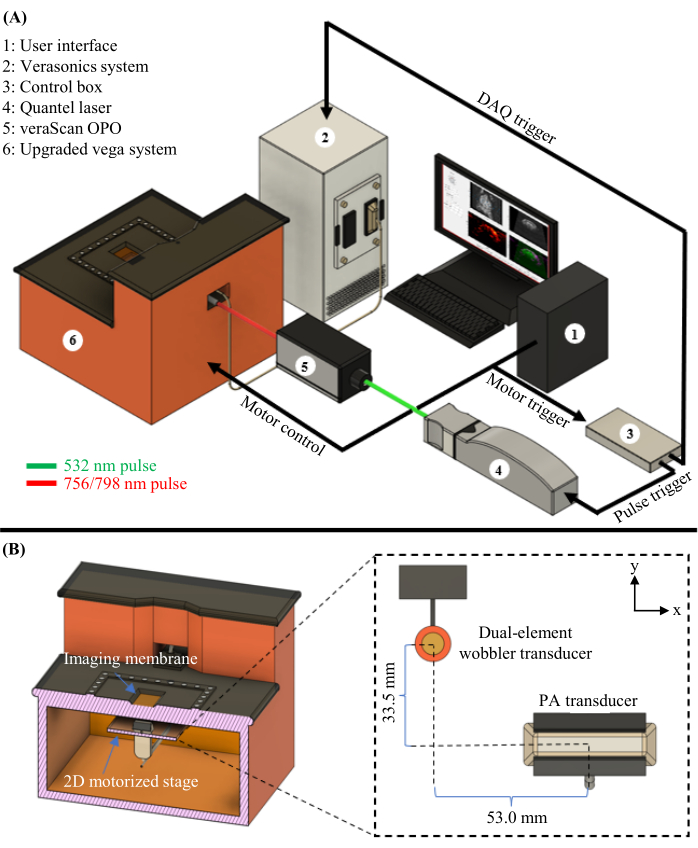
Şekil 1: PAUSAT diyagramı. (A) PAT için kullanılan lazer ve OPO dahil olmak üzere PAUSAT sisteminin tam şeması. (B) İki ultrason transdüseri de dahil olmak üzere PAUSAT sisteminin iç görünümü. Çift elemanlı yalpalayan transdüser hem B modu ultrason hem de AA için kullanılır ve doğrusal dizi dönüştürücü PAT için kullanılır. Her iki transdüser de aynı 2D motorlu aşamaya monte edilmiştir ve taramanın hacimsel veriler üretmesine izin verir. Bu rakam16'dan değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Protokol
Tüm hayvan prosedürleri, Duke Üniversitesi Tıp Merkezi Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylandı ve Amerika Birleşik Devletleri Halk Sağlığı Servisi'nin İnsancıl Bakım ve Laboratuvar Hayvanlarının Kullanımı Politikası'na uygun olarak yürütüldü. Bu çalışmalar için erkek ve dişi C57BL/6J fareler (bakınız Malzeme Tablosu) kullanılmıştır. İnme model grubu başına en az üç hayvan görüntülendi. Bu protokolde izlenen iş akışı için Şekil 2'ye bakın.
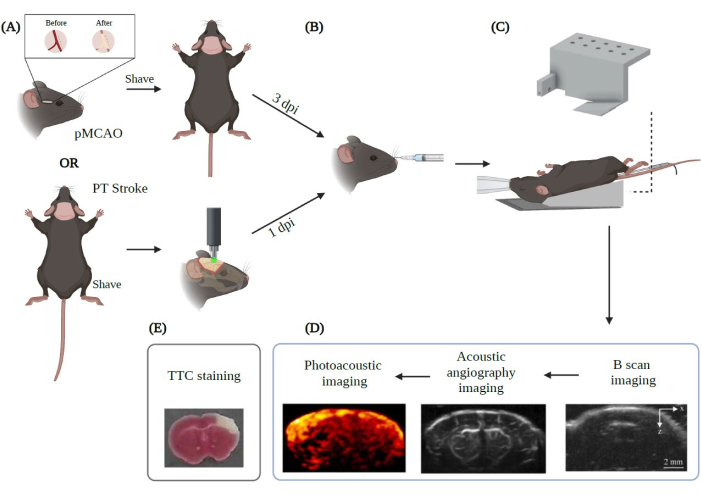
Şekil 2: İnmeye uygulanan PAUSAT görüntüleme için deneysel prosedürün özeti. Biorender.com ile oluşturuldu. Şekil, (A) iki ana inme modelinden (pMCAO ve PT inme) başlayarak görüntüleme prosedürünün iş akışını göstermektedir. (B) Mikro kabarcıkların retro-orbital enjeksiyonu, hayvanı PAUSAT zarına yerleştirmeden önce yapılmalıdır. (C) Bu kurulumda sürekli anestezi sağlayan bir maske ve hayvanın vücut ısısını sabit tutmak için bir ısıtma yastığı gereklidir. Hayvanın vücudu ısıtma yastığına yerleştirilirken, kafa sistemin zarına dayanır. (D) Görüntü alma sırası da şekilde gösterilir. (E) Bu çalışmadaki sonuçlarımızı doğrulamak için TTC boyama işlemi yapılır. DPI: Yaralanmadan sonraki günler. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
1. İnme fare modelini indükleme
- Ortak karotis arter (CCA) ligasyonu ile kalıcı orta serebral arter tıkanıklığı (pMCAO).
NOT: Kısaca, sağ CCA'nın kalıcı ligasyonunu ve sağ orta serebral arterin (MCA) posterior elektrokoterizasyonunu gerçekleştirin17. Bu prosedür, beynin sağ korteksindeki serebral kan akışını sınırlar ve iskemik inmeye neden olur18.- Bilinç kaybına kadar (pedal refleksinin kaybı olarak kabul edilir) %30 O2/70N2'de %5.0 izofluran inhalasyonel karışımı kullanarak bir indüksiyon odasında anestezi indükleyin.
- Hayvanı 20 G kateter (Malzeme Tablosu) kullanarak entübe edin ve otomatik bir ventilatöre bağlayın. Akış hızını hayvanın vücut ağırlığına göre ayarlayın ve% 30 O 2/70N2'de% 1.5 -%2.0 izofluran kullanarak hayvanı uyuşturun.
- Bir ısıtma lambası ve bir sıcaklık kontrol cihazına bağlı bir rektal prob kullanarak, hayvanın vücut sıcaklığını 37 ° C'de tutun.
- Farenin gözlerine bir damla kayganlaştırıcı göz merhemi koyun.
- Hayvanı sırtüstü pozisyona yerleştirin ve bir saç düzeltici kullanarak saçları boyun bölgesinden çıkarın.
- Cilt bölgesini önce povidon-iyotlu bir pamuklu çubukla ve daha sonra% 70 etanol içeren steril bir ped kullanarak temizleyin. Bunu üç kez gerçekleştirin.
- Anestezinin derinliğini ve ağrının yokluğunu hayvanın arka pençesini hafifçe sıkıştırarak doğrulayın.
- Boynun orta hattına 0.8 cm'lik bir sagital kesi yapın ve sağ CCA'yı açığa çıkarın.
- 4-0'lık bir ipek sütürü ana ipliği oluşturan daha ince ipliklere ayırarak CCA ligasyonu için bir dikiş hazırlayın. CCA'yı kalıcı olarak bağlamak için alt ipliklerden birinin uzunluğunu 1,5 cm kullanın.
NOT: Düğümü sıktıktan sonra, uzatmayı düğüme 1-2 mm mesafede keserek fazla ipliği çıkarın. - Yarayı kapatmadan önce bir damla bupivakain uygulayın.
- Kesilmiş 4-0 ipek cerrahi dikiş kullanarak kesiyi kapatın ve enfeksiyonu önlemek için yüzeye üçlü antibiyotik merhem uygulayın.
- Hayvanın vücudunun sağ yan tarafını ortaya çıkarmak için fareyi hareket ettirin.
-
Bir saç düzeltici kullanarak kulak ve göz bölgesi arasındaki bölgedeki tüyleri çıkarın.
-
Cerrahi bölgeyi povidon-iyotlu bir pamuklu çubukla dezenfekte edin, ardından% 70 etanol içeren steril bir ped kullanın. Bu adımı üç kez yineleyin.
-
Cerrahi alanı sabitlemek için steril bir örtü yerleştirin. Daha sonra, hayvanın sağ gözü ile kulağı arasında 0,5 cm'lik bir kesi yaparak kafatası ile temporal kas arasındaki eklemi açığa çıkarın.
- Bir koter döngüsü kullanarak, kafatasından ayırmak ve MCA alanını ortaya çıkarmak için kası koterize edin.
- Elektrikli matkap kullanarak MCA'yı açığa çıkarmak için 0,2mm2'lik bir pencere açın ve kan akışını engellemek için MCA'da elektrokoter kullanın.
NOT: MCA'yı koterize etmek için% 80 güç yoğunluğunda tek bir darbe yeterlidir. - 27G iğnesine bağlı 1mL'lik bir şırınga kullanarak, cerrahi bölgeye bir damla bupivakain (Malzeme Tablosu) uygulayın.
- Kesilmiş 6-0 berrak monofilament sütürler kullanarak cilt insizyonunu kapatın ve enfeksiyonu önlemek için yüzeye üçlü antibiyotik merhem uygulayın.
- Ameliyatı tamamladıktan sonra, hayvanı kontrollü sıcaklığa (32 ° C) sahip bir inkübatöre aktarın ve hayvanın iyileşmesine izin verin.
- 2 saat sonra, hayvanı ev kafesine aktarın ve yiyecek ve su ad libitum sağlayın.
- Fototrombotik inme (PT inme)
NOT: Kısaca PT inme, beyindeki damarların içindeki Gül Bengal'in aydınlatılmasıyla gerçekleştirilir. Rose Bengal intraperitoneal olarak uygulanır ve vücuda iyi dağıldıktan sonra (5 dakika), reaktif oksijen türleri (ROS) üretmek için Rose Bengal'i aktive eden yeşil bir soğuk ışıkla aydınlatılır. Bu ROS, endotel hücrelerinin zarına zarar verir, tüm aydınlatılmış alanda trombüs oluşturur ve lokal serebral kan akımının bozulmasına yol açar19.- Bilinç kaybına kadar (pedal refleksinin kaybı olarak kabul edilir) %30 O2/70N2'de %5.0 izofluran inhalasyonel karışımı kullanarak bir indüksiyon odasında anestezi indükleyin.
- Hayvanı stereotaksik bir çerçeveye ayarlayın, hayvanı bir maske ve% 1.5 -% 2.0 izofluran kullanarak% 30 O 2/70% N2'de anestezi altında tutun.
- Hayvanın vücut sıcaklığını ölçmek için sıcak su sirkülasyonlu bir ısıtıcı ve bir rektal prob kullanarak hayvanı 37 ° C'de tutun.
- Farenin gözlerine bir damla kayganlaştırıcı göz merhemi koyun.
- Bir saç düzeltici kullanarak hayvanın kafasını tıraş edin.
- Tıraş edilen kafa derisi bölgesini üç kez temizleyin, önce povidon-iyotlu bir pamuklu çubuk kullanın ve% 70 etanol içeren steril bir ped kullanın.
- Hayvanın arka pençesini hafifçe sıkıştırarak ağrının yokluğunu doğrulayın.
- Bir neşter kullanarak kafa derisinin orta hattına 1.4 cm'lik bir sagital kesi yapın ve kafatasını açığa çıkarın.
- Keskin bir kalem kullanarak, bregma'dan sağ tarafa doğru 1,5 mm'de bir işaret yapın.
- 1,5 mm işaretine ortalanmış 2,5 mm çapında dairesel bir iğne deliği yerleştirin.
NOT: Dairesel bir iğne deliği içeren bir kare, çift taraflı siyah bant kullanılarak ve söz konusu boyutta tek delikli bir delme aleti kullanılarak merkezde 2,5 mm çapında bir açıklık yapılarak yapılabilir. - Yeşil soğuk ışığı dairesel iğne deliğine yerleştirin, ışık ile iğne deliği arasındaki boşluğu minimumda tutun.
- Işığın yayılmasını önlemek için alanı alüminyum folyo kullanarak örtün.
- Kurulum hazır olduğunda, hayvana intraperitoneal olarak 10 mg / kg Rose Bengal (1x fosfat tamponlu salin [PBS] içinde 10 mg / mL) enjekte edin ve 5 dakika bekleyin.
- 5 dakika sonra, soğuk ışık kaynağını açın (yoğunluk: 4,25) ve pozlamayı 15 dakika boyunca koruyun.
- Daha sonra, soğuk ışığı kapatın ve inmeyi çıplak gözle (alanın çevredeki alandan daha beyaz olması beklenir) veya serebral kan akışını ölçmek için harici cihazlar kullanarak (örneğin, lazer benek kontrast görüntüleme kullanarak (Malzeme Tablosu; bkz. adım 5.1).
- 27G iğnesine bağlı 1mL'lik bir şırınga kullanarak, cerrahi bölgeye bir damla bupivakain (Malzeme Tablosu) uygulayın.
- Kesilmiş 6-0 berrak monofilament sütürler kullanarak cilt insizyonunu kapatın ve enfeksiyonu önlemek için yüzeye üçlü antibiyotik merhem uygulayın.
- Ameliyatı tamamladıktan sonra, hayvanı kontrollü sıcaklığa (32 ° C) sahip bir inkübatöre aktarın ve hayvanın iyileşmesine izin verin.
- 2 saat sonra, hayvanı ev kafesine aktarın ve yiyecek ve su ad libitum sağlayın.
2. PUSAT'ın görüntüleme için hazırlanması
- 532 nm lazeri açın ve ısınmak için 15 dakika bekletin.
- Anestezi uygulanan hayvan için görüntüleme platformunu hazırlayın.
- Görüntüleme membranının yanına manuel olarak ayarlanabilen aşamaya (Malzeme Tablosu) bağlı özelleştirilmiş bir rampa (Şekil 2C) yerleştirin.
- Özelleştirilmiş rampaya bağlı solunum tüpü ile bir fare diş tutucusu takın ve rampanın yüzeyine bir ısıtma yastığı sabitleyin.
- Lazer ısındıktan sonra, kartı fiber demet girişinin önüne yerleştirerek ve lazer ışığının demetin içine girmesini sağlayarak lazer yolunun ve fiber demetine bağlanmanın yakın kızılötesi dedektör kartı (Malzeme Tablosu) kullanarak iyi hizalandığını kontrol edin.
NOT: Lazer girişinin fiber demet girişi ile ortalandığından emin olmak için lazer yol aynalarını gerektiği gibi ayarlayın.
3. Hayvanı PAUSAT için hazırlama
NOT: PAUSAT, PT inme ameliyatından 1 gün sonra veya pMCAO ameliyatından 3 gün sonra yapılır. PAUSAT'ın görüntüleme için hazırlanması (adım 2) yaklaşık 20 dakika sürer ve hayvanı PAUSAT'a hazırlamadan hemen önce yapılmalıdır.
- Bilinç kaybına kadar (pedal refleksinin kaybı olarak kabul edilir) %30 O2/70%N2 ile karıştırılmış% 5 izofluran inhalasyon karışımı kullanarak bir indüksiyon odasında anestezi indükleyin.
- Hayvanı bir diş tutucu ve maske ile ısıtılmış bir platforma aktarın ve anesteziyi% 30 O 2/70N2'de% 1.5 -%2.0 izofluranda tutun.
- Hayvanın vücut sıcaklığını 37 ° C'de tutmak için bir ısıtma lambası ve bir sıcaklık kontrol cihazına bağlı bir rektal prob kullanın.
- Bir elektrikli tıraş makinesi kullanarak hayvanın başının üstündeki saçları kesin. Bölgeyi gözlerin yakınından kulakların arkasına kadar dahil edin.
- Kalan kısa tüyleri tamamen çıkarmak için ticari bir epilasyon kremi uygulayarak hayvanın başının üstündeki saçları tıraş edin. Cildinizi 5-6 dakika bekletin, ardından kremayı tamamen çıkarmaya yardımcı olmak için suya batırılmış bir pamuklu çubukla silin. Cilt saçlardan arınana kadar tekrarlayın.
NOT: Ameliyattan 1 gün sonra görüntüleme için ameliyata başlamadan önce şu adımlar yapılabilir; PT inmeden 1 gün sonra, bunlar ihmal edilebilir. Ameliyattan birkaç gün sonra PAUSAT görüntü elde etme işlemi yapıldığında, bu adımın kritik olarak gerçekleştirilmesi gerekmektedir. - Hayvan ve sistem görüntülemeye hazır olduğunda ve hayvanı sistemin platformuna aktarmadan hemen önce, 27 G'lik bir iğne kullanarak stok konsantrasyonunda (Malzeme Tablosu) geriye dönük olarak 100 μL'lik bir mikro kabarcık çözeltisi enjekte edin.
NOT: Kabarcıklar kan dolaşımında dolaşıma girdikten sonra, önemli bir sinyal kaybı olmadan (~ 10 dakika) görüntü almak için sınırlı bir süre vardır. - Farenin gözlerine bir damla göz koruyucu losyon koyun.
NOT: Yabancı maddelerin hayvanın kan dolaşımına ulaşmasını önlemek için retro-orbital enjeksiyon yapılana kadar göz kayganlaştırıcısının uygulanması önerilmez. Bu nedenle, epilasyon kremi uygulaması, gözlere çok fazla yaklaşmamak için yavaş ve dikkatli bir şekilde yapılmalıdır (ancak inmenin beklendiği ilgili bölgeyi açığa çıkarmak için yeterlidir). Epilasyon kremi çıkarma, daha önce suya batırılmış bir pamuklu çubukla gerçekleştirilir ve kremin damlamasını önler, bu da gözlere zarar verebilir.
4. PAUSAT Görüntüleme
NOT: Bu, inme sonrası beynin kontra- ve ipsi-lateral bölgelerini görüntülemek için yapılır
- Fareyi entegre PAUSAT (Malzeme Tablosu) görüntü platformuna aktarın ve özelleştirilmiş rampada sırtüstü pozisyonda yerleştirin (Şekil 2C).
- Görüntüleme penceresini akustik bağlantı için yüzeyde yeterince damıtılmış suyla doldurun.
NOT: Görüntü alma sırasında hayvanın vücudunun ıslanmasını önlemek ve hayvanın konforunu artırmak için 3D yazıcı kullanılarak basılmış isteğe bağlı bir rampa önerilir. Aynı zamanda sabit bir vücut ısısının korunmasına yardımcı olur. Ayrıca, çift elemanlı yalpalama dönüştürücüsünün odak derinliğini fare kafasına göre ayarlamak için rampa manuel bir aşamaya (Malzeme Tablosu) bağlanabilir. Özel rampa tasarım dosyası talep üzerine yazarlara sunulmaktadır. - Fare kafasını diş tutucuya sabitleyin ve uygun anestezi ve hava akışını sağlayın.
- Bir ısıtma lambası ve bir sıcaklık kontrol cihazına bağlı bir rektal prob kullanarak, hayvanın vücut sıcaklığını 37 ° C'de tutun.
- Görüntüleme uygulamasını açın (Malzeme Tablosu) ve B modu ultrasona gidin.
- Fare kafasını manuel olarak istenen konuma ayarlamak için canlı ultrason penceresini kullanın.
- Sahne alanının yüksekliğini ayarlamak için canlı ultrason penceresini kullanın, böylece dönüştürücünün odak derinliği (19 mm) görüntülenecek alanın yaklaşık ortasında olacaktır.
- B-mod ultrason ile görüntüleme
- B modunda ultrason iletim frekansının değerini ayarlayın (bu etütler için 16 MHz kullanın).
- Görüntüleme uygulamasında kaydetme dizini bilgilerini girin.
- Beynin B modu taraması için istenen bölgeyi seçmek üzere kayan kutuyu kullanın.
- Statik Al düğmesine basın.
- İstenilen bölgenin görüntülendiğinden emin olmak için görüntü alma işlemi tamamlandıktan sonra uygulamadaki tarama sonuçlarını kontrol edin.
NOT: AA için kan dolaşımında yeterince yüksek bir mikrokabarcık konsantrasyonunun kalmasını sağlamak için B modu görüntüleme alımında gereksiz gecikmelerden kaçının.
- AA ile görüntüleme
- Görüntü Alma'ya dönün.
- Görüntüleme uygulamasında Akustik Anjiyografi moduna geçin (Malzeme Tablosu).
- İstenilen tarama protokolü parametrelerini girin (bunlardan en önemlisi kare aralığı ve bu etütler için sırasıyla 0,2 mm ve 10 olarak ayarlanan konum başına kare sayısıdır).
- Statik Al düğmesine basın.
NOT: AA alımı, B modu ultrasondan daha uzun sürer. - Tarama tamamlandıktan sonra, görüntü kalitesinin beklendiği gibi olduğundan emin olmak için Görüntü Analizi altında tarama sonuçlarını kontrol edin.
NOT: AA modu için, beynin içindeki farklı bir odak derinliğinde ikinci bir taramanın tekrarlanması ve daha sonra görüntülerin uygun son işlemle yeniden birleştirilmesiyle daha temsili bir tüm beyin hacmi elde edilebilir (bkz. Şekil 3).
- Fotoakustik tomografi ile görüntüleme
- Optik parametrik osilatör (OPO) uygulamasını açın (Malzeme Tablosu) ve 756 nm olarak ayarlayın.
NOT: OPO'lar kalibrasyondan kolayca çıkabilir, bu nedenle deneyden önce, bağımsız bir spektrometre kullanarak OPO'nun doğru şekilde kalibre edildiğinden emin olun. - Yalpalayan birimlerin ve doğrusal dizi birimlerinin otomatik olarak birlikte kaydedildiğinden emin olmak için doğrusal dizi dönüştürücüsünü önceden belirlenmiş koordinatlara el ile çevirin.
NOT: Sahneyi çevirmek için gereken tam mesafeyi belirlemek için hayalet ızgara kullanan bir ortak kayıt deneyinin önceden yapılması çok önemlidir, böylece her iki dönüştürücüden elde edilen veriler 3B olarak birlikte kaydedilir. - Lazer uygulamasını açın ve 532 nm lazeri açın.
- Bir lazer güç ölçer kullanarak, lazer çıkışının enerjisini ölçün ve istenen enerji olduğundan emin olun (bu çalışmalar için darbe başına ~ 10 mJ kullanılmıştır).
- PAT için istenen tarama parametrelerini seçin (0,4 mm adım boyutu, 20 mm tarama uzunluğu ve konum başına ortalama 10 kare).
- Ultrason veri toplama sistemi MATLAB programını (Malzeme Tablosu) açın ve Çalıştır düğmesine basın.
- Başlat düğmesine basarak PAT taramasını edinin.
- Tarama tamamlandıktan sonra MATLAB kaydetme programını açın. Kaydetme adını istediğiniz dosya adıyla değiştirin ve Çalıştır düğmesine basın.
- OPO dalga boyunu 798 nm olarak değiştirin ve 4.10.3 ile 4.10.8 arasındaki adımları tekrarlayın.
NOT: Uzunlamasına bir çalışma için, hayvanın bir inkübatöre yerleştirilerek ve birkaç saat gözlem altında tutularak iyileşmesine izin verilmesi önerilir (1.1.18 ve 1.1.19 adımlarını izleyerek). Sonuç doğrulaması isteniyorsa, PAUSAT görüntülemeden hemen sonra bölüm 5'e geçin.
- Optik parametrik osilatör (OPO) uygulamasını açın (Malzeme Tablosu) ve 756 nm olarak ayarlayın.
5. İsteğe bağlı: Sonuç doğrulama
- Lazer benek kontrast görüntüleme (LSCI).
- Hayvanı% 30 O%2/70 N 2'de% 1.5 -%2.0 izofluran kullanarak anestezi yapın.
- Hayvanı stereotaksik bir çerçeveye ayarlayın, hayvanı bir maske ve yukarıda belirtilen inhalasyonel anestezi kullanarak anestezi altında tutun.
- Hayvanın vücut sıcaklığını ölçmek için sıcak su sirkülasyonlu bir ısıtıcı ve bir rektal prob kullanarak hayvanı 37 ° C'de tutun.
- Farenin gözlerine bir damla göz koruyucu losyon koyun.
- Hayvanın arka pençesini hafifçe sıkıştırarak ağrının yokluğunu doğrulayın.
- Bir saç düzeltici kullanarak hayvanın kafa derisindeki saçları çıkarın.
- Cerrahi bölgeyi povidon-iyotlu bir pamuklu çubukla dezenfekte edin, ardından% 70 etanol içeren steril bir ped kullanın. Bu adımı üç kez yineleyin.
- Kafa derisinin orta hattında 1.4 mm'lik bir sagital kesi yapın ve kafatasını açığa çıkarın. Kafa derisini tutmak ve taranacak beynin alanını işgal etmesini önlemek için forseps kullanın.
- Kafatasına birkaç damla salin uygulayın ve lazer benek kontrast sistemi cihazını (Malzeme Tablosu) hayvanın kafasına yerleştirin.
- Dosya menüsü altında, aygıtı Çalışma Modu alt menüsünde bulunan Çevrimiçi modda ayarlayın.
- Dosya menüsünde ve Ayarları Kaydet alt menüsünde varsayılan görüntü saklama klasörünü seçin.
- Işık Kaynağı menüsünde, görüntüleme penceresini doğru konumda bulmak için kılavuz lazeri ("Lazer açık") ve beyaz ışığı ("Beyaz ışık açık") bağlayın.
- Ayarlar menüsünde Büyütme ayarları'nı seçin, imleci manuel olarak 2,5'e getirin ve ayarları kaydetmek için Uygula ve Tamam'a basın.
- Ana sayfanın üst alt menüsünde bulunan netleme çubuğunu manuel olarak hareket ettirerek odağı ayarlayın.
- Ayar menüsünde, Sahte Renk Eşiği Ayarı'nı seçin, eşiği istediğiniz gibi ayarlayın ve ayarları kaydetmek için Uygula ve Tamam'a basın.
- Işık Kaynağı menüsünde, görüntüyü yakalamadan önce kılavuz lazerin ("Lazer kapalı") ve beyaz ışığın ("Beyaz ışık kapalı") bağlantısını kesin.
- Ana sayfanın üst alt menüsündeki Oynat sembolünü seçerek görüntüyü yakalayın.
- Trifeniltetrazolyum klorür (TTC) boyama
- % 30 O 2/70 N2'de% 5 izofluran kullanarak hayvanı derinlemesine uyuşturun.
- Hayvan nefes almayı bıraktıktan sonra, keskin makas kullanarak kafasını kesin.
- Başın etrafındaki tüm cildi ve boyun bölgesindeki kasları çıkarın.
- Kafatasının oksipital kısmında, parietal kemiğe ulaşana kadar sagital bir kesim yapın.
- Kan damarının altında sol ve sağ tarafta yatay bir kesim (~ 5 mm) yapın. Kafatasının oksipital kemiğini düz forseps kullanarak çıkarın.
- Kafatasının frontonazal sütüründe bir kesim (~ 5 mm) yapın.
- Kafatasının orta hattında (yarımküreler arasında) sagital bir kesim (~ 10-15 mm) yapın ve tamamen ayrıldıklarından emin olun.
- Boyut #7 kavisli makas kullanarak, kafatasının parietal sol ve sağ kemiklerini merkezden yanlara doğru çıkarın.
- Beyni 5 mL buz gibi soğuk 1x PBS ile dolu bir kaba aktarın ve 10 dakika boyunca buz üzerinde tutun.
- Beyni paslanmaz çelik bir beyin matrisine (1 mm kalınlığında bölümler) aktarın.
- Tek kullanımlık tıraş bıçakları kullanarak beyni 1 mm'lik koronal kesitlerde bölümlere ayırın (Malzeme Tablosu).
- Bıçakları yanlarından tutarak, buz gibi soğuk 1x PBS ile doldurulmuş bir kaba aktarın.
- Bölümleri bıçaklardan tek tek dikkatlice ayırın.
- Beyin dilimlerini 1x PBS'de 5 mL% 2 TTC (Malzeme Tablosu, 3) içeren 70 mm çapında bir Petri kabına aktarın.
- Karanlıkta oda sıcaklığında ( R / T) 15 dakika inkübe edin.
- 15 dakika sonra, TTC'yi atın, 3 mL formalin ile değiştirin ve karanlıkta R / T'de en az 30 dakika inkübe edin.
- Son olarak, beyin dilimlerini şeffaf bir plastik filme aktarın ve gelecekteki ölçümler için referans olarak tarama görüntüsündeki bir cetvel de dahil olmak üzere örnekleri tarayın.
Sonuçlar
Beyindeki kan damarı morfolojisinin görüntülenmesi
AA, dolaşım sistemindeki rezonans frekanslarında heyecan verici mikrokabarcıklar ve mikro kabarcıkların süper harmonik tepkisini alarak kan damarı morfolojisi görüntüleri üretir. Manuel olarak ayarlanabilen bir sahneye bağlı özelleştirilmiş rampayı (Şekil 2C) kullanarak, fare beynini AA modu ile iki farklı odak derinliğinde görüntüleyebiliriz. Daha derin bölgeler hedeflendiğinde, daha yüzeys...
Tartışmalar
Bu yöntemin, yanlış yapıldığında, görüntü kalitesinin ve nicel analizin önemli ölçüde azalmasına neden olabilecek birkaç hayati yönü vardır. PAUSAT görüntülerinde kullanıcı hatasının en sık ortaya çıkan sonucu, her ikisi de çeşitli nedenlerle ortaya çıkabilen sinyal eksikliği veya çok düşük sinyal gücüdür. Böyle bir neden, akustik kaplin ile ilgili bir sorundur. Görüntüleme sırasında farenin kafasını çevreleyen sudaki büyük hava kabarcıkları genellikle ultrasonun dön...
Açıklamalar
Yazarlar bu çalışmada çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Yazarlar, teknik destekleri için SonoVol Inc.'deki mühendislik ekibine teşekkür etmek ister. Bu çalışma kısmen Amerikan Kalp Derneği İşbirlikçi Bilimler Ödülü (18CSA34080277), J. Yao ve W. Yang; Amerika Birleşik Devletleri Ulusal Sağlık Enstitüleri (NIH) R21EB027981, R21 EB027304, RF1 NS115581 (BRAIN Initiative), R01 NS111039, R01 EB028143; Amerika Birleşik Devletleri Ulusal Bilim Vakfı (NSF) KARİYER ödülü 2144788; Chan Zuckerberg Girişimi Hibesi (2020-226178), J. Yao'ya; ve NIH, W. Yang'a R21NS127163 ve R01NS099590 verir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 20 GA catheter | BD Insyte Autoguard Winged | 381534 | For mouse intubation |
| 2,3,5-Triphenyltetrazolium chloride | Sigma | T8877 | Necessary for TTC-staining brain for validation |
| 532nm Laser | Quantel | Q-smart 850 | Laser used to pump the OPO for PAT |
| Automatic Ventilator Rovent Jr. | Kent Scientific | RV-JR | To keep mice under anesthesia during surgical procedure |
| Black braided silk 4-0 USP | Surgical Specialties | SP116 | Used for sutures on the neck for pMCAO surgery |
| Bupivacaine | Hospira | 0409-1159-18 | Used prior to closing wounds during surgical procedure |
| C57BL/6 Mice | Jackson Lab | #000664 | Mice used for studying ischemic stroke (2-6 month old male/female) |
| Clear suture | Ethicon | 8606 | Used for closing wound (PT stroke and pMCAO). A clear suture won't interfere with PAT |
| Cold Light LED | Schott | KL 1600 | Needed to create PT stroke |
| Disposable Razor Blade | Accutec Blades | 74-0002 | For sectioning mouse brain |
| Electric drill | JSDA | JD-700 | Used to expose MCA during pMCAO procedure |
| Electrocauterization tool | Wet-Field | Wet-Field Bipolar-RG | Stops blood flow after drilling during pMCAO procedure |
| Hair removal gel | Veet | 8282651 | Used to remove hair from mouse prior to imaging |
| High Temperature Cautery Loop Tip | BOVIE Medical Corporation | REF AA03 | Used to avoid bleeding when separating the temporal muscle from the skull |
| IR Detector Card | Thorlabs | VRC5 | Used to ensure light path is aligned |
| Laser Power Meter | Ophir | StarBright, P/N 7Z01580 | Can be used to calibrate the laser energy prior to imaging |
| Laser Speckle Imaging System | RWD Life Science Co. | RFLSI-III | Can be used to validate stroke surgery success |
| Lubricant Eye Ointment | Soothe | AB31336 | Can be used to avoid drying of the eyes |
| Manually adjustable stage | Thorlabs | L490 | Used with custom ramp for multiple focal depth AA imaging |
| Modified Vega Imaging System | Perkin Elmer | LLA00061 | System containing both B-mode/AA and PAT transducers |
| Optical Parametric Oscillator | Quantel | versaScan-L532 | Allows for tuning of excitation wavelength in a large range |
| Programmable Ultrasound System | Verasonics | Vantage 256 | Used for PAT part of system |
| Rose Bengal | Sigma | 330000 | Necessary to induce PT stroke |
| Suture | LOOK | SP116 | Used for permanent ligation of CCA |
| Temperature Contoller | Physitemp | TCAT-2 | Used to maintain stable body temperature of mice during procedures |
| VesselVue Microbubbles | Perkin Elmer | P-4007001 | Used for acoustic angiography (2.43 × 10^9 microbubbles/mL) |
Referanslar
- Durukan, A., Tatlisumak, T. Acute ischemic stroke: overview of major experimental rodent models, pathophysiology, and therapy of focal cerebral ischemia. Pharmacology Biochemistry and Behavior. 87 (1), 179-197 (2007).
- Vander Worp, H. B., van Gijn, J. Clinical Practice. Acute ischemic stroke. The New England Journal of Medicine. 357 (6), 572-579 (2007).
- Tannenbaum, J., Bennett, B. T. Russell and Burch's 3Rs then and now: the need for clarity in definition and purpose. Journal of the American Association for Laboratory Animal Science. 54 (2), 120-132 (2015).
- Hochrainer, K., Yang, W. Stroke proteomics: from discovery to diagnostic and therapeutic applications. Circulation Research. 130 (8), 1145-1166 (2022).
- Wang, L. V., Yao, J. A practical guide to photoacoustic tomography in the life sciences. Nature Methods. 13 (8), 627-638 (2016).
- Aldrich, J. E. Basic physics of ultrasound imaging. Critical Care Medicine. 35 (5), S131-S137 (2007).
- Jacques, S. L. Optical properties of biological tissues: a review. Physics in Medicine and Biology. 58 (11), R37-R61 (2013).
- Li, M., Tang, Y., Yao, J. Photoacoustic tomography of blood oxygenation: a mini review. Photoacoustics. 10, 65-73 (2018).
- Menozzi, L., Yang, W., Feng, W., Yao, J. Sound out the impaired perfusion: Photoacoustic imaging in preclinical ischemic stroke. Frontiers in Neuroscience. 16, 1055552 (2022).
- Gessner, R. C., Frederick, C. B., Foster, F. S., Dayton, P. A. Acoustic angiography: a new imaging modality for assessing microvasculature architecture. International Journal of Biomedical Imaging. 2013, 936593 (2013).
- Dayton, P. A., Rychak, J. J. Molecular ultrasound imaging using microbubble contrast agents. Frontiers in Bioscience. 12, 5124-5142 (2007).
- Isayama, K., Pitts, L. H., Nishimura, M. C. Evaluation of 2, 3, 5-triphenyitetrazolium chloride staining to delineate rat brain infarcts. Stroke. 22 (11), 1394-1398 (1991).
- Ruan, J., Yao, Y. Behavioral tests in rodent models of stroke. Brain Hemorrhages. 1 (4), 171-184 (2020).
- Parthasarathy, A. B., Kazmi, S. M. S., Dunn, A. K. Quantitative imaging of ischemic stroke through thinned skull in mice with Multi Exposure Speckle Imaging. Biomedical Optics Express. 1 (1), 246-259 (2010).
- Hingot, V., et al. Early ultrafast ultrasound imaging of cerebral perfusion correlates with ischemic stroke outcomes and responses to treatment in mice. Theranostics. 10 (17), 7480-7491 (2020).
- Menozzi, L., et al. Three-dimensional non-invasive brain imaging of ischemic stroke by integrated photoacoustic, ultrasound and angiographic tomography (PAUSAT). Photoacoustics. 29, 100444 (2022).
- Llovera, G., Roth, S., Plesnila, N., Veltkamp, R., Liesz, A. Modeling stroke in mice: permanent coagulation of the distal middle cerebral artery. Journal of Visualized Experiments. (89), e51729 (2014).
- Trotman-Lucas, M., Kelly, M. E., Janus, J., Fern, R., Gibson, C. L. An alternative surgical approach reduces variability following filament induction of experimental stroke in mice. Disease Models & Mechanisms. 10 (7), 931-938 (2017).
- Labat-Gest, V., Tomasi, S. Photothrombotic ischemia: a minimally invasive and reproducible photochemical cortical lesion model for mouse stroke studies. Journal of Visualized Experiments. (76), e50370 (2013).
- Matsumoto, Y., et al. Visualising peripheral arterioles and venules through high-resolution and large-area photoacoustic imaging. Scientific Reports. 8 (1), 14930 (2018).
- Xu, Y., Wang, L. V., Ambartsoumian, G., Kuchment, P. Reconstructions in limited-view thermoacoustic tomography. Medical Physics. 31 (4), 724-733 (2004).
- Yal Tang, ., et al. High-fidelity deep functional photoacoustic tomography enhanced by virtual point sources. Photoacoustics. 29, 100450 (2023).
- Zheng, W., Huang, C., Zhang, H., Xia, J. Slit-based photoacoustic tomography with co-planar light illumination and acoustic detection for high-resolution vascular imaging in human using a linear transducer array. Biomedical Engineering Letters. 12 (2), 125-133 (2022).
- Wang, Y., et al. Slit-enabled linear-array photoacoustic tomography with near isotropic spatial resolution in three dimensions. Optics Letters. 41 (1), 127-130 (2016).
- Vu, T., Li, M., Humayun, H., Zhou, Y., Yao, J. A generative adversarial network for artifact removal in photoacoustic computed tomography with a linear-array transducer. Experimental Biology and Medicine. 245 (7), 597-605 (2020).
- Zhang, H., et al. Deep-E: A fully-dense neural network for improving the elevation resolution in linear-array-based photoacoustic tomography. IEEE Transactions on Medical Imaging. 41 (5), 1279-1288 (2022).
- Hauptmann, A., et al. Model-based learning for accelerated, limited-view 3-D photoacoustic tomography. IEEE Transactions on Medical Imaging. 37 (6), 1382-1393 (2018).
- Li, M., et al. Three-dimensional deep-tissue functional and molecular imaging by integrated photoacoustic, ultrasound, and angiographic tomography (PAUSAT). IEEE Transactions on Medical Imaging. 41 (10), 2704-2714 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır