Method Article
الكشف عن فواصل الحمض النووي المزدوجة التي تقطعت بها السبل في بويضات الفئران
In This Article
Summary
يعد الحفاظ على سلامة جينوم البويضة أمرا ضروريا لضمان الإخلاص الجيني في الجنين الناتج. هنا ، نقدم بروتوكولا دقيقا للكشف عن فواصل الحمض النووي المزدوجة في الخلايا الجرثومية الأنثوية للثدييات.
Abstract
البويضات هي من بين أكبر الخلايا وأكثرها عمرا في جسم الأنثى. تتشكل في المبيضين أثناء التطور الجنيني وتظل محتجزة في الطور التمهيدي للانقسام الميوزي الأول. قد تستمر الحالة الهادئة لسنوات حتى تتلقى البويضات حافزا للنمو والحصول على الكفاءة لاستئناف الانقسام الميوزي. هذه الحالة المطولة من الاعتقال تجعلهم عرضة للغاية لتراكم الإهانات الضارة بالحمض النووي ، والتي تؤثر على السلامة الوراثية للأمشاج الأنثوية ، وبالتالي على السلامة الوراثية للجنين المستقبلي.
وبالتالي ، فإن تطوير طريقة دقيقة للكشف عن تلف الحمض النووي ، وهو الخطوة الأولى لإنشاء آليات استجابة لتلف الحمض النووي ، له أهمية حيوية. تصف هذه الورقة بروتوكولا شائعا لاختبار وجود وتطور تلف الحمض النووي في البويضات الموقوفة بالطور خلال فترة 20 ساعة. على وجه التحديد ، نقوم بتشريح مبيض الفئران ، واسترداد مجمعات البويضات الركامية (COCs) ، وإزالة الخلايا الركامية من موانع الحمل الفموية ، وزراعة البويضات في وسط Μ2 الذي يحتوي على 3-isobutyl-1-methylxanthine للحفاظ على حالة الاعتقال. بعد ذلك ، يتم التعامل مع البويضات بعقار مضاد للأورام سام للخلايا ، إيتوبوسيد ، لتوليد فواصل مزدوجة الخيوط (DSBs).
باستخدام التألق المناعي والمجهر متحد البؤر ، نقوم باكتشاف وتحديد مستويات البروتين الأساسي γH2AX ، وهو الشكل المفسفر للهيستون H2AX. يصبح H2AX مفسفرا في مواقع DSBs بعد تلف الحمض النووي. يمكن أن يؤدي عدم القدرة على استعادة سلامة الحمض النووي بعد تلف الحمض النووي في البويضات إلى العقم والعيوب الخلقية وزيادة معدلات الإجهاض التلقائي. لذلك ، فإن فهم آليات الاستجابة لتلف الحمض النووي ، وفي الوقت نفسه ، إنشاء طريقة سليمة لدراسة هذه الآليات أمر ضروري لأبحاث البيولوجيا الإنجابية.
Introduction
تبدأ عملية الانقسام الاختزالي في الخلايا الجرثومية الأنثوية في الثدييات في المبايض قبل الولادة. يتم إنشاء العدد الإجمالي للبويضات في المبيضين في المقام الأول أثناء التطور الجنيني. تدخل البويضات الانقسام الميوزي وتظل محتجزة في الطور التمهيديالأول 1. بعد بداية البلوغ وإنتاج وعمل الغدد الصماء للهرمون المنبه للجريب (FSH) والهرمون اللوتيني (LH) ، قد تستأنف البويضات وتكمل الانقسامالاختزالي 2. في البشر ، يمكن أن يستمر توقف الطور لمدة تصل إلى 50 عاما3. الانقسامات الخلوية بعد الدخول في الانقسام الميوزي الأول غير متماثلة ، مما يؤدي إلى إنتاج جسم قطبي صغير وخلية بويضية تحتفظ بحجمها. وبالتالي ، يتم تخزين معظم مكونات السيتوبلازم في البويضة أثناء التطور الجنينيالمبكر 4. بعد ذلك ، تدخل البويضات الانقسام الاختزالي الثاني ، دون إعادة تشكيل نواتها أو تكثيف كروموسوماتها ، وتظل محتجزة في الطور الثاني حتى الإخصاب5.
الخاصية الفريدة التي تميز البويضات عن الخلايا الجسدية هي حالة الاعتقال في الطور التمهيدي الأول ، عندما تمتلك البويضة نواة سليمة (توقف الحويصلة الجرثومية [GV]) ، يشار إليها باسم المرحلة6 من GV. بناء على تنظيم الكروماتين ، يتم تصنيف البويضات في مرحلة GV إلى فئتين: النواة غير المحاطة (NSN) والنواة المحاطة (SN) 7,8. في البويضات في مرحلة NSN GV ، ينتشر الكروماتين في جميع أنحاء المنطقة النووية بأكملها ، ويكون النسخ نشطا ، بينما في بويضات SN ، يشكل الكروماتين حلقة مضغوطة تحيط بالنواة ، ويكون النسخ صامتا9. كلا النوعين من البويضات في مرحلة GV تظهر الكفاءة الاختزالي. يدخلون الانقسام الاختزالي بنفس المعدل ، لكن بويضات NSN تقدم قدرة تنموية منخفضة ولا يمكن أن تتطور إلى ما بعد مرحلة الجنينالمكونة من خليتين 10.
تزيد الحالة المطولة للتوقف عن المرحلة الأولى من حدوث تراكم تلف الحمض النووي11. ومن ثم، فإن آليات استجابة تلف الحمض النووي (DNA) في البويضات ضرورية للسماح بإنتاج الجاميتات ذات السلامة الوراثية، ولضمان احتواء الجنين الناتج على محتوى كروموسومي فسيولوجي.
أحد الجوانب المركزية لاستجابة تلف الحمض النووي هو إصلاح الحمض النووي. تشمل المسارات الرئيسية لإصلاح DSB في الخلايا حقيقية النواة الانضمام النهائي غير المتماثل (NHEJ) ، وإعادة التركيب المتماثل (HR) ، والبديل NHEJ12،13،14،15. NHEJ هي آلية أسرع ولكنها أكثر عرضة للخطأ ، بينما تتطلب الموارد البشرية مزيدا من الوقت لإكمالها ولكنها تتمتع بدقةعالية 16.
لا توجد معرفة كافية حول الآليات التي تستخدمها البويضات لإصلاح تلف الحمض النووي. أظهرت الدراسات أن تلف الحمض النووي الناجم عن بويضات الثدييات كاملة النمو باستخدام عوامل سامة للجينات ، مثل إيتوبوسيد أو دوكسوروبيسين أو الأشعة فوق البنفسجية أو الإشعاع المؤين ، لا يؤثر على توقيت ومعدلات الخروج من الطور الأول17. يمكن أن تخضع البويضات لانهيار GV (GVBD) حتى في وجود مستويات مرتفعة من الضرر. يمكن تحديد هذا الضرر من خلال مراقبة γH2AX. هذا الشكل المفسفر من H2AX (γΗ2ΑΧ) هو علامة DSB ، والتي تقع في موقع الفواصل وتعمل كسقالة للمساعدة في إصلاح العوامل والبروتينات لتتراكم في النهايات المكسورة18.
يرجع عدم توقف دورة الخلية بعد تلف الحمض النووي إلى عدم كفاية نقطة فحص تلف الحمض النووي التي تسمح للبويضات ذات الحمض النووي غير المصلح بالعودة إلى الانقسام الاختزالي. بعد مستويات عالية من تلف الحمض النووي ، يمكن لنقطة التفتيش الحفاظ على توقف الطور من خلال تنشيط مسار يعتمد على ATM / Chk1. ترجع استجابة نقاط التفتيش المحدودة ل DSBs إلى التنشيط المحدود لأجهزة الصراف الآلي17,19. في المرحلة M من الانقسام الاختزالي الأول ، أظهرت الأبحاث أن تلف الحمض النووي قد ينشط نقطة تفتيش تجميع المغزل (SAC) التي يسببها الانقسام الاختزالي I ، مما يمنع تنشيط مركب / سيكلوزوم تعزيز الطور E3 ubiquitin ligase (APC / C) ، وبالتالي ، خروج المرحلة M. علاوة على ذلك ، فإن استئصال بروتينات SAC يتغلب على حالة توقف المرحلة M ، مما يؤكد أهمية SAC في إنشاء الانقسام الاختزالي I chekpoint20.
كما تظهر الأبحاث السابقة بوضوح ، لا يمكن ل DSBs إحداث نقطة تفتيش قوية في بويضات الفئران. إذا ترك هذا الضرر دون إصلاح ، فقد يؤدي إلى أجنة تحمل تشوهات كروموسومية. لذلك ، من المهم دراسة استجابة تلف الحمض النووي في مراحل مختلفة من تكوين الأمشاج الأنثوية لفهم المسارات الفريدة التي تستخدمها البويضات للتعامل مع الإهانات الجينية المحتملة بشكل أفضل.
Protocol
تمت الموافقة على جميع تجارب الفئران من قبل السلطات المحلية (منطقة يوانينا ، اليونان) وأجريت وفقا لتوجيهات مجلس المجتمعات الأوروبية 2010/63 / EU. أجريت تجارب فيما يتعلق بمبادئ 3Rs. تم الاحتفاظ بجميع الفئران CD-1 المستخدمة في التجارب في مرفق بيت الحيوان بجامعة يوانينا ، اليونان ، في غرفة ذات درجة حرارة مضبوطة (22 درجة مئوية) ورطوبة (60٪) وتم تغذيتها حسب الحاجة. بيت الحيوان لديه ترخيص لتشغيل منشأة للتربية (EL33-BIObr01) ، والتوريد (EL33-BIOsup01) ، والتجارب (EL33BIO-exp01).
1. إعداد الكواشف
- خفف مسحوق 3-إيزوبوتيل-1-ميثيل زانثين (IBMX) (انظر جدول المواد) في ثنائي ميثيل سلفوكسيد (DMSO) (انظر جدول المواد) إلى تركيز نهائي قدره 200 مللي مول. Μake 10 ميكرولتر من القسامة، ويخزن في درجة حرارة -20 درجة مئوية. استخدم الحل في غضون 1 شهر.
ملاحظة: يتم الاحتفاظ مسحوق IBMX عند -20 درجة مئوية. - تحضير جميع المخازن المؤقتة المناعية ، وتخزينها في 4 درجات مئوية.
- تحضير محلول ملحي معقم مخزن بالفوسفات (PBS) عن طريق تخفيف قرص PBS واحد (انظر جدول المواد) في 200 مل من ddH2Ο.
- اصنع محلول PHEM بإضافة 80 مل من ddH 2 Ο ، و 0.59575 جم من HEPES ، و 1.81422 جم من الأنابيب ، و 0.38035 جم من EGTA ، و 0.04066 جم من MgCl2(انظر جدول المواد) أثناء التقليب باستخدام محرك مغناطيسي (انظر جدول المواد) ، وإضافة NaOH في نفس الوقت (انظر جدول المواد) حتى يصل الرقم الهيدروجيني إلى 6.9 (تحقق باستخدام مقياس الأس الهيدروجيني / ORP [انظر جدول المواد]). ثم أضف ddH2Ο إلى الحجم النهائي 100 mL.
- تحضير المخزن المؤقت بارافورمالدهايد-تريتون-X-100 (PFA-Tx-100) عن طريق تخفيف مسحوق PFA (انظر جدول المواد) في المخزن المؤقت PHEM أثناء التقليب باستخدام محرك مغناطيسي تحت التسخين بتركيز نهائي بنسبة 4٪ PFA. بعد ذلك ، قم بتصفية المخزن المؤقت باستخدام حقنة ومرشح 0.2 ميكرومتر (انظر جدول المواد) ، وأضف 0.5٪ Tx-100 (انظر جدول المواد). تحضير ما يقرب من 10 مل من PFA-Tx-100 (0.4 غرام من PFA ، 50 ميكرولتر من Tx-100) ، وهو ما يكفي لتجربة واحدة. قم بتخزينه في 4 درجات مئوية لمدة 1 أسبوع كحد أقصى.
تنبيه: ارتد قفازات للتعامل مع PFA، وتجنب ملامسة الجلد والعينين. - قم بإعداد المخزن المؤقت للغسيل عن طريق إضافة ألبومين مصل الأبقار (التركيز النهائي: 0.5٪ وزن / وزن BSA) (انظر جدول المواد) في برنامج تلفزيوني ، وتحريكه ميكانيكيا. أضف 10٪ w / v NaN3 buffer (أزيد الصوديوم) بتخفيف 1: 1000 لتقليل مخاطر التلوث الفطري والبكتيري. اصنع 10٪ وزن / وزن NaN 3 عازلة بإضافة 1 جم من مسحوق NaN3 (انظر جدول المواد) إلى 10 مل من ddH2O ؛ قم بتخزين المخزن المؤقت NaN3 في درجة حرارة الغرفة.
- قم بإعداد المخزن المؤقت للحظر عن طريق إضافة BSA (التركيز النهائي: 3٪ وزن / حجم) في PBS وتحريكه ميكانيكيا. أضف 10٪ NaN3 buffer بتخفيف 1: 1,000.
2. جمع البويضات GV من تشريح المبايض وتحريض DSBs
ملاحظة: يجب أن تكون جميع الأدوات والحلول معقمة. تتم معالجة البويضات باستخدام ماصة الفم تحت مجهر ستيريو (انظر جدول المواد) ، ويتم تغطية جميع القطرات بالزيت المعدني (انظر جدول المواد والشكل 1E).
- حقن الفئران داخل الصفاق مع 7 وحدات دولية (IU) من موجهة الغدد التناسلية في مصل الفرس الحامل (PMSG) (انظر جدول المواد) 46-48 ساعة قبل إعدام الفئران عن طريق خلع عنق الرحم.
ملاحظة: يجب أن يكون عمر جميع الفئران المستخدمة من 8 إلى 12 أسبوعا. - قم بتصفية وسط زراعة M2 (انظر جدول المواد) باستخدام حقنة ومرشح 0.2 ميكرومتر ، وأضف IBMX 200 mM إلى تركيز نهائي 200 μM في أنبوب مستدير القاع سعة 14 مل (انظر جدول المواد) للحفاظ على البويضات التي تم القبض عليها في الطور التمهيدي الأول. بعد ذلك ، قم بإعداد قطرات من وسط M2-IBMX في طبق زراعة الأنسجة البلاستيكية (انظر جدول المواد) ، وضعها على كتلة ساخنة (انظر جدول المواد) عند 37 درجة مئوية لمدة 30 دقيقة على الأقل قبل عزل البويضة. قم بتخزين M2 في درجة حرارة 4 درجات مئوية.
- التضحية بالفئران عن طريق خلع عنق الرحم ، وتشريح المبايض ، ووضعها في أنبوب مستدير القاع سعة 5 مل (انظر جدول المواد) باستخدام M2-IBMX.
- انقل المبايض إلى غطاء بلاستيكي يحتوي على 1.5 مل من M2-IBMX ، وقم بإزالة أي أنسجة دهنية حول المبيض أو أجزاء قناة فالوب ، وحرر موانع الحمل الفموية عن طريق ثقب ميكانيكي للمبيض بإبرة 27 جم (انظر جدول المواد والشكل 1A-C).
- انقل موانع الحمل الفموية الفموية إلى طبق استزراع مع قطرات من M2-IBMX (حوالي 25-30 ميكرولتر لكل منهما) ، وقم بإزالة الخلايا الركامية عن طريق السحب المتكرر باستخدام ماصة باستور زجاجية ضيقة التجويف (انظر جدول المواد والشكل 1 د).
- حدد البويضات في مرحلة SN GV ، وانقلها في قطرة (25 ميكرولتر) من وسط M2-IBMX على كتلة ساخنة عند 37 درجة مئوية محمية من الضوء (الشكل 1F).
- ابحث عن بويضات SN بناء على حجمها الأكبر ونواتها الموضوعة مركزيا على عكس بويضات NSN ، حيث يتم وضع النوى بشكل محيطي21. في أي حال ، راقب تكوين الحمض النووي تحت المجهر متحد البؤر قبل اتخاذ القرار النهائي بشأن نوع بويضة GV (SN أو NSN).
- حث DSBs باستخدام etoposide (انظر جدول المواد). ضع البويضات في مرحلة GV في قطرات (25 ميكرولتر لكل منهما) من العامل السام للجينات لمدة 1 ساعة على الكتلة الساخنة عند 37 درجة مئوية في الظروف المظلمة.
ملاحظة: Etoposide هو مثبط توبويزوميراز II الذي يقدم DSBs إلى الحمض النووي22. احتفظ بالإيتوبوسيد في حصص 10 ميكرولتر من 20 مجم / مل في درجة حرارة الغرفة محمية من الضوء. التركيزات التي تم اختبارها هي 5 ميكروغرام / مل ، 20 ميكروغرام / مل ، و 50 ميكروغرام / مل. - للحفاظ على البويضات في مرحلة GV محتجزة لفترة طويلة ، ضع البويضات في قطرات من وسط زراعة M16 (انظر جدول المواد) مكملة ب 400 ميكرومتر IBMX في حاضنة (انظر جدول المواد) عند 37 درجة مئوية و 5٪ CO2. قم بتخزين M16 في درجة حرارة 4 درجات مئوية ، وقم بتصفية الوسط باستخدام حقنة ومرشح 0.2 ميكرومتر ، واحتضانه لمدة 1 ساعة على الأقل قبل الاستخدام.
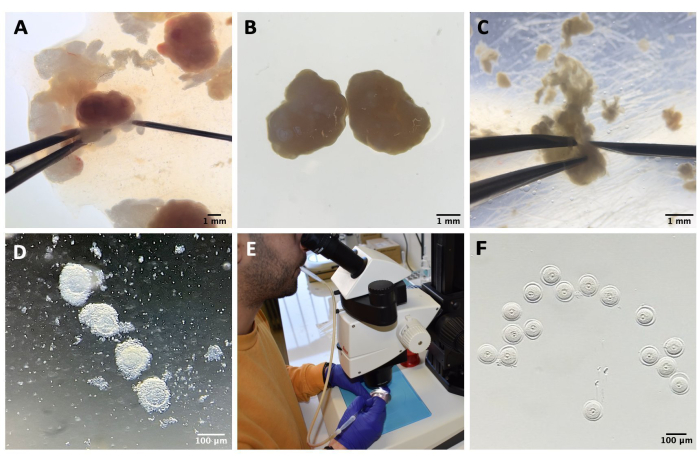
الشكل 1: عملية عزل البويضات. أ: إزالة الأنسجة الدهنية المحيطة بالمبيض وبقايا أجزاء قناة فالوب من المبيضين في وسط M2 باستخدام IBMX. الصورة التي تم الحصول عليها من خلال عدسات المجهر ستيريو. شريط المقياس = 1 مم. (B) المبايض المعزولة في وسط M2 مع IBMX. الصورة التي تم الحصول عليها من خلال عدسات المجهر ستيريو. شريط المقياس = 1 مم. (ج) ثقب ميكانيكي للمبيض باستخدام إبرة 27 جم في وسط M2 مع IBMX. الصورة التي تم الحصول عليها من خلال عدسات المجهر ستيريو. شريط المقياس = 1 مم. (D) موانع الحمل الفموية المنبعثة من المبايض بعد الانثقاب في وسط M2 مع IBMX. الصورة التي تم الحصول عليها من خلال عدسات المجهر ستيريو. شريط المقياس = 100 ميكرومتر. (ه) جمع البويضات باستخدام ماصة الفم. (F) البويضات المجردة ، بعد إزالة الخلايا الركامية المحيطة ، في وسط M2 مع IBMX. الصورة التي تم الحصول عليها من خلال عدسات المجهر ستيريو. شريط المقياس = 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
3. تثبيت البويضة والتألق المناعي
ملاحظة: يتم التعامل مع البويضات باستخدام ماصة الفم تحت مجهر ستيريو ، وجميع القطرات مغطاة بالزيت المعدني.
- ضع بويضات GV المعالجة بالإيتوبوسيد في أطباق زراعة الأنسجة البلاستيكية المختلفة باستخدام المخزن المؤقت PFA-Tx-100 لمدة 40 دقيقة في درجة حرارة الغرفة.
- اغسل البويضات في ثلاث قطرات مختلفة من محلول الغسيل (50 ميكرولتر لكل منهما) في درجة حرارة الغرفة. اترك البويضات لمدة 5 دقائق في كل قطرة.
- ضع البويضات في قطرات من العازلة المانعة (25 ميكرولتر لكل منهما) لمدة 1 ساعة على كتلة ساخنة عند 37 درجة مئوية.
- تحضير الجسم المضاد الأساسي الذي يتعرف على γH2AX (فوسفو الأرنب-Η2ΑΧ) (Ser139) (انظر جدول المواد) (محلول المخزون: 1 مجم / مل). استخدم تخفيفا بنسبة 1: 200 في المخزن المؤقت المانع ، وضع البويضات في قطرات من الجسم المضاد الأولي (15 ميكرولتر لكل منها) عند 4 درجات مئوية طوال الليل.
ملاحظة: Phospho-Η2ΑΧ (γH2AX) هو علامة شائعة للكشف عن DSBs في كل من الخلايا الجسدية وبويضات GV18,23. - في اليوم التالي ، اغسل البويضات في ثلاث قطرات مختلفة من محلول الغسيل (50 ميكرولتر لكل منهما) في درجة حرارة الغرفة. اترك البويضات لمدة 5 دقائق في كل قطرة.
- تحضير الجسم المضاد الثانوي ، أليكسا فلور 488 - مضاد للأرانب الماعز المترافق (انظر جدول المواد) (محلول المخزون: 2 مجم / مل). استخدم تخفيفا بنسبة 1: 200 في المخزن المؤقت المانع ، وضع البويضات في قطرات من الأجسام المضادة الثانوية (15 ميكرولتر لكل منهما) لمدة ساعة واحدة على كتلة ساخنة عند 37 درجة مئوية محمية من الضوء.
- انقل البويضات إلى قطرات من DRAQ7 (25 ميكرولتر لكل منها) (محلول المخزون: 0.3 مللي مول ؛ انظر جدول المواد) ، وهي صبغة حمض نووي فلورية حمراء بعيدة تلطخ الحمض النووي فقط في الخلايا النفاذية. استخدم مخففا بنسبة 1: 250 في محلول الغسيل لمدة 10 دقائق في درجة حرارة الغرفة في الظروف المظلمة.
- اغسل البويضات في ثلاث قطرات مختلفة من محلول الغسيل (50 ميكرولتر لكل منهما) في درجة حرارة الغرفة. اتركها لمدة 5 دقائق في كل قطرة ، ثم انقلها إلى قطرات صغيرة (حوالي 5 ميكرولتر لكل منها) من المخزن المؤقت للغسيل في طبق بتري ذو قاع زجاجي 35 مم (انظر جدول المواد) للفحص المجهري متحد البؤر (الشكل 2 أ).
ملاحظة: يتم غسل كل من صبغة الحمض النووي والجسم المضاد الثانوي في نفس الوقت.
4. المجهر متحد البؤر
ملاحظة: يجب إجراء الفحص المجهري متحد البؤر على الفور لتجنب انخفاض شدة التألق بعد وضع البويضات في أطباق ذات قاع زجاجي. مطلوب الوصول إلى مجهر متحد البؤر (انظر جدول المواد) مع مرحلة آلية.
- إعداد المجهر
- في النظام البؤري ، قم بتشغيل وحدة التحكم بالليزر والليزر ووحدة التحكم المجهرية ومصابيح الضوء المرسل والكمبيوتر الشخصي (الشكل 2B ، D).
- افتح البرنامج البؤري ، واختر عدسة الزيت 40x.
- ضع الطبق في حامل العينة ، وحاول التركيز على البويضات عن طريق تحريك المسرح على محاور XY و Z باستخدام عصا التحكم (الشكل 2C).
- مسح البويضات
- اضبط طاقة الليزر والكسب وحجم الثقب بشكل مستقل لكل تجربة لتقليل أي تشبع.
- لكل خلية بيضية، اضبط منطقة الاهتمام، وتحديدا في النواة في منطقة الحمض النووي (DNA). حدد حدود منطقة الحمض النووي ، واضبط حجم الخطوة z على 3 ميكرومتر. ثم ابدأ المسح.
- احفظ الصور لكل خلية في المجلد المحدد.
- عند اكتمال المسح ، اخرج من البرنامج ، وأوقف تشغيل الكمبيوتر ، وقم بإيقاف تشغيل وحدة التحكم بالليزر والليزر ووحدة التحكم المجهرية ومصابيح الضوء المرسل.
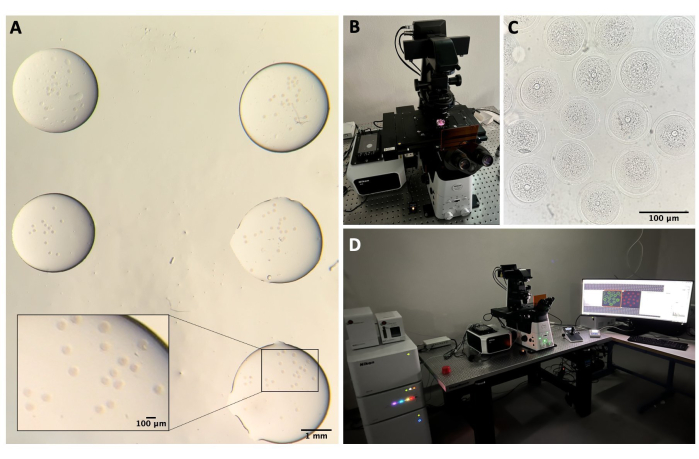
الشكل 2: الفحص المجهري متحد البؤر. أ: البويضات الثابتة بعد إجراء بروتوكول التألق المناعي وتلطيخ الحمض النووي (DNA)، وهي في قطرات منفصلة من محلول الغسيل، ومغطاة بالزيت المعدني، وموضوعة في طبق ذي قاع زجاجي، ومعدة للتصوير المجهري متحد البؤر. تحتوي كل قطرة على فئة تجريبية مختلفة. الصورة التي تم الحصول عليها من خلال عدسات المجهر ستيريو. شريط المقياس = 1 مم / 100 ميكرومتر للجزء الكبير. (ب) صفيحة زجاجية القاع موضوعة على مرحلة المجهر متحد البؤر. ج: صورة برايتفيلد للبويضات التي تم الحصول عليها من خلال الفحص المجهري متحد البؤر. شريط المقياس = 100 ميكرومتر. (د) نظام الفحص المجهري متحد البؤر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. تحليل التصوير
- قم بتنزيل Fiji ImageJ-win64 في المتصفح (https://imagej.net/software/fiji/downloads) ، وافتحه ، واستورد البيانات كملفات مكدس TIFF.
ملاحظة: افتح كل ملف بويضة على حدة. - انقر على الصورة | اللون | تقسيم القنوات لتقسيم جميع القنوات.
- انقر فوق LUT (بحث عن جدول) ، واختر الألوان المفضلة لكل قناة.
- انقر على الصورة | اللون | دمج القنوات لدمج القنوات ل γΗ2ΑΧ و DNA. اترك قناة برايتفيلد غير مدمجة.
- في بويضات NSN وفي بويضات SN ذات المستويات المنخفضة من تلف الحمض النووي ، يتم الكشف عن γΗ2ΑΧ كبؤر في منطقة الحمض النووي. في هذه الحالة ، انقر فوق الأمر "متعدد النقاط" أو النقطة ، وحدد كل تركيز γΗ2ΑΧ يتزامن مع الحمض النووي. كرر هذه الخطوة لجميع المكدسات.
- في بويضات SN ذات المستويات العالية من تلف الحمض النووي ، يتم توزيع إشارة γΗ2ΑΧ في جميع أنحاء منطقة الحمض النووي بأكملها. في هذه الحالة ، انقر فوق صورة | مداخن | مشروع Z، وباستخدام أمر التحديدات اليدوية ، حدد مساحة الحمض النووي بأكملها.
- لقياس مضان γΗ2ΑΧ ، انقر فوق تحليل | قم بقياس القياسات ونسخها في ملف .xlsx. بعد ذلك ، احسب متوسط التألق ، وقم بتطبيع القيم ، واحسب عدد البؤر قبل إنشاء أي رسوم بيانية.
- انقر فوق تحليل | تعيين مقياس لتعيين المقياس ثم على تحليل | أدوات | شريط القياس لإضافة شريط مقياس إلى القنوات.
النتائج
باستخدام الإجراء الموضح هنا ، تم تشريح مبيض الفئران ، وإزالة الدهون ، وتم جمع بويضات مرحلة GV كاملة النمو. بعد ذلك ، تمت إزالة الخلايا الركامية عن طريق السحب المتكرر باستخدام ماصة ضيقة ووضعت في قطرات جديدة من وسط M2-IBMX ومغطاة بالزيت المعدني على كتلة ساخنة (37 درجة مئوية) (الشكل 1A-F). تم تحضير ثلاثة تركيزات مختلفة من الإيتوبوسيد (5 ميكروغرام / مل ، 20 ميكروغرام / مل ، و 50 ميكروغرام / مل) باستخدام تركيز إيتوبوسيد مخزون قدره 20 ملغم / مل. تم وضع البويضات في مرحلة GV في ثلاثة تركيزات إيتوبوسيد متميزة لمدة 1 ساعة في قطرات مغطاة بالزيت المعدني ومحمية من الضوء عند 37 درجة مئوية. ثم تم اتباع بروتوكول التألق المناعي ، كما هو موضح في قسم البروتوكول بالتفصيل ، وتم وضع البويضات في أطباق ذات قاع زجاجي وتمت ملاحظتها بواسطة الفحص المجهري متحد البؤر (الشكل 2).
في البويضات في مرحلة SN GV ، مباشرة بعد تلف الحمض النووي ، زاد وجود γH2AX في جميع تركيزات الإيتوبوسيد (5 ميكروغرام / مل ، 20 ميكروغرام / مل ، و 50 ميكروغرام / مل) ، وتم توزيع γH2AX في جميع أنحاء منطقة الحمض النووي بأكملها (الشكل 3). تم إجراء القياس الكمي والتقدير DSB من خلال مراقبة شدة مضان γH2AX في مواقع الحمض النووي. تكثف مضان γH2AX بشكل متناسب مع زيادة تركيزات الإيتوبوسيد. علاوة على ذلك ، بعد توقف الطور المطول (20 ساعة بعد علاج إيتوبوسيد) ، أظهرت البويضات في مرحلة GV القدرة على تقليل عدد بؤر γH2AX وشدتها ، مما يعني وجود عمليات إصلاح نشطة في البويضات الموقوفة في مرحلة GV (الشكل 3E).
على عكس بويضات SN ، حيث تم توزيع مضان γH2AX من خلال الحمض النووي ، في بويضات NSN ، تم عرض γH2AX في بؤر مباشرة بعد العلاج بالإيتوبوسيد عند 20 ميكروغرام / مل. قمنا بتقدير عدد البؤر التي تزامنت مع منطقة الحمض النووي ، وحسبنا مضان كل بؤرة ، وقدمنا متوسط مضان جميع البويضات. أظهر كل من التألق وعدد البؤر اختلافات ذات دلالة إحصائية بين فئتي البويضات (الشكل 4).
يوفر الفحص المجهري متحد البؤر معلومات عن عدد وشدة البؤر في مداخن Z المختلفة ، مما يساعد على تحديد وجود تلف الحمض النووي وديناميكيات الإصلاح في نقاط زمنية مميزة. يوفر مسح Galvano مسحا ضوئيا دقيقا بخلفية منخفضة وتحليلا أفضل لصور المسح الضوئي.
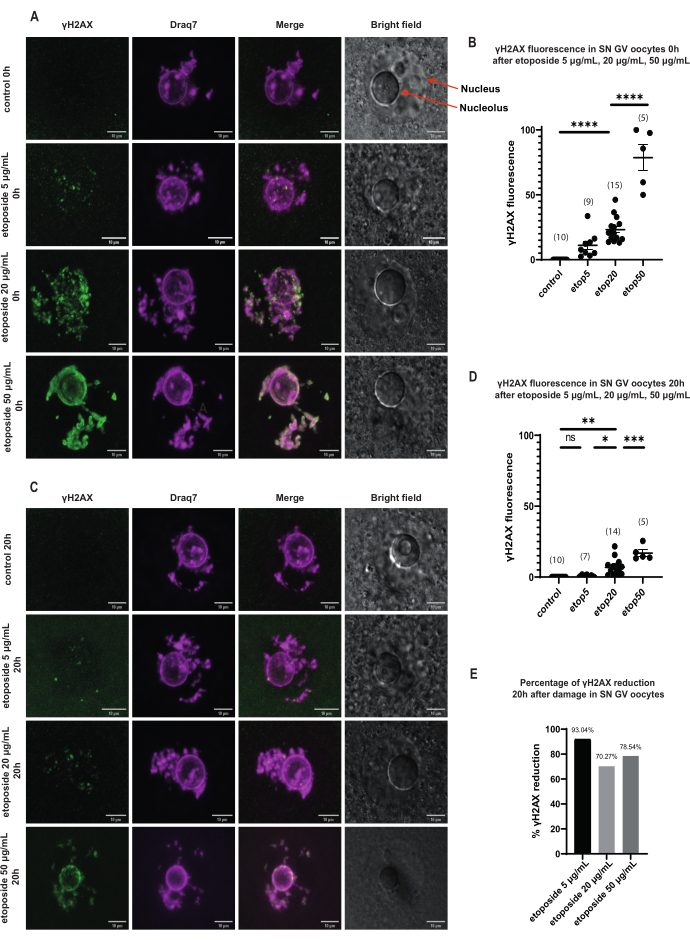
الشكل 3: اختزال γH2AX في البويضات في مرحلة SN GV المعالجة بثلاثة تركيزات مختلفة من الإيتوبوسيد بعد توقف GV المطول. (أ) مضان γH2AX في البويضات في مرحلة SN GV 0 ساعة بعد العلاج بالإيتوبوسيد. يزداد γH2AX مباشرة بعد التعرض في جميع تركيزات الإيتوبوسيد ، وتعتمد الزيادة على التركيز (أخضر: γΗ2ΑΧ ، أرجواني: DNA). الصور عبارة عن إسقاطات Z-stack ، وقد تم ضبط السطوع / التباين لكل قناة باستخدام Fiji / ImageJ. شريط المقياس = 10 ميكرومتر. (B) الرسم البياني لمضان γH2AX في بويضات مرحلة SN GV 0 ساعة بعد العلاج بتركيزات إيتوبوسيد مميزة. تمثل البيانات متوسط ± SEM. تمثل كل نقطة بويضة واحدة (يظهر عدد البويضات في الرسم البياني) ، (ns = غير معنوي ، ** p < 0.005 ، **** p < 0.0001 ، ANOVA أحادي الاتجاه مع اختبار مقارنات Tukey المتعددة). (C) مضان γH2AX في بويضات مرحلة SN GV بعد 20 ساعة من العلاج بالإيتوبوسيد. γH2AX يقلل 20 ساعة بعد التعرض في جميع تركيزات إيتوبوسيد (الأخضر: γΗ2ΑΧ ، أرجواني: DNA). الصور عبارة عن إسقاطات Z-stack ، وقد تم ضبط السطوع / التباين لكل قناة باستخدام Fiji / ImageJ. شريط المقياس = 10 ميكرومتر. (د) الرسم البياني لفلورة γH2AX في بويضات المرحلة SN GV بعد 20 ساعة من العلاج بتركيزات إيتوبوسيد متميزة. تمثل البيانات متوسط ± SEM. تمثل كل نقطة بويضة واحدة (يظهر عدد البويضات في الرسم البياني) ، (ns = غير معنوي ، * p < 0.05 ، ** p < 0.005 ، *** p < 0.0005 ، **** p < 0.0001 ، ANOVA أحادي الاتجاه مع اختبار مقارنات Tukey المتعددة). (ه) الرسم البياني الشريطي لتقليل مضان γH2AX في الخلايا البيضية في مرحلة SN GV بعد توقف الطور الأولي في البويضات المعالجة بالإيتوبوسيد. يشير الرقم الموجود أعلى كل عمود إلى النسبة المئوية للانخفاض في مضان γH2AX. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
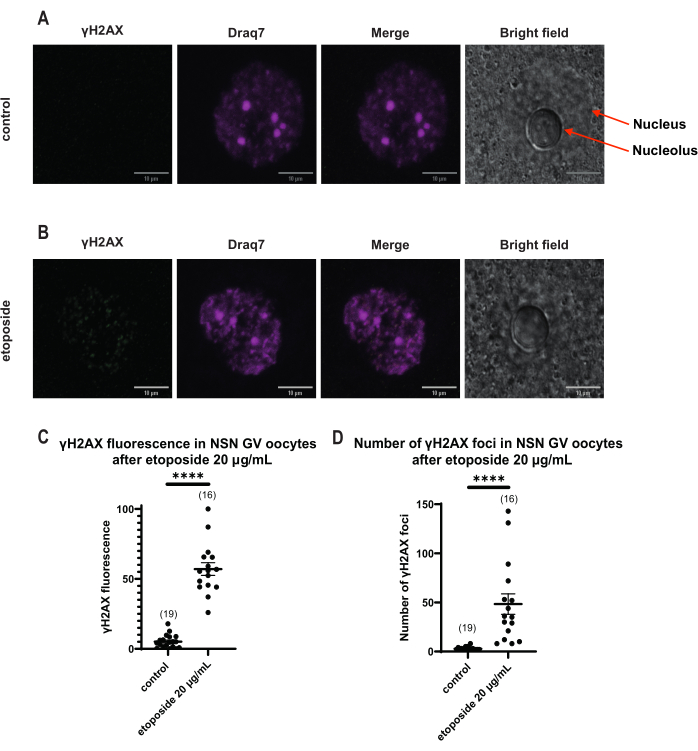
الشكل 4: فسفرة Η2ΑΧ في البويضات في مرحلة NSN GV بعد العلاج بالإيتوبوسيد عند 20 ميكروغرام / مل. (أ) صور تمثيلية متحدة البؤر لبويضة واحدة من مرحلة NSN GV (أخضر: γΗ2ΑΧ ، أرجواني: DNA). الصور عبارة عن إسقاطات Z-stack ، وقد تم ضبط السطوع / التباين لكل قناة باستخدام Fiji / ImageJ. شريط المقياس = 10 ميكرومتر. (B) صور تمثيلية متحدة البؤر لخلية بويضية NSN GV في المرحلة المعالجة بالإيتوبوسيد (أخضر: γΗ2ΑΧ ، أرجواني: DNA). تم تثبيت البويضات 0 ساعة بعد علاج إيتوبوسيد. الصور عبارة عن إسقاطات Z-stack ، وقد تم ضبط السطوع / التباين لكل قناة باستخدام Fiji / ImageJ. شريط المقياس = 10 ميكرومتر. (ج) مضان γΗ2ΑΧ الطبيعي في البويضات في مرحلة NSN GV بعد معالجة إيتوبوسيد 20 ميكروغرام / مل. تمثل البيانات متوسط ± SEM. تمثل كل نقطة بويضة واحدة (يظهر عدد البويضات في الرسم البياني) ، مأخوذة من تجربتين مستقلتين (**** p < 0.0001 ، اختبار t غير المزاوج غير المصاحب ، اختبار Mann-Whitney U). (د) عدد بؤر γΗ2ΑΧ في البويضات في مرحلة NSN GV بعد معالجة إيتوبوسيد 20 ميكروغرام / مل. تمثل البيانات متوسط ± SEM. تمثل كل نقطة بويضة واحدة (يظهر عدد البويضات في الرسم البياني) ، مأخوذة من تجربتين مستقلتين (**** p < 0.0001 ، اختبار t غير المزاوج غير المصاحب ، اختبار Mann-Whitney U). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
باستخدام الطريقة الموضحة هنا ، اكتشفنا DSBs في بويضات الثدييات. تسمح هذه الطريقة باكتشاف ودراسة عملية إصلاح الحمض النووي في البويضات. يمكن أيضا استخدام نفس البروتوكول لتحليل البروتينات الأخرى التي تشارك في العمليات الفسيولوجية في بويضات الثدييات. من المهم دراسة كيفية استجابة البويضات لتلف الحمض النووي المحتمل من أجل فهم سبب ضعف الخصوبة لدى الإناث لدى البشر بشكل أفضل.
يمكن أن تكون دراسة استجابة تلف الحمض النووي في بويضات الثدييات صعبة بسبب حساسية البويضات. تتطلب معالجة البويضات درجات حرارة محددة وتركيزات CO 2 و O2. في الوقت نفسه ، يجب حماية البويضات من الضوء. يجب أن تتم المناولة الكاملة باستخدام ماصات زجاجية غير ضيقة ، لأن هذا قد يكون ضارا للبويضات ، ولكن أيضا ليس بعرض كبير ، لأن هذا قد يتسبب في تخفيف الوسط ، وبالتالي يؤثر سلبا على إجراء التثبيت. في كل خطوة من خطوات التثبيت ، يتم استخدام عدة قطرات من المخازن المؤقتة لتقليل تأثير التخفيف. طريقة بديلة لمراقبة DSBs هي مقايسة المذنب24. على الرغم من أن هذه التقنية أكثر حساسية ، إلا أنها أكثر تعقيدا. في الوقت نفسه ، باستخدام مقايسة المذنب ، لا يمكن اكتشاف منطقة الحمض النووي الدقيقة التي يحدث فيها الضرر ، وفي الخلايا ذات جزيئات الحمض النووي الريبي الوفيرة ، مثل البويضات في مرحلة GV25 ، يمكن زيادة الخلفية ، مما يؤدي إلى إشارة تلف الحمض النووي الخاطئة26.
باستخدام بروتوكول التألق المناعي الموصوف هنا ، يمكننا اكتشاف DSBs بدقة وتقدير تقدم الإصلاح في البويضات في مرحلة GV ، كما يتضح من انخفاض مضان γH2AX بمرور الوقت. ومع ذلك ، فإن أحد قيود هذه الطريقة هو أن بعض الأجسام المضادة قد تقدم توزيعا غير محدد في جميع أنحاء البويضة ، مما يؤدي إلى صور ذات إضاءة خلفية عالية. يتم استخدام المخزن المؤقت PFA-Tx-100 بدلا من PFA المتسلسل و Tx-100 ، حيث لاحظنا أنه يحسن عملية التثبيت من خلال السماح باكتشاف خلفية أقل ومضان غير محدد. القيد الثاني لاستخدام γH2AX للكشف عن DSB هو أنه لا يمكن تقدير الضرر بعد GVBD بسبب الفسفرة التلقائية ل γH2AX في الانقسام الاختزالي23.
في بروتوكول التألق المناعي هذا ، تظل البويضات في مخزن مؤقت سائل ولا يمكن تخزينها داخل الشرائح. هذه الحقيقة تجعل من الصعب الحفاظ على الخلايا الثابتة لعدة أيام بعد إضافة الجسم المضاد الثانوي. من أجل الحصول على صور عالية الجودة وعدم فقدان الإشارة ، يفضل إجراء التصوير في غضون ساعات قليلة بعد إضافة الجسم المضاد الثانوي. وتجدر الإشارة أيضا إلى أن مسح النوى من خلال المحور Z يمكن أن يجعل الإشارة أضعف بسبب التعرض المفرط. لهذا السبب ، يفضل خفض طاقة الليزر وزيادة سرعة المسح.
أخيرا ، هناك قيد آخر لبروتوكول التألق المناعي وهو أنه يمكن استخدامه فقط للخلايا الثابتة / غير الحية. لذلك ، يمكننا فقط تقدير وجود وغياب العوامل في نقاط زمنية محددة دون معرفة ما إذا كانت هناك أي تقلبات في تركيزها أو تغيرات في سلوكها بمرور الوقت. يمكن التغلب على هذه المشكلة باستخدام تصوير الخلايا الحية والعلامات الفلورية.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح.
Acknowledgements
نعترف بدعم هذا العمل من مشروع "إنشاء بنى تحتية" لبناء القدرات "في البحوث الطبية الحيوية (BIOMED-20)" (MIS 5047236) ، والذي يتم تنفيذه في إطار عمل "تعزيز البنية التحتية للبحث والابتكار" ، بتمويل من البرنامج التشغيلي "القدرة التنافسية وريادة الأعمال والابتكار" (NSRF 2014-2020) ، وبتمويل مشترك من اليونان والاتحاد الأوروبي (الصندوق الأوروبي للتنمية الإقليمية).
Materials
| Name | Company | Catalog Number | Comments |
| 3 mL Pasteur pipettes in LDPE, graduated | APTACA | 1502 | |
| 10 cc syringes | SoftCare | 114.104.21 | |
| Alexa Fluor 488-conjugated goat anti-rabbit Secondary Ab | Biotium | 20012 | |
| Anti-phospho-H2A.X (Ser139) | Merck Millipore | 07-164 | |
| ARE Heating Magnetic Stirrer | VELP Scientifica | F20500162 | |
| BD FALCON 5 mL Polystyrene Round-Bottom Tubes | BD Biosciences | 352054 | |
| BD Microlance 3 Needles 27 G - 0.40 x 13 mm | Becton Dickinson | 300635 | |
| Bovine Serum Albumin Fraction V | Roche | 10735078001 | |
| DMSO Anhydrous | Biotium | 90082 | |
| DRAQ7 DNA dye | BioStatus | DR71000 | |
| EGTA | Sigma-Aldrich | E4378-25G | |
| EMSURE MgCl2. 6H2O | Merck Millipore | 1058330250 | |
| Etoposide | CHEMIPHARM | L01CB01 | |
| FALCON 14 mL Polystyrene Round-Bottom Tubes | Corning Science | 532057 | |
| FALCON Tissue Culture Dishes, Easy-Grip, 35 x 10 mm Style | Corning Science | 353001 | |
| Glass Bottom Culture Dishes (35 mm Petri dish/ 14 mm Microwell, No. 0 coverglass) | MatTek Corporation | P35G-0-14-C | |
| HEPES | Sigma-Aldrich | H6147-25G | |
| HERACELL 150i CO2 Incubator | ThermoFisher Scientific | 50116048 | |
| IBMX powder | Sigma-Aldrich | I5879-100MG | |
| Leica M125 Stereo Microscope | Leica Microsystems | ||
| M16 Medium | Sigma-Aldrich | M7292 | |
| M2 Medium | Sigma-Aldrich | M7167 | |
| Mineral Oil | Sigma-Aldrich | M5310 | |
| NaN3 | Honeywell | 13412H | |
| NaOH | Merck Millipore | 1064981000 | |
| Nikon AX ECLIPSE Ti2 Confocal Microscope | Nikon Corporation | ||
| Nikon SMZ800N Stereo Microscope | Nikon Corporation | ||
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Pasteur pippettes, glass, long form 230 mm | DURAN WHEATON KIMBLE | 357335 | |
| pH/ORP meter | Hanna Instruments Ltd | HI2211 | |
| Phosphate buffered saline tablets | Sigma-Aldrich | P4417-100TAB | |
| PIPES | Sigma-Aldrich | P1851 | |
| PMSG Protein Lyophilised | Genway Biotech (now AVIVA Systems Biology) | GWB-2AE30A (now OPPA01037) | |
| QBD4 Dry block heater | Grant Instruments (Cambridge) Ltd | A25218 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Whatman Puradisc 25 mm 0.2 μm filters | GE Healthcare | 6780-2502 |
References
- Wang, X., Pepling, M. E. Regulation of meiotic prophase one in mammalian oocytes. Frontiers in Cell and Developmental Biology. 9, 667306(2021).
- Filatov, M., Khramova, Y., Semenova, M. Molecular mechanisms of prophase I meiotic arrest maintenance and meiotic resumption in mammalian oocytes. Reproductive Sciences. 26 (11), 1519-1537 (2019).
- Adhikari, D., et al. Inhibitory phosphorylation of Cdk1 mediates prolonged prophase I arrest in female germ cells and is essential for female reproductive lifespan. Cell Research. 26 (11), 1212-1225 (2016).
- Sun, S. C., Kim, N. H. Molecular mechanisms of asymmetric division in oocytes. Microscopy and Microanalysis. 19 (4), 883-897 (2013).
- Jones, K. T. Mammalian egg activation: From Ca2+ spiking to cell cycle progression. Reproduction. 130 (6), 813-823 (2005).
- Solc, P., Schultz, R. M., Motlik, J. Prophase I arrest and progression to metaphase I in mouse oocytes: comparison of resumption of meiosis and recovery from G2-arrest in somatic cells. Molecular Human Reproduction. 16 (9), 654-664 (2010).
- Parfenov, V., Potchukalina, G., Dudina, L., Kostyuchek, D., Gruzova, M. Human antral follicles: oocyte nucleus and the karyosphere formation (electron microscopic and autoradiographic data). Gamete Research. 22 (2), 219-231 (1989).
- Zuccotti, M., Piccinelli, A., Giorgi Rossi, P., Garagna, S., Redi, C. A. Chromatin organization during mouse oocyte growth. Molecular Reproduction and Development. 41 (4), 479-485 (1995).
- Sun, X., et al. Comprehensive analysis of nonsurrounded nucleolus and surrounded nucleolus oocytes on chromatin accessibility using ATAC-seq. Molecular Reproduction and Development. 90 (2), 87-97 (2023).
- Zuccotti, M., Bellone, M., Longo, F., Redi, C. A., Garagna, S. Fully-mature antral mouse oocytes are transcriptionally silent but their heterochromatin maintains a transcriptional permissive histone acetylation profile. Journal of Assisted Reproduction and Genetics. 28 (12), 1193-1196 (2011).
- Winship, A. L., Stringer, J. M., Liew, S. H., Hutt, K. J. The importance of DNA repair for maintaining oocyte quality in response to anti-cancer treatments, environmental toxins and maternal ageing. Human Reproduction Update. 24 (2), 119-134 (2018).
- Lieber, M. R. The mechanism of human nonhomologous DNA end joining. The Journal of Biological Chemistry. 283 (1), 1-5 (2008).
- Chiruvella, K. K., Liang, Z., Wilson, T. E. Repair of double-strand breaks by end joining. Cold Spring Harbor Perspectives in Biology. 5 (5), 012757(2013).
- Chang, H. H. Y., Pannunzio, N. R., Adachi, N., Lieber, M. R. Non-homologous DNA end joining and alternative pathways to double-strand break repair. Nature Reviews. Molecular Cell Biology. 18 (8), 495-506 (2017).
- Shibata, A., Jeggo, P. A. Roles for the DNA-PK complex and 53BP1 in protecting ends from resection during DNA double-strand break repair. Journal of Radiation Research. 61 (5), 718-726 (2020).
- Mohiuddin, I. S., Kang, M. H. DNA-PK as an emerging therapeutic target in cancer. Frontiers in Oncology. 9, 635(2019).
- Marangos, P., Carroll, J. Oocytes progress beyond prophase in the presence of DNA damage. Current Biology. 22 (11), 989-994 (2012).
- Paull, T. T., et al. A critical role for histone H2AX in recruitment of repair factors to nuclear foci after DNA damage. Current Biology. 10 (15), 886-895 (2000).
- Bakkenist, C. J., Kastan, M. B. DNA damage activates ATM through intermolecular autophosphorylation and dimer dissociation. Nature. 421 (6922), 499-506 (2003).
- Marangos, P., et al. DNA damage-induced metaphase I arrest is mediated by the spindle assembly checkpoint and maternal age. Nature Communications. 6, 8706(2015).
- Lavrentyeva, E. A., Shishova, K. V., Zatsepina, O. V. Differences in nuclear dynamics in mouse GV oocytes with a diverse chromatin configuration. Biology Bulletin Russian Academy of Sciences. 46, 332-341 (2019).
- Montecucco, A., Zanetta, F., Biamonti, G. Molecular mechanisms of etoposide. EXCLI Journal. 14, 95-108 (1998).
- Mayer, A., et al. DNA damage response during mouse oocyte maturation. Cell Cycle. 15 (4), 546-558 (2016).
- Olive, P., Banáth, J. The comet assay: A method to measure DNA damage in individual cells. Nature Protocols. 1, 23-29 (2006).
- Wu, D., Dean, J. EXOSC10 sculpts the transcriptome during the growth-to-maturation transition in mouse oocytes. Nucleic Acids Research. 48 (10), 5349-5365 (2020).
- Simon, L., Emery, B., Carrell, D. DNA damage: COMET assay. Manual of Sperm Function Testing in Human Assisted Reproduction. Agarwal, A., Henkel, R., Majzoub, A. , 202-212 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved