Method Article
マウス卵母細胞におけるDNA二本鎖切断の検出
要約
卵母細胞のゲノムの完全性を維持することは、結果として生じる胚の遺伝的忠実度を確保するために必要です。ここでは、哺乳類の雌生殖細胞におけるDNA二本鎖切断を検出するための正確なプロトコルを提示します。
要約
卵母細胞は、女性の体内で最大かつ最も長寿命の細胞の一つです。それらは胚発生中に卵巣で形成され、減数分裂Iの前期に逮捕されたままである。静止状態は、卵母細胞が成長するための刺激を受け、減数分裂を再開する能力を得るまで何年も続く可能性があります。この長期にわたる逮捕状態は、それらをDNA損傷の侮辱を蓄積することを非常に容易にし、それは雌性配偶子の遺伝的完全性、したがって将来の胚の遺伝的完全性に影響を及ぼす。
したがって、DNA損傷応答メカニズムを確立するための第一歩であるDNA損傷を正確に検出する方法の開発は非常に重要です。この論文では、20時間の間に前期停止卵母細胞におけるDNA損傷の存在と進行をテストするための一般的なプロトコルについて説明します。具体的には、マウス卵巣を解剖し、卵丘-卵母細胞複合体(COC)を回収し、COCから卵丘細胞を取り出し、3-イソブチル-1-メチルキサンチンを含むΜ2培地で卵母細胞を培養して停止状態を維持します。その後、卵母細胞は細胞毒性の抗新生物薬であるエトポシドで処理され、二本鎖切断(DSB)を引き起こします。
免疫蛍光法と共焦点顕微鏡を用いて、ヒストンH2AXのリン酸化型であるコアタンパク質γH2AXのレベルを検出および定量します。H2AXは、DNA損傷後にDSBの部位でリン酸化されます。卵母細胞のDNA損傷後にDNAの完全性を回復できないと、不妊症、先天性欠損症、自然流産率の増加につながる可能性があります。したがって、DNA損傷応答機構の理解と同時に、これらのメカニズムを研究するためのインタクトな方法の確立は、生殖生物学研究に不可欠です。
概要
哺乳類の雌生殖細胞における減数分裂の過程は、出生前に卵巣で開始されます。卵母細胞の総数は、主に胚形成中に卵巣に確立されます。卵母細胞は減数分裂に入り、前期I1で停止したままになります。思春期が発症し、卵胞刺激ホルモン(FSH)と黄体形成ホルモン(LH)の産生と内分泌作用の後、卵母細胞が再開して減数分裂を完了することがあります2。ヒトでは、前期停止は最大50年間続く可能性があります3。減数分裂Iへの参入後の細胞分裂は非対称であり、その結果、小さな極体とそのサイズを保持する卵母細胞が生成されます。したがって、ほとんどの細胞質成分は、初期胚発生中に卵形質に貯蔵される4。その後、卵母細胞は減数分裂IIに入り、核を変形させたり、染色体を脱凝縮したりすることなく、受精まで中期IIで停止したままになります5。
卵母細胞と体細胞を区別する独特の特徴は、卵母細胞が無傷の核(胚小胞[GV]停止)を有する前期Iにおける停止状態であり、GVステージ6と呼ばれる。クロマチン構成に基づいて、GV期の卵母細胞は、非包囲核小体(NSN)と包囲核小体(SN)の2つのカテゴリーに分類されます7,8。NSN GV期の卵母細胞では、クロマチンは核領域全体に広がり、転写が活発であるのに対し、SN卵母細胞では、クロマチンは核小体を取り囲むコンパクトなリングを形成し、転写はサイレントです9。どちらのタイプのGVステージ卵母細胞も減数分裂能力を示します。それらは同じ速度で減数分裂に入りますが、NSN卵母細胞は発生能力が低く、2細胞期の胚を超えて発達することはできません10。
前期I停止の長期状態は、DNA損傷蓄積の発生率を増加させる11。したがって、卵母細胞におけるDNA損傷応答メカニズムは、遺伝的完全性を有する配偶子の産生を可能にし、結果として生じる胚が生理学的染色体含有量を有することを保証するために不可欠である。
DNA損傷応答の中心的な側面はDNA修復です。真核細胞におけるDSB修復の主な経路には、非相同末端結合(NHEJ)、相同組換え(HR)、および代替NHEJ12,13,14,15が含まれます。NHEJは高速ですがエラーが発生しやすいメカニズムですが、HRは完了するのに時間がかかりますが、忠実度は高くなります16。
卵母細胞がDNA損傷修復に使用するメカニズムについての十分な知識はありません。研究によると、エトポシド、ドキソルビシン、UVBまたは電離放射線などの遺伝毒性物質の使用によって完全に成長した哺乳類の卵母細胞に誘発されるDNA損傷は、前期I停止からの終了のタイミングと速度に影響を与えません17。卵母細胞は、損傷のレベルが上昇していてもGV分解(GVBD)を受ける可能性があります。この損傷は、γH2AXの観察によって決定することができる。このリン酸化型のH2AX(γΗ2ΑΧ)はDSBマーカーであり、切断部位に位置し、修復因子およびタンパク質が破断端に蓄積するのを助ける足場として機能する18。
DNA損傷後の細胞周期停止の欠如は、修復されていないDNAを持つ卵母細胞が減数分裂に再入ることを可能にする不十分なDNA損傷チェックポイントによるものです。高レベルのDNA損傷の後、チェックポイントはATM / Chk1依存性経路の活性化を通じて前期停止を維持することができます。DSB に対するチェックポイント応答の制限は、ATM17,19 のアクティブ化が制限されているためです。減数分裂IのM期では、DNA損傷が紡錘体集合チェックポイント(SAC)誘発減数分裂Iチェックポイントを活性化し、E3ユビキチンリガーゼ後期促進複合体/サイクロソーム(APC / C)の活性化を妨げ、したがってM期出口を妨げる可能性があることが研究によって示されています。さらに、SACタンパク質のアブレーションはM期停止の状態を克服し、減数分裂Iチェックポイント20の確立におけるSACの重要性を強調しています。
以前の研究が明らかに示しているように、DSBはマウス卵母細胞において堅牢な前期チェックポイントを誘導することはできない。このような損傷を修復せずに放置すると、染色体異常を持つ胚につながる可能性があります。したがって、卵母細胞が潜在的な遺伝的傷害に対処するために使用する固有の経路をよりよく理解するために、女性の配偶子形成のさまざまな段階でDNA損傷応答を研究することが重要です。
プロトコル
すべてのマウス実験は、地方自治体(ギリシャのヨアニナ州)によって承認され、欧州共同体理事会指令2010/63 / EUに従って実施されました。3Rの原理に関して実験を行った。実験に用いたCD-1マウスは全て、ギリシャ・ヨアニナ大学の動物飼育施設で、温度(22°C)、湿度(60%)を制御した室内で飼育し、 自由摂食させた。動物小屋は、繁殖(EL33-BIObr01)、供給(EL33-BIOsup01)、および実験(EL33BIO-exp01)のための施設を運営するライセンスを持っています。
1.試薬の調製
- 3-イソブチル-1-メチルキサンチン(IBMX)粉末(材料表を参照)をジメチルスルホキシド(DMSO)(材料表を参照)で最終濃度200 mMに希釈します。10 μLをアリコートし、-20°Cで保存します。 1ヶ月以内にソリューションを使用してください。
注:IBMXパウダーは-20°Cに保たれます。 - すべての免疫蛍光バッファーを調製し、4°Cで保存します。
- 1つのPBS錠剤( 材料表を参照)を200mLのddH2Οで希釈することにより、滅菌リン酸緩衝生理食塩水(PBS)を調製します。
- マグネチックスターラー(材料表参照)で攪拌しながら、80 mLのddH 2 Ο、0.59575 gのHEPES、1.81422 gのPIPES、0.38035 gのEGTAおよび0.04066 gのMgCl2(材料表を参照)を添加してPHEMバッファーを作成し、pHが6.9に達するまで同時にNaOH(材料表を参照)を添加します(pH/ORPメーターを使用して確認してください[材料表を参照])。次に、ddH2Οを最終容量100 mLまで加えます。
- PFA粉末(材料表参照)をPHEMバッファーで希釈し、最終濃度4%PFAで加熱しながらマグネチックスターラーで攪拌することにより、パラホルムアルデヒド-トリトン-X-100(PFA-Tx-100)バッファーを調製します。次に、シリンジと0.2 μmフィルターを使用してバッファーをろ過し(材料表を参照)、0.5%Tx-100を追加します(材料表を参照)。約10 mLのPFA-Tx-100(0.4 gのPFA、50 μLのTx-100)を準備しますが、これは1回の実験に十分です。4°Cで最大1週間保管してください。
注意: PFAを取り扱うために手袋を着用し、皮膚や目との接触を避けてください。 - PBSにウシ血清アルブミン(最終濃度:0.5% w/v BSA)(材料表参照)を加えて洗浄バッファーを調製し、機械的に撹拌します。10%w/v NaN3バッファー(アジ化ナトリウム)を1:1,000希釈で添加し、真菌および細菌汚染のリスクを最小限に抑えます。10mLのddH2Oに1gのNaN 3粉末(材料表を参照)を加えることにより、10%w/v NaN3緩衝液を作る。NaN3バッファーを室温で保存する。
- PBSにBSA(最終濃度:3%w/v)を添加し、機械的に撹拌してブロッキングバッファーを調製します。10%NaN3 バッファーを1:1,000希釈で添加します。
2.解剖した卵巣からのGV卵母細胞の採取とDSBの誘導
注意: すべてのツールとソリューションは無菌である必要があります。卵母細胞の取り扱いは、実体顕微鏡下でマウスピペットを使用して行われ(材料の表を参照)、すべての滴は鉱油で覆われています(材料の表と図1Eを参照)。
- 頸部脱臼によってマウスを淘汰する46〜48時間前に、妊娠中の牝馬の血清ゴナドトロピン(PMSG)( 材料の表を参照)の7国際単位(IU)をマウス腹腔内注射します。
注:使用するすべてのマウスは8〜12週齢である必要があります。 - M2培地(材料表参照)をシリンジと0.2 μmフィルターでろ過し、IBMX 200 mMを14 mL丸底チューブ(材料表参照)で最終濃度200 μMまで添加して、卵母細胞を前期Iで停止させます。次に、プラスチック組織培養皿(材料表を参照)でM2-IBMX培地の滴を調製し、卵母細胞単離の前に少なくとも30分間、37°Cのホットブロック(材料表を参照)に置きます。M2は4°Cで保管してください。
- 子宮頸部脱臼によってマウスを屠殺し、卵巣を解剖し、M2-IBMXで5 mLの丸底チューブ( 材料表を参照)に入れます。
- 卵巣を1.5 mLのM2-IBMXを含むプラスチック製の蓋に移し、卵巣周囲脂肪組織または卵管セグメントを取り除き、27 Gの針で卵巣を機械的に穿孔してCOCを放出します(材料表および図1A-Cを参照)。
- COCをM2-IBMX(それぞれ約25〜30 μL)の滴を入れた培養皿に移し、狭口径ガラスパスツールピペットを使用してピペッティングを繰り返して卵丘細胞を除去します( 材料表 および 図1Dを参照)。
- SN GV期の卵母細胞を選択し、光から保護された37°Cのホットブロック上のM2-IBMX培地のドロップ(25 μL)に移します(図1F)。
- 核が末梢に配置されているNSN卵母細胞とは対照的に、より大きなサイズと中央に配置された核に基づいてSN卵母細胞を探します21。いずれの場合も、GV卵母細胞の種類(SNまたはNSN)について最終決定を下す前に、共焦点顕微鏡でDNA構成を観察してください。
- エトポシドを使用してDSBを誘導します( 材料表を参照)。GV期の卵母細胞を遺伝毒性物質の滴(各25 μL)に入れて、暗条件下で37°Cのホットブロックに1時間置きます。
注:エトポシドは、DSBをDNA22に導入するトポイソメラーゼII阻害剤です。エトポシドを20 mg/mLの10 μLアリコートに保ち、室温で光から保護します。テストされた濃度は、5 μg/mL、20 μg/mL、および50 μg/mLです。 - GV期の卵母細胞を長期間停止させ続けるには、37°C、5%CO2のインキュベーター(材料表を参照)で400 μM IBMXを添加したM16培養培地(材料表を参照)の滴に卵母細胞を入れます。M16を4°Cで保存し、シリンジと0.2 μmフィルターで培地をろ過し、使用前に少なくとも1時間インキュベートします。
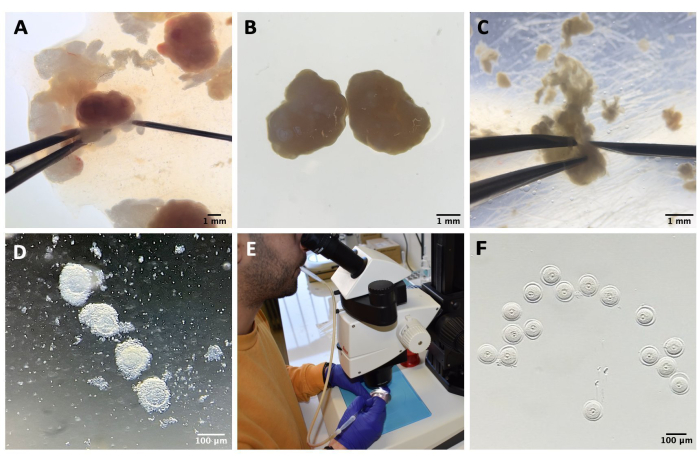
図1:卵母細胞の単離プロセス 。 (A)IBMXを用いたM2培地中の卵巣からの卵巣周囲脂肪組織および残りの卵管セグメントの除去。実体顕微鏡接眼レンズを通して得られた写真。スケールバー = 1 mm。 (B)IBMXを用いたM2培地中の単離された卵巣。実体顕微鏡接眼レンズを通して得られた画像。スケールバー = 1 mm。 (C)IBMXを用いたM2培地中の27G針を用いた卵巣の機械的穿孔。実体顕微鏡接眼レンズを通して得られた画像。スケールバー = 1 mm。 (D)IBMXを用いたM2培地での穿孔後に卵巣から放出されたCOC。実体顕微鏡接眼レンズを通して得られた画像。スケールバー = 100 μm。 (E)マウスピペットを用いた卵母細胞採取。(f)剥巣した卵母細胞を、周囲の卵丘細胞を除去した後、IBMXと共にM2培地に入れる。実体顕微鏡接眼レンズを通して得られた画像。スケールバー = 100 μm。 この図の拡大版を表示するには、ここをクリックしてください。
3.卵母細胞の固定と免疫蛍光
注:卵母細胞の取り扱いは、実体顕微鏡下でマウスピペットを使用して行われ、すべての滴は鉱油で覆われています。
- コントロールおよびエトポシド処理したGV卵母細胞を、PFA-Tx-100バッファーを含む異なるプラスチック組織培養皿に室温で40分間入れます。
- 卵母細胞を3つの異なる滴の洗浄バッファー(各50 μL)で室温で洗浄します。卵母細胞を各滴で5分間放置します。
- 卵母細胞をブロッキングバッファー(各25 μL)の滴に37°Cのホットブロック上で1時間入れます。
- γH2AX(ウサギリン酸化-Η2ΑΧ)を認識する一次抗体(Ser139)( 材料表参照)を調製します(原液:1 mg/mL)。ブロッキングバッファーで1:200希釈し、卵母細胞を一次抗体の滴(各15 μL)に入れて4°Cで一晩入れます。
注:Phospho-Η2ΑΧ(γH2AX)は、体細胞とGV卵母細胞の両方でDSBを検出するための一般的なマーカーです18,23。 - 翌日、室温で3つの異なる滴の洗浄バッファー(各50μL)で卵母細胞を洗浄します。卵母細胞を各滴で5分間放置します。
- 二次抗体であるAlexa Fluor 488結合ヤギ抗ウサギ( 材料表参照)を調製します(原液:2 mg/mL)。ブロッキングバッファーで1:200希釈し、卵母細胞を二次抗体(各15 μL)の滴に入れて、光から保護された37°Cのホットブロックに1時間置きます。
- 卵母細胞を、透過処理された細胞のDNAのみを染色する遠赤色蛍光DNA色素であるDRAQ7(各25 μL)(ストック溶液:0.3 mM、 材料表を参照)の滴に移します。洗浄バッファーで1:250希釈し、暗所で室温で10分間使用します。
- 卵母細胞を3つの異なる滴の洗浄バッファー(各50 μL)で室温で洗浄します。各滴を5分間放置した後、共焦点顕微鏡用に35 mmのガラス底ペトリ皿( 材料表を参照)の少量の滴(各約5 μL)の洗浄バッファーに移します(図2A)。
注:DNA染色剤と二次抗体の両方の洗浄は同時に行われます。
4. 共焦点顕微鏡
注:共焦点顕微鏡は、ガラス底皿に卵母細胞を配置した後の蛍光強度の低下を避けるために、直ちに実施する必要があります。電動ステージを備えた共焦点顕微鏡( 材料表を参照)へのアクセスが必要です。
- 顕微鏡のセットアップ
- 共焦点システムでは、レーザーコントローラー、レーザー、顕微鏡コントローラー、透過光用ランプ、およびPCのスイッチを入れます(図2B、D)。
- 共焦点ソフトウェアを開き、 40倍オイルレンズを選択します。
- ディッシュを標本ホルダーに入れ、ジョイスティックを使用してステージをXY軸とZ軸で動かして、卵母細胞に焦点を合わせようとします(図2C)。
- 卵母細胞のスキャン
- 飽和を最小限に抑えるために、 実験ごとにレーザー出力、 ゲイン、 ピンホールサイズ を個別に設定します。
- 卵母細胞ごとに、関心のある領域、特にDNA領域の核を設定します。DNA領域の境界を定義し、 zステップサイズ を 3μmに調整します。次に、スキャンを開始します。
- 選択したフォルダー内の各セルの画像を保存します。
- スキャンが完了したら、ソフトウェアを終了し、コンピューターをシャットダウンして、レーザーコントローラー、レーザー、顕微鏡コントローラー、および透過光のランプをオフにします。
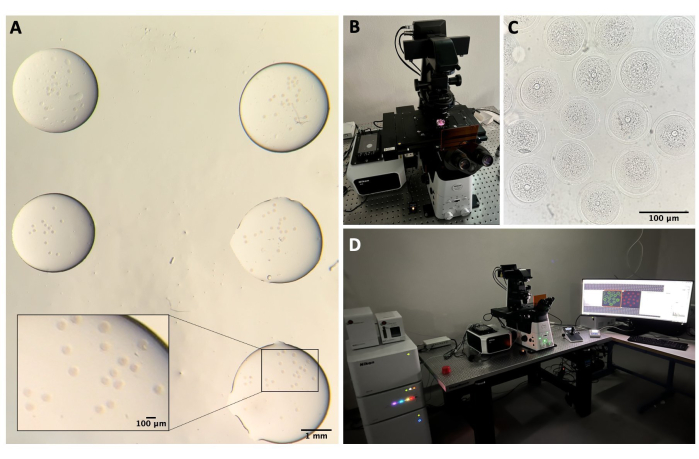
図2:共焦点顕微鏡 。 (A)免疫蛍光プロトコルとDNA染色を行った後に卵母細胞を固定し、別々の滴の洗浄バッファーに入れ、鉱油で覆い、ガラス底皿に入れ、共焦点顕微鏡イメージング用に準備しました。各ドロップには、異なる実験カテゴリが含まれています。実体顕微鏡接眼レンズを通して得られた画像。スケールバー = 1 mm/100 μm (ズームイン部分)(B)共焦点顕微鏡ステージに載せたガラス底板。(C)共焦点顕微鏡で得られた卵母細胞の明視野画像。スケールバー = 100 μm。 (D)共焦点顕微鏡システム。 この図の拡大版を表示するには、ここをクリックしてください。
5. イメージング解析
- Fiji ImageJ-win64 をブラウザー (https://imagej.net/software/fiji/downloads) でダウンロードして開き、データを TIFF スタック ファイルとしてインポートします。
注: 各卵母細胞ファイルを個別に開きます。 - 画像をクリック |カラー |[チャネルの分割] : すべてのチャネルを分割します。
- LUT(ルックアップテーブル)をクリックして、各チャンネルの好みの色を選択します。
- 画像をクリック |カラー |チャンネルをマージ して、γΗ2ΑΧとDNAのチャンネルをマージします。明視野チャネルはマージしないままにします。
- NSN卵母細胞およびDNA損傷のレベルが低いSN卵母細胞では、γΗ2ΑΧがDNA領域の病巣として検出されます。この場合、「 マルチポイント」またはポイント コマンドをクリックして、DNAと一致するすべてのγΗ2ΑΧフォーカスを選択します。すべてのスタックに対してこの手順を繰り返します。
- 高レベルのDNA損傷を有するSN卵母細胞では、γΗ2ΑΧシグナルはDNA領域全体に分布している。この場合、 画像|スタック |Z プロジェクトを選択し、[ フリーハンド選択 ]コマンドを使用して、DNA 領域全体を選択します。
- γΗ2ΑΧ蛍光を測定するには、 解析|測定し、測定値を.xlsxファイルにコピーします。次に、平均蛍光を計算し、値を正規化し、焦点の数を数えてからグラフを作成します。
- [分析] をクリックします。[スケールを設定]を設定してスケールを設定し、[分析]をオンにします。ツール |縮尺記号: チャンネルに縮尺記号を追加します。
結果
ここで実証した手順を用いて、マウス卵巣を解剖し、脂肪を除去し、そして完全に増殖したGV期の卵母細胞を採取した。次いで、卵丘細胞を細いピペットを用いた反復ピペッティングによって除去し、M2−IBMX培地の新鮮な滴に入れ、ホットブロック(37°C)上の鉱油で覆った(図1A−F)。ストックエトポシド濃度20 mg/mLを用いて、3つの異なるエトポシド濃度(5 μg/mL、20 μg/mL、および50 μg/mL)を調製しました。GV期の卵母細胞を、3つの異なるエトポシド濃度で、鉱油で覆われ、37°Cで光から保護された滴で1時間配置されました。 次に、プロトコルのセクションで詳細に説明したように、免疫蛍光プロトコルに従い、卵母細胞をガラス底皿に入れ、共焦点顕微鏡で観察しました(図2)。
SN GV期の卵母細胞では、DNA損傷直後、すべてのエトポシド濃度(5 μg/mL、20 μg/mL、および50 μg/mL)でγH2AXの存在が増加し、γH2AXはDNA領域全体に分布していました(図3)。DSBの定量および推定は、DNA部位におけるγH2AX蛍光強度を観察することによって行った。γH2AX蛍光は、エトポシド濃度の増加に比例して強まった。さらに、長期前期停止後(エトポシド処理後20時間)、GV期卵母細胞はγH2AX病巣数および強度を減少させる能力を示し、GV期停止卵母細胞における活発な修復過程の存在を示唆した(図3E)。
γH2AX蛍光がDNAを介して分布するSN卵母細胞とは異なり、NSN卵母細胞では、エトポシド処理直後の病巣にγH2AXが20 μg/mLで示されました。DNA領域と一致する病巣の数を推定し、すべての焦点の蛍光を計算し、すべての卵母細胞の平均蛍光を提示しました。蛍光と病巣数の両方が、2つの卵母細胞カテゴリー間で統計的に有意な差を示しました(図4)。
共焦点顕微鏡は、異なるZスタックにおける病巣の数と強度に関する情報を提供し、異なる時点でのDNA損傷の存在と修復ダイナミクスを特定するのに役立ちます。ガルバノスキャンは、低バックグラウンドで正確なスキャンを提供し、スキャン画像のより良い分析を提供します。
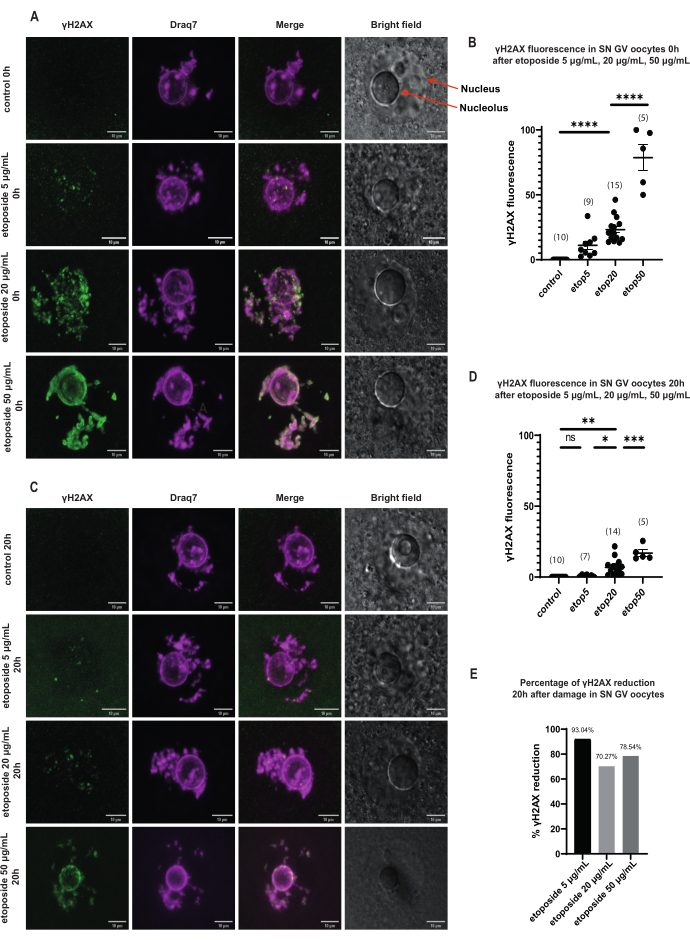
図3:長期GV停止後の3つの異なるエトポシド濃度で処理されたSN GVステージ卵母細胞におけるγH2AXの減少。 (a)エトポシド処理後0時間におけるSN GV期卵母細胞におけるγH2AX蛍光。γH2AXは、すべてのエトポシド濃度で曝露直後に増加し、その増加は濃度依存的である(緑色:γΗ2ΑΧ、マゼンタ:DNA)。画像はZスタック投影であり、明るさ/コントラストはFiji / ImageJを使用してチャンネルごとに調整されています。スケールバー = 10 μm。 (B)明確なエトポシド濃度で処理した0時間後のSN GV期の卵母細胞におけるγH2AX蛍光のグラフ。データはSEM±平均値を表す。各ドットは1つの卵母細胞(卵母細胞の数はグラフに示されています)を表します(ns =非有意、** p < 0.005、**** p < 0.0001 、テューキーの多重比較検定による一元配置分散分析)。(C)エトポシド処理後20時間のSN GV期卵母細胞におけるγH2AX蛍光。γH2AXは、すべてのエトポシド濃度(緑:γΗ2ΑΧ、マゼンタ:DNA)で曝露後20時間減少します。画像はZスタック投影であり、明るさ/コントラストはFiji/ImageJを使用してチャンネルごとに調整されています。スケールバー = 10 μm。 (D)明確なエトポシド濃度で処理した後のSN GVステージ卵母細胞におけるγH2AX蛍光のグラフ。データはSEM±平均値を表す。各ドットは1つの卵母細胞(卵母細胞の数はグラフに示されています)を表します(ns =非有意、* p < 0.05、** p < 0.005、*** p < 0.0005 、**** p < 0.0001、テ ューキーの多重比較検定による一元配置分散分析)。(E)エトポシド処理卵母細胞における前期停止後のSN GV期卵母細胞のγH2AX蛍光減少の棒グラフ。各カラムの上の数字は、γH2AX蛍光の低下率を示す。この図の拡大版を表示するには、ここをクリックしてください。
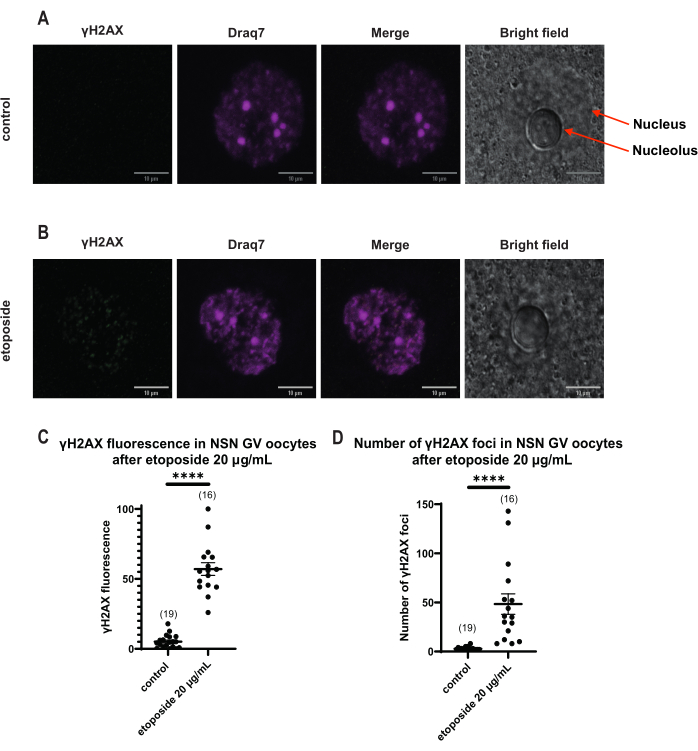
図4:20 μg/mLのエトポシドで処理した後のNSN GV期卵母細胞におけるΗ2ΑΧのリン酸化。 (A)1つの対照NSN GV期卵母細胞の代表的な共焦点画像(緑:γΗ2ΑΧ、マゼンタ:DNA)。画像はZスタック投影であり、明るさ/コントラストはFiji/ImageJを使用してチャンネルごとに調整されています。スケールバー = 10 μm。 (B)エトポシド処理NSN GV期卵母細胞(緑:γΗ2ΑΧ、マゼンタ:DNA)の代表的な共焦点画像。卵母細胞は、エトポシド処理の0時間後に固定された。画像はZスタック投影であり、Fiji/ImageJを使用して各チャンネルの明るさ/コントラストが調整されています。スケールバー = 10 μm。 (C)20 μg/mLエトポシド処理後のNSN GV期卵母細胞における正規化されたγΗ2ΑΧ蛍光。データはSEM±平均値を表す。各ドットは、2つの独立した実験(**** p < 0.0001、対応のないノンパラメトリック t検定、マン-ホイット ニーU検定)から得られた1つの卵母細胞(卵母細胞の数はグラフに示されている)を表す。 (D)20 μg/mLエトポシド処理後のNSN GV期卵母細胞におけるγΗ2ΑΧ病巣の数。データはSEM±平均値を表す。各ドットは、2つの独立した実験(**** p < 0.0001、対応のないノンパラメトリック t検定、マン-ホイット ニーU検定)から得られた1つの卵母細胞(卵母細胞の数はグラフに示されている)を表す。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ここで説明した方法を用いて、哺乳類の卵母細胞からDSBを検出しました。この方法は、卵母細胞におけるDNA修復過程の検出および研究を可能にする。同じプロトコルは、哺乳類の卵母細胞の生理学的プロセスに関与する他のタンパク質の分析にも使用できます。ヒトの女性の不妊の原因をよりよく理解するためには、卵母細胞が潜在的なDNA損傷にどのように反応するかを研究することが重要です。
哺乳類の卵母細胞におけるDNA損傷応答の研究は、卵母細胞の感受性のために困難な場合があります。卵母細胞の取り扱いには、特定の温度とCO2 およびO2 濃度が必要です。同時に、卵母細胞は光から保護されなければなりません。αllの取り扱いは、卵母細胞に有害である可能性があるため、狭くないガラスピペットを使用して行う必要がありますが、培地の希釈を引き起こし、固定手順に悪影響を与える可能性があるため、幅が広くないガラスピペットを使用する必要があります。固定の各ステップにおいて、希釈効果を最小限に抑えるために数滴の緩衝液が使用される。DSBを観察するための別の方法は、コメットアッセイ24です。この手法はより敏感ですが、より複雑です。同時に、コメットアッセイを使用することによって、損傷が生じる正確なDNA領域を検出することは不可能であり、そしてGV段階卵母細胞25のような豊富なRNA分子を有する細胞では、バックグラウンドが増加し、偽のDNA損傷シグナル26につながる可能性がある。
ここで説明する免疫蛍光プロトコルを使用することにより、DSBを正確に検出し、時間の経過に伴うγH2AX蛍光の減少によって示されるように、GV期の卵母細胞の修復の進行状況を推定することができます。それにもかかわらず、この方法の1つの制限は、特定の抗体が卵質全体に非特異的な分布を示し、したがって高いバックグラウンド蛍光を有する画像をもたらす可能性があることである。PFA-Tx-100バッファーは、連続PFAおよびTx-100の代わりに使用され、バックグラウンドおよび非特異的蛍光の検出を可能にすることで固定プロセスを改善することが観察されています。DSB検出にγH2AXを使用することの第2の制限は、減数分裂23におけるγH2AXの自発的リン酸化のために、GVBD後に損傷を推定できないことである。
この免疫蛍光プロトコルでは、卵母細胞は液体バッファーに残り、スライド内に保存することはできません。この事実は、二次抗体の添加後数日間固定細胞を保存することを困難にする。良好な画質を達成し、シグナルを失わないために、二次抗体を添加してから数時間以内にイメージングを行うことが好ましい。また、Z軸を通る核のスキャンは、露出オーバーのために信号が弱くなる可能性があることにも注意してください。そのため、レーザー出力を下げ、スキャンの速度を上げることが好ましい。
最後に、免疫蛍光プロトコルの別の制限は、固定/非生細胞にのみ使用できることです。したがって、特定の時点での要因の有無のみを推定することができ、それらの濃度の変動や時間の経過に伴う行動の変化があるかどうかはわかりません。この問題は、生細胞イメージングと蛍光タグマーカーを使用することで克服できます。
開示事項
著者には利益相反はありません。
謝辞
我々は、運用プログラム「競争力、起業家精神及びイノベーション」(NSRF 2014-2020)の資金提供を受け、ギリシャ及び欧州連合(欧州地域開発基金)の共同出資による「研究・イノベーション基盤の強化」の下で実施されるプロジェクト「生物医学研究における『能力構築』インフラの確立(BIOMED-20)」(MIS 5047236)からのこの作業への支援を認識する。
資料
| Name | Company | Catalog Number | Comments |
| 3 mL Pasteur pipettes in LDPE, graduated | APTACA | 1502 | |
| 10 cc syringes | SoftCare | 114.104.21 | |
| Alexa Fluor 488-conjugated goat anti-rabbit Secondary Ab | Biotium | 20012 | |
| Anti-phospho-H2A.X (Ser139) | Merck Millipore | 07-164 | |
| ARE Heating Magnetic Stirrer | VELP Scientifica | F20500162 | |
| BD FALCON 5 mL Polystyrene Round-Bottom Tubes | BD Biosciences | 352054 | |
| BD Microlance 3 Needles 27 G - 0.40 x 13 mm | Becton Dickinson | 300635 | |
| Bovine Serum Albumin Fraction V | Roche | 10735078001 | |
| DMSO Anhydrous | Biotium | 90082 | |
| DRAQ7 DNA dye | BioStatus | DR71000 | |
| EGTA | Sigma-Aldrich | E4378-25G | |
| EMSURE MgCl2. 6H2O | Merck Millipore | 1058330250 | |
| Etoposide | CHEMIPHARM | L01CB01 | |
| FALCON 14 mL Polystyrene Round-Bottom Tubes | Corning Science | 532057 | |
| FALCON Tissue Culture Dishes, Easy-Grip, 35 x 10 mm Style | Corning Science | 353001 | |
| Glass Bottom Culture Dishes (35 mm Petri dish/ 14 mm Microwell, No. 0 coverglass) | MatTek Corporation | P35G-0-14-C | |
| HEPES | Sigma-Aldrich | H6147-25G | |
| HERACELL 150i CO2 Incubator | ThermoFisher Scientific | 50116048 | |
| IBMX powder | Sigma-Aldrich | I5879-100MG | |
| Leica M125 Stereo Microscope | Leica Microsystems | ||
| M16 Medium | Sigma-Aldrich | M7292 | |
| M2 Medium | Sigma-Aldrich | M7167 | |
| Mineral Oil | Sigma-Aldrich | M5310 | |
| NaN3 | Honeywell | 13412H | |
| NaOH | Merck Millipore | 1064981000 | |
| Nikon AX ECLIPSE Ti2 Confocal Microscope | Nikon Corporation | ||
| Nikon SMZ800N Stereo Microscope | Nikon Corporation | ||
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Pasteur pippettes, glass, long form 230 mm | DURAN WHEATON KIMBLE | 357335 | |
| pH/ORP meter | Hanna Instruments Ltd | HI2211 | |
| Phosphate buffered saline tablets | Sigma-Aldrich | P4417-100TAB | |
| PIPES | Sigma-Aldrich | P1851 | |
| PMSG Protein Lyophilised | Genway Biotech (now AVIVA Systems Biology) | GWB-2AE30A (now OPPA01037) | |
| QBD4 Dry block heater | Grant Instruments (Cambridge) Ltd | A25218 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Whatman Puradisc 25 mm 0.2 μm filters | GE Healthcare | 6780-2502 |
参考文献
- Wang, X., Pepling, M. E. Regulation of meiotic prophase one in mammalian oocytes. Frontiers in Cell and Developmental Biology. 9, 667306(2021).
- Filatov, M., Khramova, Y., Semenova, M. Molecular mechanisms of prophase I meiotic arrest maintenance and meiotic resumption in mammalian oocytes. Reproductive Sciences. 26 (11), 1519-1537 (2019).
- Adhikari, D., et al. Inhibitory phosphorylation of Cdk1 mediates prolonged prophase I arrest in female germ cells and is essential for female reproductive lifespan. Cell Research. 26 (11), 1212-1225 (2016).
- Sun, S. C., Kim, N. H. Molecular mechanisms of asymmetric division in oocytes. Microscopy and Microanalysis. 19 (4), 883-897 (2013).
- Jones, K. T. Mammalian egg activation: From Ca2+ spiking to cell cycle progression. Reproduction. 130 (6), 813-823 (2005).
- Solc, P., Schultz, R. M., Motlik, J. Prophase I arrest and progression to metaphase I in mouse oocytes: comparison of resumption of meiosis and recovery from G2-arrest in somatic cells. Molecular Human Reproduction. 16 (9), 654-664 (2010).
- Parfenov, V., Potchukalina, G., Dudina, L., Kostyuchek, D., Gruzova, M. Human antral follicles: oocyte nucleus and the karyosphere formation (electron microscopic and autoradiographic data). Gamete Research. 22 (2), 219-231 (1989).
- Zuccotti, M., Piccinelli, A., Giorgi Rossi, P., Garagna, S., Redi, C. A. Chromatin organization during mouse oocyte growth. Molecular Reproduction and Development. 41 (4), 479-485 (1995).
- Sun, X., et al. Comprehensive analysis of nonsurrounded nucleolus and surrounded nucleolus oocytes on chromatin accessibility using ATAC-seq. Molecular Reproduction and Development. 90 (2), 87-97 (2023).
- Zuccotti, M., Bellone, M., Longo, F., Redi, C. A., Garagna, S. Fully-mature antral mouse oocytes are transcriptionally silent but their heterochromatin maintains a transcriptional permissive histone acetylation profile. Journal of Assisted Reproduction and Genetics. 28 (12), 1193-1196 (2011).
- Winship, A. L., Stringer, J. M., Liew, S. H., Hutt, K. J. The importance of DNA repair for maintaining oocyte quality in response to anti-cancer treatments, environmental toxins and maternal ageing. Human Reproduction Update. 24 (2), 119-134 (2018).
- Lieber, M. R. The mechanism of human nonhomologous DNA end joining. The Journal of Biological Chemistry. 283 (1), 1-5 (2008).
- Chiruvella, K. K., Liang, Z., Wilson, T. E. Repair of double-strand breaks by end joining. Cold Spring Harbor Perspectives in Biology. 5 (5), 012757(2013).
- Chang, H. H. Y., Pannunzio, N. R., Adachi, N., Lieber, M. R. Non-homologous DNA end joining and alternative pathways to double-strand break repair. Nature Reviews. Molecular Cell Biology. 18 (8), 495-506 (2017).
- Shibata, A., Jeggo, P. A. Roles for the DNA-PK complex and 53BP1 in protecting ends from resection during DNA double-strand break repair. Journal of Radiation Research. 61 (5), 718-726 (2020).
- Mohiuddin, I. S., Kang, M. H. DNA-PK as an emerging therapeutic target in cancer. Frontiers in Oncology. 9, 635(2019).
- Marangos, P., Carroll, J. Oocytes progress beyond prophase in the presence of DNA damage. Current Biology. 22 (11), 989-994 (2012).
- Paull, T. T., et al. A critical role for histone H2AX in recruitment of repair factors to nuclear foci after DNA damage. Current Biology. 10 (15), 886-895 (2000).
- Bakkenist, C. J., Kastan, M. B. DNA damage activates ATM through intermolecular autophosphorylation and dimer dissociation. Nature. 421 (6922), 499-506 (2003).
- Marangos, P., et al. DNA damage-induced metaphase I arrest is mediated by the spindle assembly checkpoint and maternal age. Nature Communications. 6, 8706(2015).
- Lavrentyeva, E. A., Shishova, K. V., Zatsepina, O. V. Differences in nuclear dynamics in mouse GV oocytes with a diverse chromatin configuration. Biology Bulletin Russian Academy of Sciences. 46, 332-341 (2019).
- Montecucco, A., Zanetta, F., Biamonti, G. Molecular mechanisms of etoposide. EXCLI Journal. 14, 95-108 (1998).
- Mayer, A., et al. DNA damage response during mouse oocyte maturation. Cell Cycle. 15 (4), 546-558 (2016).
- Olive, P., Banáth, J. The comet assay: A method to measure DNA damage in individual cells. Nature Protocols. 1, 23-29 (2006).
- Wu, D., Dean, J. EXOSC10 sculpts the transcriptome during the growth-to-maturation transition in mouse oocytes. Nucleic Acids Research. 48 (10), 5349-5365 (2020).
- Simon, L., Emery, B., Carrell, D. DNA damage: COMET assay. Manual of Sperm Function Testing in Human Assisted Reproduction. Agarwal, A., Henkel, R., Majzoub, A. , 202-212 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved