Method Article
Fare Oositlerinde DNA Çift Sarmallı Kırılmaların Tespiti
Bu Makalede
Özet
Oosit genom bütünlüğünün korunması, elde edilen embriyoda genetik sadakati sağlamak için gereklidir. Burada, memeli dişi üreme hücrelerinde DNA çift sarmallı kırılmaları tespit etmek için doğru bir protokol sunuyoruz.
Özet
Oositler kadın vücudundaki en büyük ve en uzun ömürlü hücreler arasındadır. Embriyonik gelişim sırasında yumurtalıklarda oluşurlar ve mayoz I'in profazında tutuklanırlar. Hareketsiz durum, oositler büyümek için bir uyaran alana ve mayoza devam etme yetkinliğini elde edene kadar yıllarca sürebilir. Bu uzun süreli tutuklama durumu, onları dişi gametlerin genetik bütünlüğünü ve dolayısıyla gelecekteki embriyonun genetik bütünlüğünü etkileyen DNA'ya zarar veren hakaretlerin birikmesine karşı son derece duyarlı hale getirir.
Sonuç olarak, DNA hasar yanıt mekanizmalarının kurulması için ilk adım olan DNA hasarını tespit etmek için doğru bir yöntemin geliştirilmesi hayati önem taşımaktadır. Bu makale, 20 saatlik bir süre boyunca faz tutuklu oositlerde DNA hasarının varlığını ve ilerlemesini test etmek için ortak bir protokolü açıklamaktadır. Spesifik olarak, fare yumurtalıklarını inceliyoruz, kümülüs-oosit komplekslerini (COC'ler) alıyoruz, kümülüs hücrelerini COC'lerden çıkarıyoruz ve tutuklama durumunu korumak için oositleri 3-izobütil-1-metilksantin içeren Μ2 ortamında kültürlüyoruz. Daha sonra, oositler, çift iplikçik kırılmaları (DSB'ler) oluşturmak için sitotoksik, antineoplazmik ilaç, etoposid ile muamele edilir.
İmmünofloresan ve konfokal mikroskopi kullanarak, histon H2AX'in fosforile formu olan çekirdek protein γH2AX'in seviyelerini tespit ediyor ve ölçüyoruz. H2AX, DNA hasarından sonra DSB'lerin bölgelerinde fosforile olur. Oositlerdeki DNA hasarını takiben DNA bütünlüğünün geri kazanılamaması kısırlığa, doğum kusurlarına ve spontan düşük oranlarının artmasına neden olabilir. Bu nedenle, DNA hasar tepki mekanizmalarının anlaşılması ve aynı zamanda bu mekanizmaları incelemek için sağlam bir yöntemin oluşturulması, üreme biyolojisi araştırmaları için esastır.
Giriş
Memeli dişi üreme hücrelerinde mayoz bölünme süreci, doğumdan önce yumurtalıklarda başlatılır. Toplam oosit sayısı, öncelikle embriyogenez sırasında yumurtalıklarda belirlenir. Oositler mayoz bölünmeye girer ve faz I1'de tutuklanır. Ergenliğin başlamasından ve folikül uyarıcı hormon (FSH) ve luteinize edici hormonun (LH) üretimi ve endokrin etkisinden sonra, oositler mayozbölünmeyi yeniden başlatabilir ve tamamlayabilir 2. İnsanlarda faz tutuklaması 50 yıla kadar sürebilir3. Mayoz I'e girişi takip eden hücre bölünmeleri asimetriktir, bu da küçük bir kutup gövdesi ve boyutunu koruyan bir oosit üretimi ile sonuçlanır. Bu nedenle, çoğu sitoplazmik bileşen, erken embriyogenez sırasında ooplazmada depolanır4. Daha sonra, oositler çekirdeklerini yeniden oluşturmadan veya kromozomlarını yoğunlaştırmadan mayoz II'ye girerler ve döllenme5'e kadar metafaz II'de durmaya devam ederler.
Oositleri somatik hücrelerden ayıran benzersiz bir özellik, oositin GV evre6 olarak adlandırılan sağlam bir çekirdeğe (germinal vezikül [GV] tutuklaması) sahip olduğu faz I'deki durma durumudur. Kromatin organizasyonuna dayanarak, GV evresi oositleri iki kategoriye ayrılır: çevrelenmemiş nükleolus (NSN) ve çevrili nükleolus (SN)7,8. NSN GV evresi oositlerinde, kromatin tüm nükleer bölge boyunca yayılır ve transkripsiyon aktiftir, SN oositlerinde kromatin nükleozu çevreleyen kompakt bir halka oluşturur ve transkripsiyon sessizdir9. Her iki GV evresi oosit türü de mayotik yeterlilik gösterir; mayoza aynı oranda girerler, ancak NSN oositleri düşük gelişim kapasitesi sunar ve iki hücreli evre embriyo10'un ötesine geçemez.
Profaz I tutuklamasının uzamış durumu, DNA hasarı birikimi insidansını arttırır11. Bu nedenle, oositlerdeki DNA hasar yanıt mekanizmaları, genetik bütünlüğe sahip gametlerin üretimine izin vermek ve elde edilen embriyonun fizyolojik bir kromozomal içeriğe sahip olmasını sağlamak için gereklidir.
DNA hasar tepkisinin merkezi bir yönü DNA onarımıdır. Ökaryotik hücrelerde DSB onarımı için ana yollar arasında homolog olmayan uç birleştirme (NHEJ), homolog rekombinasyon (HR) ve alternatif NHEJ12,13,14,15 bulunur. NHEJ daha hızlı ancak hataya daha açık bir mekanizmadır, İK ise tamamlanması için daha fazla zaman gerektirir ancak yüksek sadakate sahiptir16.
Oositlerin DNA hasarı onarımı için kullandıkları mekanizmalar hakkında yeterli bilgi yoktur. Çalışmalar, tam büyümüş memeli oositlerinde etoposit, doksorubisin veya UVB veya iyonlaştırıcı radyasyon gibi genotoksik ajanların kullanımıyla indüklenen DNA hasarının, faz I tutuklamasından çıkış zamanlamasını ve oranlarını etkilemediğini göstermiştir17. Oositler, yüksek hasar seviyelerinin varlığında bile GV yıkımına (GVBD) uğrayabilir. Bu hasar, γH2AX'in gözlemlenmesiyle belirlenebilir. H2AX'in (γΗ2ΑΧ) bu fosforile formu, kırılma bölgesinde bulunan ve kırık uçlarda birikecek faktörlerin ve proteinlerin onarılmasına yardımcı olmak için bir iskele işlevi gören bir DSB belirtecidir18.
DNA hasarını takiben hücre döngüsü durmasının olmaması, onarılmamış DNA'ya sahip oositlerin mayoz bölünmeye yeniden girmesine izin veren yetersiz DNA hasarı kontrol noktasından kaynaklanmaktadır. Yüksek düzeyde DNA hasarını takiben, bir kontrol noktası, ATM / Chk1'e bağlı bir yolun aktivasyonu yoluyla faz durmasını koruyabilir. DSB'lere sınırlı kontrol noktası yanıtı, ATM17,19'un sınırlı aktivasyonundan kaynaklanmaktadır. Mayoz I'in M fazında, araştırmalar, DNA hasarının, E3 ubikitin ligaz anafaz teşvik edici kompleks/siklozomun aktivasyonunu önleyen bir iğ montaj kontrol noktasını (SAC) indüklenen mayoz I kontrol noktasını aktive edebileceğini göstermiştir (APC/C) ve dolayısıyla M-fazı çıkışı. Ayrıca, SAC proteinlerinin ablasyonu, M-fazı durması durumunun üstesinden gelir, böylece mayoz I kontrol noktası20'nin kurulmasında SAC'nin öneminin altını çizer.
Önceki araştırmaların açıkça gösterdiği gibi, DSB'ler fare oositlerinde sağlam bir profaz kontrol noktası oluşturamaz. Bu tür bir hasar onarılmazsa, kromozomal anormallikler taşıyan embriyolara yol açabilir. Bu nedenle, oositlerin potansiyel genetik hakaretlerle başa çıkmak için kullandıkları benzersiz yolları daha iyi anlamak için kadın gametogenezinin farklı aşamalarında DNA hasar tepkisini incelemek önemlidir.
Protokol
Tüm fare deneyleri yerel makamlar (Yanya Bölgesi, Yunanistan) tarafından onaylanmış ve 2010/63/EU sayılı Avrupa Toplulukları Konseyi Direktiflerine uygun olarak yürütülmüştür. Deneyler 3R'nin ilkelerine göre yapılmıştır. Deneyler için kullanılan tüm CD-1 fareleri, Yunanistan'daki Yanya Üniversitesi'nin hayvan barınağı tesisinde, kontrollü sıcaklık (22 °C) ve nem (%60) olan bir odada tutuldu ve ad libitum ile beslendi. Hayvan barınağı, üreme (EL33-BIObr01), tedarik (EL33-BIOsup01) ve deneyler (EL33BIO-exp01) için bir tesis işletme lisansına sahiptir.
1. Reaktiflerin hazırlanması
- 3-izobütil-1-metilksantin (IBMX) tozunu (Malzeme Tablosuna bakınız) dimetil sülfoksit (DMSO) içinde seyreltin ( Malzeme Tablosuna bakınız) 200 mM'lik bir nihai konsantrasyona kadar. 10 μL alikot ekleyin ve −20 °C'de saklayın. Çözümü 1 ay içinde kullanın.
NOT: IBMX tozu −20 °C'de tutulur. - Tüm immünofloresan tamponları hazırlayın ve 4 °C'de saklayın.
- Bir PBS tabletini (Malzeme Tablosuna bakınız) 200 mL ddH2Ο içinde seyrelterek steril fosfat tamponlu salin (PBS) hazırlayın.
- 80 mL ddH 2 Ο, 0.59575 g HEPES, 1.81422 g PIPES, 0.38035 g EGTA ve 0.04066 g MgCl2ekleyerek PHEM tamponu yapın (Malzeme Tablosuna bakın) manyetik bir karıştırıcı ile çalkalarken (Malzeme Tablosuna bakın) ve aynı anda pH 6.9'a ulaşana kadar NaOH ekleyin (Malzeme Tablosuna bakın) (pH / ORP ölçer kullanarak kontrol edin [Malzeme Tablosuna bakın]). Ardından, 100 mL'lik bir son hacme ddH2Ο ekleyin.
- %4 PFA'lık bir son konsantrasyonda ısıtma altında manyetik bir karıştırıcı ile çalkalarken PFA tozunu (Malzeme Tablosuna bakın) PHEM tamponunda seyrelterek paraformaldehit-Triton-X-100 (PFA-Tx-100) tamponu hazırlayın. Ardından, bir şırınga ve 0,2 μm'lik bir filtre kullanarak tamponu süzün (Malzeme Tablosuna bakın) ve %0,5 Tx-100 ekleyin (Malzeme Tablosuna bakın). Bir deney için yeterli olan yaklaşık 10 mL PFA-Tx-100 (0.4 g PFA, 50 μL Tx-100) hazırlayın. 4 °C'de en fazla 1 hafta saklayınız.
DİKKAT: PFA'yı kullanmak için eldiven giyin ve cilt ve gözlerle temasından kaçının. - PBS'de sığır serum albümini (nihai konsantrasyon:% 0.5 w / v BSA) ekleyerek yıkama tamponu hazırlayın (Malzeme Tablosuna bakınız) ve mekanik olarak çalkalayın. Mantar ve bakteriyel kontaminasyon riskini en aza indirmek için 1:1.000 seyreltmede %10 w/v NaN3 tamponu (sodyum azid) ekleyin. 10 mL ddH2O'ya 1 g NaN 3 tozu (Malzeme Tablosuna bakınız) ekleyerek% 10 w / vNaN 3 tamponu yapın; NaN3 tamponunu oda sıcaklığında saklayın.
- PBS'ye BSA (son konsantrasyon: %3 w/h) ekleyerek ve mekanik olarak çalkalayarak bloke edici tampon hazırlayın. 1:1.000 seyreltmede %10 NaN3 tamponu ekleyin.
2. Diseke yumurtalıklardan GV oositlerinin toplanması ve DSB'lerin indüksiyonu
NOT: Tüm aletler ve solüsyonlar steril olmalıdır. Oosit kullanımı, stereo mikroskop altında bir ağız pipeti kullanılarak gerçekleştirilir (bkz. Malzeme Tablosu) ve tüm damlalar mineral yağ ile kaplanır (bkz. Malzeme Tablosu ve Şekil 1E).
- Fareleri servikal çıkık ile itlaf etmeden 46-48 saat önce 7 uluslararası birim (IU) hamile kısrak serum gonadotropin (PMSG) (Malzeme Tablosuna bakınız) ile farelere intraperitoneal olarak enjekte edin.
NOT: Kullanılan tüm fareler 8-12 haftalık olmalıdır. - M2 kültür ortamını bir şırınga ve 0.2 μm'lik bir filtre ile filtreleyin ve oositleri faz I'de tutmak için 14 mL'lik yuvarlak tabanlı bir tüpte (Malzeme Tablosuna bakınız) 200 μM'lik bir nihai konsantrasyona IBMX 200 mM ekleyin. Daha sonra, plastik bir doku kültürü kabında M2-IBMX besiyeri damlaları hazırlayın (Malzeme Tablosuna bakın) ve oosit izolasyonundan önce en az 30 dakika boyunca 37 ° C'de sıcak bir blok üzerine yerleştirin (Malzeme Tablosuna bakın). M2'yi 4 °C'de saklayın.
- Fareleri servikal çıkık ile feda edin, yumurtalıkları inceleyin ve M2-IBMX ile 5 mL'lik yuvarlak tabanlı bir tüpe ( Malzeme Tablosuna bakınız) yerleştirin.
- Yumurtalıkları 1.5 mL M2-IBMX içeren plastik bir kapağa aktarın, peri-yumurtalık yağ dokusunu veya fallop tüpü segmentlerini çıkarın ve 27 G'lik bir iğne ile yumurtalıkların mekanik perforasyonu ile COC'leri serbest bırakın (bkz. Malzeme Tablosu ve Şekil 1A-C).
- COC'leri M2-IBMX damlaları (her biri yaklaşık 25-30 μL) içeren bir kültür kabına aktarın ve dar delikli bir cam Pasteur pipeti kullanarak tekrarlanan pipetleme yoluyla kümülüs hücrelerini çıkarın (bkz. Malzeme Tablosu ve Şekil 1D).
- SN GV aşamalı oositleri seçin ve bunları ışıktan korunan 37 ° C'de sıcak bir blok üzerinde bir damla (25 μL) M2-IBMX ortamına aktarın (Şekil 1F).
- Çekirdeklerin periferik olarak konumlandırıldığı NSN oositlerinin aksine, daha büyük boyutlarına ve merkezi olarak yerleştirilmiş çekirdeklerine göre SN oositlerini arayın21. Her durumda, GV oosit tipi (SN veya NSN) hakkında nihai kararı vermeden önce DNA konfigürasyonunu konfokal mikroskop altında gözlemleyin.
- Etoposid kullanarak DSB'leri indükleyin ( Malzeme Tablosuna bakın). GV aşamalı oositleri, karanlık koşullarda 37 ° C'de sıcak blok üzerinde 1 saat boyunca genotoksik ajanın damlalarına (her biri 25 μL) yerleştirin.
NOT: Etoposit, DSB'leri DNA22'ye tanıtan bir topoizomeraz II inhibitörüdür. Etoposidi oda sıcaklığında 20 mg / mL'lik 10 μL'lik alikotlarda ışıktan koruyun. Test edilen konsantrasyonlar 5 μg/mL, 20 μg/mL ve 50 μg/mL'dir. - GV evresi oositlerini uzun süre tutuklu tutmak için, oositleri 37 ° C ve% 5 CO2'de bir inkübatörde (Malzeme Tablosuna bakınız) 400 μM IBMX ile desteklenmiş M16 kültür ortamının damlalarına (Malzeme Tablosuna bakınız) yerleştirin. M16'yı 4 °C'de saklayın, ortamı bir şırınga ve 0.2 μm filtre ile filtreleyin ve kullanmadan önce en az 1 saat inkübe edin.
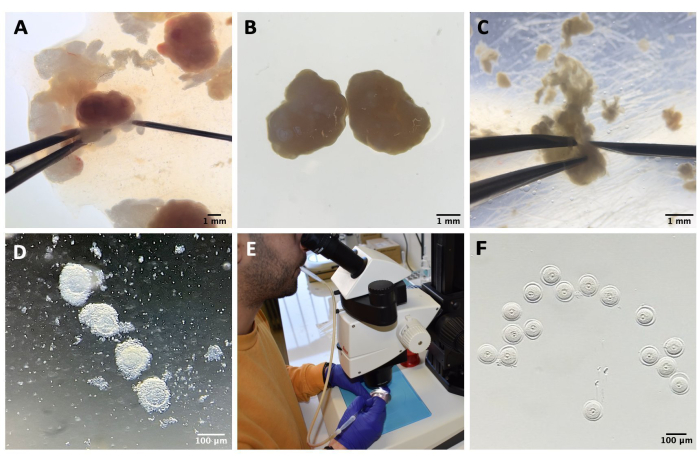
Şekil 1: Oosit izolasyon işlemi . (A) Peri-overian yağ dokusunun ve artık fallop tüpü segmentlerinin M2 besiyerinde yumurtalıklardan IBMX ile çıkarılması. Stereo mikroskop göz mercekleri ile elde edilen fotoğraf. Ölçek çubuğu = 1 mm. (B) IBMX ile M2 ortamında izole yumurtalıklar. Stereo mikroskop göz mercekleri ile elde edilen görüntü. Ölçek çubuğu = 1 mm. (C) IBMX ile M2 ortamında 27 G iğne kullanılarak yumurtalıkların mekanik delinmesi. Stereo mikroskop göz mercekleri ile elde edilen görüntü. Ölçek çubuğu = 1 mm. (D) IBMX ile M2 ortamında perforasyon sonrası yumurtalıklardan salınan COC'ler. Stereo mikroskop göz mercekleri ile elde edilen görüntü. Ölçek çubuğu = 100 μm. (E) Ağız pipeti kullanılarak oosit toplama. (F) Çevredeki kümülüs hücrelerinin çıkarılmasından sonra, IBMX ile M2 ortamında denuded oositler. Stereo mikroskop göz mercekleri ile elde edilen görüntü. Ölçek çubuğu = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Oosit fiksasyonu ve immünofloresan
NOT: Oosit kullanımı, stereo mikroskop altında bir ağız pipeti kullanılarak gerçekleştirilir ve tüm damlalar mineral yağ ile kaplanır.
- Kontrol ve etoposid ile muamele edilmiş GV oositlerini oda sıcaklığında 40 dakika boyunca PFA-Tx-100 tamponlu farklı plastik doku kültürü kaplarına yerleştirin.
- Oositleri oda sıcaklığında üç farklı damla yıkama tamponunda (her biri 50 μL) yıkayın. Yumurtaları her damlada 5 dakika bekletin.
- Oositleri, 37 ° C'de sıcak bir blok üzerinde 1 saat boyunca bloke edici tampon damlalarına (her biri 25 μL) yerleştirin.
- γH2AX'i (tavşan fosfo-Η2ΑΧ) (Ser139) tanıyan birincil antikoru hazırlayın ( Malzeme Tablosuna bakınız) (stok çözelti: 1 mg / mL). Bloke edici tamponda 1:200 seyreltme kullanın ve oositleri gece boyunca 4 ° C'de birincil antikor damlalarına (her biri 15 μL) yerleştirin.
NOT: Fosfo-Η2ΑΧ (γH2AX), hem somatik hücrelerde hem de GV oositlerinde DSB'leri tespit etmek için yaygın bir belirteçtir18,23. - Ertesi gün, yumurtaları oda sıcaklığında üç farklı damla yıkama tamponunda (her biri 50 μL) yıkayın. Yumurtaları her damlada 5 dakika bekletin.
- İkincil antikoru, Alexa Fluor 488-konjuge keçi anti-tavşanını hazırlayın ( Malzeme Tablosuna bakınız) (stok çözelti: 2 mg / mL). Bloke edici tamponda 1:200 seyreltme kullanın ve oositleri 37 ° C'de ışıktan korunan sıcak bir blok üzerinde 1 saat boyunca ikincil antikor damlalarına (her biri 15 μL) yerleştirin.
- Oositleri, yalnızca geçirgen hücrelerde DNA'yı boyayan çok kırmızı bir floresan DNA boyası olan DRAQ7 damlalarına (her biri 25 μL) aktarın (stok çözelti: 0.3 mM; Malzeme Tablosuna bakınız). Karanlık koşullarda oda sıcaklığında 10 dakika boyunca yıkama tamponunda 1:250 seyreltme kullanın.
- Oositleri oda sıcaklığında üç farklı damla yıkama tamponunda (her biri 50 μL) yıkayın. Her damlada 5 dakika bekletin ve ardından konfokal mikroskopi için 35 mm'lik cam tabanlı bir Petri kabında (Malzeme Tablosuna bakınız) küçük damlalara (her biri yaklaşık 5 μL) yıkama tamponuna aktarın (Şekil 2A).
NOT: Hem DNA boyasının hem de ikincil antikorun yıkanması aynı anda gerçekleştirilir.
4. Konfokal mikroskopi
NOT: Oositlerin cam tabanlı tabaklara yerleştirilmesinden sonra floresan yoğunluğundaki azalmayı önlemek için hemen konfokal mikroskopi yapılmalıdır. Motorlu bir aşamaya sahip bir konfokal mikroskoba ( Malzeme Tablosuna bakınız) erişim gereklidir.
- Mikroskop kurulumu
- Konfokal sistemde, lazer denetleyiciyi, lazerleri, mikroskop denetleyiciyi, iletilen ışık için lambaları ve PC'yi açın (Şekil 2B, D).
- Konfokal yazılımı açın ve 40x yağ lensini seçin.
- Çanağı numune tutucuya yerleştirin ve joystick'i kullanarak sahneyi XY ve Z eksenlerinde hareket ettirerek oositlere odaklanmaya çalışın (Şekil 2C).
- Oositlerin taranması
- Herhangi bir doygunluğu en aza indirmek için lazer gücünü, kazancı ve iğne deliği boyutunu her deney için bağımsız olarak ayarlayın.
- Her oosit için, ilgilenilen alanı, özellikle DNA bölgesindeki çekirdeğe ayarlayın. DNA alanının sınırlarını tanımlayın ve z adım boyutunu 3 μm olarak ayarlayın. Ardından, taramayı başlatın.
- Seçili klasördeki her hücre için görüntüleri kaydedin.
- Tarama tamamlandığında, yazılımdan çıkın, bilgisayarı kapatın ve lazer denetleyicisini, lazerleri, mikroskop denetleyicisini ve iletilen ışık için lambaları kapatın.
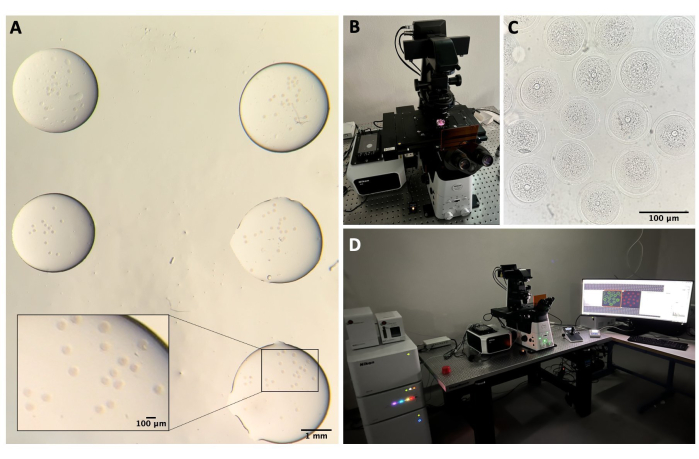
Şekil 2: Konfokal mikroskopi. (A) İmmünofloresan protokolü ve DNA boyaması yapıldıktan sonra, ayrı damla yıkama tamponunda, mineral yağ ile kaplanmış, cam tabanlı bir tabağa yerleştirilmiş ve konfokal mikroskopi görüntüleme için hazırlanmış sabit oositler. Her damla farklı bir deney kategorisi içerir. Stereo mikroskop göz mercekleri ile elde edilen görüntü. Ölçek çubuğu = yakınlaştırılmış kısım için 1 mm/100 μm. (B) Konfokal mikroskop tablasına yerleştirilmiş cam tabanlı plaka. (C) Konfokal mikroskopi ile elde edilen oositlerin parlak alan görüntüsü. Ölçek çubuğu = 100 μm. (D) Konfokal mikroskopi sistemi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. Görüntüleme analizi
- Fiji ImageJ-win64'ü tarayıcıya (https://imagej.net/software/fiji/downloads) indirin, açın ve verileri TIFF yığın dosyaları olarak içe aktarın.
NOT: Her oosit dosyasını ayrı ayrı açın. - Resmin üzerine tıklayın | Renk | Tüm kanalları bölmek için Kanalları Böl.
- LUT'a (Tabloya Bak) tıklayın ve her kanal için tercih edilen renkleri seçin.
- Resmin üzerine tıklayın | Renk | γΗ2ΑΧ ve DNA kanallarını birleştirmek için Kanalları Birleştir. Brightfield kanalını birleştirmeden bırakın.
- NSN oositlerinde ve düşük DNA hasarı olan SN oositlerinde, γΗ2ΑΧ DNA bölgesinde odaklar olarak tespit edilir. Bu durumda, " Çok noktalı" veya nokta komutuna tıklayın ve DNA ile çakışan her γΗ2ΑΧ odağını seçin. Tüm yığınlar için bu adımı yineleyin.
- Yüksek düzeyde DNA hasarı olan SN oositlerinde, γΗ2ΑΧ sinyali tüm DNA bölgesi boyunca dağılır. Bu durumda, üzerine tıklayın Resim | Yığınlar | Z projesini seçin ve Freehand seçimleri komutuyla tüm DNA alanını seçin.
- γΗ2ΑΧ floresansını ölçmek için Analiz Et | Ölçün ve ölçümleri bir .xlsx dosyasına kopyalayın. Ardından, ortalama floresansı hesaplayın, değerleri normalleştirin ve herhangi bir grafik oluşturmadan önce odak sayısını sayın.
- Analiz Et'e tıklayın | Ölçeği ayarlamak için Ölçeği Ayarla ve ardından Analiz | Araçlar | Kanallara ölçek çubuğu eklemek için Ölçek çubuğu.
Sonuçlar
Burada gösterilen prosedür kullanılarak, fare yumurtalıkları diseke edildi, yağ çıkarıldı ve tamamen büyümüş GV evresi oositler toplandı. Daha sonra, kümülüs hücreleri dar bir pipet kullanılarak tekrarlayan pipetleme ile çıkarıldı ve taze M2-IBMX besiyeri damlalarına yerleştirildi ve sıcak bir blok (37 °C) üzerinde mineral yağ ile kaplandı (Şekil 1A-F). 20 mg/mL'lik bir stok etoposid konsantrasyonu kullanılarak üç farklı etoposid konsantrasyonu (5 μg/mL, 20 μg/mL ve 50 μg/mL) hazırlandı. GV evresi oositleri, mineral yağ ile kaplanmış ve 37 ° C'de ışıktan korunan damlalar halinde 1 saat boyunca üç farklı etoposid konsantrasyonuna yerleştirildi. Daha sonra protokol bölümünde ayrıntılı olarak anlatıldığı gibi immünofloresan protokolü izlendi ve oositler cam tabanlı tabaklara yerleştirildi ve konfokal mikroskopi ile gözlendi (Şekil 2).
SN GV evresi oositlerinde, DNA hasarından hemen sonra, γH2AX varlığı tüm etoposid konsantrasyonlarında (5 μg / mL, 20 μg / mL ve 50 μg / mL) arttı ve γH2AX tüm DNA bölgesi boyunca dağıldı (Şekil 3). DSB miktar tayini ve tahmini, DNA bölgelerinde γH2AX floresan yoğunluğu gözlemlenerek gerçekleştirildi. γH2AX floresansı, artan etoposid konsantrasyonları ile orantılı olarak yoğunlaştı. Ayrıca, uzun süreli faz durmasından sonra (etoposid tedavisinden 20 saat sonra), GV evresi oositleri, γH2AX odaklarının sayısını ve yoğunluğunu azaltma kapasitesini gösterdi, bu da GV evresinde tutuklanan oositlerde aktif onarım süreçlerinin varlığını ima etti (Şekil 3E).
γH2AX floresansının DNA yoluyla dağıtıldığı SN oositlerinin aksine, NSN oositlerinde, γH2AX, 20 μg / mL'de etoposid ile tedaviden hemen sonra odaklarda gösterilmiştir. DNA alanıyla çakışan odakların sayısını tahmin ettik, her odağın floresansını hesapladık ve tüm oositlerin ortalama floresansını sunduk. Hem floresan hem de odak sayısı, iki oosit kategorisi arasında istatistiksel olarak anlamlı farklılıklar gösterdi (Şekil 4).
Konfokal mikroskopi, farklı Z yığınlarındaki odakların sayısı ve yoğunluğu hakkında bilgi sağlar, böylece farklı zaman noktalarında DNA hasarının varlığını ve onarım dinamiklerini belirlemeye yardımcı olur. Galvano tarama, düşük arka plan ile hassas tarama ve tarama görüntülerinin daha iyi analiz edilmesini sağlar.
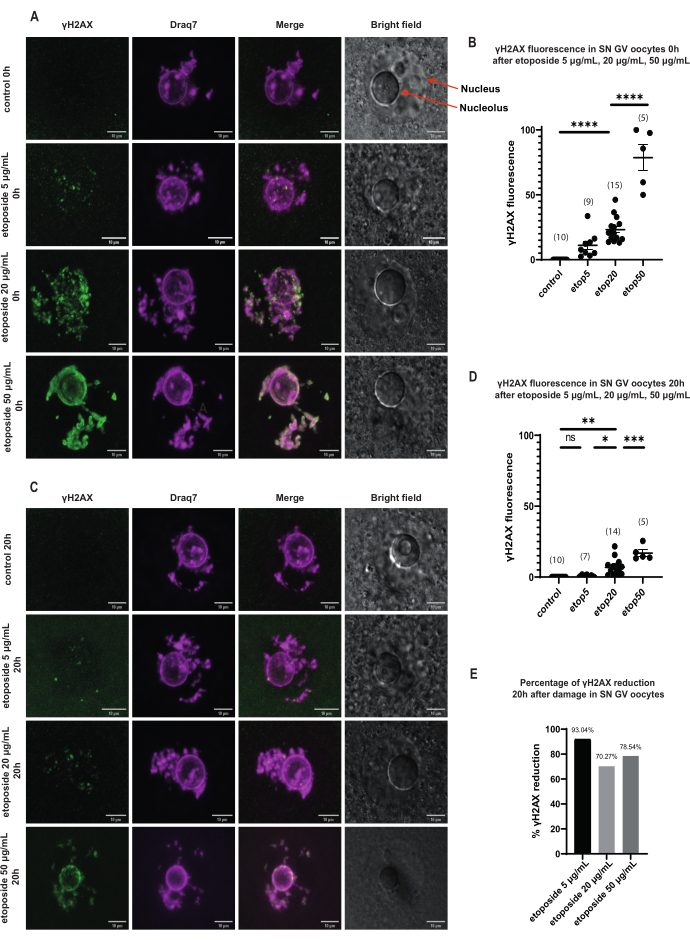
Şekil 3: Uzun süreli GV tutuklamasından sonra üç farklı etoposid konsantrasyonu ile tedavi edilen SN GV evresi oositlerinde γH2AX'in azaltılması. (A) etoposid tedavisinden 0 saat sonra SN GV evresi oositlerinde γH2AX floresansı. γH2AX, tüm etoposid konsantrasyonlarında maruziyetten hemen sonra artar ve artış konsantrasyona bağlıdır (yeşil: γΗ2ΑΧ, macenta: DNA). Görüntüler Z-yığını projeksiyonlarıdır ve parlaklık/kontrast Fiji / ImageJ kullanılarak her kanal için ayarlanmıştır. Ölçek çubuğu = 10 μm. (B) Farklı etoposid konsantrasyonları ile tedaviden 0 saat sonra SN GV evresi oositlerinde γH2AX floresan grafiği. Veriler ortalama ± SEM'i temsil eder. Her nokta bir oositi temsil eder (oosit sayısı grafikte gösterilmiştir), (ns = anlamlı değil, ** p < 0.005, **** p < 0.0001, Tukey'in çoklu karşılaştırma testi ile tek yönlü ANOVA). (C) etoposid tedavisinden 20 saat sonra SN GV evresi oositlerde γH2AX floresansı. γH2AX, tüm etoposid konsantrasyonlarında maruz kaldıktan 20 saat sonra azalır (yeşil: γΗ2ΑΧ, macenta: DNA). Görüntüler Z-yığını projeksiyonlarıdır ve parlaklık/kontrast Fiji/ImageJ kullanılarak her kanal için ayarlanmıştır. Ölçek çubuğu = 10 μm. (D) Farklı etoposid konsantrasyonları ile tedaviden 20 saat sonra SN GV evresi oositlerinde γH2AX floresan grafiği. Veriler ortalama ± SEM'i temsil eder. Her nokta bir oositi temsil eder (oosit sayısı grafikte gösterilmiştir), (ns = anlamlı değil, * p < 0.05, ** p < 0.005, *** p < 0.0005, **** p < 0.0001, Tukey'in çoklu karşılaştırma testi ile tek yönlü ANOVA). (E) Etoposid ile tedavi edilen oositlerde profaz durmasından sonra SN GV evresi oositlerinde γH2AX floresan azalmasının çubuk grafiği. Her sütunun üzerindeki sayı, γH2AX floresansındaki düşüş yüzdesini gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
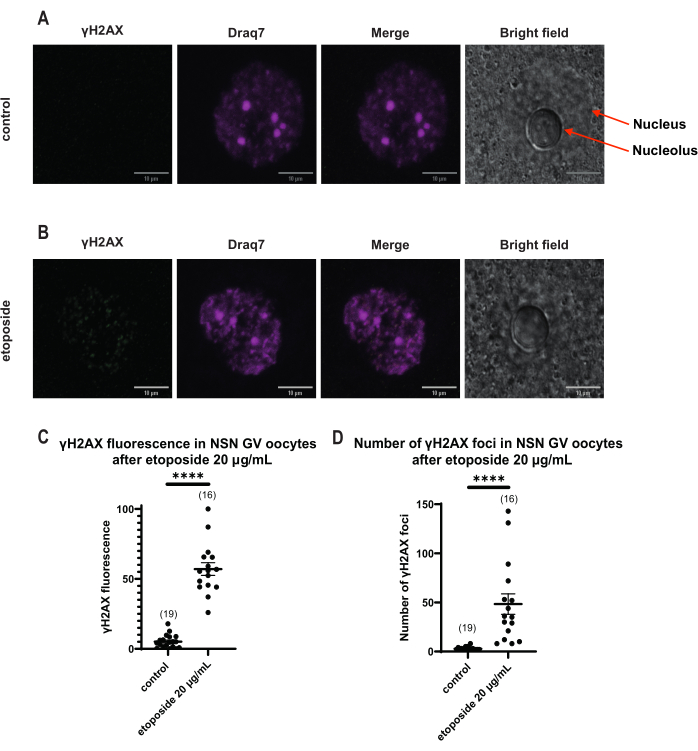
Şekil 4: 20 μg/mL'de etoposid ile tedaviden sonra NSN GV evresi oositlerinde Η2ΑΧ'nin fosforilasyonu. (A) Bir kontrol NSN GV aşaması oositinin temsili konfokal görüntüleri (yeşil: γΗ2ΑΧ, macenta: DNA). Görüntüler Z-yığını projeksiyonlarıdır ve parlaklık/kontrast Fiji/ImageJ kullanılarak her kanal için ayarlanmıştır. Ölçek çubuğu = 10 μm. (B) Etoposid ile tedavi edilmiş bir NSN GV aşaması oositinin temsili konfokal görüntüleri (yeşil: γΗ2ΑΧ, macenta: DNA). Oositler etoposid tedavisinden 0 saat sonra tespit edildi. Görüntüler Z-yığını projeksiyonlarıdır ve Fiji/ImageJ kullanılarak her kanal için parlaklık/kontrast ayarlanmıştır. Ölçek çubuğu = 10 μm. (C) 20 μg / mL etoposid tedavisinden sonra NSN GV evresi oositlerinde normalleştirilmiş γΗ2ΑΧ floresansı. Veriler ortalama ± SEM'i temsil eder. Her nokta, iki bağımsız deneyden (**** p < 0.0001, eşlenmemiş parametrik olmayan t-testi, Mann-Whitney U-testi) alınan bir oositi temsil eder (oosit sayısı grafikte gösterilmiştir). (D) 20 μg / mL etoposid tedavisinden sonra NSN GV evresi oositlerinde γΗ2ΑΧ odaklarının sayısı. Veriler ortalama ± SEM'i temsil eder. Her nokta, iki bağımsız deneyden (**** p < 0.0001, eşleştirilmemiş parametrik olmayan t-testi, Mann-Whitney U-testi) alınan bir oositi temsil eder (oosit sayısı grafikte gösterilmiştir). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada açıklanan yöntemi kullanarak, memeli oositlerinde DSB'leri tespit ettik. Bu yöntem, oositlerdeki DNA onarım sürecinin saptanmasına ve incelenmesine izin verir. Aynı protokol, memeli oositlerinde fizyolojik süreçlere katılan diğer proteinleri analiz etmek için de kullanılabilir. İnsanlarda kadın subfertilitesinin nedenini daha iyi anlamak için oositlerin potansiyel DNA hasarına nasıl tepki verdiğini incelemek önemlidir.
Memeli oositlerinde DNA hasar tepkisini incelemek, oositlerin duyarlılığı nedeniyle zor olabilir. Oosit kullanımı, belirli sıcaklıklar ve CO2 ve O2 konsantrasyonları gerektirir. Aynı zamanda yumurtalar ışıktan korunmalıdır. Αll kullanımı, oositler için zararlı olabileceğinden, aynı zamanda ortamın seyrelmesine neden olabileceğinden ve dolayısıyla fiksasyon prosedürünü olumsuz etkileyebileceğinden, dar olmayan cam pipetler kullanılarak yapılmalıdır. Fiksasyonun her adımında, seyreltme etkisini en aza indirmek için birkaç damla tampon kullanılır. DSB'leri gözlemlemenin alternatif bir yolu Comet testi24'tür. Bu teknik daha hassas olmasına rağmen daha karmaşıktır. Aynı zamanda, Comet tahlilini kullanarak, hasarın meydana geldiği DNA bölgesini tam olarak tespit etmek mümkün değildir ve GV evresi oositler25 gibi bol miktarda RNA molekülüne sahip hücrelerde, arka plan arttırılabilir ve bu da yanlış bir DNA hasar sinyalineyol açabilir 26.
Burada açıklanan immünofloresan protokolünü kullanarak, DSB'leri doğru bir şekilde tespit edebilir ve zaman içinde γH2AX floresansındaki azalma ile gösterildiği gibi GV evresi oositlerdeki onarım ilerlemesini tahmin edebiliriz. Bununla birlikte, bu yöntemin bir sınırlaması, bazı antikorların ooplazma boyunca spesifik olmayan dağılım gösterebilmesi ve böylece yüksek arka plan floresansına sahip görüntülere yol açabilmesidir. PFA-Tx-100 tamponu, daha az arka plan ve spesifik olmayan floresan tespitine izin vererek fiksasyon sürecini iyileştirdiğini gözlemlediğimiz için sıralı PFA ve Tx-100 yerine kullanılır. DSB tespiti için γH2AX kullanmanın ikinci bir sınırlaması, mayozbölünme 23'te γH2AX'in kendiliğinden fosforilasyonu nedeniyle GVBD'den sonra hasarın tahmin edilememesidir.
Bu immünofloresan protokolünde, oositler sıvı bir tamponda kalır ve slaytlar içinde saklanamaz. Bu gerçek, ikincil antikorun eklenmesinden sonra sabit hücrelerin günlerce korunmasını zorlaştırır. Kaliteli görüntüler elde etmek ve sinyal kaybı yaşamamak için sekonder antikor eklendikten sonra birkaç saat içinde görüntülemenin yapılması tercih edilir. Ayrıca, çekirdeklerin Z ekseni boyunca taranmasının, aşırı maruz kalma nedeniyle sinyalin zayıflamasına neden olabileceği de unutulmamalıdır. Bu nedenle, lazer gücünü azaltmak ve tarama hızını artırmak tercih edilir.
Son olarak, immünofloresan protokolünün bir diğer sınırlaması, sadece sabit/cansız hücreler için kullanılabilmesidir. Bu nedenle, konsantrasyonlarında herhangi bir dalgalanma olup olmadığını veya zaman içinde davranışlarında değişiklik olup olmadığını bilmeden, yalnızca belirli zaman noktalarında faktörlerin varlığını ve yokluğunu tahmin edebiliriz. Bu sorun, canlı hücre görüntüleme ve floresan etiketli belirteçler kullanılarak aşılabilir.
Açıklamalar
Yazarların çıkar çatışması yoktur.
Teşekkürler
Bu çalışmaya, "Araştırma ve Yenilik Altyapısının Güçlendirilmesi" Eylemi kapsamında uygulanan, "Rekabetçilik, Girişimcilik ve Yenilikçilik" (NSRF 2014-2020) Operasyonel Programı tarafından finanse edilen ve Yunanistan ve Avrupa Birliği (Avrupa Bölgesel Kalkınma Fonu) tarafından ortaklaşa finanse edilen "Biyomedikal Araştırmalarda 'kapasite geliştirme' altyapılarının kurulması (BIOMED-20)" (MIS 5047236) projesinden destek alıyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 3 mL Pasteur pipettes in LDPE, graduated | APTACA | 1502 | |
| 10 cc syringes | SoftCare | 114.104.21 | |
| Alexa Fluor 488-conjugated goat anti-rabbit Secondary Ab | Biotium | 20012 | |
| Anti-phospho-H2A.X (Ser139) | Merck Millipore | 07-164 | |
| ARE Heating Magnetic Stirrer | VELP Scientifica | F20500162 | |
| BD FALCON 5 mL Polystyrene Round-Bottom Tubes | BD Biosciences | 352054 | |
| BD Microlance 3 Needles 27 G - 0.40 x 13 mm | Becton Dickinson | 300635 | |
| Bovine Serum Albumin Fraction V | Roche | 10735078001 | |
| DMSO Anhydrous | Biotium | 90082 | |
| DRAQ7 DNA dye | BioStatus | DR71000 | |
| EGTA | Sigma-Aldrich | E4378-25G | |
| EMSURE MgCl2. 6H2O | Merck Millipore | 1058330250 | |
| Etoposide | CHEMIPHARM | L01CB01 | |
| FALCON 14 mL Polystyrene Round-Bottom Tubes | Corning Science | 532057 | |
| FALCON Tissue Culture Dishes, Easy-Grip, 35 x 10 mm Style | Corning Science | 353001 | |
| Glass Bottom Culture Dishes (35 mm Petri dish/ 14 mm Microwell, No. 0 coverglass) | MatTek Corporation | P35G-0-14-C | |
| HEPES | Sigma-Aldrich | H6147-25G | |
| HERACELL 150i CO2 Incubator | ThermoFisher Scientific | 50116048 | |
| IBMX powder | Sigma-Aldrich | I5879-100MG | |
| Leica M125 Stereo Microscope | Leica Microsystems | ||
| M16 Medium | Sigma-Aldrich | M7292 | |
| M2 Medium | Sigma-Aldrich | M7167 | |
| Mineral Oil | Sigma-Aldrich | M5310 | |
| NaN3 | Honeywell | 13412H | |
| NaOH | Merck Millipore | 1064981000 | |
| Nikon AX ECLIPSE Ti2 Confocal Microscope | Nikon Corporation | ||
| Nikon SMZ800N Stereo Microscope | Nikon Corporation | ||
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Pasteur pippettes, glass, long form 230 mm | DURAN WHEATON KIMBLE | 357335 | |
| pH/ORP meter | Hanna Instruments Ltd | HI2211 | |
| Phosphate buffered saline tablets | Sigma-Aldrich | P4417-100TAB | |
| PIPES | Sigma-Aldrich | P1851 | |
| PMSG Protein Lyophilised | Genway Biotech (now AVIVA Systems Biology) | GWB-2AE30A (now OPPA01037) | |
| QBD4 Dry block heater | Grant Instruments (Cambridge) Ltd | A25218 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Whatman Puradisc 25 mm 0.2 μm filters | GE Healthcare | 6780-2502 |
Referanslar
- Wang, X., Pepling, M. E. Regulation of meiotic prophase one in mammalian oocytes. Frontiers in Cell and Developmental Biology. 9, 667306(2021).
- Filatov, M., Khramova, Y., Semenova, M. Molecular mechanisms of prophase I meiotic arrest maintenance and meiotic resumption in mammalian oocytes. Reproductive Sciences. 26 (11), 1519-1537 (2019).
- Adhikari, D., et al. Inhibitory phosphorylation of Cdk1 mediates prolonged prophase I arrest in female germ cells and is essential for female reproductive lifespan. Cell Research. 26 (11), 1212-1225 (2016).
- Sun, S. C., Kim, N. H. Molecular mechanisms of asymmetric division in oocytes. Microscopy and Microanalysis. 19 (4), 883-897 (2013).
- Jones, K. T. Mammalian egg activation: From Ca2+ spiking to cell cycle progression. Reproduction. 130 (6), 813-823 (2005).
- Solc, P., Schultz, R. M., Motlik, J. Prophase I arrest and progression to metaphase I in mouse oocytes: comparison of resumption of meiosis and recovery from G2-arrest in somatic cells. Molecular Human Reproduction. 16 (9), 654-664 (2010).
- Parfenov, V., Potchukalina, G., Dudina, L., Kostyuchek, D., Gruzova, M. Human antral follicles: oocyte nucleus and the karyosphere formation (electron microscopic and autoradiographic data). Gamete Research. 22 (2), 219-231 (1989).
- Zuccotti, M., Piccinelli, A., Giorgi Rossi, P., Garagna, S., Redi, C. A. Chromatin organization during mouse oocyte growth. Molecular Reproduction and Development. 41 (4), 479-485 (1995).
- Sun, X., et al. Comprehensive analysis of nonsurrounded nucleolus and surrounded nucleolus oocytes on chromatin accessibility using ATAC-seq. Molecular Reproduction and Development. 90 (2), 87-97 (2023).
- Zuccotti, M., Bellone, M., Longo, F., Redi, C. A., Garagna, S. Fully-mature antral mouse oocytes are transcriptionally silent but their heterochromatin maintains a transcriptional permissive histone acetylation profile. Journal of Assisted Reproduction and Genetics. 28 (12), 1193-1196 (2011).
- Winship, A. L., Stringer, J. M., Liew, S. H., Hutt, K. J. The importance of DNA repair for maintaining oocyte quality in response to anti-cancer treatments, environmental toxins and maternal ageing. Human Reproduction Update. 24 (2), 119-134 (2018).
- Lieber, M. R. The mechanism of human nonhomologous DNA end joining. The Journal of Biological Chemistry. 283 (1), 1-5 (2008).
- Chiruvella, K. K., Liang, Z., Wilson, T. E. Repair of double-strand breaks by end joining. Cold Spring Harbor Perspectives in Biology. 5 (5), 012757(2013).
- Chang, H. H. Y., Pannunzio, N. R., Adachi, N., Lieber, M. R. Non-homologous DNA end joining and alternative pathways to double-strand break repair. Nature Reviews. Molecular Cell Biology. 18 (8), 495-506 (2017).
- Shibata, A., Jeggo, P. A. Roles for the DNA-PK complex and 53BP1 in protecting ends from resection during DNA double-strand break repair. Journal of Radiation Research. 61 (5), 718-726 (2020).
- Mohiuddin, I. S., Kang, M. H. DNA-PK as an emerging therapeutic target in cancer. Frontiers in Oncology. 9, 635(2019).
- Marangos, P., Carroll, J. Oocytes progress beyond prophase in the presence of DNA damage. Current Biology. 22 (11), 989-994 (2012).
- Paull, T. T., et al. A critical role for histone H2AX in recruitment of repair factors to nuclear foci after DNA damage. Current Biology. 10 (15), 886-895 (2000).
- Bakkenist, C. J., Kastan, M. B. DNA damage activates ATM through intermolecular autophosphorylation and dimer dissociation. Nature. 421 (6922), 499-506 (2003).
- Marangos, P., et al. DNA damage-induced metaphase I arrest is mediated by the spindle assembly checkpoint and maternal age. Nature Communications. 6, 8706(2015).
- Lavrentyeva, E. A., Shishova, K. V., Zatsepina, O. V. Differences in nuclear dynamics in mouse GV oocytes with a diverse chromatin configuration. Biology Bulletin Russian Academy of Sciences. 46, 332-341 (2019).
- Montecucco, A., Zanetta, F., Biamonti, G. Molecular mechanisms of etoposide. EXCLI Journal. 14, 95-108 (1998).
- Mayer, A., et al. DNA damage response during mouse oocyte maturation. Cell Cycle. 15 (4), 546-558 (2016).
- Olive, P., Banáth, J. The comet assay: A method to measure DNA damage in individual cells. Nature Protocols. 1, 23-29 (2006).
- Wu, D., Dean, J. EXOSC10 sculpts the transcriptome during the growth-to-maturation transition in mouse oocytes. Nucleic Acids Research. 48 (10), 5349-5365 (2020).
- Simon, L., Emery, B., Carrell, D. DNA damage: COMET assay. Manual of Sperm Function Testing in Human Assisted Reproduction. Agarwal, A., Henkel, R., Majzoub, A. , 202-212 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır