Method Article
마우스 난모세포에서 DNA 이중 가닥 절단 검출
요약
난모세포 게놈 무결성을 유지하는 것은 결과 배아에서 유전적 충실도를 보장하는 데 필요합니다. 여기에서 우리는 포유류 암컷 생식 세포에서 DNA 이중 가닥 절단을 검출하기 위한 정확한 프로토콜을 제시합니다.
초록
난모세포는 여성의 몸에서 가장 크고 수명이 긴 세포 중 하나입니다. 그들은 배아 발달 동안 난소에서 형성되고 감수 분열 I의 전단계에서 체포됩니다. 정지 상태는 난모세포가 성장하도록 자극을 받고 감수분열을 재개할 수 있는 능력을 얻을 때까지 수년 동안 지속될 수 있습니다. 이 장기간의 체포 상태는 여성 배우자의 유전 적 완전성에 영향을 미치고 따라서 미래 배아의 유전 적 완전성에 영향을 미치는 DNA를 손상시키는 모욕을 축적하는 데 매우 취약합니다.
결과적으로, DNA 손상 반응 메커니즘의 확립을 위한 첫 번째 단계인 DNA 손상을 감지하는 정확한 방법의 개발이 매우 중요합니다. 이 논문은 20시간 동안 전립선 정지 난모세포에서 DNA 손상의 존재와 진행을 테스트하기 위한 일반적인 프로토콜을 설명합니다. 구체적으로, 우리는 마우스 난소를 해부하고, 난모세포 복합체(COC)를 회수하고, COC에서 난구 세포를 제거하고, 난모세포를 3-이소부틸-1-메틸크산틴이 함유된 Μ2 배지에서 배양하여 정지 상태를 유지합니다. 그 후, 난모세포는 세포독성, 항신형질제인 에토포사이드로 처리되어 이중 가닥 절단(DSB)을 유발합니다.
면역형광 및 컨포칼 현미경을 사용하여 히스톤 H2AX의 인산화된 형태인 핵심 단백질 γH2AX의 수준을 검출하고 정량화합니다. H2AX는 DNA 손상 후 DSB 부위에서 인산화됩니다. 난모세포의 DNA 손상 후 DNA 무결성을 회복할 수 없으면 불임, 선천적 기형 및 자연 유산 비율 증가로 이어질 수 있습니다. 따라서 DNA 손상 반응 메커니즘에 대한 이해와 동시에 이러한 메커니즘을 연구하기 위한 온전한 방법의 확립은 생식 생물학 연구에 필수적입니다.
서문
포유류 여성 생식 세포에서 감수 분열 과정은 출생 전에 난소에서 시작됩니다. 난 모세포의 총 수는 주로 배아 발생 동안 난소에서 확립됩니다. 난모세포는 감수분열에 들어가 전구 I1단계에서 체포된 상태로 유지됩니다. 사춘기가 시작되고 난포자극호르몬(FSH)과 황체형성호르몬(LH)의 생성과 내분비 작용이 일어나면 난모세포가 다시 시작되어 감수분열을 완료할 수 있습니다2. 인간의 경우, 전립선 정지는 최대 50 년 동안 지속될 수 있습니다3. 감수 분열 I에 진입 한 후 세포 분열은 비대칭이며, 그 결과 작은 극체와 그 크기를 유지하는 난 모세포가 생성됩니다. 따라서, 대부분의 세포질 성분은 초기 배발생(early embryogenesis) 동안 난형질(ooplasm)에 저장된다4. 그런 다음 난모세포는 핵을 변형시키거나 염색체를 축합하지 않고 감수분열 II에 들어가 수정될 때까지 중기 II에서 정지된 상태를 유지합니다5.
난모세포와 체세포를 구별하는 독특한 특징은 난모세포가GV 6기라고 하는 온전한 핵(배낭[GV] 정지)을 보유하는 전구기 I의 정지 상태입니다. 염색질 조직에 따라 GV 단계 난모세포는 비포위핵소체(NSN)와 포위핵소체(SN)의 두 가지 범주로 분류됩니다7,8. NSN GV 단계 난모세포에서는 염색질이 전체 핵 영역에 퍼져 전사가 활성화되는 반면, SN 난모세포에서는 염색질이 핵소체를 둘러싸고 있는 조밀한 고리를 형성하고 전사는 침묵합니다9. GV 단계 난모세포의 두 가지 유형 모두 감수분열 능력을 보여줍니다. 그들은 같은 속도로 감수 분열에 들어가지만 NSN 난모세포는 낮은 발달 능력을 나타내며 2세포 단계 배아 이상으로 발달할 수 없습니다10.
prophase I 정지의 장기간의 상태는 DNA 손상 축적의 발생률을 증가시킨다11. 따라서 난모세포의 DNA 손상 반응 메커니즘은 유전적 완전성을 가진 배우자의 생산을 허용하고 생성된 배아가 생리학적 염색체 함량을 갖도록 하는 데 필수적입니다.
DNA 손상 반응의 핵심적인 측면은 DNA 복구입니다. 진핵 세포에서 DSB 복구를 위한 주요 경로에는 비상동 말단 접합(NHEJ), 상동 재조합(HR) 및 대체 NHEJ12,13,14,15가 포함됩니다. NHEJ는 더 빠르지만 오류가 발생하기 쉬운 메커니즘인 반면, HR은 완료하는 데 더 많은 시간이 필요하지만 충실도가 높습니다16.
난모세포가 DNA 손상 복구를 위해 사용하는 메커니즘에 대한 지식이 충분하지 않습니다. 연구에 따르면 에토포시드, 독소루비신, UVB 또는 전리 방사선과 같은 유전독성제의 사용에 의해 완전히 성장한 포유류 난모세포에서 유도된 DNA 손상은 prophase I arrest에서 탈출하는 시기와 속도에 영향을 미치지 않는 것으로 나타났다17. 난모세포는 높은 수준의 손상이 있는 경우에도 GV 분해(GVBD)를 겪을 수 있습니다. 이 손상은 γH2AX의 관찰에 의해 결정될 수 있습니다. 이 인산화된 형태의 H2AX(γΗ2ΑΧ)는 DSB 마커로, 단절 부위에 위치하며 단절에 축적되는 인자와 단백질을 복구하는 데 도움이 되는 스캐폴드 역할을 한다18.
DNA 손상 후 세포 주기 정지가 없는 것은 복구되지 않은 DNA를 가진 난모세포가 감수분열에 재진입할 수 있도록 하는 DNA 손상 체크포인트가 불충분하기 때문입니다. 높은 수준의 DNA 손상 후 체크포인트는 ATM/Chk1 의존 경로의 활성화를 통해 전단계 정지를 유지할 수 있습니다. DSB에 대한 제한된 체크포인트 응답은 ATM17,19의 제한된 활성화 때문입니다. 감수 분열 I의 M 단계에서 연구에 따르면 DNA 손상은 방추 조립 체크 포인트 (SAC) 유도 감수 분열 I 체크 포인트를 활성화하여 E3 유비퀴틴 리가제 아나 페이즈 촉진 복합체 / 사이클로솜 (APC / C)의 활성화를 방지하므로 M- 상 출구. 또한, SAC 단백질의 절제는 M-상 정지 상태를 극복하여 감수 분열 I 체크포인트20의 확립에서 SAC의 중요성을 강조합니다.
이전 연구에서 분명히 알 수 있듯이 DSB는 마우스 난모세포에서 강력한 prophase 체크포인트를 유도할 수 없습니다. 이러한 손상을 복구하지 않고 방치하면 염색체 이상을 가진 배아가 생길 수 있습니다. 따라서 난모세포가 잠재적인 유전적 손상에 대처하기 위해 사용하는 고유한 경로를 더 잘 이해하기 위해 여성 배우자 형성의 여러 단계에서 DNA 손상 반응을 연구하는 것이 중요합니다.
프로토콜
모든 마우스 실험은 지방 당국(그리스 이오안니나 지역)의 승인을 받았으며 유럽 공동체 위원회 지침 2010/63/EU에 따라 수행되었습니다. 실험은 3R의 원리에 따라 수행되었습니다. 실험에 사용된 모든 CD-1 마우스는 그리스 이오안니나 대학교의 동물 사육장 시설에서 온도(22°C)와 습도(60%)가 조절된 방에서 사육하고 임의로 급여하였다. 동물집은 사육시설(EL33-BIObr01), 공급시설(EL33-BIOsup01), 실험시설(EL33BIO-exp01)을 운영할 수 있는 허가를 받았습니다.
1. 시약의 제조
- 디메틸 설폭사이드(DMSO)( 재료 표 참조)에 3-이소부틸-1-메틸크산틴(IBMX) 분말(재료 표 참조)을 최종 농도 200mM로 희석합니다. 10 μL 분취액을 첨가하고, -20 °C에서 보관한다. 1 개월 이내에 솔루션을 사용하십시오.
참고: IBMX 분말은 -20°C에서 보관됩니다. - 모든 면역형광 완충액을 준비하고, 4°C에서 보관한다.
- 1개의 PBS 정제(재료 표 참조)를 200 mL의 ddH2Ο에 희석하여 멸균 인산염 완충 식염수(PBS)를 제조한다.
- ddH2Ο 80 mL, HEPES 0.59575 g, PIPES 1.81422 g, EGTA 0.38035 g,MgCl2 0.04066 g을 첨가하여 PHEM 완충액을 만들고(재료 표 참조) 자기 교반기로 교반하면서(재료 표 참조), pH가 6.9에 도달할 때까지 NaOH(재료 표 참조)를 동시에 첨가합니다(pH/ORP 측정기를 사용하여 확인[재료 표 참조]). 그런 다음 ddH2Ο를 최종 부피 100mL에 추가합니다.
- PFA 분말(재료 표 참조)을 PHEM 완충액에 희석하여 파라포름알데히드-트리톤-X-100(PFA-Tx-4) 완충액을 준비하면서 최종 농도 4% PFA로 가열하면서 마그네틱 교반기로 교반합니다. 그런 다음 주사기와 0.2μm 필터(재료 표 참조)를 사용하여 버퍼를 필터링하고 0.5% Tx-100(재료 표 참조)을 추가합니다. 약 10mL의 PFA-Tx-100(PFA 0.4g, Tx-100 50μL)을 준비하여 1회 실험에 충분합니다. 최대 1주일 동안 4°C에서 보관하십시오.
주의 : PFA를 다룰 때는 장갑을 착용하고 피부와 눈에 닿지 않도록 하십시오. - PBS에 소 혈청 알부민(최종 농도: 0.5% w/v BSA)( 재료 표 참조)을 첨가하여 세척 완충액을 준비하고 기계적으로 교반합니다. 곰팡이 및 박테리아 오염의 위험을 최소화하기 위해 1:1,000 희석으로 10% w/v NaN3 완충액(아지드화나트륨)을 추가합니다. 10mL의ddH2O 에 1g의NaN3 분말( 재료 표 참조)을 첨가하여 10% w/v NaN3완충액을 만듭니다. NaN3 완충액을 실온에서 보관한다.
- PBS에 BSA(최종농도: 3% w/v)를 첨가하고 기계적으로 교반하여 블로킹 버퍼를 준비합니다. 10%NaN3 완충액을 1:1,000 희석액으로 첨가합니다.
2. 해부된 난소에서 GV 난모세포 수집 및 DSB 유도
알림: 모든 도구와 용액은 멸균되어야 합니다. 난모세포 취급은 입체 현미경(재료 표 참조)에서 구강 피펫을 사용하여 수행되며 모든 방울은 미네랄 오일로 덮여 있습니다(재료 표 및 그림 1E 참조).
- 자궁경부 탈구로 마우스를 도태하기 전에 46-48시간 동안 임신한 암말의 혈청 성선 자극 호르몬(PMSG)의 7개 국제 단위(IU)( 재료 표 참조)를 마우스에 복강 주사합니다.
참고: 사용된 모든 마우스는 8-12주령이어야 합니다. - M2 배양 배지 (재료 표 참조)를 주사기 및 0.2 μm 필터로 여과하고, 14 mL 둥근-바닥 튜브 (재료 표 참조)에서 최종 농도 200 μM까지 IBMX 200 mM을 첨가하여 난모세포가 프로페이즈 I에서 정지되도록 유지하였다. 그런 다음 플라스틱 조직 배양 접시에 M2-IBMX 배지 방울을 준비하고(재료 표 참조) 난모세포 분리 전에 37°C에서 최소 30분 동안 핫 블록(재료 표 참조)에 놓습니다. M2를 4 °C에서 보관하십시오.
- 자궁 경부 탈구로 마우스를 희생시키고 난소를 해부한 다음 M2-IBMX가 있는 5mL 둥근 바닥 튜브( 재료 표 참조)에 넣습니다.
- 난소를 1.5mL의 M2-IBMX가 들어 있는 플라스틱 뚜껑으로 옮기고, 난소주위 지방 조직 또는 나팔관 세그먼트를 제거하고, 27G 바늘로 난소를 기계적으로 천공하여 COC를 방출합니다(재료 표 및 그림 1A-C 참조).
- COC를 M2-IBMX 방울(각각 약 25-30μL)이 있는 배양 접시로 옮기고 좁은 구멍 유리 파스퇴르 피펫을 사용하여 반복 피펫팅하여 적운 세포를 제거합니다( 재료 표 및 그림 1D 참조).
- SN GV-단계 난모세포를 선택하고 빛으로부터 보호되는 37°C의 핫 블록에 M2-IBMX 배지 한 방울(25μL)로 옮깁니다(그림 1F).
- SN 난모세포는 핵이 말초에 위치하는 NSN 난모세포와 대조적으로 더 큰 크기와 중앙에 배치된 핵을 기준으로 찾는다21. 어쨌든, GV 난 모세포 (SN 또는 NSN)의 유형에 대한 최종 결정을 내리기 전에 컨포칼 현미경으로 DNA 구성을 관찰하십시오.
- 에토포사이드를 사용하여 DSB를 유도합니다( 재료 표 참조). GV-stage 난모세포를 37°C의 고온 블록 상에서 1시간 동안 유전독성제의 한 방울(각각 25 μL)에 넣고 암실에서 두었다.
참고: 에토포사이드는 DNA22에 DSB를 도입하는 토포이소머라제 II 억제제입니다. 에토포사이드를 빛으로부터 보호되는 실온에서 20mg/mL의 10μL 분취량으로 보관하십시오. 테스트된 농도는 5μg/mL, 20μg/mL 및 50μg/mL입니다. - GV-단계 난모세포를 장기간 정지된 상태로 유지하려면, 난모세포를 37°C 및 5%CO2의 인큐베이터(재료 표 참조)에서 400μM IBMX로 보충된 M16 배양 배지(재료 표 참조)의 방울에 넣습니다. M16을 4°C에서 보관하고, 주사기 및 0.2 μm 필터로 배지를 여과하고, 사용하기 전에 적어도 1시간 동안 배양한다.
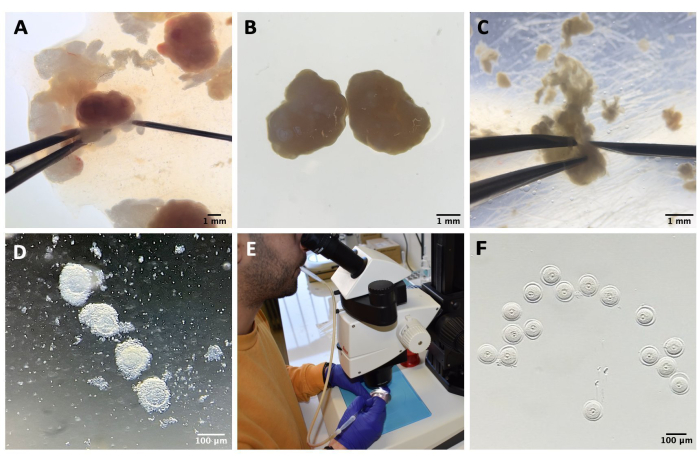
그림 1: 난모세포 분리 과정 . (A) IBMX를 사용한 M2 배지의 난소에서 난소주위 지방 조직 및 남은 나팔관 세그먼트 제거. 실체 현미경 접안렌즈를 통해 얻은 사진. 스케일 바 = 1mm. (B) IBMX가 있는 M2 배지에서 분리된 난소. 실체 현미경 접안렌즈를 통해 얻은 이미지. 스케일 바 = 1mm. (C) IBMX가 있는 M2 배지에서 27G 바늘을 사용하여 난소의 기계적 천공. 실체 현미경 접안렌즈를 통해 얻은 이미지. 스케일 바 = 1mm. (D) IBMX를 사용한 M2 배지에서 천공 후 난소에서 방출된 COC. 실체 현미경 접안렌즈를 통해 얻은 이미지. 스케일 바 = 100 μm. (E) 구강 피펫을 이용한 난모세포 수집. (F) 주변 난구를 제거한 후 IBMX가 있는 M2 배지에서 탈락한 난모세포. 실체 현미경 접안렌즈를 통해 얻은 이미지. 스케일 바 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 난모세포 고정 및 면역형광
참고: 난모세포 취급은 입체 현미경으로 입 피펫을 사용하여 수행되며 모든 방울은 미네랄 오일로 덮여 있습니다.
- 대조군과 에토포시드 처리된 GV 난모세포를 PFA-Tx-100 완충액과 함께 상이한 플라스틱 조직 배양 접시에 실온에서 40분 동안 넣습니다.
- 실온에서 세척 완충액(각각 50 μL)의 3가지 다른 방울로 난모세포를 세척합니다. 각 방울에 난모세포를 5분 동안 그대로 두십시오.
- 난모세포를 37°C의 핫 블록 상에서 1시간 동안 블로킹 완충액(각각 25μL)의 방울에 넣습니다.
- γH2AX(rabbit phospho-Η2ΑΧ)(Ser139)를 인식하는 1차 항체를 준비합니다( 재료 표 참조)(원액: 1mg/mL). 차단 완충액에 1:200 희석액을 사용하고 4°C에서 밤새 1차 항체(각각 15μL)의 한 방울에 난모세포를 넣습니다.
참고: Phospho-Η2ΑΧ (γH2AX)는 체세포와 GV 난모세포 모두에서 DSB를 검출하는 일반적인 마커이다18,23. - 다음날, 실온에서 세척 완충액(각각 50 μL)의 3가지 다른 방울로 난모세포를 세척합니다. 각 방울에 난모세포를 5분 동안 그대로 두십시오.
- 2차 항체인 Alexa Fluor 488-conjugated goat anti-rabbit( 재료 표 참조)(원액: 2mg/mL)을 준비합니다. 차단 완충액에 1:200 희석액을 사용하고 빛으로부터 보호된 37°C의 핫 블록에서 1시간 동안 2차 항체(각각 15μL) 방울에 난모세포를 넣습니다.
- 난모세포를 투과된 세포에서만 DNA를 염색하는 원적외선 형광 DNA 염료인 DRAQ7(각 25μL)(원액: 0.3mM, 재료 표 참조) 방울로 옮깁니다. 어두운 조건에서 실온에서 10분 동안 세척 완충액에 1:250 희석하여 사용하십시오.
- 실온에서 세척 완충액(각각 50 μL)의 3가지 다른 방울로 난모세포를 세척합니다. 각 방울에 5분 동안 그대로 둔 다음 컨포칼 현미경 검사를 위해 35mm 유리 바닥 페트리 접시( 재료 표 참조)에 있는 세척 완충액의 작은 방울(각각 약 5μL)로 옮깁니다(그림 2A).
참고: DNA 염색과 2차 항체의 세척이 동시에 수행됩니다.
4. 컨포칼 현미경
참고: 공초점 현미경 검사는 유리 바닥 접시에 난모세포를 배치한 후 형광 강도가 감소하는 것을 방지하기 위해 즉시 수행해야 합니다. 전동 스테이지가 있는 컨포칼 현미경( 재료 표 참조)에 대한 접근이 필요합니다.
- 현미경 설정
- 공초점 시스템에서 레이저 컨트롤러, 레이저, 현미경 컨트롤러, 투과광용 램프 및 PC를 켭니다(그림 2B, D).
- 컨포칼 소프트웨어를 열고 40x 오일 렌즈를 선택합니다.
- 접시를 표본 홀더에 놓고 조이스틱을 사용하여 XY 및 Z축에서 스테이지를 이동하여 난모세포에 초점을 맞춥니다(그림 2C).
- 난모세포 스캐닝
- 포화를 최소화하기 위해 각 실험에 대해 레이저 출력, 게인 및 핀홀 크기를 독립적으로 설정합니다.
- 각 난모세포에 대해 관심 영역, 특히 DNA 영역의 핵을 설정합니다. DNA 영역의 경계를 정의하고 z 스텝 크기를 3μm로 조정합니다. 그런 다음 스캔을 시작합니다.
- 선택한 폴더의 각 셀에 대한 이미지를 저장합니다.
- 스캔이 완료되면 소프트웨어를 종료하고 컴퓨터를 종료한 다음 레이저 컨트롤러, 레이저, 현미경 컨트롤러 및 투과광용 램프를 끕니다.
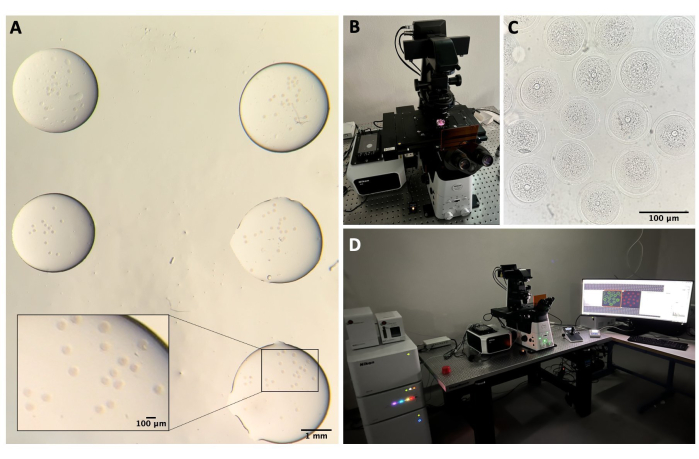
그림 2: 컨포칼 현미경 . (A) 면역형광 프로토콜 및 DNA 염색을 수행한 후 난모세포를 별도의 세척 완충액 방울에 고정하고, 미네랄 오일로 덮고, 유리 바닥 접시에 넣고, 공초점 현미경 이미징을 위해 준비합니다. 각 드롭에는 다른 실험 범주가 포함되어 있습니다. 실체 현미경 접안렌즈를 통해 얻은 이미지. 스케일 바 = 확대 부분의 경우 1mm/100μm. (B) 컨포칼 현미경 스테이지에 배치된 유리 바닥판. (C) 컨포칼 현미경을 통해 얻은 난모세포의 명시야 이미지. 스케일 바 = 100 μm. (D) 컨포칼 현미경 시스템. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 이미징 분석
- 브라우저(https://imagej.net/software/fiji/downloads)에서 Fiji ImageJ-win64를 다운로드하여 열고 데이터를 TIFF 스택 파일로 가져옵니다.
참고: 각 난모세포 파일을 별도로 엽니다. - 이미지 | 색상 | 채널 분할을 클릭하여 모든 채널을 분할합니다.
- LUT(Look up Table)를 클릭하고 각 채널에 대해 선호하는 색상을 선택합니다.
- 이미지 | 색상 | 채널 병합 γΗ2ΑΧ 및 DNA에 대한 채널을 병합합니다. 명시야 채널을 병합하지 않은 상태로 둡니다.
- NSN 난모세포 및 낮은 수준의 DNA 손상을 갖는 SN 난모세포에서, γΗ2ΑΧ는 DNA 영역에서 병소로서 검출된다. 이 경우 "멀티 포인트"또는 포인트 명령을 클릭하고 DNA와 일치하는 모든 γΗ2ΑΧ 초점을 선택하십시오. 모든 스택에 대해 이 단계를 반복합니다.
- 높은 수준의 DNA 손상을 가진 SN 난모세포에서 γΗ2ΑΧ 신호는 전체 DNA 영역에 분포합니다. 이 경우 이미지 | 스택 | Z 프로젝트를 선택하고 [자유형 선택] 명령을 사용하여 전체 DNA 영역을 선택합니다.
- γΗ2ΑΧ 형광을 측정하려면 분석 | 측정하고 측정값을 .xlsx 파일에 복사합니다. 그런 다음 평균 형광을 계산하고, 값을 정규화하고, 그래프를 만들기 전에 초점 수를 계산합니다.
- Analyze( 분석) | 배율 설정(Set Scale )을 클릭하여 배율을 설정한 다음 분석(Analyze) | 도구 | 스케일 바 를 사용하여 채널에 스케일 바를 추가합니다.
결과
여기에 설명된 절차를 사용하여 마우스 난소를 해부하고 지방을 제거하고 완전히 성장한 GV 단계 난모세포를 수집했습니다. 이어서, 좁은 피펫을 사용하여 반복적인 피펫팅에 의해 난구세포를 제거하고, M2-IBMX 배지의 신선한 방울에 넣고, 뜨거운 블록(37°C) 상에 미네랄 오일로 덮었다(도 1A-F). 20mg/mL의 스톡 에토포시드 농도를 사용하여 세 가지 다른 에토포시드 농도(5μg/mL, 20μg/mL 및 50μg/mL)를 준비했습니다. GV 단계 난모세포를 미네랄 오일로 덮고 37°C에서 빛으로부터 보호하는 방울에 1시간 동안 3개의 별개의 에토포시드 농도로 배치했습니다. 그런 다음 프로토콜 섹션에 자세히 설명된 대로 면역형광 프로토콜을 따르고 난모세포를 유리 바닥 접시에 넣고 컨포칼 현미경으로 관찰했습니다(그림 2).
SN GV 단계 난모세포에서 DNA 손상 직후 γH2AX의 존재는 모든 에토포시드 농도(5μg/mL, 20μg/mL 및 50μg/mL)에서 증가했으며 γH2AX는 전체 DNA 영역에 분포했습니다(그림 3). DSB 정량 및 추정은 DNA 부위에서 γH2AX 형광 강도를 관찰하여 수행하였다. γH2AX 형광은 에토포시드 농도가 증가함에 따라 비례적으로 강화되었습니다. 또한, 장기간의 전립선 정지 후(에토포사이드 처리 후 20시간), GV 단계 난모세포는 γH2AX 병소 수와 강도를 감소시키는 능력을 보여주었으며, 이는 GV 단계 정지 난모세포에서 활성 복구 과정의 존재를 암시합니다(그림 3E).
γH2AX 형광이 DNA를 통해 분포된 SN 난모세포와 달리 NSN 난모세포에서는 γH2AX가 20μg/mL에서 에토포시드로 처리한 직후 병소로 나타났습니다. 우리는 DNA 영역과 일치하는 병소의 수를 추정하고, 모든 초점의 형광을 계산하고, 모든 난모세포의 평균 형광을 제시했습니다. 형광과 병소의 수는 두 난모세포 범주 간에 통계적으로 유의미한 차이를 보였다(그림 4).
컨포칼 현미경은 서로 다른 Z 스택에 있는 병소의 수와 강도에 대한 정보를 제공하므로 DNA 손상의 존재와 뚜렷한 시점에서 복구 역학을 식별하는 데 도움이 됩니다. Galvano 스캐닝은 낮은 배경으로 정밀 스캔을 제공하고 스캔 이미지를 더 잘 분석합니다.
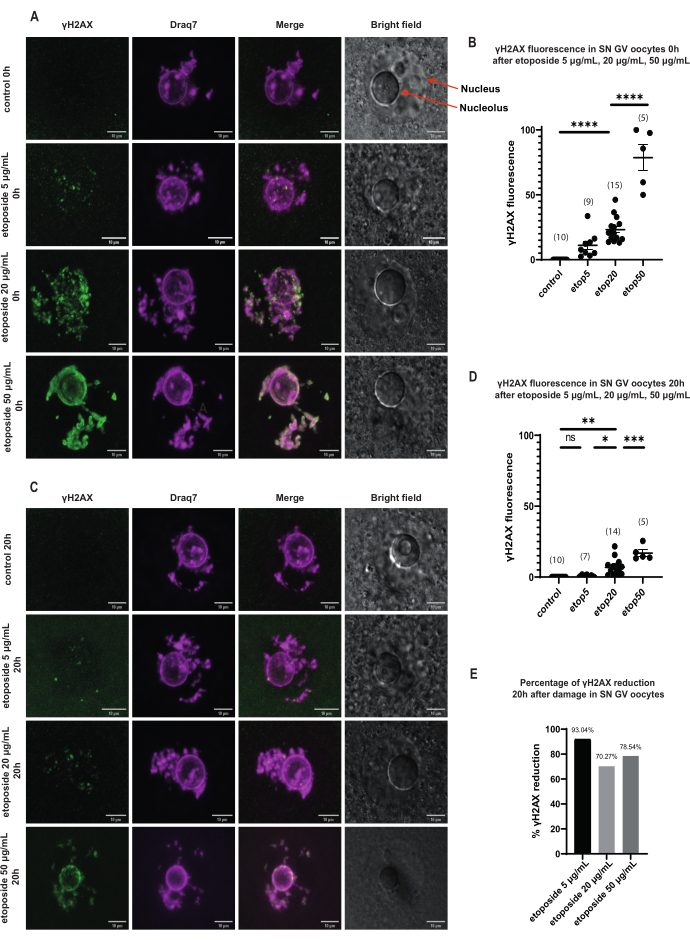
그림 3: 장기간의 GV 정지 후 세 가지 다른 에토포시드 농도로 처리된 SN GV 단계 난모세포에서 γH2AX의 감소. (A) 에토포시드 처리 0시간 후 SN GV 단계 난모세포에서의 γH2AX 형광. γH2AX는 모든 에토포시드 농도에서 노출 직후 증가하며, 증가는 농도에 따라 다릅니다(녹색: γΗ2ΑΧ, 자홍색: DNA). 이미지는 Z 스택 프로젝션이며 밝기 / 대비는 Fiji / ImageJ를 사용하여 각 채널에 맞게 조정되었습니다. 스케일 바 = 10 μm. (B) 뚜렷한 에토포시드 농도로 처리한 후 0시간 후 SN GV 단계 난모세포에서 γH2AX 형광 그래프. 데이터는 SEM± 평균을 나타냅니다. 각 점은 하나의 난모세포(난모세포의 수는 그래프에 표시됨)를 나타냅니다(ns = 유의하지 않음, **p < 0.005, **** p < 0.0001, Tukey의 다중 비교 검정을 사용한 일원 분산 분석). (C) 에토포시드 처리 20시간 후 SN GV 단계 난모세포에서의 γH2AX 형광. γH2AX는 모든 에토포사이드 농도(녹색: γΗ2ΑΧ, 자홍색: DNA)에서 노출 후 20시간 감소합니다. 이미지는 Z 스택 프로젝션이며 Fiji/ImageJ를 사용하여 각 채널에 대해 밝기/대비가 조정되었습니다. 스케일 바 = 10 μm. (D) 뚜렷한 에토포시드 농도로 처리한 후 20시간 후 SN GV 단계 난모세포에서 γH2AX 형광 그래프. 데이터는 SEM± 평균을 나타냅니다. 각 점은 하나의 난모세포(난모세포의 수는 그래프에 나타남)를 나타낸다(ns=유의하지 않음, *p < 0.05, **p < 0.005, ***p < 0.0005, **** p < 0.0001, Tukey의 다중 비교 검정을 사용한 일원 분산 분석). (E) 에토포시드 처리된 난모세포에서 프로페이즈 정지 후 SN GV 단계 난모세포의 γH2AX 형광 감소에 대한 막대 그래프. 각 열 위의 숫자는 γH2AX 형광의 백분율 감소를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
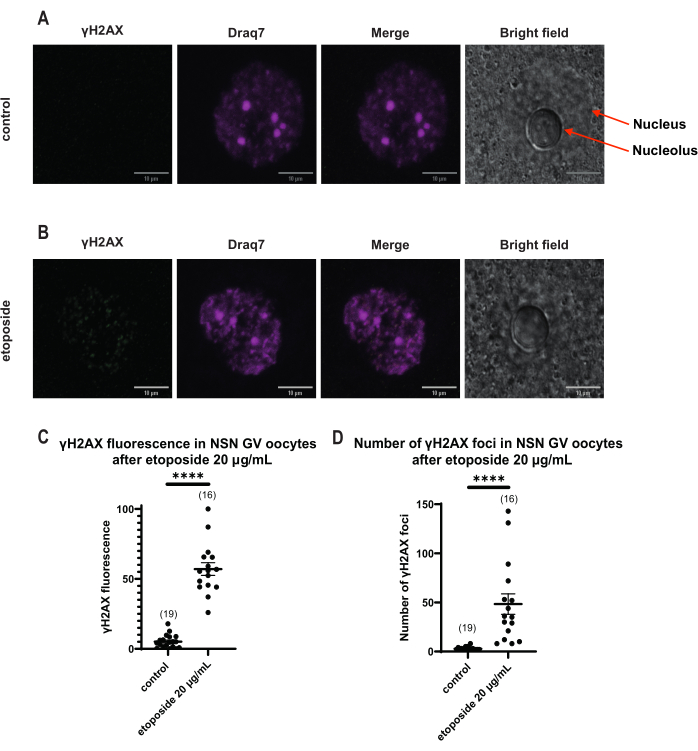
그림 4: 20μg/mL의 에토포시드로 처리한 후 NSN GV 단계 난모세포에서 Η2ΑΧ의 인산화. (A) 한 대조군 NSN GV-stage 난모세포의 대표적인 공초점 이미지(녹색: γΗ2ΑΧ, 자홍색: DNA). 이미지는 Z 스택 프로젝션이며 Fiji/ImageJ를 사용하여 각 채널에 대해 밝기/대비가 조정되었습니다. 스케일 바 = 10μm. (B) 하나의 에토포시드 처리된 NSN GV 단계 난모세포(녹색: γΗ2ΑΧ, 자홍색: DNA)의 대표적인 공초점 이미지. 난모세포는 에토포시드 처리 후 0시간 후에 고정되었습니다. 이미지는 Z 스택 프로젝션이며 Fiji/ImageJ를 사용하여 각 채널에 대해 밝기/대비가 조정되었습니다. 스케일 바 = 10μm. (C) 20μg/mL 에토포사이드 처리 후 NSN GV 단계 난모세포에서 정규화된 γΗ2ΑΧ 형광. 데이터는 SEM± 평균을 나타냅니다. 각 점은 두 개의 독립적인 실험(**** p < 0.0001, unpaired non-parametric t-test, Mann-Whitney U-test)에서 가져온 하나의 난모세포(난모세포의 수는 그래프에 표시됨)를 나타냅니다. (D) 20μg/mL 에토포시드 처리 후 NSN GV 단계 난모세포의 γΗ2ΑΧ 병소의 수. 데이터는 SEM± 평균을 나타냅니다. 각 점은 두 개의 독립적인 실험(**** p < 0.0001, unpaired non-parametric t-test, Mann-Whitney U-test)에서 가져온 하나의 난모세포(난모세포의 수는 그래프에 표시됨)를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에 설명된 방법을 사용하여 포유류 난모세포에서 DSB를 검출했습니다. 이 방법을 사용하면 난모세포에서 DNA 복구 과정을 검출하고 연구할 수 있습니다. 포유류 난모세포에서 생리학적 과정에 참여하는 다른 단백질을 분석하는 데에도 동일한 프로토콜을 사용할 수 있습니다. 인간의 여성 난임의 원인을 더 잘 이해하기 위해서는 난모세포가 잠재적인 DNA 손상에 어떻게 반응하는지 연구하는 것이 중요합니다.
포유류 난모세포의 DNA 손상 반응을 연구하는 것은 난모세포의 민감성 때문에 어려울 수 있습니다. 난모세포 취급에는 특정 온도와 CO2 및O2 농도가 필요합니다. 동시에, 난 모세포는 빛으로부터 보호되어야합니다. αll 취급은 난모세포에 해로울 수 있을 뿐만 아니라 넓지 않은 유리 피펫을 사용하여 수행해야 하며, 이는 배지의 희석을 유발하여 고정 절차에 부정적인 영향을 미칠 수 있으므로 넓지 않아야 합니다. 고정의 각 단계에서, 희석 효과를 최소화하기 위해 여러 방울의 완충액이 사용된다. DSB를 관찰하는 또 다른 방법은 혜성 분석(Comet assay)이다 24. 이 기술은 더 민감하지만 더 복잡합니다. 동시에, 혜성 분석을 사용함으로써, 손상이 발생하는 정확한 DNA 영역을 검출하는 것은 불가능하며, GV-단계 난모세포(25)와 같이 풍부한 RNA 분자를 가진 세포에서는 배경이 증가하여 잘못된 DNA 손상 신호(26)를 유발할 수 있다.
여기에 설명된 면역형광 프로토콜을 사용하여 DSB를 정확하게 검출하고 시간 경과에 따른 γH2AX 형광의 감소로 알 수 있듯이 GV 단계 난모세포의 복구 진행 상황을 추정할 수 있습니다. 그럼에도 불구하고, 이 방법의 한 가지 한계는 특정 항체가 난형질 전체에 비특이적 분포를 나타낼 수 있으며, 따라서 높은 배경 형광을 갖는 이미지를 유도할 수 있다는 것입니다. PFA-Tx-100 버퍼는 순차적 PFA 및 Tx-100 대신 사용되며, 배경 및 비특이적 형광을 덜 검출할 수 있어 고정 과정이 개선되는 것으로 관찰되었습니다. DSB 검출을 위해 γH2AX를 사용하는 두 번째 한계는 감수분열에서 γH2AX의 자발적인 인산화로 인해 GVBD 후 손상을 추정할 수 없다는 것입니다23.
이 면역형광 프로토콜에서 난모세포는 액체 완충액에 남아 있으며 슬라이드 내에 저장할 수 없습니다. 이러한 사실은 2차 항체의 첨가 후 수일 동안 고정된 세포를 보존하는 것을 어렵게 만든다. 좋은 품질의 영상을 얻고 신호를 잃지 않기 위해서는, 2차 항체의 첨가 후 몇 시간 이내에 영상화를 수행하는 것이 바람직하다. 또한 Z축을 통한 핵 스캔은 과다 노출로 인해 신호가 약해질 수 있다는 점에 유의해야 합니다. 이러한 이유로 레이저 출력을 낮추고 스캔 속도를 높이는 것이 바람직합니다.
마지막으로, 면역형광 프로토콜의 또 다른 한계는 고정/비생물 세포에만 사용할 수 있다는 것입니다. 따라서 우리는 특정 시점에서 요인의 존재 유무만 추정할 수 있으며, 시간에 따른 농도의 변동이나 행동의 변화가 있는지 알 수 없습니다. 이 문제는 생세포 이미징 및 형광 태그가 부착된 마커를 사용하여 극복할 수 있습니다.
공개
저자는 이해 상충이 없습니다.
감사의 말
우리는 "경쟁력, 기업가 정신 및 혁신" 운영 프로그램(NSRF 2014-2020)이 자금을 지원하고 그리스와 유럽 연합(유럽 지역 개발 기금)이 공동 자금을 지원하는 "연구 및 혁신 인프라 강화" 조치에 따라 구현되는 "생물의학 연구(BIOMED-20)의 '역량 구축' 인프라 구축(MIS 5047236)" 프로젝트에서 이 작업에 대한 지원을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| 3 mL Pasteur pipettes in LDPE, graduated | APTACA | 1502 | |
| 10 cc syringes | SoftCare | 114.104.21 | |
| Alexa Fluor 488-conjugated goat anti-rabbit Secondary Ab | Biotium | 20012 | |
| Anti-phospho-H2A.X (Ser139) | Merck Millipore | 07-164 | |
| ARE Heating Magnetic Stirrer | VELP Scientifica | F20500162 | |
| BD FALCON 5 mL Polystyrene Round-Bottom Tubes | BD Biosciences | 352054 | |
| BD Microlance 3 Needles 27 G - 0.40 x 13 mm | Becton Dickinson | 300635 | |
| Bovine Serum Albumin Fraction V | Roche | 10735078001 | |
| DMSO Anhydrous | Biotium | 90082 | |
| DRAQ7 DNA dye | BioStatus | DR71000 | |
| EGTA | Sigma-Aldrich | E4378-25G | |
| EMSURE MgCl2. 6H2O | Merck Millipore | 1058330250 | |
| Etoposide | CHEMIPHARM | L01CB01 | |
| FALCON 14 mL Polystyrene Round-Bottom Tubes | Corning Science | 532057 | |
| FALCON Tissue Culture Dishes, Easy-Grip, 35 x 10 mm Style | Corning Science | 353001 | |
| Glass Bottom Culture Dishes (35 mm Petri dish/ 14 mm Microwell, No. 0 coverglass) | MatTek Corporation | P35G-0-14-C | |
| HEPES | Sigma-Aldrich | H6147-25G | |
| HERACELL 150i CO2 Incubator | ThermoFisher Scientific | 50116048 | |
| IBMX powder | Sigma-Aldrich | I5879-100MG | |
| Leica M125 Stereo Microscope | Leica Microsystems | ||
| M16 Medium | Sigma-Aldrich | M7292 | |
| M2 Medium | Sigma-Aldrich | M7167 | |
| Mineral Oil | Sigma-Aldrich | M5310 | |
| NaN3 | Honeywell | 13412H | |
| NaOH | Merck Millipore | 1064981000 | |
| Nikon AX ECLIPSE Ti2 Confocal Microscope | Nikon Corporation | ||
| Nikon SMZ800N Stereo Microscope | Nikon Corporation | ||
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Pasteur pippettes, glass, long form 230 mm | DURAN WHEATON KIMBLE | 357335 | |
| pH/ORP meter | Hanna Instruments Ltd | HI2211 | |
| Phosphate buffered saline tablets | Sigma-Aldrich | P4417-100TAB | |
| PIPES | Sigma-Aldrich | P1851 | |
| PMSG Protein Lyophilised | Genway Biotech (now AVIVA Systems Biology) | GWB-2AE30A (now OPPA01037) | |
| QBD4 Dry block heater | Grant Instruments (Cambridge) Ltd | A25218 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Whatman Puradisc 25 mm 0.2 μm filters | GE Healthcare | 6780-2502 |
참고문헌
- Wang, X., Pepling, M. E. Regulation of meiotic prophase one in mammalian oocytes. Frontiers in Cell and Developmental Biology. 9, 667306(2021).
- Filatov, M., Khramova, Y., Semenova, M. Molecular mechanisms of prophase I meiotic arrest maintenance and meiotic resumption in mammalian oocytes. Reproductive Sciences. 26 (11), 1519-1537 (2019).
- Adhikari, D., et al. Inhibitory phosphorylation of Cdk1 mediates prolonged prophase I arrest in female germ cells and is essential for female reproductive lifespan. Cell Research. 26 (11), 1212-1225 (2016).
- Sun, S. C., Kim, N. H. Molecular mechanisms of asymmetric division in oocytes. Microscopy and Microanalysis. 19 (4), 883-897 (2013).
- Jones, K. T. Mammalian egg activation: From Ca2+ spiking to cell cycle progression. Reproduction. 130 (6), 813-823 (2005).
- Solc, P., Schultz, R. M., Motlik, J. Prophase I arrest and progression to metaphase I in mouse oocytes: comparison of resumption of meiosis and recovery from G2-arrest in somatic cells. Molecular Human Reproduction. 16 (9), 654-664 (2010).
- Parfenov, V., Potchukalina, G., Dudina, L., Kostyuchek, D., Gruzova, M. Human antral follicles: oocyte nucleus and the karyosphere formation (electron microscopic and autoradiographic data). Gamete Research. 22 (2), 219-231 (1989).
- Zuccotti, M., Piccinelli, A., Giorgi Rossi, P., Garagna, S., Redi, C. A. Chromatin organization during mouse oocyte growth. Molecular Reproduction and Development. 41 (4), 479-485 (1995).
- Sun, X., et al. Comprehensive analysis of nonsurrounded nucleolus and surrounded nucleolus oocytes on chromatin accessibility using ATAC-seq. Molecular Reproduction and Development. 90 (2), 87-97 (2023).
- Zuccotti, M., Bellone, M., Longo, F., Redi, C. A., Garagna, S. Fully-mature antral mouse oocytes are transcriptionally silent but their heterochromatin maintains a transcriptional permissive histone acetylation profile. Journal of Assisted Reproduction and Genetics. 28 (12), 1193-1196 (2011).
- Winship, A. L., Stringer, J. M., Liew, S. H., Hutt, K. J. The importance of DNA repair for maintaining oocyte quality in response to anti-cancer treatments, environmental toxins and maternal ageing. Human Reproduction Update. 24 (2), 119-134 (2018).
- Lieber, M. R. The mechanism of human nonhomologous DNA end joining. The Journal of Biological Chemistry. 283 (1), 1-5 (2008).
- Chiruvella, K. K., Liang, Z., Wilson, T. E. Repair of double-strand breaks by end joining. Cold Spring Harbor Perspectives in Biology. 5 (5), 012757(2013).
- Chang, H. H. Y., Pannunzio, N. R., Adachi, N., Lieber, M. R. Non-homologous DNA end joining and alternative pathways to double-strand break repair. Nature Reviews. Molecular Cell Biology. 18 (8), 495-506 (2017).
- Shibata, A., Jeggo, P. A. Roles for the DNA-PK complex and 53BP1 in protecting ends from resection during DNA double-strand break repair. Journal of Radiation Research. 61 (5), 718-726 (2020).
- Mohiuddin, I. S., Kang, M. H. DNA-PK as an emerging therapeutic target in cancer. Frontiers in Oncology. 9, 635(2019).
- Marangos, P., Carroll, J. Oocytes progress beyond prophase in the presence of DNA damage. Current Biology. 22 (11), 989-994 (2012).
- Paull, T. T., et al. A critical role for histone H2AX in recruitment of repair factors to nuclear foci after DNA damage. Current Biology. 10 (15), 886-895 (2000).
- Bakkenist, C. J., Kastan, M. B. DNA damage activates ATM through intermolecular autophosphorylation and dimer dissociation. Nature. 421 (6922), 499-506 (2003).
- Marangos, P., et al. DNA damage-induced metaphase I arrest is mediated by the spindle assembly checkpoint and maternal age. Nature Communications. 6, 8706(2015).
- Lavrentyeva, E. A., Shishova, K. V., Zatsepina, O. V. Differences in nuclear dynamics in mouse GV oocytes with a diverse chromatin configuration. Biology Bulletin Russian Academy of Sciences. 46, 332-341 (2019).
- Montecucco, A., Zanetta, F., Biamonti, G. Molecular mechanisms of etoposide. EXCLI Journal. 14, 95-108 (1998).
- Mayer, A., et al. DNA damage response during mouse oocyte maturation. Cell Cycle. 15 (4), 546-558 (2016).
- Olive, P., Banáth, J. The comet assay: A method to measure DNA damage in individual cells. Nature Protocols. 1, 23-29 (2006).
- Wu, D., Dean, J. EXOSC10 sculpts the transcriptome during the growth-to-maturation transition in mouse oocytes. Nucleic Acids Research. 48 (10), 5349-5365 (2020).
- Simon, L., Emery, B., Carrell, D. DNA damage: COMET assay. Manual of Sperm Function Testing in Human Assisted Reproduction. Agarwal, A., Henkel, R., Majzoub, A. , 202-212 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유