Method Article
检测小鼠卵母细胞中的DNA双链断裂
摘要
保持卵母细胞基因组的完整性对于确保所得胚胎的遗传保真度是必要的。在这里,我们提出了一种用于检测哺乳动物雌性生殖细胞中DNA双链断裂的准确方案。
摘要
卵母细胞是女性体内最大和最长寿的细胞之一。它们在胚胎发育过程中在卵巢中形成,并在减数分裂I期保持停滞。静止状态可能持续数年,直到卵母细胞受到刺激生长并获得恢复减数分裂的能力。这种长期的停滞状态使它们极易受到累积DNA损伤的侮辱,这会影响雌配子的遗传完整性,从而影响未来胚胎的遗传完整性。
因此,开发一种准确的DNA损伤检测方法至关重要,这是建立DNA损伤反应机制的第一步。本文描述了一种通用方案,用于在20小时内测试前期停滞卵母细胞中DNA损伤的存在和进展。具体来说,我们解剖小鼠卵巢,取回卵丘 - 卵母细胞复合物(COC),从COC中去除卵丘细胞,并将卵母细胞培养在含有3-异丁基-1-甲基黄嘌呤的Μ2培养基中以维持停滞状态。此后,用细胞毒性抗肿瘤药物依托泊苷处理卵母细胞,以产生双链断裂(DSB)。
通过使用免疫荧光和共聚焦显微镜,我们检测和量化核心蛋白γH2AX的水平,这是组蛋白H2AX的磷酸化形式。H2AX在DNA损伤后在DSB的位点磷酸化。卵母细胞DNA损伤后无法恢复DNA完整性会导致不孕症,出生缺陷和自然流产率增加。因此,了解DNA损伤反应机制,同时建立研究这些机制的完整方法对于生殖生物学研究至关重要。
引言
哺乳动物雌性生殖细胞减数分裂的过程在出生前在卵巢中启动。卵母细胞的总数主要在胚胎发生过程中在卵巢中建立。卵母细胞进入减数分裂并在前期I1保持停滞。在青春期开始以及卵泡刺激素(FSH)和促黄体生成素(LH)的产生和内分泌作用后,卵母细胞可能重新启动并完成减数分裂2。在人类中,前期停滞可持续长达50年3。进入减数分裂I后的细胞分裂是不对称的,导致产生小极体和保持其大小的卵母细胞。因此,大多数细胞质成分在早期胚胎发生期间储存在卵质中4。然后,卵母细胞进入减数分裂II,而不改造其细胞核或减薄其染色体,并在中期II保持停滞,直到受精5。
区分卵母细胞和体细胞的一个独特特征是前期I的停滞状态,当卵母细胞具有完整的细胞核(生发囊泡[GV]停滞),称为GV第6期。根据染色质组织,GV期卵母细胞分为两类:非包围核仁(NSN)和包围核仁(SN)7,8。在NSN GV期卵母细胞中,染色质扩散到整个核区,转录活跃,而在SN卵母细胞中,染色质形成围绕核仁的致密环,转录沉默9。两种类型的GV期卵母细胞均显示出减数分裂能力;它们以相同的速率进入减数分裂,但NSN卵母细胞的发育能力低下,不能发育超过双细胞阶段胚胎10。
I期停滞的长期状态增加了DNA损伤积累的发生率11。因此,卵母细胞中的DNA损伤反应机制对于允许产生具有遗传完整性的配子并确保所得胚胎具有生理染色体含量至关重要。
DNA损伤反应的一个核心方面是DNA修复。真核细胞中DSB修复的主要途径包括非同源末端连接(NHEJ),同源重组(HR)和替代NHEJ12,13,14,15。NHEJ 是一种更快但更容易出错的机制,而 HR 需要更多时间才能完成,但具有高保真度16。
关于卵母细胞用于DNA损伤修复的机制没有足够的知识。研究表明,通过使用基因毒性药物(如依托泊苷、多柔比星或 UVB 或电离辐射)诱导的完全生长的哺乳动物卵母细胞中的 DNA 损伤不会影响第一阶段停滞退出的时间和速率17。即使在损伤水平升高的情况下,卵母细胞也会经历GV分解(GVBD)。这种损伤可以通过观察γH2AX来确定。这种磷酸化形式的H2AX(γΗ2ΑΧ)是一种DSB标记,它位于断裂部位,并作为支架帮助修复因子和蛋白质在断裂端积累18。
DNA损伤后没有细胞周期停滞是由于DNA损伤检查点不足,允许具有未修复DNA的卵母细胞重新进入减数分裂。在高水平的DNA损伤之后,检查点可以通过激活ATM / Chk1依赖性途径来维持前期停滞。对DSB的有限检查点响应是由于ATM17,19的激活有限。在减数分裂I的M期,研究表明DNA损伤可能会激活纺锤体组装检查点(SAC)诱导的减数分裂I检查点,从而阻止E3泛素连接酶促进复合物/环小体(APC/C)的激活,从而阻止M期退出。此外,SAC蛋白的消融克服了M期停滞的状态,从而强调了SAC在减数分裂I chekpoint20建立中的重要性。
正如先前的研究清楚地表明的那样,DSB不能在小鼠卵母细胞中诱导强大的前期检查点。如果这种损伤得不到修复,可能会导致胚胎携带染色体异常。因此,研究雌配子发生不同阶段的DNA损伤反应非常重要,以更好地了解卵母细胞用来应对潜在遗传损伤的独特途径。
研究方案
所有小鼠实验均由地方当局(希腊约阿尼纳地区)批准,并按照欧洲共同体理事会指令2010/63 / EU进行。对3R的原理进行了实验。用于实验的所有CD-1小鼠都保存在希腊约阿尼纳大学的动物舍设施中,在一个温度(22°C)和湿度(60%)受控的 房间里,并随意喂食。动物舍拥有经营育种(EL33-BIObr01)、供应(EL33-BIOup01)和实验设施(EL33BIO-exp01)的许可证。
1. 试剂的制备
- 将3-异丁基-1-甲基黄嘌呤(IBMX)粉末(见材料表)在二甲基亚砜(DMSO)(见材料表)中稀释至200mM的最终浓度。μake 10 μL 等分试样,并储存在 −20 °C。 在 1 个月内使用该解决方案。
注意:IBMX 粉末保持在 −20 °C。 - 准备所有免疫荧光缓冲液,并将其储存在4°C。
- 通过在 200 mL ddH2Ο 中稀释一片 PBS 片剂(参见材料表)来制备无菌磷酸盐缓冲盐水 (PBS)。
- 通过加入 80 mL ddH2Ο、0.59575 g HEPES、1.81422 g PIPES、0.38035 g EGTA 和 0.04066 g MgCl2(参见材料表)同时用磁力搅拌器搅拌(参见材料表)制备 PHEM 缓冲液,并同时加入 NaOH(参见材料表)直至 pH 值达到 6.9(使用 pH/ORP 计检查 [参见材料表])。然后,将 ddH2Ο 加入到 100 mL 的最终体积中。
- 通过在PHEM缓冲液中稀释PFA粉末(参见材料表)来制备多聚甲醛-Triton-X-100(PFA-Tx-100)缓冲液,同时用磁力搅拌器在加热下以4%PFA的终浓度搅拌。然后,使用注射器和0.2μm过滤器过滤缓冲液(参见材料表),并加入0.5%Tx-100(参见材料表)。准备大约 10 mL 的 PFA-Tx-100(0.4 g PFA,50 μL Tx-100),足以进行一次实验。将其储存在4°C最多1周。
注意:戴手套处理PFA,避免接触皮肤和眼睛。 - 通过在PBS中加入牛血清白蛋白(终浓度:0.5%w / v BSA)(参见材料表)来制备洗涤缓冲液,并机械搅拌。以 1:1,000 稀释度加入 10% w/v NaN3 缓冲液(叠氮化钠),以最大限度地降低真菌和细菌污染的风险。通过将 1 g NaN 3 粉末(参见材料表)加入 10 mL ddH2O 中,制成 10% w/v NaN3 缓冲液;将NaN3缓冲液储存在室温下。
- 通过在PBS中加入BSA(终浓度:3%w / v)并机械搅拌来制备封闭缓冲液。以1:1,000稀释度加入10%NaN3 缓冲液。
2. 从解剖卵巢中收集GV卵母细胞并诱导DSB
注意:所有工具和溶液都应无菌。卵母细胞处理是在体视显微镜下使用口移液管进行的(参见材料表),所有液滴都用矿物油覆盖(参见材料表和图1E)。
- 腹膜内注射小鼠7国际单位(IU)的妊娠母马血清促性腺激素(PMSG)(参见 材料表)46-48小时,然后通过颈椎脱位淘汰小鼠。
注意:所有使用的小鼠应为8-12周大。 - 用注射器和0.2μm过滤器过滤M2培养基(参见材料表),并在14mL圆底管(参见材料表)中加入IBMX 200mM至终浓度200μM,以保持卵母细胞在前期I时停滞。然后,在塑料组织培养皿中制备M2-IBMX培养基滴(参见材料表),并将其置于37°C的热块(参见材料表)上至少30分钟,然后卵母细胞分离。将M2储存在4°C。
- 通过颈椎脱位处死小鼠,解剖卵巢,并用M2-IBMX将它们放入5mL圆底管(参见 材料表)中。
- 将卵巢转移到含有 1.5 mL M2-IBMX 的塑料盖上,去除任何卵巢周围脂肪组织或输卵管段,并通过用 27 G 针对卵巢进行机械穿孔来释放 COC(参见材料表和图 1A-C)。
- 将COC转移到带有M2-IBMX(每滴约25-30μL)的培养皿中,并使用窄口径玻璃巴斯德移液管重复移液去除卵丘细胞(参见 材料表 和 图1D)。
- 选择SN GV阶段卵母细胞,并将它们转移到M2-IBMX培养基的滴(25μL)中,置于37°C避光的热块上(图1F)。
- 寻找SN卵母细胞,基于其较大的尺寸和中心位置的细胞核与NSN卵母细胞相比,NSN卵母细胞的细胞核位于外围21。无论如何,在对GV卵母细胞类型(SN或NSN)做出最终决定之前,请在共聚焦显微镜下观察DNA构型。
- 使用依托泊苷诱导DSB(参见 材料表)。将GV期卵母细胞置于基因毒性剂的滴剂(每滴25μL)中1小时,在黑暗条件下于37°C的热块上。
注意:依托泊苷是一种拓扑异构酶II抑制剂,可将DSB引入DNA22。将依托泊苷保持在室温下避光的 10 μL 等分试样 20 mg/mL。已测试的浓度为 5 μg/mL、20 μg/mL 和 50 μg/mL。 - 为了长时间保持GV期卵母细胞的停滞,将卵母细胞置于补充有400μM IBMX的培养箱中的M16培养基(参见材料表)中,在37°C和5%CO2。将M16储存在4°C,用注射器和0.2μm过滤器过滤培养基,并在使用前孵育至少1小时。
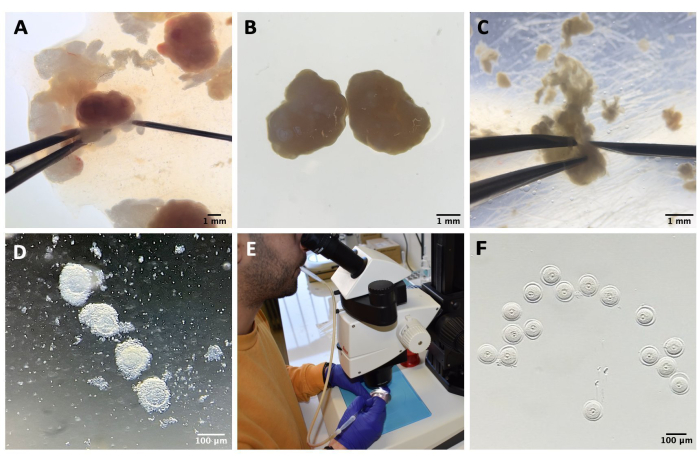
图1:卵母细胞分离过程 。 (A)用IBMX从M2培养基中的卵巢中去除卵巢周围脂肪组织和剩余的输卵管段。通过体视显微镜目镜获得的照片。比例尺 = 1 mm。 (B) 使用 IBMX 在 M2 培养基中分离的卵巢。通过体视显微镜目镜获得的图像。比例尺 = 1 mm。 (C) 在 M2 培养基中使用 27 G 针对卵巢进行机械穿孔,并带有 IBMX。通过体视显微镜目镜获得的图像。比例尺 = 1 mm. (D) 用 IBM mx 在 M2 培养基中穿孔后从卵巢释放的 COC。通过体视显微镜目镜获得的图像。比例尺= 100μm。 (E)使用口腔移液管收集卵母细胞。(F)去除周围卵丘细胞后,在M2培养基中用IBMX剥落的卵母细胞。通过体视显微镜目镜获得的图像。比例尺 = 100 μm。 请点击此处查看此图的大图。
3.卵母细胞固定和免疫荧光
注意:卵母细胞处理是在体视显微镜下使用口移液管进行的,所有滴剂都用矿物油覆盖。
- 将对照和依托泊苷处理的GV卵母细胞置于带有PFA-Tx-100缓冲液的不同塑料组织培养皿中,在室温下放置40分钟。
- 在室温下在三滴不同的洗涤缓冲液(每滴 50 μL)中洗涤卵母细胞。每滴离开卵母细胞5分钟。
- 将卵母细胞置于封闭缓冲液滴(每个25μL)中1小时,置于37°C的热块上。
- 制备识别γH2AX(兔磷酸化-Η2ΑΧ)(Ser139)的一抗(参见 材料表)(储备溶液:1 mg / mL)。在封闭缓冲液中使用1:200稀释度,并将卵母细胞置于4°C的一抗滴(每个15μL)中过夜。
注意:磷酸化-Η2ΑΧ(γH2AX)是检测体细胞和GV卵母细胞18,23中的DSB的常见标志物。 - 第二天,在室温下在三滴不同的洗涤缓冲液(每滴 50 μL)中洗涤卵母细胞。每滴离开卵母细胞5分钟。
- 制备二抗Alexa Fluor 488偶联山羊抗兔(见 材料表)(储备溶液:2 mg / mL)。在封闭缓冲液中使用1:200稀释液,并将卵母细胞置于三7°C避光的热块上,将卵母细胞滴在二抗滴(每个15μL)中1小时。
- 将卵母细胞转移到DRAQ7滴(每滴25μL)(储备溶液:0.3mM;参见 材料表)中,这是一种远红色荧光DNA染料,仅对透化细胞中的DNA进行染色。在黑暗条件下,在室温下在洗涤缓冲液中使用1:250稀释10分钟。
- 在室温下在三滴不同的洗涤缓冲液(每滴 50 μL)中洗涤卵母细胞。在每滴中放置它们5分钟,然后将它们转移到35mm玻璃底培养皿(参见 材料表)中的小滴(每滴约5μL)洗涤缓冲液中进行共聚焦显微镜检查(图2A)。
注意:DNA染色剂和二抗的洗涤同时进行。
4. 共聚焦显微镜
注意:应立即进行共聚焦显微镜检查,以避免将卵母细胞放置在玻璃底培养皿中后荧光强度降低。需要使用带有电动载物台的共聚焦显微镜(参见 材料表)。
- 显微镜设置
- 在共聚焦系统中,打开激光控制器、激光器、显微镜控制器、透射光灯和 PC(图 2B、D)。
- 打开共聚焦软件,然后选择 40倍油性镜头。
- 将培养皿放入标本支架中,并尝试通过使用操纵杆在XY和Z轴上移动载物台来聚焦卵母细胞(图2C)。
- 卵母细胞扫描
- 为每个实验单独设置 激光功率、 增益和 针孔尺寸 ,以最小化任何饱和度。
- 对于每个卵母细胞,设置感兴趣的区域,特别是在DNA区域的细胞核中。定义DNA区域的边界,并将 z步长 调整为 3μm。然后,开始扫描。
- 将每个单元格的图像保存在所选文件夹中。
- 扫描完成后,退出软件,关闭计算机,然后关闭激光控制器、激光器、显微镜控制器和透射光灯。
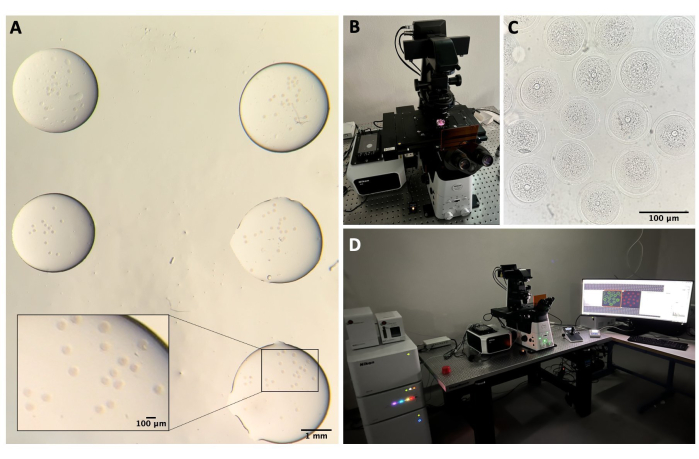
图2:共聚焦显微镜 。 (A)在进行免疫荧光方案和DNA染色后固定卵母细胞,将其置于单独的洗涤缓冲液滴中,用矿物油覆盖,置于玻璃底培养皿中,并准备用于共聚焦显微镜成像。每滴包含不同的实验类别。通过体视显微镜目镜获得的图像。比例尺 = 1 mm/100 μm 对于放大部分。(B)放置在共聚焦显微镜载物台上的玻璃底板。(C)通过共聚焦显微镜获得的卵母细胞的明场图像。比例尺 = 100 μm。 (D) 共聚焦显微镜系统。 请点击此处查看此图的大图。
5. 成像分析
- 在浏览器(https://imagej.net/software/fiji/downloads)中下载斐济ImageJ-win64,打开它,然后将数据导入为TIFF堆栈文件。
注意:分别打开每个卵母细胞文件。 - 点击 图片 |颜色 | 拆分频道以拆分所有频道。
- 单击 LUT(查找表),然后为每个通道选择首选颜色。
- 点击 图片 |颜色 |合并通道以合并 γΗ2ΑΧ和DNA的通道。保持明场通道不合并。
- 在NSN卵母细胞和DNA损伤水平低的SN卵母细胞中,γΗ2ΑΧ被检测为DNA区域的病灶。在这种情况下,单击 “多点”或点 命令,然后选择与DNA重合的每个γΗ2ΑΧ焦点。对所有堆栈重复此步骤。
- 在具有高水平DNA损伤的SN卵母细胞中,γΗ2ΑΧ信号分布在整个DNA区域。在这种情况下,请单击 “图像 |堆栈 |Z投影,然后使用 “手绘选择 ”命令选择整个DNA区域。
- 要测量 γΗ2ΑΧ 荧光,请单击 “分析”|”测量,并将测量复制到.xlsx文件中。然后,计算平均荧光,归一化值,并在创建任何图形之前计算焦点数。
- 点击 “分析”|” 设置“缩放”以设置比例,然后在 “分析”|”工具 |比例 尺,用于向通道添加比例尺。
结果
使用此处演示的程序,解剖小鼠卵巢,去除脂肪,并收集完全生长的GV期卵母细胞。然后,通过使用窄移液管重复移液除去卵丘细胞,并将其置于新鲜的M2-IBMX培养基中,并在热块(37°C)上用矿物油覆盖(图1A-F)。使用20 mg/mL的依托泊苷储备浓度制备了三种不同的依托泊苷浓度(5 μg/mL、20 μg/mL和50 μg/mL)。将GV期卵母细胞以三种不同的依托泊苷浓度置于覆盖有矿物油的滴剂中1小时,并在37°C下避光。 然后遵循免疫荧光方案,如方案部分详细描述的那样,并将卵母细胞置于玻璃底培养皿中并通过共聚焦显微镜观察(图2)。
在SN GV期卵母细胞中,DNA损伤后,γH2AX的存在在所有依托泊苷浓度(5μg/mL,20μg/mL和50μg/ mL)下立即增加,并且γH2AX分布在整个DNA区域(图3)。通过观察DNA位点的γH2AX荧光强度进行DSB定量和估计。γH2AX荧光随依托泊苷浓度的增加而成比例增强。此外,在长时间的前期停滞(依托泊苷治疗后20小时)后,GV期卵母细胞显示出降低γH2AX病灶数和强度的能力,这意味着GV期停滞的卵母细胞中存在积极的修复过程(图3E)。
与 SN 卵母细胞不同,其中 γH2AX 荧光通过 DNA 分布,在 NSN 卵母细胞中,γH2AX 在用依托泊苷处理后立即以 20 μg/mL 显示在病灶中。我们估计了与DNA区域重合的病灶数量,计算了每个焦点的荧光,并呈现了所有卵母细胞的平均荧光。荧光和病灶数量在两种卵母细胞类别之间均显示出统计学上的显着差异(图4)。
共聚焦显微镜提供了不同Z堆栈中病灶的数量和强度的信息,从而有助于识别DNA损伤的存在和不同时间点的修复动力学。电流扫描提供低背景的精确扫描和更好的扫描图像分析。
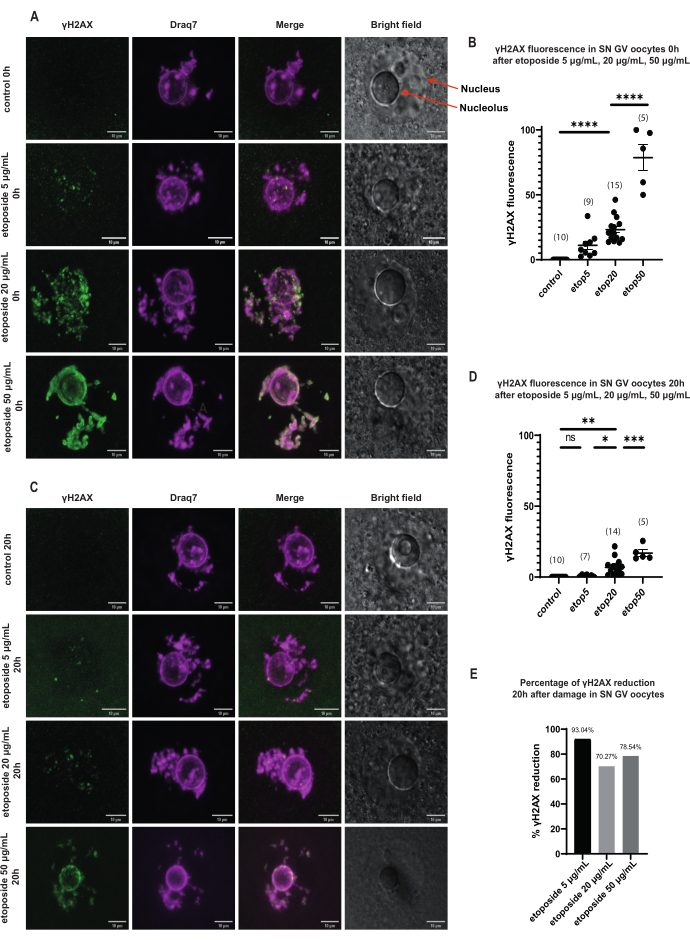
图 3:在长期 GV 停滞后,用三种不同依托泊苷浓度处理的 SN GV 期卵母细胞中 γH 2 AX 的降低。 (A) 依托泊苷治疗后 0 小时 SN GV 期卵母细胞中的 γH2AX 荧光。在所有依托泊苷浓度下,暴露后γH2AX立即增加,并且增加是浓度依赖性的(绿色:γΗ2ΑΧ,品红色:DNA)。图像是Z-stack投影,并且已使用Fiji / ImageJ为每个通道调整了亮度/对比度。比例尺 = 10 μm。 (B)用不同依托泊苷浓度处理后0小时SN GV期卵母细胞中的γH 2AX荧光图。数据表示平均± SEM。每个点代表一个卵母细胞(卵母细胞的数量如图所示),(ns = 不显著,** p < 0.005,** ** p < 0.0001,单因素方差分析与 Tukey 多重比较检验)。(C)依托泊苷处理后20小时SN GV期卵母细胞中的γH2AX荧光。γH 2AX在所有依托泊苷浓度下暴露20小时后减少(绿色:γΗ2ΑΧ,品红色:DNA)。图像是Z-stack投影,并且已使用Fiji / ImageJ为每个通道调整了亮度/对比度。比例尺= 10μm。 (D)用不同的依托泊苷浓度处理20小时后SN GV期卵母细胞中的γH 2AX荧光图。数据表示平均± SEM。每个点代表一个卵母细胞(卵母细胞数量如图所示),(ns = 不显著,* p < 0.05,** p < 0.005,*** p < 0.0005,**** p < 0.0001,单因素方差 分析与 Tukey 多重比较检验)。(E)依托泊苷处理的卵母细胞前期停滞后SN GV期卵母细胞中γH2AX荧光降低的条形图。每列上方的数字表示γH2AX荧光下降的百分比。请点击此处查看此图的大图。
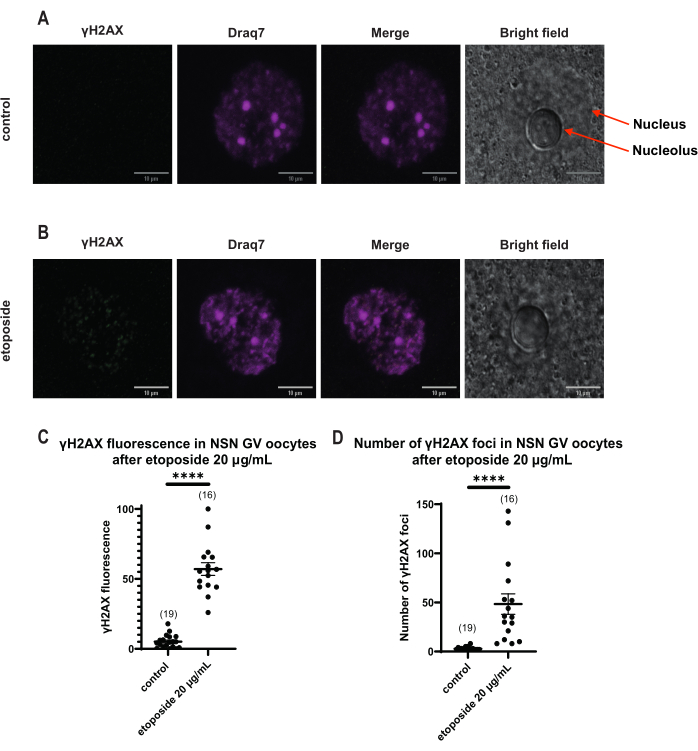
图 4:用依托泊苷以 20 μg/mL 处理后 NSN GV 期卵母细胞中 Η2ΑΧ 的磷酸化。 (A)一个对照NSN GV阶段卵母细胞的代表性共聚焦图像(绿色:γΗ2ΑΧ,品红色:DNA)。图像是Z-stack投影,并且已使用Fiji / ImageJ为每个通道调整了亮度/对比度。比例尺 = 10 μm。 (B) 一个依托泊苷处理的 NSN GV 期卵母细胞(绿色:γΗ2ΑΧ,洋红色:DNA)的代表性共聚焦图像。卵母细胞在依托泊苷治疗后0 h固定。图像是Z-stack投影,并且已使用Fiji / ImageJ为每个通道调整了亮度/对比度。比例尺 = 10 μm。 (C) 20 μg/mL 依托泊苷处理后 NSN GV 期卵母细胞中的归一化 γΗ2ΑΧ 荧光。数据表示平均± SEM。每个点代表一个卵母细胞(卵母细胞的数量如图所示),取自两个独立实验(**** p < 0.0001,未配对非参数 t检验,曼-惠特尼 U检验)。 (D)20μg/mL依托泊苷处理后NSN GV期卵母细胞中γΗ2ΑΧ病灶的数量。数据表示平均± SEM。每个点代表一个卵母细胞(卵母细胞的数量如图所示),取自两个独立实验(**** p < 0.0001,不成对非参数 t检验,曼-惠特尼 U检验)。 请点击此处查看此图的大图。
讨论
通过使用这里描述的方法,我们在哺乳动物卵母细胞中检测了DSB。该方法允许检测和研究卵母细胞中的DNA修复过程。相同的协议也可用于分析参与哺乳动物卵母细胞生理过程的其他蛋白质。重要的是要研究卵母细胞如何对潜在的DNA损伤做出反应,以便更好地了解人类女性生育力低下的原因。
由于卵母细胞的敏感性,研究哺乳动物卵母细胞的DNA损伤反应可能具有挑战性。卵母细胞处理需要特定的温度和 CO2 和 O2 浓度。同时,必须保护卵母细胞免受光照。αll处理应使用不窄的玻璃移液器来完成,因为这可能对卵母细胞有害,但也不要宽,因为这可能导致培养基稀释,从而对固定过程产生负面影响。在固定的每个步骤中,使用几滴缓冲液以尽量减少稀释效果。观察DSB的另一种方法是彗星测定24。尽管这种技术更敏感,但它更复杂。同时,通过使用Comet测定,不可能检测到发生损伤的确切DNA区域,并且在具有丰富RNA分子的细胞中,如GV期卵母细胞25,背景可能会增加,导致错误的DNA损伤信号26。
通过使用此处描述的免疫荧光方案,我们可以准确地检测DSB并估计GV期卵母细胞的修复进度,如γH2AX荧光随时间的减少所示。然而,该方法的一个局限性是某些抗体可能在整个卵质中呈现非特异性分布,从而导致具有高背景荧光的图像。使用PFA-Tx-100缓冲液代替顺序PFA和Tx-100,因为我们观察到它通过允许检测较少的背景和非特异性荧光来改善固定过程。使用 γH2AX 进行 DSB 检测的第二个限制是,由于 γH2AX 在减数分裂23 中的自发磷酸化,无法估计 GVBD 后的损伤。
在该免疫荧光方案中,卵母细胞保留在液体缓冲液中,不能储存在载玻片中。这一事实使得在添加二抗后难以将固定细胞保存数天。为了获得高质量的图像并且不丢失信号,最好在加入二抗后的几个小时内进行成像。还应该注意的是,通过Z轴扫描细胞核可能会由于过度曝光而使信号变弱。因此,最好降低激光功率并提高扫描速度。
最后,免疫荧光方案的另一个限制是它只能用于固定/非活细胞。因此,我们只能估计特定时间点存在和不存在的因素,而不知道它们的浓度是否有任何波动或它们的行为是否随时间变化。这个问题可以通过使用活细胞成像和荧光标记标记物来克服。
披露声明
作者没有利益冲突。
致谢
我们感谢“在生物医学研究中建立'能力建设'基础设施(BIOMED-20)”(MIS 5047236)项目对这项工作的支持,该项目是在“加强研究和创新基础设施”行动下实施的,由“竞争力、创业和创新”业务计划(NSRF 2014-2020)资助,由希腊和欧盟(欧洲区域发展基金)共同资助。
材料
| Name | Company | Catalog Number | Comments |
| 3 mL Pasteur pipettes in LDPE, graduated | APTACA | 1502 | |
| 10 cc syringes | SoftCare | 114.104.21 | |
| Alexa Fluor 488-conjugated goat anti-rabbit Secondary Ab | Biotium | 20012 | |
| Anti-phospho-H2A.X (Ser139) | Merck Millipore | 07-164 | |
| ARE Heating Magnetic Stirrer | VELP Scientifica | F20500162 | |
| BD FALCON 5 mL Polystyrene Round-Bottom Tubes | BD Biosciences | 352054 | |
| BD Microlance 3 Needles 27 G - 0.40 x 13 mm | Becton Dickinson | 300635 | |
| Bovine Serum Albumin Fraction V | Roche | 10735078001 | |
| DMSO Anhydrous | Biotium | 90082 | |
| DRAQ7 DNA dye | BioStatus | DR71000 | |
| EGTA | Sigma-Aldrich | E4378-25G | |
| EMSURE MgCl2. 6H2O | Merck Millipore | 1058330250 | |
| Etoposide | CHEMIPHARM | L01CB01 | |
| FALCON 14 mL Polystyrene Round-Bottom Tubes | Corning Science | 532057 | |
| FALCON Tissue Culture Dishes, Easy-Grip, 35 x 10 mm Style | Corning Science | 353001 | |
| Glass Bottom Culture Dishes (35 mm Petri dish/ 14 mm Microwell, No. 0 coverglass) | MatTek Corporation | P35G-0-14-C | |
| HEPES | Sigma-Aldrich | H6147-25G | |
| HERACELL 150i CO2 Incubator | ThermoFisher Scientific | 50116048 | |
| IBMX powder | Sigma-Aldrich | I5879-100MG | |
| Leica M125 Stereo Microscope | Leica Microsystems | ||
| M16 Medium | Sigma-Aldrich | M7292 | |
| M2 Medium | Sigma-Aldrich | M7167 | |
| Mineral Oil | Sigma-Aldrich | M5310 | |
| NaN3 | Honeywell | 13412H | |
| NaOH | Merck Millipore | 1064981000 | |
| Nikon AX ECLIPSE Ti2 Confocal Microscope | Nikon Corporation | ||
| Nikon SMZ800N Stereo Microscope | Nikon Corporation | ||
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Pasteur pippettes, glass, long form 230 mm | DURAN WHEATON KIMBLE | 357335 | |
| pH/ORP meter | Hanna Instruments Ltd | HI2211 | |
| Phosphate buffered saline tablets | Sigma-Aldrich | P4417-100TAB | |
| PIPES | Sigma-Aldrich | P1851 | |
| PMSG Protein Lyophilised | Genway Biotech (now AVIVA Systems Biology) | GWB-2AE30A (now OPPA01037) | |
| QBD4 Dry block heater | Grant Instruments (Cambridge) Ltd | A25218 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Whatman Puradisc 25 mm 0.2 μm filters | GE Healthcare | 6780-2502 |
参考文献
- Wang, X., Pepling, M. E. Regulation of meiotic prophase one in mammalian oocytes. Frontiers in Cell and Developmental Biology. 9, 667306(2021).
- Filatov, M., Khramova, Y., Semenova, M. Molecular mechanisms of prophase I meiotic arrest maintenance and meiotic resumption in mammalian oocytes. Reproductive Sciences. 26 (11), 1519-1537 (2019).
- Adhikari, D., et al. Inhibitory phosphorylation of Cdk1 mediates prolonged prophase I arrest in female germ cells and is essential for female reproductive lifespan. Cell Research. 26 (11), 1212-1225 (2016).
- Sun, S. C., Kim, N. H. Molecular mechanisms of asymmetric division in oocytes. Microscopy and Microanalysis. 19 (4), 883-897 (2013).
- Jones, K. T. Mammalian egg activation: From Ca2+ spiking to cell cycle progression. Reproduction. 130 (6), 813-823 (2005).
- Solc, P., Schultz, R. M., Motlik, J. Prophase I arrest and progression to metaphase I in mouse oocytes: comparison of resumption of meiosis and recovery from G2-arrest in somatic cells. Molecular Human Reproduction. 16 (9), 654-664 (2010).
- Parfenov, V., Potchukalina, G., Dudina, L., Kostyuchek, D., Gruzova, M. Human antral follicles: oocyte nucleus and the karyosphere formation (electron microscopic and autoradiographic data). Gamete Research. 22 (2), 219-231 (1989).
- Zuccotti, M., Piccinelli, A., Giorgi Rossi, P., Garagna, S., Redi, C. A. Chromatin organization during mouse oocyte growth. Molecular Reproduction and Development. 41 (4), 479-485 (1995).
- Sun, X., et al. Comprehensive analysis of nonsurrounded nucleolus and surrounded nucleolus oocytes on chromatin accessibility using ATAC-seq. Molecular Reproduction and Development. 90 (2), 87-97 (2023).
- Zuccotti, M., Bellone, M., Longo, F., Redi, C. A., Garagna, S. Fully-mature antral mouse oocytes are transcriptionally silent but their heterochromatin maintains a transcriptional permissive histone acetylation profile. Journal of Assisted Reproduction and Genetics. 28 (12), 1193-1196 (2011).
- Winship, A. L., Stringer, J. M., Liew, S. H., Hutt, K. J. The importance of DNA repair for maintaining oocyte quality in response to anti-cancer treatments, environmental toxins and maternal ageing. Human Reproduction Update. 24 (2), 119-134 (2018).
- Lieber, M. R. The mechanism of human nonhomologous DNA end joining. The Journal of Biological Chemistry. 283 (1), 1-5 (2008).
- Chiruvella, K. K., Liang, Z., Wilson, T. E. Repair of double-strand breaks by end joining. Cold Spring Harbor Perspectives in Biology. 5 (5), 012757(2013).
- Chang, H. H. Y., Pannunzio, N. R., Adachi, N., Lieber, M. R. Non-homologous DNA end joining and alternative pathways to double-strand break repair. Nature Reviews. Molecular Cell Biology. 18 (8), 495-506 (2017).
- Shibata, A., Jeggo, P. A. Roles for the DNA-PK complex and 53BP1 in protecting ends from resection during DNA double-strand break repair. Journal of Radiation Research. 61 (5), 718-726 (2020).
- Mohiuddin, I. S., Kang, M. H. DNA-PK as an emerging therapeutic target in cancer. Frontiers in Oncology. 9, 635(2019).
- Marangos, P., Carroll, J. Oocytes progress beyond prophase in the presence of DNA damage. Current Biology. 22 (11), 989-994 (2012).
- Paull, T. T., et al. A critical role for histone H2AX in recruitment of repair factors to nuclear foci after DNA damage. Current Biology. 10 (15), 886-895 (2000).
- Bakkenist, C. J., Kastan, M. B. DNA damage activates ATM through intermolecular autophosphorylation and dimer dissociation. Nature. 421 (6922), 499-506 (2003).
- Marangos, P., et al. DNA damage-induced metaphase I arrest is mediated by the spindle assembly checkpoint and maternal age. Nature Communications. 6, 8706(2015).
- Lavrentyeva, E. A., Shishova, K. V., Zatsepina, O. V. Differences in nuclear dynamics in mouse GV oocytes with a diverse chromatin configuration. Biology Bulletin Russian Academy of Sciences. 46, 332-341 (2019).
- Montecucco, A., Zanetta, F., Biamonti, G. Molecular mechanisms of etoposide. EXCLI Journal. 14, 95-108 (1998).
- Mayer, A., et al. DNA damage response during mouse oocyte maturation. Cell Cycle. 15 (4), 546-558 (2016).
- Olive, P., Banáth, J. The comet assay: A method to measure DNA damage in individual cells. Nature Protocols. 1, 23-29 (2006).
- Wu, D., Dean, J. EXOSC10 sculpts the transcriptome during the growth-to-maturation transition in mouse oocytes. Nucleic Acids Research. 48 (10), 5349-5365 (2020).
- Simon, L., Emery, B., Carrell, D. DNA damage: COMET assay. Manual of Sperm Function Testing in Human Assisted Reproduction. Agarwal, A., Henkel, R., Majzoub, A. , 202-212 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。