Method Article
تصوير الكالسيوم في شبكية العين المسطحة المحفزة كهربائيا
In This Article
Summary
الأطراف الاصطناعية للشبكية لديها القدرة على توليد تصورات بصرية. للمضي قدما في تطوير أطراف اصطناعية جديدة ، هناك حاجة إلى طرق خارج الجسم الحي لاختبار الأجهزة قبل الزرع. تقدم هذه المقالة بروتوكولا شاملا لدراسة نشاط الكالسيوم في طبقة خلايا العقدة الشبكية عند تعرضها للتحفيز الكهربائي.
Abstract
ضمور الشبكية هو السبب الرئيسي للعمى في جميع أنحاء العالم. تبذل جهود مكثفة لتطوير أطراف اصطناعية متقدمة للشبكية يمكنها تجاوز خلايا مستقبلات الضوء الضعيفة في شبكية العين المتدهورة ، بهدف استعادة الرؤية جزئيا عن طريق تحفيز الإدراك البصري. تتضمن إحدى الطرق الشائعة للتحقيق تصميم وإنتاج أجهزة قابلة للزرع ذات بنية مادية مرنة ، تحتوي على عدد كبير من الأقطاب الكهربائية. وهذا يتيح توليد الإدراك البصري بكفاءة ودقة. ومع ذلك ، مع كل تقدم تكنولوجي ، تنشأ حاجة إلى طريقة خارج الجسم الحي موثوقة ويمكن التحكم فيها للتحقق من وظائف الجهاز قبل التقدم إلى التجارب في الجسم الحي ، حيث تلعب عوامل تتجاوز أداء الجهاز. تقدم هذه المقالة بروتوكولا شاملا لدراسة نشاط الكالسيوم في طبقة خلايا العقدة الشبكية (GCL) بعد التحفيز الكهربائي. على وجه التحديد ، يتم تحديد الخطوات التالية: (1) وضع علامات فلورية على شبكية العين باستخدام مؤشرات الكالسيوم المشفرة وراثيا ، (2) التقاط إشارة التألق باستخدام مجهر مضان مقلوب أثناء تطبيق أنماط مميزة من التحفيز الكهربائي ، و (3) استخراج وتحليل آثار الكالسيوم من الخلايا الفردية داخل GCL. باتباع هذا الإجراء ، يمكن للباحثين اختبار بروتوكولات التحفيز الجديدة بكفاءة قبل إجراء التجارب في الجسم الحي .
Introduction
تحتوي شبكية العين على مستقبلات ضوئية ، وهي خلايا مسؤولة عن استشعار الضوء. يلتقطون الفوتونات ويحولونها إلى نبضات عصبية. ثم تتم معالجة هذه النبضات داخل شبكية العين وتنتقل إلى القشرة البصرية ، مما يؤدي إلى تكوين صورة مرئية1. التهاب الشبكية الصباغي (RP) والتنكس البقعي المرتبط بالعمر (AMD) من الأمراض التنكسية التي تتميز بالفقدان التدريجي للمستقبلات الضوئية. تعد اعتلالات الشبكية هذه من بين الأسباب الرئيسية للعمى في جميع أنحاء العالم1 ، حيث تؤثر على ملايين الأفراد ولها عواقب طبية وشخصية واجتماعية واقتصادية كبيرة على المرضى وأنظمة الرعاية الصحية والمجتمع ككل. علاوة على ذلك ، مع شيخوخة السكان ، من المتوقع أن تزداد حالات AMD بنسبة 15٪ بحلول عام 20502.
حاليا ، هناك العديد من الجهود البحثية الجارية لاستعادة الرؤية لدى المرضى المتضررين من هذه الحالات3. أحد الأساليب الواعدة هو استخدام الأطراف الاصطناعية للشبكية ، والتي أثبتت فعاليتها في استعادة الرؤية جزئيا 4,5. تلتقط هذه الأجهزة الضوء من المشهد المرئي وتحوله إلى نبضات كهربائية. يتم تسليم هذه النبضات من خلال أقطاب كهربائية داخل مجموعة أقطاب كهربائية دقيقة (MEA) مزروعة في العين ، مما يحفز الخلايا العصبية الباقية ويتجاوز وظيفة المستقبلات الضوئية المفقودة. تنقل خلايا العقدة الشبكية المنشطة (RGCs) الإخراج إلى الدماغ ، حيث يتم تفسيره على أنه إدراك بصري. ومع ذلك ، فإن القيود الرئيسية للزرع الحالي تكمن في دقة واجهة القطب والأنسجة6 والتحفيز غير الانتقائي لأنواع الخلايا المختلفة. لذلك ، لتحسين تصميم الأجهزة الجديدة القابلة للزرع لاستعادة الرؤية بشكل أكثر كفاءة ، من الأهمية بمكان فهم كيفية تطوير نماذج التحفيز لتنشيط الخلايا بشكل انتقائي على مقربة من الأقطاب الكهربائية.
تصوير الكالسيوم هو تقنية مستخدمة على نطاق واسع لدراسة النشاط العصبي ، وتقدم العديد من المزايا على الطرق غير البصرية 7,8. أولا ، يوفر دقة خلوية ودون خلوية. ثانيا ، يمكن أن تستهدف علامات الكالسيوم أنواعا معينة من الخلايا. ثالثا ، يسمح بالتتبع على المدى الطويل ، ورابعا ، يتيح مراقبة مجموعات الخلايا بأكملها مع التمييز بين الخلايا النشطة وغير النشطة. توفر هذه الطريقة دليلا غير مباشر على النشاط الخلوي بدقة زمنية في حدود مئات المللي ثانية. تخضع مؤشرات الكالسيوم الفلورية المشفرة وراثيا ، مثل مستشعرات GCaMP ، لتغيير مطابق عند الارتباط بالكالسيوم ، مما يؤدي إلى زيادة التألق9. النواقل الفيروسية المرتبطة بالغدي المؤتلف (AAVs) هي وسيلة فعالة لتحويل خلايا الشبكية باستخدام GCaMP10.
يقدم هذا البروتوكول طريقة فعالة تستخدم تصوير الكالسيوم لاختبار بروتوكولات تحفيز غرسات الشبكية. على وجه التحديد ، نركز على أنسجة شبكية الفئران خارج الجسم الحي ونقدم تعليمات مفصلة خطوة بخطوة ، من الحصول على العينات إلى تحليل البيانات. من خلال تقديم هذا الدليل الشامل ، يمكن للباحثين من خلفيات مختلفة الشروع في تجربة التحفيز الكهربائي بثقة.
Protocol
تم إجراء جميع الإجراءات الحيوانية وفقا للمبادئ التوجيهية الأخلاقية الحيوانية القياسية (توجيه المجتمعات الأوروبية 86/609 / EU) ووافقت عليها لجان أخلاقيات المحلية. تم استخدام فئران Long Evans البالغة من العمر 8 أسابيع في الدراسة الحالية. تم الحصول على من مصدر تجاري (انظر جدول المواد).
1. إعداد الوسائط والتجميع المسطح
- أميس متوسطة (1 لتر)
- في زجاجة زجاجية سعة 1 لتر ، اخلطي مسحوق Ames المتوسط ، و 1.9 جم / لتر NaHCO3 ، و 10 مل من البنسلين / الستربتومايسين 100x ، و 1 لتر من الماء منزوع الأيونات (انظر جدول المواد). اضبط الأس الهيدروجيني على 7.4 والتناضح على 280 mOsm بالماء منزوع الأيونات أو NaHCO3. تعقيم المحلول عن طريق ترشيحه من خلال مرشح بحجم المسام 0.2 ميكرومتر تحت غطاء المحرك.
ملاحظة: قم بتخزين الوسط المعقم على حرارة 4 درجات مئوية. يبقى هذا الحل مستقرا ويمكن استخدامه لمدة تصل إلى 1 شهر.
- في زجاجة زجاجية سعة 1 لتر ، اخلطي مسحوق Ames المتوسط ، و 1.9 جم / لتر NaHCO3 ، و 10 مل من البنسلين / الستربتومايسين 100x ، و 1 لتر من الماء منزوع الأيونات (انظر جدول المواد). اضبط الأس الهيدروجيني على 7.4 والتناضح على 280 mOsm بالماء منزوع الأيونات أو NaHCO3. تعقيم المحلول عن طريق ترشيحه من خلال مرشح بحجم المسام 0.2 ميكرومتر تحت غطاء المحرك.
- تصاعد الأغشية
- قم بتوصيل غشاء مسامي PTFE واحد (انظر جدول المواد) بغسالة باستخدام قطرات صغيرة من الغراء. اتركه حتى يجف لمدة 15 دقيقة على الأقل.
- لتحقيق الشفافية ، اغمر الأغشية في 70٪ إيثانول لمدة 1 دقيقة.
- شطف الأغشية مرتين بالماء منزوع الأيونات لإزالة الإيثانول تماما. قم بتخزينها في ماء منزوع الأيونات لمنع التعتيم.
2. وضع العلامات GCL وتركيب شبكية العين الفئران شقة
ملاحظة: لا تفرق طريقة وضع العلامات هذه بين RGCs وخلايا الأمكرين النازحة. إذا كان وضع العلامات الانتقائية ل RGCs مطلوبا ، ففكر في استخدام AAVs مع المروجين الخاصين ب RGC11 و / أو وضع العلامات الرجعية من خلال العصب البصري12. للتمييز بين فئات RGCs داخل وخارج المركز ، قم بتصنيف RGCs بناء على استجابتها للضوء13,14 ، واستخدام إصدارات أحدث من مؤشرات الكالسيوم المشفرة وراثيا والتي توفر حساسية متزايدة والقدرة على قياس إمكانات الفعل الفردي15.
- الحقن داخل الجسم الزجاجي
- تخدير فأر Long Evans البالغ من العمر 8 أسابيع باستخدام 2٪ isoflurane / 1٪ O2 حتى لا يكون هناك منعكس دواسة ، والحفاظ على التخدير باستخدام قناع أنف الفئران (انظر جدول المواد).
ملاحظة: أثناء التخدير ، ضع على وسادة تدفئة للحفاظ على درجة حرارة الجسم. - تطبيق قطرة واحدة من قطرات العين المتاحة تجاريا (انظر جدول المواد) لتوسيع حدقة العين.
- قبل الشروع في الجراحة ، افحص العين بحثا عن تشوهات باستخدام تنظير قاع العين والتصوير المقطعي للتماسك البصري (OCT) مع نظام تصوير الشبكية في الجسم الحي . ضع قطرة واحدة من Methocel 2٪ لتسهيل ملامسة القرنية الموضوعية (انظر جدول المواد).
ملاحظة: إذا تم الكشف عن أي تشوهات ، فلا تتابع الخطوات اللاحقة لتلك العين. - ضع قطرة واحدة من Prescaine كمخدر موضعي. ثبت الجفن والملتحمة القزحية بخيوط خياطة متاحة تجاريا (انظر جدول المواد). قم بإنشاء بضع تصلب 1 مم 4 مم من النسيان باستخدام إبرة 30 جرام.
- قم بتوصيل إبرة حادة 36 جم بحقنة دقيقة وحقن جزيئات AAV التي تحمل مؤشر الكالسيوم المشفر وراثيا في الجسم الزجاجي لمدة 30 ثانية ، بزاوية 45 درجة. في هذه الدراسة ، استخدمنا AAV2-CAG-GCaMP5G (7.5 × 1011 GC / mL في HBSS) (انظر جدول المواد).
ملاحظة: يمكن التعامل مع تركيبات AAV التي لا تشفر منتجات الجينات التي يحتمل أن تكون سرطانية أو جزيئات السم ويتم إنتاجها بدون فيروس مساعد في مرافق السلامة البيولوجية من المستوى 1 (BSL-1). خلاف ذلك ، إذا اعتبرت مادة خطرة بيولوجيا تحت احتواء BSL-2 ، فيجب اتخاذ الاحتياطات المناسبة16. يعتبر ترميز AAVs ل GCaMP BSL-1 ولا يتطلب التلاعب تحت خزانات السلامة الأحيائية.
- قم بتوصيل إبرة حادة 36 جم بحقنة دقيقة وحقن جزيئات AAV التي تحمل مؤشر الكالسيوم المشفر وراثيا في الجسم الزجاجي لمدة 30 ثانية ، بزاوية 45 درجة. في هذه الدراسة ، استخدمنا AAV2-CAG-GCaMP5G (7.5 × 1011 GC / mL في HBSS) (انظر جدول المواد).
- ضع قطرة واحدة من Tobradex (انظر جدول المواد) لمنع الالتهاب وكعلاج وقائي بالمضادات الحيوية.
- إذا رغبت في ذلك ، كرر الخطوات 2 و 3 و 4 بالعين الأخرى.
ملاحظة: تحقق من بعد 12-24 ساعة من الجراحة للتأكد من عدم وجود ردود فعل سلبية. - بعد ثلاثة أيام من الحقن ، افحص بنية الشبكية باستخدام تنظير القاع و OCT باستخدام نظام تصوير الشبكية في الجسم الحي (انظر جدول المواد).
- بعد أسبوعين من الحقن ، يجب أن ينبعث GCL من مضان. تقييم بنية الشبكية وتعبير AAV عن طريق تنظير قاع العين الفلوري باستخدام نظام تصوير الشبكية في الجسم الحي .
ملاحظة: وفقا ل Weitz et al.12 ، يصبح التألق من AAV2-CAG-GCaMP5G ملحوظا في أسبوع واحد بعد الحقن ويكثف لمدة أسبوعين. بدءا من الأسبوع الرابع ، يؤدي الإفراط في التعبير عن GCaMP إلى الإصابة بالمراضة الخلوية. تظهر الخلايا الميتة إشارة مضان أساسية عالية في النواة والسيتوبلازم لا تتقلب استجابة للتحفيز. في الخلايا السليمة ، يقتصر تعبير GCaMP على السيتوبلازم ويستبعد من النواة7،8،12،17،18. يمكن ملاحظة هذه الميزات خارج الجسم الحي أثناء التصوير المجهري. قد تختلف نافذة التعبير الجيني اعتمادا على الناقل الفيروسي والمروج المختار.
- تخدير فأر Long Evans البالغ من العمر 8 أسابيع باستخدام 2٪ isoflurane / 1٪ O2 حتى لا يكون هناك منعكس دواسة ، والحفاظ على التخدير باستخدام قناع أنف الفئران (انظر جدول المواد).
- استئصال شبكية العين والتركيب المسطح
ملاحظة: بعد أسبوعين إلى ثلاثة أسابيع من الحقن ، يتم قتل الفئران المحقونة داخل الجسم الزجاجي مباشرة قبل بدء بروتوكول الفيزيولوجيا الكهربية ، وفقا للمبادئ التوجيهية الأخلاقية القياسية (توجيه الجماعات الأوروبية 86/609 / EU) والموافقة عليها من قبل اللجان الأخلاقية المحلية. يستخدم استنشاق ثاني أكسيد الكربون (CO2) كطريقة للقتل الرحيم في هذا البروتوكول.- استئصال العين
- اضغط برفق على الجزء الخارجي من المدار باستخدام زوج من الملقط المنحني لإبراز العين قليلا من مقبس العين.
- استخدم مقص زنبركي لقطع العضلات التي تمسك العين وإزالتها ، مع الحرص على عدم ثقب مقلة العين.
ملاحظة: بدءا من هذه الخطوة ، قم بتشريح شبكية العين تحت مجهر ستيريو في وسط أميس المؤكسج (95٪ O2 / 5٪ CO2).
- استئصال الشبكية
- استخدم زوجا من الملقط الصغير المنحني ومقص زنبركي ناعم لإزالة جميع الأنسجة المحيطة من مقلة العين.
- خذ قطعة من ورق الترشيح حوالي 3 سم × 3 سم وضعها على غطاء طبق 3.5 سم. انقع الورق باستخدام وسيط أميس.
- ضع مقلة العين أعلى الورقة ، بحيث يكون الجزء الأمامي مواجها للمشغل. استخدم زوجا من الملقط المستقيم لتثبيت مقلة العين ، وضعها فوق ora serrata بزاوية 45 درجة تقريبا من سطح الطبق. قم بعمل قطع صغير بشفرة ، باستخدام المسافة بين الملقط المستقيم كمرجع.
- سداد مقلة العين في وسط أميس. استخدم زوجا من الملقط المستقيم ومقص زنبركي ناعم لفصل الأجزاء الأمامية والخلفية من العين.
- قم بإزالة العدسة بعناية باستخدام زوجين من الملقط المستقيم. ثم افصل الشبكية عن الصلبة.
- اقطع الصلبة باتجاه العصب البصري باستخدام مقص زنبركي ناعم حتى يتم عزل الشبكية عن فنجان العين.
- استخدم مجهر ستيريو مضان لتحديد منطقة الشبكية بأفضل تعبير لمؤشر الكالسيوم.
ملاحظة: يعتمد مدى انتشار الفيروس على نجاح الحقن داخل الجسم الزجاجي. قد يتطلب تحقيق التألق عبر أجزاء كبيرة من شبكية العين ممارسة. تلعب خبرة المحقق دورا حاسما في الحصول على أفضل النتائج. - باستخدام ماصة بلاستيكية مقطوعة ، انقل القطعة المحددة من شبكية العين إلى غشاء التركيب (خطوات أغشية التثبيت). استخدم زوجا من الملقط المستقيم لتركيب شبكية العين بشكل مسطح مع توجيه GCL لأعلى.
- باستخدام ماصة بلاستيكية متصلة بطرف ماصة سعة 100 ميكرولتر ، قم بإزالة الوسائط للسماح لقطعة شبكية العين بالالتصاق بالغشاء المسامي. اقلب التجميع على MEA بحيث تستقر GCL أعلى الأقطاب الكهربائية.
- املأ حمام العينة بوسط أميس المؤكسج.
- استئصال العين
3. تصوير الكالسيوم خارج الجسم الحي عند التحفيز الكهربائي
ملاحظة: في هذا العمل، تم استخدام إثبات المفهوم MEA للتجارب خارج الجسم الحي . تم تصنيع MEAs المخصصة بأقطاب كهربائية مسامية أساسها الجرافين بقطر 25 ميكرومتر على زجاج البورسليكات بسمك 500 ميكرومتر مع آثار Ti / Au وتم عزلها لاحقا بنيتريد السيليكون ومقاومة الضوء SU-812. ومع ذلك ، فإن طرق تصوير الكالسيوم صالحة بغض النظر عن مادة القطب المستخدمة في التحفيز.
- اضبط نظام التروية بحيث يقوم وسط أميس المؤكسج بتهوية حمام العينة باستمرار عند 33 درجة مئوية بمعدل تدفق ثابت يبلغ 5 مل / دقيقة.
- باستخدام مجهر مضان مقلوب مزود بمصباح فلورسنت ومكعب مرشح FITC وكاميرا CMOS ، افحص شبكية العين بحثا عن منطقة تظهر فيها الأقطاب الكهربائية المحفزة والتألق من الخلايا المعبرة عن GCaMP. تم استخدام هدف هوائي 20x NA 0.75 لهذه الدراسة.
ملاحظة: لتحفيز (وتسجيل) الخلايا باستخدام الأقطاب الكهربائية بشكل فعال ، يجب أن تكون شبكية العين والقطب على اتصال وثيق. وبالتالي ، تكون الخلايا واضحة في نفس المستوى البؤري مثل الأقطاب الكهربائية. إذا لم يكن الأمر كذلك ، كرر خطوات استئصال الشبكية من الخطوة 8 فصاعدا. عند استخدام شبكية العين من نماذج حيوانية صحية (مع مستقبلات ضوئية عاملة) ، لاحظ أنه في كل مرة يتم فيها تشغيل مصباح الفلورسنت ، ستكون هناك بعض الاستجابات المستثارة الناتجة عن الضوء لأن شبكية العين حساسة للضوء للطول الموجي المستخدم لإثارة مستشعر GCaMP. يمكن استخدام هذه التغيرات في الكالسيوم التي يسببها الضوء لتقييم الحالة الصحية للأنسجة. لتجنب خلط الضوء مع الاستجابات المستثارة كهربائيا ، قم بتشغيل مصباح الفلورسنت قبل 1 دقيقة على الأقل من بدء التقاط الصورة. - لاستنباط الاستجابات المستثارة كهربائيا في GCL ، حدد قطبا كهربائيا لإرسال نبضات يتم التحكم فيها بالتيار. اضبط معلمات التحفيز الكهربائي في برنامج جهاز مولد النبض ، مثل: الشكل والسعة والمدة وتأخير الطور وتكرار النبضات المراد تطبيقها.
ملاحظة: يمكن أن تختلف معلمات التحفيز الفعالة بشكل كبير من عرض النبضة من 50 μs إلى 100 مللي ثانية ، مع سعة تتراوح من 0.1 μA إلى 10 μA. يمكن أن تؤثر هذه المعلمات ، جنبا إلى جنب مع تردد التحفيز ، وقطبية التحفيز ، وعدد النبضات ، وتأخيرات الطور البيني ، على الاستجابة الزمانية المكانية التي يلاحظها تصوير الكالسيوم19،20،21،22. غالبا ما يولد قطار مكون من 40 نبضة ثنائية الطور تقدم تحفيزا بمقدار 1 مللي ثانية و 2 μA استجابة مرئية في الخلايا العصبية المصنفة. - لمزامنة التقاط الصورة مع توصيل التحفيز ، استخدم مولد النبض كمشغل خارجي للتحكم في بدء التقاط الصورة. قم بتوصيل الكاميرا (انظر جدول المواد) بمولد النبضات باستخدام إشارة مشغل الخرج واضبط "وضع الالتقاط" لبرنامج الكاميرا على "مشغل البدء الخارجي". اضغط على Start في برنامج الكاميرا بحيث ينتظر مشغل خارجي للبدء. ابدأ في الحصول على الصور باستخدام برنامج مولد النبض.
ملاحظة: قد يتم إعداد عنصر التحكم في الزناد الخارجي بشكل مختلف للكاميرات المختلفة. حصلت هذه الدراسة عادة على صور (512 × 512 بكسل ، تدرج رمادي 16 بت) بمعدل 10 إطارات في الثانية لمدة دقيقة واحدة مع توفير دفعات من قطارات النبض ثنائية الطور كل 10 ثوان. يبدأ توصيل النبض بعد 10 ثوان ، وبالتالي فإن الإطارات الأولى في جميع التجارب تتوافق مع النشاط التلقائي. اعتمادا على مستشعر GCaMP والتحليل الذي سيجريه المرء ، قد يحتاج المرء إلى ضبط معدل التسجيل وفقا لأوقات ارتفاع واضمحلال مؤشر الكالسيوم8. ضع في اعتبارك الحساسية للكشف عن إمكانات الفعل الفردي لمؤشر الكالسيوم15. - احفظ الصور باسم ملف يتضمن معلمات التحفيز الكهربائي المطبقة، مثل [رقم القطب الكهربائي]_[سعة النبض]_[مدة النبض]_[تردد النبض]_Image001.
4. تحليل البيانات
- ImageJ/FIJI لاستخراج ملف تعريف شدة التألق بمرور الوقت والإحداثيات المكانية من سومات الخلية
- قسم منطقة الاهتمام (ROI) باستخدام "أدوات تحديد المنطقة" وأضفها إلى مدير عائد الاستثمار (تحليل أدوات > > مدير عائد الاستثمار > إضافة). من قائمة مدير عائد الاستثمار، احفظه كمجلد .zip (حفظ > أكثر).
ملاحظة: عادة ، يمكن تطبيق نفس عائد الاستثمار على جميع تجارب التحفيز لأنها تتوافق مع نفس مجال الرؤية. - حدد "متوسط القيمة الرمادية" كمعلمة ليتم استخراجها (تحليل > تعيين القياسات).
- استخرج "متوسط القيمة الرمادية" من سوماس الخلية بالنقر فوق المزيد > القياس المتعدد. سيظهر مربع حوار. قم بتمكين خيارات قياس جميع الشرائح البالغ عددها 600 شريحة وصفا واحدا لكل شريحة للحصول على جدول واحد تتوافق فيه الأعمدة مع عائد الاستثمار وتتوافق الصفوف مع الأطر الزمنية. احفظ الجدول الذي تم إنشاؤه كجدول بيانات .xls.
- حدد "Centroid" كمعلمة ليتم استخراجها (تحليل > تعيين القياسات).
- استخرج "Centroid" من عائد الاستثمار بالنقر فوق قياس. يتوافق الجدول الذي تم إنشاؤه مع الإحداثيات (X ، Y) لعائد الاستثمار. احفظه كجدول بيانات .xls.
- قسم منطقة الاهتمام (ROI) باستخدام "أدوات تحديد المنطقة" وأضفها إلى مدير عائد الاستثمار (تحليل أدوات > > مدير عائد الاستثمار > إضافة). من قائمة مدير عائد الاستثمار، احفظه كمجلد .zip (حفظ > أكثر).
- برنامج نصي مصمم خصيصا لتحديد الخلايا التي تستجيب للمنبهات
ملاحظة: تم استخدام MATLAB (انظر جدول المواد) هنا ، ولكن يمكن تحقيق الخطوات الموضحة بأي لغة برمجة. يمكن للمستخدمين الحصول على البرنامج النصي المصمم خصيصا عن طريق طلب المؤلف المقابل.- تصحيح تأثير التبييض الضوئي: للتخفيف من تأثير الخلفية والتبييض الضوئي ، خذ 15-20 إطارا من الفترات غير المحفزة قبل كل انفجار وقم بملاءمتها لمنحنى خطي [ملاءمة (poly1)].
ملاحظة: في هذه الحالة ، بالنسبة لفيلم إجمالي 600 إطار يتم فيه إرسال رشقات نارية دورية من القطارات النبضية كل 10 ثوان ، تم اعتبار الإطارات 1:90 ، 170: 190 ، 270: 290 ، 370: 390 ، 470: 490 ، 570: 590 فترات غير محفزة. - تطبيع باستخدام الصيغة: (X-min) / (max-min)
- تحديد الخلايا المستجيبة
- احسب جذر متوسط المربع (RMS) للفترات غير المحفزة من البيانات الطبيعية. سيتم اعتبار هذا بمثابة إشارة خط الأساس.
- احسب الحد الأقصى لفترات التحفيز (الإطارات بين الفترات غير المحفزة). في هذه الحالة ، بالنسبة لفيلم إجمالي 600 إطار يتم فيه إرسال رشقات نارية دورية من قطارات النبض كل 10 ثوان ، تم اعتبار الإطارات 91: 169 ، 191: 269 ، 291: 369 ، 391: 469 ، 491: 569 فترات تحفيز.
- إذا تجاوزت القيمة القصوى إشارة خط الأساس بمقدار 2.5 مرة لعائد استثمار معين ، فقم بوضع علامة على الخلية على أنها تستجيب لفترة التحفيز هذه. إذا استجابت الخلية لثلاث من فترات التحفيز الخمس ، فصنفها على أنها خلية مستجيبة.
- تصحيح تأثير التبييض الضوئي: للتخفيف من تأثير الخلفية والتبييض الضوئي ، خذ 15-20 إطارا من الفترات غير المحفزة قبل كل انفجار وقم بملاءمتها لمنحنى خطي [ملاءمة (poly1)].
النتائج
يعتمد البروتوكول الموصوف في هذه الدراسة على دراسات التصوير الفلوري والتحفيز الكهربائي التي أجراها Weitz et al.12. يتكون البروتوكول من ثلاثة أجزاء رئيسية: (1) وضع العلامات الفلورية على GCL والتركيب المسطح لشبكية العين على MEA (الشكل 1-اليسار) ، (2) تصور نشاط الكالسيوم في GCL أثناء التحفيز الكهربائي (الشكل 1-الأوسط) ، و (3) استخراج ومعالجة وتفسير بيانات التصوير (الشكل 1-اليمين).
أولا ، كما هو موضح في الشكل 1 على اليسار ، يتم حقن فئران Long Evans داخل الجسم باستخدام AAV2-CAG-GCaMP5G قبل جلسة التصوير. يحدث التعبير الفيروسي الأمثل لهذا الناقل بعد 2 إلى 3 أسابيع من الحقن12,18. بعد تخدير بالكامل ، يتم عمل ثقب تجريبي باستخدام إبرة 30 جم ، ثم يتم حقن 5 ميكرولتر من AAV2-CAG-GCaMP5G ببطء في الجسم الزجاجي باستخدام إبرة حادة 36 جيجا متصلة بحقنة دقيقة لمنع الارتجاع. أثناء التعبير الفيروسي ، يتم استخدام نظام تصوير الشبكية في الجسم الحي لتقييم حالة الشبكية بعد الجراحة ، مع صور OCT التي توفر تصورا مفصلا لطبقات الشبكية. بمجرد تحقيق التعبير الجيني ، يتم استخراج شبكية العين بعناية من فنجان العين باستخدام مجهر ستيريو وأدوات تشريح عالية الدقة. من هذه النقطة فصاعدا ، يتم التعامل مع الأنسجة في وسط مؤكسج للحفاظ على العينة. ثم يتم تثبيت شبكية العين المستأصلة ، مع توجيه GCL لأعلى ، على منصة مصممة للتركيب المسطح لضمان الاستقرار ومنع تعويم العينة. يتم تركيب العينة على سطح MEA مع مواجهة GCL للأقطاب الكهربائية.
بعد ذلك ، يتم تثبيت MEA على لوحة الواجهة الخاصة به على مجهر فلوري مقلوب (الشكل 1-وسط). يتم ترشيح عينة الشبكية بوسائط مؤكسجة عند 33 درجة مئوية باستخدام نظام التروية. يمكن الاحتفاظ بالعينة في هذا التكوين لعدة ساعات. تمت برمجة مخطط التحفيز المطلوب ، ويتم الحصول على الصور بمعدل 10 إطارات في الثانية. يوصى بتسمية الأفلام وفقا لمعايير التحفيز الكهربائي المطبقة. يجب أن يبدأ الحصول على الصور قبل بدء التحفيز للحصول على بعض إطارات خط الأساس دون تحفيز ، والتي ستكون بمثابة عنصر تحكم سلبي.
وأخيرا، كما هو موضح في الشكل 1-اليمين، يتم استخراج البيانات من صور الفاصل الزمني عن طريق تقسيم سوما الخلية. يتم تصحيح تأثيرات التبييض الضوئي عن طريق تركيب البيانات ، ويتم تحديد الخلايا المستجيبة. تعرف الخلايا المستجيبة بأنها تلك التي لها قمم مضان أثناء التحفيز تتجاوز خط الأساس بمقدار 2.5 مرة. إذا استجابت الخلية لثلاث رشقات من أصل خمس دفعات من التحفيز ، فإنها تعتبر مستجيبة لقطار التحفيز المحدد.
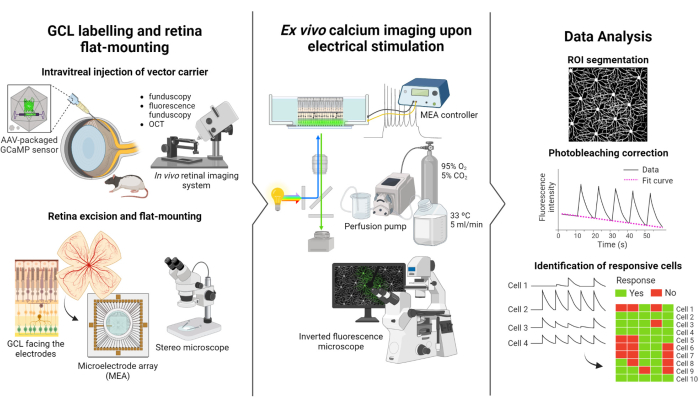
الشكل 1: نظرة عامة على الدراسة. رسم تخطيطي لبروتوكول (يسار) وضع علامات على GCL لشبكية العين وتركيب العينات ، (وسط) إعداد التحضير للتسجيلات خارج الجسم الحي مع التحفيز الكهربائي المقدم من MEA ، و (يمين) تحليل بيانات تصوير الكالسيوم لتصنيف الخلايا المستجيبة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشبكية المحقونة داخل الجسم الزجاجي
حدوث المضاعفات المرتبطة بالحقن داخل الجسم الزجاجي منخفض للغاية. ومع ذلك ، هناك بعض المضاعفات التي يمكن أن تنشأ عن الجراحة نفسها ، بغض النظر عن المكون المحقون. وتشمل هذه المضاعفات تشكيل إعتام عدسة العين ، ونزيف الجسم الزجاجي ، وارتفاع ضغط العين ، والتهاب باطن المقلة23. لتحديد ما إذا كانت هذه المضاعفات ناتجة عن الجراحة ، يحتاج إلى الخضوع للتقييم قبل الإجراء باستخدام تنظير قاع العين و OCT. بعد ثلاثة أيام من الحقن ، يجب متابعة. في الشكل 2A-D ، تظهر شبكية العين لحيوان محقون سليم. بعد أسبوعين من الحقن ، تبدأ RGCs في التعبير عن التألق ، والذي يمكن تصوره باستخدام تنظير قاع العين الفلوري (الشكل 2B ، C). توفر صور OCT تصورا مفصلا لترتيب وسمك طبقات الشبكية (الشكل 2D) ، مما يوفر دقة أعلى مقارنة بتنظير قاع العين ، خاصة عند تقييم انفصال الشبكية. بمجرد تركيب شبكية العين بشكل مسطح وتصويرها باستخدام مجهر مضان مقلوب ، يصبح من الممكن التمييز بين الخلايا وحزم المحور العصبي. على عكس مؤشرات الكالسيوم الأخرى ، يقتصر مؤشر GCaMP على السيتوبلازم7 ، ويتم استبعاد التألق من النواة (الشكل 2E).
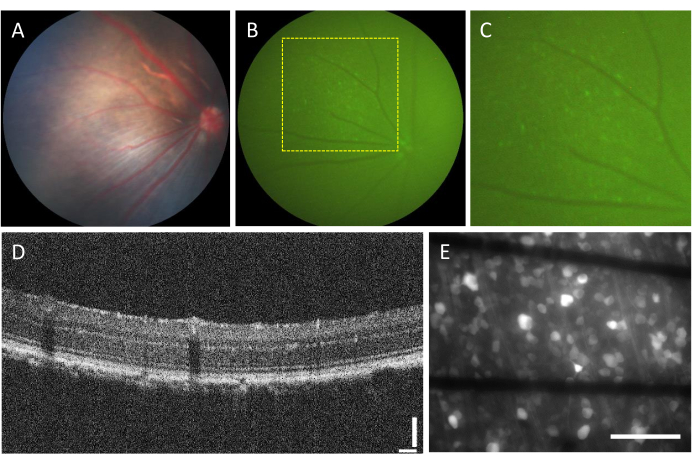
الشكل 2: صور تمثيلية للشبكية المحقونة داخل الجسم الزجاجي. (أ) تنظير قاع القاع، (ب) تنظير قاع العين الفلوري، (ج) تكبير تنظير قاع العين الفلوري، (د) صورة OCT، (ه) صورة مضان epi-fluorescence للشبكية المستأصلة مثبتة على MEA مخصص مع أقطاب كهربائية قائمة على الجرافين على زجاج البورسليكات بسمك 500 ميكرومتر. في (E) ، تتوافق الخطوط السوداء مع آثار Ti / Au. قضبان المقياس: 115 ميكرومتر (D) و 100 ميكرومتر (E). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
اتصال الأقطاب الكهربائية و GCL
من أجل إثارة الاستجابات العصبية بشكل فعال ، من الأهمية بمكان التأكد من أن شبكية العين المثبتة بشكل مسطح على اتصال وثيق بسطح MEA. هناك طريقة بسيطة للتحقق من ذلك وهي التأكد بصريا مما إذا كانت الخلايا والأقطاب الكهربائية موجودة في نفس المستوى البؤري (الشكل 3 أ). إذا لم تكن الخلايا في نفس المستوى البؤري مثل الأقطاب الكهربائية (الشكل 3B) ، فهذا يشير إلى أن الاتصال دون المستوى الأمثل ، مما سيؤدي إلى تحفيز أقل فعالية.
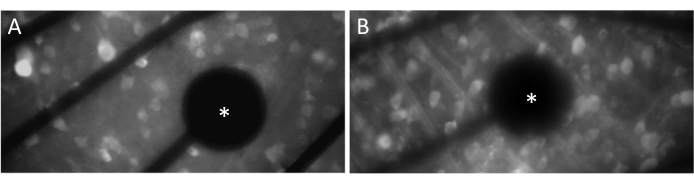
الشكل 3: الأقطاب الكهربائية وتلامس GCL. أ: الخلايا والقطب (العلامة النجمية) في المستوى البؤري نفسه. ب: الخلايا والأقطاب الكهربائية التي لا توجد في المستوى البؤري نفسه، مما يشير إلى التلامس دون المستوى الأمثل للتحفيز الكهربي في تلك المنطقة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تصوير الكالسيوم خارج الجسم الحي عند التحفيز الكهربائي المقدم من MEA
تتكون البيانات الناتجة من تصوير الكالسيوم من صور الفاصل الزمني التي تراقب النشاط العصبي لمئات الخلايا استجابة للتحفيز الكهربائي. تتسبب المنبهات فوق العتبة في تدفق الكالسيوم إلى سوما الخلية ، مما يؤدي إلى تغير مفاجئ في شدة التألق (الفيديو 1). يتيح هذا البروتوكول تحديد ما إذا كان القطب الكهربائي و / أو MEA و / أو خوارزمية التحفيز تثير الاستجابة المطلوبة في الأنسجة العصبية. سيحدد حجم ودرجة الأقطاب الكهربائية في MEA ، بالإضافة إلى نسبة الأنسجة التي تتم دراستها ، التكبير الموضوعي المناسب للاختيار. عادة ، بالنسبة لدراسات تحفيز القطب الواحد بأقطار تتراوح من 5 ميكرومتر إلى 100 ميكرومتر ، يكون التكبير الموضوعي 20-25x مناسبا (الشكل 4 أ) ، مما يوفر مجال رؤية يبلغ حوالي 600 ميكرومتر × 600 ميكرومتر. بالنسبة للتجارب التي تنطوي على التحفيز باستخدام أقطاب كهربائية متعددة ، قد يكون من الضروري تكبير الهدف 4-10x لتقييم مساحة أوسع تبلغ حوالي 2 مم × 2 مم. يمكن التعرف بسهولة على الخلايا المستجيبة عن طريق إنشاء إسقاط صورة انحراف معياري لفيلم الفاصل الزمني (الشكل 4B والفيديو 1).
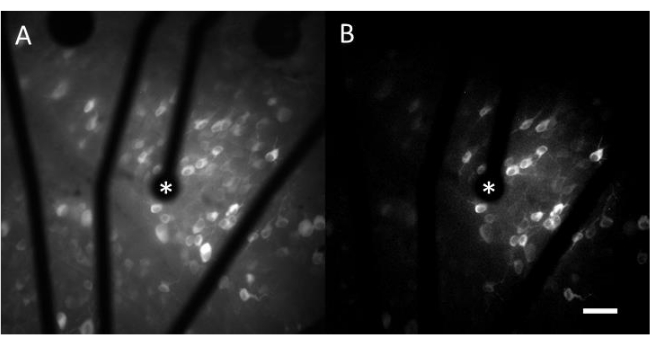
الشكل 4: تصوير الكالسيوم ل GCL مع التحفيز الكهربائي الذي يوفره قطب كهربائي قطره 25 ميكرومتر. (أ) الإسقاط الأقصى لفيلم بفاصل زمني مقداره 60 ثانية، (ب) إسقاط الانحراف المعياري الذي يصور بوضوح الخلايا التي تستجيب للمثيرات الكهربية من قطب كهربائي مسامي قائم على الجرافين قطره 25 ميكرومتر. يشار إلى القطب المحفز بعلامة النجمة. شريط المقياس: 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
تحليل ديناميكيات الكالسيوم بمرور الوقت عند التحكم في التحفيز
لكل سوما خلية محددة ، تم استخراج قيم متوسط الكثافة بمرور الوقت. يوضح الشكل 5 أ آثار الكالسيوم المصححة بالتبييض الضوئي من الخلايا المستجيبة. في هذا المثال ، تم تسليم خمس دفعات من قطارات النبض ثنائية الطور (الكاثودية الأولى ، 40 دورة ، مدة 1 مللي ثانية ، سعة 2 μA) كل 10 ثوان (يشار إليها بخطوط سوداء) أثناء التقاط صورة 60 ثانية. في تجربة معينة ، يتم تطبيق نفس القطارات النبضية الخمسة لاختبار اتساق الاستجابة. تستخدم الإطارات التي تم التقاطها خلال الفترات غير المحفزة (مظللة باللون الأحمر) لأداء ملاءمة خطية ، وتصحيح تأثير التبييض الضوئي.
بمجرد تحديد الخلايا المستجيبة ، ومعرفة إحداثياتها (x ، y) بالنسبة إلى القطب المنجذب ، يمكن للمرء فحص العلاقة بين التيار المطلوب لتنشيط الخلايا والمسافة من القطب المنجذب (الشكل 5B). كما هو متوقع ، تتطلب الخلايا الموجودة بالقرب من القطب المحفز قيم تيار أقل لإثارة استجابة.
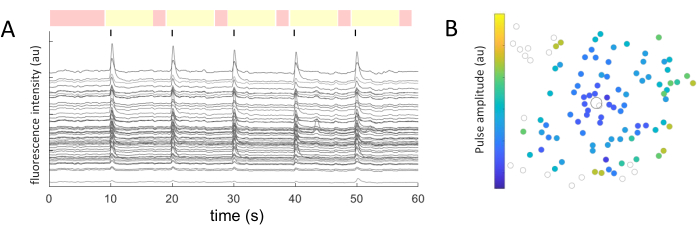
الشكل 5: تمثيل الاستجابات المستثارة كهربيا. (أ) آثار الكالسيوم للسومات الخلوية على 5 دفعات من القطارات النبضية (ثنائية الطور ، الكاثودية الأولى ، 40 دورة ، مدة 1 مللي ثانية ، سعة 2 μA) كل 10 ثوان (خطوط سوداء) أثناء التقاط صورة 60 ثانية. يتم عرض فترات غير محفزة (إطارات مظللة باللون الأحمر) وفترات تحفيز (إطارات مظللة باللون الأصفر). تعتبر الآثار التي تتجاوز إشارة خط الأساس (جذر متوسط مربع الفترات غير المحفزة) بمقدار 2.5 مرة استجابات مستثارة. تصنف الخلايا التي تستجيب في ثلاث من فترات التحفيز الخمس على أنها خلايا مستجيبة. (ب) خريطة توزيع نشاط الكالسيوم توضح القطب المنجذب (دائرة سوداء محددة) والخلايا (دائرة رمادية محددة). يمثل رمز اللون الحد الأدنى من سعة النبضة اللازمة لإثارة استجابة خلوية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
فيديو 1: تصوير الكالسيوم ل GCL مع التحفيز الكهربائي الذي يوفره قطب كهربائي قطره 25 ميكرومتر. يعرض الفيديو الاختلافات في شدة التألق بسبب التحفيز الكهربائي من قطب كهربائي مسامي قائم على الجرافين بقطر 25 ميكرومتر. يعرض الجانب الأيسر الفيلم الأصلي ، ويظهر الجانب الأيمن إسقاط الانحراف المعياري حيث يمكن التعرف على الخلايا المستجيبة بسهولة. شريط المقياس: 50 ميكرومتر. الرجاء الضغط هنا لتنزيل هذا الفيديو.
Discussion
يعمل البروتوكول الموصوف هنا على دراسة ديناميكيات الكالسيوم التي تحدث في GCL لشبكية الفئران عند التحفيز الكهربائي المقدم مع MEA. إنها طريقة موثوقة ويمكن التحكم فيها ولكنها تتطلب بعض التدريب ، لا سيما لتسمية GCL بشكل موحد بكفاءة وتركيب شبكية العين بشكل صحيح لضمان الاتصال الأمثل بين الأنسجة والقطب الكهربائي. هذا البروتوكول خاص بالقوارض ويحتاج إلى تكييف إذا تم تطبيقه على أنواع مختبرية مختلفة. يتم عرض النقاط الحرجة والتعديلات والقيود على المنهجية بالتفصيل.
الحقن داخل الجسم الزجاجي
تستخدم الحقن على نطاق واسع لتوصيل الجينات العينية ، مع كون الحقن داخل الجسم الزجاجي هو الإجراء المفضل. لقد ثبت أنها أكثر أمانا وأقل توغلا مقارنة بالحقن تحت الشبكية ، والتي تقدم الجزيئات ذات الأهمية مباشرة بين المستقبلات الضوئية وظهارة الشبكية الصبغية (RPE) ، مما يهدد بانفصال الشبكية10. ومع ذلك ، هناك قيود ، خاصة عند إجراء هذه الحقن في نماذج القوارض. الفكاهة الزجاجية هلامية ، تعيق الانتشار الفيروسي. علاوة على ذلك ، فإن العدسة في عيون القوارض كبيرة ، مما يجعلها غير تافهة لإدخال الإبرة دون خدشها. إبر الحقن الدقيقة حساسة وتحتاج إلى استبدالها كثيرا. لمنع الانسداد ، اغسلها بالماء منزوع الأيونات قبل وبعد كل استخدام واستبدلها بانتظام. بالإضافة إلى ذلك ، قم بحقن المحتوى ببطء لمنع ارتجاع المحلول والتغيرات في ضغط العين. قد يتطلب تحقيق مضان كبير وموحد عبر شبكية العين ممارسة.
نقل خلايا الشبكية
النواقل الفيروسية هي طريقة ممتازة لتوصيل الجينات في الجسم الحي ، وقد استخدمت AAVs على نطاق واسع لتحويل خلايا الشبكية10. تمت الموافقة عليها كعلاج لبعض اعتلالات الشبكية التي تسبب العمى البشري24. ومع ذلك ، فإن سعة الناقل الخاصة بهم تقتصر على 5 كيلو بايت ، بما في ذلك العناصر التنظيمية المطلوبة (على سبيل المثال ، المروج)10,25. هناك العديد من الأنماط المصلية المتاحة ، ولكل منها انتحاء مختلف. اختر أنسب AAV بناء على الجينات المراد تسليمها والخلايا المراد تحويلها26. لوضع علامات على RGCs ، يوصى باستخدام AAV227.
نافذة التعبير الجيني
التعبير الفيروسي الأمثل ل AAV2-CAG-GCaMP5G هو من 2 إلى 3 أسابيع بعد الحقن12,18. بعد هذا الإطار الزمني ، تصبح النوى من الخلايا المنقولة فلورية ، وتتوقف الخلايا عن الاستجابة للمنبهات ، وتموت في النهاية7،28،29. ويرجع ذلك إلى الإفراط في التعبير عن مؤشر GCaMP ، والذي يتم نقله إلى النواة. ستختلف النافذة الزمنية للتعبير الجيني الأمثل اعتمادا على الناقل الفيروسي والمروج المختار30 ويجب تحديدها تجريبيا قبل متابعة هذا البروتوكول.
الاتصال الأنسجة القطب
للحصول على أفضل النتائج والقابلة للتكرار ، يعد تحقيق اتصال جيد بين الأنسجة والقطب أمرا بالغ الأهمية. عادة ما يكون ضعف الاتصال بسبب الانحناء الطبيعي لشبكية العين. تتمثل إحدى الطرق في تقطيع شبكية العين إلى أرباع ، وتركيب وتصوير قسم واحد في كل مرة. يمكن تسطيح أجزاء صغيرة من شبكية العين بشكل أفضل ، مما يؤدي إلى اتصال أكثر فعالية مع سطح MEA. سبب آخر محتمل لضعف الاتصال هو وجود الفكاهة الزجاجية. عند إجراء تجارب التحفيز التي تحاكي غرسة فوق الشبكية ، من المهم إزالة الخلط الزجاجي بعناية أثناء استئصال الشبكية لأنه يمكن أن يعمل كعازل للتيار. هنا ، يتم وصف طريقة بسيطة للتحقق مما إذا كان الاتصال كافيا من خلال تصور القطب والخلايا في نفس المستوى البؤري.
بديل لقياسات الشبكية خارج الجسم الحي هو زراعة الخلايا العصبية مباشرة على سطح الأقطاب الكهربائية. يمكن أن تكون الثقافة الأولية للخلايا العصبية ، مثل الخلايا العصبية الحصينية31 ، مفيدة للاختبارات الأولية لتقييم وظائف جهاز التحفيز الجديد. ومع ذلك ، لا يزال هذا النهج يتطلب استخدام المختبر ولا يمثل تعقيد شبكة الشبكية ، وهو أمر مهم لتقييم الاستجابات المشبكية للتحفيز.
لتصور الخلايا الموجودة أسفل آثار القطب الكهربائي والأقطاب الكهربائية ، يمكن استخدام MEAs المصنعة بمواد شفافة مثل أكسيد القصدير الإنديوم (ITO)19،20،32. بالإضافة إلى القياسات البصرية، يمكن تقييم نشاط GCL عند التحفيز الكهربائي من خلال التسجيلات الكهربائية. يمكن استخدام MEA لتسجيل إمكانات المجال المحلي (LFP) للأنسجة. ومع ذلك ، فإن هذا يضر بالدقة المكانية ، حيث يلتقط كل قطب كهربائي النشاط من خلايا متعددة في وقت واحد (اعتمادا على أبعاد القطب). يتغلب التسجيل البصري على هذا القيد ويوفر تخطيطا أعلى دقة مكانية. ميزته الرئيسية هي القدرة على التمييز بين الخلايا النشطة وغير النشطة أثناء قياس مجال الرؤية الكبير بدقة خلية واحدة. من بين جميع مراسلي النشاط الخلوي ، يتم وصف مؤشرات الكالسيوم بشكل جيد والأكثر استخداما33.
Disclosures
ليس لدى المؤلفين أي إفصاحات لإضافتها إلى المخطوطة.
Acknowledgements
نحن ممتنون لميرشي ريفاس ، وأنجيل ساندوفال ، وخيسوس بلاناغوما ، وجوردي كورتيس ، وساندرا أورتونوبيس لارا ، وألينا هيرشمان (ICFO-Institut de Ciències Fotòniques) على دعمهم الفني ، إلى آنا دواري (VHIR ، معهد فال ديبرون للأبحاث) من مجموعة أبحاث طب العيون لدعمهم في الحقن داخل الجسم الزجاجي وتصوير الشبكية في الجسم الحي .
والكيانات الممولة التي دعمت هذا العمل هي: مؤسسة سيلكس؛ ومؤسسة سيلكس. مؤسسة مير بويغ; وزارة الاقتصاد والمنافسة - برنامج سيفيرو أوتشوا لمراكز الامتياز في مجال البحث والتطوير (CEX2019-000910-S, [MCIN/AEI/10.13039/501100011033])؛ Generalitat de Catalunya من خلال برنامج CERCA ؛ Laserlab-Europe (EU-H2020 GA رقم 871124) ؛ مؤسسة لا كايشا (LCF/HR19/52160003)؛ وفوندو سوشال يوروبيو (PRE2020-095721 ، M.C.).
Materials
| Name | Company | Catalog Number | Comments |
| 20x NA 0.75 S Fluor air objective | Nikon | CFI Super Fluor 20X | - |
| 3.5 cm Cell culture dish | Nunc | 12-565-90 | - |
| 30 G needle | VWR | 613-5373 | - |
| 36 G blunt needle | World Precision Instruments | NF36BL-2 | - |
| 6 cm Cell culture dish | Nunc | 12-565-94 | - |
| AAV2-CAG-GCaMP5G | Vector Biolabs | - | - |
| Ames' Medium | Sigma Aldrich | A1420 | - |
| Blade | Swann-morton | 0308 | - |
| Camera | Hamamatsu | ORCA Flash v4.0 | - |
| Carbogen | Air liquide | - | - |
| Curved-forceps | - | - | - |
| Fine spring-scissors | FST | 91501-09 | - |
| FITC filter cube | Nikon | Standard series | - |
| Fluorescent lamp | Nikon | C-HGFI | - |
| Fluorescent stereomicroscope | Nikon | SMZ25 | - |
| HBSS | Capricorn | HBSS-1A | - |
| ImageJ/FIJI | NIH | v1.50i | - |
| In vivo retinal imaging system | Phoenix Research Laboratories | Micron III | - |
| Inverted fluorescence microscope | Nikon | Eclipse Ti | - |
| Isofluorane | Arrane Baxter Laboratories | - | - |
| Long-Evans rat | Janvier | - | - |
| MATLAB (Version R2021b) | Mathworks | - | - |
| Media filters | Merckmillipore | SCGPS02RE | - |
| Methocel 2% | Omni Vision | - | - |
| Microelectrode array (MEA) | - | Custom-made | |
| NaHCO3 | Thermofisher | 42427 | - |
| Penicillin/Streptomycin 100x | Thermofisher | 15140122 | - |
| Phenylephrine | Alcon Cusí Laboratories | 653437.3 | 100 mg/mL |
| Plastic pipette | VWR | 612-1793 | - |
| Porous membrane | Merckmillipore | #JVWP01300 | - |
| Precision syringe | World Precision Instruments | 10 µl Nanofil | - |
| Prescaina | Llorens | - | Oxybuprocaine chlorhydrate (2 mg/mL), local anesthetic |
| Rat nasal mask | Xenotec | XRK-RA | - |
| Small curved-forceps | Bbraun | AESCBD311R | - |
| Spring-scissors | FST | 15040-11 | - |
| Stereo microscope | Zeiss | Stemi 2000 | - |
| Straight forceps | FST | 11252-20 | - |
| Suture filament | Vitrex Medical | 4328 | Nilon monofilament, 7/0, DS12 |
| Tobradex | Alcon Cusí Laboratories | - | Tobramycin (3 mg/mL) and dexamethasone (1 mg/mL) |
| Tropicamide | Alcon Cusí Laboratories | 653486 | 10 mg/mL |
| Washer | Thorlabs | W8S038 | - |
References
- Bourne, R. R. A., et al. Prevalence and causes of vision loss in high-income countries and in Eastern and Central Europe in 2015: Magnitude, temporal trends and projections. British Journal of Ophthalmology. 102 (5), 575-585 (2018).
- Li, J. Q., et al. Prevalence and incidence of age-related macular degeneration in Europe: a systematic review and meta-analysis. British Journal of Ophthalmology. 104 (8), 1077-1084 (2020).
- Roska, B., Sahel, J. A. Restoring vision. Nature. 557 (7705), 359-367 (2018).
- Hornig, R., Velikay-Parel, M. Retina implants. Implantable Sensor Systems for Medical Applications. , Elsevier. 469-496 (2013).
- Lewis, P. M., et al. Advances in implantable bionic devices for blindness: a review. ANZ Journal of Surgery. 86 (9), 654-659 (2016).
- Weiland, J. D., Walston, S. T., Humayun, M. S. Electrical stimulation of the retina to produce artificial vision. Annual Review of Vision Science. 2, 273-294 (2016).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6, 875-881 (2009).
- Chen, T. -W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499, 295-300 (2013).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca2+ probe composed of a single green fluorescent protein. Nature Biotechnology. 19, 137-141 (2001).
- Sahu, B., Chug, I., Khanna, H. The ocular gene delivery landscape. Biomolecules. 11 (8), 1135(2021).
- Hanlon, K. S., et al. A novel retinal ganglion cell promoter for utility in AAV vectors. Frontiers in Neuroscience. 11, (2017).
- Weitz, A. C., et al. Imaging the response of the retina to electrical stimulation with genetically encoded calcium indicators. Journal of Neurophysiology. 9 (7), 1979-1988 (2013).
- Briggman, K. L., Euler, T. Bulk electroporation and population calcium imaging in the adult mammalian retina. Journal of Neurophysiology. 105 (5), 2601-2609 (2011).
- Baden, T., Berens, P., Franke, K., Román Rosón, M., Euler, T. The functional diversity of retinal ganglion cells in the mouse. Nature. 529, 345-350 (2016).
- Zhang, Y., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Nature. 615, 884-891 (2023).
- Meyer, E. L., Jenkins, C., Rengarajan, K. NIH Guidelines April 2019. Applied Biosafety. 24, Preprint at https://doi.org/10.1177/1535676019871146 (2019).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Chang, Y. -C., Walston, S. T., Chow, R. H., Weiland, J. D. GCaMP expression in retinal ganglion cells characterized using a low-cost fundus imaging system. Journal of Neural Engineering. 14 (5), 056018(2017).
- Weitz, A. C., et al. Improving the spatial resolution of epiretinal implants by increasing stimulus pulse duration. Science Translational Medicine. 7 (318), 1-12 (2015).
- Chang, Y. C., Ghaffari, D. H., Chow, R. H., Weiland, J. D. Stimulation strategies for selective activation of retinal ganglion cell soma and threshold reduction. Journal of Neural Engineering. 16 (2), 026017(2019).
- Im, M., Fried, S. I. Temporal properties of network-mediated responses to repetitive stimuli are dependent upon retinal ganglion cell type. Journal of Neural Engineering. 13 (2), 025002(2016).
- Jensen, R. J., Ziv, O. R., Rizzo, J. F. Thresholds for activation of rabbit retinal ganglion cells with relatively large, extracellular microelectrodes. Investigative Ophthalmology & Visual Science. 46 (4), 1486-1496 (2005).
- Ramos, M. S., et al. Patient-reported complications after intravitreal injection and their predictive factors. Ophthalmology Retina. 5 (7), 625-632 (2021).
- Vandenberghe, L. H., Auricchio, A. Novel adeno-associated viral vectors for retinal gene therapy. Gene Therapy. 19 (2), 162-168 (2012).
- Zin, E. A., Ozturk, B. E., Dalkara, D., Byrne, L. C. Developing new vectors for retinal gene therapy. Cold Spring Harbor Perspectives in Medicine. , a041291(2023).
- Haggerty, D. L., Grecco, G. G., Reeves, K. C., Atwood, B. Adeno-associated viral vectors in neuroscience research. Molecular Therapy-Methods & Clinical Development. 17, 69-82 (2020).
- Hellström, M., et al. Cellular tropism and transduction properties of seven adeno-associated viral vector serotypes in adult retina after intravitreal injection. Gene Therapy. 16 (4), 521-532 (2009).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nature Protocols. 11, 566-597 (2016).
- Yang, Y., et al. Improved calcium sensor GCaMP-X overcomes the calcium channel perturbations induced by the calmodulin in GCaMP. Nature Communications. 9, 1504(2018).
- Nieuwenhuis, B., et al. Improving adeno-associated viral (AAV) vector-mediated transgene expression in retinal ganglion cells: comparison of five promoters. Gene Therapy. 30, 503-519 (2023).
- Cunquero, M., Aguilar, E., Loza-Alvarez, P., Planagumà, J. Hippocampal neuronal cultures to detect and study new pathogenic antibodies involved in autoimmune encephalitis. Journal of Visualized Experiments. 184, e63829(2022).
- Behrend, M. R., Ahuja, A. K., Humayun, M. S., Chow, R. H., Weiland, J. D. Resolution of the epiretinal prosthesis is not limited by electrode size. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 19 (4), 436-442 (2011).
- Grienberger, C., Konnerth, A. Imaging calcium in neurons. Neuron. 73 (5), 862-885 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved