Method Article
Kalzium-Bildgebung bei elektrisch stimulierten, flach montierten Netzhäuten
In diesem Artikel
Zusammenfassung
Netzhautprothesen haben die Fähigkeit, visuelle Wahrnehmungen zu erzeugen. Um die Entwicklung neuer Prothesen voranzutreiben, werden Ex-vivo-Methoden benötigt, um Geräte vor der Implantation zu testen. Dieser Artikel bietet ein umfassendes Protokoll zur Untersuchung der Kalziumaktivität in der retinalen Ganglienzellschicht bei elektrischer Stimulation.
Zusammenfassung
Netzhautdystrophien sind weltweit eine der Hauptursachen für Erblindung. Es werden umfangreiche Anstrengungen unternommen, um fortschrittliche Netzhautprothesen zu entwickeln, die die beeinträchtigten lichtempfindlichen Photorezeptorzellen in der degenerierten Netzhaut umgehen können, um das Sehvermögen durch die Induktion visueller Wahrnehmungen teilweise wiederherzustellen. Ein gängiger Forschungsansatz ist die Entwicklung und Herstellung von implantierbaren Geräten mit einer flexiblen physikalischen Struktur, die eine große Anzahl von Elektroden beherbergen. Dies ermöglicht die effiziente und präzise Generierung visueller Wahrnehmungen. Mit jedem technologischen Fortschritt entsteht jedoch ein Bedarf an einer zuverlässigen und handhabbaren Ex-vivo-Methode , um die Funktionalität des Geräts zu überprüfen, bevor zu In-vivo-Experimenten übergegangen wird, bei denen Faktoren ins Spiel kommen, die über die Leistung des Geräts hinausgehen. In diesem Artikel wird ein umfassendes Protokoll zur Untersuchung der Kalziumaktivität in der retinalen Ganglienzellschicht (GCL) nach elektrischer Stimulation vorgestellt. Im Einzelnen werden die folgenden Schritte beschrieben: (1) Fluoreszenzmarkierung der Rattennetzhaut unter Verwendung genetisch kodierter Kalziumindikatoren, (2) Erfassung des Fluoreszenzsignals mit einem inversen Fluoreszenzmikroskop unter Anwendung unterschiedlicher Muster der elektrischen Stimulation und (3) Extraktion und Analyse der Kalziumspuren aus einzelnen Zellen innerhalb des GCL. Auf diese Weise können Forscher neue Stimulationsprotokolle effizient testen, bevor sie In-vivo-Experimente durchführen.
Einleitung
Die Netzhaut enthält Photorezeptoren, das sind Zellen, die für die Wahrnehmung von Licht verantwortlich sind. Sie fangen Photonen ein und wandeln sie in Nervenimpulse um. Diese Impulse werden dann in der Netzhaut verarbeitet und an den visuellen Kortex weitergeleitet, was zur Bildung eines visuellen Bildesführt 1. Retinitis pigmentosa (RP) und altersbedingte Makuladegeneration (AMD) sind degenerative Erkrankungen, die durch einen fortschreitenden Verlust der Photorezeptoren gekennzeichnet sind. Diese Retinopathien gehören weltweit zu den häufigsten Erblindungsursachen1, betreffen Millionen von Menschen und haben erhebliche medizinische, persönliche und sozioökonomische Folgen für Patienten, Gesundheitssysteme und die Gesellschaft als Ganzes. Darüber hinaus wird prognostiziert, dass die Zahl der AMD-Fälle aufgrund der alternden Bevölkerung bis 2050 um 15 % zunehmenwird 2.
Derzeit sind zahlreiche Forschungsbemühungen im Gange, um das Sehvermögen bei Patienten, die von diesen Erkrankungen betroffen sind, wiederherzustellen3. Ein vielversprechender Ansatz ist der Einsatz von Netzhautprothesen, die sich bei der teilweisen Wiederherstellung des Sehvermögens als wirksam erwiesenhaben 4,5. Diese Geräte fangen das Licht der visuellen Szene ein und wandeln es in elektrische Impulse um. Diese Impulse werden durch Elektroden innerhalb eines Mikroelektrodenarrays (MEA) abgegeben, das in das Auge implantiert wird, wodurch die überlebenden Neuronen stimuliert und die Funktion der verlorenen Photorezeptoren umgangen wird. Die aktivierten retinalen Ganglienzellen (RGCs) leiten den Output an das Gehirn weiter, wo er als visuelle Wahrnehmung interpretiert wird. Die Haupteinschränkungen aktueller Implantate liegen jedoch in der Auflösung der Elektroden-Gewebe-Grenzfläche6 und der nicht-selektiven Stimulation verschiedener Zelltypen. Um das Design neuer implantierbarer Geräte für eine effizientere Wiederherstellung des Sehvermögens zu optimieren, ist es daher von entscheidender Bedeutung zu verstehen, wie Stimulationsparadigmen entwickelt werden können, um Zellen in unmittelbarer Nähe der Elektroden selektiv zu aktivieren.
Die Kalzium-Bildgebung ist eine weit verbreitete Technik zur Untersuchung der neuronalen Aktivität, die mehrere Vorteile gegenüber nicht-optischen Methoden bietet 7,8. Erstens bietet es zelluläre und subzelluläre Auflösung. Zweitens können Kalziummarker auf bestimmte Zelltypen abzielen. Drittens ermöglicht es ein langfristiges Tracking und viertens die Beobachtung ganzer Zellpopulationen bei gleichzeitiger Unterscheidung zwischen aktiven und inaktiven Zellen. Diese Methode liefert indirekte Hinweise auf zelluläre Aktivität mit einer zeitlichen Auflösung im Bereich von Hunderten von Millisekunden. Genetisch kodierte fluoreszierende Kalziumindikatoren, wie z. B. GCaMP-Sensoren, unterliegen bei der Bindung an Kalzium einer Konformationsänderung, was zu einer erhöhten Fluoreszenzführt 9. Rekombinante adeno-assoziierte virale Vektoren (AAVs) sind ein wirksames Mittel zur Transduktion von Netzhautzellen mit GCaMP10.
Dieses Protokoll stellt eine effiziente Methode dar, die die Kalziumbildgebung zum Testen von Stimulationsprotokollen von Netzhautimplantaten verwendet. Insbesondere konzentrieren wir uns auf Ex-vivo-Netzhautgewebe von Ratten und bieten detaillierte Schritt-für-Schritt-Anleitungen, von der Probenentnahme bis zur Datenanalyse. Durch das Angebot dieses umfassenden Leitfadens können Forscher mit unterschiedlichem Hintergrund mit Zuversicht in das Experimentieren mit elektrischer Stimulation einsteigen.
Protokoll
Alle Tierversuche wurden in Übereinstimmung mit den ethischen Standardrichtlinien für Tiere (Richtlinie 86/609/EU der Europäischen Gemeinschaften) durchgeführt und von den lokalen Tierethikkommissionen genehmigt. Für die vorliegende Studie wurden 8 Wochen alte Long-Evans-Ratten verwendet. Die Tiere stammten aus einer kommerziellen Quelle (siehe Materialtabelle).
1. Vorbereitung der Medien und flache Montage
- Ames' Medium (1 L)
- Mischen Sie in einer 1-Liter-Glasflasche das Ames' Medium-Pulver, 1,9 g/L NaHCO3, 10 ml Penicillin/Streptomycin 100x und 1 L deionisiertes Wasser (siehe Materialtabelle). Stellen Sie den pH-Wert auf 7,4 und die Osmolarität auf 280 mOsm mit deionisiertem Wasser oder NaHCO3 ein. Sterilisieren Sie die Lösung, indem Sie sie durch einen 0,2-μm-Porenfilter unter einer Haube filtern.
HINWEIS: Lagern Sie das sterilisierte Medium bei 4 °C. Diese Lösung bleibt stabil und kann bis zu 1 Monat lang verwendet werden.
- Mischen Sie in einer 1-Liter-Glasflasche das Ames' Medium-Pulver, 1,9 g/L NaHCO3, 10 ml Penicillin/Streptomycin 100x und 1 L deionisiertes Wasser (siehe Materialtabelle). Stellen Sie den pH-Wert auf 7,4 und die Osmolarität auf 280 mOsm mit deionisiertem Wasser oder NaHCO3 ein. Sterilisieren Sie die Lösung, indem Sie sie durch einen 0,2-μm-Porenfilter unter einer Haube filtern.
- Montage von Membranen
- Befestigen Sie eine poröse PTFE-Membran (siehe Materialtabelle) mit kleinen Tropfen Klebstoff an einer Unterlegscheibe. Mindestens 15 Minuten trocknen lassen.
- Um Transluzenz zu erreichen, tauchen Sie die Membranen 1 Minute lang in 70%iges Ethanol.
- Spülen Sie die Membranen zweimal mit deionisiertem Wasser, um das Ethanol vollständig zu entfernen. Bewahren Sie sie in deionisiertem Wasser auf, um eine Trübung zu verhindern.
2. GCL-Markierung und Ratten-Retina-Flachmontage
HINWEIS: Bei dieser Markierungsmethode werden RGCs nicht von verdrängten Amakrinzellen unterschieden. Wenn eine selektive Markierung von RGCs gewünscht wird, sollten Sie die Verwendung von AAVs mit RGC-spezifischen Promotoren11 und/oder eine retrograde Markierung durch den Sehnerv12 in Betracht ziehen. Um zwischen Klassen von ON- und OFF-Center RGCs zu unterscheiden, klassifizieren Sie RGCs basierend auf ihrer Lichtantwort13,14 und verwenden Sie neuere Versionen von genetisch kodierten Kalziumindikatoren, die eine erhöhte Empfindlichkeit und die Fähigkeit bieten, einzelne Aktionspotentiale zu messen15.
- Intravitreale Injektion
- Betäuben Sie die 8 Wochen alte Long-Evans-Ratte mit 2 % Isofluran/1 % O2 , bis kein Pedalreflex mehr auftritt, und halten Sie die Anästhesie mit einer Ratten-Nasenmaske aufrecht (siehe Materialtabelle).
HINWEIS: Positionieren Sie das Tier während der Narkose auf einem Heizkissen, um die Körpertemperatur zu halten. - Verabreichen Sie einen Tropfen handelsüblicher Augentropfen (siehe Materialtabelle), um die Pupille zu erweitern.
- Bevor Sie mit der Operation fortfahren, untersuchen Sie das Auge mit Fundoskopie und optischer Kohärenztomographie (OCT) mit einem In-vivo-Netzhautbildgebungssystem auf Anomalien. Tragen Sie einen Tropfen Methocel 2% auf, um den Kontakt zwischen Hornhaut und Objektiv zu erleichtern (siehe Materialtabelle).
HINWEIS: Wenn Anomalien festgestellt werden, fahren Sie nicht mit den nachfolgenden Schritten für dieses Auge fort. - Tragen Sie einen Tropfen Prescain als Lokalanästhetikum auf. Fixieren Sie das Augenlid und die limbale Bindehaut mit einem handelsüblichen Nahtfilament (siehe Materialtabelle). Erstellen Sie mit einer 30-G-Nadel eine 1 mm lange Sklerotomie 4 mm vom Limbus entfernt.
- Befestigen Sie eine stumpfe 36-G-Nadel an einer Präzisionsspritze und injizieren Sie die AAV-Partikel, die den genetisch kodierten Kalziumindikator tragen, 30 s lang in einem Winkel von 45° in den Glaskörper. In dieser Studie haben wir AAV2-CAG-GCaMP5G (7,5 x 1011 GC/ml in HBSS) verwendet (siehe Materialtabelle).
HINWEIS: AAV-Konstrukte, die keine potenziell tumorigenen Genprodukte oder Toxinmoleküle kodieren und ohne Helfervirus hergestellt werden, können in Einrichtungen der Biosicherheitsstufe 1 (BSL-1) gehandhabt werden. Andernfalls, wenn es als biogefährliches Material unter BSL-2-Eindämmung gilt, müssen geeignete Vorsichtsmaßnahmen getroffen werden16. AAVs, die für GCaMP kodieren, gelten als BSL-1 und müssen nicht in Biosicherheitswerkbänken manipuliert werden.
- Befestigen Sie eine stumpfe 36-G-Nadel an einer Präzisionsspritze und injizieren Sie die AAV-Partikel, die den genetisch kodierten Kalziumindikator tragen, 30 s lang in einem Winkel von 45° in den Glaskörper. In dieser Studie haben wir AAV2-CAG-GCaMP5G (7,5 x 1011 GC/ml in HBSS) verwendet (siehe Materialtabelle).
- Tragen Sie einen Tropfen Tobradex (siehe Materialtabelle) zur Vorbeugung von Entzündungen und als antibiotische Prophylaxe auf.
- Wiederholen Sie bei Bedarf die Schritte 2, 3 und 4 mit dem anderen Auge.
HINWEIS: Kontrollieren Sie die Tiere 12-24 Stunden nach der Operation, um sicherzustellen, dass keine Nebenwirkungen auftreten. - Drei Tage nach der Injektion ist die Netzhautstruktur mittels Fundoskopie und OCT mit einem In-vivo-Netzhautbildgebungssystem zu untersuchen (siehe Materialtabelle).
- Zwei Wochen nach der Injektion sollte der GCL Fluoreszenz emittieren. Beurteilung der Netzhautstruktur und der AAV-Expression durch Fluoreszenzfundoskopie mit einem In-vivo-Netzhautbildgebungssystem .
HINWEIS: Laut Weitz et al.12 macht sich die Fluoreszenz von AAV2-CAG-GCaMP5G 1 Woche nach der Injektion bemerkbar und intensiviert sich um 2 Wochen. Ab der vierten Woche induziert eine Überexpression von GCaMP eine Zytomorbidität. Sterbende Zellen weisen ein hohes Basisfluoreszenzsignal im Zellkern und im Zytoplasma auf, das als Reaktion auf die Stimulation nicht schwankt. In gesunden Zellen ist die GCaMP-Expression auf das Zytoplasma beschränkt und vom Zellkern ausgeschlossen 7,8,12,17,18. Diese Merkmale können ex vivo während der mikroskopischen Bildgebung beobachtet werden. Das Zeitfenster der Genexpression kann je nach viralem Vektor und gewähltem Promotor variieren.
- Betäuben Sie die 8 Wochen alte Long-Evans-Ratte mit 2 % Isofluran/1 % O2 , bis kein Pedalreflex mehr auftritt, und halten Sie die Anästhesie mit einer Ratten-Nasenmaske aufrecht (siehe Materialtabelle).
- Netzhautexzision und flache Montage
HINWEIS: Zwei bis drei Wochen nach der Injektion werden intravitreal injizierte Ratten unmittelbar vor Beginn des elektrophysiologischen Protokolls in Übereinstimmung mit den ethischen Standardrichtlinien (Richtlinie 86/609/EU der Europäischen Gemeinschaften) euthanasiert und von lokalen Ethikkommissionen genehmigt. Die Inhalation von Kohlendioxid (CO2) wird in diesem Protokoll als Euthanasiemethode verwendet.- Enukleation des Auges
- Drücken Sie vorsichtig mit einer gebogenen Pinzette auf die Außenseite der Augenhöhle, um das Auge leicht aus der Augenhöhle herauszuragen.
- Verwenden Sie eine Federschere, um die Muskeln, die das Auge halten, zu durchtrennen und zu enukleieren, wobei Sie darauf achten müssen, den Augapfel nicht zu durchstechen.
HINWEIS: Ausgehend von diesem Schritt wird die Netzhaut unter einem Stereomikroskop in sauerstoffhaltigem (95 % O2 / 5 %CO2) Ames-Medium präpariert.
- Netzhaut-Exzision
- Verwende eine kleine gebogene Pinzette und eine feine Federschere, um das gesamte umliegende Gewebe vom Augapfel zu entfernen.
- Nehmen Sie ein Stück ca. 3 cm x 3 cm Filterpapier und legen Sie es auf den Deckel einer 3,5 cm großen Schale. Tränken Sie das Papier mit Ames' Medium.
- Legen Sie den Augapfel auf das Papier, so dass das vordere Augensegment zum Bediener zeigt. Verwenden Sie eine gerade Pinzette, um den Augapfel zu halten, und positionieren Sie sie in einem Winkel von etwa 45° zur Oberfläche der Schale auf der Oberseite der Ora serrata. Mache einen kleinen Schnitt mit einer Klinge und verwende dabei den Abstand zwischen den geraden Pinzetten als Referenz.
- Erstatten Sie den Augapfel in Ames' Medium. Verwende eine gerade Pinzette und eine feine Federschere, um das vordere und hintere Augensegment zu trennen.
- Entferne die Linse vorsichtig mit zwei geraden Pinzetten. Trennen Sie dann die Netzhaut von der Sklera.
- Schneiden Sie die Sklera mit einer feinen Federschere in Richtung Sehnerv durch, bis die Netzhaut von der Augenmuschel isoliert ist.
- Verwenden Sie ein Fluoreszenz-Stereomikroskop, um den Bereich der Netzhaut mit der besten Kalziumindikatorexpression zu identifizieren.
HINWEIS: Das Ausmaß der Virusausbreitung hängt vom Erfolg der intravitrealen Injektion ab. Das Erreichen von Fluoreszenz über große Teile der Netzhaut kann Übung erfordern. Die Erfahrung des Prüfarztes spielt eine entscheidende Rolle, um optimale Ergebnisse zu erzielen. - Übertragen Sie mit einer Kunststoffpipette mit abgeschnittener Spitze das ausgewählte Stück der Netzhaut auf die Montagemembran (Montagemembranschritte). Verwenden Sie eine gerade Pinzette, um die Netzhaut mit der GCL nach oben flach zu befestigen.
- Entfernen Sie mit einer Kunststoffpipette, die an einer 100-μl-Pipettenspitze befestigt ist, das Medium, damit das Netzhautstück an der porösen Membran haften kann. Drehen Sie die Baugruppe auf die MEA, so dass die GCL auf den Elektroden aufliegt.
- Füllen Sie das Probenbad mit sauerstoffhaltigem Ames' Medium.
- Enukleation des Auges
3. Ex-vivo-Kalzium-Bildgebung nach elektrischer Stimulation
ANMERKUNG: In dieser Arbeit wurde ein Proof-of-Concept-MEA für Ex-vivo-Experimente verwendet. Die kundenspezifischen MEAs wurden mit porösen Elektroden auf Graphenbasis mit einem Durchmesser von 25 μm auf 500 μm dickem Borosilikatglas mit Ti/Au-Spuren hergestellt und später mit Siliziumnitrid und SU-8-Fotolack12 isoliert. Die Calcium-Imaging-Verfahren sind jedoch unabhängig vom für die Stimulation verwendeten Elektrodenmaterial gültig.
- Stellen Sie das Perfusionssystem so ein, dass das sauerstoffhaltige Ames-Medium das Probenbad konstant bei 33 °C bei einer konstanten Durchflussrate von 5 ml/min durchströmt.
- Mit einem inversen Fluoreszenzmikroskop, das mit einer Leuchtstofflampe, einem FITC-Filterwürfel und einer CMOS-Kamera ausgestattet ist, untersuchen Sie die Netzhaut auf einen Bereich, in dem die stimulierenden Elektroden und die Fluoreszenz von GCaMP-exprimierenden Zellen sichtbar sind. Für diese Studie wurde ein 20x NA 0,75 Luftobjektiv verwendet.
HINWEIS: Um die Zellen mit den Elektroden effektiv zu stimulieren (und aufzuzeichnen), müssen die Netzhaut und die Elektrode in engem Kontakt stehen. So befinden sich die Zellen sichtbar in der gleichen Brennebene wie die Elektroden. Ist dies nicht der Fall, wiederholen Sie die Schritte der Netzhautexzision ab Schritt 8. Beachten Sie bei der Verwendung von Netzhäuten aus gesunden Tiermodellen (mit funktionierenden Photorezeptoren), dass jedes Mal, wenn die Leuchtstofflampe eingeschaltet wird, einige hervorgerufene Reaktionen durch das Licht erzeugt werden, da die Netzhaut lichtempfindlich auf die Wellenlänge reagiert, die zur Anregung des GCaMP-Sensors verwendet wird. Diese lichtinduzierten Kalziumveränderungen können zur Beurteilung des Gesundheitszustands des Gewebes verwendet werden. Um eine Vermischung von Licht mit elektrisch evozierten Reaktionen zu vermeiden, schalten Sie die Leuchtstofflampe mindestens 1 Minute vor Beginn der Bildaufnahme ein. - Um elektrisch evozierte Reaktionen in der GCL hervorzurufen, wählen Sie eine Elektrode aus, um stromgesteuerte Impulse zu senden. Stellen Sie die Parameter der elektrischen Stimulation in der Software des Impulsgenerators ein, wie z. B.: Form, Amplitude, Dauer, Phasenverzögerung und Frequenz der anzuwendenden Impulse.
HINWEIS: Die effektiven Stimulusparameter können stark von Pulsbreiten von 50 μs bis 100 ms variieren, wobei die Amplituden von 0,1 μA bis 10 μA reichen. Diese Parameter können zusammen mit der Stimulusfrequenz, der Stimuluspolarität, der Anzahl der Pulse und den Interphasenverzögerungen die räumlich-zeitliche Reaktion beeinflussen, die durch die Kalziumbildgebung beobachtet wird 19,20,21,22. Ein Zug von 40 biphasischen Impulsen, die eine Stimulation von 1 ms und 2 μA liefern, erzeugt oft eine sichtbare Reaktion in markierten Neuronen. - Um die Bildaufnahme mit der Stimulationsabgabe zu synchronisieren, verwenden Sie den Impulsgenerator als externen Trigger, um den Beginn der Bildaufnahme zu steuern. Verbinden Sie die Kamera (siehe Materialtabelle) mit dem Impulsgeber über das Ausgangs-Trigger-Signal und stellen Sie den "Capture Mode" der Kamerasoftware auf "External Start Trigger". Drücken Sie in der Kamerasoftware auf Start, damit sie auf einen externen Auslöser wartet, um zu starten. Starten Sie die Bildaufnahme mit der Impulsgenerator-Software.
HINWEIS: Die externe Triggersteuerung kann für verschiedene Kameras unterschiedlich eingerichtet sein. In dieser Studie wurden in der Regel Bilder (512 x 512 Pixel, 16-Bit-Graustufen) mit 10 Bildern pro Sekunde für 1 Minute aufgenommen, während alle 10 s Bursts von biphasischen Pulsfolgen geliefert wurden. Die Impulsabgabe beginnt nach 10 s, so dass die ersten Bilder in allen Experimenten der spontanen Aktivität entsprechen. Abhängig vom GCaMP-Sensor und der Analyse, die durchgeführt wird, muss die Aufzeichnungsrate möglicherweise an die Anstiegs- und Abklingzeiten Ihres Kalziumindikators angepasstwerden 8. Berücksichtigen Sie die Empfindlichkeit des Kalziumindikators15 zum Nachweis einzelner Aktionspotentiale. - Speichern Sie die Bilder unter einem Dateinamen, der die angewendeten elektrischen Stimulationsparameter enthält, z. B. [Elektrodennummer]_[Pulsamplitude]_[Pulsdauer]_[Pulsfrequenz]_Image001.
4. Datenanalyse
- ImageJ/FIJI zur Extraktion des Fluoreszenzintensitätsprofils über die Zeit und der räumlichen Koordinaten aus den Zellsomas
- Segmentieren Sie die Region of Interest (ROI) mit den "Area Selection Tools" und fügen Sie sie dem ROI-Manager hinzu (Analyze > Tools > ROI Manager > Hinzufügen). Speichern Sie es im Menü ROI-Manager als .zip Ordner (Mehr > Speichern).
HINWEIS: In der Regel können die gleichen ROIs auf alle Stimulationsexperimente angewendet werden, da sie demselben Sichtfeld entsprechen. - Wählen Sie als zu extrahierenden Parameter den "Mittleren Grauwert" aus (Analysieren > Messungen festlegen).
- Extrahieren Sie den "Mittleren Grauwert" aus den Zellen-Somas, indem Sie auf Mehr > Multi Measure klicken. Ein Dialogfeld wird angezeigt. Aktivieren Sie die Optionen Alle 600 Slices messen und Eine Zeile pro Slice , um eine einzelne Tabelle zu erhalten, in der die Spalten den ROIs und die Zeilen den Zeitrahmen entsprechen. Speichern Sie die generierte Tabelle als .xls Tabelle.
- Wählen Sie den "Schwerpunkt" als zu extrahierenden Parameter aus (Analysieren > Messungen festlegen).
- Extrahieren Sie den "Schwerpunkt" aus den ROIs, indem Sie auf Messen klicken. Die generierte Tabelle entspricht den Koordinaten (X,Y) der ROIs. Speichern Sie es als .xls Tabelle.
- Segmentieren Sie die Region of Interest (ROI) mit den "Area Selection Tools" und fügen Sie sie dem ROI-Manager hinzu (Analyze > Tools > ROI Manager > Hinzufügen). Speichern Sie es im Menü ROI-Manager als .zip Ordner (Mehr > Speichern).
- Maßgeschneidertes Skript zur Identifizierung von Zellen, die auf die Reize reagieren
HINWEIS: Hier wurde MATLAB (siehe Materialtabelle) verwendet, aber die beschriebenen Schritte können in jeder Programmiersprache ausgeführt werden. Benutzer können unser maßgeschneidertes Skript erhalten, indem sie den entsprechenden Autor anfordern.- Korrektur des Photobleaching-Effekts: Um den Hintergrund- und Photobleaching-Effekt abzuschwächen, nehmen Sie 15-20 Frames aus den nicht stimulierenden Perioden vor jeder Serie und passen Sie sie an eine lineare Kurve an [anpassen (poly1)].
HINWEIS: In diesem Fall wurden für einen Film mit insgesamt 600 Bildern, in dem alle 10 s periodische Ausbrüche von Pulsfolgen gesendet wurden, die Frames 1:90, 170:190, 270:290, 370:390, 470:490, 570:590 als nicht stimulierende Perioden betrachtet. - Normalisieren Sie mit der Formel: (X-min) / (max-min)
- Identifizierung von antwortenden Zellen
- Berechnen Sie den quadratischen Mittelwert (RMS) der nicht stimulierenden Perioden aus den normalisierten Daten. Dies wird als Basissignal betrachtet.
- Berechnen Sie das Maximum der stimulierenden Perioden (Frames zwischen den nicht stimulierenden Perioden). In diesem Fall wurden für einen Film mit insgesamt 600 Bildern, in dem periodische Ausbrüche von Pulsfolgen alle 10 s gesendet wurden, die Frames 91:169, 191:269, 291:369, 391:469, 491:569 als die stimulierenden Perioden betrachtet.
- Wenn der Maximalwert das Basisliniensignal für einen bestimmten ROI um das 2,5-fache überschreitet, markieren Sie die Zelle als Reaktion auf diesen stimulierenden Zeitraum. Wenn die Zelle auf drei der fünf stimulierenden Perioden reagiert, klassifizieren Sie sie als reagierende Zelle.
- Korrektur des Photobleaching-Effekts: Um den Hintergrund- und Photobleaching-Effekt abzuschwächen, nehmen Sie 15-20 Frames aus den nicht stimulierenden Perioden vor jeder Serie und passen Sie sie an eine lineare Kurve an [anpassen (poly1)].
Ergebnisse
Das in dieser Studie beschriebene Protokoll basiert auf den von Weitz et al. durchgeführten Studien zur Fluoreszenzbildgebung und elektrischen Stimulation.12. Das Protokoll besteht aus drei Hauptteilen: (1) Fluoreszenzmarkierung der GCL und flacher Montage der Netzhaut auf der MEA (Abbildung 1-links), (2) Visualisierung der Kalziumaktivität im GCL während der elektrischen Stimulation (Abbildung 1-Mitte) und (3) Extraktion, Verarbeitung und Interpretation der Bildgebungsdaten (Abbildung 1-rechts).
Erstens, wie in Abbildung 1 links dargestellt, wird Long Evans-Ratten vor der Bildgebungssitzung intravitreal AAV2-CAG-GCaMP5G injiziert. Die optimale virale Expression für diesen Vektor tritt 2 bis 3 Wochen nach der Injektion auf12,18. Nach der vollständigen Betäubung des Tieres wird mit einer 30-G-Nadel ein Pilotloch gebohrt, und dann werden 5 μl AAV2-CAG-GCaMP5G langsam mit einer stumpfen 36-G-Nadel, die an einer Präzisionsspritze befestigt ist, in den Glaskörper injiziert, um einen Reflux zu verhindern. Während der viralen Expression wird ein In-vivo-Netzhautbildgebungssystem verwendet, um den Zustand der Netzhaut nach der Operation zu beurteilen, wobei OCT-Bilder eine detaillierte Visualisierung der Netzhautschichten ermöglichen. Sobald die Genexpression erreicht ist, wird die Netzhaut mit einem Stereomikroskop und hochpräzisen Präparierwerkzeugen vorsichtig aus der Augenmuschel entnommen. Ab diesem Zeitpunkt wird das Gewebe in sauerstoffhaltigen Medien manipuliert, um die Probe zu konservieren. Die herausgeschnittene Netzhaut wird dann mit der GCL nach oben auf einer Plattform montiert, die für eine flache Montage ausgelegt ist, um Stabilität zu gewährleisten und ein Aufschwimmen der Probe zu verhindern. Die Probe wird auf der MEA-Oberfläche montiert, wobei der GCL den Elektroden zugewandt ist.
Als nächstes wird die MEA auf ihrer Schnittstellenplatine auf einem inversen Fluoreszenzmikroskop montiert (Abbildung 1 Mitte). Die Netzhautprobe wird mit einem Perfusionssystem bei 33 °C mit sauerstoffhaltigen Medien perfundiert. Das Beispiel kann in dieser Konfiguration mehrere Stunden lang beibehalten werden. Das gewünschte Stimulationsschema wird programmiert und die Bilder werden mit einer Rate von 10 Bildern pro Sekunde aufgenommen. Es wird empfohlen, die Filme nach den angewendeten Elektrostimulationsparametern zu benennen. Die Bildaufnahme sollte vor Beginn der Stimulation beginnen, um einige Basisbilder ohne Stimulation zu erhalten, die als Negativkontrolle dienen.
Wie in Abbildung 1 rechts dargestellt, werden die Daten schließlich aus den Zeitrafferbildern extrahiert, indem die Zellsomen segmentiert werden. Photobleaching-Effekte werden durch Anpassung der Daten korrigiert und reaktionsfähige Zellen identifiziert. Responsive Zellen sind definiert als solche mit Fluoreszenzspitzen während der Stimulation, die ihren Ausgangswert um das 2,5-fache überschreiten. Wenn eine Zelle auf drei der fünf Stimulationsausbrüche reagiert, wird davon ausgegangen, dass sie auf diesen spezifischen Stimulationsstrang reagiert.
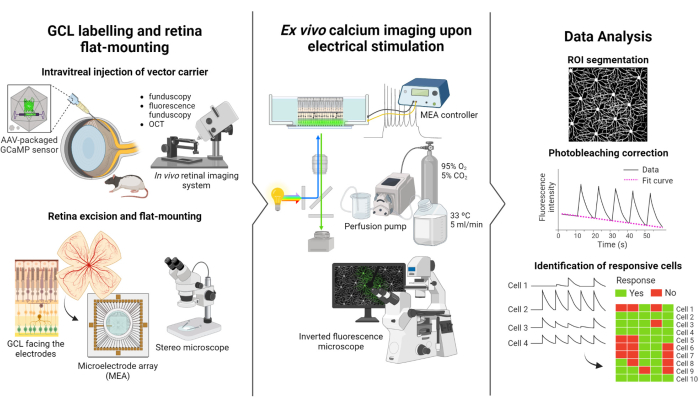
Abbildung 1: Überblick über die Studie. Schematische Darstellung des Protokolls für (links) fluoreszenzmarkierte GCL der Netzhaut und Probenmontage, (mittlere) Vorbereitung für Ex-vivo-Aufnahmen mit elektrischer Stimulation durch eine MEA und (rechts) Analyse der Kalziumbildgebungsdaten zur Klassifizierung reaktionsfähiger Zellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Intravitreal injizierte Netzhaut
Die Inzidenz von Komplikationen im Zusammenhang mit intravitrealen Injektionen ist sehr gering. Es gibt jedoch einige Komplikationen, die durch die Operation selbst entstehen können, unabhängig von der injizierten Komponente. Zu diesen Komplikationen gehören Kataraktbildung, Glaskörperblutungen, Erhöhung des Augeninnendrucks und Endophthalmitis23. Um festzustellen, ob diese Komplikationen durch die Operation verursacht werden, muss das Tier vor dem Eingriff mittels Funduskopie und OCT untersucht werden. Drei Tage nach der Injektion sollten die Tiere nachbeobachtet werden. In Abbildung 2A-D ist die Netzhaut eines gesunden injizierten Tieres dargestellt. Nach zweiwöchiger Injektion beginnen die RGCs Fluoreszenz zu exprimieren, was mittels Fluoreszenzfundoskopie sichtbar gemacht werden kann (Abbildung 2B,C). OCT-Bilder bieten eine detaillierte Visualisierung der Anordnung und Dicke der Netzhautschichten (Abbildung 2D) und bieten im Vergleich zur Funduskopie eine höhere Auflösung, insbesondere bei der Beurteilung der Netzhautablösung. Sobald die Netzhaut flach montiert und mit einem inversen Fluoreszenzmikroskop abgebildet ist, ist es möglich, die Zellen und Axonbündel zu unterscheiden. Im Gegensatz zu anderen Kalziumindikatoren ist der GCaMP-Indikator auf das Zytoplasmabeschränkt 7 und die Fluoreszenz ist vom Zellkern ausgeschlossen (Abbildung 2E).
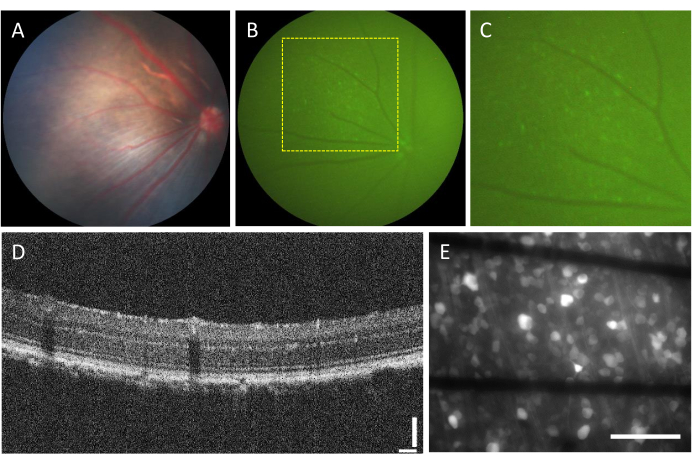
Abbildung 2: Repräsentative Bilder der intravitreal injizierten Netzhaut. (A) Fundoskopie, (B) Fluoreszenzfundoskopie, (C) Zoom-in der Fluoreszenzfundoskopie, (D) OCT-Bild und (E) Epifluoreszenzbild der exzidierten Netzhaut, montiert auf einer kundenspezifischen MEA mit Elektroden auf Graphenbasis auf 500 μm dickem Borosilikatglas. In (E) entsprechen schwarze Linien den Ti/Au-Spuren. Maßstabsleisten: 115 μm (D) und 100 μm (E). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Elektroden und GCL-Kontakt
Um neuronale Reaktionen effektiv hervorzurufen, muss sichergestellt werden, dass die flach montierte Netzhaut in engem Kontakt mit der Oberfläche der MEA steht. Eine einfache Möglichkeit, dies zu überprüfen, besteht darin, visuell zu bestätigen, ob sich die Zellen und Elektroden in derselben Brennebene befinden (Abbildung 3A). Wenn sich die Zellen nicht in der gleichen Fokusebene wie die Elektroden befinden (Abbildung 3B), deutet dies darauf hin, dass der Kontakt suboptimal ist, was zu einer weniger effektiven Stimulation führt.
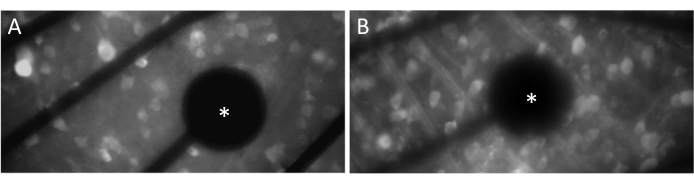
Abbildung 3: Elektroden und GCL-Kontakt. (A) Zellen und Elektrode (Sternchen) in derselben Fokusebene. (B) Zellen und Elektroden, die sich nicht in derselben Brennebene befinden, was auf einen suboptimalen Kontakt für die elektrische Stimulation in diesem Bereich hinweist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ex-vivo-Kalzium-Bildgebung nach elektrischer Stimulation durch eine MEA
Die daraus resultierenden Daten aus der Kalziumbildgebung bestehen aus Zeitrafferbildern, die die neuronale Aktivität von Hunderten von Zellen als Reaktion auf elektrische Stimulation überwachen. Überschwellige Stimuli bewirken einen Kalziumeinstrom in die Zellsomas, was zu einer plötzlichen Änderung der Fluoreszenzintensität führt (Video 1). Mit diesem Protokoll kann festgestellt werden, ob ein Elektroden-, MEA- und/oder Stimulationsalgorithmus die gewünschte Reaktion im Nervengewebe hervorruft. Die Größe und der Abstand der Elektroden auf der MEA sowie der Anteil des untersuchten Gewebes bestimmen die geeignete objektive Vergrößerung. Typischerweise ist für Einzelelektroden-Stimulationsstudien mit Durchmessern von 5 μm bis 100 μm eine 20- bis 25-fache Objektivvergrößerung geeignet (Abbildung 4A), die ein Sichtfeld von etwa 600 μm x 600 μm bietet. Bei Experimenten mit Stimulation mit mehreren Elektroden kann eine 4-10-fache Objektivvergrößerung erforderlich sein, um einen größeren Bereich von etwa 2 mm x 2 mm zu beurteilen. Responsive Zellen können leicht identifiziert werden, indem eine Bildprojektion mit Standardabweichung des Zeitrafferfilms erzeugt wird (Abbildung 4B und Video 1).
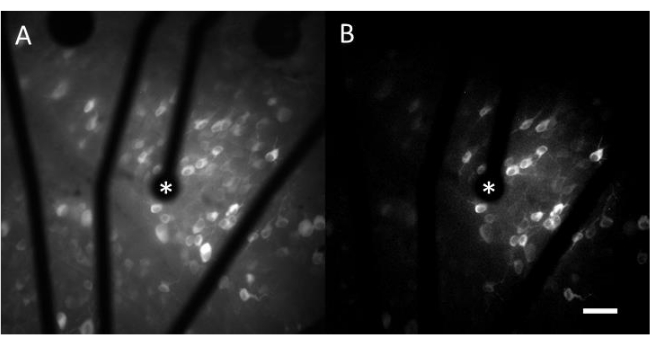
Abbildung 4: Kalzium-Bildgebung des GCL mit elektrischer Stimulation durch eine Elektrode mit einem Durchmesser von 25 μm. (A) Maximale Projektion eines 60-Sekunden-Zeitrafferfilms und (B) Standardabweichungsprojektion, die Zellen deutlich darstellt, die auf elektrische Reize von einer porösen Elektrode auf Graphenbasis mit einem Durchmesser von 25 μm reagieren. Die stimulierende Elektrode ist mit einem Sternchen gekennzeichnet. Maßstab: 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Analyse der Kalziumdynamik im Zeitverlauf bei kontrollierter Stimulation
Für jedes identifizierte Zellsoma wurden die mittleren Intensitätswerte über die Zeit extrahiert. Abbildung 5A zeigt die photobleaching-korrigierten Kalziumspuren aus den reaktionsfähigen Zellen. In diesem Beispiel wurden während einer 60-s-Bildaufnahme alle 10 s fünf Bursts von zweiphasigen Pulsfolgen (kathodisch-zuerst, 40 Zyklen, 1 ms Dauer, 2 μA Amplitude) (gekennzeichnet durch schwarze Linien) abgegeben. Innerhalb eines gegebenen Experiments werden die gleichen fünf Pulsfolgen angewendet, um die Konsistenz der Antwort zu testen. Die Frames, die während der nicht stimulierenden Perioden aufgenommen wurden (rot hervorgehoben), werden verwendet, um eine lineare Anpassung durchzuführen und den Photobleaching-Effekt zu korrigieren.
Sobald die antwortenden Zellen identifiziert sind und ihre Koordinaten (x,y) relativ zur stimulierenden Elektrode bekannt sind, kann man die Beziehung zwischen dem Strom, der zur Aktivierung der Zellen erforderlich ist, und dem Abstand von der stimulierenden Elektrode untersuchen (Abbildung 5B). Erwartungsgemäß benötigen Zellen, die sich näher an der stimulierenden Elektrode befinden, niedrigere Stromwerte, um eine Reaktion hervorzurufen.
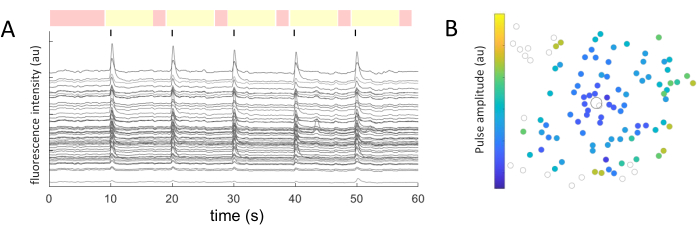
Abbildung 5: Darstellung der elektrisch evozierten Reaktionen. (A) Kalziumspuren von Zellsomas bei 5 Impulsstößen (biphasisch, kathodisch, 40 Zyklen, 1 ms Dauer, 2 μA Amplitude) alle 10 s (schwarze Linien) während einer 60 s Bildaufnahme. Nicht stimulierende (rot markierte Frames) und stimulierende Perioden (gelb markierte Frames) werden angezeigt. Spuren, die das Basissignal (Wurzel des mittleren Quadrats der nicht-stimulierenden Perioden) um das 2,5-fache überschreiten, werden als evozierte Reaktionen betrachtet. Zellen, die in drei der fünf stimulierenden Perioden reagieren, werden als reagierende Zellen klassifiziert. (B) Karte der Verteilung der Kalziumaktivität mit der stimulierenden Elektrode (schwarz umrandeter Kreis) und den Zellen (grau umrandeter Kreis). Der Farbcode stellt die minimale Pulsamplitude dar, die erforderlich ist, um eine zelluläre Reaktion hervorzurufen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Video 1: Kalzium-Bildgebung des GCL mit elektrischer Stimulation durch eine Elektrode mit einem Durchmesser von 25 μm. Das Video zeigt Unterschiede in der Fluoreszenzintensität aufgrund der elektrischen Stimulation durch eine poröse Elektrode auf Graphenbasis mit einem Durchmesser von 25 μm. Die linke Seite zeigt den Originalfilm und die rechte Seite zeigt die Standardabweichungsprojektion, bei der die antwortenden Zellen leicht identifiziert werden können. Maßstab: 50 μm. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Diskussion
Das hier beschriebene Protokoll dient dazu, die Kalziumdynamik zu untersuchen, die in der retinalen GCL der Ratte nach elektrischer Stimulation mit einer MEA auftritt. Es handelt sich um eine zuverlässige und handhabbare Methode, die jedoch einige Schulungen erfordert, insbesondere um die GCL effizient gleichmäßig zu markieren und die Netzhaut richtig zu befestigen, um einen optimalen Gewebe-Elektroden-Kontakt zu gewährleisten. Dieses Protokoll ist spezifisch für Nagetiere und muss angepasst werden, wenn es auf eine andere Laborspezies angewendet wird. Die kritischen Punkte, Modifikationen und Grenzen der Methodik werden detailliert dargestellt.
Intravitreale Injektionen
Injektionen werden häufig für die Verabreichung von okulären Genen verwendet, wobei intravitreale Injektionen das bevorzugte Verfahren sind. Sie haben sich als sicherer und weniger invasiv erwiesen im Vergleich zu subretinalen Injektionen, bei denen die interessierenden Moleküle direkt zwischen die Photorezeptoren und das retinale Pigmentepithel (RPE) eingeführt werden, wodurch die Gefahr einer Netzhautablösung besteht10. Es gibt jedoch Einschränkungen, insbesondere bei der Durchführung dieser Injektionen in Nagetiermodellen. Der Glaskörper ist gallertartig und behindert die virale Diffusion. Darüber hinaus ist die Linse in Nagetieraugen groß, so dass es nicht trivial ist, die Nadel einzuführen, ohne sie zu zerkratzen. Die Präzisionsspritzennadeln sind empfindlich und müssen häufig ausgetauscht werden. Um Verstopfungen zu vermeiden, waschen Sie sie vor und nach jedem Gebrauch mit deionisiertem Wasser und tauschen Sie sie regelmäßig aus. Injizieren Sie den Inhalt zusätzlich langsam, um einen Lösungsrückfluss und Veränderungen des Augeninnendrucks zu verhindern. Das Erreichen einer großen und gleichmäßigen Fluoreszenz auf der gesamten Netzhaut kann Übung erfordern.
Transduktion von Netzhautzellen
Virale Vektoren sind eine hervorragende Methode für die In-vivo-Genübertragung, und AAVs werden häufig für die Transduktion von Netzhautzellen verwendet10. Sie wurden zur Behandlung einiger Retinopathien zugelassen, die zur Erblindung des Menschen führen24. Ihre Trägerkapazität ist jedoch auf 5 kb begrenzt, einschließlich der erforderlichen regulatorischen Elemente (z. B. des Projektträgers)10,25. Es gibt mehrere Serotypen, jeder mit unterschiedlichem Tropismus. Wählen Sie das am besten geeignete AAV basierend auf den zu verabreichenden Genen und den zu übertragenden Zellenaus 26. Für die Markierung der RGCs wird empfohlen, AAV227 zu verwenden.
Genexpressions-Fenster
Die optimale virale Expression für AAV2-CAG-GCaMP5G beträgt 2 bis 3 Wochen nach der Injektion12,18. Jenseits dieses Zeitraums werden die Zellkerne der transfizierten Zellen fluoreszierend, die Zellen reagieren nicht mehr auf Reize und sterben schließlichab 7,28,29. Dies ist auf die Überexpression des GCaMP-Indikators zurückzuführen, der in den Zellkern transloziert wird. Das Zeitfenster für eine optimale Genexpression variiert je nach viralem Vektor und gewähltem Promotor30 und muss experimentell bestimmt werden, bevor mit diesem Protokoll fortgefahren werden kann.
Kontakt zwischen Gewebe und Elektrode
Für optimale und reproduzierbare Ergebnisse ist ein guter Gewebe-Elektroden-Kontakt entscheidend. Ein schlechter Kontakt ist in der Regel auf die natürliche Krümmung der Netzhaut zurückzuführen. Ein Ansatz besteht darin, die Netzhaut zu vierteln, zu montieren und einen Abschnitt nach dem anderen abzubilden. Kleine Teile der Netzhaut können besser abgeflacht werden, was zu einem effektiveren Kontakt mit der MEA-Oberfläche führt. Ein weiterer möglicher Grund für einen schlechten Kontakt ist das Vorhandensein von Glaskörper. Bei der Durchführung von Stimulationsexperimenten, bei denen ein epiretinales Implantat simuliert wird, ist es wichtig, den Glaskörper während der Netzhautexzision vorsichtig zu entfernen, da er als Isolator für Strom wirken kann. Hier wird eine einfache Methode beschrieben, um zu überprüfen, ob der Kontakt ausreichend ist, indem Elektrode und Zellen in der gleichen Fokusebene visualisiert werden.
Eine Alternative zu ex vivo Netzhautmessungen besteht darin, Neuronen direkt auf der Oberfläche der Elektroden zu züchten. Eine Primärkultur von Neuronen, wie z. B. Hippocampus-Neuronen31, kann für erste Tests nützlich sein, um die Funktionalität der neuartigen Stimulationsvorrichtung zu bewerten. Dieser Ansatz erfordert jedoch immer noch den Einsatz von Labortieren und repräsentiert nicht die Komplexität des Netzhautnetzwerks, das für die Bewertung der synaptischen Reaktionen auf die Stimulation wichtig ist.
Um die Zellen unter der Elektrode und die Elektrodenspuren sichtbar zu machen, können MEAs verwendet werden, die aus transparenten Materialien wie Indiumzinnoxid (ITO) hergestellt werden 19,20,32. Zusätzlich zu den optischen Messungen kann die GCL-Aktivität bei elektrischer Stimulation durch elektrische Aufzeichnungen beurteilt werden. Mit der MEA kann das lokale Feldpotential (LFP) des Gewebes aufgezeichnet werden. Dies beeinträchtigt jedoch die räumliche Auflösung, da jede Elektrode die Aktivität mehrerer Zellen gleichzeitig erfasst (abhängig von den Elektrodenabmessungen). Die optische Aufzeichnung überwindet diese Einschränkung und bietet eine Abbildung mit höherer räumlicher Auflösung. Sein Hauptvorteil ist die Fähigkeit, zwischen aktiven und inaktiven Zellen zu unterscheiden und gleichzeitig ein großes Sichtfeld mit Einzelzellauflösung zu messen. Unter allen zellulären Aktivitätsberichten sind Kalziumindikatoren gut beschrieben und werden am häufigsten verwendet33.
Offenlegungen
Die Autoren haben dem Manuskript keine Angaben zu machen.
Danksagungen
Wir danken Merche Rivas, Angel Sandoval, Jesús Planagumà, Jordi Cortés, Sandra Ortonobés Lara und Alina Hirschmann (ICFO-Institut de Ciències Fotòniques) für ihre technische Unterstützung, Anna Duarri (VHIR, Vall d'Hebron Institute of Research) von der Ophthalmology Research Group für ihre Unterstützung bei den intravitrealen Injektionen und der In-vivo-Netzhautbildgebung .
Die Geldgeber, die diese Arbeit unterstützt haben, sind: Fundació CELLEX; Fundació Mir-Puig; Ministerio de Economía y Competitividad - Severo Ochoa-Programm für Exzellenzzentren in Forschung und Entwicklung (CEX2019-000910-S, [MCIN/AEI/10.13039/501100011033]); Generalitat de Catalunya durch das CERCA-Programm; Laserlab-Europe (EU-H2020 GA Nr. 871124); Stiftung La Caixa (LCF/HR19/52160003); und Fondo Social Europeo (PRE2020-095721, M.C.).
Materialien
| Name | Company | Catalog Number | Comments |
| 20x NA 0.75 S Fluor air objective | Nikon | CFI Super Fluor 20X | - |
| 3.5 cm Cell culture dish | Nunc | 12-565-90 | - |
| 30 G needle | VWR | 613-5373 | - |
| 36 G blunt needle | World Precision Instruments | NF36BL-2 | - |
| 6 cm Cell culture dish | Nunc | 12-565-94 | - |
| AAV2-CAG-GCaMP5G | Vector Biolabs | - | - |
| Ames' Medium | Sigma Aldrich | A1420 | - |
| Blade | Swann-morton | 0308 | - |
| Camera | Hamamatsu | ORCA Flash v4.0 | - |
| Carbogen | Air liquide | - | - |
| Curved-forceps | - | - | - |
| Fine spring-scissors | FST | 91501-09 | - |
| FITC filter cube | Nikon | Standard series | - |
| Fluorescent lamp | Nikon | C-HGFI | - |
| Fluorescent stereomicroscope | Nikon | SMZ25 | - |
| HBSS | Capricorn | HBSS-1A | - |
| ImageJ/FIJI | NIH | v1.50i | - |
| In vivo retinal imaging system | Phoenix Research Laboratories | Micron III | - |
| Inverted fluorescence microscope | Nikon | Eclipse Ti | - |
| Isofluorane | Arrane Baxter Laboratories | - | - |
| Long-Evans rat | Janvier | - | - |
| MATLAB (Version R2021b) | Mathworks | - | - |
| Media filters | Merckmillipore | SCGPS02RE | - |
| Methocel 2% | Omni Vision | - | - |
| Microelectrode array (MEA) | - | Custom-made | |
| NaHCO3 | Thermofisher | 42427 | - |
| Penicillin/Streptomycin 100x | Thermofisher | 15140122 | - |
| Phenylephrine | Alcon Cusí Laboratories | 653437.3 | 100 mg/mL |
| Plastic pipette | VWR | 612-1793 | - |
| Porous membrane | Merckmillipore | #JVWP01300 | - |
| Precision syringe | World Precision Instruments | 10 µl Nanofil | - |
| Prescaina | Llorens | - | Oxybuprocaine chlorhydrate (2 mg/mL), local anesthetic |
| Rat nasal mask | Xenotec | XRK-RA | - |
| Small curved-forceps | Bbraun | AESCBD311R | - |
| Spring-scissors | FST | 15040-11 | - |
| Stereo microscope | Zeiss | Stemi 2000 | - |
| Straight forceps | FST | 11252-20 | - |
| Suture filament | Vitrex Medical | 4328 | Nilon monofilament, 7/0, DS12 |
| Tobradex | Alcon Cusí Laboratories | - | Tobramycin (3 mg/mL) and dexamethasone (1 mg/mL) |
| Tropicamide | Alcon Cusí Laboratories | 653486 | 10 mg/mL |
| Washer | Thorlabs | W8S038 | - |
Referenzen
- Bourne, R. R. A., et al. Prevalence and causes of vision loss in high-income countries and in Eastern and Central Europe in 2015: Magnitude, temporal trends and projections. British Journal of Ophthalmology. 102 (5), 575-585 (2018).
- Li, J. Q., et al. Prevalence and incidence of age-related macular degeneration in Europe: a systematic review and meta-analysis. British Journal of Ophthalmology. 104 (8), 1077-1084 (2020).
- Roska, B., Sahel, J. A. Restoring vision. Nature. 557 (7705), 359-367 (2018).
- Hornig, R., Velikay-Parel, M. Retina implants. Implantable Sensor Systems for Medical Applications. , Elsevier. 469-496 (2013).
- Lewis, P. M., et al. Advances in implantable bionic devices for blindness: a review. ANZ Journal of Surgery. 86 (9), 654-659 (2016).
- Weiland, J. D., Walston, S. T., Humayun, M. S. Electrical stimulation of the retina to produce artificial vision. Annual Review of Vision Science. 2, 273-294 (2016).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6, 875-881 (2009).
- Chen, T. -W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499, 295-300 (2013).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca2+ probe composed of a single green fluorescent protein. Nature Biotechnology. 19, 137-141 (2001).
- Sahu, B., Chug, I., Khanna, H. The ocular gene delivery landscape. Biomolecules. 11 (8), 1135(2021).
- Hanlon, K. S., et al. A novel retinal ganglion cell promoter for utility in AAV vectors. Frontiers in Neuroscience. 11, (2017).
- Weitz, A. C., et al. Imaging the response of the retina to electrical stimulation with genetically encoded calcium indicators. Journal of Neurophysiology. 9 (7), 1979-1988 (2013).
- Briggman, K. L., Euler, T. Bulk electroporation and population calcium imaging in the adult mammalian retina. Journal of Neurophysiology. 105 (5), 2601-2609 (2011).
- Baden, T., Berens, P., Franke, K., Román Rosón, M., Euler, T. The functional diversity of retinal ganglion cells in the mouse. Nature. 529, 345-350 (2016).
- Zhang, Y., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Nature. 615, 884-891 (2023).
- Meyer, E. L., Jenkins, C., Rengarajan, K. NIH Guidelines April 2019. Applied Biosafety. 24, Preprint at https://doi.org/10.1177/1535676019871146 (2019).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Chang, Y. -C., Walston, S. T., Chow, R. H., Weiland, J. D. GCaMP expression in retinal ganglion cells characterized using a low-cost fundus imaging system. Journal of Neural Engineering. 14 (5), 056018(2017).
- Weitz, A. C., et al. Improving the spatial resolution of epiretinal implants by increasing stimulus pulse duration. Science Translational Medicine. 7 (318), 1-12 (2015).
- Chang, Y. C., Ghaffari, D. H., Chow, R. H., Weiland, J. D. Stimulation strategies for selective activation of retinal ganglion cell soma and threshold reduction. Journal of Neural Engineering. 16 (2), 026017(2019).
- Im, M., Fried, S. I. Temporal properties of network-mediated responses to repetitive stimuli are dependent upon retinal ganglion cell type. Journal of Neural Engineering. 13 (2), 025002(2016).
- Jensen, R. J., Ziv, O. R., Rizzo, J. F. Thresholds for activation of rabbit retinal ganglion cells with relatively large, extracellular microelectrodes. Investigative Ophthalmology & Visual Science. 46 (4), 1486-1496 (2005).
- Ramos, M. S., et al. Patient-reported complications after intravitreal injection and their predictive factors. Ophthalmology Retina. 5 (7), 625-632 (2021).
- Vandenberghe, L. H., Auricchio, A. Novel adeno-associated viral vectors for retinal gene therapy. Gene Therapy. 19 (2), 162-168 (2012).
- Zin, E. A., Ozturk, B. E., Dalkara, D., Byrne, L. C. Developing new vectors for retinal gene therapy. Cold Spring Harbor Perspectives in Medicine. , a041291(2023).
- Haggerty, D. L., Grecco, G. G., Reeves, K. C., Atwood, B. Adeno-associated viral vectors in neuroscience research. Molecular Therapy-Methods & Clinical Development. 17, 69-82 (2020).
- Hellström, M., et al. Cellular tropism and transduction properties of seven adeno-associated viral vector serotypes in adult retina after intravitreal injection. Gene Therapy. 16 (4), 521-532 (2009).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nature Protocols. 11, 566-597 (2016).
- Yang, Y., et al. Improved calcium sensor GCaMP-X overcomes the calcium channel perturbations induced by the calmodulin in GCaMP. Nature Communications. 9, 1504(2018).
- Nieuwenhuis, B., et al. Improving adeno-associated viral (AAV) vector-mediated transgene expression in retinal ganglion cells: comparison of five promoters. Gene Therapy. 30, 503-519 (2023).
- Cunquero, M., Aguilar, E., Loza-Alvarez, P., Planagumà, J. Hippocampal neuronal cultures to detect and study new pathogenic antibodies involved in autoimmune encephalitis. Journal of Visualized Experiments. 184, e63829(2022).
- Behrend, M. R., Ahuja, A. K., Humayun, M. S., Chow, R. H., Weiland, J. D. Resolution of the epiretinal prosthesis is not limited by electrode size. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 19 (4), 436-442 (2011).
- Grienberger, C., Konnerth, A. Imaging calcium in neurons. Neuron. 73 (5), 862-885 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten