Method Article
电刺激平装视网膜中的钙成像
摘要
视网膜假体具有产生视觉感知的能力。为了推进新型假体的开发,需要在植入前使用 离体 方法对设备进行测试。本文提供了一个全面的方案,用于研究视网膜神经节细胞层在受到电刺激时的钙活性。
摘要
视网膜营养不良是全球失明的主要原因。人们正在努力开发先进的视网膜假体,该假体可以绕过退化视网膜中受损的感光光细胞,旨在通过诱导视觉知觉来部分恢复视力。一种常见的研究途径涉及设计和生产具有柔性物理结构的植入式设备,可容纳大量电极。这样可以高效、精确地生成视觉感知。然而,随着技术的不断进步,在进行体内实验之前,需要一种可靠且易于管理的离体方法来验证设备的功能,其中除了设备性能之外的因素也会发挥作用。本文提出了一种研究电刺激后视网膜神经节细胞层 (GCL) 中钙活性的综合方案。具体来说,概述了以下步骤:(1)使用基因编码的钙指示剂对大鼠视网膜进行荧光标记,(2)使用倒置荧光显微镜捕获荧光信号,同时应用不同的电刺激模式,以及(3)从GCL内的单个细胞中提取和分析钙痕迹。通过遵循此程序,研究人员可以在进行体内实验之前有效地测试新的刺激方案。
引言
视网膜含有感光细胞,它们是负责感知光的细胞。它们捕获光子并将其转化为神经冲动。然后,这些冲动在视网膜内进行处理并传递到视觉皮层,从而形成视觉图像1。色素性视网膜炎 (RP) 和年龄相关性黄斑变性 (AMD) 是以光感受器进行性丧失为特征的退行性疾病。这些视网膜病变是全球失明的主要原因之一1,影响着数百万人,并对患者、医疗保健系统和整个社会产生重大的医疗、个人和社会经济后果。此外,随着人口老龄化,预计到 2050 年,AMD 病例将增加 15%2。
目前,许多研究工作正在进行中,以恢复受这些疾病影响的患者的视力3.一种有前途的方法是使用视网膜假体,该假体已被证明可有效部分恢复视力 4,5。这些设备从视觉场景中捕获光并将其转换为电脉冲。这些脉冲通过植入眼睛的微电极阵列 (MEA) 内的电极传递,刺激幸存的神经元并绕过丢失的光感受器的功能。激活的视网膜神经节细胞 (RGC) 将输出传递到大脑,在那里它被解释为视觉感知。然而,当前植入物的主要局限性在于电极-组织界面6的分辨率和对不同细胞类型的非选择性刺激。因此,为了优化新型植入式设备的设计以实现更有效的视力恢复,了解如何开发刺激范式以选择性地激活靠近电极的细胞至关重要。
钙成像是一种广泛使用的神经活动研究技术,与非光学方法相比具有多项优势 7,8。首先,它提供细胞和亚细胞分辨率。其次,钙标志物可以靶向特定的细胞类型。第三,它允许长期跟踪,第四,它能够观察整个细胞群,同时区分活性细胞和非活性细胞。该方法提供了细胞活动的间接证据,时间分辨率在数百毫秒的范围内。基因编码的荧光钙指示剂,如GCaMP传感器,在与钙结合时发生构象变化,导致荧光增加9。重组腺相关病毒载体 (AAV) 是用 GCaMP10 转导视网膜细胞的有效手段。
该协议提出了一种有效的方法,该方法利用钙成像来测试视网膜植入物的刺激方案。具体来说,我们专注于 离体 大鼠视网膜组织,并提供从样品采集到数据分析的详细分步说明。通过提供这份全面的指南,来自不同背景的研究人员可以自信地进行电刺激实验。
研究方案
所有动物程序均按照标准动物伦理准则(欧洲共同体指令 86/609/EU)进行,并得到当地动物伦理委员会的批准。本研究使用8周龄的Long Evans大鼠。这些动物是从商业来源获得的(见 材料表)。
1. 介质的准备和平装组件
- Ames' 培养基 (1 L)
- 在 1 L 玻璃瓶中,将 Ames 培养基粉末、1.9 g/L NaHCO3、10 ml 青霉素/链霉素 100x 和 1 L 去离子水混合(参见 材料表)。用去离子水或NaHCO3将pH调节至7.4,渗透压调节至280mOsm。通过在罩下通过0.2μm孔径过滤器过滤溶液来灭菌溶液。
注意:将灭菌培养基储存在4°C。 该溶液保持稳定,可使用长达 1 个月。
- 在 1 L 玻璃瓶中,将 Ames 培养基粉末、1.9 g/L NaHCO3、10 ml 青霉素/链霉素 100x 和 1 L 去离子水混合(参见 材料表)。用去离子水或NaHCO3将pH调节至7.4,渗透压调节至280mOsm。通过在罩下通过0.2μm孔径过滤器过滤溶液来灭菌溶液。
- 安装膜
- 使用小滴胶水将一个 PTFE 多孔膜(参见 材料表)连接到垫圈上。让它干燥至少 15 分钟。
- 为了达到半透明性,将膜浸入70%乙醇中1分钟。
- 用去离子水冲洗膜两次,以完全去除乙醇。将它们储存在去离子水中以防止不透明。
2. GCL贴标和大鼠视网膜平装
注意:这种标记方法不能将 RGC 与移位的无长突细胞区分开来。如果需要对 RGC 进行选择性标记,请考虑使用带有 RGC 特异性启动子11 的 AAV 和/或通过视神经12 进行逆行标记。为了区分 ON 和 OFF-center RGC 的类别,根据其光响应对 RGC 进行分类13,14,并利用较新版本的基因编码钙指示剂,这些指示剂具有更高的灵敏度和测量单动作电位的能力15。
- 玻璃体内注射
- 用2%异氟烷/ 1%O2 麻醉8周龄的Long Evans大鼠,直到没有踏板反射,并用大鼠鼻罩保持麻醉(见 材料表)。
注意: 在麻醉期间,将动物放在加热垫上以保持体温。 - 滴一滴市售滴眼液(见 材料表)以扩张瞳孔。
- 在进行手术之前,使用眼底镜检查和光学相干断层扫描 (OCT) 以及 体内 视网膜成像系统检查眼睛是否有异常。涂抹一滴 2% 的 Methocel 以促进角膜与客观接触(见 材料表)。
注意:如果检测到任何异常,请不要继续对该眼睛进行后续步骤。 - 使用一滴Prescane作为局部麻醉剂。用市售缝合线固定眼睑和角膜缘结膜(见 材料表)。使用 30 G 针头在距角膜缘 4 mm 处进行 1 毫米硬化切开术。
- 将 36 G 钝针连接到精密注射器上,然后将携带基因编码钙指示剂的 AAV 颗粒以 45° 角注射到玻璃体中 30 秒。在这项研究中,我们使用了AAV2-CAG-GCaMP5G(HBSS中的7.5 x10 11 GC/mL)(见 材料表)。
注:不编码潜在致瘤基因产物或毒素分子且在没有辅助病毒的情况下生产的 AAV 构建体可以在生物安全 1 级 (BSL-1) 设施中处理。否则,如果被视为 BSL-2 收容下的生物危害材料,则必须采取适当的预防措施16.编码 GCaMP 的 AAV 被认为是 BSL-1,不需要在生物安全柜下进行操作。
- 将 36 G 钝针连接到精密注射器上,然后将携带基因编码钙指示剂的 AAV 颗粒以 45° 角注射到玻璃体中 30 秒。在这项研究中,我们使用了AAV2-CAG-GCaMP5G(HBSS中的7.5 x10 11 GC/mL)(见 材料表)。
- 涂抹一滴Tobradex(见 材料表)以预防炎症并作为抗生素预防。
- 如果需要,用另一只眼睛重复步骤 2、3 和 4。
注意:手术后 12-24 小时检查动物,以确保没有不良反应。 - 注射后三天,使用眼底镜检查和OCT检查视网膜结构,并带有 体内 视网膜成像系统(见 材料表)。
- 注射两周后,GCL应发出荧光。使用 体内 视网膜成像系统通过荧光眼底镜检查评估视网膜结构和 AAV 表达。
注意:根据 Weitz 等人 12,AAV2-CAG-GCaMP5G 的荧光在注射后 1 周变得明显,并在 2 周时增强。从第四周开始,GCaMP的过表达诱导细胞病。垂死细胞在细胞核和细胞质中表现出高基线荧光信号,该信号不会因刺激而波动。在健康细胞中,GCaMP 表达仅限于细胞质并被排除在细胞核之外 7,8,12,17,18。这些特征可以在显微镜成像过程中从体内观察到。基因表达窗口可能因病毒载体和所选启动子而异。
- 用2%异氟烷/ 1%O2 麻醉8周龄的Long Evans大鼠,直到没有踏板反射,并用大鼠鼻罩保持麻醉(见 材料表)。
- 视网膜切除和平装
注意:注射后两到三周,根据标准伦理准则(欧洲共同体指令 86/609/EU)并经当地伦理委员会批准,在电生理学方案开始之前立即对玻璃体内注射的大鼠实施安乐死。二氧化碳 (CO 2) 吸入在本协议中用作安乐死方法。- 眼部摘除术
- 使用一对弯曲的镊子轻轻按压眼眶的外部,使眼睛从眼窝中稍微突出。
- 用一把弹簧剪刀剪断固定眼睛的肌肉并将其摘除,注意不要刺穿眼球。
注意:从这一步开始,在含氧(95%O2 / 5%CO2)Ames培养基中在立体显微镜下解剖视网膜。
- 视网膜切除术
- 使用一把弯曲的小镊子和细弹簧剪刀从眼球上去除所有周围组织。
- 取一张约 3 厘米 x 3 厘米的滤纸,将其放在 3.5 厘米培养皿的盖子上。用艾姆斯培养基浸泡纸张。
- 将眼球放在纸的顶部,前段朝向操作者。使用一对直镊子固定眼球,将它们定位在锯齿肌的顶部,与培养皿表面成大约 45° 角。用刀片做一个小切口,使用直镊子之间的空间作为参考。
- 将眼球报销到 Ames' Medium 中。使用一把直镊子和细弹簧剪刀将眼睛的前段和后段分开。
- 使用两对直镊子小心地取出晶状体。然后,将视网膜与巩膜分开。
- 使用细弹簧剪刀将巩膜朝向视神经切割,直到视网膜与眼罩隔离。
- 使用荧光体视显微镜确定视网膜中钙指示剂表达最佳的区域。
注意:病毒传播的程度取决于玻璃体内注射的成功。在视网膜的大部分区域实现荧光可能需要练习。研究者的经验在获得最佳结果方面起着至关重要的作用。 - 使用切割尖端塑料移液器,将选定的视网膜转移到安装膜上(安装膜步骤)。使用一对直镊子平装视网膜,GCL 朝上。
- 将塑料移液器连接到100 μL移液器吸头,取出培养基,使视网膜片粘附在多孔膜上。将组件翻转到 MEA 上,使 GCL 位于电极顶部。
- 用含氧的Ames培养基填充样品浴。
- 眼部摘除术
3. 电刺激下的 离体 钙成像
注:在这项工作中,概念验证MEA用于 离体 实验。定制的膜电极是用直径为25 μm的多孔石墨烯基电极在500 μm厚的硼硅酸盐玻璃上制备的,上面有Ti/Au迹线,然后用氮化硅和SU-8光刻胶绝缘12。然而,无论用于刺激的电极材料如何,钙成像方法都是有效的。
- 设置灌注系统,使含氧Ames培养基在33°C下以5 mL/min的恒定流速持续灌注样品浴。
- 使用配备荧光灯、FITC滤光片立方体和CMOS相机的倒置荧光显微镜,检查视网膜中刺激电极和GCaMP表达细胞的荧光可见的区域。本研究使用了 20x NA 0.75 空气物镜。
注意:为了有效地刺激(和记录)电极的细胞,视网膜和电极需要密切接触。因此,细胞明显地与电极位于同一焦平面上。如果不是这种情况,请从第 8 步开始重复视网膜切除的步骤。当使用来自健康动物模型(具有功能性光感受器)的视网膜时,请注意,每次打开荧光灯时,光都会产生一些诱发反应,因为视网膜对用于激发 GCaMP 传感器的波长敏感。这些光诱导的钙变化可用于评估组织的健康状况。为避免将光与电诱发响应混合,请在开始图像采集前至少 1 分钟打开荧光灯。 - 要在 GCL 中引起电诱发响应,请选择一个电极来发送电流控制脉冲。在脉冲发生器装置的软件中设置电刺激参数,如:要施加的脉冲的形状、振幅、持续时间、相位延迟和频率。
注: 有效激励参数的脉冲宽度从 50 μs 到 100 ms 不等,幅度范围为 0.1 μA 至 10 μA。这些参数以及刺激频率、刺激极性、脉冲数和相间延迟会影响钙成像 19,20,21,22 观察到的时空响应。一列 40 个双相脉冲提供 1 ms、2 μA 的刺激通常会在标记的神经元中产生可见的反应。 - 要使图像采集与刺激传输同步,请使用脉冲发生器作为外部触发器来控制图像采集的开始。使用输出触发信号将相机(参见 材料表)与脉冲发生器连接,并将相机软件的"拍摄模式"设置为"外部启动触发"。在相机软件中按开始,等待外部触发器启动。使用脉冲发生器软件开始图像采集。
注意: 对于不同的摄像机,外部触发控制的设置可能不同。本研究通常以每秒 10 帧的速度采集图像(512 x 512 像素,16 位灰度),持续 1 分钟,同时每 10 秒提供一次双相脉冲序列的爆发。脉冲传递在 10 秒后开始,因此所有实验中的第一帧都对应于自发活动。根据 GCaMP 传感器和将要执行的分析,可能需要根据钙指示剂8 的上升和衰减时间调整记录速率。考虑检测钙指示剂15的单动作电位的灵敏度。 - 使用包含所应用电刺激参数的文件名保存图像,例如[电极编号]_[脉冲幅度]_[脉冲持续时间]_[脉冲频率]_Image001。
4. 数据分析
- ImageJ/FIJI从细胞体中提取随时间变化的荧光强度分布和空间坐标
- 使用"区域选择工具"对感兴趣区域 (ROI) 进行细分,并将其添加到 ROI 管理器(> ROI 管理器>添加>分析工具)。在 ROI 管理器菜单中,将其另存为.zip文件夹(更多>保存)。
注意:通常,相同的 ROI 可以应用于所有刺激实验,因为它们对应于相同的 FOV。 - 选择"平均灰度值"作为要提取的参数(分析>设置测量值)。
- 通过单击" 更多"从单元格体块中提取"平均灰度值">多度量。将出现一个对话框。启用 "测量所有 600 个切片 "和 "每个切片一行 "选项,以获取单个表,其中列对应于 ROI,行对应于时间范围。将生成的表格另存为.xls电子表格。
- 选择"质心"作为要提取的参数(分析>设置测量值)。
- 通过单击 "测量"从 ROI 中提取"质心"。生成的表格对应于 ROI 的坐标 (X,Y)。将其另存为.xls电子表格。
- 使用"区域选择工具"对感兴趣区域 (ROI) 进行细分,并将其添加到 ROI 管理器(> ROI 管理器>添加>分析工具)。在 ROI 管理器菜单中,将其另存为.zip文件夹(更多>保存)。
- 自定义脚本,用于识别对刺激做出反应的细胞
注意:此处使用了 MATLAB(参见 材料表),但所描述的步骤可以在任何编程语言中实现。用户可以通过请求相应的作者来获取我们的定制脚本。- 光漂白效果校正:为了减轻背景和光漂白效果,在每次爆发前从非刺激期中取出 15-20 帧,并将它们拟合到线性曲线上 [拟合 (poly1)]。
注意:在这种情况下,对于总共 600 帧的电影,其中每 10 秒发送周期性脉冲序列的爆发,帧 1:90、170:190、270:290、370:390、470:490、570:590 被视为非刺激周期。 - 使用公式进行归一化:(X-min) / (max-min)
- 识别应答细胞
- 根据归一化数据计算非刺激周期的均方根 (RMS)。这将被视为基线信号。
- 计算刺激期的最大值(非刺激期之间的帧数)。在这种情况下,对于总共 600 帧的电影,其中每 10 秒发送周期性脉冲序列,帧 91:169、191:269、291:369、391:469、491:569 被认为是刺激期。
- 如果特定 ROI 的最大值超过基线信号 2.5 倍,则将细胞标记为对该刺激期有响应。如果细胞对五个刺激期中的三个有反应,则将其归类为反应细胞。
- 光漂白效果校正:为了减轻背景和光漂白效果,在每次爆发前从非刺激期中取出 15-20 帧,并将它们拟合到线性曲线上 [拟合 (poly1)]。
结果
本研究中描述的方案基于 Weitz 等人进行的荧光成像和电刺激研究12。该协议由三个主要部分组成:(1)GCL的荧光标记和视网膜在MEA上的平装(图1-左),(2)电刺激期间GCL中钙活性的可视化(图1-中),以及(3)成像数据的提取,处理和解释(图1-右)。
首先,如图1左图所示,在成像之前,将Long Evans大鼠玻璃体内注射AAV2-CAG-GCaMP5G。该载体的最佳病毒表达发生在注射后 2 至 3 周12,18。对动物完全麻醉后,使用30G针头制作导向孔,然后使用连接到精密注射器的36G钝针将5μL的AAV2-CAG-GCaMP5G缓慢注射到玻璃体中以防止反流。在病毒表达过程中,体内视网膜成像系统用于评估术后视网膜的状况,OCT 图像提供视网膜层的详细可视化。一旦实现基因表达,使用体视显微镜和高精度解剖工具小心地从眼罩中提取视网膜。从这一点开始,组织在含氧介质中纵以保存样品。然后将切除的视网膜(GCL)朝上安装在设计用于平装的平台上,以确保稳定性并防止样品漂浮。样品安装在 MEA 表面上,GCL 朝向电极。
接下来,将MEA安装在倒置荧光显微镜上的接口板上(图1-中)。使用灌注系统在33°C下用含氧介质灌注视网膜样品。该示例可以在此配置中保持数小时。对所需的刺激方案进行编程,并以每秒 10 帧的速率获取图像。建议根据应用的电刺激参数为电影命名。图像采集应在刺激开始之前开始,以获得一些没有刺激的基线帧,这将作为阴性对照。
最后,如 图 1-right 所示,通过分割细胞体从延时图像中提取数据。通过拟合数据来校正光漂白效应,并识别响应细胞。反应性细胞被定义为那些在刺激过程中具有荧光峰值超过其基线 2.5 倍的细胞。如果一个细胞对五次刺激中的三次有反应,则认为它对该特定的刺激序列有反应。
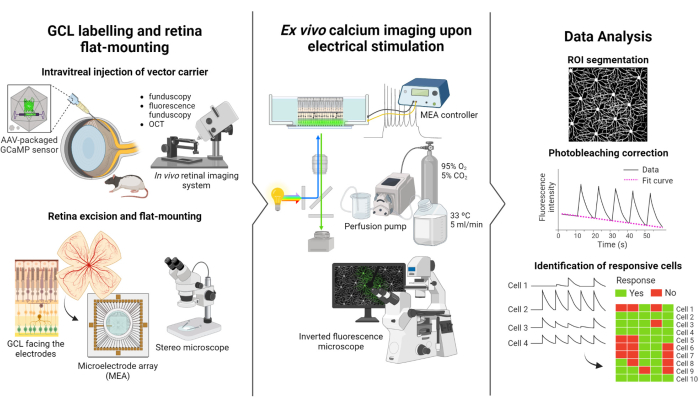
图1:研究概述。 (左)荧光标记视网膜GCL和样品安装的方案示意图,(中)设置由MEA提供的电刺激的 离体 记录准备,以及(右)分析钙成像数据以对反应细胞进行分类。 请点击这里查看此图的较大版本.
玻璃体内注射视网膜
玻璃体内注射相关并发症的发生率非常低。然而,无论注射的成分如何,手术本身都可能产生一些并发症。这些并发症包括白内障形成、玻璃体出血、眼压升高和眼内炎23。为了确定这些并发症是否是由手术引起的,动物需要在手术前使用眼底镜检查和 OCT 进行评估。注射后三天,应对动物进行随访。在图2A-D中,显示了健康注射动物的视网膜。注射两周后,RGC开始表达荧光,可以使用荧光眼底镜观察(图2B,C)。OCT图像提供了视网膜层分布和厚度的详细可视化(图2D),与眼底镜检查相比,提供了更高的分辨率,特别是在评估视网膜脱离时。一旦视网膜被平装并使用倒置荧光显微镜成像,就可以区分细胞和轴突束。与其他钙指示剂不同,GCaMP指示剂仅限于细胞质7,并且荧光被排除在细胞核之外(图2E)。
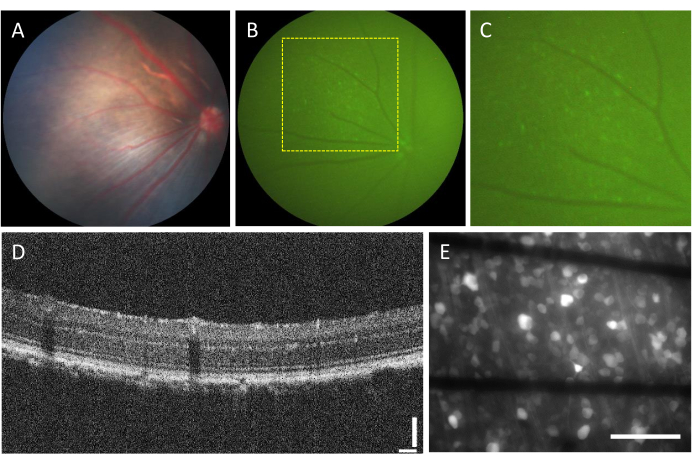
图2:玻璃体内注射视网膜的代表性图像。 (A) 眼底镜检查,(B) 荧光眼底镜检查,(C) 荧光眼底镜检查的放大,(D) OCT 图像,以及 (E) 切除视网膜的落射荧光图像,安装在定制的 MEA 上,在 500 μm 厚的硼硅酸盐玻璃上使用石墨烯基电极。在(E)中,黑线对应于Ti/Au迹线。比例尺:115 μm (D) 和 100 μm (E)。 请点击这里查看此图的较大版本.
电极和GCL触点
为了有效地唤起神经反应,确保平面安装的视网膜与 MEA 表面紧密接触至关重要。验证这一点的一种简单方法是目视确认电池和电极是否位于同一焦平面上(图3A)。如果细胞与电极不在同一焦平面上(图3B),则表明接触不理想,这将导致刺激效果降低。
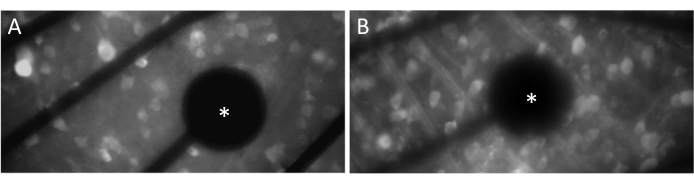
图 3:电极和 GCL 接触。 (A) 电池和电极(星号)在同一焦平面上。(B) 细胞和电极不在同一焦平面上,表明该区域的电刺激接触不理想。 请点击这里查看此图的较大版本.
MEA 提供的电刺激下的离体钙成像
钙成像产生的数据由延时图像组成,这些图像监测数百个细胞响应电刺激的神经活动。超阈值刺激导致钙流入细胞体,导致荧光强度突然变化(视频1)。该协议能够确定电极,MEA和/或刺激算法是否在神经组织中引起所需的反应。MEA上电极的大小和间距,以及所研究组织的比例,将决定选择合适的客观放大倍率。通常,对于直径范围为5μm至100μm的单电极刺激研究,20-25倍的物镜放大倍率是合适的(图4A),提供约600μm x 600μm的FOV。对于涉及使用多个电极进行刺激的实验,可能需要 4-10 倍的物镜放大倍率来评估约 2 mm x 2 mm 的更宽区域。通过生成延时电影的标准偏差图像投影,可以很容易地识别响应单元(图4B 和 视频1)。
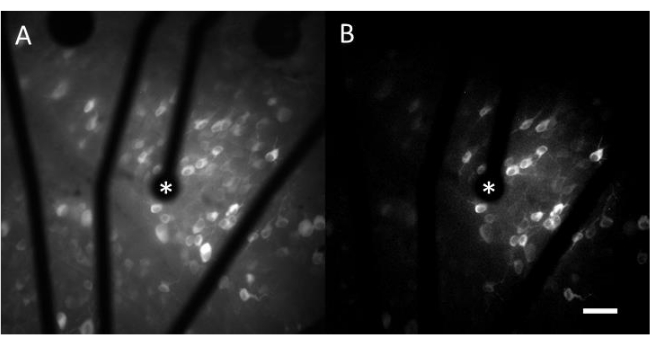
图 4:由直径为 25 μm 的电极提供的电刺激对 GCL 进行钙成像。 (A) 60 秒延时电影的最大投影和 (B) 标准偏差投影,清楚地描绘了对直径为 25 μm 的多孔石墨烯基电极的电刺激做出反应的细胞。刺激电极用星号表示。比例尺:50μm。 请点击这里查看此图的较大版本.
分析受控刺激后钙随时间的变化
对于每个鉴定的细胞体,随时间提取平均强度值。 图5A 显示了来自反应细胞的光漂白校正钙痕迹。在本例中,在 60 秒的图像采集过程中,每 10 秒(用黑线表示)传递 5 个双相脉冲序列(阴极优先、40 个周期、1 ms 持续时间、2 μA 幅度)。在给定的实验中,应用相同的五个脉冲序列来测试响应的一致性。在非刺激期间捕获的帧(以红色突出显示)用于执行线性拟合,校正光漂白效果。
一旦确定了响应细胞,并且它们相对于刺激电极的坐标(x,y)是已知的,就可以检查激活细胞所需的电流与与刺激电极的距离之间的关系(图5B)。正如预期的那样,位于刺激电极附近的细胞需要较低的电流值才能引起响应。
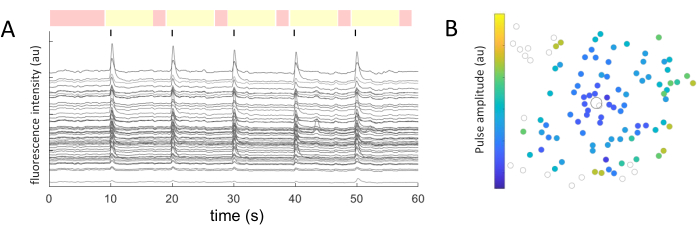
图 5:电诱发响应的表示。 (A) 在 60 秒的图像采集期间,每 10 秒(黑线)对 5 次脉冲序列(双相、阴极优先、40 个周期、持续时间 1 ms、振幅 2 μA)进行细胞胞体的钙痕迹。显示非刺激期(红色突出显示的帧)和刺激期(黄色突出显示的帧)。超过基线信号(非刺激周期的均方根)2.5倍的迹线被认为是诱发反应。在五个刺激期中的三个刺激期有反应的细胞被归类为反应细胞。(B)钙活性分布图,显示刺激电极(黑色轮廓圆圈)和细胞(灰色轮廓圆圈)。颜色代码表示唤起细胞反应所需的最小脉冲幅度。 请点击这里查看此图的较大版本.
视频 1:GCL 的钙成像,由直径为 25 μm 的电极提供电刺激。 该视频显示了由于直径为 25 μm 的多孔石墨烯基电极的电刺激导致的荧光强度差异。左侧显示原始影片,右侧显示标准差投影,其中可以轻松识别响应单元格。比例尺:50μm。 请点击此处下载此视频。
讨论
此处描述的方案用于研究大鼠视网膜GCL中发生的钙动力学,在提供MEA的电刺激下。这是一种可靠且易于管理的方法,但需要一些培训,特别是要有效地统一标记 GCL 并正确安装视网膜以确保最佳的组织-电极接触。该协议特定于啮齿动物,如果应用于不同的实验室物种,则需要进行调整。详细介绍了该方法的关键点、修改和局限性。
玻璃体内注射
注射广泛用于眼部基因递送,玻璃体内注射是首选手术。与视网膜下注射相比,它们已被证明更安全且侵入性更小,视网膜下注射将感兴趣的分子直接引入光感受器和视网膜色素上皮 (RPE) 之间,有视网膜脱离的风险10。然而,存在局限性,尤其是在啮齿动物模型中进行这些注射时。玻璃体液呈凝胶状,阻碍病毒扩散。此外,啮齿动物眼睛的晶状体很大,因此插入针头而不会划伤它。精密注射器针头很脆弱,需要经常更换。为防止阻塞,请在每次使用前后用去离子水清洗并定期更换。此外,缓慢注射内容物以防止溶液回流和眼压变化。在视网膜上获得大而均匀的荧光可能需要练习。
视网膜细胞转导
病毒载体是体内基因递送的极好方法,AAV 已广泛用于转导视网膜细胞10。它们已被批准用于治疗一些导致人类失明的视网膜病变24.然而,它们的载流子容量被限制在5 kb,包括所需的调节元件(例如,启动子)10,25。有多种血清型可供选择,每种血清型都有不同的嗜性。根据要递送的基因和要转导的细胞选择最合适的 AAV26.为了标记RGC,建议使用AAV227。
基因表达窗口
AAV2-CAG-GCaMP5G 的最佳病毒表达是注射后 2 至 3 周12,18。超过这个时间范围,转染细胞的细胞核变得荧光,细胞停止对刺激做出反应,并最终死亡 7,28,29。这是由于GCaMP指示剂的过表达,该指示剂易位到细胞核中。最佳基因表达的时间窗口将取决于病毒载体和所选启动子30,并且需要在进行该方案之前通过实验确定。
组织-电极接触
为了获得最佳和可重复的结果,实现良好的组织-电极接触至关重要。接触不良通常是由于视网膜的自然弯曲。一种方法是将视网膜切成四等份,一次安装并成像一个部分。视网膜的小部分可以更好地变平,从而更有效地与MEA表面接触。接触不良的另一个潜在原因是玻璃体液的存在。在进行模拟视网膜外植入物的刺激实验时,在视网膜切除过程中小心去除玻璃体液非常重要,因为它可以充当电流的绝缘体。在这里,描述了一种简单的方法,通过在同一焦平面上可视化电极和电池来检查接触是否足够。
离体视网膜测量的另一种方法是直接在电极表面生长神经元。神经元的原代培养物,如海马神经元31,可用于评估新型刺激装置功能的初始测试。然而,这种方法仍然需要使用实验动物,并不代表视网膜网络的复杂性,这对于评估突触对刺激的反应很重要。
为了可视化电极和电极迹线下方的电池,可以使用用透明材料(如氧化铟锡 (ITO))制造的 MEA 19,20,32。除了光学测量外,还可以通过电记录来评估电刺激后的GCL活性。MEA 可用于记录组织的局部场电位 (LFP)。然而,这会影响空间分辨率,因为每个电极同时捕获来自多个电池的活动(取决于电极尺寸)。光学记录克服了这一限制,并提供了更高的空间分辨率映射。它的主要优点是能够区分活性和非活性细胞,同时以单细胞分辨率测量大视场。在所有细胞活性报告基因中,钙指示剂被很好地描述和最常用33.
披露声明
作者没有要添加到手稿中的披露。
致谢
我们感谢 Merche Rivas、Angel Sandoval、Jesús Planagumà、Jordi Cortés、Sandra Ortonobés Lara 和 Alina Hirschmann(ICFO-Institut de Ciències Fotòniques)的技术支持,感谢眼科研究小组的 Anna Duarri(VHIR,Vall d'Hebron 研究所)在玻璃体内注射和 体内 视网膜成像方面的支持。
支持这项工作的资助实体是:Fundació CELLEX;米尔-普伊格基金会;经济和通信部 - Severo Ochoa 研发卓越中心计划 (CEX2019-000910-S, [MCIN/AEI/10.13039/501100011033]);加泰罗尼亚政府通过CERCA计划;Laserlab-Europe(EU-H2020 GA编号871124);La Caixa基金会(LCF/HR19/52160003);和 Fondo Social Europeo (PRE2020-095721, M.C.)。
材料
| Name | Company | Catalog Number | Comments |
| 20x NA 0.75 S Fluor air objective | Nikon | CFI Super Fluor 20X | - |
| 3.5 cm Cell culture dish | Nunc | 12-565-90 | - |
| 30 G needle | VWR | 613-5373 | - |
| 36 G blunt needle | World Precision Instruments | NF36BL-2 | - |
| 6 cm Cell culture dish | Nunc | 12-565-94 | - |
| AAV2-CAG-GCaMP5G | Vector Biolabs | - | - |
| Ames' Medium | Sigma Aldrich | A1420 | - |
| Blade | Swann-morton | 0308 | - |
| Camera | Hamamatsu | ORCA Flash v4.0 | - |
| Carbogen | Air liquide | - | - |
| Curved-forceps | - | - | - |
| Fine spring-scissors | FST | 91501-09 | - |
| FITC filter cube | Nikon | Standard series | - |
| Fluorescent lamp | Nikon | C-HGFI | - |
| Fluorescent stereomicroscope | Nikon | SMZ25 | - |
| HBSS | Capricorn | HBSS-1A | - |
| ImageJ/FIJI | NIH | v1.50i | - |
| In vivo retinal imaging system | Phoenix Research Laboratories | Micron III | - |
| Inverted fluorescence microscope | Nikon | Eclipse Ti | - |
| Isofluorane | Arrane Baxter Laboratories | - | - |
| Long-Evans rat | Janvier | - | - |
| MATLAB (Version R2021b) | Mathworks | - | - |
| Media filters | Merckmillipore | SCGPS02RE | - |
| Methocel 2% | Omni Vision | - | - |
| Microelectrode array (MEA) | - | Custom-made | |
| NaHCO3 | Thermofisher | 42427 | - |
| Penicillin/Streptomycin 100x | Thermofisher | 15140122 | - |
| Phenylephrine | Alcon Cusí Laboratories | 653437.3 | 100 mg/mL |
| Plastic pipette | VWR | 612-1793 | - |
| Porous membrane | Merckmillipore | #JVWP01300 | - |
| Precision syringe | World Precision Instruments | 10 µl Nanofil | - |
| Prescaina | Llorens | - | Oxybuprocaine chlorhydrate (2 mg/mL), local anesthetic |
| Rat nasal mask | Xenotec | XRK-RA | - |
| Small curved-forceps | Bbraun | AESCBD311R | - |
| Spring-scissors | FST | 15040-11 | - |
| Stereo microscope | Zeiss | Stemi 2000 | - |
| Straight forceps | FST | 11252-20 | - |
| Suture filament | Vitrex Medical | 4328 | Nilon monofilament, 7/0, DS12 |
| Tobradex | Alcon Cusí Laboratories | - | Tobramycin (3 mg/mL) and dexamethasone (1 mg/mL) |
| Tropicamide | Alcon Cusí Laboratories | 653486 | 10 mg/mL |
| Washer | Thorlabs | W8S038 | - |
参考文献
- Bourne, R. R. A., et al. Prevalence and causes of vision loss in high-income countries and in Eastern and Central Europe in 2015: Magnitude, temporal trends and projections. British Journal of Ophthalmology. 102 (5), 575-585 (2018).
- Li, J. Q., et al. Prevalence and incidence of age-related macular degeneration in Europe: a systematic review and meta-analysis. British Journal of Ophthalmology. 104 (8), 1077-1084 (2020).
- Roska, B., Sahel, J. A. Restoring vision. Nature. 557 (7705), 359-367 (2018).
- Hornig, R., Velikay-Parel, M. Retina implants. Implantable Sensor Systems for Medical Applications. , Elsevier. 469-496 (2013).
- Lewis, P. M., et al. Advances in implantable bionic devices for blindness: a review. ANZ Journal of Surgery. 86 (9), 654-659 (2016).
- Weiland, J. D., Walston, S. T., Humayun, M. S. Electrical stimulation of the retina to produce artificial vision. Annual Review of Vision Science. 2, 273-294 (2016).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6, 875-881 (2009).
- Chen, T. -W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499, 295-300 (2013).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca2+ probe composed of a single green fluorescent protein. Nature Biotechnology. 19, 137-141 (2001).
- Sahu, B., Chug, I., Khanna, H. The ocular gene delivery landscape. Biomolecules. 11 (8), 1135(2021).
- Hanlon, K. S., et al. A novel retinal ganglion cell promoter for utility in AAV vectors. Frontiers in Neuroscience. 11, (2017).
- Weitz, A. C., et al. Imaging the response of the retina to electrical stimulation with genetically encoded calcium indicators. Journal of Neurophysiology. 9 (7), 1979-1988 (2013).
- Briggman, K. L., Euler, T. Bulk electroporation and population calcium imaging in the adult mammalian retina. Journal of Neurophysiology. 105 (5), 2601-2609 (2011).
- Baden, T., Berens, P., Franke, K., Román Rosón, M., Euler, T. The functional diversity of retinal ganglion cells in the mouse. Nature. 529, 345-350 (2016).
- Zhang, Y., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Nature. 615, 884-891 (2023).
- Meyer, E. L., Jenkins, C., Rengarajan, K. NIH Guidelines April 2019. Applied Biosafety. 24, Preprint at https://doi.org/10.1177/1535676019871146 (2019).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Chang, Y. -C., Walston, S. T., Chow, R. H., Weiland, J. D. GCaMP expression in retinal ganglion cells characterized using a low-cost fundus imaging system. Journal of Neural Engineering. 14 (5), 056018(2017).
- Weitz, A. C., et al. Improving the spatial resolution of epiretinal implants by increasing stimulus pulse duration. Science Translational Medicine. 7 (318), 1-12 (2015).
- Chang, Y. C., Ghaffari, D. H., Chow, R. H., Weiland, J. D. Stimulation strategies for selective activation of retinal ganglion cell soma and threshold reduction. Journal of Neural Engineering. 16 (2), 026017(2019).
- Im, M., Fried, S. I. Temporal properties of network-mediated responses to repetitive stimuli are dependent upon retinal ganglion cell type. Journal of Neural Engineering. 13 (2), 025002(2016).
- Jensen, R. J., Ziv, O. R., Rizzo, J. F. Thresholds for activation of rabbit retinal ganglion cells with relatively large, extracellular microelectrodes. Investigative Ophthalmology & Visual Science. 46 (4), 1486-1496 (2005).
- Ramos, M. S., et al. Patient-reported complications after intravitreal injection and their predictive factors. Ophthalmology Retina. 5 (7), 625-632 (2021).
- Vandenberghe, L. H., Auricchio, A. Novel adeno-associated viral vectors for retinal gene therapy. Gene Therapy. 19 (2), 162-168 (2012).
- Zin, E. A., Ozturk, B. E., Dalkara, D., Byrne, L. C. Developing new vectors for retinal gene therapy. Cold Spring Harbor Perspectives in Medicine. , a041291(2023).
- Haggerty, D. L., Grecco, G. G., Reeves, K. C., Atwood, B. Adeno-associated viral vectors in neuroscience research. Molecular Therapy-Methods & Clinical Development. 17, 69-82 (2020).
- Hellström, M., et al. Cellular tropism and transduction properties of seven adeno-associated viral vector serotypes in adult retina after intravitreal injection. Gene Therapy. 16 (4), 521-532 (2009).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nature Protocols. 11, 566-597 (2016).
- Yang, Y., et al. Improved calcium sensor GCaMP-X overcomes the calcium channel perturbations induced by the calmodulin in GCaMP. Nature Communications. 9, 1504(2018).
- Nieuwenhuis, B., et al. Improving adeno-associated viral (AAV) vector-mediated transgene expression in retinal ganglion cells: comparison of five promoters. Gene Therapy. 30, 503-519 (2023).
- Cunquero, M., Aguilar, E., Loza-Alvarez, P., Planagumà, J. Hippocampal neuronal cultures to detect and study new pathogenic antibodies involved in autoimmune encephalitis. Journal of Visualized Experiments. 184, e63829(2022).
- Behrend, M. R., Ahuja, A. K., Humayun, M. S., Chow, R. H., Weiland, J. D. Resolution of the epiretinal prosthesis is not limited by electrode size. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 19 (4), 436-442 (2011).
- Grienberger, C., Konnerth, A. Imaging calcium in neurons. Neuron. 73 (5), 862-885 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。