Method Article
Imaging del calcio nelle retine piatte stimolate elettricamente
In questo articolo
Riepilogo
Le protesi retiniche hanno la capacità di generare percezioni visive. Per far progredire lo sviluppo di nuove protesi, sono necessari metodi ex vivo per testare i dispositivi prima dell'impianto. Questo articolo fornisce un protocollo completo per studiare l'attività del calcio nello strato di cellule gangliari retiniche quando sottoposto a stimolazione elettrica.
Abstract
Le distrofie retiniche sono una delle principali cause di cecità in tutto il mondo. Sono in corso ampi sforzi per sviluppare protesi retiniche avanzate in grado di bypassare le cellule fotorecettrici sensibili alla luce compromesse nella retina degenerata, con l'obiettivo di ripristinare parzialmente la vista inducendo percezioni visive. Una strada comune di indagine riguarda la progettazione e la produzione di dispositivi impiantabili con una struttura fisica flessibile, che ospita un numero elevato di elettrodi. Ciò consente la generazione efficiente e precisa di percezioni visive. Tuttavia, con ogni progresso tecnologico, sorge la necessità di un metodo ex vivo affidabile e gestibile per verificare la funzionalità del dispositivo prima di passare agli esperimenti in vivo , in cui entrano in gioco fattori che vanno oltre le prestazioni del dispositivo. Questo articolo presenta un protocollo completo per lo studio dell'attività del calcio nello strato di cellule gangliari retiniche (GCL) dopo la stimolazione elettrica. In particolare, vengono delineati i seguenti passaggi: (1) marcatura fluorescente della retina di ratto utilizzando indicatori di calcio geneticamente codificati, (2) cattura del segnale di fluorescenza utilizzando un microscopio a fluorescenza invertito applicando modelli distinti di stimolazione elettrica e (3) estrazione e analisi delle tracce di calcio da singole cellule all'interno del GCL. Seguendo questa procedura, i ricercatori possono testare in modo efficiente nuovi protocolli di stimolazione prima di condurre esperimenti in vivo .
Introduzione
La retina contiene fotorecettori, che sono cellule responsabili del rilevamento della luce. Catturano i fotoni e li convertono in impulsi nervosi. Questi impulsi vengono poi elaborati all'interno della retina e trasmessi alla corteccia visiva, con conseguente formazione di un'immagine visiva1. La Retinite Pigmentosa (RP) e la Degenerazione Maculare Legata all'Età (AMD) sono malattie degenerative caratterizzate dalla progressiva perdita dei fotorecettori. Queste retinopatie sono tra le principali cause di cecità in tutto il mondo1, colpendo milioni di individui e avendo conseguenze mediche, personali e socioeconomiche significative per i pazienti, i sistemi sanitari e la società nel suo complesso. Inoltre, con l'invecchiamento della popolazione, si prevede che i casi di AMD aumenteranno del 15% entro il 20502.
Attualmente, sono in corso numerosi sforzi di ricerca per ripristinare la vista nei pazienti affetti da queste condizioni3. Un approccio promettente è l'uso di protesi retiniche, che si sono dimostrate efficaci nel ripristinare parzialmente la vista 4,5. Questi dispositivi catturano la luce dalla scena visiva e la convertono in impulsi elettrici. Questi impulsi vengono erogati attraverso elettrodi all'interno di un array di microelettrodi (MEA) impiantato nell'occhio, stimolando i neuroni sopravvissuti e bypassando la funzione dei fotorecettori persi. Le cellule gangliari retiniche attivate (RGC) trasmettono l'output al cervello, dove viene interpretato come percezione visiva. Tuttavia, i principali limiti degli impianti attuali risiedono nella risoluzione dell'interfaccia elettrodo-tessuto6 e nella stimolazione non selettiva di diversi tipi di cellule. Pertanto, per ottimizzare la progettazione di nuovi dispositivi impiantabili per un ripristino della vista più efficiente, è fondamentale comprendere come possono essere sviluppati paradigmi di stimolazione per attivare selettivamente le cellule in prossimità degli elettrodi.
L'imaging del calcio è una tecnica ampiamente utilizzata per lo studio dell'attività neurale, che offre diversi vantaggi rispetto ai metodi non ottici 7,8. In primo luogo, fornisce una risoluzione cellulare e subcellulare. In secondo luogo, i marcatori del calcio possono colpire specifici tipi di cellule. In terzo luogo, consente il monitoraggio a lungo termine e, in quarto luogo, consente l'osservazione di intere popolazioni cellulari distinguendo tra cellule attive e inattive. Questo metodo fornisce prove indirette dell'attività cellulare con una risoluzione temporale nell'ordine di centinaia di millisecondi. Gli indicatori fluorescenti di calcio geneticamente codificati, come i sensori GCaMP, subiscono un cambiamento conformazionale quando si legano al calcio, con conseguente aumento della fluorescenza9. I vettori virali adeno-associati ricombinanti (AAV) sono un mezzo efficace per trasdurre le cellule retiniche con GCaMP10.
Questo protocollo presenta un metodo efficiente che utilizza l'imaging del calcio per testare i protocolli di stimolazione degli impianti retinici. In particolare, ci concentriamo sul tessuto retinico di ratto ex vivo e forniamo istruzioni dettagliate passo dopo passo, dall'acquisizione del campione all'analisi dei dati. Offrendo questa guida completa, i ricercatori di vari background possono intraprendere con sicurezza la sperimentazione della stimolazione elettrica.
Protocollo
Tutte le procedure per gli animali sono state condotte in conformità con le linee guida standard per l'etica degli animali (Direttiva delle Comunità Europee 86/609/UE) e approvate dai comitati etici locali per gli animali. Per il presente studio sono stati utilizzati ratti Long Evans di 8 settimane. Gli animali sono stati ottenuti da una fonte commerciale (vedi Tabella dei materiali).
1. Preparazione del supporto e montaggio piatto
- Ames' Medio (1 L)
- In un flacone di vetro da 1 L, unire la polvere Ames' Medium, 1,9 g/L di NaHCO3, 10 ml di Penicillina/Streptomicina 100x e 1 L di acqua deionizzata (vedi Tabella dei materiali). Regolare il pH a 7,4 e l'osmolarità a 280 mOsm con acqua deionizzata o NaHCO3. Sterilizzare la soluzione filtrandola attraverso un filtro con pori da 0,2 μm sotto una cappa.
NOTA: Conservare il terreno sterilizzato a 4 °C. Questa soluzione rimane stabile e può essere utilizzata fino a 1 mese.
- In un flacone di vetro da 1 L, unire la polvere Ames' Medium, 1,9 g/L di NaHCO3, 10 ml di Penicillina/Streptomicina 100x e 1 L di acqua deionizzata (vedi Tabella dei materiali). Regolare il pH a 7,4 e l'osmolarità a 280 mOsm con acqua deionizzata o NaHCO3. Sterilizzare la soluzione filtrandola attraverso un filtro con pori da 0,2 μm sotto una cappa.
- Membrane di montaggio
- Fissare una membrana porosa in PTFE (vedi Tabella dei materiali) a una rondella utilizzando piccole gocce di colla. Lasciare asciugare per almeno 15 min.
- Per ottenere la traslucenza, immergere le membrane in etanolo al 70% per 1 minuto.
- Sciacquare due volte le membrane con acqua deionizzata per rimuovere completamente l'etanolo. Conservarli in acqua deionizzata per evitare l'opacità.
2. Etichettatura GCL e montaggio piatto della retina di ratto
NOTA: Questo metodo di marcatura non differenzia le RGC dalle cellule amacrine spostate. Se si desidera una marcatura selettiva delle RGC, prendere in considerazione l'utilizzo di AAV con promotori specifici per RGC11 e/o la marcatura retrograda attraverso il nervo ottico12. Per discriminare tra le classi di RGC ON- e OFF-center, classificare le RGC in base alla loro risposta alla luce13,14 e utilizzare versioni più recenti di indicatori di calcio geneticamente codificati che offrono una maggiore sensibilità e la capacità di misurare i singoli potenziali d'azione15.
- Iniezione intravitreale
- Anestetizzare il ratto Long Evans di 8 settimane con isoflurano al 2% e all'1% di O2 fino a quando non c'è più riflesso del pedale e mantenere l'anestesia con una maschera nasale per ratti (vedere Tabella dei materiali).
NOTA: Durante l'anestesia, posizionare l'animale su un termoforo per mantenere la temperatura corporea. - Somministrare una goccia di collirio disponibile in commercio (vedere Tabella dei materiali) per dilatare la pupilla.
- Prima di procedere con l'intervento chirurgico, esaminare l'occhio per anomalie utilizzando la fundoscopia e la tomografia a coerenza ottica (OCT) con un sistema di imaging retinico in vivo . Applicare una goccia di Methocel 2% per facilitare il contatto cornea-obiettivo (vedere Tabella dei materiali).
NOTA: Se vengono rilevate anomalie, non procedere con i passaggi successivi per quell'occhio. - Applicare una goccia di Prescaine come anestetico locale. Fissare la palpebra e la congiuntiva limbare con un filamento di sutura disponibile in commercio (vedere Tabella dei materiali). Creare una sclerotomia di 1 mm a 4 mm dal limbus utilizzando un ago da 30 G.
- Collegare un ago smussato da 36 G a una siringa di precisione e iniettare le particelle AAV che trasportano l'indicatore di calcio geneticamente codificato nel vitreo per 30 secondi, con un angolo di 45°. In questo studio, abbiamo utilizzato AAV2-CAG-GCaMP5G (7,5 x 1011 GC/mL in HBSS) (vedi Tabella dei materiali).
NOTA: I costrutti AAV che non codificano prodotti genici potenzialmente tumorigenici o molecole tossiche e sono prodotti senza un virus helper possono essere gestiti in strutture di livello di biosicurezza 1 (BSL-1). In caso contrario, se considerato materiale a rischio biologico sotto il contenimento BSL-2, devono essere prese le dovute precauzioni16. Gli AAV che codificano per GCaMP sono considerati BSL-1 e non richiedono manipolazione in armadi di biosicurezza.
- Collegare un ago smussato da 36 G a una siringa di precisione e iniettare le particelle AAV che trasportano l'indicatore di calcio geneticamente codificato nel vitreo per 30 secondi, con un angolo di 45°. In questo studio, abbiamo utilizzato AAV2-CAG-GCaMP5G (7,5 x 1011 GC/mL in HBSS) (vedi Tabella dei materiali).
- Applicare una goccia di Tobradex (vedere Tabella dei materiali) per prevenire l'infiammazione e come profilassi antibiotica.
- Se lo si desidera, ripetere i passaggi 2, 3 e 4 con l'altro occhio.
NOTA: Controllare gli animali 12-24 ore dopo l'intervento chirurgico per assicurarsi che non ci siano reazioni avverse. - Tre giorni dopo l'iniezione, esaminare la struttura retinica utilizzando la fundoscopia e l'OCT con un sistema di imaging retinico in vivo (vedere Tabella dei materiali).
- Due settimane dopo l'iniezione, il GCL dovrebbe emettere fluorescenza. Valutare la struttura retinica e l'espressione di AAV mediante fundoscopia a fluorescenza utilizzando un sistema di imaging retinico in vivo .
NOTA: Secondo Weitz et al.12, la fluorescenza da AAV2-CAG-GCaMP5G diventa evidente a 1 settimana dopo l'iniezione e si intensifica entro 2 settimane. A partire dalla quarta settimana, la sovraespressione di GCaMP induce citomorbilità. Le cellule morenti mostrano un segnale di fluorescenza di base elevato nel nucleo e nel citoplasma che non fluttua in risposta alla stimolazione. Nelle cellule sane, l'espressione di GCaMP è confinata al citoplasma ed esclusa dal nucleo 7,8,12,17,18. Queste caratteristiche possono essere osservate ex vivo durante l'imaging al microscopio. La finestra di espressione genica può variare a seconda del vettore virale e del promotore scelto.
- Anestetizzare il ratto Long Evans di 8 settimane con isoflurano al 2% e all'1% di O2 fino a quando non c'è più riflesso del pedale e mantenere l'anestesia con una maschera nasale per ratti (vedere Tabella dei materiali).
- Escissione della retina e montaggio piatto
NOTA: Due o tre settimane dopo l'iniezione, i ratti iniettati per via intravitreale vengono soppressi immediatamente prima dell'inizio del protocollo di elettrofisiologia, in conformità con le linee guida etiche standard (Direttiva delle Comunità Europee 86/609/UE) e approvate dai comitati etici locali. L'inalazione di anidride carbonica (CO2 ) è utilizzata come metodo di eutanasia in questo protocollo.- Enucleazione dell'occhio
- Premere delicatamente l'esterno dell'orbita usando un paio di pinze curve per sporgere leggermente l'occhio dall'orbita.
- Usa un paio di forbici a molla per tagliare i muscoli che tengono l'occhio ed enuclearlo, facendo attenzione a non forare il bulbo oculare.
NOTA: Partendo da questo passaggio, sezionare la retina sotto uno stereomicroscopio in mezzo di Ames ossigenato (95% O2 / 5% CO2).
- Escissione della retina
- Usa un paio di piccole pinze curve e forbici a molla fine per rimuovere tutto il tessuto circostante dal bulbo oculare.
- Prendete un pezzo di carta da filtro di circa 3 cm x 3 cm e mettetelo sul coperchio di un piatto da 3,5 cm. Immergi la carta con Ames' Medium.
- Posizionare il bulbo oculare sopra la carta, con il segmento anteriore rivolto verso l'operatore. Usa un paio di pinze diritte per tenere il bulbo oculare, posizionandole sopra l'ora serrata a un angolo di circa 45° dalla superficie del piatto. Fai un piccolo taglio con una lama, usando lo spazio tra le pinze diritte come riferimento.
- Rimborsa il bulbo oculare nel medium di Ames. Usa un paio di pinze diritte e forbici a molla fine per separare i segmenti anteriore e posteriore dell'occhio.
- Rimuovere con cautela la lente utilizzando due paia di pinze diritte. Quindi, separa la retina dalla sclera.
- Tagliare la sclera verso il nervo ottico usando delle forbici a molla fino a quando la retina non è isolata dall'oculare.
- Utilizzare uno stereomicroscopio a fluorescenza per identificare la regione della retina con la migliore espressione dell'indicatore di calcio.
NOTA: L'entità della diffusione virale dipende dal successo dell'iniezione intravitreale. Ottenere la fluorescenza su ampie porzioni della retina può richiedere pratica. L'esperienza dello sperimentatore gioca un ruolo cruciale nell'ottenere risultati ottimali. - Utilizzando una pipetta di plastica con punta tagliata, trasferire il pezzo selezionato della retina sulla membrana di montaggio (passaggi di montaggio delle membrane). Usa un paio di pinze diritte per montare la retina con il GCL rivolto verso l'alto.
- Con una pipetta di plastica collegata a un puntale da 100 μL, rimuovere il terreno per consentire al pezzo di retina di aderire alla membrana porosa. Capovolgere il gruppo sul MEA in modo che il GCL poggi sopra gli elettrodi.
- Riempire il bagno del campione con Ames' Medium ossigenato.
- Enucleazione dell'occhio
3. Imaging del calcio ex vivo dopo stimolazione elettrica
NOTA: In questo lavoro, è stato utilizzato un MEA proof-of-concept per la sperimentazione ex vivo . I MEA personalizzati sono stati fabbricati con elettrodi porosi a base di grafene di 25 μm di diametro su vetro borosilicato di 500 μm di spessore con tracce di Ti/Au e successivamente isolati con nitruro di silicio e fotoresistSU-8 12. Tuttavia, i metodi di imaging del calcio sono validi indipendentemente dal materiale dell'elettrodo utilizzato per la stimolazione.
- Impostare il sistema di perfusione in modo che il terreno di Ames ossigenato perfondi costantemente il bagno del campione a 33 °C a una portata costante di 5 mL/min.
- Utilizzando un microscopio a fluorescenza invertita dotato di una lampada fluorescente, un cubo filtrante FITC e una fotocamera CMOS, ispezionare la retina per un'area in cui sono visibili gli elettrodi stimolanti e la fluorescenza delle cellule che esprimono GCaMP. Per questo studio è stato utilizzato un obiettivo aereo 20x NA 0,75.
NOTA: Per stimolare efficacemente (e registrare) le cellule con gli elettrodi, la retina e l'elettrodo devono essere a stretto contatto. Pertanto, le cellule si trovano visibilmente sullo stesso piano focale degli elettrodi. In caso contrario, ripetere le fasi dell'escissione della retina dal punto 8 in poi. Quando si utilizzano retine di modelli animali sani (con fotorecettori funzionanti), si noti che ogni volta che si accende la lampada fluorescente, ci saranno alcune risposte evocate generate dalla luce poiché la retina è sensibile alla luce alla lunghezza d'onda utilizzata per eccitare il sensore GCaMP. Questi cambiamenti di calcio indotti dalla luce possono essere utilizzati per valutare lo stato di salute del tessuto. Per evitare di confondere la luce con le risposte evocate elettricamente, accendere la lampada fluorescente almeno 1 minuto prima di iniziare l'acquisizione dell'immagine. - Per suscitare risposte evocate elettricamente nel GCL, selezionare un elettrodo per inviare impulsi controllati dalla corrente. Impostare i parametri di stimolazione elettrica nel software del dispositivo generatore di impulsi, quali: forma, ampiezza, durata, ritardo di fase e frequenza degli impulsi da applicare.
NOTA: I parametri di stimolo effettivi possono variare notevolmente da larghezze di impulso di 50 μs a 100 ms, con ampiezze che vanno da 0,1 μA a 10 μA. Questi parametri, insieme alla frequenza dello stimolo, alla polarità dello stimolo, al numero di impulsi e ai ritardi interfasici, possono influenzare la risposta spazio-temporale osservata dall'imaging del calcio 19,20,21,22. Un treno di 40 impulsi bifasici che erogano una stimolazione di 1 ms e 2 μA spesso genera una risposta visibile nei neuroni marcati. - Per sincronizzare l'acquisizione dell'immagine con l'erogazione della stimolazione, utilizzare il generatore di impulsi come trigger esterno per controllare l'avvio dell'acquisizione dell'immagine. Collegare la fotocamera (vedere la tabella dei materiali) con il generatore di impulsi utilizzando il segnale di attivazione in uscita e impostare la "Modalità di acquisizione" del software della fotocamera su "Trigger di avvio esterno". Premere Start nel software della fotocamera in modo che attenda l'avvio di un trigger esterno. Avviare l'acquisizione delle immagini con il software del generatore di impulsi.
NOTA: Il controllo del grilletto esterno potrebbe essere impostato in modo diverso per le diverse telecamere. Questo studio ha tipicamente acquisito immagini (512 x 512 pixel, scala di grigi a 16 bit) a 10 fotogrammi al secondo per 1 minuto, fornendo raffiche di treni di impulsi bifasici ogni 10 s. L'erogazione dell'impulso inizia dopo 10 s, quindi i primi fotogrammi in tutti gli esperimenti corrispondono all'attività spontanea. A seconda del sensore GCaMP e dell'analisi che verrà eseguita, potrebbe essere necessario regolare la velocità di registrazione in base ai tempi di salita e decadimento dell'indicatore di calcio8. Si consideri la sensibilità per rilevare i singoli potenziali d'azione dell'indicatore di calcio15. - Salvare le immagini con un nome file che includa i parametri di stimolazione elettrica applicati, ad esempio [Numero elettrodo]_[Ampiezza impulso]_[Durata impulso]_[Frequenza impulso]_Image001.
4. Analisi dei dati
- ImageJ/FIJI per estrarre il profilo di intensità della fluorescenza nel tempo e le coordinate spaziali dai soma cellulari
- Segmentare la regione di interesse (ROI) con gli "Strumenti di selezione dell'area" e aggiungerla a Gestione ROI (Analizza strumenti > > Gestione ROI > Aggiungi). Dal menu ROI Manager, salvalo come cartella .zip (Altro > Salva).
NOTA: In genere, le stesse ROI possono essere applicate a tutti gli esperimenti di stimolazione poiché corrispondono allo stesso FOV. - Selezionare il "Valore medio del grigio" come parametro da estrarre (Analizza > Imposta misure).
- Estrai il "Valore medio del grigio" dai soma della cella facendo clic su Altro > Multi Misura. Apparirà una finestra di dialogo. Abilita le opzioni Misura tutte le 600 sezioni e Una riga per sezione per ottenere un'unica tabella in cui le colonne corrispondono ai ROI e le righe corrispondono agli intervalli di tempo. Salva la tabella generata come foglio di calcolo .xls.
- Selezionare il "Centroide" come parametro da estrarre (Analizza > Imposta misure).
- Estrarre il "Centroide" dalle ROI facendo clic su Misura. La tabella generata corrisponde alle coordinate (X,Y) delle ROI. Salvalo come foglio di calcolo .xls.
- Segmentare la regione di interesse (ROI) con gli "Strumenti di selezione dell'area" e aggiungerla a Gestione ROI (Analizza strumenti > > Gestione ROI > Aggiungi). Dal menu ROI Manager, salvalo come cartella .zip (Altro > Salva).
- Script personalizzato per identificare le cellule che rispondono agli stimoli
NOTA: In questo caso è stato utilizzato MATLAB (vedere la tabella dei materiali), ma i passaggi descritti possono essere eseguiti in qualsiasi linguaggio di programmazione. Gli utenti possono ottenere il nostro script personalizzato richiedendo l'autore corrispondente.- Correzione dell'effetto fotosbiancamento: per mitigare l'effetto di sfondo e fotosbiancamento, prendi 15-20 fotogrammi dai periodi non stimolanti prima di ogni raffica e adattali a una curva lineare [adatta (poly1)].
NOTA: In questo caso, per un filmato totale di 600 fotogrammi in cui sono state inviate raffiche periodiche di treni di impulsi ogni 10 s, i fotogrammi 1:90, 170:190, 270:290, 370:390, 470:490, 570:590 sono stati considerati periodi non stimolanti. - Normalizza usando la formula: (X-min) / (max-min)
- Identificazione delle cellule rispondenti
- Calcola la radice quadratica media (RMS) dei periodi non stimolanti dai dati normalizzati. Questo sarà considerato come il segnale di base.
- Calcolare il massimo dei periodi di stimolazione (fotogrammi tra i periodi non stimolanti). In questo caso, per un filmato totale di 600 fotogrammi in cui venivano inviate raffiche periodiche di treni di impulsi ogni 10 s, i fotogrammi 91:169, 191:269, 291:369, 391:469, 491:569 sono stati considerati come periodi stimolanti.
- Se il valore massimo supera il segnale di base di 2,5 volte per un ROI specifico, contrassegnare la cellula come rispondente a quel periodo di stimolazione. Se la cellula risponde a tre dei cinque periodi di stimolazione, classificala come cellula rispondente.
- Correzione dell'effetto fotosbiancamento: per mitigare l'effetto di sfondo e fotosbiancamento, prendi 15-20 fotogrammi dai periodi non stimolanti prima di ogni raffica e adattali a una curva lineare [adatta (poly1)].
Risultati
Il protocollo descritto in questo studio si basa sugli studi di imaging a fluorescenza e stimolazione elettrica condotti da Weitz et al.12. Il protocollo è costituito da tre parti principali: (1) marcatura fluorescente del GCL e montaggio piatto della retina sul MEA (Figura 1-sinistra), (2) visualizzazione dell'attività del calcio nel GCL durante la stimolazione elettrica (Figura 1-centrale) e (3) estrazione, elaborazione e interpretazione dei dati di imaging (Figura 1-destra).
Innanzitutto, come illustrato nella Figura 1 a sinistra, i ratti Long Evans vengono iniettati per via intravitrea con AAV2-CAG-GCaMP5G prima della sessione di imaging. L'espressione virale ottimale per questo vettore si verifica da 2 a 3 settimane dopo l'iniezione12,18. Dopo aver anestetizzato completamente l'animale, viene praticato un foro pilota utilizzando un ago da 30 G, quindi 5 μL di AAV2-CAG-GCaMP5G vengono iniettati lentamente nel vitreo utilizzando un ago smussato da 36 G collegato a una siringa di precisione per prevenire il reflusso. Durante l'espressione virale, viene utilizzato un sistema di imaging retinico in vivo per valutare le condizioni della retina dopo l'intervento chirurgico, con immagini OCT che forniscono una visualizzazione dettagliata degli strati retinici. Una volta raggiunta l'espressione genica, la retina viene accuratamente estratta dall'oculare utilizzando uno stereomicroscopio e strumenti di dissezione ad alta precisione. Da questo punto in poi, il tessuto viene manipolato in mezzi ossigenati per preservare il campione. La retina asportata, con il GCL rivolto verso l'alto, viene quindi montata su una piattaforma progettata per il montaggio piatto per garantire la stabilità e impedire il galleggiamento del campione. Il campione viene montato sulla superficie MEA con il GCL rivolto verso gli elettrodi.
Successivamente, il MEA viene montato sulla sua scheda di interfaccia su un microscopio a fluorescenza invertito (Figura 1 al centro). Il campione retinico viene perfuso con mezzi ossigenati a 33 °C utilizzando un sistema di perfusione. Il campione può essere mantenuto in questa configurazione per diverse ore. Viene programmato lo schema di stimolazione desiderato e le immagini vengono acquisite a una velocità di 10 fotogrammi al secondo. Si consiglia di denominare i film in base ai parametri di stimolazione elettrica applicati. L'acquisizione dell'immagine dovrebbe iniziare prima dell'inizio della stimolazione per ottenere alcuni fotogrammi di base senza stimolazione, che serviranno come controllo negativo.
Infine, come illustrato nella Figura 1 a destra, i dati vengono estratti dalle immagini time-lapse segmentando i somi cellulari. Gli effetti del fotosbiancamento vengono corretti adattando i dati e vengono identificate le cellule reattive. Le cellule responsive sono definite come quelle con picchi di fluorescenza durante la stimolazione che superano la loro linea di base di 2,5 volte. Se una cellula risponde a tre dei cinque impulsi di stimolazione, è considerata reattiva a quello specifico treno di stimolazione.
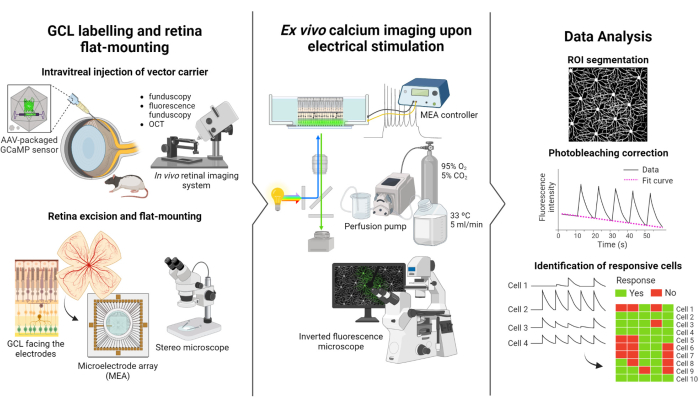
Figura 1: Panoramica dello studio. Illustrazione schematica del protocollo per l'etichettatura fluorescente (a sinistra) del GCL della retina e il montaggio del campione, (al centro) la preparazione per le registrazioni ex vivo con stimolazione elettrica fornita da un MEA e (a destra) l'analisi dei dati di imaging del calcio per classificare le cellule responsive. Fare clic qui per visualizzare una versione più grande di questa figura.
Retina iniettata intravitreale
L'incidenza di complicanze associate alle iniezioni intravitreali è molto bassa. Tuttavia, ci sono alcune complicazioni che possono derivare dall'intervento stesso, indipendentemente dal componente iniettato. Queste complicanze includono la formazione della cataratta, l'emorragia vitreale, l'aumento della pressione intraoculare e l'endoftalmite23. Per determinare se queste complicazioni sono causate dall'intervento chirurgico, l'animale deve essere sottoposto a valutazione prima della procedura utilizzando la funduscopia e l'OCT. Tre giorni dopo l'iniezione, gli animali devono essere seguiti. Nella Figura 2A-D, viene mostrata la retina di un animale sano a cui è stata iniettata l'iniezione. Dopo due settimane dall'iniezione, le RGC iniziano ad esprimere fluorescenza, che può essere visualizzata utilizzando la fundoscopia a fluorescenza (Figura 2B,C). Le immagini OCT forniscono una visualizzazione dettagliata della disposizione e dello spessore degli strati retinici (Figura 2D), offrendo una risoluzione più elevata rispetto alla funduscopia, in particolare quando si valuta il distacco della retina. Una volta che la retina è montata in piano e fotografata utilizzando un microscopio a fluorescenza invertita, diventa possibile distinguere le cellule e i fasci di assoni. A differenza di altri indicatori di calcio, l'indicatore GCaMP è limitato al citoplasma7 e la fluorescenza è esclusa dal nucleo (Figura 2E).
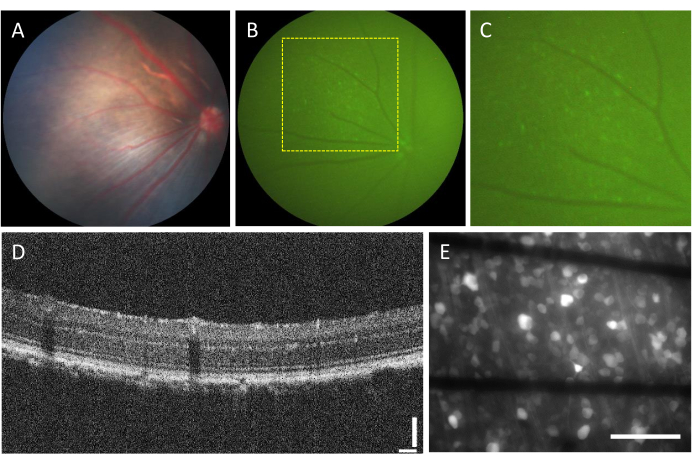
Figura 2: Immagini rappresentative della retina iniettata intravitreale. (A) Fundoscopia, (B) fundoscopia a fluorescenza, (C) ingrandimento della fundoscopia a fluorescenza, (D) immagine OCT e (E) immagine a epifluorescenza della retina asportata montata su un MEA personalizzato con elettrodi a base di grafene su vetro borosilicato di 500 μm di spessore. In (E), le linee nere corrispondono alle tracce Ti/Au. Barre graduate: 115 μm (D) e 100 μm (E). Fare clic qui per visualizzare una versione più grande di questa figura.
Elettrodi e contatto GCL
Al fine di evocare risposte neurali in modo efficace, è fondamentale assicurarsi che la retina piatta sia a stretto contatto con la superficie del MEA. Un modo semplice per verificarlo è confermare visivamente se le celle e gli elettrodi si trovano sullo stesso piano focale (Figura 3A). Se le celle non si trovano sullo stesso piano focale degli elettrodi (Figura 3B), indica che il contatto non è ottimale, il che si tradurrà in una stimolazione meno efficace.
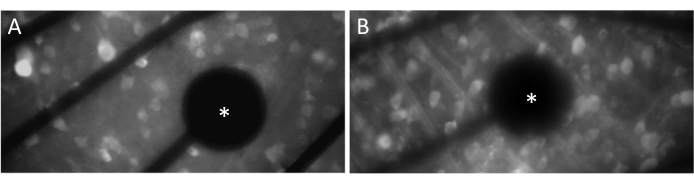
Figura 3: Elettrodi e contatto GCL. (A) Celle ed elettrodo (asterisco) sullo stesso piano focale. (B) Cellule ed elettrodi che non si trovano sullo stesso piano focale, indicando un contatto non ottimale per la stimolazione elettrica in quell'area. Fare clic qui per visualizzare una versione più grande di questa figura.
Imaging del calcio ex vivo su stimolazione elettrica fornita da un MEA
I dati risultanti dall'imaging del calcio consistono in immagini time-lapse che monitorano l'attività neurale di centinaia di cellule in risposta alla stimolazione elettrica. Gli stimoli soprasoglia causano un afflusso di calcio nei somi cellulari, con conseguente improvviso cambiamento nell'intensità della fluorescenza (Video 1). Questo protocollo consente di determinare se un elettrodo, MEA e/o un algoritmo di stimolazione suscitano la risposta desiderata nel tessuto neurale. Le dimensioni e il passo degli elettrodi sul MEA, così come la proporzione di tessuto studiato, determineranno l'ingrandimento obiettivo appropriato da scegliere. Tipicamente, per gli studi di stimolazione a singolo elettrodo con diametri compresi tra 5 μm e 100 μm, è adatto un ingrandimento dell'obiettivo 20-25x (Figura 4A), che fornisce un FOV di circa 600 μm x 600 μm. Per gli esperimenti che prevedono la stimolazione con elettrodi multipli, può essere necessario un ingrandimento dell'obiettivo 4-10x per valutare un'area più ampia di circa 2 mm x 2 mm. Le cellule reattive possono essere facilmente identificate generando una proiezione dell'immagine con deviazione standard del filmato time-lapse (Figura 4B e Video 1).
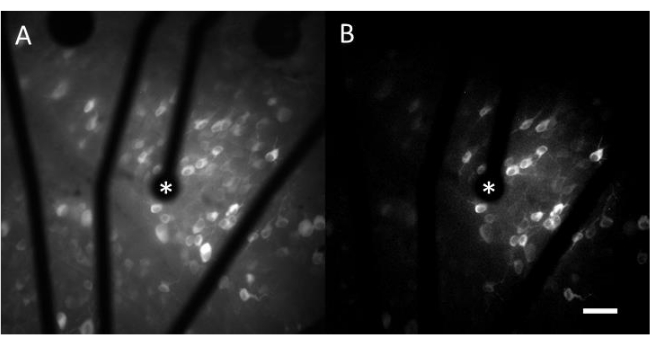
Figura 4: Imaging del calcio del GCL con stimolazione elettrica fornita da un elettrodo di 25 μm di diametro. (A) Proiezione massima di un filmato time-lapse di 60 s e (B) proiezione a deviazione standard che raffigura chiaramente le cellule che rispondono agli stimoli elettrici da un elettrodo poroso a base di grafene di 25 μm di diametro. L'elettrodo stimolante è indicato con un asterisco. Barra graduata: 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Analisi della dinamica del calcio nel tempo dopo stimolazione controllata
Per ogni soma cellulare identificato, i valori medi di intensità sono stati estratti nel tempo. La Figura 5A mostra le tracce di calcio corrette per il fotosbiancamento dalle cellule responsive. In questo esempio, cinque raffiche di treni di impulsi bifasici (prima catodica, 40 cicli, durata 1 ms, ampiezza 2 μA) sono stati erogati ogni 10 s (indicati da linee nere) durante un'acquisizione di immagini di 60 s. All'interno di un dato esperimento, vengono applicati gli stessi cinque treni di impulsi per testare la coerenza della risposta. I fotogrammi catturati durante i periodi di non stimolazione (evidenziati in rosso) vengono utilizzati per eseguire un adattamento lineare, correggendo l'effetto di fotosbiancamento.
Una volta identificate le cellule rispondenti e note le loro coordinate (x,y) rispetto all'elettrodo stimolante, si può esaminare la relazione tra la corrente necessaria per attivare le celle e la distanza dall'elettrodo stimolante (Figura 5B). Come previsto, le celle situate più vicino all'elettrodo stimolante richiedono valori di corrente più bassi per evocare una risposta.
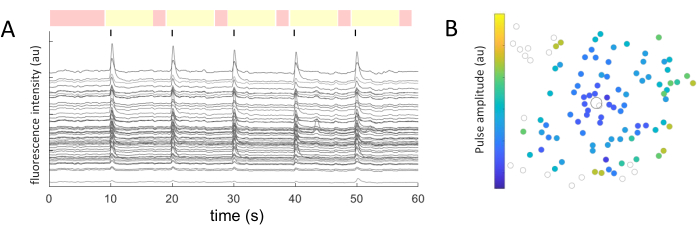
Figura 5: Rappresentazione delle risposte evocate elettricamente. (A) Tracce di calcio di soma cellulari dopo 5 raffiche di treni di impulsi (bifasici, catodici, 40 cicli, durata 1 ms, ampiezza 2 μA) ogni 10 s (linee nere) durante un'acquisizione di immagini di 60 s. Vengono mostrati i periodi non stimolanti (fotogrammi evidenziati in rosso) e stimolanti (fotogrammi evidenziati in giallo). Le tracce che superano di 2,5 volte il segnale basale (quadrato medio dei periodi non stimolanti) sono considerate risposte evocate. Le cellule che rispondono in tre dei cinque periodi di stimolazione sono classificate come cellule che rispondono. (B) Mappa di distribuzione dell'attività del calcio che mostra l'elettrodo stimolante (cerchio delineato nero) e le cellule (cerchio delineato in grigio). Il codice colore rappresenta l'ampiezza minima dell'impulso necessaria per evocare una risposta cellulare. Fare clic qui per visualizzare una versione più grande di questa figura.
Video 1: Imaging del calcio del GCL con stimolazione elettrica fornita da un elettrodo di 25 μm di diametro. Il video mostra le differenze nell'intensità della fluorescenza dovute alla stimolazione elettrica di un elettrodo poroso a base di grafene di 25 μm di diametro. Il lato sinistro mostra il filmato originale e il lato destro mostra la proiezione della deviazione standard in cui le cellule rispondenti possono essere facilmente identificate. Barra graduata: 50 μm. Clicca qui per scaricare questo video.
Discussione
Il protocollo qui descritto serve a studiare la dinamica del calcio che si verifica nel GCL retinico di ratto dopo stimolazione elettrica fornita con un MEA. Si tratta di un metodo affidabile e gestibile, ma richiede un po' di formazione, in particolare per etichettare uniformemente il GCL in modo efficiente e per montare correttamente la retina per garantire un contatto ottimale tessuto-elettrodo. Questo protocollo è specifico per i roditori e deve essere adattato se applicato a una diversa specie di laboratorio. I punti critici, le modifiche e i limiti della metodologia sono presentati in dettaglio.
Iniezioni intravitreali
Le iniezioni sono ampiamente utilizzate per la somministrazione di geni oculari, con le iniezioni intravitreali che sono la procedura preferita. Si sono dimostrate più sicure e meno invasive rispetto alle iniezioni sottoretiniche, che introducono le molecole di interesse direttamente tra i fotorecettori e l'epitelio pigmentato retinico (RPE), rischiando il distacco di retina10. Tuttavia, ci sono delle limitazioni, soprattutto quando si eseguono queste iniezioni in modelli di roditori. L'umor vitreo è gelatinoso, ostacolando la diffusione virale. Inoltre, la lente negli occhi dei roditori è grande, il che rende non banale inserire l'ago senza graffiarlo. Gli aghi per siringa di precisione sono delicati e devono essere sostituiti spesso. Per evitare ostruzioni, lavarli con acqua deionizzata prima e dopo ogni utilizzo e sostituirli regolarmente. Inoltre, iniettare lentamente il contenuto per prevenire il reflusso della soluzione e le variazioni della pressione intraoculare. Ottenere una fluorescenza ampia e uniforme attraverso la retina può richiedere pratica.
Trasduzione delle cellule retiniche
I vettori virali sono un metodo eccellente per la somministrazione genica in vivo e gli AAV sono stati ampiamente utilizzati per la trasduzione delle cellule retiniche10. Sono stati approvati come trattamento per alcune retinopatie che causano cecità umana24. Tuttavia, la loro capacità di trasporto è limitata a 5 kb, compresi gli elementi normativi richiesti (ad esempio, il promotore)10,25. Sono disponibili diversi sierotipi, ognuno con un diverso tropismo. Scegliere l'AAV più adatto in base ai geni da veicolare e alle cellule da trasdurre26. Per etichettare gli RGC, si consiglia di utilizzare AAV227.
Finestra di espressione genica
L'espressione virale ottimale per AAV2-CAG-GCaMP5G è da 2 a 3 settimane dopo l'iniezione12,18. Oltre questo lasso di tempo, i nuclei delle cellule trasfettate diventano fluorescenti, le cellule smettono di rispondere agli stimoli e alla fine muoiono 7,28,29. Ciò è dovuto alla sovraespressione dell'indicatore GCaMP, che viene traslocato nel nucleo. La finestra temporale per l'espressione genica ottimale varierà a seconda del vettore virale e del promotore scelto30 e deve essere determinata sperimentalmente prima di procedere con questo protocollo.
Contatto tessuto-elettrodo
Per risultati ottimali e riproducibili, è fondamentale ottenere un buon contatto tessuto-elettrodo. Lo scarso contatto è in genere dovuto alla curvatura naturale della retina. Un approccio consiste nel tagliare la retina in quarti, montare e fotografare una sezione alla volta. Piccole porzioni della retina possono essere meglio appiattite, con conseguente contatto più efficace con la superficie del MEA. Un'altra potenziale ragione per uno scarso contatto è la presenza di umor vitreo. Quando si conducono esperimenti di stimolazione che simulano un impianto epi-retinico, è importante rimuovere con cura l'umor vitreo durante l'escissione della retina in quanto può fungere da isolante per la corrente. Qui viene descritto un semplice metodo per verificare se il contatto è sufficiente visualizzando l'elettrodo e le celle sullo stesso piano focale.
Un'alternativa alle misurazioni retiniche ex vivo è quella di far crescere i neuroni direttamente sulla superficie degli elettrodi. La coltura primaria di neuroni, come i neuroni dell'ippocampo31, può essere utile per i test iniziali per valutare la funzionalità del nuovo dispositivo stimolante. Tuttavia, questo approccio richiede ancora l'uso di animali da laboratorio e non rappresenta la complessità della rete retinica, che è importante per valutare le risposte sinaptiche alla stimolazione.
Per visualizzare le celle sotto l'elettrodo e le tracce dell'elettrodo, è possibile utilizzare MEA fabbricati con materiali trasparenti come l'ossido di indio-stagno (ITO) 19,20,32. Oltre alle misurazioni ottiche, l'attività dei GCL in seguito alla stimolazione elettrica può essere valutata attraverso registrazioni elettriche. Il MEA può essere utilizzato per registrare il potenziale di campo locale (LFP) del tessuto. Tuttavia, ciò compromette la risoluzione spaziale, poiché ogni elettrodo cattura l'attività di più celle contemporaneamente (a seconda delle dimensioni dell'elettrodo). La registrazione ottica supera questa limitazione e offre una mappatura a risoluzione spaziale più elevata. Il suo vantaggio principale è la capacità di distinguere tra celle attive e inattive misurando un ampio FOV con risoluzione a cella singola. Tra tutti i segnalatori di attività cellulare, gli indicatori di calcio sono ben descritti e più comunemente usati33.
Divulgazioni
Gli autori non hanno informazioni da aggiungere al manoscritto.
Riconoscimenti
Siamo grati a Merche Rivas, Angel Sandoval, Jesús Planagumà, Jordi Cortés, Sandra Ortonobés Lara e Alina Hirschmann (ICFO-Institut de Ciències Fotòniques) per il loro supporto tecnico, ad Anna Duarri (VHIR, Istituto di Ricerca Vall d'Hebron) del gruppo di ricerca oftalmologica per il loro supporto con le iniezioni intravitreali e l'imaging retinico in vivo .
Gli enti finanziatori che hanno sostenuto questo lavoro sono: Fundació CELLEX; Fundació Mir-Puig; Programma del Ministerio de Economía y Competitividad - Severo Ochoa per i centri di eccellenza in R&S (CEX2019-000910-S, [MCIN/AEI/10.13039/501100011033]); Generalitat de Catalunya attraverso il programma CERCA; Laserlab-Europe (EU-H2020 GA n. 871124); Fondazione La Caixa (LCF/HR19/52160003); Fondo Sociale Europeo (PRE2020-095721, M.C.).
Materiali
| Name | Company | Catalog Number | Comments |
| 20x NA 0.75 S Fluor air objective | Nikon | CFI Super Fluor 20X | - |
| 3.5 cm Cell culture dish | Nunc | 12-565-90 | - |
| 30 G needle | VWR | 613-5373 | - |
| 36 G blunt needle | World Precision Instruments | NF36BL-2 | - |
| 6 cm Cell culture dish | Nunc | 12-565-94 | - |
| AAV2-CAG-GCaMP5G | Vector Biolabs | - | - |
| Ames' Medium | Sigma Aldrich | A1420 | - |
| Blade | Swann-morton | 0308 | - |
| Camera | Hamamatsu | ORCA Flash v4.0 | - |
| Carbogen | Air liquide | - | - |
| Curved-forceps | - | - | - |
| Fine spring-scissors | FST | 91501-09 | - |
| FITC filter cube | Nikon | Standard series | - |
| Fluorescent lamp | Nikon | C-HGFI | - |
| Fluorescent stereomicroscope | Nikon | SMZ25 | - |
| HBSS | Capricorn | HBSS-1A | - |
| ImageJ/FIJI | NIH | v1.50i | - |
| In vivo retinal imaging system | Phoenix Research Laboratories | Micron III | - |
| Inverted fluorescence microscope | Nikon | Eclipse Ti | - |
| Isofluorane | Arrane Baxter Laboratories | - | - |
| Long-Evans rat | Janvier | - | - |
| MATLAB (Version R2021b) | Mathworks | - | - |
| Media filters | Merckmillipore | SCGPS02RE | - |
| Methocel 2% | Omni Vision | - | - |
| Microelectrode array (MEA) | - | Custom-made | |
| NaHCO3 | Thermofisher | 42427 | - |
| Penicillin/Streptomycin 100x | Thermofisher | 15140122 | - |
| Phenylephrine | Alcon Cusí Laboratories | 653437.3 | 100 mg/mL |
| Plastic pipette | VWR | 612-1793 | - |
| Porous membrane | Merckmillipore | #JVWP01300 | - |
| Precision syringe | World Precision Instruments | 10 µl Nanofil | - |
| Prescaina | Llorens | - | Oxybuprocaine chlorhydrate (2 mg/mL), local anesthetic |
| Rat nasal mask | Xenotec | XRK-RA | - |
| Small curved-forceps | Bbraun | AESCBD311R | - |
| Spring-scissors | FST | 15040-11 | - |
| Stereo microscope | Zeiss | Stemi 2000 | - |
| Straight forceps | FST | 11252-20 | - |
| Suture filament | Vitrex Medical | 4328 | Nilon monofilament, 7/0, DS12 |
| Tobradex | Alcon Cusí Laboratories | - | Tobramycin (3 mg/mL) and dexamethasone (1 mg/mL) |
| Tropicamide | Alcon Cusí Laboratories | 653486 | 10 mg/mL |
| Washer | Thorlabs | W8S038 | - |
Riferimenti
- Bourne, R. R. A., et al. Prevalence and causes of vision loss in high-income countries and in Eastern and Central Europe in 2015: Magnitude, temporal trends and projections. British Journal of Ophthalmology. 102 (5), 575-585 (2018).
- Li, J. Q., et al. Prevalence and incidence of age-related macular degeneration in Europe: a systematic review and meta-analysis. British Journal of Ophthalmology. 104 (8), 1077-1084 (2020).
- Roska, B., Sahel, J. A. Restoring vision. Nature. 557 (7705), 359-367 (2018).
- Hornig, R., Velikay-Parel, M. Retina implants. Implantable Sensor Systems for Medical Applications. , Elsevier. 469-496 (2013).
- Lewis, P. M., et al. Advances in implantable bionic devices for blindness: a review. ANZ Journal of Surgery. 86 (9), 654-659 (2016).
- Weiland, J. D., Walston, S. T., Humayun, M. S. Electrical stimulation of the retina to produce artificial vision. Annual Review of Vision Science. 2, 273-294 (2016).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6, 875-881 (2009).
- Chen, T. -W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499, 295-300 (2013).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca2+ probe composed of a single green fluorescent protein. Nature Biotechnology. 19, 137-141 (2001).
- Sahu, B., Chug, I., Khanna, H. The ocular gene delivery landscape. Biomolecules. 11 (8), 1135(2021).
- Hanlon, K. S., et al. A novel retinal ganglion cell promoter for utility in AAV vectors. Frontiers in Neuroscience. 11, (2017).
- Weitz, A. C., et al. Imaging the response of the retina to electrical stimulation with genetically encoded calcium indicators. Journal of Neurophysiology. 9 (7), 1979-1988 (2013).
- Briggman, K. L., Euler, T. Bulk electroporation and population calcium imaging in the adult mammalian retina. Journal of Neurophysiology. 105 (5), 2601-2609 (2011).
- Baden, T., Berens, P., Franke, K., Román Rosón, M., Euler, T. The functional diversity of retinal ganglion cells in the mouse. Nature. 529, 345-350 (2016).
- Zhang, Y., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Nature. 615, 884-891 (2023).
- Meyer, E. L., Jenkins, C., Rengarajan, K. NIH Guidelines April 2019. Applied Biosafety. 24, Preprint at https://doi.org/10.1177/1535676019871146 (2019).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Chang, Y. -C., Walston, S. T., Chow, R. H., Weiland, J. D. GCaMP expression in retinal ganglion cells characterized using a low-cost fundus imaging system. Journal of Neural Engineering. 14 (5), 056018(2017).
- Weitz, A. C., et al. Improving the spatial resolution of epiretinal implants by increasing stimulus pulse duration. Science Translational Medicine. 7 (318), 1-12 (2015).
- Chang, Y. C., Ghaffari, D. H., Chow, R. H., Weiland, J. D. Stimulation strategies for selective activation of retinal ganglion cell soma and threshold reduction. Journal of Neural Engineering. 16 (2), 026017(2019).
- Im, M., Fried, S. I. Temporal properties of network-mediated responses to repetitive stimuli are dependent upon retinal ganglion cell type. Journal of Neural Engineering. 13 (2), 025002(2016).
- Jensen, R. J., Ziv, O. R., Rizzo, J. F. Thresholds for activation of rabbit retinal ganglion cells with relatively large, extracellular microelectrodes. Investigative Ophthalmology & Visual Science. 46 (4), 1486-1496 (2005).
- Ramos, M. S., et al. Patient-reported complications after intravitreal injection and their predictive factors. Ophthalmology Retina. 5 (7), 625-632 (2021).
- Vandenberghe, L. H., Auricchio, A. Novel adeno-associated viral vectors for retinal gene therapy. Gene Therapy. 19 (2), 162-168 (2012).
- Zin, E. A., Ozturk, B. E., Dalkara, D., Byrne, L. C. Developing new vectors for retinal gene therapy. Cold Spring Harbor Perspectives in Medicine. , a041291(2023).
- Haggerty, D. L., Grecco, G. G., Reeves, K. C., Atwood, B. Adeno-associated viral vectors in neuroscience research. Molecular Therapy-Methods & Clinical Development. 17, 69-82 (2020).
- Hellström, M., et al. Cellular tropism and transduction properties of seven adeno-associated viral vector serotypes in adult retina after intravitreal injection. Gene Therapy. 16 (4), 521-532 (2009).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nature Protocols. 11, 566-597 (2016).
- Yang, Y., et al. Improved calcium sensor GCaMP-X overcomes the calcium channel perturbations induced by the calmodulin in GCaMP. Nature Communications. 9, 1504(2018).
- Nieuwenhuis, B., et al. Improving adeno-associated viral (AAV) vector-mediated transgene expression in retinal ganglion cells: comparison of five promoters. Gene Therapy. 30, 503-519 (2023).
- Cunquero, M., Aguilar, E., Loza-Alvarez, P., Planagumà, J. Hippocampal neuronal cultures to detect and study new pathogenic antibodies involved in autoimmune encephalitis. Journal of Visualized Experiments. 184, e63829(2022).
- Behrend, M. R., Ahuja, A. K., Humayun, M. S., Chow, R. H., Weiland, J. D. Resolution of the epiretinal prosthesis is not limited by electrode size. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 19 (4), 436-442 (2011).
- Grienberger, C., Konnerth, A. Imaging calcium in neurons. Neuron. 73 (5), 862-885 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon