Method Article
Elektrikle Uyarılan Düz Monte Retinalarda Kalsiyum Görüntüleme
Bu Makalede
Özet
Retina protezleri görsel algı oluşturma özelliğine sahiptir. Yeni protezlerin geliştirilmesini ilerletmek için, implantasyondan önce cihazları test etmek için ex vivo yöntemlere ihtiyaç vardır. Bu makale, elektriksel stimülasyona maruz kaldığında retinal ganglion hücre tabakasındaki kalsiyum aktivitesini incelemek için kapsamlı bir protokol sunmaktadır.
Özet
Retina distrofileri dünya çapında körlüğün önde gelen nedenlerinden biridir. Dejenere retinadaki bozulmuş ışığa duyarlı fotoreseptör hücrelerini atlayabilen, görsel algıları indükleyerek görmeyi kısmen geri kazanmayı amaçlayan gelişmiş retina protezleri geliştirmek için kapsamlı çabalar devam etmektedir. Yaygın bir araştırma yolu, çok sayıda elektrot barındıran, esnek bir fiziksel yapıya sahip implante edilebilir cihazların tasarımını ve üretimini içerir. Bu, görsel algıların verimli ve hassas bir şekilde oluşturulmasını sağlar. Bununla birlikte, her teknolojik ilerlemeyle birlikte, cihazın performansının ötesindeki faktörlerin devreye girdiği in vivo deneylere geçmeden önce cihazın işlevselliğini doğrulamak için güvenilir ve yönetilebilir bir ex vivo yönteme ihtiyaç duyulmaktadır. Bu makale, elektriksel stimülasyonu takiben retinal ganglion hücre tabakasında (GCL) kalsiyum aktivitesini incelemek için kapsamlı bir protokol sunmaktadır. Spesifik olarak, aşağıdaki adımlar özetlenmiştir: (1) genetik olarak kodlanmış kalsiyum göstergeleri kullanılarak sıçan retinasının floresan olarak etiketlenmesi, (2) farklı elektriksel stimülasyon desenleri uygulanırken ters çevrilmiş bir floresan mikroskobu kullanılarak floresan sinyalinin yakalanması ve (3) GCL içindeki tek tek hücrelerden kalsiyum izlerinin çıkarılması ve analiz edilmesi. Bu prosedürü izleyerek, araştırmacılar in vivo deneyler yapmadan önce yeni stimülasyon protokollerini verimli bir şekilde test edebilirler.
Giriş
Retina, ışığı algılamaktan sorumlu hücreler olan fotoreseptörleri içerir. Fotonları yakalar ve onları sinir uyarılarına dönüştürürler. Bu uyarılar daha sonra retina içinde işlenir ve görsel kortekse iletilir, bu da görsel bir görüntününoluşumuna neden olur 1. Retinitis Pigmentosa (RP) ve Yaşa Bağlı Makula Dejenerasyonu (YBMD), fotoreseptörlerin ilerleyici kaybı ile karakterize dejeneratif hastalıklardır. Bu retinopatiler, dünya çapında körlüğün önde gelen nedenleriarasındadır1, milyonlarca kişiyi etkiler ve hastalar, sağlık sistemleri ve bir bütün olarak toplum için önemli tıbbi, kişisel ve sosyoekonomik sonuçlara sahiptir. Ayrıca, yaşlanan nüfusla birlikte YBMD vakalarının 2050 yılına kadar %15 oranında artacağı tahmin edilmektedir2.
Şu anda, bu koşullardan etkilenen hastalarda görmeyi geri kazanmak için çok sayıda araştırma çabası devam etmektedir3. Umut verici bir yaklaşım, görmeyi kısmen geri kazanmada etkinliği olan retina protezlerinin kullanılmasıdır 4,5. Bu cihazlar görsel sahneden ışığı yakalar ve elektrik darbelerine dönüştürür. Bu darbeler, göze implante edilmiş bir mikroelektrot dizisi (MEA) içindeki elektrotlar aracılığıyla iletilir, hayatta kalan nöronları uyarır ve kayıp fotoreseptörlerin işlevini atlar. Aktive edilmiş retinal ganglion hücreleri (RGC'ler) çıktıyı beyne iletir ve burada görsel algı olarak yorumlanır. Bununla birlikte, mevcut implantların ana sınırlamaları, elektrot-doku arayüzünün6 çözünürlüğünde ve farklı hücre tiplerinin seçici olmayan stimülasyonunda yatmaktadır. Bu nedenle, daha verimli görme restorasyonu için yeni implante edilebilir cihazların tasarımını optimize etmek için, elektrotlara yakın hücreleri seçici olarak aktive etmek için stimülasyon paradigmalarının nasıl geliştirilebileceğini anlamak çok önemlidir.
Kalsiyum görüntüleme, nöral aktiviteyi incelemek için yaygın olarak kullanılan bir tekniktir ve optik olmayan yöntemlere göre çeşitli avantajlar sunar 7,8. İlk olarak, hücresel ve hücre altı çözünürlük sağlar. İkincisi, kalsiyum belirteçleri belirli hücre tiplerini hedefleyebilir. Üçüncüsü, uzun süreli izlemeye izin verir ve dördüncüsü, aktif ve aktif olmayan hücreleri ayırt ederken tüm hücre popülasyonlarının gözlemlenmesini sağlar. Bu yöntem, yüzlerce milisaniye aralığında zamansal bir çözünürlükle hücresel aktivitenin dolaylı kanıtını sağlar. GCaMP sensörleri gibi genetik olarak kodlanmış floresan kalsiyum göstergeleri, kalsiyuma bağlandıktan sonra konformasyonel bir değişikliğe uğrar ve bu da floresansın artmasına neden olur9. Rekombinant adeno ilişkili viral vektörler (AAV'ler), GCaMP10 ile retina hücrelerini dönüştürmenin etkili bir yoludur.
Bu protokol, retina implantlarının stimülasyon protokollerini test etmek için kalsiyum görüntülemeyi kullanan etkili bir yöntem sunar. Özellikle, ex vivo sıçan retina dokusuna odaklanıyoruz ve numune alımından veri analizine kadar ayrıntılı adım adım talimatlar sağlıyoruz. Bu kapsamlı kılavuzu sunarak, çeşitli geçmişlere sahip araştırmacılar elektriksel stimülasyon deneylerine güvenle başlayabilirler.
Protokol
Tüm hayvan prosedürleri, standart hayvan etik kurallarına (Avrupa Toplulukları Direktifi 86/609/EU) uygun olarak yürütülmüş ve yerel hayvan etik kurulları tarafından onaylanmıştır. Bu çalışma için 8 haftalık Long Evans sıçanları kullanıldı. Hayvanlar ticari bir kaynaktan elde edilmiştir (bkz.
1. Ortamın hazırlanması ve düz montaj montajı
- Ames Orta Boy (1 L)
- 1 L'lik bir cam şişede Ames'in Orta tozu, 1.9 g/L NaHCO3, 10 ml Penisilin / Streptomisin 100x ve 1 L deiyonize suyu birleştirin (Malzeme Tablosuna bakınız). Deiyonize su veya NaHCO3 ile pH'ı 7.4'e ve ozmolariteyi 280 mOsm'ye ayarlayın. Çözeltiyi bir başlık altında 0,2 μm gözenek boyutunda bir filtreden süzerek sterilize edin.
NOT: Sterilize edilmiş ortamı 4 °C'de saklayın. Bu çözelti stabil kalır ve 1 aya kadar kullanılabilir.
- 1 L'lik bir cam şişede Ames'in Orta tozu, 1.9 g/L NaHCO3, 10 ml Penisilin / Streptomisin 100x ve 1 L deiyonize suyu birleştirin (Malzeme Tablosuna bakınız). Deiyonize su veya NaHCO3 ile pH'ı 7.4'e ve ozmolariteyi 280 mOsm'ye ayarlayın. Çözeltiyi bir başlık altında 0,2 μm gözenek boyutunda bir filtreden süzerek sterilize edin.
- Montaj membranları
- Küçük tutkal damlaları kullanarak bir PTFE gözenekli membranı ( Malzeme Tablosuna bakın) bir yıkayıcıya takın. En az 15 dakika kurumasını bekleyin.
- Yarı saydamlık elde etmek için, membranları 1 dakika boyunca% 70 etanole batırın.
- Etanolü tamamen çıkarmak için membranları iki kez deiyonize suyla durulayın. Opaklığı önlemek için deiyonize suda saklayın.
2. GCL etiketleme ve sıçan retina düz montajı
NOT: Bu etiketleme yöntemi, RGC'leri yer değiştirmiş amakrin hücrelerden ayırt etmez. RGC'lerin seçici olarak etiketlenmesi isteniyorsa, RGC'ye özgü promotörler11 ve/veya optik sinir12 yoluyla retrograd etiketleme ile AAV'leri kullanmayı düşünün. AÇIK ve MERKEZ DIŞI RGC sınıfları arasında ayrım yapmak için, RGC'leri ışık tepkilerinegöre sınıflandırın 13,14 ve daha fazla hassasiyet ve tek eylem potansiyellerini ölçme yeteneği sunan genetik olarak kodlanmış kalsiyum göstergelerinin daha yeni versiyonlarını kullanın15.
- İntravitreal enjeksiyon
- 8 haftalık Long Evans sıçanını pedal refleksi kalmayana kadar %2 izofluran /%1O2 ile uyuşturun ve anesteziyi sıçan burun maskesi ile koruyun (bkz.
NOT: Anestezi sırasında, vücut ısısını korumak için hayvanı bir ısıtma yastığına yerleştirin. - Öğrenciyi genişletmek için piyasada bulunan bir damla göz damlası uygulayın ( Malzeme Tablosuna bakın).
- Ameliyata devam etmeden önce, in vivo retinal görüntüleme sistemi ile fundoskopi ve Optik Koherens Tomografi (OCT) kullanarak gözü anormallikler açısından inceleyin. Kornea-objektif teması kolaylaştırmak için bir damla Methocel% 2 uygulayın (bkz.
NOT: Herhangi bir anormallik tespit edilirse, o göz için sonraki adımlara devam etmeyin. - Lokal anestezik olarak bir damla Prescaine uygulayın. Göz kapağını ve limbal konjonktivayı piyasada bulunan bir sütür filamenti ile sabitleyin (bkz. 30 G'lik bir iğne kullanarak limbustan 4 mm'lik bir 1 mm sklerotomi oluşturun.
- Hassas bir şırıngaya 36 G'lik künt bir iğne takın ve genetik olarak kodlanmış kalsiyum indikatörünü taşıyan AAV parçacıklarını 45°'lik bir açıyla 30 saniye boyunca vitreusa enjekte edin. Bu çalışmada AAV2-CAG-GCaMP5G (HBSS'de 7.5 x 1011 GC/mL) kullanıldı (bkz.
NOT: Potansiyel olarak tümörjenik gen ürünlerini veya toksin moleküllerini kodlamayan ve yardımcı bir virüs olmadan üretilen AAV yapıları, Biyogüvenlik Seviye 1 (BSL-1) tesislerinde ele alınabilir. Aksi takdirde, BSL-2 muhafazası kapsamında biyolojik olarak tehlikeli malzeme olarak kabul edilirse, uygun önlemler alınmalıdır16. GCaMP'yi kodlayan AAV'ler BSL-1 olarak kabul edilir ve biyogüvenlik kabinleri altında manipülasyon gerektirmez.
- Hassas bir şırıngaya 36 G'lik künt bir iğne takın ve genetik olarak kodlanmış kalsiyum indikatörünü taşıyan AAV parçacıklarını 45°'lik bir açıyla 30 saniye boyunca vitreusa enjekte edin. Bu çalışmada AAV2-CAG-GCaMP5G (HBSS'de 7.5 x 1011 GC/mL) kullanıldı (bkz.
- Enflamasyonu önlemek ve antibiyotik profilaksisi olarak bir damla Tobradex uygulayın ( Malzeme Tablosuna bakınız).
- İstenirse, diğer gözünüzle 2., 3. ve 4. adımları tekrarlayın.
NOT: Herhangi bir advers reaksiyon olmadığından emin olmak için ameliyattan 12-24 saat sonra hayvanları kontrol edin. - Enjeksiyondan üç gün sonra, in vivo retinal görüntüleme sistemi ile fundoskopi ve OCT kullanarak retina yapısını inceleyin (bkz.
- Enjeksiyondan iki hafta sonra, GCL floresan yaymalıdır. Bir in vivo retinal görüntüleme sistemi kullanarak floresan fundoskopi ile retina yapısını ve AAV ekspresyonunu değerlendirin.
NOT: Weitz ve ark.12'ye göre, AAV2-CAG-GCaMP5G'den gelen floresan, enjeksiyondan 1 hafta sonra fark edilir hale gelir ve 2 hafta yoğunlaşır. Dördüncü haftadan itibaren GCaMP'nin aşırı ekspresyonu sitomorbiditeyi indükler. Ölmekte olan hücreler, çekirdekte ve sitoplazmada stimülasyona yanıt olarak dalgalanmayan yüksek bir temel floresan sinyali sergiler. Sağlıklı hücrelerde, GCaMP ekspresyonu sitoplazma ile sınırlıdır veçekirdekten hariç tutulur 7,8,12,17,18. Bu özellikler mikroskopi görüntüleme sırasında ex vivo olarak gözlemlenebilir. Gen ekspresyon penceresi, viral vektöre ve seçilen promotöre bağlı olarak değişebilir.
- 8 haftalık Long Evans sıçanını pedal refleksi kalmayana kadar %2 izofluran /%1O2 ile uyuşturun ve anesteziyi sıçan burun maskesi ile koruyun (bkz.
- Retina eksizyonu ve düz montaj
NOT: Enjeksiyondan iki ila üç hafta sonra, intravitreal olarak enjekte edilen sıçanlar, elektrofizyoloji protokolü başlamadan hemen önce, standart etik yönergelere (Avrupa Toplulukları Direktifi 86/609 / EU) uygun olarak ötenazi yapılır ve yerel etik komiteler tarafından onaylanır. Bu protokolde ötenazi yöntemi olarak karbondioksit (CO2) inhalasyonu kullanılmaktadır.- Göz enükleasyonu
- Gözü göz yuvasından hafifçe çıkarmak için bir çift kavisli forseps kullanarak yörüngenin dışına hafifçe bastırın.
- Göz küresini delmemeye dikkat ederek gözü tutan kasları kesmek ve enükleasyon yapmak için bir çift yaylı makas kullanın.
NOT: Bu adımdan başlayarak, retinayı oksijenli (%95O2 /% 5 CO2) Ames Ortamında stereo mikroskop altında inceleyin.
- Retina eksizyonu
- Çevresindeki tüm dokuyu göz küresinden çıkarmak için bir çift küçük kavisli forseps ve ince yaylı makas kullanın.
- Yaklaşık 3 cm x 3 cm boyutlarında bir parça filtre kağıdı alın ve 3,5 cm'lik bir kabın kapağına yerleştirin. Kağıdı Ames' Medium ile ıslatın.
- Göz küresini, ön segment operatöre bakacak şekilde kağıdın üzerine yerleştirin. Göz küresini tutmak için bir çift düz forseps kullanın ve bunları çanak yüzeyinden yaklaşık 45°'lik bir açıyla ora serrata'nın üzerine yerleştirin. Düz forseps arasındaki boşluğu referans olarak kullanarak bir bıçakla küçük bir kesim yapın.
- Göz küresini Ames'in Medium'una geri ödeyin. Gözün ön ve arka kısımlarını ayırmak için bir çift düz forseps ve ince yaylı makas kullanın.
- İki çift düz forseps kullanarak lensi dikkatlice çıkarın. Ardından, retinayı skleradan ayırın.
- Retina vizör lastiğinden izole edilene kadar ince yaylı makas kullanarak sklerayı optik sinire doğru kesin.
- Retinanın en iyi kalsiyum indikatör ifadesine sahip bölgesini belirlemek için bir floresan stereo mikroskop kullanın.
NOT: Viral yayılımın derecesi intravitreal enjeksiyonun başarısına bağlıdır. Retinanın büyük bölümlerinde floresan elde etmek pratik gerektirebilir. Araştırmacının deneyimi, en iyi sonuçların elde edilmesinde çok önemli bir rol oynar. - Kesik uçlu plastik bir pipet kullanarak, retinanın seçilen parçasını montaj membranına aktarın (montaj membranı adımları). Retinayı GCL yukarı bakacak şekilde düz bir şekilde monte etmek için bir çift düz forseps kullanın.
- 100 μL'lik bir pipet ucuna bağlı plastik bir pipetle, retina parçasının gözenekli zara yapışmasını sağlamak için ortamı çıkarın. GCL'nin elektrotların üzerine oturması için düzeneği MEA'ya çevirin.
- Numune banyosunu oksijenli Ames Medium ile doldurun.
- Göz enükleasyonu
3. Elektrik stimülasyonu üzerine ex vivo kalsiyum görüntüleme
NOT: Bu çalışmada, ex vivo deneyler için bir kavram kanıtı MEA kullanılmıştır. Özel MEA'lar, Ti/Au izleri olan 500 μm kalınlığında borosilikat cam üzerine 25 μm çapında gözenekli grafen bazlı elektrotlarla üretildi ve daha sonra silisyum nitrür ve SU-8 fotorezist12 ile izole edildi. Ancak kalsiyum görüntüleme yöntemleri, stimülasyon için kullanılan elektrot materyalinden bağımsız olarak geçerlidir.
- Perfüzyon sistemini, oksijenli Ames Ortamı, numune banyosunu 33 °C'de 5 mL/dk'lık sabit bir akış hızında sürekli olarak perfüze edecek şekilde ayarlayın.
- Bir floresan lamba, bir FITC filtre küpü ve bir CMOS kamera ile donatılmış ters çevrilmiş bir floresan mikroskobu kullanarak, uyarıcı elektrotların ve GCaMP eksprese eden hücrelerden gelen floresanın görülebildiği bir alan için retinayı inceleyin. Bu çalışma için 20x NA 0.75 hava objektifi kullanıldı.
NOT: Elektrotlarla hücreleri etkili bir şekilde uyarmak (ve kaydetmek) için retina ve elektrotun yakın temas halinde olması gerekir. Böylece hücreler gözle görülür şekilde elektrotlarla aynı odak düzlemindedir. Aksi takdirde, 8. adımdan itibaren retina eksizyon adımlarını tekrarlayın. Sağlıklı hayvan modellerinden (çalışan fotoreseptörlerle) retinaları kullanırken, floresan lamba her açıldığında, retina GCaMP sensörünü uyarmak için kullanılan dalga boyuna ışığa duyarlı olduğundan, ışık tarafından üretilen bazı uyarılmış tepkiler olacağını unutmayın. Bu ışığa bağlı kalsiyum değişiklikleri, dokunun sağlık durumunu değerlendirmek için kullanılabilir. Işığın elektrikle uyarılmış tepkilerle karışmasını önlemek için, görüntü alımına başlamadan en az 1 dakika önce floresan lambayı açın. - GCL'de elektriksel olarak uyarılmış yanıtları ortaya çıkarmak için, akım kontrollü darbeler göndermek üzere bir elektrot seçin. Darbe üreteci cihazının yazılımında, uygulanacak darbelerin şekli, genliği, süresi, faz gecikmesi ve frekansı gibi elektriksel stimülasyon parametrelerini ayarlayın.
NOT: Etkili uyaran parametreleri, 0,1 μA ila 10 μA arasında değişen genliklerle, 50 μs ila 100 ms darbe genişlikleri arasında büyük ölçüde değişebilir. Bu parametreler, uyaran frekansı, uyaran polaritesi, darbe sayısı ve fazlar arası gecikmeler ile birlikte, kalsiyum görüntüleme 19,20,21,22 ile gözlenen uzay-zamansal yanıtı etkileyebilir. 1 ms, 2 μA stimülasyon sağlayan 40 bifazik darbeden oluşan bir tren, genellikle etiketli nöronlarda görünür bir yanıt oluşturur. - Görüntü alımını stimülasyon iletimi ile senkronize etmek için, görüntü alımının başlangıcını kontrol etmek için darbe üretecini harici bir tetikleyici olarak kullanın. Çıkış tetikleme sinyalini kullanarak kamerayı ( Malzeme Tablosuna bakın) darbe üretecine bağlayın ve kamera yazılımının "Çekim Modu"nu "Harici Başlatma Tetiği" olarak ayarlayın. Harici bir tetikleyicinin başlamasını beklemek için kamera yazılımında Başlat'a basın. Nabız üreteci yazılımı ile görüntü alımını başlatın.
NOT: Harici tetik kontrolü, farklı kameralar için farklı şekilde ayarlanmış olabilir. Bu çalışma tipik olarak 1 dakika boyunca saniyede 10 kare hızında görüntüler (512 x 512 piksel, 16 bit gri tonlama) elde ederken, her 10 saniyede bir bifazik darbe treni patlamaları sağladı. Nabız iletimi 10 saniye sonra başlar, bu nedenle tüm deneylerdeki ilk kareler spontan aktiviteye karşılık gelir. GCaMP sensörüne ve gerçekleştirilecek analize bağlı olarak, kayıt hızını kalsiyum göstergenizin8 yükselme ve bozulma sürelerine göre ayarlamanız gerekebilir. Kalsiyum indikatörünün15 tek etki potansiyellerini tespit etme hassasiyetini göz önünde bulundurun. - Görüntüleri, [Elektrot numarası]_[Darbe Genliği]_[Darbe süresi]_[Darbe Frekansı]_Image001 gibi uygulanan elektriksel stimülasyon parametrelerini içeren bir dosya adıyla kaydedin.
4. Veri analizi
- Zaman içindeki floresan yoğunluk profilini ve hücre somalarından uzamsal koordinatları çıkarmak için ImageJ/FIJI
- "Alan Seçim Araçları" ile ilgilenilen bölgeyi (ROI) segmentlere ayırın ve ROI Yöneticisine ekleyin (ROI Yöneticisi > Ekle'> Analiz > Araçları). ROI Yöneticisi menüsünden, .zip klasörü olarak kaydedin (Kaydet> daha fazlası).
NOT: Tipik olarak, aynı ROI'ler, aynı FOV'a karşılık geldikleri için tüm stimülasyon deneylerine uygulanabilir. - Çıkarılacak parametre olarak "Ortalama gri değer"i seçin (Analiz > Ölçümleri ayarlayın).
- Daha Fazla > Çoklu Ölçü'yü tıklayarak hücre somalarından "Ortalama gri değeri" çıkarın. Bir iletişim kutusu görünecektir. Sütunların ROI'lere ve satırların zaman dilimlerine karşılık geldiği tek bir tablo elde etmek için 600 dilimin tümünü ölç ve Dilim başına bir satır seçeneklerini etkinleştirin. Oluşturulan tabloyu .xls bir elektronik tablo olarak kaydedin.
- Çıkarılacak parametre olarak "Centroid"i seçin (Analiz > Ölçümleri ayarlayın).
- Ölç'e tıklayarak ROI'lerden "Centroid"i çıkarın. Oluşturulan tablo, ROI'lerin koordinatlarına (X,Y) karşılık gelir. .xls bir e-tablo olarak kaydedin.
- "Alan Seçim Araçları" ile ilgilenilen bölgeyi (ROI) segmentlere ayırın ve ROI Yöneticisine ekleyin (ROI Yöneticisi > Ekle'> Analiz > Araçları). ROI Yöneticisi menüsünden, .zip klasörü olarak kaydedin (Kaydet> daha fazlası).
- Uyaranlara yanıt veren hücreleri tanımlamak için özel olarak oluşturulmuş komut dosyası
NOT: Burada MATLAB ( Malzeme Tablosuna bakınız) kullanılmıştır, ancak açıklanan adımlar herhangi bir programlama dilinde gerçekleştirilebilir. Kullanıcılar, ilgili yazarı talep ederek özel olarak oluşturulmuş komut dosyamızı edinebilirler.- Foto ağartma etkisi düzeltmesi: Arka planı ve foto ağartma etkisini azaltmak için, her patlamadan önce uyarıcı olmayan dönemlerden 15-20 kare alın ve bunları doğrusal bir eğriye sığdırın [fit (poly1)].
NOT: Bu durumda, her 10 saniyede bir periyodik darbe dizisi patlamalarının gönderildiği toplam 600 karelik bir film için, 1:90, 170:190, 270:290, 370:390, 470:490, 570:590 kareleri uyarıcı olmayan dönemler olarak kabul edildi. - Aşağıdaki formülü kullanarak normalleştirin: (X-dk) / (maks-dk)
- Yanıt veren hücrelerin tanımlanması
- Normalleştirilmiş verilerden uyarıcı olmayan dönemlerin ortalama karekök karesini (RMS) hesaplayın. Bu, temel sinyal olarak kabul edilecektir.
- Uyarıcı dönemlerin maksimumunu hesaplayın (uyarıcı olmayan dönemler arasındaki kareler). Bu durumda, her 10 saniyede bir periyodik darbe treni patlamalarının gönderildiği toplam 600 karelik bir film için, 91:169, 191:269, 291:369, 391:469, 491:569 kareleri uyarıcı dönemler olarak kabul edildi.
- Maksimum değer, belirli bir ROI için temel sinyali 2,5 kat aşarsa, hücreyi bu uyarıcı döneme yanıt verecek şekilde etiketleyin. Hücre, beş uyarıcı periyottan üçüne yanıt verirse, onu yanıt veren bir hücre olarak sınıflandırın.
- Foto ağartma etkisi düzeltmesi: Arka planı ve foto ağartma etkisini azaltmak için, her patlamadan önce uyarıcı olmayan dönemlerden 15-20 kare alın ve bunları doğrusal bir eğriye sığdırın [fit (poly1)].
Sonuçlar
Bu çalışmada açıklanan protokol, Weitz ve ark.12 tarafından yürütülen floresan görüntüleme ve elektriksel stimülasyon çalışmalarına dayanmaktadır. Protokol üç ana bölümden oluşur: (1) GCL'nin floresan etiketlemesi ve retinanın MEA'ya düz montajı (Şekil 1-sol), (2) elektriksel stimülasyon sırasında GCL'deki kalsiyum aktivitesinin görselleştirilmesi (Şekil 1-orta) ve (3) görüntüleme verilerinin çıkarılması, işlenmesi ve yorumlanması (Şekil 1-sağ).
İlk olarak, Şekil 1-solda gösterildiği gibi, Long Evans sıçanlarına görüntüleme seansından önce intravitreal AAV2-CAG-GCaMP5G enjekte edilir. Bu vektör için optimal viral ekspresyon, enjeksiyondan 2 ila 3 hafta sonraortaya çıkar 12,18. Hayvanı tamamen uyuşturduktan sonra, 30 G'lik bir iğne kullanılarak bir pilot delik açılır ve daha sonra reflüyü önlemek için hassas bir şırıngaya bağlı 36 G'lik künt bir iğne kullanılarak 5 μL AAV2-CAG-GCaMP5G yavaşça vitreusa enjekte edilir. Viral ekspresyon sırasında, ameliyat sonrası retinanın durumunu değerlendirmek için bir in vivo retinal görüntüleme sistemi kullanılır ve OCT görüntüleri retina katmanlarının ayrıntılı görselleştirilmesini sağlar. Gen ekspresyonu sağlandıktan sonra, retina bir stereo mikroskop ve yüksek hassasiyetli diseksiyon araçları kullanılarak vizör lastiğinden dikkatlice çıkarılır. Bu noktadan itibaren, numuneyi korumak için doku oksijenli ortamda manipüle edilir. Eksize edilen retina, GCL yukarı bakacak şekilde, stabiliteyi sağlamak ve numunenin yüzmesini önlemek için düz montaj için tasarlanmış bir platforma monte edilir. Numune, GCL elektrotlara bakacak şekilde MEA yüzeyine monte edilir.
Daha sonra, MEA, ters çevrilmiş bir floresan mikroskop üzerindeki arayüz kartına monte edilir (Şekil 1-orta). Retina örneği, bir perfüzyon sistemi kullanılarak 33 ° C'de oksijenli ortam ile perfüze edilir. Örnek bu yapılandırmada birkaç saat tutulabilir. İstenilen stimülasyon şeması programlanır ve görüntüler saniyede 10 kare hızında elde edilir. Filmlerin uygulanan elektriksel stimülasyon parametrelerine göre isimlendirilmesi tavsiye edilir. Görüntü edinimi, negatif bir kontrol görevi görecek olan stimülasyon olmadan bazı temel çerçeveler elde etmek için stimülasyonun başlamasından önce başlamalıdır.
Son olarak, Şekil 1-sağda gösterildiği gibi, veriler, hücre somalarını bölümlere ayırarak hızlandırılmış görüntülerden çıkarılır. Foto ağartma etkileri, veriler uydurularak düzeltilir ve yanıt veren hücreler tanımlanır. Duyarlı hücreler, stimülasyon sırasında taban çizgilerini 2,5 kat aşan floresan zirvelerine sahip olanlar olarak tanımlanır. Bir hücre, beş stimülasyon patlamasından üçüne yanıt verirse, bu spesifik stimülasyon dizisine yanıt verdiği kabul edilir.
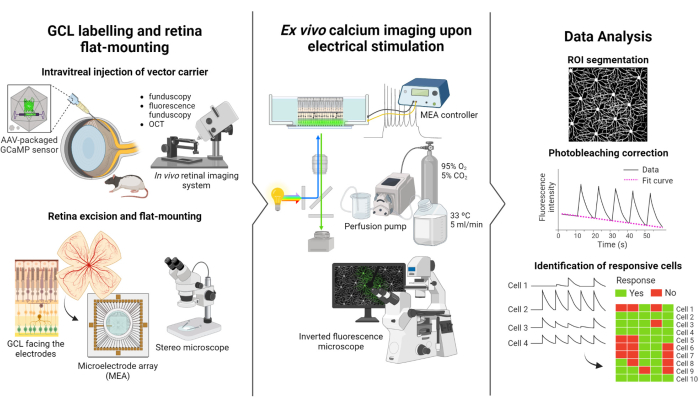
Şekil 1: Çalışmaya genel bakış. (Solda) retinanın GCL'sini floresan olarak etiketleme ve numune montajı için protokolün şematik gösterimi, (ortada) bir MEA tarafından sağlanan elektriksel stimülasyon ile ex vivo kayıtlar için hazırlık ve (sağda) duyarlı hücreleri sınıflandırmak için kalsiyum görüntüleme verilerinin analiz edilmesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
İntravitreal enjeksiyonlu retina
İntravitreal enjeksiyonlara bağlı komplikasyon insidansı çok düşüktür. Bununla birlikte, enjekte edilen bileşenden bağımsız olarak ameliyatın kendisinden kaynaklanabilecek bazı komplikasyonlar vardır. Bu komplikasyonlar arasında katarakt oluşumu, vitreus kanaması, göz içi basıncının yükselmesi ve endoftalmibulunur 23. Bu komplikasyonların ameliyattan kaynaklanıp kaynaklanmadığını belirlemek için, hayvanın işlemden önce funduskopi ve OCT kullanılarak değerlendirilmesi gerekir. Enjeksiyondan üç gün sonra hayvanlar takip edilmelidir. Şekil 2A-D'de, enjekte edilen sağlıklı bir hayvanın retinası gösterilmektedir. İki haftalık enjeksiyondan sonra, RGC'ler floresan fundoskopi kullanılarak görselleştirilebilen floresan eksprese etmeye başlar (Şekil 2B, C). OCT görüntüleri, retina katmanlarının yerleşimi ve kalınlığının ayrıntılı bir şekilde görüntülenmesini sağlar (Şekil 2D), özellikle retina dekolmanı değerlendirilirken fundoskopiye kıyasla daha yüksek çözünürlük sunar. Retina düz bir şekilde monte edildikten ve ters çevrilmiş bir floresan mikroskobu kullanılarak görüntülendikten sonra, hücreleri ve akson demetlerini ayırt etmek mümkün hale gelir. Diğer kalsiyum indikatörlerinden farklı olarak, GCaMP indikatörü sitoplazma7 ile sınırlıdır ve floresan çekirdekten hariç tutulur (Şekil 2E).
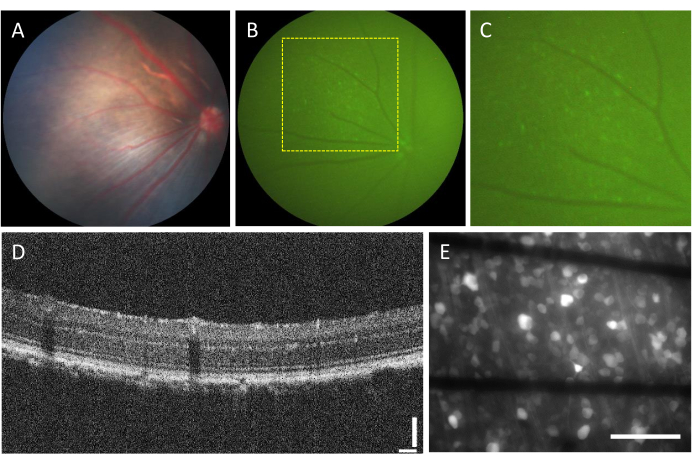
Şekil 2: İntravitreal enjekte edilen retinanın temsili görüntüleri. (A) Fundoskopi, (B) floresan fundoskopi, (C) floresan fundoskopinin yakınlaştırılması, (D) OCT görüntüsü ve (E) 500 μm kalınlığında borosilikat cam üzerine grafen bazlı elektrotlarla özel bir MEA üzerine monte edilmiş eksize edilmiş retinanın epi-floresan görüntüsü. (E)'de siyah çizgiler Ti/Au izlerine karşılık gelir. Ölçek çubukları: 115 μm (D) ve 100 μm (E). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Elektrotlar ve GCL kontağı
Nöral tepkileri etkili bir şekilde uyandırmak için, düz monte retinanın MEA yüzeyi ile yakın temas halinde olmasını sağlamak çok önemlidir. Bunu doğrulamanın basit bir yolu, hücrelerin ve elektrotların aynı odak düzleminde bulunup bulunmadığını görsel olarak doğrulamaktır (Şekil 3A). Hücreler elektrotlarla aynı odak düzleminde değilse (Şekil 3B), temasın yetersiz olduğunu gösterir ve bu da daha az etkili stimülasyona neden olur.
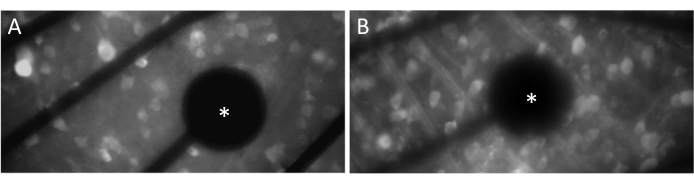
Şekil 3: Elektrotlar ve GCL kontağı. (A) Hücreler ve elektrot (yıldız) aynı odak düzleminde. (B) Aynı odak düzleminde olmayan hücreler ve elektrotlar, o bölgedeki elektriksel stimülasyon için yetersiz teması gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bir MEA tarafından sağlanan elektriksel stimülasyon üzerine ex vivo kalsiyum görüntüleme
Kalsiyum görüntülemeden elde edilen veriler, elektriksel stimülasyona yanıt olarak yüzlerce hücrenin nöral aktivitesini izleyen hızlandırılmış görüntülerden oluşur. Eşik üstü uyaranlar, hücre somalarına kalsiyum akışına neden olarak floresan yoğunluğunda ani bir değişikliğe neden olur (Video 1). Bu protokol, bir elektrot, MEA ve/veya stimülasyon algoritmasının nöral dokuda istenen yanıtı ortaya çıkarıp çıkarmadığını belirlemeyi sağlar. MEA üzerindeki elektrotların boyutu ve aralığı ile çalışılan dokunun oranı, seçilecek uygun objektif büyütmeyi belirleyecektir. Tipik olarak, çapları 5 μm ila 100 μm arasında değişen tek elektrotlu stimülasyon çalışmaları için, yaklaşık 600 μm x 600 μm'lik bir FOV sağlayan 20-25x objektif büyütme uygundur (Şekil 4A). Birden fazla elektrotla stimülasyon içeren deneyler için, yaklaşık 2 mm x 2 mm'lik daha geniş bir alanı değerlendirmek için 4-10x objektif büyütme gerekebilir. Duyarlı hücreler, zaman atlamalı filmin standart sapmalı görüntü projeksiyonu oluşturularak kolayca tanımlanabilir (Şekil 4B ve Video 1).
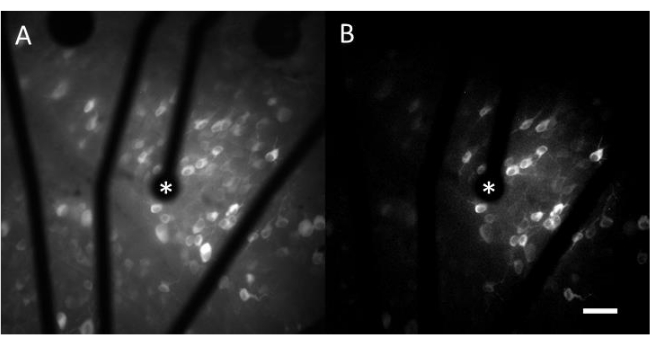
Şekil 4: 25 μm çapında bir elektrot tarafından sağlanan elektriksel stimülasyon ile GCL'nin kalsiyum görüntülemesi. (A) 60 sn hızlandırılmış filmin maksimum projeksiyonu ve (B) 25 μm çapında gözenekli grafen bazlı bir elektrottan elektrik uyaranlarına yanıt veren hücreleri net bir şekilde gösteren standart sapma projeksiyonu. Uyarıcı elektrot bir yıldızla gösterilir. Ölçek çubuğu: 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Kontrollü stimülasyon üzerine zaman içinde kalsiyum dinamiğinin analizi
Tanımlanan her hücre soma için, ortalama yoğunluk değerleri zaman içinde çıkarıldı. Şekil 5A , yanıt veren hücrelerden fotoağartma ile düzeltilmiş kalsiyum izlerini göstermektedir. Bu örnekte, 60 sn'lik bir görüntü alımı sırasında her 10 saniyede bir (siyah çizgilerle gösterilir) beş bifazik darbe dizisi patlaması (katodik ilk, 40 döngü, 1 ms süre, 2 μA genlik) iletildi. Belirli bir deneyde, yanıtın tutarlılığını test etmek için aynı beş darbe dizisi uygulanır. Uyarıcı olmayan dönemlerde yakalanan kareler (kırmızıyla vurgulanmıştır), foto ağartma etkisini düzelterek doğrusal bir uyum sağlamak için kullanılır.
Yanıt veren hücreler tanımlandıktan ve uyarıcı elektrota göre koordinatları (x,y) bilindikten sonra, hücreleri aktive etmek için gereken akım ile uyarıcı elektrottan uzaklık arasındaki ilişki incelenebilir (Şekil 5B). Beklendiği gibi, uyarıcı elektroda daha yakın bulunan hücreler, bir yanıt uyandırmak için daha düşük akım değerlerine ihtiyaç duyar.
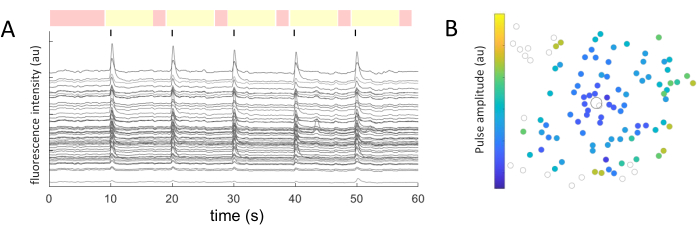
Şekil 5: Elektriksel uyarılmış tepkilerin temsili. (A) 60 sn'lik bir görüntü alımı sırasında her 10 saniyede bir (siyah çizgiler) 5 darbe dizisi patlaması (bifazik, katodik ilk, 40 döngü, 1 ms süre, 2 μA genlik) üzerinde hücre somalarının kalsiyum izleri. Uyarıcı olmayan (kırmızı vurgulu kareler) ve uyarıcı dönemler (sarı vurgulu kareler) gösterilir. Başlangıç sinyalini (uyarıcı olmayan dönemlerin ortalama karekökü) 2,5 kat aşan izler, uyarılmış yanıtlar olarak kabul edilir. Beş uyarıcı periyodun üçünde yanıt veren hücreler, yanıt veren hücreler olarak sınıflandırılır. (B) Uyarıcı elektrotu (siyah çerçeveli daire) ve hücreleri (gri çerçeveli daire) gösteren kalsiyum aktivite dağılım haritası. Renk kodu, hücresel bir yanıtı uyandırmak için gereken minimum darbe genliğini temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Video 1: 25 μm çapında bir elektrot tarafından sağlanan elektriksel stimülasyon ile GCL'nin kalsiyum görüntülemesi. Video, 25 μm çapında gözenekli grafen bazlı bir elektrottan elektrik stimülasyonuna bağlı floresan yoğunluğundaki farklılıkları gösterir. Sol taraf orijinal filmi gösterir ve sağ taraf, yanıt veren hücrelerin kolayca tanımlanabileceği standart sapma projeksiyonunu gösterir. Ölçek çubuğu: 50 μm. Bu videoyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Burada tarif edilen protokol, bir MEA ile sağlanan elektriksel stimülasyon üzerine sıçan retinal GCL'de meydana gelen kalsiyum dinamiklerini incelemeye hizmet eder. Güvenilir ve yönetilebilir bir yöntemdir, ancak özellikle GCL'yi verimli bir şekilde düzgün bir şekilde etiketlemek ve optimal doku-elektrot temasını sağlamak için retinayı düzgün bir şekilde monte etmek için biraz eğitim gerektirir. Bu protokol kemirgenlere özgüdür ve farklı bir laboratuvar türüne uygulandığında uyarlanması gerekir. Metodolojinin kritik noktaları, değişiklikleri ve sınırlamaları ayrıntılı olarak sunulmaktadır.
İntravitreal enjeksiyonlar
Enjeksiyonlar, oküler gen iletimi için yaygın olarak kullanılmaktadır ve intravitreal enjeksiyonlar tercih edilen prosedürdür. İlgilenilen molekülleri doğrudan fotoreseptörler ve retina pigment epiteli (RPE) arasına sokan ve retina dekolmanı riski taşıyan subretinal enjeksiyonlara kıyasla daha güvenli ve daha az invaziv oldukları kanıtlanmıştır10. Bununla birlikte, özellikle kemirgen modellerinde bu enjeksiyonlar yapılırken sınırlamalar vardır. Camsı mizah jelatinimsidir ve viral difüzyonu engeller. Dahası, kemirgen gözlerindeki lens büyüktür, bu da iğneyi çizmeden sokmayı önemsiz hale getirir. Hassas şırınga iğneleri hassastır ve sık sık değiştirilmesi gerekir. Tıkanmayı önlemek için her kullanımdan önce ve sonra deiyonize su ile yıkayın ve düzenli olarak değiştirin. Ek olarak, çözelti reflüsünü ve göz içi basıncındaki değişiklikleri önlemek için içeriği yavaşça enjekte edin. Retina boyunca büyük ve homojen floresan elde etmek pratik gerektirebilir.
Retina hücre transdüksiyonu
Viral vektörler, in vivo gen iletimi için mükemmel bir yöntemdir ve AAV'ler, retina hücrelerini dönüştürmek için yaygın olarak kullanılmaktadır10. İnsan körlüğüne neden olan bazı retinopatilerin tedavisi olarak onaylanmıştır24. Bununla birlikte, taşıyıcı kapasiteleri, gerekli düzenleyici unsurlar (örneğin, destekleyici) dahil olmak üzere 5 kb ile sınırlıdır10,25. Her biri farklı tropizme sahip birden fazla serotip mevcuttur. Verilecek genlere ve dönüştürülecek hücrelere göre en uygun AAV'yi seçin26. RGC'leri etiketlemek için AAV227 kullanılması önerilir.
Gen ekspresyonu penceresi
AAV2-CAG-GCaMP5G için optimal viral ekspresyon, enjeksiyondan 2 ila 3 hafta sonradır12,18. Bu zaman diliminin ötesinde, transfekte edilmiş hücrelerden gelen çekirdekler floresan hale gelir, hücreler uyaranlara yanıt vermeyi bırakır ve sonuçtaölür 7,28,29. Bunun nedeni, çekirdeğe translokasyon olan GCaMP göstergesinin aşırı ekspresyonudur. Optimal gen ekspresyonu için zaman penceresi, viral vektöre ve seçilen promotör30'a bağlı olarak değişecektir ve bu protokole devam etmeden önce deneysel olarak belirlenmesi gerekir.
Doku-elektrot teması
Optimal ve tekrarlanabilir sonuçlar için, iyi bir doku-elektrot teması elde etmek çok önemlidir. Zayıf temas tipik olarak retinanın doğal eğriliğinden kaynaklanır. Bir yaklaşım, retinayı dörde bölmek, her seferinde bir bölüm monte etmek ve görüntülemektir. Retinanın küçük kısımları daha iyi düzleştirilebilir, bu da MEA'nın yüzeyi ile daha etkili temas sağlar. Zayıf temasın bir başka potansiyel nedeni de vitreus mizahının varlığıdır. Bir epi-retinal implantı simüle eden stimülasyon deneyleri yaparken, retina eksizyonu sırasında vitreus mizahının dikkatlice çıkarılması önemlidir, çünkü akıma karşı bir yalıtkan görevi görebilir. Burada, elektrot ve hücreleri aynı odak düzleminde görselleştirerek temasın yeterli olup olmadığını kontrol etmek için basit bir yöntem anlatılmaktadır.
Ex vivo retinal ölçümlere bir alternatif, nöronları doğrudan elektrotların yüzeyinde büyütmektir. Hipokampal nöronlar31 gibi nöronların birincil kültürü, yeni uyarıcı cihazın işlevselliğini değerlendirmek için ilk testler için yararlı olabilir. Bununla birlikte, bu yaklaşım hala laboratuvar hayvanlarının kullanılmasını gerektirir ve stimülasyona sinaptik yanıtları değerlendirmek için önemli olan retina ağının karmaşıklığını temsil etmez.
Elektrotun altındaki hücreleri ve elektrot izlerini görselleştirmek için, indiyum kalay oksit (ITO) gibi şeffaf malzemelerle üretilen MEA'lar kullanılabilir 19,20,32. Optik ölçümlere ek olarak, elektriksel stimülasyon üzerine GCL aktivitesi elektriksel kayıtlar yoluyla değerlendirilebilir. MEA, dokunun lokal alan potansiyelini (LFP) kaydetmek için kullanılabilir. Bununla birlikte, her elektrot aynı anda birden fazla hücreden aktivite yakaladığından (elektrot boyutlarına bağlı olarak) bu, uzamsal çözünürlüğü tehlikeye atar. Optik kayıt bu sınırlamanın üstesinden gelir ve daha yüksek uzamsal çözünürlüklü haritalama sunar. Başlıca avantajı, tek hücreli çözünürlüğe sahip büyük bir FOV'u ölçerken aktif ve aktif olmayan hücreleri ayırt etme yeteneğidir. Tüm hücresel aktivite raportörleri arasında, kalsiyum göstergeleri iyi tanımlanmıştır ve en yaygın olarak kullanılmaktadır33.
Açıklamalar
Yazarların makaleye ekleyecekleri herhangi bir açıklama yoktur.
Teşekkürler
Teknik destekleri için Merche Rivas, Angel Sandoval, Jesús Planagumà, Jordi Cortés, Sandra Ortonobés Lara ve Alina Hirschmann'a (ICFO-Institut de Ciències Fotòniques), intravitreal enjeksiyonlar ve in vivo retinal görüntüleme konusundaki destekleri için Oftalmoloji Araştırma grubundan Anna Duarri'ye (VHIR, Vall d'Hebron Araştırma Enstitüsü) teşekkür ederiz.
Bu çalışmayı destekleyen finansman kuruluşları şunlardır: Fundació CELLEX; Fundació Mir-Puig; Ministerio de Economía y Competitividad - Ar-Ge'de Mükemmeliyet Merkezleri için Severo Ochoa programı (CEX2019-000910-S, [MCIN/AEI/10.13039/501100011033]); CERCA programı aracılığıyla Generalitat de Catalunya; Laserlab-Europe (EU-H2020 GA no. 871124); La Caixa Vakfı (LCF/HR19/52160003); ve Fondo Social Europeo (PRE2020-095721, M.C.).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 20x NA 0.75 S Fluor air objective | Nikon | CFI Super Fluor 20X | - |
| 3.5 cm Cell culture dish | Nunc | 12-565-90 | - |
| 30 G needle | VWR | 613-5373 | - |
| 36 G blunt needle | World Precision Instruments | NF36BL-2 | - |
| 6 cm Cell culture dish | Nunc | 12-565-94 | - |
| AAV2-CAG-GCaMP5G | Vector Biolabs | - | - |
| Ames' Medium | Sigma Aldrich | A1420 | - |
| Blade | Swann-morton | 0308 | - |
| Camera | Hamamatsu | ORCA Flash v4.0 | - |
| Carbogen | Air liquide | - | - |
| Curved-forceps | - | - | - |
| Fine spring-scissors | FST | 91501-09 | - |
| FITC filter cube | Nikon | Standard series | - |
| Fluorescent lamp | Nikon | C-HGFI | - |
| Fluorescent stereomicroscope | Nikon | SMZ25 | - |
| HBSS | Capricorn | HBSS-1A | - |
| ImageJ/FIJI | NIH | v1.50i | - |
| In vivo retinal imaging system | Phoenix Research Laboratories | Micron III | - |
| Inverted fluorescence microscope | Nikon | Eclipse Ti | - |
| Isofluorane | Arrane Baxter Laboratories | - | - |
| Long-Evans rat | Janvier | - | - |
| MATLAB (Version R2021b) | Mathworks | - | - |
| Media filters | Merckmillipore | SCGPS02RE | - |
| Methocel 2% | Omni Vision | - | - |
| Microelectrode array (MEA) | - | Custom-made | |
| NaHCO3 | Thermofisher | 42427 | - |
| Penicillin/Streptomycin 100x | Thermofisher | 15140122 | - |
| Phenylephrine | Alcon Cusí Laboratories | 653437.3 | 100 mg/mL |
| Plastic pipette | VWR | 612-1793 | - |
| Porous membrane | Merckmillipore | #JVWP01300 | - |
| Precision syringe | World Precision Instruments | 10 µl Nanofil | - |
| Prescaina | Llorens | - | Oxybuprocaine chlorhydrate (2 mg/mL), local anesthetic |
| Rat nasal mask | Xenotec | XRK-RA | - |
| Small curved-forceps | Bbraun | AESCBD311R | - |
| Spring-scissors | FST | 15040-11 | - |
| Stereo microscope | Zeiss | Stemi 2000 | - |
| Straight forceps | FST | 11252-20 | - |
| Suture filament | Vitrex Medical | 4328 | Nilon monofilament, 7/0, DS12 |
| Tobradex | Alcon Cusí Laboratories | - | Tobramycin (3 mg/mL) and dexamethasone (1 mg/mL) |
| Tropicamide | Alcon Cusí Laboratories | 653486 | 10 mg/mL |
| Washer | Thorlabs | W8S038 | - |
Referanslar
- Bourne, R. R. A., et al. Prevalence and causes of vision loss in high-income countries and in Eastern and Central Europe in 2015: Magnitude, temporal trends and projections. British Journal of Ophthalmology. 102 (5), 575-585 (2018).
- Li, J. Q., et al. Prevalence and incidence of age-related macular degeneration in Europe: a systematic review and meta-analysis. British Journal of Ophthalmology. 104 (8), 1077-1084 (2020).
- Roska, B., Sahel, J. A. Restoring vision. Nature. 557 (7705), 359-367 (2018).
- Hornig, R., Velikay-Parel, M. Retina implants. Implantable Sensor Systems for Medical Applications. , Elsevier. 469-496 (2013).
- Lewis, P. M., et al. Advances in implantable bionic devices for blindness: a review. ANZ Journal of Surgery. 86 (9), 654-659 (2016).
- Weiland, J. D., Walston, S. T., Humayun, M. S. Electrical stimulation of the retina to produce artificial vision. Annual Review of Vision Science. 2, 273-294 (2016).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6, 875-881 (2009).
- Chen, T. -W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499, 295-300 (2013).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca2+ probe composed of a single green fluorescent protein. Nature Biotechnology. 19, 137-141 (2001).
- Sahu, B., Chug, I., Khanna, H. The ocular gene delivery landscape. Biomolecules. 11 (8), 1135(2021).
- Hanlon, K. S., et al. A novel retinal ganglion cell promoter for utility in AAV vectors. Frontiers in Neuroscience. 11, (2017).
- Weitz, A. C., et al. Imaging the response of the retina to electrical stimulation with genetically encoded calcium indicators. Journal of Neurophysiology. 9 (7), 1979-1988 (2013).
- Briggman, K. L., Euler, T. Bulk electroporation and population calcium imaging in the adult mammalian retina. Journal of Neurophysiology. 105 (5), 2601-2609 (2011).
- Baden, T., Berens, P., Franke, K., Román Rosón, M., Euler, T. The functional diversity of retinal ganglion cells in the mouse. Nature. 529, 345-350 (2016).
- Zhang, Y., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Nature. 615, 884-891 (2023).
- Meyer, E. L., Jenkins, C., Rengarajan, K. NIH Guidelines April 2019. Applied Biosafety. 24, Preprint at https://doi.org/10.1177/1535676019871146 (2019).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Chang, Y. -C., Walston, S. T., Chow, R. H., Weiland, J. D. GCaMP expression in retinal ganglion cells characterized using a low-cost fundus imaging system. Journal of Neural Engineering. 14 (5), 056018(2017).
- Weitz, A. C., et al. Improving the spatial resolution of epiretinal implants by increasing stimulus pulse duration. Science Translational Medicine. 7 (318), 1-12 (2015).
- Chang, Y. C., Ghaffari, D. H., Chow, R. H., Weiland, J. D. Stimulation strategies for selective activation of retinal ganglion cell soma and threshold reduction. Journal of Neural Engineering. 16 (2), 026017(2019).
- Im, M., Fried, S. I. Temporal properties of network-mediated responses to repetitive stimuli are dependent upon retinal ganglion cell type. Journal of Neural Engineering. 13 (2), 025002(2016).
- Jensen, R. J., Ziv, O. R., Rizzo, J. F. Thresholds for activation of rabbit retinal ganglion cells with relatively large, extracellular microelectrodes. Investigative Ophthalmology & Visual Science. 46 (4), 1486-1496 (2005).
- Ramos, M. S., et al. Patient-reported complications after intravitreal injection and their predictive factors. Ophthalmology Retina. 5 (7), 625-632 (2021).
- Vandenberghe, L. H., Auricchio, A. Novel adeno-associated viral vectors for retinal gene therapy. Gene Therapy. 19 (2), 162-168 (2012).
- Zin, E. A., Ozturk, B. E., Dalkara, D., Byrne, L. C. Developing new vectors for retinal gene therapy. Cold Spring Harbor Perspectives in Medicine. , a041291(2023).
- Haggerty, D. L., Grecco, G. G., Reeves, K. C., Atwood, B. Adeno-associated viral vectors in neuroscience research. Molecular Therapy-Methods & Clinical Development. 17, 69-82 (2020).
- Hellström, M., et al. Cellular tropism and transduction properties of seven adeno-associated viral vector serotypes in adult retina after intravitreal injection. Gene Therapy. 16 (4), 521-532 (2009).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nature Protocols. 11, 566-597 (2016).
- Yang, Y., et al. Improved calcium sensor GCaMP-X overcomes the calcium channel perturbations induced by the calmodulin in GCaMP. Nature Communications. 9, 1504(2018).
- Nieuwenhuis, B., et al. Improving adeno-associated viral (AAV) vector-mediated transgene expression in retinal ganglion cells: comparison of five promoters. Gene Therapy. 30, 503-519 (2023).
- Cunquero, M., Aguilar, E., Loza-Alvarez, P., Planagumà, J. Hippocampal neuronal cultures to detect and study new pathogenic antibodies involved in autoimmune encephalitis. Journal of Visualized Experiments. 184, e63829(2022).
- Behrend, M. R., Ahuja, A. K., Humayun, M. S., Chow, R. H., Weiland, J. D. Resolution of the epiretinal prosthesis is not limited by electrode size. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 19 (4), 436-442 (2011).
- Grienberger, C., Konnerth, A. Imaging calcium in neurons. Neuron. 73 (5), 862-885 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır