Method Article
التحليل الكيميائي المناعي المتعدد لمشهد الخلايا المناعية المكانية للبيئة المكروية للورم
* These authors contributed equally
In This Article
Summary
يصف هذا البروتوكول بالتفصيل كيفية إجراء توصيف الخلايا المناعية للبيئة المكروية للورم باستخدام الكيمياء الهيستولوجية المناعية المتعددة.
Abstract
من المحتمل أن يحتوي مشهد الخلايا المناعية للبيئة المكروية للورم على معلومات لاكتشاف المؤشرات الحيوية التنبؤية والتنبؤية. تعد الكيمياء الهيستولوجية المناعية المتعددة أداة قيمة لتصور وتحديد أنواع مختلفة من الخلايا المناعية في أنسجة الورم مع الاحتفاظ بمعلوماتها المكانية. نقدم هنا بروتوكولات مفصلة لتحليل مجموعات الخلايا الليمفاوية والنخاعية والمتغصنة في أقسام الأنسجة. بدءا من قطع المقاطع المضمنة في البارافين المثبتة بالفورمالين ، وإجراءات تلطيخ تعدد الإرسال التلقائي على منصة آلية ، ومسح الشرائح على مجهر تصوير متعدد الأطياف ، إلى تحليل الصور باستخدام خوارزمية التعلم الآلي المطورة داخليا ImmuNet. يمكن تطبيق هذه البروتوكولات على مجموعة متنوعة من عينات الورم ببساطة عن طريق تبديل علامات الورم لتحليل الخلايا المناعية في أجزاء مختلفة من العينة (الورم مقابل الهامش الغازي) وتطبيق تحليل أقرب جار. لا يقتصر هذا التحليل على عينات الورم ولكن يمكن تطبيقه أيضا على الأنسجة الأخرى (غير المسببة للأمراض). أدت التحسينات التي أدخلت على المعدات وسير العمل على مدى السنوات القليلة الماضية إلى تقصير أوقات الإنتاجية بشكل كبير ، مما يسهل التطبيق المستقبلي لهذا الإجراء في بيئة التشخيص.
Introduction
تلعب الخلايا المناعية دورا حاسما في الحماية من مسببات الأمراض مثل الفيروسات والبكتيريا ، ولكن أيضا ضد الخلايا السرطانية1. لذلك ، فإن الجهاز المناعي داخل البيئة المكروية للورم (TME) يحمل الكثير من الوعد لاكتشاف المؤشرات الحيوية النذير والتنبؤية2. ارتبطت ارتشاح الخلايا المناعية بالتشخيص في أنواع مختلفة من السرطان ، على الرغم من أن هذا لم يتم تنفيذه في الرعاية السريرية حتى الآن 3,4. في معظم أنواع الأورام ، ترتبط أعداد كبيرة من الخلايا التائية السامة والخلايا التائية المساعدة 1 و / أو أعداد منخفضة من الخلايا التائية التنظيمية بتوقعات جيدة. الجهود مستمرة لدمج ما يسمى ب "Immunoscore" في مرحلة TNM لسرطان القولون والمستقيم ، وتحويلها إلى TNM-I التي تبلغ 5,6. يتم اشتقاق Immunoscore من العدد الإجمالي للخلايا التائية (المكتشفة باستخدام CD3) والخلايا التائية السامة (المكتشفة باستخدام CD8) في منطقتين مختلفتين من الورم: قلب الورم مقابل الهامش الغازي (IM) للأورام. كما تم اقتراح أن تكون النتيجة المناعية ذات قيمة تنبؤية في أنواع السرطان الأخرى ، مثل سرطان الجلد وسرطان الرئة وسرطان الثدي6،7،8،9. علاوة على ذلك ، قد ترتبط ارتشاح الخلايا المناعية أيضا بالاستجابة للعلاج المناعي لحصار نقاط التفتيش10. ومع ذلك ، يجب التحقق من صحة هذه المؤشرات الحيوية التنبؤية في الدراسات المستقبلية قبل أن يتم تنفيذها بشكل روتيني في الممارسة السريرية. علاوة على ذلك ، فقد اقترح أيضا أن علامة بيولوجية واحدة لن تكون كافية للتنبؤ الهادف11. لذلك ، تم اقتراح إنشاء خريطة كاملة لعينة المريض من خلال الجمع بين المؤشرات الحيوية المختلفة كعلامة حيوية تنبؤية أكثر شمولا في ما يسمى "مخطط المناعة السرطاني"12.
من بين طرق دراسة الخلايا المناعية داخل TME ، فإن أقدم التقنيات وأكثرها شهرة هي الكيمياء الهيستولوجية المناعية (IHC) ، والتي تستخدم بشكل روتيني للاختبار التشخيصي في العديد من الأمراض ، وخاصة السرطان13. اقتصرت هذه التقنية على استخدام علامة واحدة أو عدد قليل فقط من العلامات14 لفترة طويلة ، وبالتالي ، تم تفويضها في إعدادات البحث من خلال تقنيات أخرى مثل قياس التدفق الخلوي وتنميط التعبير الجيني (GEP). ومع ذلك ، فإن أنسجة الورم المثبتة بالفورمالين والمضمنة بالبارافين (FFPE) المستخدمة عادة في التشخيص والأبحاث الروتينية ليست مناسبة (على النحو الأمثل) لقياس التدفق الخلوي و GEP. علاوة على ذلك ، على الرغم من أن GEP وقياس التدفق الخلوي يوفران الكثير من التبصر في النمط الظاهري للخلية ووظيفتها ، فإن نقص المعلومات المكانية يعد عيبا كبيرا. لذلك ، فإن عدم التجانس داخل العينة ، مثل الاختلافات في المناطق المتسللة من الخلايا المناعية مقابل المناطق المستبعدة من الخلايا المناعية للورم ، يمكن أن لا يتم اكتشافه15. تم تطوير منصات جديدة لتحليل تعدد الإرسال لأنسجة FFPE ، مثل تعدد الإرسال IHC ، وقياس الخلايا الكتلية التصويرية ، والكشف عن ثاني أكسيد الكربون بواسطة indEXing (CODEX) التي يمكن استخدامها للكشف عن علامات متعددة في وقت واحد داخل قسم الأنسجة16. تتم دراسة الخلايا المناعية في TME على نطاق واسع للعثور على أفضل المؤشرات الحيوية للعلاج المناعي. ومع ذلك ، فإن تقنيات تعدد الإرسال وتحليل الصور الآلي تشكل عقبات خاصة بها.
يتمتع مختبرنا بخبرة واسعة في تلطيخ IHC متعدد الإرسال باستخدام طريقة تضخيم إشارة أوبال / تيراميد (TSA) وقد قام بأتمتة ذلك على منصة IHC (انظر جدول المواد) 17،18،19،20،21،22،23،24،25،26،27،28 ، 29,30,31. لقد قمنا بتحسين لوحات الخلايا المناعية للكشف عن مجموعات فرعية مختلفة من الخلايا الليمفاوية والخلايا النخاعية والخلايا المتغصنة (DCs). الأنسجة التي تحتوي على مناطق خلايا مناعية كثيفة - للخلايا الليمفاوية أو مورفولوجيا الخلايا المعقدة (أي الخلايا النخاعية و DCs) - يصعب تحليلها بشكل خاص ، مع خطر الإفراط في تقدير عدد الخلايا المناعية الموجودة أو التقليل من شأنه. للتغلب على هذه المشكلة ، تم تطوير برنامج تحليل ImmuNet بواسطة مجموعتنا32 ، وأدى خط أنابيب التعلم الآلي هذا إلى تحسين جودة اكتشاف هذه الأنواع المختلفة من الخلايا المناعية بشكل كبير. يتم وصف بروتوكول مفصل من الحصول على مادة FFPE إلى تحليل كثافة الخلايا المناعية في مقصورات الأنسجة المختلفة والمسافات بين أنواع الخلايا المناعية هنا.
يوضح هذا البروتوكول كيفية تنفيذ لوحات IHC متعددة الإرسال في المركز الطبي بجامعة رادبود منذ تنفيذ جهاز تصوير علم الأمراض الرقمي في عام 2022. يمكن استخدام لوحات IHC المتعددة الموصوفة لسرطانات مختلفة (على سبيل المثال ، الرئة والبروستاتا والقولون والمستقيم والمثانة والثدي) باستخدام جسم مضاد لعموم السيتوكيراتين كعلامة للورم أو لسرطان الجلد باستخدام الأجسام المضادة المرتبطة بالخلايا الصباغية كعلامات للورم. تم تحسين بروتوكولات IHC متعددة الإرسال هذه بعناية من حيث تركيز الأجسام المضادة الأولية ، ومجموعات الفلوروفور ، وتسلسل إجراء التلطيخ. لقد وصفنا نحن وآخرون تحسين لوحة IHC المتعددة في وقت سابق17،33،34،35. يمكن تكييف لوحات IHC متعددة الإرسال ، ولكن يجب تقييم خطوط أنابيب التحليل الموصوفة وربما تعديلها أو إعادة تدريبها وفقا لذلك. تستخدم بروتوكولات IHC متعددة الألوان ذات الألوان السبعة الموصوفة فلوروفورات أوبال أوبال 480 وأوبال 520 وأوبال 570 وأوبال620 وأوبال690 وأوبال 780 و4 'و 6-دياميدينو -2-فينيليندول (DAPI) ، بحيث يتم تمكين فك الخلط السهل والمسح السريع على جهاز التصوير باستخدام "متعدد الأطياف بلمسة واحدة المناعية" (MOTiF). لم يتم وصف تلطيخ ومسح تسعة ألوان في هذا البروتوكول لأن هذا يتطلب مزيدا من الضبط الدقيق للإعداد التجريبي ووضع آخر للمسح الضوئي على جهاز التصوير الذي يستخدم مرشح قابل للضبط بالكريستال السائل.
Protocol
كانت مواد المريض المعروضة لهذا البروتوكول جزءا من دراسة أجريت سابقا واعتبرت رسميا معفاة من الموافقة الأخلاقية الطبية من قبل لجنة الأخلاقيات الطبية المحلية في رادبودومك بالتزامن مع التشريع الهولندي (رقم الملف 2017-3164)30.
1. جمع مواد FFPE ، واختيار الكتل ، وإعداد العينات
- استرداد معرفات كتلة FFPE من ملفات المرضى من خلال الأطباء المعالجين أو أخصائيي علم الأمراض. تحقق مع اللوائح المحلية مما إذا كان الإذن الأخلاقي مطلوبا.
- اطلب كتل FFPE من أرشيف علم الأمراض المحلي أو المستشفى (المستشفيات) الخارجية.
ملاحظة: من الممكن أيضا الحصول على مادة الورم أو الخزعة لدراسة معينة. يمكن أن يكون هذا هو الحال بالنسبة للتجارب السريرية الصغيرة أو الدراسات على. في هذه الحالات ، قد تكون معالجة عينة الأنسجة من مسؤولية الباحث. - عند توفر كتل FFPE متعددة ، حدد كتلة FFPE الأكثر تمثيلا التي تحتوي على أنسجة ورمية قابلة للحياة ، بشكل تفضيلي مع الأنسجة اللحمية المحيطة الموجودة من خلال تقييم الشرائح الملطخة بالهيماتوكسيلين ويوزين (HE) (الشكل 1).
ملاحظة: ينصح بالحصول على رأي خبير لهذا الاختيار (على سبيل المثال ، أخصائي علم الأمراض). من الممكن أن تكون HEs غير متاحة لتقييم محتوى كتلة FFPE ويجب عمل مجموعات جديدة للاختيار. انتقل إلى القسم 2 للحصول على وصف. - قطع شرائط FFPE بسمك 4 ميكرومتر على ميكروتوم.
ملاحظة: يمكن أن يتراوح سمكها بين 1 ميكرومتر و 6 ميكرومتر دون تأثير تلطيخ ملحوظ ؛ ومع ذلك ، 4 ميكرومتر هو الأكثر معيار. - قم بتركيب العينات على شرائح زجاجية في موضع مناسب لسوائع autostainer (الشكل 2A-C) باستخدام إحدى الطرق الموضحة أدناه:
- ضع الأجزاء على سطح الماء المقطر 40 درجة مئوية في حمام مائي لتمديدها والتقاطها بشريحة زجاجية.
أو
ضع شرائح زجاجية على لوح تسخين 40 درجة مئوية ، مع التأكد من تغطية المكان الذي سيتم تركيب القسم فيه على الشريحة بقطرة من الماء المقطر. ضع القسم أعلى هذا القطرة بالملقط واتركه يمتد. امتص الماء المقطر باستخدام منشفة ورقية وقم بإزالة الماء الزائد عن طريق النقر على الشريحة.
ملاحظة: سيؤدي وضع أقسام الأنسجة بالقرب من ملصق الشريحة إلى تلطيخ دون المستوى الأمثل (الشكل 2D ، E). نميل إلى تركيب 6-10 شرائح زجاجية لكل عينة لأداء لوحات IHC متعددة الإرسال المختلفة والحصول على نسخة احتياطية.
- ضع الأجزاء على سطح الماء المقطر 40 درجة مئوية في حمام مائي لتمديدها والتقاطها بشريحة زجاجية.
- اترك الزجاج المركب يجف عند 56 درجة مئوية لمدة 1 ساعة أو طوال الليل عند 37 درجة مئوية.
- استخدم الشرائح الزجاجية المثبتة للتجربة أو قم بتخزينها في صناديق عند 4 درجات مئوية.
ملاحظة: في تجربتنا حتى الآن ، يمكن تخزين هذه الشرائح المثبتة لسنوات قبل إجراء تلطيخ IHC متعدد الإرسال.
2. توليد الهيماتوكسيلين والشرائح الملطخة بالإيوزين
ملاحظة: يجب تنفيذ جميع الخطوات التالية من القسم 2 في غطاء الدخان.
- شرائح Deparaffinize في الزيلين (2 × 5 دقائق).
- إعادة الترطيب في الإيثانول (99.6٪ 1 × 5 دقائق ؛ 95٪ 1 × 5 دقائق ؛ 70٪ 1 × 2 دقيقة). بدلا من ذلك ، اغمس الشرائح 3x في 99.6٪ إيثانول.
- اغسل الشرائح بالماء المقطر (2 دقيقة).
- وصمة عار النواة مع الهيماتوكسيلين (10 دقائق).
- اغسل الشرائح باستخدام H2O المقطر (5 دقائق).
- تلطيخ الشرائح مع eosin (5 دقائق).
- قم بتجفيف الشرائح عن طريق غمس 3x في 99.6٪ إيثانول.
- اغمس الشرائح 2x في الزيلين.
- أضف بضع قطرات من وسيط التثبيت وأغلقه بغطاء غطاء.
- دع الشرائح تتصلب وأخرج الشرائح من غطاء الدخان عندما تتبخر جميع المواد الكيميائية.
3. أداء monoplex و multiplex IHC في autostainer
- احسب مقدار الكاشف المطلوب اعتمادا على عدد العينات المراد تلطيخها.
ملاحظة: في كل تشغيل ، تبلغ سعة autostainer 30 شريحة ويستغرق ~ 18 ساعة لإكمال بروتوكول IHC المتعدد بستة أجسام مضادة. عندما تحتاج إلى تلطيخ المزيد من الشرائح ، يمكن وضع دفعات متعددة في كل ليلة من أسبوع (العمل) ؛ 4 ليال من 30 شريحة = 120 شريحة في الأسبوع.- إعداد جميع الكواشف اللازمة في بداية الأسبوع. يوزع نظام autostainer 150 ميكرولتر من الكاشف لكل شريحة. استخدم حاويات المعايرة بالتحليل الحجمي سعة 6 مل للأجسام المضادة وكواشف الأوبال وحاويات سعة 30 مل للكاشف المانع وبيروكسيديز الفجل والأجسام المضادة الثانوية.
ملاحظة: تحتوي الحاويات سعة 6 مل على إدخالات مريحة يمكن إخراجها واستبدالها بسهولة عند الضرورة. مع حسابات الكاشف ، يتعين على المرء أن يأخذ في الاعتبار الحجم الميت البالغ 1.6 مل أو 300 ميكرولتر للحاوية سعة 30 مل أو حاوية المعايرة بالتحليل الحجمي سعة 6 مل ، على التوالي. - تمييع جميع فلوروفورات أوبال وديجوكسيجينين (DIG) 1: 100 في المادة المخففة المقدمة ؛ تمييع Opal780 1:25 في مخفف الأجسام المضادة. تمييع جميع الأجسام المضادة الأولية في مخفف الأجسام المضادة ، مع التخفيفات المحددة في الملف التكميلي 1.
- إعداد جميع الكواشف اللازمة في بداية الأسبوع. يوزع نظام autostainer 150 ميكرولتر من الكاشف لكل شريحة. استخدم حاويات المعايرة بالتحليل الحجمي سعة 6 مل للأجسام المضادة وكواشف الأوبال وحاويات سعة 30 مل للكاشف المانع وبيروكسيديز الفجل والأجسام المضادة الثانوية.
- لاتباع هذا البروتوكول ، قم بتشغيل monoplex IHC (الملف التكميلي 2) على شرائح تحتوي على كل من أنسجة التحكم في اللوزتين وأنواع الأنسجة الأخرى (الورم) ذات الأهمية قبل البدء في تجربة IHC متعددة الإرسال الفعلية للتأكد من إعداد جميع الكواشف جيدا.
ملاحظة: يستغرق Monoplex IHC ~ 3.5 ساعة ويمكن التحقق منه قبل نهاية ذلك اليوم لمعرفة أنماط الإشارة وشدتها. إذا كانت بعض الإشارات ضعيفة جدا (الشكل 3) ، فيمكن إجراء تعديلات على الكواشف. - لتصحيح التألق الذاتي ، قم بإعداد شريحة تحتوي على نسيج (ورم) يحتوي على هياكل ذاتية الفلورسنت ، مثل الدم والكولاجين. قم بإعداد هذه الشريحة في وقت واحد مع شرائح monoplex IHC ، ولكن مع كاشف مانع يحل محل الجسم المضاد وكواشف أوبال (الملف التكميلي 3).
ملاحظة: من حيث المبدأ ، يمكن إعادة استخدام هذه الشريحة للتصوير متعدد الأطياف حتى لا يصبح تصحيح التألق الذاتي هو الأمثل بعد الآن. ومع ذلك ، مع الأنسجة ذاتية الفلورسنت للغاية ، مثل الدماغ والكبد ، فمن المستحسن استخدام هذا النسيج لتصحيح التألق الذاتي. - مع كل تشغيل IHC متعدد الإرسال ، قم بتحميل 29 عينة في نظام autostainer مع شريحة أنسجة تحكم واحدة للتحقق من أداء كل تشغيل IHC متعدد الإرسال.
- قم بتنزيل بروتوكولات IHC متعددة الإرسال من موقع الويب الخاص ب autostainer ضمن علامة التبويب التنزيلات واضبطها لتناسب كل لوحة IHC متعددة الإرسالمخصصة 36. للحصول على IHC متعدد الإرسال ، راجع الملف التكميلي 4 للبروتوكول ولوحات IHC متعددة الإرسال المخصصة ، راجع الملف التكميلي 1.
- بعد الانتهاء من بروتوكول التلوين ، أخرج الشرائح من autostainer وضعها في حاوية مع عازلة للغسيل.
- لمنع تلوث نظام autostainer باستخدام DAPI حيث أن العينات ملطخة بالفعل بتركيزات منخفضة جدا ، قم بتطبيق DAPI يدويا قبل تغطية الشرائح بأغطية الغطاء. أضف قطرتين من DAPI لكل مل من محلول الغسيل واحتضانها لمدة 5 دقائق في درجة حرارة الغرفة في الظلام.
ملاحظة: لبناء المكتبات الطيفية ، من المهم عدم وجود أي DAPI ملطخة في العينات. قطرة واحدة من DAPI لكل مل من المخزن المؤقت للغسيل و 10 دقائق من الحضانة في RT ممكنة أيضا. - اغسل الشرائح 3x باستخدام المخزن المؤقت للغسيل.
- ضع الشرائح على مناشف ورقية واضغط على المخزن المؤقت الزائد للغسيل من الشرائح.
- ماصة بضع قطرات من تصاعد المتوسطة على الأنسجة.
- ضع غطاء زجاجي برفق أعلى وسيط التثبيت لتغطية الشريحة بزاوية لتجنب فقاعات الهواء.
- قم بإزالة وسط التثبيت الزائد وفقاعات الهواء عن طريق الضغط برفق على الغطاء الزجاجي باستخدام ملقط أو طرف ماصة نظيف.
- اترك الشرائح دون إزعاج لمدة ~ 24 ساعة قبل أن يصلب وسط التثبيت ، إما أفقيا على لوحة منزلقة مجهرية أو قم بتحميلها مباشرة في المجهر للتصوير.
- بعد ترسيخ وسيط التثبيت أو بعد تصوير الشرائح ، قم بتخزين الشرائح في صناديق الفحص المجهري عند 4 درجات مئوية.
4. التصوير باستخدام جهاز تصوير علم الأمراض الرقمي والتعليق التوضيحي لملفات المسح الضوئي
- قم بتشغيل جهاز التصوير عن طريق الضغط على زر الطاقة الموجود على يمين الجهاز. بعد 20 ثانية على الأقل ، ابدأ تشغيل البرنامج.
ملاحظة: انتظر لمدة 20 ثانية للسماح للجهاز ببدء التشغيل بشكل صحيح. - قم بتحميل الشرائح في أشرطة الكاسيت لكل أربع شرائح.
- اختياري: أدخل الشرائح في ملف .csv يمكن تنزيل قالب له (الملف التكميلي 5). لتحميل ملف .csv في البرنامج ، احفظه في C: \ Users \ Public \ Akoya \ VectraPolaris \ States.
ملاحظة: يمكن تحميل 20 علبة أو 80 شريحة كحد أقصى في وقت واحد.
- اختياري: أدخل الشرائح في ملف .csv يمكن تنزيل قالب له (الملف التكميلي 5). لتحميل ملف .csv في البرنامج ، احفظه في C: \ Users \ Public \ Akoya \ VectraPolaris \ States.
- الإعدادات المرجعية
- افتح Check Dashboard من القائمة الرئيسية.
ملاحظة: يتم توفير علبة مع شرائح مرجعية من قبل الشركة المصنعة ويمكن الاحتفاظ بها اختياريا بشكل دائم في الفتحة 20. - قم بتعيين مراجع brightfield على الشريحة المتوفرة مرة واحدة في الأسبوع وفقا لإرشادات الشركة المصنعة (يستغرق بضع دقائق).
- اضبط مراجع التألق على الشريحة المتوفرة مرة واحدة شهريا وفقا لتعليمات الشركة المصنعة (يستغرق أكثر من 1 ساعة).
- افتح Check Dashboard من القائمة الرئيسية.
- صنع أو تعديل البروتوكول
- ارجع إلى القائمة الرئيسية وانقر فوق تحرير البروتوكول لإنشاء بروتوكول.
- انقر فوق جديد... وحدد مضان كوضع تصوير، ومسح شرائح متعدد الأطياف، ولون أوبال بولاريس 5 و6 و7 تحت خيار تلطيخ.
- قم بتسمية البروتوكول ضمن اسم البروتوكول واحفظه ضمن دراسة عن طريق تحديد دراسة من الدراسات المتاحة أو إنشاء دراسة ضمن إنشاء دراسة جديدة | اسم الدراسة.
- قم بإنهاء بتحديد إنشاء بروتوكول.
- لهذا النوع من المسح ، استخدم فقط إعدادات مسح الشرائح متعددة الأطياف للنافذة اليسرى ؛ تجاهل النافذة الموجودة على اليمين إعدادات الحقل متعدد الأطياف.
- امسح الشرائح ضوئيا بتكبيرات مختلفة. لاتباع هذا البروتوكول ، قم بالمسح الضوئي بتكبير 20x عن طريق ترك دقة البكسل عند 0.50 ميكرومتر (20x).
- اضبط أوقات التعرض عن طريق تحديد مسح التعرضات.
- قم بتحميل الدرج الذي يتم فيه الاحتفاظ بالشرائح عن طريق تحديد الفتحة الصحيحة ضمن خيار تحميل الناقل .
- للمساعدة في التنقل عبر الشرائح، حدد أخذ نظرة عامة للحصول على صورة نظرة عامة لشركة الاتصالات التي تحتوي على الشرائح بعد تحميل شركة الاتصالات. لتشغيل هذا أو إيقاف تشغيله تلقائيا ، انقر فوق رمز الترس في أعلى اليمين ، وانتقل إلى التفضيلات ... ، وحدد الخيار تشغيل أو إيقاف تشغيل ضمن صورة نظرة عامة على التنقل لتمكين مشغل الصور تلقائيا عند التحميل للمهام التفاعلية.
- اضبط أوقات التعرض لكل مرشح على الشرائح الملطخة ب MONOPLEX IHC المقابلة عن طريق تحديد تعيين التعرض للمسح الضوئي والعثور على نقاط مختلفة بإشارة موجبة. قم بالتركيز البؤري يدويا أو استخدم التركيز التلقائي وحدد Autoexposure بعد التبديل إلى المرشح المتوافق لتلك الإشارة. حدد أقل وقت تعرض لمنع التعرض المفرط والتقط لقطات لكل شريحة كمرجع بعد تعيين جميع أوقات التعرض (الشكل 3).
ملاحظة: تجاهل الخيار تعيين التعرض للحقول لهذا النوع من المسح الضوئي. - اضبط أوقات التعرض على شريحة ملطخة متعددة الإرسال عن طريق التحقق من جميع المرشحات في عدد قليل من المواقع بإشارة إيجابية. قلل أقل وقت للتعرض التلقائي بنسبة 10٪ لمنع التعرض المفرط والتقط بضع لقطات بعد ضبط جميع أوقات التعرض.
- التقط لقطات للشريحة غير الملوثة لتعويض التألق الذاتي باستخدام مرشح نموذج التركيز البؤري التلقائي للتنقل (الشكل 3H).
ملاحظة: المواقع مع كريات الدم الحمراء وهياكل الكولاجين هي ذات أهمية. قد يلزم تقليل وقت التعرض لمرشح Opal480 لمناطق التألق الذاتي القوية. إذا كانت إشارة Opal480 قوية بما فيه الكفاية ، فلا يزال يتعين فصلها جيدا (انظر القسم 6) عن هياكل الفلورسنت الذاتي بسبب تنفيذ مرشح Sample AF الخاص. - تقييم جودة التلوين والتصوير باستخدام البرنامج (انظر القسمين 5 و 6 ؛ الشكل 4 ، الملف التكميلي 6: الشكل التكميلي S1 ، والشكل التكميلي S2).
- حدد الزر حفظ... للتأكد من حفظ البروتوكول وأوقات التعرض المعدلة في البروتوكول.
ملاحظة: عندما يتم حفظ البروتوكول بالفعل ، لا يقدم البرنامج أي إشعار إضافي بالتعديلات غير المحفوظة حتى الآن.
- المسح التلقائي للشرائح
- ارجع إلى القائمة الرئيسية وانقر فوق مسح الشرائح ضوئيا لمسح الشرائح.
- أدخل أسماء الشرائح/المعرفات والمهام والبروتوكول المطابقين يدويا ضمن تكوين المهام أو تلقائيا من ملف .csv الذي تم إنشاؤه مسبقا باستخدام تحميل الإعداد.
- انقر فوق Scan (فحص) لبدء المسح.
- انتظر حتى تظهر نافذة لحفظ إعداد الفحص. انقر فوق حفظ لاستخدام الإعدادات الافتراضية وبدء المسح.
ملاحظة: يستغرق المسح الضوئي باستخدام هذه الطريقة ~ 10-20 دقيقة لكل شريحة. اعتمادا على عدد الشرائح، يمكن أن يستغرق المسح الضوئي ما يصل إلى يوم كامل. - تحقق مما إذا كان فحص الشرائح ناجحا لجميع الشرائح من خلال البحث عن أي رسائل خطأ. لمعرفة ما إذا كان المسح ناجحا ، ابحث عن ملف فحص شريحة Akoya بالكامل (.qptiff) المحفوظ للفحص والأنسجة الكاملة في الفحص.
5. شرح البيانات باستخدام عارض الشرائح
- ارجع إلى القائمة الرئيسية وانقر فوق تشغيل Phenochart لفتح عارض الشرائح.
- إذا لم تكن ملفات الفحص مرئية بشكل مباشر ، فقم بتعيين موقعها بالنقر أولا على رمز الترس في الزاوية اليمنى العليا ، وانتقل إلى تغيير موقع المتصفح ... وحدد عشوائيا أحد ملفات .qptiff لمجموعة البيانات ذات الاهتمام.
ملاحظة: يتم تخزين البيانات بشكل افتراضي في D:\Data\VectraPolaris. - قم بتحميل شريحة عن طريق تحديدها والنقر فوق تحميل في الزاوية اليمنى العليا أو بالنقر المزدوج عليها.
- قم بتسجيل الدخول بالنقر فوق زر تسجيل الدخول في الزاوية اليمنى العليا.
ملاحظة: يمكن أن يكون اسم المستخدم هو الأحرف الأولى أو الاسم فقط ويستخدم لتتبع من قام بعمل التعليقات التوضيحية. - لإجراء إلغاء الخلط ، انقر فوق الزر Unmixing في الأعلى وحدد خيار Opal + AF .
ملاحظة: هذا مفيد للتخلص من بعض إشارات الفلورسنت الذاتي بالقرب من قناة Opal 480 ، ولكن ليس كلها. - لإنشاء خوارزمية لمعالجة البيانات على دفعات، حدد صورا تمثيلية باستخدام الختم باستخدام خيار ل inForm Projects 1 × 1 صور (حجم الصورة: 928 ميكرومتر × 696 ميكرومتر).
ملاحظة: يتم اختيار عدد قليل من الطوابع التمثيلية التي تحتوي على الورم والسدى والخلفية وأنواع مختلفة من الخلايا المناعية في جميع أنحاء مجموعة البيانات لتنتهي ب ~ 20-30 صورة. - اعتمادا على ما يجب تحليله في الأنسجة ، حدد منطقة الاهتمام باستخدام خيار عائد الاستثمار وحدد inForm Batch. احذف يدويا الصور التي لا تحتاج إلى تحليل ، مثل الصور البعيدة جدا عن الورم أو في الخلفية.
ملاحظة: نميل إلى رسم عائد استثمار حول الورم بأكمله واختيار صورة إضافية واحدة بعيدا عن منطقة الورم لتتمكن من تحليل IM ~ 0.5 مم.
إذا كان عائد الاستثمار المرسوم صغيرا نسبيا ، فسيتألف عائد الاستثمار من 2-9 صور مدمجة 20x. نظرا لأن هذا غير مفضل من قبلنا ، فقم بختم الأنسجة محل الاهتمام يدويا (المحدد ل inForm Batch) للتحايل على ذلك. - عند الانتهاء من التعليق التوضيحي ، دع التعليقات التوضيحية يتم حفظها تلقائيا وقم بتحميل الشريحة التالية.
- أثناء عملية التعليق التوضيحي، تحقق مما إذا كانت الشرائح قد تم مسحها ضوئيا بشكل صحيح.
- إذا كان ملف .qptiff مفقودا أو لم يتم فحص شريحة بنجاح، فتحقق مما إذا كان هناك أي نسيج موجود على الشريحة، وقم بتنظيف الشريحة باستخدام 70٪ من الإيثانول، ثم قم بالمسح الضوئي مرة أخرى.
- إذا لم يتم فحص الأنسجة بالكامل ، وبالتالي فقدت منطقة (ورم) يحتمل أن تكون مهمة ، أو إذا كان مسح المنطقة المهمة خارج التركيز ، فقم بتنظيف الشريحة باستخدام 70٪ من الإيثانول والمسح الضوئي مرة أخرى.
ملاحظة: في كلتا الحالتين ، يمكن أن يساعد أيضا في تطويق الأنسجة بعلامة أعلى قسيمة الغطاء لمساعدة النظام على تحديد موقع الأنسجة ومحاولة المسح مرة أخرى (الملف التكميلي 6: الشكل التكميلي S3). في أيدينا ، عملت علامة حمراء رقيقة بشكل أفضل من علامة سوداء سميكة.
- بمجرد اكتمال المسح الضوئي والتعليق التوضيحي لجميع العينات ، قم بعمل نسخة احتياطية من البيانات عن طريق تخزينها على جهاز كمبيوتر مختلف أو قرص خارجي.
6. فك الخلط الطيفي
- افتح برنامج تحليل الصور الآلي inForm.
- قم بتحميل الصور في البرنامج عن طريق ملف | فتح الصورة حدد ملفات .qptiff. دع الطوابع، التي تم وضع علامة عليها كمشاريع inForm في الخطوة 5.6، يتم تحميلها في المشروع.
- تحميل ملفات .qptiff التي تم تصويرها لتعويض التألق الذاتي.
- للتعويض عن التألق الذاتي ، استخدم تحديد التألق الذاتي على أداة الصورة لرسم خط على الصورة من الشريحة غير الملوثة عبر أنواع مختلفة من الهياكل ذاتية الفلورسنت ، مثل كريات الدم الحمراء والكولاجين.
- في تحرير العلامات والألوان... ، قم بتعيين أسماء العلامات التي تتوافق مع فلوروفور أوبال واضبط اللون على اللون المفضل.
- لإلغاء خلط الفلوروفور، حدد تحضير الكل في الزاوية اليسرى السفلية.
- راجع الصور وتحقق مما إذا كانت جميع الإشارات مرئية في الصور وما إذا كان الخلط قد سار على ما يرام. حدد رمز مقلة العين لإيقاف تشغيله وعلى جميع العلامات واحدة تلو الأخرى للتحقق من الجودة.
- اختياريا ، قم بتدريب الخوارزميات على تجزئة الأنسجة وتجزئة الخلايا والتنميط الظاهري.
- انتقل إلى علامة التبويب تصدير وقم بإنشاء دليل تصدير فارغ جديد بالنقر فوق تصفح ... زر تحت دليل التصدير.
- ضمن الصور المراد تصديرها:، حدد الصورة المركبة والصور المكونة (TIFF متعدد الصور).
- حدد ملف | حفظ | مشروع لحفظ الخوارزمية في موقع معين.
- انتقل إلى علامة التبويب تحليل الدفعات عموديا على اليسار للمعالجة المجمعة للشرائح.
- حدد إنشاء أدلة منفصلة لكل عنصر ضمن خيارات التصدير.
- لإضافة شرائح للتحليل ، حدد ملفات .qptiff ضمن الزر "إضافة شرائح... وقم بتحميلها في تحليل الدفعات.
- حدد تشغيل لبدء المعالجة المجمعة للشرائح.
7. رسم عائد الاستثمار
- قم بإنشاء مجلد يحتوي على ملفات المكونات فقط من القسم 6 ، ولكن احتفظ ببنية المجلد الهرمي سليمة (توجد ملفات المكونات في مجلدات مسماة بواسطة عينة / شريحة).
- افتح برنامج عارض الشرائح QuPath بالكامل.
- انقر فوق إنشاء مشروع على اليسار وحدد / أنشئ مجلدا فارغا جديدا باسم مناسب.
- انقر فوق أتمتة وحدد إظهار محرر البرامج النصية.
- نسخ ولصق البرنامج النصي المتوفر في الملف التكميلي 7. في السطر 34، قم بتغيير الموقع إلى حيث توجد مجلدات الشرائح التي تحتوي على كافة الملفات المكونة (المجلد الذي تم إنشاؤه في الخطوة 7.1.
- حدد تشغيل والعودة عند انتهاء الدمج الدفعي للشرائح (في اليوم التالي أو في وقت لاحق) للمتابعة.
- اسحب ملفات .ome.tif التي تم إنشاؤها إلى مشروع QuPath واحفظها كمشروع.
- عندما تنبثق نافذة جديدة تلقائيا، حدد تعيين نوع الصورة | مضان وانقر فوق استيراد.
- في القائمة إلى اليسار ، لاحظ قائمة العينات ؛ انقر نقرا مزدوجا فوق واحد لفتح العينة (الشكل 5 أ).
- لضبط كثافة القنوات لجعلها مرئية بشكل أفضل، انقر فوق أيقونة التباين.
- حدد جميع القنوات وانقر فوق إعادة تعيين.
- قم بإيقاف تشغيل التألق الذاتي.
- لبدء رسم عائد استثمار للورم ، انقر فوق رمز التباين وحدد إظهار التدرج الرمادي. حدد قناة علامة الورم واضبط شدتها لجعلها مرئية على النحو الأمثل (الشكل 5 ب).
- انقر فوق أداة الفرشاة لرسم عائد استثمار للورم تقريبا.
- أثناء تحديد أداة العصا ، انقر خارج عائد الاستثمار أثناء الضغط على مفتاح alt لتنعيم عائد الاستثمار من الخارج (الشكل 5C).
- دمج قطع الورم المنفصلة بنفس عائد الاستثمار.
- امنح عائد الاستثمار اسما مناسبا مثل الورم بالنقر بزر الماوس الأيمن فوق التعليق التوضيحي في القائمة الموجودة على اليسار ؛ حدد تعيين الخصائص وأدخل الاسم.
- لعمل عائد استثمار للرسالة الفورية، قم بتوسيع عائد الاستثمار الحالي من منطقة الورم عن طريق تحديد: الكائنات | الشروح... | توسيع التعليقات التوضيحية.
- حدد الحجم الذي يجب أن يكون عليه نصف قطر التمدد وحدد إزالة الجزء الداخلي وتقييد الأصل (الشكل 5D).
- انقر فوق أيقونة التباين ، وحدد قناة التألق الذاتي ، واضبط الكثافة لجعلها مرئية على النحو الأمثل.
- انقر فوق العصا واضبط عائد الاستثمار أثناء الضغط على مفتاح alt لتنعيم عائد الاستثمار من الخارج وإزالة أي خلفية لا ينبغي أن تكون جزءا من عائد الاستثمار هذا.
- امنح عائد الاستثمار اسما مناسبا مثل الهامش الغازي أو المراسلة الفورية بالنقر بزر الماوس الأيمن فوق التعليق التوضيحي في القائمة الموجودة على اليمين، وحدد تعيين الخصائص، وأدخل الاسم، وقم اختياريا بتغيير لونه إلى اللون الأخضر.
- حفظ التعليقات التوضيحية: ملف | تصدير الكائنات | تصدير كافة الكائنات وانقر فوق موافق مع التحديد الافتراضي على تصدير كمجموعة ميزات واحفظه في موقع مفضل.
8. الكشف عن الخلايا المناعية
- نظرا لأن ImmuNet يستخدم بيانات المكونات (ملفات TIFF متعددة القنوات) لكل من التدريب والاستدلال ، قم بتقسيم التعليقات التوضيحية إلى مجموعات التدريب والتحقق من الصحة. لتدريب النموذج، اتبع الخطوات الموضحة في الملف التمهيدي للمستودع، مع استبدال مجموعة البيانات والتعليقات التوضيحية النموذجية بالبيانات المطلوبة. بصرف النظر عن الخلايا المناعية المختلفة ، قم بتزويد النموذج بأمثلة سلبية عن طريق عمل تعليقات توضيحية أساسية في المواقع التي لا ينبغي التعرف عليها كخلية ذات أهمية: الخلايا السرطانية ، أو الخلايا الأخرى ، أو "لا خلايا" (الهياكل التي يمكن الخلط بينها وبين الخلايا ذات الاهتمام) ؛ انظر منشور ImmuNet للحصول على التفاصيل32.
- باستخدام التعليقات التوضيحية للتحقق من الصحة، تأكد من أن الأداء مرض. انظر إلى معدل الخطأ لكل نوع تعليق توضيحي - حصة من التعليقات التوضيحية للتحقق من الصحة التي لم يكتشفها النموذج - مقياس التقييم الأكثر وضوحا. قم بتقييم الأداء فيما يتعلق بالإيجابيات الخاطئة عن طريق عمل عدد قليل من عائد الاستثمار المشروح بالكامل وحساب درجات F.
- بالإضافة إلى التقييم الكمي ، افحص التنبؤ بصريا للحصول على إحساس نوعي بالأخطاء التي يميل النموذج إلى ارتكابها (الشكل 6 ، الملف التكميلي 6: الشكل التكميلي S4 ، والشكل التكميلي S5). إذا تم الحكم على أداء النموذج بأنه غير كاف، فقم بتصور التنبؤ لبعض اللوحات كما هو موضح في المستودع وتحقق من المواقع الأكثر عرضة للخطأ. قم بعمل المزيد من التعليقات التوضيحية في هذه المواقع وأعد تشغيل تدريب النموذج وتقييمه.
- عند تحقيق الأداء الهدف، قم بتشغيل الاستدلال لمجموعة البيانات بأكملها كما هو موضح في قسم الاستدلال لمجموعة البيانات بأكملها في الملف التمهيدي المستودع. استخدم ملفات .csv التي تم الحصول عليها مع تنبؤ النموذج كمدخلات لتحليل البيانات (اكتب نصا نصيا ل Python أو R لذلك).
9. التنميط الظاهري للتنبؤ وتحليل البيانات
ملاحظة: في هذا القسم ، نقدم مثالا على تحليل البيانات البسيط لعينة واحدة من سرطان الجلد ملطخة بلوحة الخلايا الليمفاوية ، والتي تجمع بين مواقع الخلايا المناعية التي حددها ImmuNet (القسم 8) وعائد الاستثمار المحدد باستخدام QuPath (القسم 7). تم إجراء التحليل في R 4.1.1 (يتم توفير نص كملف تكميلي 8). يتطلب البرنامج النصي الحزم: plyr 1.8.8 و dplyr 1.0.8 و tidyr 1.2.0 و sf 1.0-7 و ggplot2 3.4.0 و RANN 2.6.1 و RColorBrewer 1.1-2 ، والتي يمكن تثبيتها باستخدام الأمر install.packages(). كمدخل ، يأخذ ملف .csv مع توقع ImmuNet لعينة وملف مع عائد استثمار تم تصديره من QuPath. تصف الخطوات 9.1-9.6 تحليل عينة واحدة يتم إجراؤها في البرنامج النصي المقدم ، وتصف الأقسام 9.7-9.9 خيارات تحليل عينات متعددة.
- بعد تحميل تنبؤ ImmuNet في R ، حدد عتبات تعبير العلامة المتوقعة عن طريق رسم العلامات التي تحدد الأنماط الظاهرية مقابل بعضها البعض واختيار العتبات التي تفصل بين السكان بشكل أفضل.
ملاحظة: تظهر استراتيجية البوابة المستخدمة للعينة المعطاة في الشكل 7B. يتم عرض استراتيجيات البوابات لألواح الخلايا النخاعية والمتغصنة في الملف التكميلي 6: الشكل التكميلي S6 والشكل التكميلي S7. - بعد تحديد العتبات، استخدمها لتعيين نمط ظاهري محدد في لوحة لكل تنبؤ ImmuNet. في بعض التنبؤات ، لاحظ أن أيا من العلامات المتوقعة لا تزيد عن العتبة أو أن مجموعة العلامات التي يتم التعبير عنها بعد العتبة قد تكون غير متسقة (على سبيل المثال ، تنبؤات CD3 + CD20 + في لوحات الخلايا الليمفاوية). إذا تم تحقيق أداء نموذج جيد في الخطوة 8.3 ، فإن جزء هذه التنبؤات سيكون صغيرا ؛ قم بتصفيتها قبل التحليل.
- لتحليل عائد الاستثمار بشكل منفصل للورم وهامشه الغازي حتى 100 ميكرومتر المرسوم في QuPath ، قم بتحميل ملفات GeoJSON المقابلة في R ، ولكل تنبؤ ، حدد عائد الاستثمار الذي يقع فيه التنبؤ.
- لفحص السلامة العقلية وكجزء من تحليل البيانات الاستكشافية ، تصور الخلايا المناعية الموجودة في عينة بشكل منفصل في عائد الاستثمار المقابل مع حدود عائد الاستثمار (الشكل 7 أ).
- الآن ، احسب كثافات الخلايا المناعية المختلفة بشكل منفصل لكل عائد استثمار. الكثافات الموجودة في العينة المعطاة موضحة في الجدول 1.
- في حالة توفر عينات متعددة ، تصور توزيع كثافات الخلايا. قم بتحويل قيم الكثافة لتحقيق القيم الموزعة بشكل طبيعي.
ملاحظة: عندما تكون أعداد أنماط ظاهرية معينة 0 ، لا يمكن تحويلها إلى Log ، مما يؤدي إلى قيم مفقودة. للتغلب على هذه المشكلة ، يمكن تطبيق تجانس LaPlacian بإضافة 0.5 إلى جميع عدد الخلايا أولا قبل القسمة على مساحة السطح. - تحليل قيم الكثافة ورسمها باستخدام البرنامج المختار (الشكل 8).
- تتيح المواقع المحفوظة للخلايا التحليل المكاني. على سبيل المثال، لكل خلية مناعية مكتشفة، ابحث عن أقرب جار، ثم لكل نمط ظاهري، احسب النسبة المئوية للحالات التي تحدث فيها الأنماط الظاهرية المختلفة باعتبارها أقرب جار.
ملاحظة: نظرا لأن عدد الخلايا القاتلة الطبيعية (NK) الموجودة في هذه العينة كان صغيرا جدا ، فقد استبعدناها من هذا التحليل. يتم إعطاء النتائج التي تم الحصول عليها للورم و IM ROIs في الشكل 9.
النتائج
تم اختيار كتل FFPE التي تحتوي على أنسجة الورم على أساس تقارير علم الأمراض والشرائح الملطخة ب HE. عندما يتم استئصال آفات الورم المتعددة من المريض و / أو تكون عينات الورم كبيرة ، يتم تقسيمها على كتل FFPE متعددة. نحن نفضل تحليل الخلايا المناعية في كل من حجرة الورم وما يعرف بالهامش الغازي (IM) للورم. العضل هو نسيج انسجة غير سرطاني مجاور للورم. لذلك ، عندما يكون هناك العديد من كتل FFPE المتاحة لعينة ورم واحدة ، يتم تحديد كتل FFPE التي تحتوي على كلا النوعين من الأنسجة. كما هو موضح في الشرائح الملطخة ب HE، احتوت كتلة واحدة من FFPE على أنسجة الورم والأنسجة اللحمية المجاورة للورم (الشكل 1 أ). احتوت كتلة FFPE أخرى من نفس الورم على أنسجة انسجة محيطة أقل بكثير (الشكل 1 ب). ومع ذلك ، بالنسبة لبعض عينات الأنسجة ، لا يوجد خيار في كتل FFPE أو أن IM غير موجود في أي من كتل FFPE. غالبا ما يكون هذا هو الحال بالنسبة للخزعات (الإبرة) ، والتي يجب وضعها في الاعتبار أثناء تفسير البيانات.
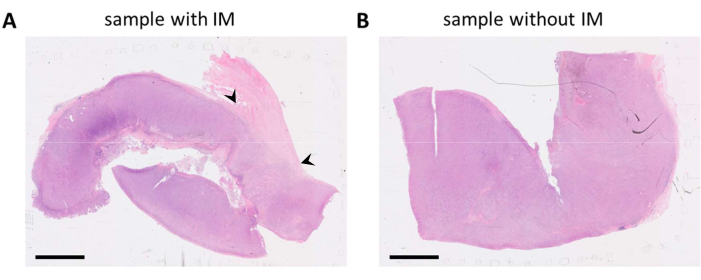
الشكل 1: شرائح ملطخة ب HE-لعينة ورم سرطان الميلانوما. (أ) مثال لعينة ورم بها نسيج انسجة مجاور للورم (IM) في الزاوية اليمنى العليا من العينة (يشار إليها برؤوس أسهم سوداء). (ب) عينة أخرى من نفس آفة الورم مع وجود القليل من الأنسجة اللحمية في العينة. قضبان المقياس = 5 مم. الاختصارات: HE = الهيماتوكسيلين ويوزين. IM = الهامش الغازي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يمكن إجراء تلطيخ IHC متعدد الإرسال باستخدام لوحة مقترحة من سبعة ألوان (الملف التكميلي 4) إما يدويا في عملية تلطيخ لمدة 3 أيام (مع مراعاة ساعات العمل العادية) أو بين عشية وضحاها في جهاز تلطيخ تلقائي. عند استخدام autostainer ، يجب تركيب المقاطع في موقع معين على الشريحة الزجاجية التي تتيح السوائل المثلى للنظام (الشكل 2 أ). عندما يتم تثبيت الأقسام بشكل صحيح على الشرائح (الشكل 2 ب) ، سيتم تلوينها بالتساوي (الشكل 2 ج). إذا لم يتم تثبيت المقاطع على النحو الأمثل على الشريحة الزجاجية (الشكل 2D) ، فغالبا ما ينتج عنها نمط تلطيخ دون المستوى الأمثل (الشكل 2E) لأن سوائع autostainer لا تصل إلى الأنسجة (الكاملة). يمكن أن يحدث هذا عندما تكون العينات كبيرة جدا ، أو عندما يتم توفير الشرائح المثبتة من قبل شخص ليس على دراية بهذه المشكلة. في هذه الحالات ، يجب تحديد الجزء الملطخ جيدا من الشريحة فقط للتحليل. خيار آخر لهذه الأنواع من العينات يمكن أن يكون تلطيخها يدويا لنشر السوائل على النحو الأمثل.
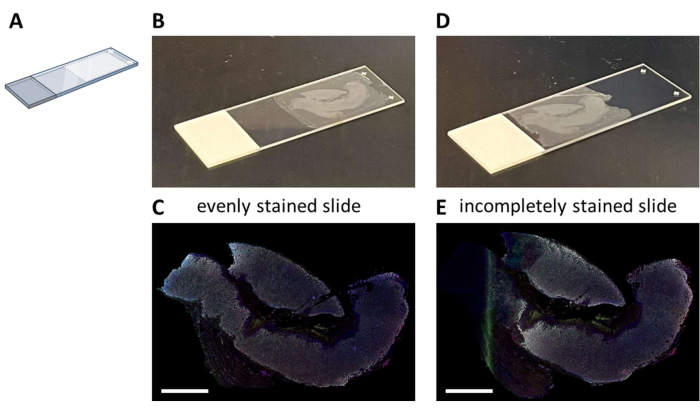
الشكل 2: تركيب قسم FFPE على الشريحة الزجاجية والتأثير. (أ) رسم تخطيطي لمكان التركيب على الشريحة الزجاجية للحصول على تلطيخ مثالي على autostainer. (ب) مثال على شريحة مثبتة بشكل صحيح. (ج) ينتج عن الشرائح المركبة بشكل صحيح مقطع نسيج ملطخ بالتساوي. (د) مثال على شريحة مركبة دون المستوى الأمثل. (ه) يمكن أن تؤدي الشرائح المركبة دون المستوى الأمثل إلى جزء غير مكتمل من الأنسجة الملطخة كما هو موضح في الجانب الأيسر من هذه الصورة. قضبان المقياس = 5 مم. اختصار: FFPE = الفورمالين الثابت والبارافين جزءا لا يتجزأ منها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
عندما يتم إجراء تجارب IHC متعددة الإرسال الكبيرة في جولات تلطيخ متعددة ويجب إعداد كميات كبيرة من المحاليل ، فمن الأفضل أولا اختبار هذه الكواشف في تشغيل IHC أحادي الإرسال قبل الانتقال إلى IHC متعدد الإرسال. يتم فحص Monoplex IHC باستخدام جهاز تصوير علم الأمراض الرقمي لمعرفة أنماط التلوين المتوقعة ويتم ضبط أوقات التعرض باستخدام المرشحات المقابلة على شرائح التحكم (الشكل 3A-H). يستخدم نسيج اللوزتين كعنصر تحكم إيجابي لمعظم علامات الخلايا المناعية. نظرا لأن وقت التعرض ل DAPI في أنسجة التحكم في اللوزتين يكون دائما أعلى منه في الأنسجة الأخرى (الشكل 3G) ، يجب ضبط وقت التعرض ل DAPI على نوع الأنسجة المراد دراستها. تتراوح أوقات التعرض المنتظمة مع هذا النوع من المسح بين 1 مللي ثانية و 30 مللي ثانية ، اعتمادا على الفلوروفور والمرشح (الشكل 3I). عندما يتجاوز monoplex IHC هذه الأرقام أو يكون نمط التلوين غير واضح كما هو متوقع ، يجب تعديل محلول الجسم المضاد أو استبداله. في المثال الموضح هنا ، قررنا زيادة تركيز FOXP3 (الشكل 3C والشكل 3I) لجعل الكثافة أكثر في النطاق مع العلامات الأخرى. قد يكون التألق الذاتي أقوى أيضا في الأنسجة الأخرى منه في أنسجة التحكم في اللوزتين. في إعدادنا ، يتراوح وقت التعرض لمرشح التركيز البؤري التلقائي لعينة 25 مللي ثانية و 50 مللي ثانية (الشكل 3H ، I).

الشكل 3: تحديد أوقات التعرض على monoplex IHC وعينات التحكم غير الملوثة. (أ) إشارة CD20 - Opal 480 في أنسجة التحكم في اللوزتين. (B) CD3 - إشارة أوبال 520 في أنسجة التحكم في اللوزتين. (C) FOXP3 - إشارة أوبال 570 في أنسجة التحكم في اللوزتين. (D) CD56 - إشارة أوبال 620 في أنسجة التحكم في اللوزتين (E) CD8 - إشارة أوبال 690 في أنسجة التحكم في اللوزتين. (F) علامة الورم - إشارة أوبال 780 في أنسجة التحكم في اللوزتين. (G) غالبا ما تكون إشارة DAPI في أنسجة التحكم في اللوزتين أضعف من نوع الأنسجة محل الاهتمام. (H) التألق الذاتي - عينة من إشارة AF في أنسجة التحكم في الورم. (I) لقطة شاشة لأوقات التعرض قبل ضبطها بنسبة 10٪ والتحقق من الشرائح الملطخة ب IHC المتعددة. قضبان المقياس = 100 ميكرومتر. الاختصارات: AF = autofluorescence; IHC = الكيمياء الهيستولوجية المناعية ؛ DAPI = 4'6-دياميدينو-2-فينيليندول. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
بعد إجراء IHC متعدد الإرسال ، يتم ضبط أوقات التعرض من إعدادات IHC أحادية الإرسال عن طريق التحقق من عدد قليل من شرائح IHC متعددة الإرسال وتحديد التعرض التلقائي. مع هذا النوع من المسح ، لا يوجد خيار حماية من التشبع ، وبالتالي ، من المهم للغاية تجنب ضبط التعرض بدرجة عالية جدا ، وبالتالي تجنب التعرض المفرط. التعرض المفرط يعيق الخلط الطيفي للفلوروفور. غالبا ما لا نحدد أوقات التعرض التي تتجاوز أوقات التعرض التي كانت تستند إلى monoplex IHC ونقوم فقط بتقليل أوقات التعرض للعلامات الأقوى في IHC متعدد الإرسال (الشكل 3G والشكل 4A). من خلال التعرض التلقائي لمواقع مختلفة على عدد قليل من الشرائح ، يمكن ملاحظة أن أوقات التعرض لبعض المرشحات لا تزال مرتفعة للغاية. يجب ضبطها على أقل رقم يتم ملاحظته عند استخدام إعداد التعرض التلقائي وطرح 10٪ أخرى من القيمة لمنع التعرض المفرط في المواقع الأخرى غير المرئية (الشكل 4 أ). باستخدام هذه الطريقة ، يمكن أن تكون أوقات التعرض أقل لمرشحات معينة من تلك التي تم تعيينها على monoplex IHC. ومع ذلك ، مع تجربة IHC متعددة الإرسال الناجحة ، يجب أن تكون جميع العلامات قابلة للملاحظة ، على الأقل على شريحة التحكم (الشكل 4B-H ، الملف التكميلي 6: الشكل التكميلي S1 ، والشكل التكميلي S2). ضع في اعتبارك أن بعض العلامات قد لا تكون موجودة في كل عينة. من خلال تضمين شريحة تحكم تحتوي على قسم لوزتين على الأقل ، يمكن التحقق من التلوين الناجح لجميع علامات اللوحات القياسية وقوة الإشارة.
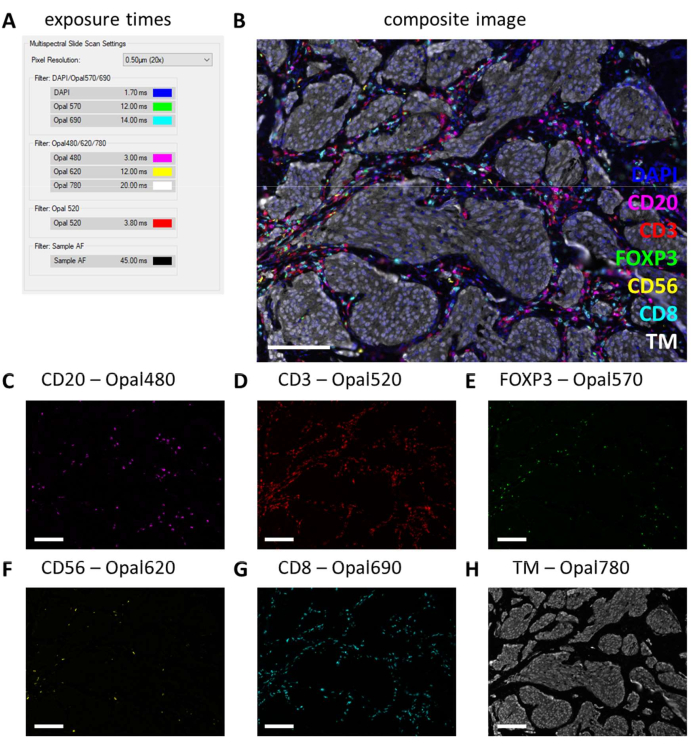
الشكل 4: مثال على مقطع ملطخ بنجاح مع لوحة الخلايا الليمفاوية في عينة ورم سرطان الجلد. (أ) أوقات التعرض المستخدمة لتسجيل عينة IHC المتعددة هذه. (B) صورة مركبة للوحة الخلايا الليمفاوية IHC متعددة الإرسال داخل أنسجة الورم. (C) CD20 - إشارة أوبال 480 باللون الأرجواني. (D) CD3 - إشارة أوبال 520 باللون الأحمر. (ه) إشارة FOXP3 - أوبال 570 باللون الأخضر. (F) CD56 - إشارة أوبال 620 باللون الأصفر. (ز) CD8 - إشارة أوبال 690 باللون السماوي. (H) TM - أوبال 780 باللون الأبيض. قضبان المقياس = 100 ميكرومتر. اختصار: TM = علامة الورم. IHC = الكيمياء الهيستولوجية المناعية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يتم مسح شرائح IHC متعددة الإرسال بالكامل بواسطة جهاز التصوير الرقمي. يتم تحديد اللوحات للتحليل اللاحق في عارض الشرائح. ومع ذلك ، عندما تحتاج إلى تحليل مناطق أكثر تحديدا مثل الورم مقابل IM ، يمكن رسم مناطق الاهتمام هذه (ROIs) باستخدام QuPath. بعد اكتمال المعالجة المجمعة للمربعات المحددة في عارض الشرائح ، يتم دمج ملفات المكونات معا مرة أخرى (الشكل 5A والملف التكميلي 7). باستخدام قناة علامة الورم (الشكل 5B) وأداة العصا السحرية في QuPath ، يمكن تتبع مخطط الورم لتشكيل "عائد استثمار الورم" (الشكل 5C). بعد ذلك ، يمكن توسيع عائد الاستثمار للورم بمسافة معينة ، في هذه الحالة ، 500 ميكرومتر ، لإنشاء "عائد استثمار هامش غازي" (الشكل 5 د). تتم إزالة أي خلفية غير مرغوب فيها (غير الأنسجة) من عائد الاستثمار هذا باستخدام أداة العصا السحرية من خلال النظر إلى إشارة التألق الذاتي (الشكل 5E). يتم حفظ كل من عائد الاستثمار للورم وعائد الاستثمار العضلي كملف GeoJSON لمزيد من المعالجة (الشكل 5F).
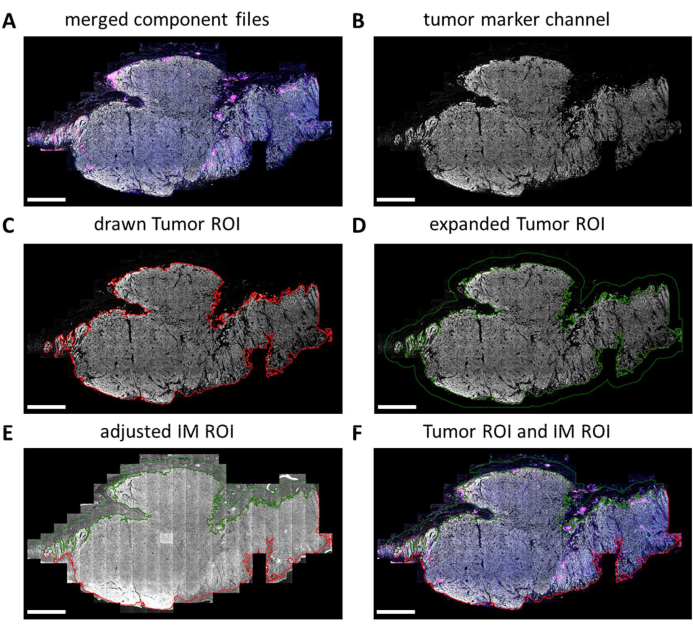
الشكل 5: عائد الاستثمار للورم وعملية رسم عائد الاستثمار للهامش الغازي في QuPath. (أ) ملفات المكونات المدمجة. (ب) صورة بتدرج الرمادي تظهر قناة علامة الورم فقط. (ج) يتم رسم عائد استثمار الورم حول إشارة علامة الورم. (د) يتم إجراء عائد استثمار جديد عن طريق توسيع عائد الاستثمار للورم بمقدار 100-500 ميكرومتر لتشكيل عائد الاستثمار العضلي. (ه) يتم ضبط عائد الاستثمار العضلي ليشمل الأنسجة اللحمية فقط عن طريق استبعاد الخلفية (الإشارة السلبية) وهياكل الأنسجة الكبيرة الأخرى مثل الدهون والأوعية الدموية وبصيلات الشعر. (F) يتم حفظ عائد الاستثمار الناتج للورم وعائد الاستثمار العضلي وتصديره إلى ملفات GeoJSON لمزيد من المعالجة للمناطق. يتم عرض عائد الاستثمار للورم بمخطط أحمر وعائد استثمار IM بمخطط أخضر. قضبان المقياس = 2 مم. الاختصارات: ROI = منطقة الاهتمام ؛ IM = الهامش الغازي ؛ GeoJSON = تدوين كائن جافا سكريبت الجغرافي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يمكن استخدام شبكات ImmuNet للكشف عن الخلايا المناعية. بالنسبة للوحة الخلايا الليمفاوية ، يمكن مقارنة الصورة المركبة التجريبية (الشكل 6 أ) بصريا بالخلايا المناعية المكتشفة بواسطة البرنامج (الشكل 6 ب). يمكن إجراء مقارنات بصرية مماثلة للوحة النخاعية (الملف التكميلي 6: الشكل التكميلي S4) ولوحة الخلايا المتغصنة (الملف التكميلي 6: الشكل التكميلي S5).
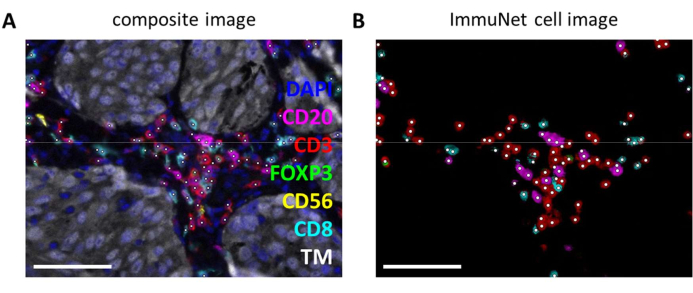
الشكل 6: الخلايا الليمفاوية التي يتعرف عليها ImmuNet. (أ) صورة مركبة من الشكل 4B توضح الخلايا التي يتعرف عليها ImmuNet بنقاط بيضاء. (ب) الخلايا التي يتعرف عليها ImmuNet وتعبير العلامة المكتشف لاحقا. قضبان المقياس = 50 ميكرومتر. اختصار: TM = علامة الورم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يمكن استيراد الخلايا المناعية التي اكتشفها ImmuNet وحفظها بتنسيق .csv إلى أي لغة برمجة لمزيد من التحليل. أجرينا التصور المكاني والبوابات في R (الملف التكميلي 8). يمكن بعد ذلك تصور الخلايا المكتشفة مكانيا (الشكل 7 أ ، الملف التكميلي 6: الشكل التكميلي S6 والشكل التكميلي S7). يمكن إجراء البوابات على تعبير العلامة الزائفة للنمط الظاهري للخلايا المناعية الفردية (الشكل 7 ب).
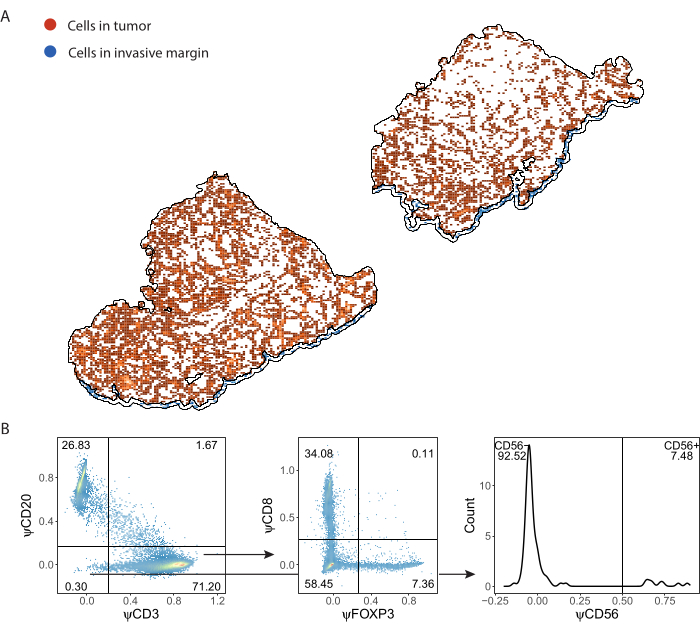
الشكل 7: استراتيجية بوابة لوحة الخلايا الليمفاوية. (أ) الخلايا المناعية المكتشفة في مناطق الورم والهامش الغازي ذات الأهمية المحددة باستخدام QuPath. (ب) بوابات جميع الخلايا التي اكتشفها ImmuNet من الجزء A. يتم أولا إغلاق الخلايا الليمفاوية على خلايا CD20 + B وخلايا CD3 + T. يتم أيضا بوابات خلايا CD3 + T لتعبير CD8 و FOXP3. مجموعة CD20-CD3- مسورة للخلايا القاتلة الطبيعية CD56 +. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
عندما يتم تحديد الأنماط الظاهرية للخلايا المتوقعة باستخدام البوابات ، يمكن حساب كثافات الخلايا للأنماط الظاهرية المختلفة ضمن عائد استثمار مختلف. يتم حساب ذلك بقسمة العدد الإجمالي للخلايا لكل نمط ظاهري على مساحة سطح عائد الاستثمار (الجدول 1 ، الشكل 8 ، والملف التكميلي 8). هنا ، تعرف الخلايا البائية بأنها CD3-CD20+ ، والخلايا التائية المساعدة على أنها CD3 + CD20-CD8-FoxP3- ، والخلايا التائية التنظيمية على أنها CD3 + CD20-CD8-FoxP3+ ، والخلايا التائية السامة للخلايا على أنها CD3 + CD20-CD8 + FoxP3- ، والخلايا القاتلة الطبيعية على أنها CD3-CD20-CD56+ .
| الظاهري | الكثافة في الورم (الخلايا / مم2) | الكثافة في العضل (خلايا/مم2) |
| الخلية البائية | 185.74 | 145.62 |
| الخلية التائية المساعدة | 301.46 | 157.51 |
| الخلية التائية التنظيمية | 38.53 | 19.53 |
| الخلايا التائية السامة للخلايا | 185.35 | 83.21 |
| خلية NK | 0.18 | 0 |
الجدول 1: كثافات الأنماط الظاهرية في عائد الاستثمار. كثافات الخلايا ذات الأنماط الظاهرية المختلفة الموجودة في عينة واحدة من سرطان الجلد ملطخة بلوحة الخلايا الليمفاوية. يتم حساب الكثافات بشكل منفصل في ROIs للورم و IM. الاختصارات: IM = الهامش الغازي ؛ عائد الاستثمار = منطقة الاهتمام.
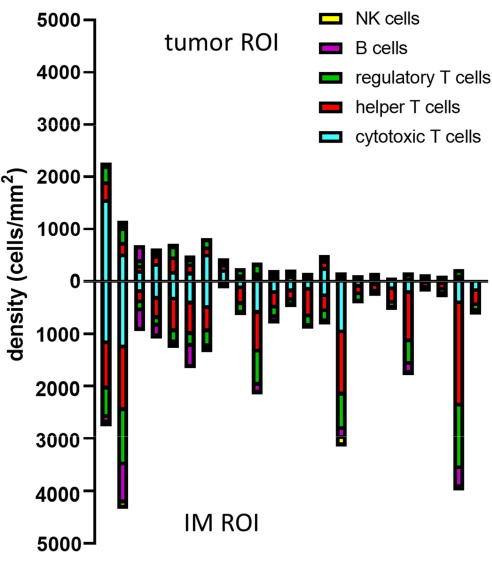
الشكل 8: مثال على تحليل البيانات لعينات متعددة. تحليل كثافة الأنماط الظاهرية المختلفة للخلايا الليمفاوية في الورم و IM ل 23 ورم ميلانوما أولي. الاختصارات: IM = الهامش الغازي ؛ عائد الاستثمار = منطقة الاهتمام. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
للتعمق أكثر في المعلومات المكانية لهذه الخلايا المناعية ، من الممكن أيضا تحديد المسافات بين الأنماط الظاهرية المحددة أو النسب المئوية للأنماط الظاهرية لأقرب الجيران في العينة (الشكل 9).
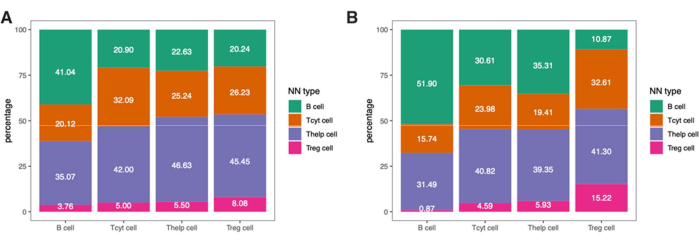
الشكل 9: مثال على تحليل أقرب جار لعينة واحدة. النسبة المئوية للأنماط الظاهرية القريبة من الجار لأنواع الخلايا المختلفة في (أ) الورم و (ب) عائد الاستثمار العضلي الموجود في عينة واحدة من سرطان الجلد ملطخة بلوحة الخلايا الليمفاوية. الاختصارات: IM = الهامش الغازي ؛ عائد الاستثمار = منطقة الاهتمام. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الملف التكميلي 1: تعدد الإرسال IHC يلخص مواصفات البروتوكول. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 2: بروتوكول Autostainer ل monoplex. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 3: بروتوكول Autostainer لتعويض التألق الذاتي. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 4: بروتوكول Autostainer للكيمياء الهيستولوجية المناعية المتعددة. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 5: ملف .csv القالب. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 6: ألواح الخلايا النخاعية والمتغصنة في عينة أنسجة سرطان الجلد ؛ وضع علامات على الشرائح في حالة فشل المسح ؛ الخلايا النخاعية والمتغصنة المعترف بها من قبل ImmuNet ؛ استراتيجيات بوابات ألواح الخلايا النخاعية والمتغصنة. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 7: البرنامج النصي غرزة QuPath. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 8: البرنامج النصي لتحليل البيانات. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
التحليل المكاني ل TME هو تقنية مطلوبة لمعرفة المزيد عن حجرة الخلايا المناعية واكتشاف مؤشرات حيوية تنبؤية وتنبؤية جديدة ، لا سيما في مجال علم الأورام المناعي16. يتم تطوير العديد من التقنيات المختلفة لهذا الغرض ، بما في ذلك الكشف عن البروتينات ، أو نسخ mRNA ، أو مزيج من الاثنين ، مع تقديرات تصل إلى 100-1000 هدف. ومع ذلك ، فإن تعدد الإرسال العالي يأتي على حساب تجارب أقل إنتاجية عالية ، وتكاليف تجريبية أعلى ، وتحديات تقنية ، وفي كثير من الأحيان ، لا يمكن تحليل سوى جزء صغير من TME. Multiplex IHC باستخدام الطريقة المستندة إلى TSA التي وصفناها هنا ، يكتشف ست علامات مختلفة + DAPI في وقت واحد ، وهو أقل تكلفة نسبيا في الأداء ، ويتم تصوير أقسام الأنسجة الكاملة في أقل من 20 دقيقة ، وجاهزة للتحليل بالكامل. أصبحت هذه التقنية أقل تعقيدا مع أتمتة إجراء التلطيخ. أدت التحسينات في المجهر متعدد الأطياف ، والتي تشمل إضافة مرشحين إضافيين ، إلى تحسين أوقات فك الخلط الطيفي والمسح بشكل كبير. من الممكن اكتشاف ما يصل إلى ثماني علامات مختلفة + DAPI في وقت واحد. ومع ذلك ، من خلال توسيع تعدد الإرسال بمزيد من العلامات ، تختفي الفوائد المذكورة أعلاه حيث يصبح فك الخلط الطيفي أكثر صعوبة وتزداد أوقات المسح للشرائح بأكملها بشكل كبير. تبذل الجهود لتوحيد تعدد الإرسال الإنساني بين المؤسسات المختلفة لتسهيل التنفيذ في بيئة التشخيص بسهولة أكبر. لهذا التوحيد القياسي ل multiplex IHC ، ننصح المستخدمين بالالتزام بالبروتوكول الذي يسهل الوصول إليه بست علامات مختلفة + DAPI. ومع ذلك ، لا يزال من الضروري بعض الدراية الفنية ويمكن أن يكون التحليل النهائي أمرا صعبا ، وقد طورنا منهجيات موصوفة في هذا البروتوكول.
يبدأ التوحيد القياسي بتطوير لوحة IHC متعددة الإرسال. تم التأكيد على أهمية اختيار الأجسام المضادة الأولية التي تكتشف أهدافا بروتينية معينة قبل17. تم تطوير لوحات IHC متعددة الإرسال الخاصة بنا في الغالب باستخدام استنساخ الأجسام المضادة الأولية التي يتم استخدامها أيضا والتحقق من صحتها للمدينة العالمية للخدمات الإنسانية في قسم التشخيص لدينا. ومع ذلك ، في حالة لوحة IHC متعددة الخلايا المتغصنة ، لم يتم استخدام معظم الأجسام المضادة في الإعداد التشخيصي (van der Hoorn et al. ، مخطوطة قيد التقديم). لضمان الخصوصية وتقليل الاختلافات في الدفعات ، اخترنا استخدام الأجسام المضادة وحيدة النسيلة على الأجسام المضادة متعددة النسيلة وتحققنا أيضا من صحة معظم الأجسام المضادة باستخدام خطوط الخلايا المنقولة والخلايا الأولية. على مر السنين ، تم استخدام إصدارات مختلفة من لوحات IHC متعددة الإرسال في العديد من الدراسات باستخدام نظام Vectra 318،21،23،24،25،26،27،28،29،30،31،32. لتنفيذ لوحات IHC متعددة الإرسال هذه على النحو الأمثل على نظام PhenoImager HT ، كان لا بد من إجراء بعض التعديلات في مجموعات الأجسام المضادة الأولية والفلوروفور. للاستفادة من عدم الخلط الطيفي الأفضل وأوقات المسح الأسرع لأقسام الأنسجة الكاملة ، من الضروري تنفيذ أحدث فلوروفورات Opal480 و Opal780 وتجنب استخدام فلوروفورات Opal540 و Opal650 في لوحات IHC متعددة الألوان ذات سبعة ألوان. أوقات المسح ~ 3-10 مرات أسرع حسب حجم قسم الأنسجة. كان من السهل جدا تحقيق تعديلات لوحة IHC متعددة الإرسال ، ولكن يجب مراعاة بعض الاعتبارات. يتداخل طيف الفلورسنت ل Opal480 كثيرا مع طيف التألق الذاتي ، وبالتالي يتداخل مع الاختلاط الطيفي لكريات الدم الحمراء وغيرها من الهياكل الفلورية الذاتية. أدى استخدام تركيز متزايد من الجسم المضاد الأساسي المقترن ب Opal480 إلى حل هذه المشكلة في معظم الحالات. يسهل تنفيذ مرشح التركيز البؤري التلقائي لعينة الملكية على PhenoImager HT فك خلط Opal480 والتألق الذاتي. ومع ذلك ، فمن الأفضل استخدام جسم مضاد أولي يعطي إشارة واضحة عند استخدامه مع Opal480 بحيث تكون إشارته أعلى من التألق الذاتي.
على الرغم من إنشاء لوحات IHC متعددة الإرسال هذه ، إلا أن الاختلاف من دفعة إلى أخرى أمر يجب مراعاته. من خلال إجراء عناصر تحكم أحادية الإرسال IHC قبل بدء تجربة IHC متعددة الإرسال الكاملة ، لاحظنا أحيانا أن الأجسام المضادة الأولية تعمل إما أقوى أو أضعف من تجربة إلى أخرى. قد تكون أسباب ذلك هي أخطاء السحب ، وظروف تخزين الكاشف دون المستوى الأمثل ، ومدة الصلاحية. لقد حللنا هذه المشكلة عن طريق تعديل محلول الجسم المضاد الأساسي بناء على تجربتنا. حتى في حالة عدم الحاجة إلى إجراء أي من التعديلات المذكورة أعلاه ، مع كل تجربة دفعية متعددة IHC ، من المهم ضبط أوقات التعرض بناء على شرائح التحكم أحادية الإرسال IHC.
نظرا لأن بحثنا كان يركز في البداية على أنواع مختلفة من السرطانات وسرطان الجلد ، فقد كان مطلوبا من لوحات IHC المتعددة أن تكون قابلة للتبديل بين أنواع الأورام مع الحد الأدنى من التعديلات. لذلك ، قمنا دائما بتضمين أنواع متعددة من الأنسجة (الورم) في عملية التحسين ولاحظنا أن التخفيفات للأجسام المضادة الأولية لعلامات الخلايا المناعية يمكن أن تظل متشابهة بين أنواع الأورام المختلفة. ومع ذلك ، فإن اكتشاف أنسجة الورم بين السرطان وسرطان الجلد يحتاج إلى علامات ورم مختلفة. وفقا لذلك ، تم دائما تحسين علامة الورم للعمل في نهاية كل لوحة IHC متعددة الإرسال وتستخدم حاليا دائما جنبا إلى جنب مع Opal780 ، والتي من قبيل الصدفة يجب أن تكون أيضا في آخر فلوروفور في إجراء تلطيخ IHC متعدد. باستخدام علامة الورم وبالتالي في نهاية IHC المتعدد ، يمكن استبدال لوحات IHC المتعددة هذه بسهولة بأنواع أخرى من الأورام ، مثل الورم الأرومي الدبقي (أي GFAP) وسرطان الغدد الليمفاوية هودجكين (أي CD30). بالنسبة للساركوما الوعائية ، استخدمنا لوحة IHC متعددة الخلايا الليمفاوية مع الجين المرتبط بتحويل الأرومة الحمراء (ERG) كعلامة للورم مع تجربتين فقطللتحسين 25. تضمن التحسين معايرة الجسم المضاد الأساسي ERG واختبار لوحة IHC متعددة الإرسال مع ERG في النهاية.
يمكن أيضا إجراء تعديلات أخرى على لوحات IHC متعددة الإرسال هذه عن طريق استبدال علامة خلية مناعية معينة بعلامة مناعية أو وظيفية أخرى. كل تغيير يتطلب التحسين. يمكن اتباع بروتوكول التحسين كما هو موضح سابقا17. ستتداخل بعض التغييرات على لوحات IHC متعددة الإرسال المقترحة مع خوارزميات ImmuNet التي أنشأناها. يجب إنشاء بيانات كافية ويجب قضاء الوقت لتنفيذ هذه التغييرات في الخوارزمية (750 تعليقا توضيحيا على الأقل لكل علامة و / أو أنماط ظاهرية جديدة للخلية ، و 150 تعليقا توضيحيا للتحقق من صحة العلامات المدربة مسبقا). لا تحتوي اللوحات المعروضة هنا على علامات وظيفية ، على الرغم من أن تنفيذ علامات نقاط التفتيش المناعية مثل PD-1 و PD-L1 في لوحات IHC متعددة الإرسال يتم في مختبرنا. ومع ذلك ، فقد ثبت أن تحليل العلامات الأقل ثنائية في الإشارات السلبية والإيجابية أكثر صعوبة وهو مجال بحث نشط في مجموعتنا.
عدد العلامات التي يمكن تقييمها في وقت واحد باستخدام تعدد الإرسال IHC محدود مقارنة بالتقنيات الجديدة الأخرى. بينما يمكن التحايل على ذلك من خلال تحليل لوحات مختلفة على شرائح متتالية من كتلة FFPE ، سيكون من الصعب مقارنة هذه الشرائح مكانيا. من المحتمل ألا يكون الاتجاه والتحف المطوية هي نفسها بعد إعداد الشرائح. ومع ذلك ، يمكن الوصول إلى تعدد الإرسال IHC تماما ، مما يجعله أداة جذابة لمزيد من المؤسسات والباحثين ، وبالتالي ، أكثر ملاءمة للتنفيذ المستقبلي في بيئة تشخيصية. مع توحيد لوحات الخلايا المناعية IHC متعددة الإرسال لأنواع متعددة من الأورام وخطوط أنابيب التحليل النهائية ، يمكن اكتساب المزيد من المعرفة حول الاختلافات في TME بين المرضى وأنواع الأورام. يمكن أن يؤدي هذا ، على سبيل المثال ، إلى مزيد من الأفكار حول دور TME في الاستجابة المضادة للأورام لعلاجات محددة. قد يؤدي هذا إلى ظهور مؤشرات حيوية جديدة للتنبؤ بعوامل مثل الاستجابة للعلاج والبقاء المتوقع. بشكل عام ، يمكن أن يمكن هذا من جعل تعدد الإرسال IHC أداة سريرية للمساعدة في اتخاذ القرارات السريرية ، في نهج الطب الشخصي. من المسلم به أنه من المحتمل أن تكون المزيد من خطوات إجراء التحليل مؤتمتة وموحدة حتى تكون مجدية للاستخدام في بيئة تشخيصية يومية ، لذلك حتى الآن ، فهي في الغالب منظور مستقبلي.
يمكن أن يكون تحليل علامات متعددة على شريحة عينة واحدة أداة قوية للغاية على الرغم من التحديات التقنية. مع بروتوكولات تجريبية موحدة وطريقة تحليل قوية ، كما وصفنا هنا باستخدام ImmuNet ، فإن القياس الكمي للعلامات المتعددة يجعلها أكثر إفادة من IHC الكلاسيكية ، في حين أن IHC متعدد الإرسال يظل عالي الإنتاجية نسبيا مقارنة بالطرق التجريبية الجديدة ذات البلكس الأعلى.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
تم شراء PhenoImager HT من خلال التمويل المقدم من المركز الطبي بجامعة رادبود ومركز رادبود للتكنولوجيا للفحص المجهري. يتم دعم CF ماليا من خلال منحة جمعية السرطان الهولندية (10673) ومنحة ERC Adv ARTimmune (834618). يتم دعم JT ماليا من خلال منحة NWO Vidi (VI.Vidi.192.084). يود المؤلفون أن يشكروا Eric van Dinther و Ankur Ankan على مساعدتهم في إنشاء مهام سير عمل لتخزين بيانات IHC متعددة الإرسال ويتم شكر Bengt Phung على الإرشادات حول كيفية تنفيذ بيانات IHC متعددة الإرسال في QuPath لرسم عائد الاستثمار.
Materials
| Name | Company | Catalog Number | Comments |
| anti-CD14 | Cell Marque | 114R-16 | section 3, clone EPR3653 |
| anti-CD163 | Cell Marque | 163M-15 | section 3, clone MRQ-26 |
| anti-CD19 | Abcam | ab134114 | section 3, clone EPR5906 |
| anti-CD1c (BDCA1) | Thermo Scientific | TA505411 | section 3, clone OTI2F4 |
| anti-CD20 | Thermo Scientific | MS-340-S | section 3, clone L26 |
| anti-CD3 | Thermo Scientific | RM-9107 | section 3, clone sp7 |
| anti-CD303/BDCA2 | Dendritics via Enzo Lifesciences/Axxora | DDX0043 | section 3, clone 124B3.13 |
| anti-CD56 | Cell Marque | 156R-94 | section 3, clone MRQ-42 |
| anti-CD66b | BD Biosciences | 555723 | section 3, clone G10F5 |
| anti-CD68 | Dako Agilent | M087601 | section 3, clone PG-M1 |
| anti-CD8 | Dako Agilent | M7103 | section 3, clone C8/144B |
| anti-Foxp3 | Thermo Scientific | 14-4777 | section 3, clone 236A/E7 |
| anti-Gp100 | Dako Agilent | M063401 | section 3, clone HMB45 |
| anti-HLA-DR, DP, DQ | Santa Cruz | sc-53302 | section 3, clone CR3/43 |
| anti-MART-1 | Thermo Scientific | MS-799 | section 3, clone A103 |
| anti-pan cytokeratin | Abcam | ab86734 | section 3, clone AE1/AE3 + 5D3 |
| anti-SOX10 | Sigma Aldrich | 383R | section 3, clone EP268 |
| anti-Tyrosinase | Sanbio | MONX10591 | section 3, clone T311 |
| anti-XCR1 | Cell Signaling Technologies via Bioké | 44665S | section 3, clone D2F8T |
| antibody diluent | Akoya BioSciences | SKU ARD1001EA | section 3, from Opal 7-Color Automation IHC Kit 50 slide (can optionally also be replaced by TBST with 10% BSA) |
| Bond Aspirating Probe | Leica Biosciences | S21.0605 | section 3 |
| Bond Aspirating Probe Cleaning | Leica Biosciences | CS9100 | section 3 |
| Bond Dewax Solution | Leica Biosciences | AR9222 | section 3 |
| Bond Objectglas label + print lint | Leica Biosciences | S21.4564.A | section 3 |
| Bond Research Detection System 2 | Leica Biosciences | DS9777 | section 3 |
| Bond RX autostainer | Leica Biosciences | - | section 3, automated platform |
| Bond TM Epitope Retrieval 1 - 1 L | Leica Biosciences | AR9961 | section 3 |
| Bond TM Epitope Retrieval 2 - 1 L | Leica Biosciences | AR9640 | section 3 |
| Bond TM Wash Solution 10x - 1 L | Leica Biosciences | AR9590 | section 3 |
| BOND Universal Covertile | Leica Biosciences | S21.4611 | section 3 |
| Bond(TM) Titration Kit | Leica Biosciences | OPT9049 | section 3 |
| Coverslip 24 x 32 mm #1 (0.13-0.16 mm) | Fisher Scientific | 15717592 | section 2 |
| coverslip 24 x 50 mm | VWR | 631-0146 | section 2 |
| DAPI Fluoromount-G | VWR | 0100-20 | section 3, whenever monoplex slides need to be quickly checked, not for official analysis, then DAPI is stained seperately for better results |
| Eosine | section 2, home made | ||
| Ethanol 99.5% | VWR | 4099.9005 | section 2 |
| Fluoromount-G | VWR | 0100-01 | section 3 |
| haematoxyline | - | section 2, home made | |
| ImmuNet | - | immune cell detection and phenotyping pipeline | |
| inForm software 2.4.10 | Akoya BioSciences | - | section 4 & 6 |
| OPAL 480 reagent pack | Akoya BioSciences | FP1500001KT | section 3 |
| OPAL 520 reagent pack | Akoya BioSciences | FP1487001KT | section 3 |
| OPAL 570 reagent pack | Akoya BioSciences | FP1488001KT | section 3 |
| OPAL 620 reagent pack | Akoya BioSciences | FP1495001KT | section 3 |
| OPAL 690 reagent pack | Akoya BioSciences | FP1497001KT | section 3 |
| OPAL 780 reagent pack | Akoya BioSciences | FP1501001KT | section 3 |
| Opal 7-Color Automation IHC Kit 50 slide | Akoya BioSciences | NEL821001KT | section 3 |
| PhenoChart 1.1.0 | Akoya BioSciences | - | section 5 |
| PhenoImagerHT | Akoya BioSciences | CLS143455 | section 4, digital pathology imager with slide viewer and imaging software (formerly known as Vectra Polaris) |
| Quick-D mounting medium | Klinipath | 7280 | section 2 |
| QuPath 0.3.2 | whole slide image analysis software platform | ||
| R 4.1.1 | |||
| Slide boxes | VWR | 631-0737 | section 1 |
| SuperFrost Plus | Thermo Scientific through VWR | 631-9483 | section 1 |
| Vectra Polaris software 1.0.13 | Akoya BioSciences | - | section 4 |
| Xylene | VWR | 4055-9005 | section 2 |
References
- Dunn, G. P., Bruce, A. T., Ikeda, H., Old, L. J., Schreiber, R. D. Cancer immunoediting: from immunosurveillance to tumor escape. Nature Immunology. 3 (11), 991-998 (2002).
- van der Woude, L. L., Gorris, M. A. J., Halilovic, A., Figdor, C. G., de Vries, I. J. M. Migrating into the tumor: a roadmap for T cells. Trends in Cancer. 3 (11), 797-808 (2017).
- Fridman, W. H., Pages, F., Sautes-Fridman, C., Galon, J. The immune contexture in human tumours: impact on clinical outcome. Nature Reviews. Cancer. 12 (4), 298-306 (2012).
- Fridman, W. H., et al. The immune microenvironment of human tumors: general significance and clinical impact. Cancer Microenvironment. 6 (2), 117-122 (2013).
- Pages, F., et al. International validation of the consensus Immunoscore for the classification of colon cancer: a prognostic and accuracy study. Lancet. 391 (10135), 2128-2139 (2018).
- Angell, H. K., Bruni, D., Barrett, J. C., Herbst, R., Galon, J. The Immunoscore: colon cancer and beyond. Clinical Cancer Research. 26 (2), 332-339 (2020).
- Angell, H., Galon, J. From the immune contexture to the Immunoscore: the role of prognostic and predictive immune markers in cancer. Current Opinion in Immunology. 25 (2), 261-267 (2013).
- Galon, J., et al. Cancer classification using the Immunoscore: a worldwide task force. Journal of Translational Medicine. 10, 205 (2012).
- Galon, J., et al. World-wide Immunoscore Task Force: meeting report from the 34;Melanoma Bridge", Napoli, November 30th-December 3rd, 2016. Journal of Translational Medicine. 15 (1), 212 (2017).
- Tumeh, P. C., et al. PD-1 blockade induces responses by inhibiting adaptive immune resistance. Nature. 515 (7528), 568-571 (2014).
- Creemers, J. H. A., et al. A tipping point in cancer-immune dynamics leads to divergent immunotherapy responses and hampers biomarker discovery. Journal for Immunotherapy of Cancer. 9 (5), e002032 (2021).
- Blank, C. U., Haanen, J. B., Ribas, A., Schumacher, T. N. CANCER IMMUNOLOGY. The "cancer immunogram". Science. 352 (6286), 658-660 (2016).
- Teruya-Feldstein, J. The immunohistochemistry laboratory looking at molecules and preparing for tomorrow. Archives of Pathology & Laboratory Medicine. 134 (11), 1659-1665 (2010).
- Ramos-Vara, J. A., Miller, M. A., et al. When tissue antigens and antibodies get along: revisiting the technical aspects of immunohistochemistry--the red, brown, and blue technique. Veterinary Pathology. 51 (1), 42-87 (2014).
- Hegde, P. S., Karanikas, V., Evers, S. The where, the when, and the how of immune monitoring for cancer immunotherapies in the era of checkpoint inhibition. Clinical Cancer Research. 22 (8), 1865-1874 (2016).
- Parra, E. Novel platforms of multiplexed immunofluorescence for study of paraffin tumor tissues. Journal of Cancer Treatment and Diagnosis. 2 (1), 43-53 (2018).
- Gorris, M. A. J., et al. Eight-color multiplex immunohistochemistry for simultaneous detection of multiple immune checkpoint molecules within the tumor microenvironment. Journal of Immunology. 200 (1), 347-354 (2018).
- Roelofsen, T., et al. Spontaneous regression of ovarian carcinoma after septic peritonitis; a unique case report. Frontiers in Oncology. 8, 562 (2018).
- van den Brand, D., et al. Peptide-mediated delivery of therapeutic mRNA in ovarian cancer. European Journal of Pharmaceutics and Biopharmaceutics. 141, 180-190 (2019).
- van den Brand, D., et al. EpCAM-binding DARPins for targeted photodynamic therapy of ovarian cancer. Cancers. 12 (7), 1762 (2020).
- Di Blasio, S., et al. The tumour microenvironment shapes dendritic cell plasticity in a human organotypic melanoma culture. Nature Communications. 11 (1), 2749 (2020).
- van Beek, J. J. P., et al. Human pDCs are superior to cDC2s in attracting cytolytic lymphocytes in melanoma patients receiving DC vaccination. Cell Reports. 30 (4), 1027-1038 (2020).
- Rodriguez-Rosales, Y. A., et al. Immunomodulatory aged neutrophils are augmented in blood and skin of psoriasis patients. Journal of Allergy and Clinical Immunology. 148 (4), 1030-1040 (2021).
- Hoeijmakers, Y. M., et al. Immune cell composition in the endometrium of patients with a complete molar pregnancy: Effects on outcome. Gynecologic Oncology. 160 (2), 450-456 (2021).
- van Ravensteijn, S. G., et al. Immunological and genomic analysis reveals clinically relevant distinctions between angiosarcoma subgroups. Cancers. 14 (23), 5938 (2022).
- van der Woude, L. L., et al. Tumor microenvironment shows an immunological abscopal effect in patients with NSCLC treated with pembrolizumab-radiotherapy combination. Journal for Immunotherapy of Cancer. 10 (10), e005248 (2022).
- Graham Martinez, C., et al. The immune microenvironment landscape shows treatment-specific differences in rectal cancer patients. Frontiers in Immunology. 13, 1011498 (2022).
- Cortenbach, K. R. G., et al. Topography of immune cell infiltration in different stages of coronary atherosclerosis revealed by multiplex immunohistochemistry. International Journal of Cardiology. Heart & Vasculature. 44, 101111 (2023).
- van Wilpe, S., et al. Homologous recombination repair deficient prostate cancer represents an immunologically distinct subtype. Oncoimmunology. 11 (1), 2094133 (2022).
- Gorris, M. A. J., et al. Paired primary and metastatic lesions of patients with ipilimumab-treated melanoma: high variation in lymphocyte infiltration and HLA-ABC expression whereas tumor mutational load is similar and correlates with clinical outcome. Journal for Immunotherapy of Cancer. 10 (5), e004329 (2022).
- van Wilpe, S., et al. Intratumoral T cell depletion following neoadjuvant chemotherapy in patients with muscle-invasive bladder cancer is associated with poor clinical outcome. Cancer Immunology, Immunotherapy. 72 (1), 137-149 (2023).
- Sultan, S., Gorris, M. A. J., Buytenhuijs, F., Lvan de Woude, L. A Segmentation-free machine learning architecture for immune land-scape phenotyping in solid tumors by multichannel imaging. bioRxiv. , (2021).
- Parra, E. R., et al. Immuno-profiling and cellular spatial analysis using five immune oncology multiplex immunofluorescence panels for paraffin tumor tissue. Scientific Reports. 11 (1), 8511 (2021).
- Parra, E. R., et al. Validation of multiplex immunofluorescence panels using multispectral microscopy for immune-profiling of formalin-fixed and paraffin-embedded human tumor tissues. Scientific Reports. 7 (1), 13380 (2017).
- Sun, Z., Nyberg, R., Wu, Y., Bernard, B., Redmond, W. L. Developing an enhanced 7-color multiplex IHC protocol to dissect immune infiltration in human cancers. PLoS One. 16 (2), e0247238 (2021).
- LeicaBiosystems. BOND RX Fully Automated Research Stainer Protocols. , (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved