Method Article
Мультиплексный иммуногистохимический анализ пространственного иммунного клеточного ландшафта опухолевого микроокружения
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этом протоколе подробно описано, как проводится характеристика иммунными клетками микроокружения опухоли с помощью мультиплексной иммуногистохимии.
Аннотация
Иммунный клеточный ландшафт опухолевого микроокружения потенциально содержит информацию для открытия прогностических и прогностических биомаркеров. Мультиплексная иммуногистохимия является ценным инструментом для визуализации и идентификации различных типов иммунных клеток в опухолевых тканях с сохранением их пространственной информации. Здесь мы предоставляем подробные протоколы для анализа популяций лимфоцитов, миелоидных и дендритных клеток в срезах тканей. Начиная от резки фиксированных формалином срезов, залитых парафином, автоматических процедур мультиплексного окрашивания на автоматизированной платформе, сканирования предметных стекол на мультиспектральном микроскопе и заканчивая анализом изображений с помощью алгоритма машинного обучения собственной разработки ImmuNet. Эти протоколы могут быть применены к различным образцам опухолей путем простого переключения опухолевых маркеров для анализа иммунных клеток в различных компартментах образца (опухоль против инвазивного края) и применения анализа ближайшего соседа. Этот анализ не ограничивается образцами опухолей, но также может быть применен к другим (не)патогенным тканям. Усовершенствование оборудования и рабочего процесса за последние несколько лет значительно сократило время обработки, что облегчает будущее применение этой процедуры в диагностических условиях.
Введение
Иммунные клетки играют решающую роль в защите от патогенов, таких как вирусы и бактерии, а также от раковых клеток1. Таким образом, иммунная система в микроокружении опухоли (TME) имеет большие перспективы для открытия прогностических и прогностических биомаркеров2. Инфильтраты иммунных клеток коррелируют с прогнозом при различных типах рака, хотя это еще не было реализовано в клинической помощи 3,4. При большинстве типов опухолей большое количество цитотоксических Т-клеток и Т-хелперов 1 и/или низкое количество регуляторных Т-клеток связаны с хорошими прогнозами. В настоящее время предпринимаются усилия по включению так называемого «иммунобалла» в стадию колоректального рака TNM, превращая его встадию TNM-I 5,6. Иммунооценка рассчитывается на основе общего количества Т-клеток (обнаруженных с помощью CD3) и цитотоксических Т-клеток (обнаруженных с помощью CD8) в двух различных областях опухоли: ядро опухоли и инвазивный край (IM) опухолей. Также было высказано предположение, что иммунооценка имеет прогностическую ценность при других типах рака, таких как меланома, рак легких и рак молочной железы 6,7,8,9. Кроме того, инфильтраты иммунных клеток могут также коррелировать с ответом на иммунотерапию блокадой контрольных точек10. Тем не менее, эти прогностические биомаркеры должны быть валидированы в проспективных исследованиях, прежде чем они могут быть рутинно внедрены в клиническую практику. Более того, было также высказано предположение, что одного биомаркера будет недостаточно для осмысленного прогноза11. Таким образом, создание полной карты выборки пациента путем комбинации различных биомаркеров было предложено в качестве более полного прогностического биомаркера в так называемой «иммунограмме рака»12.
Среди методов изучения иммунных клеток в рамках ТМЭ самым старым и известным методом является иммуногистохимия (ИГХ), обычно используемая для диагностического тестирования при нескольких заболеваниях, особенно при раке13. Этот метод был ограничен использованием одного или нескольких маркеровв течение длительного времени и, следовательно, был вытеснен в исследовательских условиях другими методами, такими как проточная цитометрия и профилирование экспрессии генов (GEP). Тем не менее, фиксированные формалином и залитые парафином (FFPE) опухолевые ткани, обычно используемые в рутинной диагностике и исследованиях, не подходят (оптимально) для проточной цитометрии и GEP. Кроме того, хотя GEP и проточная цитометрия дают много информации о фенотипе и функции клеток, отсутствие пространственной информации является основным недостатком. Таким образом, гетерогенность в образце, такая как различия в областях опухоли, инфильтрированных иммунными клетками, и областей опухоли, исключенных из иммунных клеток, может остаться незамеченной. Были разработаны новые платформы для мультиплексного анализа тканей FFPE, такие как мультиплексная ИГХ, визуализационная массовая цитометрия и CO-Detection методом indEXing (CODEX), которые могут быть использованы для одновременного обнаружения нескольких маркеров в пределах участка ткани16. Иммунные клетки в ТМЭ широко изучаются с целью поиска лучших биомаркеров для иммунотерапии. Тем не менее, методы мультиплексирования и автоматизированный анализ изображений создают свои собственные препятствия.
Наша лаборатория имеет большой опыт мультиплексного окрашивания ИГХ методом усиления сигнала (ТСА) Опал/Тирамид и автоматизировала его на платформе ИГХ (см. Таблицу материалов)17,18,19,20,21,22,23,24,25,26,27,28, 29,30,31. Мы оптимизировали панели иммунных клеток для обнаружения различных подмножеств лимфоцитов, миелоидных клеток и дендритных клеток (ДК). Ткани, содержащие плотные участки иммунных клеток (для лимфоцитов или сложных морфологий клеток (т.е. миелоидных клеток и ДК), особенно сложны для анализа, что сопряжено с риском переоценки или недооценки количества присутствующих иммунных клеток. Чтобы решить эту проблему, наша группа32 разработала аналитическое программное обеспечение ImmuNet, и этот конвейер машинного обучения значительно улучшил качество обнаружения этих различных типов иммунных клеток. Подробный протокол от получения материала FFPE до анализа плотности иммунных клеток в различных тканевых компартментах и расстояниях между типами иммунных клеток описан здесь.
В этом протоколе описывается, как выполняются мультиплексные панели IHC в Медицинском центре Университета Радбуда с момента внедрения цифрового устройства визуализации патологии в 2022 году. Описанные мультиплексные панели ИГХ могут быть использованы при различных карциномах (например, легких, предстательной, толстой кишки, мочевого пузыря, молочной железы) с использованием пан-цитокератинового антитела в качестве опухолевого маркера или при меланоме с использованием меланоцит-ассоциированных антител в качестве опухолевых маркеров. Эти мультиплексные протоколы ИГХ были тщательно оптимизированы с точки зрения концентрации первичных антител, комбинаций флуорофоров и последовательности процедуры окрашивания. Мы и другие ранее описывали оптимизацию мультиплексной панели IHC 17,33,34,35. Мультиплексные панели IHC могут быть адаптированы, но описанные конвейеры анализа должны быть оценены и, возможно, скорректированы или переобучены соответствующим образом. В описанных семицветных мультиплексных протоколах ИГХ используются опаловые флуорофоры Opal480, Opal520, Opal570, Opal620, Opal690, Opal780 и 4',6-диамидино-2-фенилиндол (DAPI), так что простое расмешивание и быстрое сканирование на имидж-сканере обеспечивается с помощью «Мультиспектральной иммунофлуоресценции в одно касание» (MOTiF). Девятицветное окрашивание и сканирование в данном протоколе не описывается, так как это требует еще более тонкой настройки экспериментальной установки и другого режима сканирования на тепловизоре, в котором используется перестраиваемый фильтр с жидкими кристаллами.
протокол
Материалы пациента, показанные для этого протокола, были частью ранее проведенного исследования и были официально признаны освобожденными от санитарно-этического одобрения местным Комитетом по медицинской этике Radboudumc в соответствии с законодательством Нидерландов (номер файла 2017-3164)30.
1. Сбор материала FFPE, подбор блоков и подготовка образцов
- Извлекайте идентификаторы блоков FFPE из файлов пациентов с помощью лечащих врачей или патологоанатомов. Ознакомьтесь с местными правилами, требуется ли этическое разрешение.
- Запросите блоки FFPE в местном архиве патологии или в внешней больнице.
ПРИМЕЧАНИЕ: Также возможно, что для конкретного исследования был получен опухолевый материал или биопсия. Это может быть в случае небольших клинических испытаний или исследований на животных. В этих случаях обработка образца ткани может быть обязанностью исследователя. - При наличии нескольких блоков FFPE выберите наиболее репрезентативный блок FFPE, содержащий жизнеспособную опухолевую ткань, предпочтительно с присутствующей окружающей стромальной тканью, оценив окрашенные гематоксилином и эозином (HE) стекла (рис. 1).
ПРИМЕЧАНИЕ: Для этого выбора рекомендуется получить экспертное заключение (например, патологоанатома). Возможно, что HE недоступны для оценки содержимого блока FFPE и для отбора необходимо внести новые. Перейдите в раздел 2 для получения описания. - Нарежьте на микротоме ленты FFPE толщиной 4 мкм.
ПРИМЕЧАНИЕ: Толщина может составлять от 1 мкм до 6 мкм без заметного окрашивания; Тем не менее, 4 мкм является наиболее стандартным. - Установите образцы на предметные стекла в положении, благоприятном для жидкости автокрасителя (рисунок 2A-C), используя один из методов, описанных ниже:
- Поместите срезы на поверхность дистиллированной 40 °C воды в водяную баню, чтобы растянуть, и поднимите их с помощью предметного стекла.
ИЛИ
Поместите стеклянные предметные стекла на нагревательную пластину с температурой 40 °C, обязательно накрыв место установки секции на предметном стекле каплей дистиллированной воды. Поместите секцию поверх этой капли с помощью щипцов и дайте ей растянуться. Впитайте дистиллированную воду с помощью бумажного полотенца и удалите лишнюю воду, постукивая по предметному стеклу.
ПРИМЕЧАНИЕ: Размещение срезов ткани слишком близко к этикетке предметного стекла приведет к неоптимальному окрашиванию (Рисунок 2D, E). Как правило, мы устанавливаем 6-10 стеклянных стекол на образец, чтобы выполнить различные мультиплексные панели IHC и иметь резервную копию.
- Поместите срезы на поверхность дистиллированной 40 °C воды в водяную баню, чтобы растянуть, и поднимите их с помощью предметного стекла.
- Дайте установленным предметным стеклам высохнуть при температуре 56 °C в течение 1 часа или в течение ночи при 37 °C.
- Используйте для эксперимента установленные стеклянные стекла или храните их в коробках при температуре 4 °C.
ПРИМЕЧАНИЕ: По нашему опыту, эти смонтированные предметные стекла могут храниться в течение многих лет, прежде чем будет проведено мультиплексное окрашивание IHC.
2. Генерация предметных стекол, окрашенных гематоксилином и эозином
ПРИМЕЧАНИЕ: Все следующие шаги раздела 2 должны выполняться в вытяжном шкафу.
- Депарафинизируйте предметные стекла в ксилоле (2 x 5 мин).
- Регидратация в этаноле (99,6% 1 x 5 мин; 95% 1 x 5 мин; 70% 1 x 2 мин). В качестве альтернативы окуните предметные стекла в 3 раза в 99,6% этанол.
- Промойте горки в дистиллированной воде (2 мин).
- Окрашиваем ядра гематоксилином (10 мин).
- Промойте предметные стекла дистиллированным H2O (5 мин).
- Покрасьте предметные стекла эозином (5 мин).
- Обезвоживайте предметные стекла, 3 раза окунув их в 99,6% этанол.
- Окуните предметные стекла в 2 раза в ксилол.
- Добавьте несколько капель монтажного средства и запечатайте покровным стеклом.
- Дайте предметным стеклам застыть и выньте стекла из вытяжного шкафа, когда все химикаты испарятся.
3. Выполнение моноплексного и мультиплексного ИГХ в автопятнителе
- Рассчитайте, сколько реагента необходимо в зависимости от количества образцов, которые необходимо окрашивать.
ПРИМЕЧАНИЕ: За один прогон автокраситель имеет емкость 30 слайдов и требуется ~18 часов для завершения мультиплексного протокола ИГХ с шестью антителами. Когда необходимо покрасить больше предметных стекол, можно добавлять несколько партий каждый вечер (рабочей) недели; 4 ночи по 30 горок = 120 горок в неделю.- Подготовьте все необходимые реактивы в начале недели. Система автоокрашивания дозирует 150 мкл реагента на предметное стекло. Используйте контейнеры для титрования объемом 6 мл для антител и реагентов Opal и контейнеры объемом 30 мл для блокирующего реагента и вторичного антитела — пероксидазы хрена.
ПРИМЕЧАНИЕ: Контейнеры объемом 6 мл имеют удобные вкладыши, которые можно легко вынуть и заменить при необходимости. При расчете реагентов необходимо учитывать мертвый объем 1,6 мл или 300 мкл для контейнера объемом 30 мл или контейнера для титрования объемом 6 мл соответственно. - Разведите все опаловые флуорофоры и дигоксигенин (DIG) 1:100 в предоставленном разбавителе; Разведите Opal780 1:25 в разбавителе антител. Разведите все первичные антитела в разбавителе антител с разведениями, указанными в Дополнительном файле 1.
- Подготовьте все необходимые реактивы в начале недели. Система автоокрашивания дозирует 150 мкл реагента на предметное стекло. Используйте контейнеры для титрования объемом 6 мл для антител и реагентов Opal и контейнеры объемом 30 мл для блокирующего реагента и вторичного антитела — пероксидазы хрена.
- Чтобы следовать этому протоколу, запустите моноплексную ИГХ (Дополнительный файл 2) на предметных стеклах, содержащих как контрольную ткань миндалин, так и другие (опухолевые) типы тканей, представляющие интерес, прежде чем приступать к фактическому эксперименту с мультиплексной ИГХ, чтобы убедиться, что все реагенты хорошо подготовлены.
ПРИМЕЧАНИЕ: Моноплексный IHC занимает ~3,5 часа и может быть проверен до конца этого дня на шаблоны и интенсивность сигнала. Если определенные сигналы слишком слабы (рис. 3), можно внести коррективы в реагенты. - Для коррекции аутофлуоресценции необходимо подготовить предметное стекло с (опухолевой) тканью, содержащей автофлуоресцентные структуры, такие как кровь и коллаген. Подготовьте это предметное стекло одновременно со слайдами с моноплексным ИГХ, но с блокирующим реагентом, заменяющим антитело, и реагентами Opal (Дополнительный файл 3).
ПРИМЕЧАНИЕ: В принципе, такой слайд можно повторно использовать для мультиспектральной визуализации до тех пор, пока автофлуоресцентная коррекция больше не станет оптимальной. Тем не менее, при работе с тканями с высоким уровнем аутофлуоресценции, такими как мозг и печень, рекомендуется использовать эту ткань для коррекции аутофлуоресценции. - При каждом прогоне мультиплексной ИГХ загружайте 29 образцов в систему автоокрашивания с помощью одного контрольного предметного стекла для проверки производительности каждого мультиплексного прогона ИГХ.
- Загрузите мультиплексные протоколы IHC с веб-сайта автоокрашивателя на вкладке «Загрузки» и настройте их в соответствии с каждой настроенной мультиплексной панелью IHC36. Для мультиплексных ИГХ см. Дополнительный файл 4 для протокола, а для специализированных мультиплексных панелей ИГХ см. Дополнительный файл 1.
- После завершения протокола окрашивания выньте предметные стекла из автопятницы и положите их в контейнер с буфером для стирки.
- Чтобы предотвратить загрязнение системы автоокрашивания DAPI, так как образцы уже окрашены в очень низких концентрациях, нанесите DAPI вручную, прежде чем закрывать предметные стекла покровными стеклами. Добавьте две капли DAPI на мл промывочного буфера и выдерживайте 5 минут при комнатной температуре в темноте.
ПРИМЕЧАНИЕ: Для создания спектральных библиотек важно не иметь никаких пятен DAPI в образцах. Также возможна одна капля DAPI на мл промывочного буфера и 10 минут инкубации в RT. - Промойте слайды 3 раза с буфером для стирки.
- Положите слайды на бумажные полотенца и постучите по буферу для стирки слайдов.
- Нанесите несколько капель монтажного средства на ткань.
- Аккуратно положите стеклянный покровный колпак поверх монтажного носителя, чтобы закрыть предметное стекло под углом, чтобы избежать образования пузырьков воздуха.
- Удалите излишки монтажной среды и пузырьки воздуха, осторожно надавливая на стеклянную защитную крышку щипцами или чистым наконечником пипетки.
- Оставьте предметные стекла в покое на ~24 часа, прежде чем монтажная среда затвердеет, либо горизонтально на доске микроскопических слайдов, либо загрузите их непосредственно в микроскоп для визуализации.
- После того как монтажный носитель застынет или после получения изображений предметных стекол, храните их в коробках для микроскопии при температуре 4 °C.
4. Визуализация с помощью цифрового сканера патологоанатомических исследований и аннотация файлов сканирования
- Включите тепловизор, нажав кнопку питания в правой части устройства. По прошествии не менее 20 секунд запустите программное обеспечение.
ПРИМЕЧАНИЕ: Подождите 20 секунд, чтобы оборудование загрузилось правильно. - Загрузите слайды в кассеты по четыре слайда.
- Необязательно: Введите слайды в файл .csv, для которого можно загрузить шаблон (Дополнительный файл 5). Чтобы загрузить файл .csv в программу, сохраните его в папке C:\Users\Public\Akoya\VectraPolaris\States.
ПРИМЕЧАНИЕ: Одновременно можно загрузить не более 20 кассет или 80 слайдов.
- Необязательно: Введите слайды в файл .csv, для которого можно загрузить шаблон (Дополнительный файл 5). Чтобы загрузить файл .csv в программу, сохраните его в папке C:\Users\Public\Akoya\VectraPolaris\States.
- Референсные настройки
- Откройте «Проверить дашборд» в главном меню.
ПРИМЕЧАНИЕ: Кассета с справочными слайдами предоставляется производителем и опционально может постоянно храниться в слоте 20. - Устанавливайте опорные значения яркого поля на предоставленном слайде один раз в неделю в соответствии с инструкциями производителя (занимает несколько минут).
- Устанавливайте эталоны флуоресценции на прилагаемом предметном стекле один раз в месяц в соответствии с инструкциями производителя (занимает более 1 часа).
- Откройте «Проверить дашборд» в главном меню.
- Составление или корректировка протокола
- Вернитесь в главное меню и нажмите «Редактировать протокол », чтобы создать протокол.
- Нажмите «Создать» и выберите «Флуоресценция» в качестве режима визуализации, «Мультиспектральное сканирование слайдов» и «Цвет Opal Polaris 5, 6 и 7» в опции «Окрашивание».
- Присвойте протоколу имя в поле Имя протокола и сохраните его в исследовании, выбрав исследование из списка Доступные исследования, или создайте исследование в разделе Создать новое исследование | Название исследования.
- В завершение выберите «Создать протокол».
- Для этого типа сканирования используйте только левое окно Настройки сканирования мультиспектральных слайдов; Игнорируйте окно справа Настройки мультиспектрального поля.
- Сканируйте слайды с разным увеличением. Чтобы следовать этому протоколу, сканируйте с 20-кратным увеличением, оставив разрешение пикселя на 0,50 мкм (20x).
- Установите время экспозиции, выбрав Сканировать экспозиции.
- Загрузите кассету, в которой хранятся слайды, выбрав правильный слот в опции «Держатель груза ».
- Чтобы упростить навигацию по слайдам, выберите «Сделать обзор», чтобы получить обзорное изображение носителя, содержащего слайды, после загрузки носителя. Чтобы включить или выключить эту функцию автоматически, нажмите на значок шестеренки в правом верхнем углу, перейдите в раздел «Настройки...» и установите флажок «Включить или выключить» в разделе «Изображение обзора навигации», чтобы включить параметр «Автоматически носитель образа при загрузке для интерактивных задач».
- Установите время экспозиции для каждого фильтра на соответствующих моноплексных предметных стеклах, окрашенных IHC, выбрав «Установить экспозиции сканирования » и найдя различные пятна с положительным сигналом. Сфокусируйтесь вручную или используйте автофокус и выберите «Автоэкспонирование » после переключения на совместимый фильтр для этого сигнала. Выберите наименьшее время экспозиции, чтобы предотвратить переэкспонирование, и делайте снимки каждого слайда для справки после установки всех времен экспозиции (рис. 3).
ПРИМЕЧАНИЕ: Игнорируйте опцию "Установить экспозиции поля " для этого типа сканирования. - Установите время экспозиции на мультиплексном предметном стекле, проверив все фильтры в нескольких местах с положительным сигналом. Уменьшите минимальное время автоэкспозиции на 10%, чтобы предотвратить передержку, и сделайте несколько снимков после того, как будет установлено время экспозиции.
- Сделайте снимки неокрашенного слайда для компенсации автофлуоресценции с помощью фильтра «Образец автофокусировки » для навигации (рис. 3H).
ПРИМЕЧАНИЕ: Интерес представляют места с эритроцитами и коллагеновыми структурами. Для получения сильных автофлуоресцентных областей может потребоваться сократить время воздействия фильтра Opal480. Если сигнал Opal480 достаточно сильный, он все равно должен быть хорошо отделен (см. раздел 6) от автофлуоресцентных структур благодаря использованию запатентованного фильтра Sample AF. - Оцените качество окрашивания и визуализации с помощью программного обеспечения (см. разделы 5 и 6; Рисунок 4, Дополнительный файл 6: Дополнительный рисунок S1 и Дополнительный рисунок S2).
- Нажмите кнопку «Сохранить...», чтобы убедиться, что протокол и его скорректированное время воздействия сохранены в протоколе.
ПРИМЕЧАНИЕ: Когда протокол уже сохранен, программное обеспечение пока не выдает никаких дополнительных уведомлений о несохраненных корректировках.
- Автоматическое сканирование слайдов
- Вернитесь в главное меню и нажмите «Сканировать слайды », чтобы отсканировать слайды.
- Вручную введите имена/идентификаторы слайдов и соответствующие задачи и протокол в разделе «Настройка задач» или автоматически из ранее созданного файла .csv с помощью настройки загрузки.
- Нажмите кнопку Сканировать, чтобы начать сканирование.
- Подождите, пока не появится всплывающее окно, чтобы сохранить настройки сканирования. Нажмите «Сохранить », чтобы использовать настройки по умолчанию и начать сканирование.
ПРИМЕЧАНИЕ: Сканирование с помощью этого метода занимает ~10-20 минут на слайд. В зависимости от количества слайдов, сканирование может занять до целого дня. - Проверьте, было ли сканирование слайдов успешным для всех слайдов, посмотрев на сообщения об ошибках. Чтобы узнать, прошло ли сканирование успешно, найдите сохраненный файл сканирования всего предметного стекла Akoya (.qptiff) сканирования и всей ткани в сканировании.
5. Аннотирование данных с помощью просмотрщика слайдов
- Вернитесь в главное меню и нажмите «Запустить Phenochart », чтобы открыть просмотрщик слайдов.
- Если файлы сканирования не видны напрямую, назначьте их местоположение, сначала нажав на значок шестеренки в правом верхнем углу, перейдите в раздел «Изменить местоположение браузера...» и случайным образом выберите один из файлов .qptiff интересующего набора данных.
ПРИМЕЧАНИЕ: Данные по умолчанию хранятся в D:\Data\VectraPolaris. - Загрузите слайд, выбрав его и нажав «Загрузить » в правом верхнем углу или дважды кликнув по нему.
- Авторизуйтесь, нажав на кнопку «Войти » в правом верхнем углу.
ПРИМЕЧАНИЕ: Имя пользователя может быть просто инициалами или именем и используется для отслеживания того, кто и какие аннотации сделал. - Чтобы выполнить размикширование, нажмите на кнопку «Размикшивание » вверху и выберите опцию «Опал + AF ».
ПРИМЕЧАНИЕ: Это полезно, чтобы избавиться от части автофлуоресцентного сигнала рядом с каналом Opal 480, но не от всего. - Чтобы сгенерировать алгоритм пакетной обработки данных, выберите репрезентативные изображения с помощью Штампа с помощью опции для изображений inForm Projects 1 x 1 (размер изображения: 928 μм x 696 μм).
ПРИМЕЧАНИЕ: Несколько репрезентативных марок, содержащих опухоль, строму, фон и различные типы иммунных клеток, выбираются по всему набору данных, чтобы в конечном итоге получить ~20-30 изображений. - В зависимости от того, что необходимо проанализировать в ткани, выберите интересующую область с помощью опции ROI и выберите inForm Batch. Вручную удалите изображения, которые не нужно анализировать, например, изображения, которые находятся слишком далеко от опухоли или на заднем плане.
ПРИМЕЧАНИЕ: Мы обычно рисуем ROI вокруг всей опухоли и выбираем одно дополнительное изображение вдали от области опухоли, чтобы иметь возможность анализировать IM ~0,5 мм.
Если нарисованный ROI относительно небольшой, ROI будет состоять из 2-9 объединенных изображений 20x. Поскольку мы не предпочитаем это делать, вручную проштампуйте интересующую ткань (выбранную для inForm Batch), чтобы обойти это. - После завершения аннотирования позвольте аннотациям автоматически сохраниться и загрузите следующий слайд.
- В процессе аннотации проверяйте, правильно ли отсканированы слайды.
- Если файл .qptiff отсутствует или предметное стекло не было успешно отсканировано, проверьте, нет ли на предметном стекле ткани, очистите предметное стекло 70% этанолом и отсканируйте еще раз.
- Если ткань не просканирована полностью, тем самым пропускается потенциально важная (опухолевая) область, или если сканирование важной области было не в фокусе, очистите предметное стекло 70% этанолом и просканируйте еще раз.
ПРИМЕЧАНИЕ: В обоих случаях также может быть полезно обвести ткань маркером на верхней части покровного стекла, чтобы помочь системе найти ткань и повторить попытку сканирования (Дополнительный файл 6: Дополнительный рисунок S3). В наших руках тонкий красный маркер работал лучше, чем толстый черный маркер.
- После завершения сканирования и аннотирования всех образцов создайте резервную копию данных, сохранив их на другом компьютере или внешнем диске.
6. Спектральное расмешивание
- Откройте программное обеспечение для автоматического анализа изображений inForm.
- Загрузка изображений в программу с помощью File | Открыть изображение; Выберите файлы QPTIFF. Пусть штампы, помеченные как проекты inForm на шаге 5.6, будут загружены в проект.
- Загрузите файлы .qptiff, которые визуализируются для компенсации автофлуоресценции.
- Чтобы компенсировать автофлуоресценцию, используйте инструмент выбора автофлуоресценции на изображении , чтобы провести линию на изображении от неокрашенного предметного стекла через различные типы автофлуоресцентных структур, таких как эритроциты и коллаген.
- В разделе Редактирование маркеров и цветов... назначьте имена маркеров, которые соответствуют флуорофору Opal, и настройте цвет в соответствии с предпочтительным.
- Чтобы размешать флуорофоры, выберите «Подготовить все » в левом нижнем углу.
- Просмотрите изображения и проверьте, все ли сигналы видны на изображениях и хорошо ли прошло размикширование. Выберите значок глазного яблока , чтобы выключить, и включите все маркеры один за другим, чтобы проверить качество.
- При необходимости обучите алгоритмы сегментации тканей, сегментации клеток и фенотипирования.
- Перейдите на вкладку «Экспорт» и создайте новую пустую директорию экспорта, нажав кнопку «Обзор...» под «Экспортной директорией».
- В разделе Изображения для экспорта: выберите Составное изображение и изображения компонентов (TIFF с несколькими изображениями).
- Выбрать файл | Сохранить | Проект для сохранения алгоритма в определенном месте.
- Перейдите на вкладку Пакетный анализ по вертикали слева для пакетной обработки слайдов.
- Выберите Создать отдельные каталоги для каждого элемента в разделе Параметры экспорта.
- Чтобы добавить слайды для анализа, выберите файлы .qptiff под кнопкой « Добавить слайды...» и загрузите их в пакетный анализ.
- Выберите Выполнить , чтобы начать пакетную обработку слайдов.
7. Розыгрыш ROI
- Создайте папку, содержащую только файлы компонентов из раздела 6, но сохраните иерархическую структуру папок (файлы компонентов находятся в папках, названных по образцу/слайду).
- Откройте программу для просмотра слайдов QuPath.
- Нажмите « Создать проект » слева и выберите/создайте новую пустую папку с подходящим именем.
- Нажмите кнопку Автоматизировать и выберите Показать редактор скриптов.
- Скопируйте и вставьте сценарий, который доступен в дополнительном файле 7. В строке 34 измените расположение, где находятся папки слайдов, содержащие все файлы компонентов (папка, созданная на шаге 7.1.
- Выберите Запустить и вернуться после завершения пакетной сшивки слайдов (на следующий день или позже), чтобы продолжить.
- Перетащите сгенерированные файлы .ome.tif в проект QuPath и сохраните их как проект.
- Когда автоматически появится новое окно, выберите Задать тип изображения | Флуоресценция и нажмите кнопку Импорт.
- В меню слева посмотрите на список образцов; дважды щелкните по одному из них, чтобы открыть образец (Рисунок 5A).
- Чтобы настроить интенсивность каналов и сделать их более заметными, нажмите значок контраста.
- Выберите все каналы и нажмите «Сбросить».
- Выключите автофлуоресценцию.
- Чтобы начать построение ROI для опухоли, щелкните значок контраста и выберите «Показать оттенки серого». Выберите канал онкомаркера и отрегулируйте интенсивность, чтобы сделать его оптимально видимым (рисунок 5B).
- Нажмите на инструмент кисть , чтобы нарисовать ROI опухоли приблизительно.
- При выборе инструмента «палочка» щелкните за пределами ROI, одновременно нажимая клавишу Alt , чтобы сгладить ROI снаружи (рис. 5C).
- Объединяйте разделенные части опухоли с одинаковой рентабельностью инвестиций.
- Присвойте ROI подходящее имя, например tumor , щелкнув правой кнопкой мыши аннотацию в списке слева; выберите Задать свойства и введите имя.
- Чтобы получить ROI для IM, разверните существующий ROI от опухолевой области, выбрав: Объекты | Аннотации... | Разверните аннотации.
- Выберите, каким должен быть радиус расширения, и выберите Удалить внутреннее и Ограничить родительским (Рисунок 5D).
- Нажмите на значок контрастности, выберите канал автофлуоресценции и отрегулируйте интенсивность, чтобы сделать ее оптимально видимой.
- Нажмите палочку и отрегулируйте ROI, нажимая клавишу Alt , чтобы сгладить ROI снаружи и удалить любой фон, который не должен быть частью этого ROI.
- Присвойте ROI подходящее имя, например инвазивное поле или IM , щелкнув правой кнопкой мыши аннотацию в списке слева, выберите Задать свойства, введите имя и при необходимости измените его цвет на зеленый.
- Сохраните аннотации: Файл | Экспорт объектов | Экспортируйте все объекты и нажмите OK с выбором по умолчанию в разделе Экспортировать как FeatureCollection и сохраните его в нужном месте.
8. Обнаружение иммунных клеток
- Поскольку ImmuNet использует данные компонентов (многоканальные файлы TIFF) как для обучения, так и для вывода, разделите аннотации на обучающие и проверочные наборы. Чтобы обучить модель, выполните действия, описанные в файле сведений репозитория, заменив пример набора данных и аннотаций нужными данными. Помимо различных иммунных клеток, предоставьте модели отрицательные примеры, сделав фоновые аннотации в местах, которые не должны быть распознаны как представляющие интерес клетки: опухолевые клетки, другие клетки или «без клеток» (структуры, которые можно спутать с представляющими интерес клетками); подробности см. в публикации ImmuNet32.
- Используя аннотации проверки, убедитесь, что производительность удовлетворительна. Посмотрите на частоту ошибок для каждого типа аннотации — долю аннотаций проверки, которые модель не обнаружила — самый простой показатель оценки. Оцените производительность с точки зрения ложных срабатываний, сделав несколько полностью аннотированных ROI и рассчитав F-оценки.
- В дополнение к количественной оценке проведите визуальный анализ прогноза, чтобы получить качественное представление об ошибках, которые модель склонна допускать (Рисунок 6, Дополнительный файл 6: Дополнительный рисунок S4 и Дополнительный рисунок S5). Если производительность модели оценивается как недостаточная, визуализируйте прогноз для некоторых плиток, как описано в репозитории, и проверьте, какие сайты наиболее подвержены ошибкам. Сделайте больше аннотаций на таких сайтах и повторно запустите обучение и оценку модели.
- Когда целевая производительность будет достигнута, запустите вывод для всего набора данных, как описано в разделе Вывод для всего набора данных файла сведений репозитория. Используйте полученные .csv файлы с предсказанием модели в качестве входных данных для анализа данных (напишите для этого скрипт на Python или R).
9. Прогнозирование, фенотипирование и анализ данных
ПРИМЕЧАНИЕ: В этом разделе мы приводим пример простого анализа данных для одного образца меланомы, окрашенного с помощью панели лимфоцитов, которая сочетает в себе расположение иммунных клеток, идентифицированных с помощью ImmuNet (раздел 8), и ROI, очерченные с помощью QuPath (раздел 7). Анализ выполнен в R 4.1.1 (сценарий предоставлен в виде дополнительного файла 8). Для скрипта требуются пакеты: plyr 1.8.8, dplyr 1.0.8, tidyr 1.2.0, sf 1.0-7, ggplot2 3.4.0, RANN 2.6.1 и RColorBrewer 1.1-2, которые можно установить с помощью команды install.packages(). В качестве входных данных он берет файл .csv с предсказанием образца ImmuNet и файл с ROI, экспортированный из QuPath. Шаги 9.1-9.6 описывают анализ одной выборки, выполненный в предоставленном скрипте, а разделы 9.7-9.9 описывают варианты анализа нескольких выборок.
- После загрузки предсказания ImmuNet в R определите пороговые значения для предсказанной экспрессии маркеров, построив графики маркеров, определяющих фенотипы, относительно друг друга и выбрав пороговые значения, которые лучше всего разделяют популяции.
ПРИМЕЧАНИЕ: Стратегия стробирования, используемая для данного образца, показана на рисунке 7B. Стратегии стробирования для панелей миелоидных и дендритных клеток показаны в Дополнительном файле 6: Дополнительный рисунок S6 и Дополнительный рисунок S7. - После определения пороговых значений используйте их, чтобы присвоить каждому прогнозу ImmuNet фенотип, определенный на панели. В некоторых прогнозах следует обратить внимание на то, что ни один из прогнозируемых маркеров не превышает порогового значения, или комбинация маркеров, считающаяся экспрессированной после порогового значения, может быть несогласованной (например, прогнозы CD3+ CD20+ в панелях лимфоцитов). Если на шаге 8.3 достигнута хорошая производительность модели, доля таких прогнозов будет небольшой; Отфильтруйте их перед анализом.
- Чтобы отдельно проанализировать ROI для опухоли и ее инвазивного края до 100 мкм, нарисованного в QuPath, загрузите соответствующие файлы GeoJSON в R, и для каждого прогноза определите ROI, в который попадает прогноз.
- Для проверки здравого смысла и в рамках исследовательского анализа данных визуализируйте иммунные клетки, обнаруженные в образце, отдельно в соответствующих ROI вместе с границами ROI (рис. 7A).
- Теперь рассчитайте плотность различных иммунных клеток отдельно для каждого ROI. Плотности, обнаруженные в данном образце, приведены в таблице 1.
- Если доступно несколько образцов, визуализируйте распределение плотности клеток. Логарифмическое преобразование значений плотности для получения нормально распределенных значений.
ПРИМЕЧАНИЕ: Когда количество определенных фенотипов равно 0, они не могут быть преобразованы Log, что приводит к отсутствующим значениям. Чтобы решить эту проблему, можно применить сглаживание ЛаПласиа, добавив 0,5 ко всем ячейкам перед делением на площадь поверхности. - Проанализируйте значения плотности и постройте их на график с помощью выбранного программного обеспечения (рис. 8).
- Сохраненные местоположения ячеек позволяют проводить пространственный анализ. Например, для каждой обнаруженной иммунной клетки найдите ближайшего соседа, а затем для каждого фенотипа вычислите процент случаев, когда различные фенотипы встречаются как ближайший сосед.
ПРИМЕЧАНИЕ: Поскольку количество естественных киллеров (NK) клеток, обнаруженных в этом образце, было очень малым, мы исключили их из этого анализа. Полученные результаты для ROI опухоли и ИМ приведены на рисунке 9.
Результаты
Блоки FFPE, содержащие опухолевую ткань, были выбраны на основании патологоанатомических заключений и HE-окрашенных стекол. Когда у пациента удаляются множественные опухолевые поражения и/или образцы опухоли имеют большие размеры, они разделяются на несколько блоков FFPE. Мы предпочитаем анализировать иммунные клетки как в опухолевом компартменте, так и в так называемом инвазивном крае (ИМ) опухоли. ИМ представляет собой доброкачественную стромальную ткань, которая прилегает к опухоли. Таким образом, при наличии нескольких блоков FFPE для одного образца опухоли выбираются блоки FFPE, которые содержат оба типа тканей. Как видно на HE-окрашенных предметных стеклах, один блок FFPE содержал опухолевую ткань и стромальную ткань, прилегающие к опухоли (Рисунок 1A). Другой блок FFPE из той же опухоли содержал гораздо меньше окружающей стромальной ткани (рис. 1B). Однако для некоторых образцов тканей нет выбора в блоках FFPE или IM отсутствует ни в одном из блоков FFPE. Это часто имеет место при биопсии (игольчатой), о чем необходимо помнить при интерпретации данных.
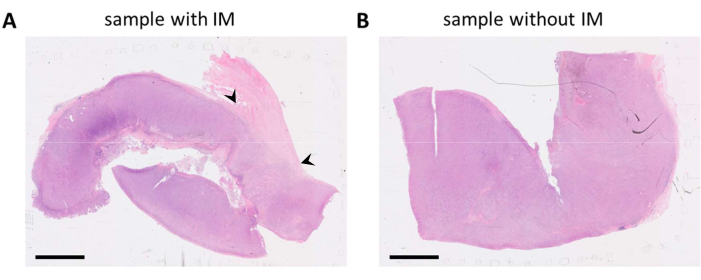
Рисунок 1: Окрашенные HE слайды образца опухоли меланомы. (A) Пример образца опухоли со стромальной тканью, прилегающей к опухоли (ВМ) в правом верхнем углу образца (обозначено черными стрелками). (B) Другой образец из того же опухолевого поражения, в котором стромальная ткань практически отсутствует. Масштабные линейки = 5 мм. Сокращения: HE = гематоксилин и эозин; IM = инвазивная граница. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Мультиплексное окрашивание IHC с помощью предлагаемой семицветной панели (Дополнительный файл 4) может быть выполнено либо вручную в течение 3-дневного процесса окрашивания (с учетом нормального рабочего времени), либо в течение ночи в автоокрашивателе. При использовании автоокрашивателя секции должны быть установлены в определенном месте на предметном стекле, что обеспечивает оптимальную гидродинамику системы (Рисунок 2A). Когда секции правильно установлены на слайдах (Рисунок 2B), они будут равномерно окрашены (Рисунок 2C). Если секции не установлены оптимально на предметном стекле (Рисунок 2D), это часто приводит к неоптимальному рисунку окрашивания (Рисунок 2E), поскольку жидкость автоокрашивателя не достигает (полной) ткани. Это может произойти, когда образцы очень большие или когда смонтированные предметные стекла предоставлены кем-то, кто не знает об этой проблеме. В этих случаях для анализа следует выбирать только хорошо окрашенную часть предметного стекла. Другим вариантом для таких образцов может быть окрашивание их вручную, чтобы оптимально распределить жидкости.
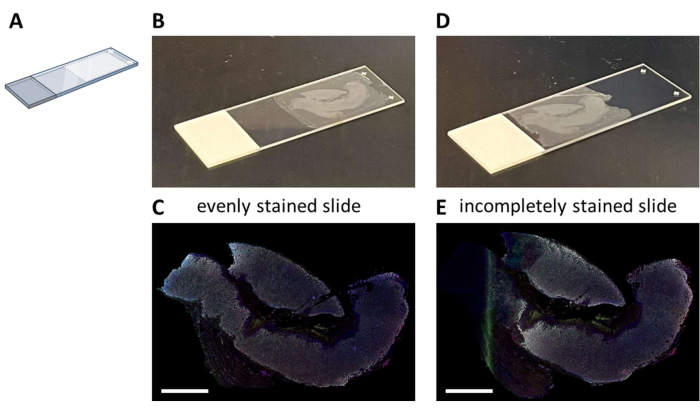
Рисунок 2: Крепление секции FFPE к предметному стеклу и удар. (A) Схема места установки на предметное стекло для оптимального окрашивания автоморилки. (B) Пример правильно установленного предметного стекла. (C) Правильно установленные предметные стекла приводят к равномерному окрашиванию участка ткани. (D) Пример неоптимально установленной горки. (E) Неоптимально установленные предметные стекла могут привести к неполному разрезу окрашенной ткани, как видно на левой стороне этого рисунка. Масштабные линейки = 5 мм. Аббревиатура: FFPE = формалин-фиксированный и парафин-инфильтрованный. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Когда эксперименты с большой мультиплексной ИГХ проводятся в несколько циклов окрашивания и необходимо приготовить большое количество растворов, лучше всего сначала протестировать эти реагенты в моноплексной ИГХ, прежде чем приступать к мультиплексной ИГХ. Моноплексный ИГХ проверяется с помощью цифрового сканера патологии на ожидаемые закономерности окрашивания, а время экспозиции устанавливается с помощью соответствующих фильтров на контрольных предметных стеклах (рис. 3A-H). Ткань миндалин используется в качестве положительного контроля для большинства маркеров иммунных клеток. Поскольку время воздействия DAPI в контрольной ткани миндалин всегда выше, чем в других тканях (рисунок 3G), время воздействия DAPI должно быть установлено в зависимости от типа ткани, которую необходимо изучать. Обычное время экспозиции при этом типе сканирования составляет от 1 мс до 30 мс, в зависимости от флуорофора и фильтра (рис. 3I). Когда моноплексная ИГХ превышает эти цифры или картина окрашивания не так четка, как ожидалось, раствор антитела следует скорректировать или заменить. В показанном здесь примере мы решили увеличить концентрацию FOXP3 (рис. 3C и рис. 3I), чтобы интенсивность была больше в диапазоне с другими маркерами. Аутофлуоресценция также может быть сильнее в других тканях, чем в контрольной ткани миндалин. В наших настройках время экспозиции для фильтра Sample AF составляет от 25 мс до 50 мс (рис. 3H,I).

Рисунок 3: Настройка времени воздействия на моноплексные ИГХ и неокрашенные контрольные образцы. (A) Сигнал CD20 - Opal 480 в контрольной ткани миндалин. (B) Сигнал CD3 - Opal 520 в контрольной ткани миндалин. (C) FOXP3 - сигнал Opal 570 в контрольной ткани миндалин. (D) CD56 - сигнал Opal 620 в контрольной ткани миндалин (E) CD8 - сигнал Opal 690 в контрольной ткани миндалин. (F) Онкомаркер - сигнал Opal 780 в контрольной ткани миндалин. (G) Сигнал DAPI в контрольной ткани миндалин часто слабее, чем интересующий тип ткани. (H) Аутофлуоресценция - образец сигнала ФП в ткани, контролирующей опухоль. (I) Скриншот времени экспозиции перед его корректировкой на 10% и проверкой на мультиплексных слайдах, окрашенных IHC. Масштабные линейки = 100 μм. Сокращения: AF = автофлуоресценция; ИГХ = иммуногистохимия; DAPI = 4'6-диамидино-2-фенилиндол. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
После выполнения мультиплексной ИГХ время экспозиции корректируется в соответствии с настройками моноплексной ИГХ путем проверки нескольких слайдов мультиплексной ИГХ и выбора автоэкспонирования. При этом типе сканирования нет возможности защиты от насыщения, поэтому крайне важно не устанавливать слишком высокую экспозицию, тем самым избегая передержки. Чрезмерное воздействие препятствует спектральному расмешиванию флуорофоров. Мы часто не устанавливаем время воздействия, превышающее время воздействия, которое было основано на моноплексной ИГХ, и мы уменьшаем время воздействия только для маркеров, которые сильнее в мультиплексной ИГХ (Рисунок 3G и Рисунок 4A). При автоматической экспонировании в разных местах на нескольких слайдах можно заметить, что время экспозиции некоторых фильтров все еще слишком велико. Они должны быть отрегулированы до наименьшего значения, которое наблюдается при использовании настройки автоматического воздействия, и вычесть еще 10% от значения, чтобы предотвратить чрезмерное воздействие в других невидимых местах (рис. 4A). При использовании этого метода время экспозиции для определенных фильтров может быть меньше, чем те, которые были установлены на моноплексном IHC. Тем не менее, при успешном эксперименте с мультиплексной ИГХ все маркеры должны быть наблюдаемы, по крайней мере, на контрольном стекле (Рисунок 4B-H, Дополнительный файл 6: Дополнительный рисунок S1 и Дополнительный рисунок S2). Учтите, что определенные маркеры могут присутствовать не в каждом образце. Включение контрольного предметного стекла, содержащего по крайней мере секцию миндалины, может быть проверено успешное окрашивание всех маркеров стандартных панелей и уровень сигнала.
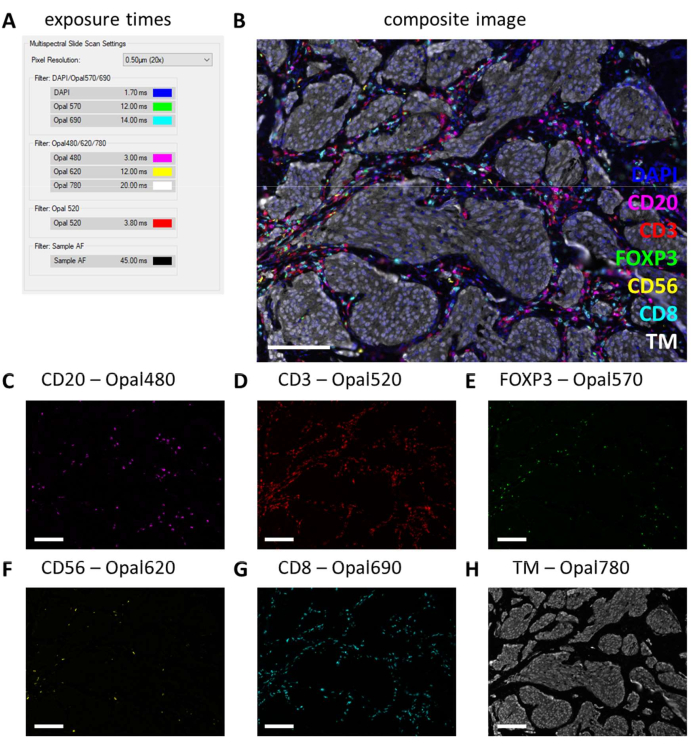
Рисунок 4: Пример успешно окрашенного среза с лимфоцитарной панелью в образце опухоли меланомы. (A) Время экспозиции, использованное для записи этого мультиплексного образца ИГХ. (B) Составное изображение мультиплексной панели лимфоцитов ИГХ в опухолевой ткани. (C) CD20 - Opal 480 сигнал пурпурного цвета. (D) CD3 - Opal 520 сигнал красного цвета. (E) FOXP3 - Опал 570 сигнал зеленого цвета. (F) CD56 - Opal 620 сигнал желтого цвета. (G) CD8 - Опал 690 сигнал голубого цвета. (H) TM - Opal 780 в белом цвете. Масштабные линейки = 100 μм. Аббревиатура: ТМ = онкомаркер; ИГХ = иммуногистохимия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Мультиплексные слайды IHC полностью сканируются цифровым тепловизором. Плитки для последующего анализа выбираются в просмотрщике слайдов. Однако, когда необходимо проанализировать более конкретные области, такие как опухоль или внутримышечное введение, эти области интереса (ROI) могут быть нарисованы с помощью QuPath. После завершения пакетной обработки фрагментов, выбранных в просмотрщике слайдов, файлы компонентов снова объединяются (рисунок 5A и дополнительный файл 7). Используя канал онкомаркеров (Рисунок 5B) и инструмент «Волшебная палочка» в QuPath, контур опухоли может быть прослежен для формирования «ROI опухоли» (Рисунок 5C). Затем ROI опухоли может быть расширен на определенное расстояние, в данном случае на 500 мкм, для создания «ROI инвазивной окраины» (рисунок 5D). Любой нежелательный фон (не тканевый) удаляется из этого ROI с помощью волшебной палочки путем просмотра сигнала автофлуоресценции (рис. 5E). Как Tumor ROI, так и IM ROI сохраняются в виде файла GeoJSON для дальнейшей обработки (рис. 5F).
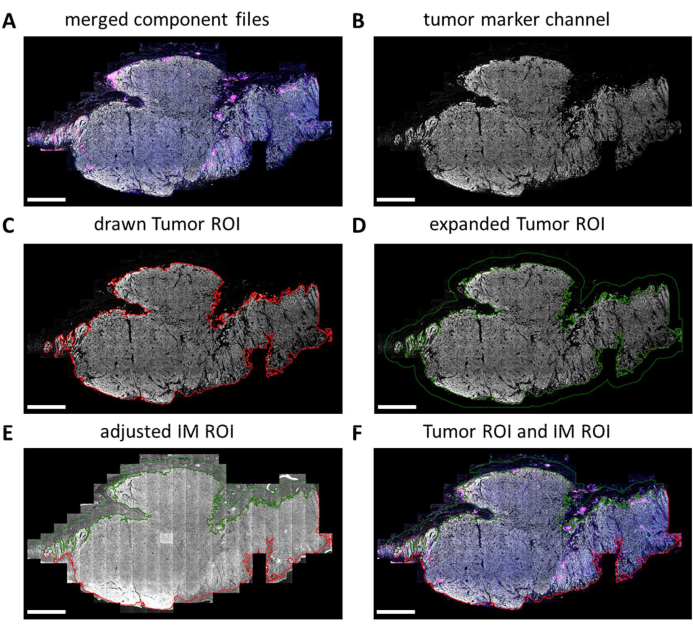
Рисунок 5: Процесс рисования ROI опухоли и инвазивной маржи ROI в QuPath. (A) Объединенные файлы компонентов. (B) Изображение в оттенках серого, показывающее только канал онкомаркера. (C) ROI опухоли строится вокруг сигнала онкомаркера. (D) Новый ROI достигается путем расширения ROI опухоли на 100-500 мкм для формирования IM ROI. (E) Внутримышечный ROI корректируется таким образом, чтобы включать только стромальную ткань путем исключения фонового (отрицательного сигнала) и других крупных тканевых структур, таких как жир, кровеносные сосуды и волосяные фолликулы. (F) Полученные ROI опухоли и IM ROI сохраняются и экспортируются в файлы GeoJSON для дальнейшей обработки регионов. ROI опухоли отображается красным контуром, а ROI IM — зеленым контуром. Масштабные линейки = 2 мм. Сокращения: ROI = область интереса; IM = инвазивный край; GeoJSON = географическая нотация объектов JavaScript. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Сети ImmuNet могут быть использованы для обнаружения иммунных клеток. Что касается панели лимфоцитов, экспериментальное композитное изображение (рисунок 6A) можно визуально сравнить с иммунными клетками, обнаруженными программным обеспечением (рисунок 6B). Аналогичные визуальные сравнения можно провести для миелоидной панели (Дополнительный файл 6: Дополнительный рисунок S4) и панели дендритных клеток (Дополнительный файл 6: Дополнительный рисунок S5).
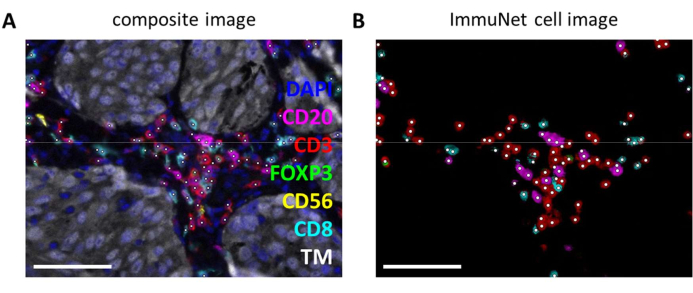
Рисунок 6: Лимфоциты, распознанные ImmuNet. (A) Составное изображение рисунка 4B , показывающее клетки, распознанные ImmuNet, с белыми точками. (B) Клетки, распознанные ImmuNet, и последующая обнаруженная экспрессия маркеров. Масштабные линейки = 50 μм. Сокращение: ТМ = онкомаркер. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Иммунные клетки, обнаруженные ImmuNet и сохраненные в .csv формате, могут быть импортированы на любой язык программирования для дальнейшего анализа. Мы выполнили пространственную визуализацию и стробирование в R (Дополнительный файл 8). Затем обнаруженные клетки могут быть визуализированы в пространстве (Рисунок 7A, Дополнительный файл 6: Дополнительный рисунок S6 и Дополнительный рисунок S7). Гейтирование экспрессии псевдомаркеров может быть выполнено для фенотипирования отдельных иммунных клеток (рис. 7B).
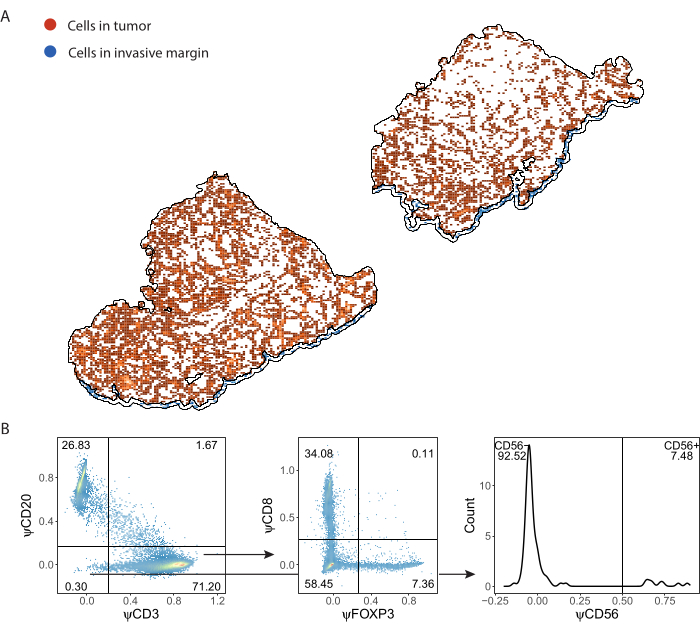
Рисунок 7: Стратегия стробирования лимфоцитарной панели. (A) Иммунные клетки, обнаруженные в областях интереса опухоли и инвазивного края, очерченных с помощью QuPath. (B) Стробирование всех клеток, обнаруженных ImmuNet из части А. Лимфоциты сначала запираются на CD20+ В-клетки и CD3+ Т-клетки. CD3+ Т-клетки дополнительно затворяются для экспрессии CD8 и FOXP3. Популяция CD20-CD3- закрыта для CD56+ естественных клеток-киллеров. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Когда фенотипы предсказанных клеток определяются с помощью гейтинга, плотности клеток различных фенотипов могут быть рассчитаны в пределах различных ROI. Это рассчитывается путем деления общего числа клеток на фенотип на площадь поверхности ROI (Таблица 1, Рисунок 8 и Дополнительный файл 8). Здесь В-клетки определяются как CD3-CD20+, хелперные Т-клетки как CD3+CD20-CD8-FoxP3-, регуляторные Т-клетки как CD3+CD20-CD8-FoxP3+, цитотоксические Т-клетки как CD3+CD20-CD8+FoxP3-, а NK-клетки как CD3-CD20-CD56+.
| Фенотип | Плотность в опухоли (клеток/мм2) | Плотность в IM (ячейки/мм2) |
| В-клетка | 185.74 | 145.62 |
| Хелпер Т-клетка | 301.46 | 157.51 |
| Регуляторные Т-клетки | 38.53 | 19.53 |
| Цитотоксические Т-клетки | 185.35 | 83.21 |
| NK-элемент | 0.18 | 0 |
Таблица 1: Плотности фенотипов в ROI. Плотности клеток различных фенотипов, обнаруженных в одном образце меланомы, окрашенном лимфоцитарной панелью. Плотности рассчитываются отдельно в ROI опухоли и IM. Сокращения: IM = инвазивный край; ROI = область интереса.
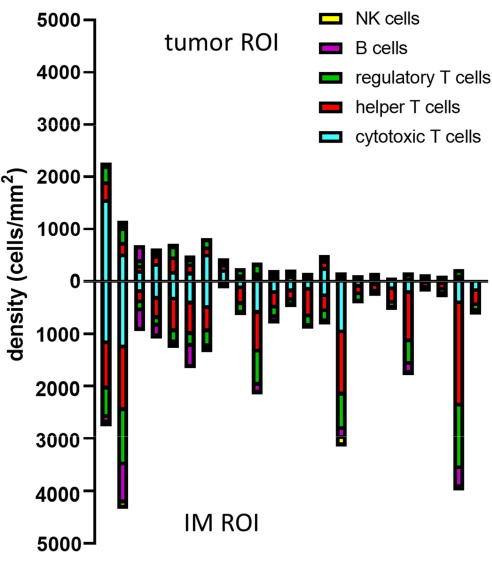
Рисунок 8: Пример анализа данных для нескольких образцов. Анализ плотности различных фенотипов лимфоцитов в опухоли и ИМ 23 первичных опухолей меланомы. Сокращения: IM = инвазивный край; ROI = область интереса. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Чтобы глубже погрузиться в пространственную информацию об этих иммунных клетках, можно также определить расстояния между идентифицированными фенотипами или процентное соотношение фенотипов ближайших соседей в выборке (рис. 9).
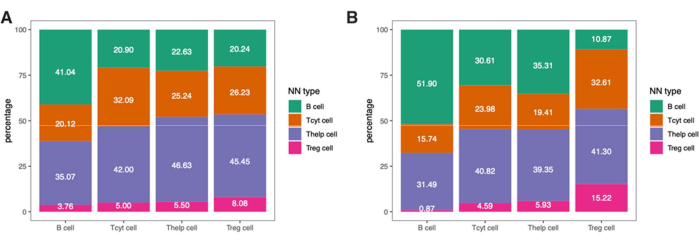
Рисунок 9: Пример анализа по принципу ближайшего соседа для одного образца. Процент фенотипов ближайшего соседа для различных типов клеток в (A) Tumor и (B) IM ROI, обнаруженных в одном образце меланомы, окрашенном лимфоцитарной панелью. Сокращения: IM = инвазивный край; ROI = область интереса. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный файл 1: Multiplex IHC с обобщением спецификаций протокола. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2: Протокол автоокрашивания для моноплекса. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 3: Протокол автоокрашивания для компенсации автофлуоресценции. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 4: Протокол автоокрашивания для мультиплексной иммуногистохимии. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 5: Шаблон .csv файл. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 6: Панели миелоидных и дендритных клеток в образце ткани меланомы; маркерные стекла в случае неудачного сканирования; миелоидные и дендритные клетки, распознаваемые ImmuNet; стратегии гейтирования панелей миелоидных и дендритных клеток. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 7: Скрипт сшивания QuPath. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 8: Скрипт анализа данных. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Пространственный анализ ТМЭ является востребованным методом для получения дополнительной информации об иммунных клетках и открытия новых прогностических и прогностических биомаркеров, особенно в области иммуноонкологии16. Для этой цели разрабатывается множество различных методов, включающих обнаружение белков, транскриптов мРНК или их комбинации, с оценкой до 100-1000 мишеней. Тем не менее, более высокая мультиплексация достигается за счет менее высокопроизводительных экспериментов, более высоких затрат на эксперименты и технических проблем, и часто только небольшая часть TME может быть проанализирована. Мультиплексная ИГХ с использованием метода на основе TSA, который мы описываем здесь, обнаруживает шесть различных маркеров + DAPI одновременно, относительно дешевле в выполнении, а целые срезы ткани визуализируются менее чем за 20 минут, готовые к полному анализу. Эта методика стала менее сложной с автоматизацией процедуры окрашивания. Усовершенствования в мультиспектральном микроскопе, которые включают в себя добавление двух дополнительных фильтров, значительно улучшили время расмешивания спектров и сканирования. Можно одновременно обнаруживать до восьми различных маркеров + DAPI. Однако, расширяя мультиплексирование большим количеством маркеров, вышеупомянутые преимущества исчезают, поскольку спектральное размешивание становится более сложным, а время сканирования целых слайдов значительно увеличивается. Предпринимаются усилия по стандартизации мультиплексной ИГХ между различными учреждениями для облегчения внедрения в диагностических условиях. Для этой стандартизации мультиплексной IHC мы советуем пользователям придерживаться более доступного протокола с шестью различными маркерами + DAPI. Тем не менее, все же необходимы некоторые технические ноу-хау, а последующий анализ может быть сложным, для чего мы разработали методологии, описанные в этом протоколе.
Стандартизация начинается с разработки мультиплексных панелей IHC. Важность выбора первичных антител, обнаруживающих определенные белковые мишени, была подчеркнута до17. Наши мультиплексные панели ИГХ в основном разрабатываются с использованием первичных клонов антител, которые также используются и проверяются на ИГХ в нашем диагностическом отделении. Однако в случае мультиплексной панели ИГХ дендритных клеток большинство антител не использовались в диагностических условиях (van der Hoorn et al., рукопись в представлении). Чтобы обеспечить специфичность и свести к минимуму различия в партиях, мы решили использовать моноклональные антитела вместо поликлональных антител, а также валидировали большинство антител с использованием трансфицированных клеточных линий и первичных клеток. На протяжении многих лет различные версии мультиплексных панелей IHC использовались в многочисленных исследованиях с использованием системы Vectra 3 18,21,23,24,25,26,27,28,29,30,31,32. Чтобы оптимально реализовать эти мультиплексные панели IHC в системе PhenoImager HT, необходимо было внести некоторые коррективы в комбинации первичных антител и флуорофора. Чтобы получить преимущества от лучшего спектрального расмешивания и более быстрого сканирования целых срезов ткани, необходимо использовать новейшие флуорофоры Opal480 и Opal780 и отказаться от использования флуорофоров Opal540 и Opal650 в семицветных мультиплексных панелях IHC. Время сканирования в ~3-10 раз быстрее в зависимости от размера участка ткани. Регулировка мультиплексной панели IHC была довольно простой задачей, но необходимо учитывать некоторые соображения. Флуоресцентный спектр Opal480 сильно перекрывается со спектром автофлуоресценции и, следовательно, препятствует спектральному расмешению эритроцитов и других автофлуоресцентных структур. Использование повышенной концентрации первичного антитела в паре с Opal480 решало этот вопрос в большинстве случаев. Использование запатентованного фильтра Sample AF на PhenoImager HT позволяет избежать смешивания Opal480 и автофлуоресценции. Тем не менее, лучше всего использовать первичное антитело, которое дает четкий сигнал при использовании с Opal480, чтобы его сигнал был выше, чем аутофлуоресценция.
Несмотря на то, что эти мультиплексные панели IHC уже созданы, необходимо учитывать возможность их вариативности от партии к партии. Выполняя контроль моноплексной ИГХ перед началом полного эксперимента с мультиплексной ИГХ, мы иногда наблюдали, что первичные антитела действуют либо сильнее, либо слабее от эксперимента к эксперименту. Причинами этого могут быть ошибки в пипетировании, неоптимальные условия хранения реагентов и срок годности. Мы решили эту проблему, скорректировав решение первичного антитела на основе нашего опыта. Даже если ни одна из вышеупомянутых корректировок не должна быть выполнена, при каждом эксперименте с мультиплексной партией ИГХ важно устанавливать время экспозиции на основе моноплексных ИГХ-окрашенных контрольных стекол.
Поскольку наши исследования изначально были сосредоточены на различных типах карцином и меланомы, мультиплексные панели ИГХ должны были быть взаимозаменяемыми между типами опухолей с минимальными корректировками. Таким образом, мы всегда включали несколько (опухолевых) типов тканей в процесс оптимизации и наблюдали, что разведения первичных антител к маркерам иммунных клеток могут оставаться одинаковыми между разными типами опухолей. Однако для выявления опухолевой ткани между карциномой и меланомой требуются разные онкомаркеры. Соответственно, онкомаркер всегда был оптимизирован для работы в конце каждой мультиплексной ИГХ-панели и в настоящее время всегда используется в сочетании с Opal780, который, по совпадению, также должен быть на последнем флуорофоре в процедуре мультиплексного окрашивания ИГХ. Используя опухолевый маркер в конце мультиплексной ИГХ, эти мультиплексные панели ИГХ могут быть легко заменены на другие типы опухолей, такие как глиобластома (т.е. GFAP) и лимфома Ходжкина (т.е. CD30). Для ангиосаркомы мы использовали эту мультиплексную панель ИГХ лимфоцитов с геном, специфичным для трансформации эритробластов (ЭРГ), в качестве опухолевого маркера с помощью всего двух экспериментов по оптимизации25. Оптимизация включала титрование первичного антитела ERG и тестирование мультиплексной панели ИГХ с ERG в конце.
Другие корректировки этих мультиплексных панелей ИГХ также могут быть выполнены путем замены определенного маркера иммунных клеток на другой иммунный или функциональный маркер. Каждое изменение требует оптимизации. Протокол оптимизации может быть выполнен так, как описано ранее17. Некоторые изменения в предлагаемых мультиплексных панелях IHC будут мешать алгоритмам ImmuNet, которые мы создали. Необходимо сгенерировать достаточное количество данных и затратить время на внедрение этих изменений в алгоритм (не менее 750 аннотаций для каждого нового маркера и/или фенотипа клетки и 150 аннотаций для валидации ранее обученных маркеров). Представленные здесь панели не содержат функциональных маркеров, хотя внедрение маркеров иммунных контрольных точек, таких как PD-1 и PD-L1, в мультиплексные панели ИГХ выполняется в нашей лаборатории. Однако анализ маркеров, которые менее бинарны в отрицательных и положительных сигналах, оказался более сложным и является областью активных исследований в нашей группе.
Количество маркеров, которые можно одновременно оценить с помощью мультиплексной ИГХ, ограничено по сравнению с другими новыми методами. Хотя это можно обойти, анализируя различные панели на последовательных срезах блока FFPE, будет трудно сравнить эти срезы в пространстве. Ориентация и сложенные артефакты, скорее всего, не будут такими же после подготовки слайдов. Тем не менее, мультиплексная ИГХ вполне доступна, что делает ее привлекательным инструментом для большего числа учреждений и исследователей и, следовательно, более подходящей для будущего внедрения в диагностических условиях. Благодаря стандартизации мультиплексных панелей иммунных клеток ИГХ для нескольких типов опухолей и последующих аналитических процессов можно получить больше знаний о различиях в ТМЭ между пациентами и типами опухолей. Это может, например, привести к более глубокому пониманию роли ТМЭ в противоопухолевом ответе на специфические методы лечения. Это может даже привести к появлению новых биомаркеров для прогнозирования таких факторов, как реакция на лечение и ожидаемая выживаемость. В целом, это может позволить мультиплексной ИГХ стать клиническим инструментом, помогающим в принятии клинических решений в рамках персонализированного медицинского подхода. Следует признать, что большее количество этапов процедуры анализа, вероятно, должно быть автоматизировано и стандартизировано, чтобы ее можно было использовать в повседневных диагностических условиях, поэтому на данный момент это в основном футуристическая перспектива.
Анализ нескольких маркеров на одном предметном стекле может быть очень мощным инструментом, несмотря на его технические сложности. Благодаря стандартизированным экспериментальным протоколам и надежному методу анализа, как мы описали здесь с использованием ImmuNet, количественная оценка множественных маркеров делает его более информативным, чем классическая ИГХ, в то время как мультиплексная ИГХ остается относительно высокопроизводительной по сравнению с новыми экспериментальными методами с более высоким уровнем плекса.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
PhenoImager HT был приобретен за счет средств, предоставленных Медицинским центром Университета Радбуда и Технологическим центром микроскопии Радбуда. Муковисцидоз финансируется грантом Голландского онкологического общества (10673) и грантом ERC Adv ARTimmune (834618). JT получает финансовую поддержку за счет гранта NWO Vidi (VI.Vidi.192.084). Авторы благодарят Эрика ван Динтера (Eric van Dinther) и Анкура Анкана (Ankur Ankan) за помощь в создании рабочих процессов для хранения мультиплексных данных IHC, а Бенгта Фунга (Bengt Phung) за инструкции по реализации мультиплексных данных IHC в QuPath для рисования ROI.
Материалы
| Name | Company | Catalog Number | Comments |
| anti-CD14 | Cell Marque | 114R-16 | section 3, clone EPR3653 |
| anti-CD163 | Cell Marque | 163M-15 | section 3, clone MRQ-26 |
| anti-CD19 | Abcam | ab134114 | section 3, clone EPR5906 |
| anti-CD1c (BDCA1) | Thermo Scientific | TA505411 | section 3, clone OTI2F4 |
| anti-CD20 | Thermo Scientific | MS-340-S | section 3, clone L26 |
| anti-CD3 | Thermo Scientific | RM-9107 | section 3, clone sp7 |
| anti-CD303/BDCA2 | Dendritics via Enzo Lifesciences/Axxora | DDX0043 | section 3, clone 124B3.13 |
| anti-CD56 | Cell Marque | 156R-94 | section 3, clone MRQ-42 |
| anti-CD66b | BD Biosciences | 555723 | section 3, clone G10F5 |
| anti-CD68 | Dako Agilent | M087601 | section 3, clone PG-M1 |
| anti-CD8 | Dako Agilent | M7103 | section 3, clone C8/144B |
| anti-Foxp3 | Thermo Scientific | 14-4777 | section 3, clone 236A/E7 |
| anti-Gp100 | Dako Agilent | M063401 | section 3, clone HMB45 |
| anti-HLA-DR, DP, DQ | Santa Cruz | sc-53302 | section 3, clone CR3/43 |
| anti-MART-1 | Thermo Scientific | MS-799 | section 3, clone A103 |
| anti-pan cytokeratin | Abcam | ab86734 | section 3, clone AE1/AE3 + 5D3 |
| anti-SOX10 | Sigma Aldrich | 383R | section 3, clone EP268 |
| anti-Tyrosinase | Sanbio | MONX10591 | section 3, clone T311 |
| anti-XCR1 | Cell Signaling Technologies via Bioké | 44665S | section 3, clone D2F8T |
| antibody diluent | Akoya BioSciences | SKU ARD1001EA | section 3, from Opal 7-Color Automation IHC Kit 50 slide (can optionally also be replaced by TBST with 10% BSA) |
| Bond Aspirating Probe | Leica Biosciences | S21.0605 | section 3 |
| Bond Aspirating Probe Cleaning | Leica Biosciences | CS9100 | section 3 |
| Bond Dewax Solution | Leica Biosciences | AR9222 | section 3 |
| Bond Objectglas label + print lint | Leica Biosciences | S21.4564.A | section 3 |
| Bond Research Detection System 2 | Leica Biosciences | DS9777 | section 3 |
| Bond RX autostainer | Leica Biosciences | - | section 3, automated platform |
| Bond TM Epitope Retrieval 1 - 1 L | Leica Biosciences | AR9961 | section 3 |
| Bond TM Epitope Retrieval 2 - 1 L | Leica Biosciences | AR9640 | section 3 |
| Bond TM Wash Solution 10x - 1 L | Leica Biosciences | AR9590 | section 3 |
| BOND Universal Covertile | Leica Biosciences | S21.4611 | section 3 |
| Bond(TM) Titration Kit | Leica Biosciences | OPT9049 | section 3 |
| Coverslip 24 x 32 mm #1 (0.13-0.16 mm) | Fisher Scientific | 15717592 | section 2 |
| coverslip 24 x 50 mm | VWR | 631-0146 | section 2 |
| DAPI Fluoromount-G | VWR | 0100-20 | section 3, whenever monoplex slides need to be quickly checked, not for official analysis, then DAPI is stained seperately for better results |
| Eosine | section 2, home made | ||
| Ethanol 99.5% | VWR | 4099.9005 | section 2 |
| Fluoromount-G | VWR | 0100-01 | section 3 |
| haematoxyline | - | section 2, home made | |
| ImmuNet | - | immune cell detection and phenotyping pipeline | |
| inForm software 2.4.10 | Akoya BioSciences | - | section 4 & 6 |
| OPAL 480 reagent pack | Akoya BioSciences | FP1500001KT | section 3 |
| OPAL 520 reagent pack | Akoya BioSciences | FP1487001KT | section 3 |
| OPAL 570 reagent pack | Akoya BioSciences | FP1488001KT | section 3 |
| OPAL 620 reagent pack | Akoya BioSciences | FP1495001KT | section 3 |
| OPAL 690 reagent pack | Akoya BioSciences | FP1497001KT | section 3 |
| OPAL 780 reagent pack | Akoya BioSciences | FP1501001KT | section 3 |
| Opal 7-Color Automation IHC Kit 50 slide | Akoya BioSciences | NEL821001KT | section 3 |
| PhenoChart 1.1.0 | Akoya BioSciences | - | section 5 |
| PhenoImagerHT | Akoya BioSciences | CLS143455 | section 4, digital pathology imager with slide viewer and imaging software (formerly known as Vectra Polaris) |
| Quick-D mounting medium | Klinipath | 7280 | section 2 |
| QuPath 0.3.2 | whole slide image analysis software platform | ||
| R 4.1.1 | |||
| Slide boxes | VWR | 631-0737 | section 1 |
| SuperFrost Plus | Thermo Scientific through VWR | 631-9483 | section 1 |
| Vectra Polaris software 1.0.13 | Akoya BioSciences | - | section 4 |
| Xylene | VWR | 4055-9005 | section 2 |
Ссылки
- Dunn, G. P., Bruce, A. T., Ikeda, H., Old, L. J., Schreiber, R. D. Cancer immunoediting: from immunosurveillance to tumor escape. Nature Immunology. 3 (11), 991-998 (2002).
- van der Woude, L. L., Gorris, M. A. J., Halilovic, A., Figdor, C. G., de Vries, I. J. M. Migrating into the tumor: a roadmap for T cells. Trends in Cancer. 3 (11), 797-808 (2017).
- Fridman, W. H., Pages, F., Sautes-Fridman, C., Galon, J. The immune contexture in human tumours: impact on clinical outcome. Nature Reviews. Cancer. 12 (4), 298-306 (2012).
- Fridman, W. H., et al. The immune microenvironment of human tumors: general significance and clinical impact. Cancer Microenvironment. 6 (2), 117-122 (2013).
- Pages, F., et al. International validation of the consensus Immunoscore for the classification of colon cancer: a prognostic and accuracy study. Lancet. 391 (10135), 2128-2139 (2018).
- Angell, H. K., Bruni, D., Barrett, J. C., Herbst, R., Galon, J. The Immunoscore: colon cancer and beyond. Clinical Cancer Research. 26 (2), 332-339 (2020).
- Angell, H., Galon, J. From the immune contexture to the Immunoscore: the role of prognostic and predictive immune markers in cancer. Current Opinion in Immunology. 25 (2), 261-267 (2013).
- Galon, J., et al. Cancer classification using the Immunoscore: a worldwide task force. Journal of Translational Medicine. 10, 205(2012).
- Galon, J., et al. World-wide Immunoscore Task Force: meeting report from the 34;Melanoma Bridge", Napoli, November 30th-December 3rd, 2016. Journal of Translational Medicine. 15 (1), 212(2017).
- Tumeh, P. C., et al. PD-1 blockade induces responses by inhibiting adaptive immune resistance. Nature. 515 (7528), 568-571 (2014).
- Creemers, J. H. A., et al. A tipping point in cancer-immune dynamics leads to divergent immunotherapy responses and hampers biomarker discovery. Journal for Immunotherapy of Cancer. 9 (5), e002032(2021).
- Blank, C. U., Haanen, J. B., Ribas, A., Schumacher, T. N. CANCER IMMUNOLOGY. The "cancer immunogram". Science. 352 (6286), 658-660 (2016).
- Teruya-Feldstein, J. The immunohistochemistry laboratory looking at molecules and preparing for tomorrow. Archives of Pathology & Laboratory Medicine. 134 (11), 1659-1665 (2010).
- Ramos-Vara, J. A., Miller, M. A., et al. When tissue antigens and antibodies get along: revisiting the technical aspects of immunohistochemistry--the red, brown, and blue technique. Veterinary Pathology. 51 (1), 42-87 (2014).
- Hegde, P. S., Karanikas, V., Evers, S. The where, the when, and the how of immune monitoring for cancer immunotherapies in the era of checkpoint inhibition. Clinical Cancer Research. 22 (8), 1865-1874 (2016).
- Parra, E. Novel platforms of multiplexed immunofluorescence for study of paraffin tumor tissues. Journal of Cancer Treatment and Diagnosis. 2 (1), 43-53 (2018).
- Gorris, M. A. J., et al. Eight-color multiplex immunohistochemistry for simultaneous detection of multiple immune checkpoint molecules within the tumor microenvironment. Journal of Immunology. 200 (1), 347-354 (2018).
- Roelofsen, T., et al. Spontaneous regression of ovarian carcinoma after septic peritonitis; a unique case report. Frontiers in Oncology. 8, 562(2018).
- van den Brand, D., et al. Peptide-mediated delivery of therapeutic mRNA in ovarian cancer. European Journal of Pharmaceutics and Biopharmaceutics. 141, 180-190 (2019).
- van den Brand, D., et al. EpCAM-binding DARPins for targeted photodynamic therapy of ovarian cancer. Cancers. 12 (7), 1762(2020).
- Di Blasio, S., et al. The tumour microenvironment shapes dendritic cell plasticity in a human organotypic melanoma culture. Nature Communications. 11 (1), 2749(2020).
- van Beek, J. J. P., et al. Human pDCs are superior to cDC2s in attracting cytolytic lymphocytes in melanoma patients receiving DC vaccination. Cell Reports. 30 (4), 1027-1038 (2020).
- Rodriguez-Rosales, Y. A., et al. Immunomodulatory aged neutrophils are augmented in blood and skin of psoriasis patients. Journal of Allergy and Clinical Immunology. 148 (4), 1030-1040 (2021).
- Hoeijmakers, Y. M., et al. Immune cell composition in the endometrium of patients with a complete molar pregnancy: Effects on outcome. Gynecologic Oncology. 160 (2), 450-456 (2021).
- van Ravensteijn, S. G., et al. Immunological and genomic analysis reveals clinically relevant distinctions between angiosarcoma subgroups. Cancers. 14 (23), 5938(2022).
- van der Woude, L. L., et al. Tumor microenvironment shows an immunological abscopal effect in patients with NSCLC treated with pembrolizumab-radiotherapy combination. Journal for Immunotherapy of Cancer. 10 (10), e005248(2022).
- Graham Martinez, C., et al. The immune microenvironment landscape shows treatment-specific differences in rectal cancer patients. Frontiers in Immunology. 13, 1011498(2022).
- Cortenbach, K. R. G., et al. Topography of immune cell infiltration in different stages of coronary atherosclerosis revealed by multiplex immunohistochemistry. International Journal of Cardiology. Heart & Vasculature. 44, 101111(2023).
- van Wilpe, S., et al. Homologous recombination repair deficient prostate cancer represents an immunologically distinct subtype. Oncoimmunology. 11 (1), 2094133(2022).
- Gorris, M. A. J., et al. Paired primary and metastatic lesions of patients with ipilimumab-treated melanoma: high variation in lymphocyte infiltration and HLA-ABC expression whereas tumor mutational load is similar and correlates with clinical outcome. Journal for Immunotherapy of Cancer. 10 (5), e004329(2022).
- van Wilpe, S., et al. Intratumoral T cell depletion following neoadjuvant chemotherapy in patients with muscle-invasive bladder cancer is associated with poor clinical outcome. Cancer Immunology, Immunotherapy. 72 (1), 137-149 (2023).
- Sultan, S., Gorris, M. A. J., Buytenhuijs, F., Lvan de Woude, L. A Segmentation-free machine learning architecture for immune land-scape phenotyping in solid tumors by multichannel imaging. bioRxiv. , (2021).
- Parra, E. R., et al. Immuno-profiling and cellular spatial analysis using five immune oncology multiplex immunofluorescence panels for paraffin tumor tissue. Scientific Reports. 11 (1), 8511(2021).
- Parra, E. R., et al. Validation of multiplex immunofluorescence panels using multispectral microscopy for immune-profiling of formalin-fixed and paraffin-embedded human tumor tissues. Scientific Reports. 7 (1), 13380(2017).
- Sun, Z., Nyberg, R., Wu, Y., Bernard, B., Redmond, W. L. Developing an enhanced 7-color multiplex IHC protocol to dissect immune infiltration in human cancers. PLoS One. 16 (2), e0247238(2021).
- LeicaBiosystems. BOND RX Fully Automated Research Stainer Protocols. , https://www.leicabiosystems.com/en-nl/ihc-ish/ihc-ish-instruments/bond-rx/ (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены