A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
CRISPR-Cas9 تحرير الجينوم لأجنة الفئران باستخدام الفيروس المرتبط بالغدي (AAV) والتثقيب الكهربائي للأجنة 2 خلية
In This Article
Summary
يقدم هذا البروتوكول نهجا محسنا لإنتاج نماذج الفئران المعدلة وراثيا. يستخدم الفيروس المرتبط بالغدي (AAV) لتقديم قالب إصلاح الحمض النووي ، ويستخدم التثقيب الكهربائي لتقديم كواشف CRISPR-Cas9 لإكمال عملية تحرير الجينوم في جنين 2-cell.
Abstract
تستخدم تقنية تحرير الجينوم على نطاق واسع لإنتاج المعدلة وراثيا ، بما في ذلك الفئران. يعد الحقن السيتوبلازمي أو النووي لقوالب إصلاح الحمض النووي وكواشف CRISPR-Cas أكثر طرق التوصيل شيوعا إلى الأجنة. ومع ذلك ، فإن هذا النوع من المعالجة الدقيقة يتطلب الوصول إلى معدات متخصصة ، وهو شاق ، ويتطلب مستوى معينا من المهارة التقنية. علاوة على ذلك ، غالبا ما تؤدي تقنيات الحقن المجهري إلى انخفاض بقاء الجنين بسبب الضغط الميكانيكي على الجنين. في هذا البروتوكول ، طورنا طريقة محسنة لتقديم قوالب كبيرة لإصلاح الحمض النووي للعمل جنبا إلى جنب مع تحرير جينوم CRISPR-Cas9 دون الحاجة إلى الحقن المجهري. يجمع هذا البروتوكول بين تسليم الحمض النووي بوساطة AAV لقوالب مانح الحمض النووي التي تقطعت بها السبل جنبا إلى جنب مع تسليم البروتين النووي الريبي CRISPR-Cas9 (RNP) عن طريق التثقيب الكهربائي لتعديل أجنة الخلية 2. باستخدام هذه الاستراتيجية الجديدة ، نجحنا في إنتاج نماذج فئران مستهدفة تحمل إدخال تسلسلات الحمض النووي من 1.2 إلى 3.0 كيلو بايت في الحجم بكفاءة تتراوح بين 42٪ و 90٪.
Introduction
أدى تطوير أدوات تحرير الجينوم القائمة على كريسبر إلى تسريع قدرتنا على توليد نماذج فئران جديدة وأكثر تطورا معدلة وراثيا بكفاءة. يتم الجمع بين الحمض النووي الريبي أحادي التوجيه ، جنبا إلى جنب مع Cas9 nuclease ، لتشكيل مجمعات البروتين النووي الريبي (RNP) التي تستهدف تسلسلات الحمض النووي ذات الأهمية داخل الجينوم وتؤدي إلى فواصل الحمض النووي المزدوجة التي تقطعت بها السبل. نظرا لأن آليات إصلاح الحمض النووي الخلوي عرضة للخطأ ، يتم إدخال عمليات الإدراج والحذف (INDELs) أثناء عملية الإصلاح التي يمكن أن تعطل وظيفة الجين المستهدف. عندما يكون هناك تسليم مشترك لتسلسل الحمض النووي الهندسي المطلوب (قالب الإصلاح) جنبا إلى جنب مع كواشف تحرير الجينوم ، يحدث إدخال قالب الإصلاح في المنطقة التي تحتوي على كسر الحمض النووي المزدوج الذي تقطعت به السبل من خلال عملية تسمى الإصلاح الموجه بالتماثل (HDR). هذه استراتيجية فعالة لتوليد نماذج حيوانية مع إدخالات / بدائل الحمض النووي المستهدفة (الضربات القاضية). أحد القيود هو أن التسلسلات غير المباشرة غالبا ما تكون كبيرة الحجم ، والتي ثبت أنها تقلل من كفاءة تحرير الجينات ، مما يجعل إنشاء النموذج المطلوب أكثر صعوبة1. تضمنت استراتيجيات زيادة الكفاءة الخطية لكل من قوالب إصلاح الحمض النووي المزدوج (dsDNA) والحمض النووي أحادي الشريط (ssDNA) والتعديل الكيميائي لقوالب إصلاح الحمض النووي2،3،4. بالإضافة إلى ذلك ، تمت تجربة الحقن المجهري النووي جنبا إلى جنب مع مركبات تحفيز HDR ، وتطبيق النبضات الكهربائية بالتزامن مع الحقن المجهري ، والحقن المجهري الموقوت في أجنة خلية 25،6،7. على الرغم من نجاح بعض هذه الأساليب ، فإن دمج تسلسلات الحمض النووي الأكبر من 1.0 كيلو بايت لا يزال يمثل تحديا تقنيا.
يوفر التثقيب الكهربائي ، وهو طريقة شائعة لإدخال الكواشف في خطوط الخلايا المستزرعة ، بديلا للحقن المجهري لتوصيل مكونات CRISPR-Cas9 إلى الأجنة. تم استخدام التثقيب الكهربائي للأجنة ، الذي تم إثباته لأول مرة في أجنة الفئران8 ، بنجاح كطريقة توصيل في الفئران9،10،11،12،13 ، والخنازير14،15 ، والكائنات الحية الحيوانية الأخرى16،17،18. يتم وضع الأجنة ، المعلقة في الوسط الذي يحتوي على كواشف CRISPR-Cas9 ، في كوفيت أو على شريحة زجاجية بين قطبين كهربائيين وتخضع لنبضات مباشرة من التيارات الكهربائية. وهذا يخلق فتحات عابرة في المنطقة الشفافة وغشاء بلازما الجنين الذي تدخل من خلاله مكونات كريسبر-كاس 9 إلى الأجنة. عادة ، يتم استخدام نبضات "بورينغ" كهربائية متوسطة المستوى لإنشاء فتحات مؤقتة تليها "نبضات نقل" كهربائية منخفضة المستوى تسهل حركة مكونات تحرير الجينوم سالبة الشحنة. التثقيب الكهربائي للجنين فعال ، وله إنتاجية عالية ، وسهل الأداء. ومع ذلك ، في حين ثبت أن التثقيب الكهربائي للجنين ناجح للغاية في إدخال قوالب إصلاح ssDNA صغيرة (<200 bp) ، إلا أن هناك تقارير قليلة عن نجاح التثقيب الكهربائي لقوالب إصلاح أكبر (>1.0 كيلو بايت)13,19. يمثل هذا التقييد في الحجم قيدا رئيسيا على التثقيب الكهربائي للأجنة لتوليد نماذج حيوانية غير مطروقة تتطلب إدخالات كبيرة.
في سياق العلاج الجيني ، لطالما استخدمت الفيروسات المرتبطة بالغدي (AAVs) كمركبات لتوصيل المواد الوراثية بسبب كفاءتها في العدوى في الجسم الحي لكل من الخلايا المنقسمة وغير المنقسمة ، ونقص الإمراضية ، والتكامل الجينيالنادر 20,21. في الآونة الأخيرة ، جمعت المزيد من الدراسات بين AAVs وتقنية CRISPR-Cas9 لتقديم قوالب إصلاح الحمض النووي وكواشف CRISPR22،23،24. يسمح هذا النهج بتسليم قوالب أكبر لإصلاح الحمض النووي دون الحاجة إلى تقنيات الحقن المجهري.
يكون مسار HDR أكثر نشاطا في المراحل المتأخرة S و G2 من دورة الخلية25,26. في الدراسات التي أجريت في المختبر ، تم تحقيق زيادات كبيرة في كفاءة الضربة القاضية من خلال توصيل CRISPR-Cas9 RNPs وقوالب إصلاح الحمض النووي إلى خلايا متزامنة G2 أو عن طريق تقييد وجود بروتين Cas9 إلى المراحل المتأخرة S و G2 باستخدام بروتين اندماج Cas9-Geminin2. علاوة على ذلك ، هناك حدث تنشيط جينوم زيجوتي رئيسي (ZGA) يحدث خلال المرحلة G2 الممتدة من جنين المرحلة المكونة من خليتين ، وهذا يرتبط بحالة الكروماتين المفتوحة. يعتقد أن هذا يوفر ل CRISPR-Cas9 RNPs وقوالب الإصلاح إمكانية وصول أكبر إلى الحمض النووي الجينومي.
كان هدفنا هو البناء على كل هذه الملاحظات ، من خلال الجمع بين نهج AAV والتثقيب الكهربائي للأجنة لإدخال CRISPR-Cas9 RNPs في مرحلة 2-cell من تطور الجنين. تستفيد هذه الاستراتيجية من قدرة تسليم قالب إصلاح الحمض النووي الأكبر ل AAV ، والسهولة التقنية للتثقيب الكهربائي والنقطة الزمنية المثلى لخلية 2 للوصول الجينومي أثناء تطور الجنين لإنشاء طريقة فعالة للهندسة الوراثية المستهدفة لإدخال الحمض النووي. كما هو موضح في هذا البروتوكول ، تسمح طريقتنا المحسنة بإنتاج نماذج الفئران المستهدفة التي تحمل إدخالات تسلسل الحمض النووي من 1.2 إلى 3.0 كيلو بايت في الحجم دون الحاجة إلى تقنيات الحقن المجهري.
Access restricted. Please log in or start a trial to view this content.
Protocol
تمت الموافقة على جميع الإجراءات التجريبية من قبل اللجنة المؤسسية لرعاية واستخدام بجامعة ميسوري (بروتوكول ACUC # 25580) وتم تنفيذها وفقا للمبادئ التوجيهية المنصوص عليها في دليل استخدام ورعاية المختبر.
1. تسليم قالب إصلاح الحمض النووي بوساطة AAV
- صمم بنية الحمض النووي لاحتواء التسلسل المطلوب بين ذراعي التماثل. يبلغ طول ذراع التماثل النموذجي 300-500 نقطة أساس. تأكد من أن قالب إصلاح الحمض النووي بأكمله (أذرع التماثل + تسلسل الضربة القاضية المطلوب) محاط بتكرارات طرفية مقلوبة (ITR) عن طريق الاستنساخ في العمود الفقري البلازميد المناسب والتعبئة في SSAAV1 أو ssAAV6 المؤتلف (الأنماط المصلية 1 أو 6).
ملاحظة: إذا كان تسلسل هدف sgRNA موجودا في قالب إصلاح الحمض النووي ، فمن المهم هندسة طفرات صامتة لتعطيل هذا التسلسل وبالتالي منع التحرير بوساطة CRISPR-Cas9 للأليل المستهدف بشكل صحيح.
تنبيه: النواقل الفيروسية AAV المؤتلفة غير متكاملة وتصنف على أنها BSL-1. تستخدم تقنيات التعقيم القياسية لسحب الأجنة التي تعرضت للفيروس والتعامل معها. - أضف ssAAV1 أو ssAAV6 المصمم هندسيا (معبأ بقالب إصلاح الحمض النووي) إلى 30 ميكرولتر من وسائط KSOM-R27,28 إلى تركيز نهائي يبلغ 3 × 10 7 نسخ جينوم (GC) / ميكرولتر تحت الزيت المعدني في طبق بتري 35 مم.
- ضع الزيجوت مع نوى البرونوى المرئية في وسائط KSOM-R التي تحتوي على ssAAV الهندسي.
ملاحظة: باستخدام هذا البروتوكول ، ليست هناك حاجة لترقق المنطقة الشفافة لأن الأنماط المصلية AAV 1 و 6 قادرة على المرور بسهولة من أجل تسليم قالب إصلاح الحمض النووي بكفاءة. - احتضان عند 37 درجة مئوية مع 5٪ CO2 والرطوبة القصوى لمدة 18-20 ساعة للسماح بنقل فيروسي كاف.
2. إعداد التثقيب الكهربائي
- في اليوم التالي ، اصنع خليط التثقيب الكهربائي الذي يحتوي على 100 نانوغرام / ميكرولتر من sgRNA و 100 نانوغرام / ميكرولتر من بروتين Cas9 المخفف في وسائط Opti-MEM في أنبوب معقم خال من RNase. مزيج بلطف.
- احتضان في درجة حرارة الغرفة لمدة 10 دقائق للسماح لتشكيل RNP.
- أثناء وقت الحضانة ، قم بتشغيل جهاز الحفر الكهربائي وتوصيل الخيوط بقطب منزلق زجاجي بفجوة 1.5 مم.
- تعيين معلمات التثقيب الكهربائي كما هو موضح في الجدول 1.
3. 2-خلية الجنين التثقيب الكهربائي
- ماصة بلطف 5 ميكرولتر من خليط التثقيب الكهربائي كريسبر بين القطبين على الشريحة الزجاجية مع الحرص على عدم إدخال فقاعات الهواء إلى المحلول.
- قم بإزالة جنين المرحلة 2 خلية من محلول AAV. اصطف أجنة مرحلة 2 خلية في الخليط دون السماح لهم بلمس جوانب الأقطاب الكهربائية. يتم ذلك لتجنب التحلل.
- اضغط على زر أوم لقياس المقاومة. تحقق للتأكد من أن المقاومة تتراوح بين 0.100 و 0.300 كيلو أوم. سيغير حجم التفاعل المعاوقة (أضف حجما لتقليل المقاومة واطرح الحجم لزيادة المقاومة).
- اضغط على ابدأ. تستغرق العملية بضع ثوان حتى تكتمل.
- قم بإزالة الأجنة مباشرة بعد التثقيب الكهربائي واغسلها 3 مرات في قطرات جديدة سعة 30 ميكرولتر من وسائط KSOM-R.
- ضع الأجنة مرة أخرى في حاضنة 37 درجة مئوية مع 5٪ CO2 والرطوبة القصوى للزراعة في المختبر في 500 ميكرولتر من وسائط KSOM-R تحت الزيت المعدني. بدلا من ذلك ، قم بنقل الأجنة جراحيا إلى أنثى الفئران الحامل الكاذبة لمدة 1.5 يوم بعد الجماع (dpc) لإنتاج ذرية حية.
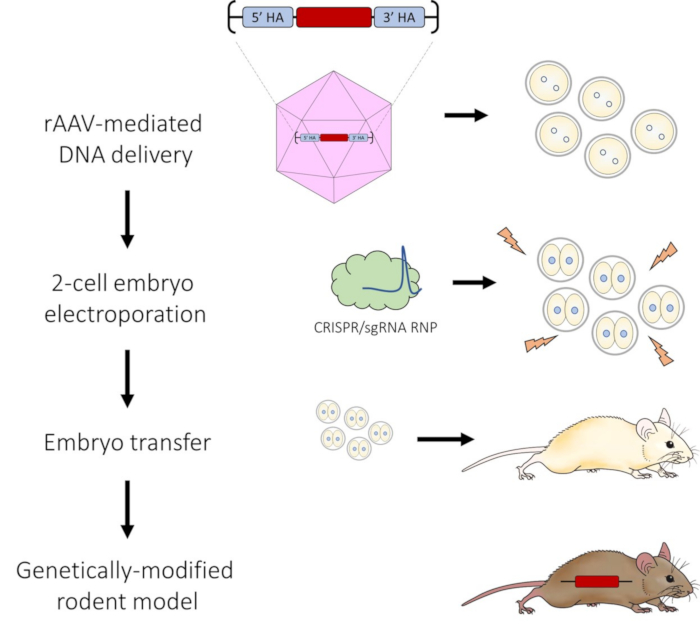
الشكل 1: رسم تخطيطي لتوصيل الحمض النووي بوساطة AAV وخط أنابيب التثقيب الكهربائي للجنين 2 خلية لتحرير الجينوم CRISPR-Cas9. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Access restricted. Please log in or start a trial to view this content.
النتائج
بعد البروتوكول ، هناك تسليم فعال بوساطة AAV لقالب إصلاح الحمض النووي مما يسمح ب HDR عالي الكفاءة بعد أن يتم إلكتروبور أجنة الخلية 2 باستخدام CRISPR-Cas9 RNPs. كما هو موضح في الفيديو ، تؤدي عملية التثقيب الكهربائي الناجحة إلى تكوين فقاعات على كل قطب كهربائي (الشكل 2C) و...
Access restricted. Please log in or start a trial to view this content.
Discussion
أحدث نظام تحرير الجينوم CRISPR-Cas ثورة في مجال الهندسة الوراثية من خلال السماح بالإنتاج الفعال لكل من التعديلات الجينية المباشرة والمعقدة والمخصصة في مجموعة متنوعة من الأنواع الحيوانية. التحسينات والتحسينات المتكررة في التقنيات المرتبطة بتحرير الجينوم تزيد من تنوعها. لقد وصفنا هنا نهجا جد?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
يود المؤلفون أن يشكروا نولان ديفيس على المساعدة في تصوير الفيديو وتحرير الفيديو.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Leads with alligator clips for electrodes | NepaGene | C117 | |
| Mineral oil | MilliporeSigma | M5310 | |
| NepaGene21 Super Electroporator | NepaGene | NEPA21 | |
| Platinum plate electrodes on slide glass | NepaGene | CUY501P1-1.5 | |
| PURedit Cas9 Protein | MilliporeSigma | PECAS9 | |
| sgRNA (chemically-modified) | Synthego | N/A | |
| ssAAV1 or ssAAV6 packaged DNA repair template | Vectorbuilder | N/A |
References
- Lau, C. H., Tin, C., Suh, Y. CRISPR-based strategies for targeted transgene knock-in and gene correction. Fac Rev. 9, 20(2020).
- Gutschner, T., Haemmerle, M., Genovese, G., Draetta, G. F., Chin, L. Post-translational Regulation of Cas9 during G1 Enhances Homology-Directed Repair. Cell Rep. 14 (6), 1555-1566 (2016).
- Zhang, J. P., et al. Efficient precise knockin with a double cut HDR donor after CRISPR/Cas9-mediated double-stranded DNA cleavage. Genome Biol. 18 (1), 35(2017).
- Miura, H., Quadros, R. M., Gurumurthy, C. B., Ohtsuka, M. Easi-CRISPR for creating knock-in and conditional knockout mouse models using long ssDNA donors. Nat Protoc. 13 (1), 195-215 (2018).
- Gu, B., Posfai, E., Gertsenstein, M., Rossant, J. Efficient generation of large-fragment knock-in mouse models using 2-cell (2C)-homologous recombination (HR)-CRISPR. Curr Protoc Mouse Biol. 10 (1), e67(2020).
- Gu, B., Posfai, E., Rossant, J. Efficient generation of targeted large insertions by microinjection into two-cell-stage mouse embryos. Nat Biotechnol. 36 (7), 632-637 (2018).
- Kurihara, T., et al. DNA repair protein RAD51 enhances the CRISPR/Cas9-mediated knock-in efficiency in brain neurons. Biochem Biophys Res Commun. 524 (3), 621-628 (2020).
- Kaneko, T., Sakuma, T., Yamamoto, T., Mashimo, T. Simple knockout by electroporation of engineered endonucleases into intact rat embryos. Sci Rep. 4, 6382(2014).
- Chen, S., Lee, B., Lee, A. Y., Modzelewski, A. J., He, L. Highly efficient mouse genome editing by CRISPR ribonucleoprotein electroporation of zygotes. J Biol Chem. 291 (28), 14457-14467 (2016).
- Hashimoto, M., Yamashita, Y., Takemoto, T. Electroporation of Cas9 protein/sgRNA into early pronuclear zygotes generates non-mosaic mutants in the mouse. Dev Biol. 418 (1), 1-9 (2016).
- Wang, W., et al. Delivery of Cas9 protein into mouse zygotes through a series of electroporation dramatically increases the efficiency of model creation. J Genet Genomics. 43 (5), 319-327 (2016).
- Troder, S. E., et al. An optimized electroporation approach for efficient CRISPR/Cas9 genome editing in murine zygotes. PLoS One. 13 (5), e0196891(2018).
- Teixeira, M., et al. Electroporation of mice zygotes with dual guide RNA/Cas9 complexes for simple and efficient cloning-free genome editing. Sci Rep. 8 (1), 474(2018).
- Tanihara, F., et al. Efficient generation of GGTA1-deficient pigs by electroporation of the CRISPR/Cas9 system into in vitro-fertilized zygotes. BMC Biotechnol. 20 (1), 40(2020).
- Tanihara, F., et al. Generation of CD163-edited pig via electroporation of the CRISPR/Cas9 system into porcine in vitro-fertilized zygotes. Anim Biotechnol. 32 (2), 147-154 (2021).
- Camargo, L. S. A., Owen, J. R., Van Eenennaam, A. L., Ross, P. J. Efficient one-step knockout by electroporation of ribonucleoproteins into zona-intact bovine embryos. Front Genet. 11, 570069(2020).
- Lin, J. C., Van Eenennaam, A. L. Electroporation-mediated genome editing of livestock zygotes. Front Genet. 12, 648482(2021).
- Betters, E., Charney, R. M., Garcia-Castro, M. I. Electroporation and in vitro culture of early rabbit embryos. Data Brief. 21, 316-320 (2018).
- Miyasaka, Y., et al. CLICK: one-step generation of conditional knockout mice. BMC Genomics. 19 (1), 318(2018).
- Epstein, B. E., Schaffer, D. V. Combining engineered nucleases with adeno-associated viral vectors for therapeutic gene editing. Adv Exp Med Biol. 1016, 29-42 (2017).
- Gaj, T., Epstein, B. E., Schaffer, D. V. Genome engineering using adeno-associated virus: basic and clinical research applications. Mol Ther. 24 (3), 458-464 (2016).
- Chen, S., et al. CRISPR-READI: Efficient generation of knockin mice by CRISPR RNP electroporation and AAV donor infection. Cell Rep. 27 (13), 3780-3789 (2019).
- Mizuno, N., et al. Intra-embryo gene cassette knockin by CRISPR/CAS9-mediated genome editing with adeno-associated viral vector. iScience. 9, 286-297 (2018).
- Davis, D. J., et al. Efficient DNA knock-in using AAV-mediated delivery with 2-cell embryo CRISPR-Cas9 electroporation. Front Genome Ed. 5, 1256451(2023).
- Smirnikhina, S. A., Zaynitdinova, M. I., Sergeeva, V. A., Lavrov, A. V. Improving homology-directed repair in genome editing experiments by influencing the cell cycle. Int J Mol Sci. 23 (11), (2022).
- Takata, M., et al. Homologous recombination and non-homologous end-joining pathways of DNA double-strand break repair have overlapping roles in the maintenance of chromosomal integrity in vertebrate cells. EMBO J. 17 (18), 5497-5508 (1998).
- Men, H., Stone, B. J., Bryda, E. C. Media optimization to promote rat embryonic development to the blastocyst stage in vitro. Theriogenology. 151, 81-85 (2020).
- Men, H., Amos-Landgraf, J. M., Bryda, E. C., Franklin, C. L. KSOM-R supports both mouse and rat preimplantation embryo development in vitro. Theriogenology. 198, 69-74 (2023).
- Romeo, C., et al. AAV diffuses across zona pellucida for effortless gene delivery to fertilized eggs. Biochem Biophys Res Commun. 526 (1), 85-90 (2020).
- Fulka, J., Moor, R. M., Fulka, J. Electrofusion of mammalian oocytes and embryonic cells. Methods Mol Biol. 48, 309-316 (1995).
- Rems, L., et al. Cell electrofusion using nanosecond electric pulses. Sci Rep. 3, 3382(2013).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved