JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
아데노 관련 바이러스(AAV) 및 2세포 배아 전기천공법을 이용한 쥐 배아의 CRISPR-Cas9 게놈 편집
요약
이 프로토콜은 유전자 변형 쥐 모델을 생산하기 위한 최적화된 접근 방식을 제시합니다. 아데노 관련 바이러스(AAV)는 DNA 복구 템플릿을 전달하는 데 사용되며, 전기천공법은 CRISPR-Cas9 시약을 전달하여 2세포 배아에서 게놈 편집 과정을 완료하는 데 사용됩니다.
초록
게놈 편집 기술은 쥐를 포함한 유전자 변형 동물을 생산하는 데 널리 사용됩니다. DNA 복구 템플릿과 CRISPR-Cas 시약의 세포질 또는 전핵 주입은 배아에 전달하는 가장 일반적인 방법입니다. 그러나 이러한 유형의 미세 조작은 특수 장비에 대한 접근이 필요하고 힘들며 일정 수준의 기술이 필요합니다. 더욱이, 미세주입 기술은 종종 배아에 가해지는 기계적 스트레스로 인해 배아 생존율을 낮춥니다. 이 프로토콜에서는 미세주입 없이 CRISPR-Cas9 게놈 편집과 함께 작동하는 대규모 DNA 복구 템플릿을 제공하는 최적화된 방법을 개발했습니다. 이 프로토콜은 단일 가닥 DNA 공여 템플릿의 AAV 매개 DNA 전달과 전기천공에 의한 CRISPR-Cas9 리보핵단백질(RNP) 전달을 결합하여 2세포 배아를 변형합니다. 이 새로운 전략을 사용하여 42%에서 90% 사이의 효율로 1.2-3.0kb 크기의 DNA 염기서열을 삽입하는 표적 knock-in rat 모델을 성공적으로 생산했습니다.
서문
CRISPR 기반 게놈 편집 도구의 개발은 새롭고 더 정교한 유전자 조작 쥐 모델을 효율적으로 생성하는 능력을 가속화했습니다. 단일 가이드 RNA는 Cas9 뉴클레아제와 함께 결합되어 게놈 내에서 관심 있는 DNA 염기서열을 표적으로 하는 리보핵단백질(RNP) 복합체를 형성하고 이중 가닥 DNA 절단을 초래합니다. 세포 DNA 복구 메커니즘은 오류가 발생하기 쉽기 때문에 복구 과정에서 삽입 및 결실(INDEL)이 도입되어 표적 유전자의 기능을 방해할 수 있습니다. 게놈 편집 시약과 함께 원하는 조작된 DNA 염기서열(복구 템플릿)의 동시 전달이 있는 경우, 이중 가닥 DNA 절단을 포함하는 영역에 복구 템플릿의 삽입은 상동성 유도 복구(HDR)라는 프로세스를 통해 발생합니다. 이는 표적 DNA 삽입/치환(knock-in)을 통해 동물 모델을 생성하는 데 효과적인 전략입니다. 한 가지 한계는 knock-in 염기서열의 크기가 큰 경우가 많아 유전자 편집 효율이 감소하여 원하는 모델을 생성하기가 더 어려워진다는 것입니다1. knock-in 효율을 높이기 위한 전략에는 이중 가닥 DNA(dsDNA) 및 단일 가닥 DNA(ssDNA) 복구 템플릿의 선형화와 DNA 복구 템플릿의 화학적 변형이 포함됩니다 2,3,4. 또한, HDR 자극 화합물과 함께 전핵 미세주입, 미세주입과 함께 전기 펄스의 적용, 2세포 배아에 대한 시간 미세주입이 모두 시도되었습니다 5,6,7. 이러한 접근 방식 중 일부의 성공에도 불구하고 1.0kb보다 큰 DNA 서열의 통합은 기술적으로 어려운 과제로 남아 있습니다.
배양된 세포주에 시약을 도입하는 일반적인 방법인 전기천공법은 CRISPR-Cas9 성분을 배아에 전달하기 위한 미세주입의 대안을 제공합니다. 쥐 배아(rat embryo)8에서 처음 증명된 배아 전기천공법(embryo electroporation)은 이후 마우스(9,10,11,12,13), 돼지(14,15) 및 기타 동물 모델 유기체(16,17,18)에서 전달 방법으로 성공적으로 사용되었다 . CRISPR-Cas9 시약이 포함된 배지에 현탁된 배아는 큐벳 또는 두 전극 사이의 유리 슬라이드에 배치되고 직접 전류 펄스를 받습니다. 이로 인해 CRISPR-Cas9 구성 요소가 배아로 들어가는 zona pellucida 및 배아 원형질막에 일시적인 구멍이 생깁니다. 전형적으로, 중간 수준의 전기 "포링" 펄스는 음전하를 띤 게놈 편집 성분의 이동을 용이하게 하는 낮은 수준의 전기 "전달 펄스"에 이어 임시 개구부를 생성하는 데 사용됩니다. 배아 전기천공법은 효율적이고, 처리량이 높으며, 수행하기 쉽습니다. 그러나, 배아 전기천공법은 작은(<200 bp) ssDNA 복구 주형의 도입에 대해 매우 성공적인 것으로 나타났지만, 더 큰(>1.0 kb) 복구 주형의 성공적인 전기천공법에 대한 보고는 거의 없다13,19. 이러한 크기 제한은 큰 삽입이 필요한 knock-in 동물 모델을 생성하기 위한 배아 전기천공법의 주요 한계를 나타냅니다.
유전자 치료의 맥락에서 아데노 관련 바이러스(AAV)는 분열 및 비분열 세포 모두의 효율적인 생체 내 감염성, 병원성 부족 및 희귀 게놈 통합으로 인해 유전 물질을 전달하는 매개체로 오랫동안 사용되어 왔습니다20,21. 최근에는 AAV와 CRISPR-Cas9 기술을 결합하여 DNA 복구 템플릿과 CRISPR 시약을 도입하는 연구가 더 많아지고있습니다 22,23,24. 이 접근법을 사용하면 미세주입 기술 없이 더 큰 DNA 복구 템플릿을 전달할 수 있습니다.
HDR 경로는 세포주기의 후기 S 및 G2 단계에서 더 활성화됩니다25,26. in vitro에서 수행된 연구에서 CRISPR-Cas9 RNP 및 DNA 복구 템플릿을 G2 동기화 세포에 전달하거나 Cas9-Geminin 융합 단백질2을 사용하여 Cas9 단백질의 존재를 후기 S 및 G2 단계로 제한함으로써 knock-in 효율이 크게 증가했습니다. 또한, 2세포 단계 배아의 확장된 G2 단계에서 발생하는 주요 접합 게놈 활성화(ZGA) 이벤트가 있으며, 이는 개방 염색질 상태와 관련이 있습니다. 이를 통해 CRISPR-Cas9 RNP와 복구 템플릿에 게놈 DNA에 대한 접근성을 높일 수 있을 것으로 추측됩니다.
우리의 목표는 AAV 접근법과 배아 전기천공법을 결합하여 배아 발달의 2세포 단계에서 CRISPR-Cas9 RNP를 도입함으로써 이러한 모든 관찰을 기반으로 하는 것이었습니다. 이 전략은 AAV의 더 큰 DNA 복구 템플릿 전달 용량, 전기천공법의 기술적 용이성 및 배아 발달 중 게놈 접근성을 위한 보다 최적의 2세포 시점을 활용하여 DNA 삽입의 표적 유전 공학을 위한 효율적인 방법을 만듭니다. 이 프로토콜에서 강조된 바와 같이, 당사의 최적화된 방법을 사용하면 미세주입 기술 없이 1.2-3.0kb 크기의 DNA 염기서열을 삽입하는 표적 knock-in rat 모델을 생산할 수 있습니다.
프로토콜
모든 실험 절차는 미주리 대학의 기관 동물 관리 및 사용 위원회(ACUC 프로토콜 #25580)의 승인을 받았으며 실험실 동물의 사용 및 관리 가이드에 명시된 지침에 따라 수행되었습니다.
1. AAV 매개 DNA 복구 템플릿 전달
- 두 상동성 암 사이에 원하는 knock-in 시퀀스를 포함하도록 DNA 구조를 설계합니다. 일반적인 상동성 암 길이는 300-500bp입니다. 적절한 플라스미드 백본으로 클로닝하고 재조합 ssAAV1 또는 ssAAV6(혈청형 1 또는 6)으로 패키징하여 전체 DNA 복구 템플릿(homology arm + desired knock-in sequence)이 반전 말단 반복(ITR)에 의해 측면에 있는지 확인합니다.
참고: sgRNA 표적 염기서열이 DNA 복구 템플릿에 존재하는 경우, 이 염기서열을 방해하는 침묵의 돌연변이를 설계하여 올바르게 표적화된 대립유전자의 CRISPR-Cas9 매개 편집을 방지하는 것이 중요합니다.
주의: 재조합 AAV 바이러스 벡터는 비통합적이며 BSL-1로 분류됩니다. 표준 무균 기술은 바이러스에 노출된 배아를 피펫팅하고 처리하는 데 사용됩니다. - 엔지니어링된 ssAAV1 또는 ssAAV6(DNA 복구 템플릿과 함께 패키지)을 30μL의 KSOM-R 배지27,28에 추가하여 35mm 페트리 접시의 미네랄 오일 아래에 3 × 107 게놈 사본(GC)/μL의 최종 농도가 되도록 합니다.
- 눈에 보이는 전핵이 있는 접합체를 엔지니어링된 ssAAV가 포함된 KSOM-R 배지에 넣습니다.
참고: 이 프로토콜을 사용하면 AAV 혈청형 1 및 6이 효율적인 DNA 복구 템플릿 전달을 위해 쉽게 통과할 수 있으므로 zona pellucida를 얇게 할 필요가 없습니다. - 37 ° C에서 5 % CO2 및 최대 습도로 18-20 시간 동안 배양하여 충분한 바이러스 transduction을 허용합니다.
2. 전기천공법 준비
- 다음 날, 멸균 RNase-free 튜브에서 Opti-MEM 배지에 희석한 100ng/μL의 sgRNA와 100ng/μL의 Cas9 단백질을 포함하는 전기천공법 혼합물을 만듭니다. 부드럽게 섞는다.
- RNP 형성을 위해 실온에서 10분 동안 배양합니다.
- 배양 시간 동안 electroporator를 켜고 리드를 1.5mm 간격의 유리 슬라이드 전극에 연결합니다.
- 표 1에 설명된 대로 electroporation 매개변수를 설정합니다.
3. 2세포 배아 전기천공법
- 용액에 기포가 유입되지 않도록 주의하면서 유리 슬라이드의 두 전극 사이에 CRISPR 전기천공법 혼합물 5μL를 부드럽게 피펫팅합니다.
- AAV 용액에서 2세포 단계 배아를 제거합니다. 2세포 단계 배아가 전극의 측면에 닿지 않도록 혼합물에 정렬합니다. 이것은 용해를 피하기 위해 수행됩니다.
- Ohm 버튼을 눌러 임피던스를 측정합니다. 임피던스가 0.100에서 0.300kΩ 사이인지 확인하십시오. 반응 볼륨은 임피던스를 변경합니다(임피던스를 줄이려면 볼륨을 추가하고 임피던스를 높이려면 볼륨을 뺍니다).
- 보도자료 스타트. 프로세스를 완료하는 데 몇 초 정도 걸립니다.
- 전기천공법 직후 배아를 제거하고 신선한 30μL 방울의 KSOM-R 배지로 3회 세척합니다.
- 배아를 5%CO2 및 최대 습도를 유지한 37°C 인큐베이터에 다시 넣고 미네랄 오일 아래 KSOM-R 배지 500μL 방울에 넣어 체외 배양을 합니다. 또는 배아를 1.5일 후 성교(dpc) 유사 임신 암컷 쥐에게 외과적으로 이식하여 살아있는 자손을 생산합니다.
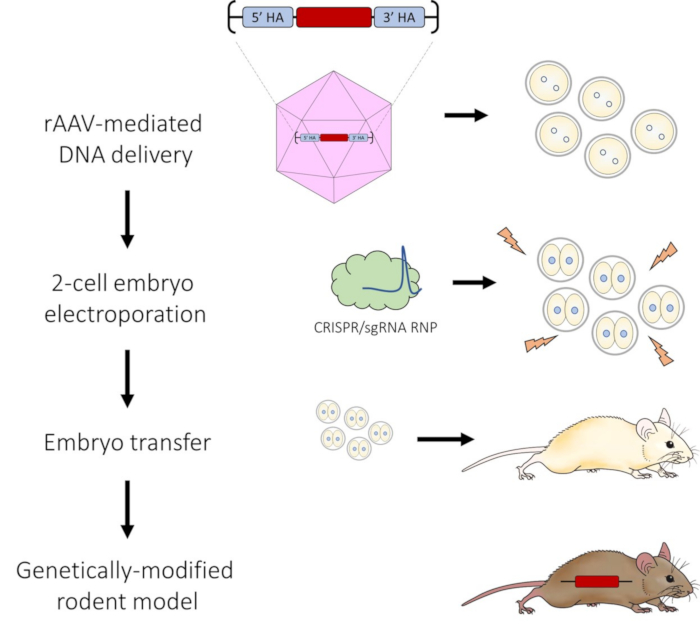
그림 1: CRISPR-Cas9 게놈 편집을 위한 AAV 매개 DNA 전달 및 2세포 배아 전기천공법 파이프라인의 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
프로토콜에 따라 DNA 복구 템플릿의 효과적인 AAV 매개 전달이 있어 2세포 배아를 CRISPR-Cas9 RNP로 전기천공한 후 매우 효율적인 HDR을 수행할 수 있습니다. 비디오에서 볼 수 있듯이 성공적인 electroporation 공정은 각 전극에 기포를 형성하고(그림 2C) 임피던스가 0.100 및 0.300kΩ 범위 내에서 유지되는 결과를 낳습니다. 전기천공법 후 배아가 부풀어 올라 조나...
토론
CRISPR-Cas 게놈 편집 시스템은 다양한 동물 종에서 간단하고 복잡한 맞춤형 유전자 변형을 효율적으로 생산할 수 있도록 함으로써 유전 공학 분야에 혁명을 일으켰습니다. 게놈 편집과 관련된 기술의 빈번한 개선과 개선은 그 다양성을 더욱 강화합니다. 여기서는 CRISPR-Cas9 시약을 2세포 설치류 배아에 주입하는 2세포 배아 전기천공법과 함께 ssAAV 매개 DNA 전달을 사용하는 새로운 접근법을 설명했습?...
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
저자는 비디오 촬영 및 비디오 편집에 도움을 준 Nolan Davis에게 감사의 뜻을 전합니다.
자료
| Name | Company | Catalog Number | Comments |
| Leads with alligator clips for electrodes | NepaGene | C117 | |
| Mineral oil | MilliporeSigma | M5310 | |
| NepaGene21 Super Electroporator | NepaGene | NEPA21 | |
| Platinum plate electrodes on slide glass | NepaGene | CUY501P1-1.5 | |
| PURedit Cas9 Protein | MilliporeSigma | PECAS9 | |
| sgRNA (chemically-modified) | Synthego | N/A | |
| ssAAV1 or ssAAV6 packaged DNA repair template | Vectorbuilder | N/A |
참고문헌
- Lau, C. H., Tin, C., Suh, Y. CRISPR-based strategies for targeted transgene knock-in and gene correction. Fac Rev. 9, 20 (2020).
- Gutschner, T., Haemmerle, M., Genovese, G., Draetta, G. F., Chin, L. Post-translational Regulation of Cas9 during G1 Enhances Homology-Directed Repair. Cell Rep. 14 (6), 1555-1566 (2016).
- Zhang, J. P., et al. Efficient precise knockin with a double cut HDR donor after CRISPR/Cas9-mediated double-stranded DNA cleavage. Genome Biol. 18 (1), 35 (2017).
- Miura, H., Quadros, R. M., Gurumurthy, C. B., Ohtsuka, M. Easi-CRISPR for creating knock-in and conditional knockout mouse models using long ssDNA donors. Nat Protoc. 13 (1), 195-215 (2018).
- Gu, B., Posfai, E., Gertsenstein, M., Rossant, J. Efficient generation of large-fragment knock-in mouse models using 2-cell (2C)-homologous recombination (HR)-CRISPR. Curr Protoc Mouse Biol. 10 (1), e67 (2020).
- Gu, B., Posfai, E., Rossant, J. Efficient generation of targeted large insertions by microinjection into two-cell-stage mouse embryos. Nat Biotechnol. 36 (7), 632-637 (2018).
- Kurihara, T., et al. DNA repair protein RAD51 enhances the CRISPR/Cas9-mediated knock-in efficiency in brain neurons. Biochem Biophys Res Commun. 524 (3), 621-628 (2020).
- Kaneko, T., Sakuma, T., Yamamoto, T., Mashimo, T. Simple knockout by electroporation of engineered endonucleases into intact rat embryos. Sci Rep. 4, 6382 (2014).
- Chen, S., Lee, B., Lee, A. Y., Modzelewski, A. J., He, L. Highly efficient mouse genome editing by CRISPR ribonucleoprotein electroporation of zygotes. J Biol Chem. 291 (28), 14457-14467 (2016).
- Hashimoto, M., Yamashita, Y., Takemoto, T. Electroporation of Cas9 protein/sgRNA into early pronuclear zygotes generates non-mosaic mutants in the mouse. Dev Biol. 418 (1), 1-9 (2016).
- Wang, W., et al. Delivery of Cas9 protein into mouse zygotes through a series of electroporation dramatically increases the efficiency of model creation. J Genet Genomics. 43 (5), 319-327 (2016).
- Troder, S. E., et al. An optimized electroporation approach for efficient CRISPR/Cas9 genome editing in murine zygotes. PLoS One. 13 (5), e0196891 (2018).
- Teixeira, M., et al. Electroporation of mice zygotes with dual guide RNA/Cas9 complexes for simple and efficient cloning-free genome editing. Sci Rep. 8 (1), 474 (2018).
- Tanihara, F., et al. Efficient generation of GGTA1-deficient pigs by electroporation of the CRISPR/Cas9 system into in vitro-fertilized zygotes. BMC Biotechnol. 20 (1), 40 (2020).
- Tanihara, F., et al. Generation of CD163-edited pig via electroporation of the CRISPR/Cas9 system into porcine in vitro-fertilized zygotes. Anim Biotechnol. 32 (2), 147-154 (2021).
- Camargo, L. S. A., Owen, J. R., Van Eenennaam, A. L., Ross, P. J. Efficient one-step knockout by electroporation of ribonucleoproteins into zona-intact bovine embryos. Front Genet. 11, 570069 (2020).
- Lin, J. C., Van Eenennaam, A. L. Electroporation-mediated genome editing of livestock zygotes. Front Genet. 12, 648482 (2021).
- Betters, E., Charney, R. M., Garcia-Castro, M. I. Electroporation and in vitro culture of early rabbit embryos. Data Brief. 21, 316-320 (2018).
- Miyasaka, Y., et al. CLICK: one-step generation of conditional knockout mice. BMC Genomics. 19 (1), 318 (2018).
- Epstein, B. E., Schaffer, D. V. Combining engineered nucleases with adeno-associated viral vectors for therapeutic gene editing. Adv Exp Med Biol. 1016, 29-42 (2017).
- Gaj, T., Epstein, B. E., Schaffer, D. V. Genome engineering using adeno-associated virus: basic and clinical research applications. Mol Ther. 24 (3), 458-464 (2016).
- Chen, S., et al. CRISPR-READI: Efficient generation of knockin mice by CRISPR RNP electroporation and AAV donor infection. Cell Rep. 27 (13), 3780-3789 (2019).
- Mizuno, N., et al. Intra-embryo gene cassette knockin by CRISPR/CAS9-mediated genome editing with adeno-associated viral vector. iScience. 9, 286-297 (2018).
- Davis, D. J., et al. Efficient DNA knock-in using AAV-mediated delivery with 2-cell embryo CRISPR-Cas9 electroporation. Front Genome Ed. 5, 1256451 (2023).
- Smirnikhina, S. A., Zaynitdinova, M. I., Sergeeva, V. A., Lavrov, A. V. Improving homology-directed repair in genome editing experiments by influencing the cell cycle. Int J Mol Sci. 23 (11), (2022).
- Takata, M., et al. Homologous recombination and non-homologous end-joining pathways of DNA double-strand break repair have overlapping roles in the maintenance of chromosomal integrity in vertebrate cells. EMBO J. 17 (18), 5497-5508 (1998).
- Men, H., Stone, B. J., Bryda, E. C. Media optimization to promote rat embryonic development to the blastocyst stage in vitro. Theriogenology. 151, 81-85 (2020).
- Men, H., Amos-Landgraf, J. M., Bryda, E. C., Franklin, C. L. KSOM-R supports both mouse and rat preimplantation embryo development in vitro. Theriogenology. 198, 69-74 (2023).
- Romeo, C., et al. AAV diffuses across zona pellucida for effortless gene delivery to fertilized eggs. Biochem Biophys Res Commun. 526 (1), 85-90 (2020).
- Fulka, J., Moor, R. M., Fulka, J. Electrofusion of mammalian oocytes and embryonic cells. Methods Mol Biol. 48, 309-316 (1995).
- Rems, L., et al. Cell electrofusion using nanosecond electric pulses. Sci Rep. 3, 3382 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유