需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用腺相关病毒 (AAV) 和 2 细胞胚胎电穿孔对大鼠胚胎进行 CRISPR-Cas9 基因组编辑
摘要
该协议提出了一种用于生产转基因大鼠模型的优化方法。腺相关病毒 (AAV) 用于递送 DNA 修复模板,电穿孔用于递送 CRISPR-Cas9 试剂以完成 2 细胞胚胎的基因组编辑过程。
摘要
基因组编辑技术被广泛用于生产转基因动物,包括大鼠。DNA修复模板和CRISPR-Cas试剂的细胞质或原核注射是最常见的胚胎递送方法。然而,这种类型的显微操作需要使用专门的设备,很费力,并且需要一定程度的技术技能。此外,由于胚胎上的机械应力,显微注射技术通常会导致胚胎存活率降低。在该协议中,我们开发了一种优化的方法,以提供大型DNA修复模板,以与CRISPR-Cas9基因组编辑结合使用,而无需显微注射。该协议结合了单链DNA供体模板的AAV介导的DNA递送以及通过电穿孔递送CRISPR-Cas9核糖核蛋白(RNP)以修饰2细胞胚胎。使用这种新颖的策略,我们成功地生产了靶向敲入大鼠模型,该模型携带1.2至3.0 kb大小的DNA序列插入,效率在42%至90%之间。
引言
基于CRISPR的基因组编辑工具的发展加速了我们高效生成新的、更复杂的基因工程大鼠模型的能力。单向导 RNA 与 Cas9 核酸酶结合形成核糖核蛋白 (RNP) 复合物,靶向基因组中感兴趣的 DNA 序列并导致双链 DNA 断裂。由于细胞DNA修复机制容易出错,因此在修复过程中会引入插入和缺失(INDELs),从而破坏靶基因的功能。当所需的工程化 DNA 序列(修复模板)与基因组编辑试剂共同递送时,修复模板通过称为同源定向修复 (HDR) 的过程插入包含双链 DNA 断裂的区域。这是生成具有靶向DNA插入/替换(敲入)的动物模型的有效策略。一个局限性是敲入序列通常尺寸很大,这已被证明会降低基因编辑效率,从而使生成所需模型更加困难1。提高敲入效率的策略包括双链 DNA (dsDNA) 和单链 DNA (ssDNA) 修复模板的线性化以及 DNA 修复模板的化学修饰 2,3,4。此外,已经尝试了前核显微注射以及HDR刺激化合物,将电脉冲与显微注射相结合,以及定时显微注射到2细胞胚胎中5,6,7。尽管其中一些方法取得了成功,但掺入大于 1.0 kb 的 DNA 序列在技术上仍然具有挑战性。
电穿孔是将试剂引入培养细胞系的常用方法,它提供了一种将 CRISPR-Cas9 成分递送至胚胎的显微注射替代方案。胚胎电穿孔首次在大鼠胚胎中得到证实8,此后已成功用作小鼠9,10,11,12,13,猪14,15和其他动物模式生物16,17,18的递送方法.将悬浮在含有CRISPR-Cas9试剂的培养基中的胚胎放入比色皿或两个电极之间的载玻片上,并受到电流的直接脉冲。这会在透明带和胚胎质膜中产生瞬时开口,CRISPR-Cas9成分通过这些开口进入胚胎。通常,中级电"孔"脉冲用于创建临时开口,然后是较低级别的电"传输脉冲",以促进带负电荷的基因组编辑组件的移动。胚胎电穿孔效率高,通量高,易于执行。然而,虽然胚胎电穿孔已被证明在引入小 (<200 bp) ssDNA 修复模板方面非常成功,但很少有关于成功电穿孔较大 (>1.0 kb) 修复模板的报道 13,19。这种尺寸限制代表了胚胎电穿孔在生成需要大插入的敲入动物模型方面的主要局限性。
在基因治疗的背景下,腺相关病毒 (AAV) 长期以来一直被用作传递遗传物质的载体,因为它们对分裂和非分裂细胞都具有有效的体内感染性、缺乏致病性和罕见的基因组整合20,21。最近,越来越多的研究将 AAV 与 CRISPR-Cas9 技术相结合,引入了 DNA 修复模板和 CRISPR 试剂 22,23,24。这种方法允许在不需要显微注射技术的情况下提供更大的DNA修复模板。
HDR 通路在细胞周期的晚期 S 和 G2 期更为活跃25,26。在体外进行的研究中,通过将 CRISPR-Cas9 RNP 和 DNA 修复模板递送至 G2 同步细胞或使用 Cas9-Geminin 融合蛋白2 将 Cas9 蛋白的存在限制在晚期 S 期和 G2 期,实现了敲入效率的显着提高。此外,在 2 细胞阶段胚胎的延长 G2 期期间发生主要的合子基因组激活 (ZGA) 事件,这与开放染色质状态有关。据推测,这为CRISPR-Cas9 RNP和修复模板提供了对基因组DNA的更大可及性。
我们的目标是在所有这些观察结果的基础上,将AAV方法与胚胎电穿孔相结合,在胚胎发育的2细胞阶段引入CRISPR-Cas9 RNP。该策略利用了AAV更大的DNA修复模板递送能力,电穿孔的技术易用性以及胚胎发育过程中基因组可及性的最佳2细胞时间点,为DNA插入的靶向基因工程创造了一种有效的方法。正如本方案所强调的,我们优化的方法允许生产靶向敲入大鼠模型,该模型携带插入的DNA序列从1.2到3.0 kb大小,而无需显微注射技术。
Access restricted. Please log in or start a trial to view this content.
研究方案
所有实验程序均由密苏里大学机构动物护理和使用委员会(ACUC 协议 #25580)批准,并按照《实验动物使用和护理指南》中规定的指南进行。
1. AAV 介导的 DNA 修复模板递送
- 设计 DNA 构建体以在两个同源臂之间包含所需的敲入序列。典型的同源臂长度为 300-500 bp。通过克隆到适当的质粒骨架并包装到重组 ssAAV1 或 ssAAV6(血清型 1 或 6)中,确保整个 DNA 修复模板(同源臂 + 所需的敲入序列)两侧有倒置末端重复序列 (ITR)。
注意:如果 sgRNA 靶序列存在于 DNA 修复模板中,则重要的是设计沉默突变以破坏该序列,从而阻止 CRISPR-Cas9 介导的正确靶向等位基因的编辑。
注意:重组 AAV 病毒载体是非整合的,分类为 BSL-1。标准无菌技术用于移液和处理暴露于病毒的胚胎。 - 将工程化的 ssAAV1 或 ssAAV6(用 DNA 修复模板包装)加入 30 μL KSOM-R 培养基27,28 中,在矿物油下在 35 mm 培养皿中达到 3 ×10 7 个基因组拷贝 (GC)/μL 的终浓度。
- 将具有可见原核的受精卵放入含有工程化 ssAAV 的 KSOM-R 培养基中。
注意:使用此方案,无需稀释透明带,因为AAV血清型1和6能够轻松通过以进行有效的DNA修复模板递送。 - 在37°C下用5%CO2 和最大湿度孵育18-20小时,以允许足够的病毒转导。
2.电穿孔准备
- 第二天,在无菌 RNase 管中制备含有 100 ng/μL sgRNA 和 100 ng/μL Cas9 蛋白的电穿孔混合物,这些蛋白在 Opti-MEM 培养基中稀释。轻轻混合。
- 在室温下孵育 10 分钟以形成 RNP。
- 在孵育期间,打开电穿孔仪并将引线连接到 1.5 mm 间隙的载玻片电极。
- 如 表1所示设置电穿孔参数。
3. 2细胞胚胎电穿孔
- 在载玻片上的两个电极之间轻轻移液 5 μL CRISPR 电穿孔混合物,注意不要将气泡引入溶液中。
- 从AAV溶液中取出2细胞期胚胎。将 2 细胞阶段的胚胎排列在混合物中,不允许它们接触电极的侧面。这样做是为了避免裂解。
- 按 欧姆 按钮测量阻抗。检查以确保阻抗介于 0.100 和 0.300 kΩ 之间。反应体积将改变阻抗(增加体积以降低阻抗,减去体积以增加阻抗)。
- 按 开始。该过程只需几秒钟即可完成。
- 电穿孔后立即取出胚胎,并在新鲜的30μL KSOM-R培养基中洗涤3次。
- 将胚胎放回37°C培养箱中,在矿物油下放入500μL KSOM-R培养基中,在500μL KSOM-R培养基中进行体外培养。或者,通过手术将胚胎移植到后 1.5 天 (dpc) 假怀孕雌性大鼠以产生活体后代。
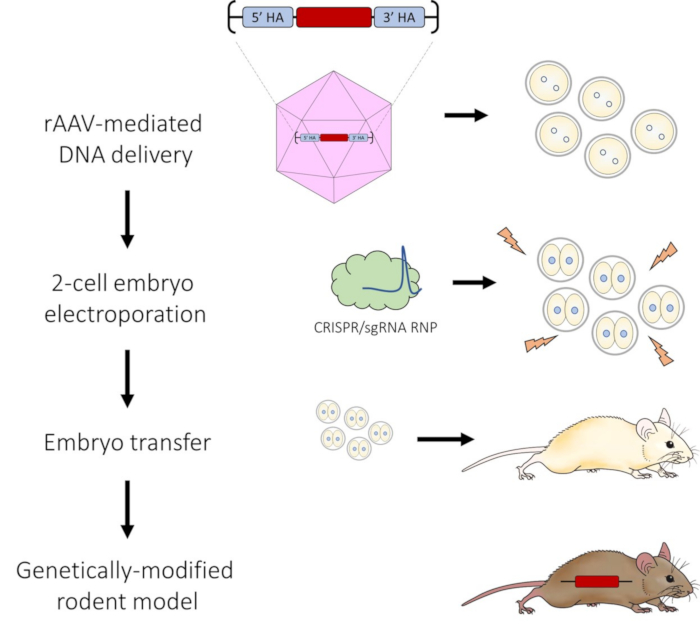
图 1:用于 CRISPR-Cas9 基因组编辑的 AAV 介导的 DNA 递送和 2 细胞胚胎电穿孔管道示意图。 请点击这里查看此图的较大版本.
Access restricted. Please log in or start a trial to view this content.
结果
根据该方案,在用 CRISPR-Cas9 RNP 电穿孔 2 细胞胚胎后,AAV 介导的 DNA 修复模板的有效递送允许高效的 HDR。如视频所示,成功的电穿孔过程会导致每个电极上形成气泡(图2C),阻抗保持在0.100和0.300 kΩ范围内。电穿孔后,胚胎肿胀填充透明带内的卵黄周围空间的情况并不少见(图3)。这种肿胀应该在培养数小时后消退。在电穿?...
Access restricted. Please log in or start a trial to view this content.
讨论
CRISPR-Cas基因组编辑系统通过允许在各种动物物种中高效生产直接和复杂的定制基因修饰,彻底改变了基因工程领域。与基因组编辑相关的技术的频繁改进和改进进一步增强了其多功能性。在这里,我们描述了一种使用 ssAAV 介导的 DNA 递送以及将 CRISPR-Cas9 试剂的 2 细胞胚胎电穿孔到 2 细胞啮齿动物胚胎中的新方法。我们已经证明,这是产生靶向敲入式动物模型的有效方法。
使...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有利益冲突需要声明。
致谢
作者要感谢诺兰·戴维斯(Nolan Davis)在摄像和视频编辑方面的帮助。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Leads with alligator clips for electrodes | NepaGene | C117 | |
| Mineral oil | MilliporeSigma | M5310 | |
| NepaGene21 Super Electroporator | NepaGene | NEPA21 | |
| Platinum plate electrodes on slide glass | NepaGene | CUY501P1-1.5 | |
| PURedit Cas9 Protein | MilliporeSigma | PECAS9 | |
| sgRNA (chemically-modified) | Synthego | N/A | |
| ssAAV1 or ssAAV6 packaged DNA repair template | Vectorbuilder | N/A |
参考文献
- Lau, C. H., Tin, C., Suh, Y. CRISPR-based strategies for targeted transgene knock-in and gene correction. Fac Rev. 9, 20(2020).
- Gutschner, T., Haemmerle, M., Genovese, G., Draetta, G. F., Chin, L. Post-translational Regulation of Cas9 during G1 Enhances Homology-Directed Repair. Cell Rep. 14 (6), 1555-1566 (2016).
- Zhang, J. P., et al. Efficient precise knockin with a double cut HDR donor after CRISPR/Cas9-mediated double-stranded DNA cleavage. Genome Biol. 18 (1), 35(2017).
- Miura, H., Quadros, R. M., Gurumurthy, C. B., Ohtsuka, M. Easi-CRISPR for creating knock-in and conditional knockout mouse models using long ssDNA donors. Nat Protoc. 13 (1), 195-215 (2018).
- Gu, B., Posfai, E., Gertsenstein, M., Rossant, J. Efficient generation of large-fragment knock-in mouse models using 2-cell (2C)-homologous recombination (HR)-CRISPR. Curr Protoc Mouse Biol. 10 (1), e67(2020).
- Gu, B., Posfai, E., Rossant, J. Efficient generation of targeted large insertions by microinjection into two-cell-stage mouse embryos. Nat Biotechnol. 36 (7), 632-637 (2018).
- Kurihara, T., et al. DNA repair protein RAD51 enhances the CRISPR/Cas9-mediated knock-in efficiency in brain neurons. Biochem Biophys Res Commun. 524 (3), 621-628 (2020).
- Kaneko, T., Sakuma, T., Yamamoto, T., Mashimo, T. Simple knockout by electroporation of engineered endonucleases into intact rat embryos. Sci Rep. 4, 6382(2014).
- Chen, S., Lee, B., Lee, A. Y., Modzelewski, A. J., He, L. Highly efficient mouse genome editing by CRISPR ribonucleoprotein electroporation of zygotes. J Biol Chem. 291 (28), 14457-14467 (2016).
- Hashimoto, M., Yamashita, Y., Takemoto, T. Electroporation of Cas9 protein/sgRNA into early pronuclear zygotes generates non-mosaic mutants in the mouse. Dev Biol. 418 (1), 1-9 (2016).
- Wang, W., et al. Delivery of Cas9 protein into mouse zygotes through a series of electroporation dramatically increases the efficiency of model creation. J Genet Genomics. 43 (5), 319-327 (2016).
- Troder, S. E., et al. An optimized electroporation approach for efficient CRISPR/Cas9 genome editing in murine zygotes. PLoS One. 13 (5), e0196891(2018).
- Teixeira, M., et al. Electroporation of mice zygotes with dual guide RNA/Cas9 complexes for simple and efficient cloning-free genome editing. Sci Rep. 8 (1), 474(2018).
- Tanihara, F., et al. Efficient generation of GGTA1-deficient pigs by electroporation of the CRISPR/Cas9 system into in vitro-fertilized zygotes. BMC Biotechnol. 20 (1), 40(2020).
- Tanihara, F., et al. Generation of CD163-edited pig via electroporation of the CRISPR/Cas9 system into porcine in vitro-fertilized zygotes. Anim Biotechnol. 32 (2), 147-154 (2021).
- Camargo, L. S. A., Owen, J. R., Van Eenennaam, A. L., Ross, P. J. Efficient one-step knockout by electroporation of ribonucleoproteins into zona-intact bovine embryos. Front Genet. 11, 570069(2020).
- Lin, J. C., Van Eenennaam, A. L. Electroporation-mediated genome editing of livestock zygotes. Front Genet. 12, 648482(2021).
- Betters, E., Charney, R. M., Garcia-Castro, M. I. Electroporation and in vitro culture of early rabbit embryos. Data Brief. 21, 316-320 (2018).
- Miyasaka, Y., et al. CLICK: one-step generation of conditional knockout mice. BMC Genomics. 19 (1), 318(2018).
- Epstein, B. E., Schaffer, D. V. Combining engineered nucleases with adeno-associated viral vectors for therapeutic gene editing. Adv Exp Med Biol. 1016, 29-42 (2017).
- Gaj, T., Epstein, B. E., Schaffer, D. V. Genome engineering using adeno-associated virus: basic and clinical research applications. Mol Ther. 24 (3), 458-464 (2016).
- Chen, S., et al. CRISPR-READI: Efficient generation of knockin mice by CRISPR RNP electroporation and AAV donor infection. Cell Rep. 27 (13), 3780-3789 (2019).
- Mizuno, N., et al. Intra-embryo gene cassette knockin by CRISPR/CAS9-mediated genome editing with adeno-associated viral vector. iScience. 9, 286-297 (2018).
- Davis, D. J., et al. Efficient DNA knock-in using AAV-mediated delivery with 2-cell embryo CRISPR-Cas9 electroporation. Front Genome Ed. 5, 1256451(2023).
- Smirnikhina, S. A., Zaynitdinova, M. I., Sergeeva, V. A., Lavrov, A. V. Improving homology-directed repair in genome editing experiments by influencing the cell cycle. Int J Mol Sci. 23 (11), (2022).
- Takata, M., et al. Homologous recombination and non-homologous end-joining pathways of DNA double-strand break repair have overlapping roles in the maintenance of chromosomal integrity in vertebrate cells. EMBO J. 17 (18), 5497-5508 (1998).
- Men, H., Stone, B. J., Bryda, E. C. Media optimization to promote rat embryonic development to the blastocyst stage in vitro. Theriogenology. 151, 81-85 (2020).
- Men, H., Amos-Landgraf, J. M., Bryda, E. C., Franklin, C. L. KSOM-R supports both mouse and rat preimplantation embryo development in vitro. Theriogenology. 198, 69-74 (2023).
- Romeo, C., et al. AAV diffuses across zona pellucida for effortless gene delivery to fertilized eggs. Biochem Biophys Res Commun. 526 (1), 85-90 (2020).
- Fulka, J., Moor, R. M., Fulka, J. Electrofusion of mammalian oocytes and embryonic cells. Methods Mol Biol. 48, 309-316 (1995).
- Rems, L., et al. Cell electrofusion using nanosecond electric pulses. Sci Rep. 3, 3382(2013).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。