このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
アデノ随伴ウイルス(AAV)と2細胞胚エレクトロポレーションを用いたラット胚のCRISPR-Cas9ゲノム編集
要約
このプロトコルは、遺伝子修正されたラットモデルを生成するための最適化されたアプローチを提示します。アデノ随伴ウイルス(AAV)はDNA修復テンプレートの送達に使用され、エレクトロポレーションはCRISPR-Cas9試薬の送達に使用され、2細胞胚のゲノム編集プロセスを完了します。
要約
ゲノム編集技術は、ラットを含む遺伝子改変動物の製造に広く利用されています。DNA修復テンプレートとCRISPR-Cas試薬の細胞質または前核注入は、胚への最も一般的な送達方法です。しかし、この種のマイクロマニピュレーションは、特殊な機器へのアクセスを必要とし、手間がかかり、ある程度の技術力が必要です。さらに、マイクロインジェクション技術は、胚に機械的ストレスがかかるため、胚の生存率が低下することがよくあります。このプロトコルでは、マイクロインジェクションを必要とせずに、CRISPR-Cas9ゲノム編集と連動する大きなDNA修復テンプレートを送達するための最適化された方法を開発しました。このプロトコルは、2細胞胚を変更するためにエレクトロポレーションによるCRISPR-Cas9リボ核タンパク質(RNP)の送達とともに、一本鎖DNAドナーテンプレートのAAV媒介DNA送達を組み合わせたものです。この斬新な戦略を用いて、1.2〜3.0kbのDNA配列を42%〜90%の効率で挿入する標的ノックインラットモデルを作製することに成功しました。
概要
CRISPRベースのゲノム編集ツールの開発により、より洗練された新しい遺伝子改変ラットモデルを効率的に生成する能力が加速しました。シングルガイドRNAは、Cas9ヌクレアーゼとともに結合して、ゲノム内の目的のDNA配列を標的とするリボ核タンパク質(RNP)複合体を形成し、二本鎖DNA切断を引き起こします。細胞DNA修復機構はエラーが発生しやすいため、修復プロセス中に挿入および欠失(INDEL)が導入され、標的遺伝子の機能を破壊する可能性があります。ゲノム編集試薬とともに目的の改変DNA配列(修復テンプレート)が共送達されると、二本鎖DNA切断を含む領域への修復テンプレートの挿入は、相同性指向性修復(HDR)と呼ばれるプロセスを通じて行われます。これは、ターゲットDNAの挿入/置換(ノックイン)を持つ動物モデルを生成するための効果的な戦略です。1つの制限は、ノックイン配列がしばしばサイズが大きいことであり、これは遺伝子編集効率を低下させ、したがって、目的のモデルを生成することをより困難にすることが示されている1。ノックイン効率を高めるための戦略には、二本鎖DNA(dsDNA)と一本鎖DNA(ssDNA)の両方の修復テンプレートの直鎖化と、DNA修復テンプレートの化学修飾が含まれます2,3,4。さらに、HDR刺激化合物を伴う前核マイクロインジェクション、マイクロインジェクションと組み合わせた電気パルスの適用、および2細胞胚への時限マイクロインジェクションがすべて試みられています5,6,7。これらのアプローチのいくつかは成功していますが、1.0 kbを超えるDNA配列の取り込みは依然として技術的に困難です。
エレクトロポレーションは、培養細胞株に試薬を導入するための一般的な方法であり、CRISPR-Cas9成分を胚に送達するためのマイクロインジェクションの代替手段となります。胚エレクトロポレーションは、ラットの胚8で初めて実証され、その後、マウス9,10,11,12,13、ブタ14,15、その他の動物モデル生物16,17,18の送達方法として成功裏に用いられてきた.CRISPR-Cas9試薬を含む培地に懸濁した胚を、キュベットまたは2つの電極の間のスライドガラスに入れ、直接パルスの電流を流します。これにより、透明帯と胚の原形質膜に一時的な開口部が生じ、そこからCRISPR-Cas9成分が胚に入ります。典型的には、中レベルの電気的な「孔あけ」パルスを使用して一時的な開口部を作成し、その後に負に帯電したゲノム編集コンポーネントの移動を容易にする低レベルの電気的な「転送パルス」が続きます。胚エレクトロポレーションは効率的で、スループットが高く、実行が容易です。しかし、胚エレクトロポレーションは、小さな(<200 bp)のssDNA修復テンプレートの導入に非常に成功することが示されていますが、より大きな(>1.0 kb)の修復テンプレートのエレクトロポレーションが成功したという報告はほとんどありません13,19。このサイズ制限は、大きな挿入を必要とするノックイン動物モデルを生成するための胚エレクトロポレーションの大きな制限を表しています。
遺伝子治療の文脈では、アデノ随伴ウイルス(AAV)は、分裂細胞と非分裂細胞の両方の効率的なin vivo感染性、病原性の欠如、およびまれなゲノム統合により、遺伝物質を送達する媒体として長い間使用されてきました20,21。最近では、AAVとCRISPR-Cas9技術を組み合わせて、DNA修復テンプレートとCRISPR試薬を導入する研究が増えています22,23,24。このアプローチにより、マイクロインジェクション技術を必要とせずに、より大きなDNA修復テンプレートを送達することができます。
HDR経路は、細胞周期の後期S期およびG2期でより活発になります25,26。in vitroで実施された研究では、CRISPR-Cas9 RNPとDNA修復テンプレートをG2同期細胞に送達するか、Cas9-Geminin融合タンパク質を用いてCas9タンパク質の存在を後期S期およびG2期に制限することにより、ノックイン効率の大幅な向上が達成されました2。さらに、2細胞期の胚の拡張G2期に発生する主要な接合性ゲノム活性化(ZGA)イベントがあり、これはオープンクロマチン状態に関連しています。これにより、CRISPR-Cas9 RNPと修復テンプレートがゲノムDNAにアクセスしやすくなると推測されます。
私たちの目標は、AAVアプローチと胚エレクトロポレーションを組み合わせて、胚発生の2細胞段階でCRISPR-Cas9 RNPを導入することで、これらすべての観察結果に基づいて構築することでした。この戦略は、AAVのより大きなDNA修復テンプレート送達能力、エレクトロポレーションの技術的容易さ、および胚発生中のゲノムアクセスのためのより最適な2細胞時点を利用して、DNA挿入の標的遺伝子工学のための効率的な方法を作成します。このプロトコルで強調されるように、私達の最大限に活用された方法はmicroinjectionの技術の必要性なしでサイズの1.2から3.0 kbにDNAシーケンスの挿入を運ぶ目標とされたノックインラットモデルの生産を可能にする。
Access restricted. Please log in or start a trial to view this content.
プロトコル
すべての実験手順は、ミズーリ大学の施設動物管理および使用委員会(ACUCプロトコル#25580)によって承認され、実験動物の使用とケアに関するガイドに記載されているガイドラインに従って実施されました。
1. AAVを介したDNA修復テンプレートの送達
- 2つの相同性アームの間に目的のノックイン配列を含むようにDNAコンストラクトを設計します。典型的な相同アームの長さは、長さが300〜500bpである。適切なプラスミドバックボーンにクローニングし、組換え ssAAV1 または ssAAV6(血清型 1 または 6)にパッケージングすることにより、DNA 修復テンプレート全体(相同アーム + 目的のノックイン配列)に逆末端反復配列(ITR)が挟まれていることを確認します。
注:sgRNAの標的配列がDNA修復テンプレートに存在する場合、この配列を破壊するサイレント変異を操作し、CRISPR-Cas9を介した正しく標的対立遺伝子の編集を防ぐことが重要です。
注意:組換えAAVウイルスベクターは非積分であり、BSL-1に分類されます。標準的な無菌技術は、ウイルスに曝露された胚のピペッティングと取り扱いに使用されます。 - 改変したssAAV1またはssAAV6(DNA修復テンプレートと同梱)を30 μLのKSOM-R培地27,28に添加し、35 mmシャーレの鉱油下で最終濃度が3 × 107ゲノムコピー(GC)/μLになるようにします。
- 目に見える前核を有する受精卵を、改変されたssAAVを含むKSOM-R培地に入れます。
注:このプロトコルを使用してAAVの血清型1および6が有効なDNA修理テンプレート配達のために容易に渡れるのでpellucida帯を薄くする必要はありません。 - 37°C、5%CO2 、最大湿度で18〜20時間インキュベートし、十分なウイルス形質導入を可能にします。
2. エレクトロポレーションの準備
- 翌日、100 ng/μL の sgRNA と 100 ng/μL の Cas9 タンパク質を含むエレクトロポレーション混合物を、滅菌 RNase フリーチューブ内の Opti-MEM 培地で希釈します。やさしく混ぜます。
- 室温で10分間インキュベートし、RNPの形成を可能にします。
- インキュベーション時間中に、エレクトロポレーターをオンにし、リード線を1.5mmギャップのスライドガラス電極に接続します。
- エレクトロポレーションパラメータを 表1に記載のとおりに設定します。
3. 2細胞胚エレクトロポレーション
- CRISPRエレクトロポレーション混合物5μLをスライドガラス上の2つの電極の間に静かにピペットで移し、溶液に気泡が入らないように注意します。
- AAV溶液から2細胞期の胚を取り除きます。2細胞期の胚を電極の側面に触れさせないように混合物に並べます。これは溶解を避けるために行われます。
- オームボタンを押してインピーダンスを測定します。インピーダンスが0.100〜0.300kΩであることを確認してください。反応体積はインピーダンスを変化させます(体積を加算してインピーダンスを減少させ、体積を減算してインピーダンスを増加させます)。
- [開始]を押します。このプロセスは完了するまでに数秒かかります。
- エレクトロポレーションの直後に胚を除去し、新鮮な30μL滴のKSOM-R培地で3回洗浄します。
- 胚を5%CO2 、最大湿度の37°Cのインキュベーターに戻し、鉱物油下で500μL滴のKSOM-R培地で in vitro 培養します。あるいは、胚を1.5日分娩後(dpc)の偽妊娠雌ラットに外科的に移植して、生きた子孫を産出します。
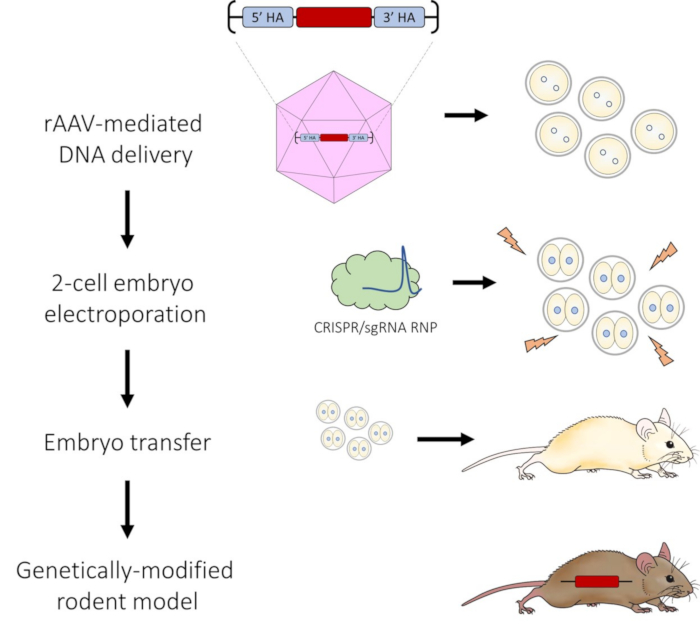
図1:CRISPR-Cas9ゲノム編集のためのAAVを介したDNA送達と2細胞胚エレクトロポレーションパイプラインの概略図。 この図の拡大版をご覧になるには、ここをクリックしてください。
Access restricted. Please log in or start a trial to view this content.
結果
プロトコルに続いて、2細胞胚がCRISPR-Cas9 RNPでエレクトロポレーションされた後、DNA修復テンプレートの効果的なAAV媒介送達があり、非常に効率的なHDRが可能になります。ビデオに示されているように、エレクトロポレーションプロセスが成功すると、各電極に気泡が形成され(図2C)、インピーダンスは0.100〜0.300kΩの範囲にとどまります。エレク?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
CRISPR-Casゲノム編集システムは、さまざまな動物種において、単純な遺伝子組み換えと複雑な遺伝子組み換えの両方を効率的に生産できるようにすることで、遺伝子工学の分野に革命をもたらしました。ゲノム編集に関連する技術の頻繁な改良と改善により、その汎用性はさらに高まっています。ここでは、ssAAVを介したDNA送達と、CRISPR-Cas9試薬の2細胞胚エレクトロポレーションを2細胞げっ歯...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は、宣言すべき利益相反を持っていません。
謝辞
著者は、ビデオ撮影とビデオ編集の支援をしてくれたノーラン・デイビスに感謝します。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Leads with alligator clips for electrodes | NepaGene | C117 | |
| Mineral oil | MilliporeSigma | M5310 | |
| NepaGene21 Super Electroporator | NepaGene | NEPA21 | |
| Platinum plate electrodes on slide glass | NepaGene | CUY501P1-1.5 | |
| PURedit Cas9 Protein | MilliporeSigma | PECAS9 | |
| sgRNA (chemically-modified) | Synthego | N/A | |
| ssAAV1 or ssAAV6 packaged DNA repair template | Vectorbuilder | N/A |
参考文献
- Lau, C. H., Tin, C., Suh, Y. CRISPR-based strategies for targeted transgene knock-in and gene correction. Fac Rev. 9, 20(2020).
- Gutschner, T., Haemmerle, M., Genovese, G., Draetta, G. F., Chin, L. Post-translational Regulation of Cas9 during G1 Enhances Homology-Directed Repair. Cell Rep. 14 (6), 1555-1566 (2016).
- Zhang, J. P., et al. Efficient precise knockin with a double cut HDR donor after CRISPR/Cas9-mediated double-stranded DNA cleavage. Genome Biol. 18 (1), 35(2017).
- Miura, H., Quadros, R. M., Gurumurthy, C. B., Ohtsuka, M. Easi-CRISPR for creating knock-in and conditional knockout mouse models using long ssDNA donors. Nat Protoc. 13 (1), 195-215 (2018).
- Gu, B., Posfai, E., Gertsenstein, M., Rossant, J. Efficient generation of large-fragment knock-in mouse models using 2-cell (2C)-homologous recombination (HR)-CRISPR. Curr Protoc Mouse Biol. 10 (1), e67(2020).
- Gu, B., Posfai, E., Rossant, J. Efficient generation of targeted large insertions by microinjection into two-cell-stage mouse embryos. Nat Biotechnol. 36 (7), 632-637 (2018).
- Kurihara, T., et al. DNA repair protein RAD51 enhances the CRISPR/Cas9-mediated knock-in efficiency in brain neurons. Biochem Biophys Res Commun. 524 (3), 621-628 (2020).
- Kaneko, T., Sakuma, T., Yamamoto, T., Mashimo, T. Simple knockout by electroporation of engineered endonucleases into intact rat embryos. Sci Rep. 4, 6382(2014).
- Chen, S., Lee, B., Lee, A. Y., Modzelewski, A. J., He, L. Highly efficient mouse genome editing by CRISPR ribonucleoprotein electroporation of zygotes. J Biol Chem. 291 (28), 14457-14467 (2016).
- Hashimoto, M., Yamashita, Y., Takemoto, T. Electroporation of Cas9 protein/sgRNA into early pronuclear zygotes generates non-mosaic mutants in the mouse. Dev Biol. 418 (1), 1-9 (2016).
- Wang, W., et al. Delivery of Cas9 protein into mouse zygotes through a series of electroporation dramatically increases the efficiency of model creation. J Genet Genomics. 43 (5), 319-327 (2016).
- Troder, S. E., et al. An optimized electroporation approach for efficient CRISPR/Cas9 genome editing in murine zygotes. PLoS One. 13 (5), e0196891(2018).
- Teixeira, M., et al. Electroporation of mice zygotes with dual guide RNA/Cas9 complexes for simple and efficient cloning-free genome editing. Sci Rep. 8 (1), 474(2018).
- Tanihara, F., et al. Efficient generation of GGTA1-deficient pigs by electroporation of the CRISPR/Cas9 system into in vitro-fertilized zygotes. BMC Biotechnol. 20 (1), 40(2020).
- Tanihara, F., et al. Generation of CD163-edited pig via electroporation of the CRISPR/Cas9 system into porcine in vitro-fertilized zygotes. Anim Biotechnol. 32 (2), 147-154 (2021).
- Camargo, L. S. A., Owen, J. R., Van Eenennaam, A. L., Ross, P. J. Efficient one-step knockout by electroporation of ribonucleoproteins into zona-intact bovine embryos. Front Genet. 11, 570069(2020).
- Lin, J. C., Van Eenennaam, A. L. Electroporation-mediated genome editing of livestock zygotes. Front Genet. 12, 648482(2021).
- Betters, E., Charney, R. M., Garcia-Castro, M. I. Electroporation and in vitro culture of early rabbit embryos. Data Brief. 21, 316-320 (2018).
- Miyasaka, Y., et al. CLICK: one-step generation of conditional knockout mice. BMC Genomics. 19 (1), 318(2018).
- Epstein, B. E., Schaffer, D. V. Combining engineered nucleases with adeno-associated viral vectors for therapeutic gene editing. Adv Exp Med Biol. 1016, 29-42 (2017).
- Gaj, T., Epstein, B. E., Schaffer, D. V. Genome engineering using adeno-associated virus: basic and clinical research applications. Mol Ther. 24 (3), 458-464 (2016).
- Chen, S., et al. CRISPR-READI: Efficient generation of knockin mice by CRISPR RNP electroporation and AAV donor infection. Cell Rep. 27 (13), 3780-3789 (2019).
- Mizuno, N., et al. Intra-embryo gene cassette knockin by CRISPR/CAS9-mediated genome editing with adeno-associated viral vector. iScience. 9, 286-297 (2018).
- Davis, D. J., et al. Efficient DNA knock-in using AAV-mediated delivery with 2-cell embryo CRISPR-Cas9 electroporation. Front Genome Ed. 5, 1256451(2023).
- Smirnikhina, S. A., Zaynitdinova, M. I., Sergeeva, V. A., Lavrov, A. V. Improving homology-directed repair in genome editing experiments by influencing the cell cycle. Int J Mol Sci. 23 (11), (2022).
- Takata, M., et al. Homologous recombination and non-homologous end-joining pathways of DNA double-strand break repair have overlapping roles in the maintenance of chromosomal integrity in vertebrate cells. EMBO J. 17 (18), 5497-5508 (1998).
- Men, H., Stone, B. J., Bryda, E. C. Media optimization to promote rat embryonic development to the blastocyst stage in vitro. Theriogenology. 151, 81-85 (2020).
- Men, H., Amos-Landgraf, J. M., Bryda, E. C., Franklin, C. L. KSOM-R supports both mouse and rat preimplantation embryo development in vitro. Theriogenology. 198, 69-74 (2023).
- Romeo, C., et al. AAV diffuses across zona pellucida for effortless gene delivery to fertilized eggs. Biochem Biophys Res Commun. 526 (1), 85-90 (2020).
- Fulka, J., Moor, R. M., Fulka, J. Electrofusion of mammalian oocytes and embryonic cells. Methods Mol Biol. 48, 309-316 (1995).
- Rems, L., et al. Cell electrofusion using nanosecond electric pulses. Sci Rep. 3, 3382(2013).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved