Method Article
بكتيريا الطباعة ثلاثية الأبعاد لدراسة الحركة والنمو في الوسائط المسامية ثلاثية الأبعاد المعقدة
In This Article
Summary
يصف هذا البروتوكول إجراء للطباعة ثلاثية الأبعاد (3D) للمستعمرات البكتيرية لدراسة حركتها ونموها في مصفوفات هيدروجيل مسامية ثلاثية الأبعاد معقدة تشبه موائلها الطبيعية أكثر من الثقافات السائلة التقليدية أو أطباق بتري.
Abstract
البكتيريا موجودة في كل مكان في البيئات المسامية المعقدة ثلاثية الأبعاد (3D) ، مثل الأنسجة البيولوجية والمواد الهلامية ، والتربة تحت السطحية والرواسب. ومع ذلك ، فقد ركزت غالبية الأعمال السابقة على دراسات الخلايا في السوائل السائبة أو على الأسطح المستوية ، والتي لا تلخص بشكل كامل تعقيد العديد من الموائل البكتيرية الطبيعية. هنا ، يتم معالجة هذه الفجوة في المعرفة من خلال وصف تطوير طريقة لطباعة مستعمرات كثيفة من البكتيريا 3D إلى مصفوفات هيدروجيل حبيبية محشورة. هذه المصفوفات لها أحجام مسام قابلة للضبط وخصائص ميكانيكية. أنها تحصر الخلايا جسديا ، وبالتالي دعمها في 3D. إنها شفافة بصريا ، مما يسمح بالتصور المباشر لانتشار البكتيريا عبر محيطها باستخدام التصوير. كدليل على هذا المبدأ ، هنا ، يتم إثبات قدرة هذا البروتوكول من خلال الطباعة ثلاثية الأبعاد والتصوير غير المتحرك والكوليرا Vibro ، وكذلك الإشريكية القولونية غير المتحركة ، في مصفوفات هيدروجيل حبيبية محشورة بأحجام مختلفة من المسام الخلالية.
Introduction
غالبا ما تعيش البكتيريا في بيئات مسامية 3D متنوعة ومعقدة تتراوح من المواد الهلامية المخاطية في الأمعاء والرئتين إلى التربة في الأرض1،2،3،4،5،6،7،8،9،10،11،12،13،14،15 ، 16، 17، 18، 19، 20، 21،
22,23,24,25. في هذه الظروف ، يمكن إعاقة الحركة البكتيرية من خلال الحركة أو النمو بسبب العوائق المحيطة ، مثل شبكات البوليمر أو حزم الحبوب المعدنية الصلبة - مما يؤثر على قدرة الخلايا على الانتشار عبر بيئاتها26 ، والوصول إلى مصادر المغذيات ، واستعمار تضاريس جديدة ، وتشكيل مجتمعات الأغشية الحيوية الواقية27. ومع ذلك ، تستخدم الدراسات المعملية التقليدية عادة هندسة مبسطة للغاية ، مع التركيز على الخلايا في الثقافات السائلة أو على الأسطح المستوية. في حين أن هذه الأساليب تسفر عن رؤى رئيسية في علم الأحياء الدقيقة ، إلا أنها لا تلخص بشكل كامل تعقيد الموائل الطبيعية ، مما يؤدي إلى اختلافات كبيرة في معدلات النمو وسلوك الحركة مقارنة بالقياسات التي يتم إجراؤها في بيئات العالم الحقيقي. لذلك ، هناك حاجة ماسة إلى طريقة لتحديد المستعمرات البكتيرية ودراسة حركتها ونموها في البيئات المسامية 3D الأقرب إلى العديد من موائلها الطبيعية.
إن تلقيح الخلايا في هلام أجار ثم تصور انتشارها العياني بالعين أو باستخدام الكاميرا يوفر طريقة واحدة مباشرة لتحقيق ذلك ، كما اقترح لأول مرة من قبل Tittsler و Sandholzer في 193628. ومع ذلك ، يعاني هذا النهج من عدد من التحديات التقنية الرئيسية: (1) في حين أن أحجام المسام يمكن ، من حيث المبدأ ، أن تختلف عن طريق تغيير تركيز الأغاروز ، فإن بنية المسام لهذه المواد الهلامية غير محددة بشكل جيد. (2) يؤدي تشتت الضوء إلى تعكر هذه المواد الهلامية ، مما يجعل من الصعب تصور الخلايا على المستوى الفردي بدقة عالية ودقة ، خاصة في العينات الكبيرة ؛ (3) عندما يكون تركيز الآجار كبيرا جدا ، تقتصر هجرة الخلايا على السطح المسطح العلوي للهلام ؛ (4) إن الريولوجيا المعقدة لمثل هذه المواد الهلامية تجعل من الصعب إدخال لقاح بأشكال هندسية محددة جيدا.
لمعالجة هذه القيود ، في العمل السابق ، طور مختبر داتا نهجا بديلا باستخدام مصفوفات هيدروجيل حبيبية - تتألف من جزيئات هيدروجيل محشورة ومتوافقة حيويا منتفخة في الثقافة البكتيرية السائلة - ك "أطباق بتري مسامية" لحصر الخلايا في 3D. هذه المصفوفات هي المواد الصلبة لينة ، الشفاء الذاتي ، الإجهاد الغلة. وبالتالي ، على عكس المواد الهلامية المتشابكة المستخدمة في عمليات الطباعة الحيوية الأخرى ، يمكن لفوهة الحقن الدقيقة أن تتحرك بحرية داخل المصفوفة على طول أي مسار 3D محدد عن طريق إعادة ترتيب جزيئات الهيدروجيل محليا29. ثم تعيد هذه الجسيمات تكثيفها بسرعة وتلتئم ذاتيا حول البكتيريا المحقونة ، مما يدعم الخلايا في مكانها دون أي معالجة ضارة إضافية. وبالتالي ، فإن هذه العملية هي شكل من أشكال الطباعة ثلاثية الأبعاد التي تمكن من ترتيب الخلايا البكتيرية - في بنية ثلاثية الأبعاد مرغوبة ، مع تكوين مجتمع محدد - داخل مصفوفة مسامية لها خصائص فيزيائية كيميائية قابلة للضبط. علاوة على ذلك ، فإن مصفوفات الهيدروجيل شفافة تماما ، مما يتيح تصور الخلايا مباشرة باستخدام التصوير.
وقد تم إثبات فائدة هذا النهج سابقا بطريقتين. في مجموعة واحدة من الدراسات ، تم تشتيت الخلايا المخففة في جميع أنحاء مصفوفة هيدروجيل ، مما مكن من إجراء دراسات على حركة البكتيريا الفردية 30,31. في مجموعة أخرى من الدراسات ، تمت طباعة المجتمعات متعددة الخلايا ثلاثية الأبعاد في مواد هلامية على نطاق سنتيمتر باستخدام فوهة حقن مثبتة على مرحلة مجهر قابلة للبرمجة ، مما مكن من إجراء دراسات لانتشار الجماعات البكتيرية عبر محيطها32،33. في كلتا الحالتين ، كشفت هذه الدراسات عن اختلافات غير معروفة سابقا في خصائص انتشار البكتيريا التي تعيش في البيئات المسامية مقارنة بتلك الموجودة في الثقافة السائلة / على الأسطح المستوية. ومع ذلك ، نظرا لأنها تم تركيبها على مرحلة المجهر ، فقد اقتصرت هذه الدراسات السابقة على أحجام عينات صغيرة (~ 1 مل) ، وبالتالي ، مقاييس زمنية تجريبية قصيرة. كما كانت محدودة في قدرتها على تحديد هندسة اللقاح بدقة مكانية عالية.
هنا ، يتم وصف الجيل التالي من هذه المنصة التجريبية التي تعالج كلا القيدين. على وجه التحديد ، يتم توفير البروتوكولات التي يمكن للمرء من خلالها استخدام طابعة 3D معدلة مع آلة بثق حقنة مرفقة بطباعة 3D وتصوير المستعمرات البكتيرية على نطاقات كبيرة. علاوة على ذلك ، تشير البيانات التمثيلية إلى كيف يمكن أن يكون هذا النهج مفيدا لدراسة حركة البكتيريا ونموها ، باستخدام ضمة الكوليرا السابقة والعوالق الإشريكية القولونية كأمثلة. يتيح هذا النهج الحفاظ على المستعمرات البكتيرية على مدى فترات طويلة وتصورها باستخدام تقنيات التصوير المختلفة. وبالتالي ، فإن قدرة هذا النهج على دراسة المجتمعات البكتيرية في الموائل المسامية 3D لديها إمكانات بحثية وتطبيقية هائلة ، مما يؤثر على علاج ودراسة الميكروبات في الأمعاء والجلد والرئة والتربة. علاوة على ذلك ، يمكن استخدام هذا النهج في المستقبل لطباعة المواد الحية المهندسة القائمة على البكتيريا 3D إلى أشكال قائمة بذاتها أكثر تعقيدا.
Protocol
هذا النهج هو تحويل طابعة نمذجة الترسيب المنصهرة ثلاثية الأبعاد التجارية إلى طابعة حيوية ثلاثية الأبعاد باستخدام بروتوكول تم إنشاؤه مسبقا بواسطة Tashman et al.34. باختصار ، استبدل Tashman et al. رأس الطارد التجاري بآلة بثق مضخة حقنة مصنوعة خصيصا. يتيح هذا الطارد طباعة معلقات سائلة عالية التركيز للخلايا البكتيرية في 3D ، مع حجمها المبثوق وموضع 3D الذي يتم التحكم فيه بواسطة لغة برمجة G-code. يتم تحديد وحدة التخزين المبثوقة في البرنامج بواسطة خطوة الطارد (E-step) ويتم معايرتها بشكل إضافي كما هو موضح أدناه. وبالتالي تتم طباعة هذه المعلقات البكتيرية مباشرة في مصفوفة هيدروجيل حبيبية ، والتي تعمل كدعم 3D للخلايا. أدناه ، يصف البروتوكول أيضا كيفية تحضير المصفوفات بتركيزات مختلفة من البوليمر ، وتوصيف التغيرات الناتجة في حجم المسام والخصائص الريولوجية ، وتوصيف الحركة البكتيرية اللاحقة والنمو باستخدام التصوير المباشر.
1. تحويل طابعة ثلاثية الأبعاد تجارية إلى طابعة حيوية ثلاثية الأبعاد
- قم بإزالة الطارد والسخان من طابعة 3D تجارية (انظر جدول المواد).
- اتبع البروتوكولات السابقة لتصنيع آلة بثق مضخة الحقنة34 ، مع تعديل إضافي لاستيعاب حقنة قفل Luer التي تستخدم لمرة واحدة. قم بتركيب آلة بثق مضخة المحقنة على الطابعة.
ملاحظة: يتم توفير ملفات CAD المطلوبة لتعديل آلة بثق مضخة المحقنة للمحاقن البلاستيكية في الملفات التكميلية 1-3. - قم بتثبيت برنامج طابعة 3D وفتحه (انظر جدول المواد) على جهاز كمبيوتر. قم بتوصيل طابعة 3D بالكمبيوتر.
- قم بتحميل حقنة سعة 1 مل يمكن التخلص منها بإبرة ذات حجم مناسب في المشابك المطبوعة ثلاثية الأبعاد عن طريق محاذاة النصفين العلوي والسفلي للآلية (الشكل 1). قم بتأمين المشابك حول المحقنة باستخدام ثلاثة مسامير مقبس M8 وصواميل سداسية فولاذية رفيعة (انظر جدول المواد). يتصل مكبس المحقنة بالمسمار اللولبي في آلة بثق مضخة المحقنة. ارفع المكبس يدويا عن طريق تدوير المسمار اللولبي لإنشاء فجوة هواء 0.5 مل في المحقنة.
- إذا كان التلوث مصدر قلق للتجربة ، فقم بنقل مركب مشبك المحقنة إلى غطاء حيوي وتعقيمه برذاذ الإيثانول بنسبة 70٪ عند الدخول قبل إكمال الخطوات التالية.
2. إعداد التعليق البكتيري
- بالنسبة لبكتيريا V. cholerae و E. coli ، تنمو طوال الليل على صفيحة أجار Lennox LB (مرق لوريا ، انظر جدول المواد) بنسبة 2٪ عند 37 درجة مئوية.
- بالنسبة لبكتيريا V. cholerae ، قم بتلقيح الخلايا في 3 مل من LB السائل بعشر حبات زجاجية معقمة. تنمو الخلايا في حاضنة اهتزاز عند 37 درجة مئوية لمدة 5-6 ساعات حتى المرحلة الأسية المتوسطة إلى كثافة بصرية (OD) 600 من ~ 0.9.
- بالنسبة للإشريكية القولونية، قم بتلقيح الخلايا في 3 مل من LB السائل. تنمو الخلايا في حاضنة تهتز عند 37 درجة مئوية طوال الليل. قم بتطهير 200 ميكرولتر من الاستزراع الليلي في رطل جديد لمدة 3 ساعات حتى يصل OD إلى 0.6.
- نقل الثقافة إلى أنبوب طرد مركزي 10 مل. أجهزة الطرد المركزي الثقافة لمدة 5 دقائق عند 5000 × غرام في درجة حرارة الغرفة لتشكيل بيليه. إزالة الطاف. أعد التعليق باستخدام ~ 10 ميكرولتر من LB السائل لتحقيق كثافة خلية ~ 9 × 1010 خلايا لكل مل.
3. تحميل التعليق البكتيري في المحقنة
ملاحظة: يتم توفير طريقتين لتحميل البكتيريا في المحقنة (الخطوة 3.1 والخطوة 3.2). تعمل الخطوة 3.1 لتحميل كميات صغيرة من المعلقات البكتيرية ، <200 ميكرولتر ، والخطوة 3.2 تعمل على تحميل كميات أكبر من المعلقات البكتيرية ، >200 ميكرولتر. تم استخدام الخطوة 3.1 للنتائج التمثيلية الموضحة هنا.
- قم بتحميل حقنة قفل بلاستيكية فارغة سعة 1 مل في الطابعة الحيوية ثلاثية الأبعاد. قم بتوصيل مكبس المحقنة بالمسمار اللولبي. اسحب المحقنة يدويا لإضافة 0.2 مل من فجوة الهواء لتوفير مساحة للمكبس للتحرك في المحقنة حيث يتم استخدام حجم صغير من الخلايا ~ 20-50 ميكرولتر لكل دفعة من التجارب.
- قم بتوصيل إبرة حادة بطرف المحقنة بحجم الإبرة اللازم لحجم ميزات الطباعة المطلوبة. هنا ، يتم استخدام إبرة 2 بوصة 20 جرام.
- قم بتحميل التعليق البكتيري في المحقنة عن طريق وضع أنبوب طرد مركزي سعة 10 مل مع اللقاح البكتيري أسفل الإبرة. قم بتدوير المسمار يدويا لسحب مكبس المحقنة وتحميل الخلايا في المحقنة. أحجام الخلايا البكتيرية صغيرة جدا لدرجة أنه في كثير من الأحيان ، يتم تحميل الخلايا فقط في الإبرة.
- قم بإزالة المكبس من مجمع مشبك المحاقن واستخدم حقنة وإبرة أخرى لتحميل مركب مشبك المحقنة بعناية مع المعلقات البكتيرية المطلوبة ، مع الحرص على تجنب حبس فقاعات الهواء. يجب ملء مجمع مشبك المحقنة قليلا فوق الحافة بالتعليق البكتيري المطلوب ثم نقله إلى الطابعة الحيوية.
- أدخل بعناية مجمع مشبك المحقنة بدون المكبس في المقبس المقابل على النواة الرئيسية لآلة بثق الطابعة الحيوية.
- تأكد من أن حامل الطابعة في منتصف الطريق تقريبا أعلى المسمار اللولبي ، وأن طبق التجميع موجود أسفل المحقنة المحملة. بعد ذلك ، أدخل المكبس بعناية من خلال كل من العربة ومجمع مشبك المحاقن حتى يمسك بالعربة. اضغط على المكبس ببطء في التعليق البكتيري لتجنب حبس فقاعات الهواء في المحقنة.
- حرك مشبك المحول على الحامل فوق الجزء الخلفي من المكبس لتثبيته في مكانه لكل من مناورات البثق والسحب.
4. معايرة خطوة الطارد إلى الحجم المودع
- لمعايرة خطوة الطارد (E-step) إلى الحجم المودع ، قم أولا بإعداد الطابعة الحيوية باستخدام المحقنة الدقيقة وإبرة المحقنة والتعليق البكتيري الذي سيتم استخدامه في التجربة. هنا ، يتم استخدام حقنة قفل Luer سعة 1 مل.
- حدد نطاق الخطوة E المقدر للمعايرة عن طريق بثق رقم الخطوة E التعسفي (~ 200) ولاحظ تغيير حجم المكبس باستخدام علامات حجم المحقنة.
- استخدم هذه النسبة الخشنة E-step إلى مستوى الصوت لتحديد إعدادات E-step لإجراء مسح المعايرة. على سبيل المثال ، إذا كانت الخطوة E المكونة من 200 تقذف حوالي 20 ميكرولتر عن طريق الفحص البصري وأراد المرء إيداع 10-200 ميكرولتر ، فاختبر الخطوات الإلكترونية بين 100-2000.
- لإجراء مسح المعايرة الخطية، قم أولا بتسمية وقياس الكتلة الجافة لعشرين أنبوب أخذ عينات سعة 1.5 مل على ميزان تحليلي بحساسية 0.1 ملغ.
- قذف المعلق البكتيري في أنابيب 1.5 مل المقاسة مسبقا. لكل خطوة إلكترونية ، قم بإجراء نسخ متماثلة 2 على الأقل. كرر لجميع الخطوات E على النطاق الخطي ، مع استبدال التعليق البكتيري حسب الضرورة. إذا كان التلوث مصدر قلق للتجربة ، امسح الجزء الخارجي من إبرة المحقنة بمنديل خال من النسالة مشبع بنسبة 70٪ من الإيثانول بعد كل عينة.
- قم بقياس كتلة جميع الأنابيب التي تبلغ سعتها 1.5 مل بنفس الميزان التحليلي. اطرح قيمة الكتلة الأولى من الثانية للحصول على كتلة صافية من التعليق البكتيري المودعة.
- تحويل كتلة التعليق البكتيري إلى حجم مع كثافة المواد. بالنسبة للعديد من المعلقات البكتيرية المكونة أساسا من الماء ، فإن 1 جم / مل هو تقريب مناسب للكثافة.
- قم بإجراء ملاءمة خطية بين الخطوة E والحجم المبثوق لإنهاء عملية المعايرة.
5. إعداد مصفوفة هيدروجيل الحبيبية
- في خزانة السلامة الأحيائية ، أضف حبيبات جافة من البوليمرات المشتركة لحمض الأكريليك / ألكيل أكريليت المتصالب (انظر جدول المواد) إلى 400 مل من 2٪ Lennox Luria-Bertani (LB) للحفاظ على المصفوفة معقمة ؛ ومع ذلك ، يمكن أيضا استخدام وسائط زراعة الخلايا السائلة الأخرى لتضخيم مصفوفة الهيدروجيل.
ملاحظة: تعتمد نسبة وزن الحبيبات المضافة إلى LB على حجم المسام الذي يهدف إليه المرء. في الدراسة الحالية ، بالنسبة لمصفوفة هيدروجيل حبيبي بنسبة 0.9٪ ، تتم إضافة 3.6 جم من الحبيبات الجافة إلى LB ولمصفوفة هيدروجيل حبيبية بنسبة 1.2٪ ، تتم إضافة 4.8 جم من الحبيبات الجافة إلى LB. يتم تشتيت حبيبات الهيدروجيل بشكل متجانس عن طريق خلطها في خلاط عمودي لمدة 2 دقيقة. - بمجرد الخلط ، اضبط الرقم الهيدروجيني على 7.4 عن طريق إضافة زيادات من 20 إلى 500 ميكرولتر من هيدروكسيد الصوديوم 10 M (NaOH) لضمان بقاء الخلية. بعد كل إضافة لهيدروكسيد الصوديوم، قم بقياس الأس الهيدروجيني عن طريق غمس طرف ماصة في الخليط ثم مسح مصفوفة الهيدروجيل على ورقة اختبار الأس الهيدروجيني.
ملاحظة: عند إضافة NaOH ، ستزداد لزوجة الخليط عندما تبدأ حبيبات الهيدروجيل في الانتفاخ. يبلغ قطر حبيبات الهيدروجيل المنتفخة ~ 5 ميكرومتر إلى 10 ميكرومتر وتتكدس معا في مصفوفة هيدروجيل. حجم الشبكة الداخلية للحبيبات هو ~ 40 نانومتر إلى 100 نانومتر ، كما هو محدد سابقا32. حجم الشبكة كبير بما يكفي للجزيئات الصغيرة (مثل الأكسجين والمواد المغذية) لتنتشر بحرية ولكنه صغير بما يكفي لحصر البكتيريا بين المسام الخلالية. - بعد ذلك ، قم بنقل مصفوفة الهيدروجيل الحبيبية إلى أنبوب طرد مركزي سعة 50 مل باستخدام حقنة بلاستيكية معقمة سعة 50 مل. جهاز طرد مركزي مصفوفة هيدروجيل عند 161 × جم لمدة 1 دقيقة في درجة حرارة الغرفة لإزالة الفقاعات التي تشكلت أثناء عملية الخلط.
- السماح لمصفوفة هيدروجيل للجلوس لمدة 2 أيام على الأقل في درجة حرارة الغرفة لضمان عدم حدوث تلوث. يظهر التلوث كمستعمرات دقيقة معلقة في مصفوفة الهيدروجيل. بعد يومين ، قم بطرد مصفوفة الهيدروجيل عند 161 × جم لمدة 1 دقيقة لإزالة أي فقاعات إضافية تشكلت.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا عن طريق تخزين مصفوفة الهيدروجيل في درجة حرارة الغرفة لمدة تصل إلى أسبوع. - في خزانة السلامة البيولوجية ، باستخدام حقنة بلاستيكية معقمة سعة 30 مل ، قم بنقل الكمية المطلوبة من مصفوفة الهيدروجيل إلى الحاوية حيث ستحدث الطباعة (هنا ~ 20 مل لقارورة زراعة الأنسجة 20 مل أو 1 مل ل 1 مل من البلاستيك الصغير تم استخدام cuvettes).
6. توصيف الخصائص الريولوجية لمصفوفة الهيدروجيل الحبيبية
- قم بتحميل ~ 3 مل من مصفوفة الهيدروجيل في مقياس ريومتر القص (انظر جدول المواد) مع وجود فجوة 1 مم بين الألواح المتوازية الخشنة بقطر 50 مم لقياس الخصائص الريولوجية.
- تحديد سلوك الخضوع باستخدام قياسات القص أحادية الاتجاه على مقياس ريومتر القص عن طريق قياس إجهاد القص كدالة لاكتساح لوغاريتمي لمعدل القص من 10-4 s-1 إلى 102 s-1 (على سبيل المثال ، الشكل 2A).
ملاحظة: عند معدلات القص المنخفضة ، سيكون لمصفوفة الهيدروجيل إجهاد قص ثابت (إجهاد الخضوع) مستقل عن معدل القص. عند معدلات القص العالية ، سيزداد إجهاد القص مع اعتماد قانون الطاقة على معدل القص ، مما يشير إلى تميع مصفوفة الهيدروجيل. يسمح سلوك إجهاد الغلة هذا للبكتيريا بطباعة 3D داخل مصفوفة هيدروجيل الحبيبية29. - قم بقياس معياري التخزين والفقد ، G ' و G' على التوالي ، كدالة للتردد باستخدام الريولوجيا التذبذبية ذات السعة الصغيرة بسعة إجهاد تبلغ 1٪ وترددات تتراوح بين 0.1 إلى 1 هرتز (على سبيل المثال ، الشكل 2B).
ملاحظة: يجب أن تحتوي مصفوفة الهيدروجيل الحبيبية المثالية للطباعة ثلاثية الأبعاد على معامل تخزين أكبر من معامل الفقد ، مما يشير إلى أن الوسط يعمل كمادة صلبة مرنةمحشورة 29.
7. توصيف حجم المسام الخلالي لمصفوفة هيدروجيل الحبيبية
- Sonicate 100 نانومتر جزيئات البوليسترين الفلورية الكربوكسيلية النانوية (~ 3.6 × 1013 جسيمات / مل ، انظر جدول المواد) في عبواتها لمدة 15 دقيقة لإعادة التعليق لتفتيت أي تجمعات / مجموعات من الجسيمات. نقل 50 ميكرولتر من الجسيمات النانوية إلى أنبوب طرد مركزي دقيق سعة 1.5 مل.
- جهاز طرد مركزي لمدة 10 دقائق عند 9500 × جم في درجة حرارة الغرفة حتى تتشكل الحبيبات وتصبح المادة الطافية صافية. قم بإزالة المادة الطافية وأعد تعليق الحبيبات في 1 مل من وسائط النمو السائل (هنا LB) المستخدمة لتحضير مصفوفة الهيدروجيل الحبيبية.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا عن طريق تخزين الجسيمات النانوية المعاد تعليقها عند 4 درجات مئوية لمدة تصل إلى 3 أشهر.
- جهاز طرد مركزي لمدة 10 دقائق عند 9500 × جم في درجة حرارة الغرفة حتى تتشكل الحبيبات وتصبح المادة الطافية صافية. قم بإزالة المادة الطافية وأعد تعليق الحبيبات في 1 مل من وسائط النمو السائل (هنا LB) المستخدمة لتحضير مصفوفة الهيدروجيل الحبيبية.
- قم بتنشيط الجسيمات النانوية المعاد تعليقها لمدة 30 دقيقة. نقل 1 مل من مصفوفة هيدروجيل حبيبية إلى أنبوب طرد مركزي دقيق 1.5 مل. أضف 1 ميكرولتر من الجسيمات النانوية المعاد تعليقها إلى مصفوفة الهيدروجيل الحبيبية واخلطها بطرف ماصة. بعد الخلط ، أجهزة الطرد المركزي لمدة 30 ثانية عند 161 × جم في درجة حرارة الغرفة.
- انقل مصفوفة الهيدروجيل وخليط الجسيمات النانوية إلى طبق بتري بقطر 35 مم مع بئر زجاجي بسمك 0.1 مم. يبلغ قطر البئر 20 مم وعمقه 1 مم. ضع غطاء زجاجي في الأعلى واضغط لأسفل لتعطيل التدفق والتبخر أثناء التصوير. بديل للغطاء الزجاجي هو إضافة 1 مل من زيت البارافين في الأعلى.
- قم بتصوير الجسيمات النانوية باستخدام مجهر متحد البؤر بهدف زيت 40x مع تكبير إضافي 8x في برنامج التصوير (انظر جدول المواد).
ملاحظة: يمكن استخدام هدف تكبير أعلى بدلا من استخدام تكبير رقمي إضافي في البرنامج.- تخيل حلقة زمنية بدون تأخير (من الناحية المثالية ~ 19 إطارا / ثانية) في مستوى z واحد لمدة 2 دقيقة مع أربعة جسيمات نانوية على الأقل داخل مجال الرؤية. كرر 15 إلى 20 مرة في مواقع مختلفة لجمع بيانات كافية للإحصاءات (100 إلى 200 جسيم نانوي).
- استخدم برنامج تتبع الجسيمات لتحليل إزاحة الجسيمات. هنا ، يتم استخدام نص مكتوب خصيصا بناء على خوارزمية Crocker-Grier الكلاسيكية لتتبع مركز كتلة الجسيماتالنانوية 35 (انظر الملف التكميلي 7).
- من تتبع الجسيمات ، احسب متوسط الإزاحة التربيعية (MSD). سيظهر MSD انتشارا مجانيا في مساحة المسام بأطوال قصيرة ومقاييس زمنية والانتقال إلى التحجيم الفرعي المنتشر بأطوال كبيرة ومقاييس زمنية بسبب الحبس35.
- حدد مقياس الطول حيث يحدث الانتقال إلى القياس شبه المنتشر لتقدير حجم المسام المحلي. احسب حجم المسام بإضافة مقياس الطول هذا إلى قطر الجسيمات النانوية. كرر تحليل حجم المسام لكل جسيم نانوي تم قياسه. سيؤدي ذلك إلى توزيع حجم المسام الذي يمكن من خلاله حساب متوسط حجم المسام (على سبيل المثال ، الشكل 3).
عملية طباعة 8. 3D
- حوامل 3D الطباعة حسب الطلب لحاويات العينات (انظر الملفات التكميلية 4-6 لملفات CAD). هنا ، يتم استخدام حاملات قوارير زراعة الأنسجة و microcuvettes. تسمح الحوامل ببرمجة الطابعة لطباعة عينات متعددة في جلسة طباعة واحدة. ضع حاويات العينات مع وسائط هيدروجيل في الحوامل على منصة البناء.
- افتح برنامج الطباعة 3D. قم بتحميل رمز g مبرمج مسبقا في البرنامج. للحصول على النتائج التمثيلية ، يتم استخدام الخطوة 3.1 لتحميل التعليق البكتيري في الطابعة ثلاثية الأبعاد.
ملاحظة: يرد مثال على رمز g لطباعة الأشكال الهندسية الرأسية الخطية في الجدول 1. - من خلال برنامج الطباعة 3D ، انقل طائرات x-y-z لتوسيط رأس الطباعة على مستوى x-y لتكون الحاوية الأولى ثم المحور z. سيرفع المحور z الموجه رأس الطباعة. قم بتدوير المسمار يدويا ببطء للضغط على مكبس المحقنة حتى يمكن رؤية كمية صغيرة من التعليق البكتيري عند طرف الإبرة.
- امسح المعلق البكتيري الزائد برفق باستخدام منديل معقم يمكن التخلص منه. استنادا إلى ارتفاع حامل العينة والإبرة والمحقنة ، باستخدام برنامج الطباعة 3D ، قم بخفض رأس الطباعة مسافة ثابتة في وسائط الهيدروجيل في حاوية العينة المختارة. ابدأ عملية الطباعة بالنقر فوق طباعة.
- بمجرد اكتمال الطباعة ، أغلق حاويات العينات. امسح الطابعة باستخدام 70٪ من الإيثانول. تخلص بشكل صحيح من المحقنة والإبرة.
9. زراعة وتصوير V. الكوليرا
- لتصوير مجال الرؤية الكبير، استخدم كاميرا مزودة بعدسة تكبير/تصغير لنمو خلايا الصورة باستخدام صندوق مبسط. صور العينات مباشرة بعد الطباعة في درجة حرارة الغرفة ثم انقلها إلى حاضنة. الحفاظ على العينات عند 37 درجة مئوية في حاضنة ثابتة بين جلسات التصوير أثناء التجربة.
- التقط الصور خلال الفترة الزمنية المطلوبة لمراقبة سلوك النمو لفترات طويلة في مصفوفة الهيدروجيل الحبيبية.
النتائج
باستخدام طابعة حيوية 3D مع مصفوفة هيدروجيل حبيبية يوسع قدرات الطابعات الحيوية لطباعة المستعمرات البكتيرية في الأشكال التي ، عند طباعتها على ركيزة مسطحة بدلا من ذلك ، سوف تتراجع بسبب انخفاض لزوجة التعليق البكتيري. يعتمد حل النهج المقدم هنا على سرعة البثق وحجم الإبرة وسرعة رأس الطباعة والهواء في الإبرة ولزوجة التعليق البكتيري. نظرا لانخفاض حجم التعليق البكتيري ، قد يتم إدخال فقاعات الهواء عن غير قصد أثناء تحميل التعليق البكتيري في المحقنة والإبرة. يمكن أن يؤدي ذلك إلى ترسيب فقاعة هواء في الهيكل المطبوع النهائي (الشكل 4). هناك طريقة أخرى لإدخال فقاعات الهواء في الطباعة وهي إذا لم يضغط المرء على المكبس لتشكيل قطرة صغيرة من التعليق البكتيري عند طرف الإبرة قبل الطباعة وتوجد فجوة هوائية عند طرف الإبرة. يمكن أن يؤدي عدم الضغط على مكبس المحقنة قبل الطباعة أيضا إلى طباعة أحجام مختلفة من الخلايا في نفس الدفعة. ومع ذلك ، مع تقدم الوقت ، تذوب فقاعة الهواء في الوسط المحيط ، كما هو موضح في الشكل 4.
لمعايرة خطوة البثق ، يعتمد الحجم المودع على كيفية ترجمة المشغل الخطي لرأس الطباعة لمكبس المحقنة ، وسيؤثر القطر الداخلي للمحقنة بشكل مباشر على الحجم. علاوة على ذلك ، ستؤثر الخصائص الريولوجية للتعليق البكتيري على مدى سهولة قصها من خلال تقلص الإبرة للطباعة بسلاسة. وبالتالي ، يجب إعادة إجراء المعايرة هذا لكل إعداد تعليق حقنة / إبرة / بكتيريا. من حيث المبدأ ، يمكن أتمتة معايرة المحاقن. ومع ذلك ، من الناحية العملية ، فإن كتابة مثل هذا الرمز الذي ينطبق على نطاق واسع على العديد من حالات الاستخدام سيكون أمرا صعبا. على سبيل المثال ، سيحتاج المستخدم الذي يهدف إلى معايرة قذف ما يقرب من 300 ميكرولتر من حقنة سعة 1 مل إلى إعادة تحميل المحقنة بشكل متكرر أكثر بكثير من المستخدم الذي يقوم بالمعايرة حول حجم مستهدف يبلغ 30 ميكرولتر. نظرا لأن الخطوة الإلكترونية لثابت معايرة الحجم غير معروف عند بدء عملية المعايرة ، فقد لا يتمكن المستخدم من التنبؤ بالضبط بعدد مرات إعادة التحميل المطلوبة بالفعل. علاوة على ذلك ، لأتمتة عملية المعايرة ، يجب تحديد المواضع الدقيقة لكل أنبوب 1.5 مل تم وزنه مسبقا. لضمان ترسيب كل الحبر الحيوي من الإبرة إلى الأنبوب لإجراء معايرة دقيقة ، يجب إجراء اتصال دقيق بين الإبرة وأسفل / جدار الأنبوب. بدون ملامسة جيدة ، قد تظل القطرات الصغيرة مبللة ومتصلة بالإبرة. وبالتالي ، فإن أي اختلاف موضعي بين الأنابيب قد يساهم بشكل كبير في حدوث أخطاء في عملية المعايرة. لهذه الأسباب ، يوصي المؤلفون بأن يقوم كل مستخدم ببناء برنامج معايرة يناسب احتياجاته الفريدة.
من السمات الرئيسية للنهج المقدم هنا القدرة على تصور انتشار البكتيريا عبر بيئاتها مباشرة عبر الحركة والنمو باستخدام التصوير. في إصدار سابق من بروتوكول التصوير ، تم ملء ألواح 6 آبار ب 19 مل من مصفوفة هيدروجيل حبيبية. ومع ذلك ، حتى مع طباعة 3D ناجحة لخط أفقي من الخلايا التي يمكن ملاحظتها على المجهر المقلوب ، فإن مستعمرة كثيفة ستنمو أيضا على السطح العلوي للوسط ، مما يحد من التصور باستخدام مجهر برايت فيلد (الشكل 5). من المحتمل أن تكون المستعمرة الموجودة على السطح العلوي ناتجة عن التلوث حيث تم وضع إبرة المحقنة في الوسط أو إزالته منه أثناء الطباعة. للتحايل على هذه المشكلة ، تتم طباعة الخطوط الرأسية للخلايا في قوارير التلألؤ (الشكل 6 أ). ومع ذلك ، تسبب انحناء القوارير الأسطوانية في تشويه أثناء التصوير. أدى ذلك إلى اختيار قوارير مسطحة الجدران وقوارير زراعة الأنسجة كحاويات عينات للطباعة ، مما يسمح بالتصوير غير المشوه (الشكل 6B-D). أحد قيود قوارير زراعة الأنسجة هو الرقبة المائلة الصغيرة التي تحد من الأشكال الهندسية التي يمكن طباعتها.
مجتمعة ، يسمح هذا البروتوكول بمراقبة الحركة البكتيرية والنمو في البيئات المسامية المعقدة على مدى فترات زمنية طويلة. يتم عرض بعض الأمثلة في الشكل 6B-G لتكوين الأغشية الحيوية V. cholerae باستخدام الفحص المجهري برايت فيلد وكذلك خلايا العوالق من E. coli باستخدام المجهر البؤري الفلوري المسح بالليزر - مما يدل على تنوع هذا النهج. في الواقع ، هناك مشكلة محتملة لمصفوفات الهيدروجيل وهي التألق الذاتي المحتمل عند تصويرها باستخدام المجهر الفلوري. ومع ذلك ، فإن الصور الموضحة في الشكل 6F ، G توضح أن هذا التألق الذاتي ضئيل في المنصة التجريبية المعروضة هنا. ومن القيود الأخرى على نهج الفحص المجهري الضوئي هذه استباجتها المكانية ، والتي يتم تعيينها بواسطة حد الحيود عند ~ 100 ثانية نانومتر. ومع ذلك ، فإن مقياس الطول هذا أصغر بكثير من حجم الخلية البكتيرية الفردية ، وبالتالي ، توفر التقنيات البصرية القدرة على تصوير الخلايا البكتيرية من مقياس الخلايا الفردية (الشكل 6G) إلى مقياس المستعمرات الأكبر متعددة الخلايا30،31،32،33. ويرد أدناه وصف لأمثلة إضافية.
كما هو مذكور أعلاه ، يمكن استخدام النهج المقدم هنا لطباعة 3D وتصوير المستعمرات البكتيرية في أحجام مصفوفة صغيرة (1 مل) وكبيرة (20 مل). ومن ثم ، فإن الاختلافات في النتائج التي تم الحصول عليها باستخدام أحجام مختلفة موصوفة أدناه ، باستخدام مستعمرات مطبوعة 3D من V. cholerae المتحركة وغير المتحركة كأمثلة تمثيلية. يتم تعيين الدقة المكانية (عرض الخط) للطباعة بواسطة القطر الداخلي للفوهة. في الأمثلة الموضحة أدناه ، ينتج عن إبرة قطرها الداخلي 0.6 مم مستعمرة أسطوانية أولية تبلغ 0.6 مم. أثبتت الأعمال السابقة أنه يمكن تقليل دقة الطباعة بشكل أكبر باستخدام شعرية زجاجية مسحوبة بقطر داخلي ~ 100-200 ميكرومتر33.
بالنسبة للأحجام الصغيرة ، يتم استخدام مصفوفتين حبيبيتين مختلفتين من الهيدروجيل مع توزيعين مختلفين لحجم المسام: أحدهما بمتوسط حجم مسام أكبر من متوسط قطر خلية V. cholerae ، 0.2-0.4 ميكرومتر36 ، والآخر بمتوسط حجم مسام أصغر من هذا القطر. يتم تصوير العينات على مدى اثني عشر يوما وقياسها من خلال تحليل الصور للتوسع المساحي للمستعمرات بمرور الوقت (الشكل 7 والشكل 8). بالنسبة للخلايا غير المتحركة ، والتي لا يمكن أن تنتشر إلا من خلال محيطها من خلال النمو الخلوي ، كان معدل التوسع المساحي مشابها بين المصفوفات المختلفة التي تم فحصها (الشكل 7) ، مما يشير إلى أن الاختلافات في حجم مسام المصفوفة لا تؤثر على الانتشار الخلوي من خلال النمو - كما هو متوقع. على النقيض من ذلك ، بالنسبة للخلايا المتحركة التي تنتشر عبر محيطها من خلال الحركة النشطة ، كان معدل التوسع المساحي ل V. cholerae أعلى بالنسبة لمصفوفة الهيدروجيل مع المسام الأكبر - حيث يؤدي الحبس بواسطة حبيبات الهيدروجيل إلى إعاقة الحركة الخلوية بشكل أقل. كانت هذه الاختلافات في الانتشار البكتيري واضحة أيضا في مورفولوجيا المستعمرة (الشكل 8). مستعمرة V. cholerae في مصفوفات هيدروجيل ذات مسام أكبر تنتشر من خلال أعمدة ناعمة ومنتشرة (الشكل 8 أ) ، مما يعكس الانتشار من خلال الحركة النشطة كما لوحظ سابقا32. في الواقع ، تمشيا مع هذا التفسير ، لا يتم ملاحظة هذه الأعمدة المنتشرة في حالة الخلايا غير المتحركة (الشكل 8C). بالإضافة إلى ذلك ، تكون المسام كبيرة بما يكفي بحيث لا تدفع الخلايا الخرز أثناء السباحة عبر المسام. علاوة على ذلك ، فإن الضغط اللزج الذي تطبقه السباحة أقل من 1 باسكال ، وهو غير كاف لتشويه مصفوفة الهيدروجيل المحيطة بشكل ملحوظ. على النقيض من ذلك ، فإن المستعمرة في مصفوفات الهيدروجيل ذات المسام الأصغر تنتشر فقط من خلال أعمدة خشنة تشبه الفركتلات لكل من الخلايا المتحركة وغير المتحركة (الشكل 8B ، D) ، مما يعكس انتشارها فقط من خلال النمو الخلوي ، في حين أن الخلايا تنمو بشكل عابر تشوه وتنتج المصفوفة المحيطة. في الواقع ، بالنظر إلى أن إجهاد الخضوع لمصفوفات الهيدروجيل أصغر بكثير من ضغط الانتفاخ للخلايا ، في هذا الحد من حجم المسام الصغير ، توفر المصفوفة مقاومة ضعيفة للنمو الخلوي ولا يبدو أنها تؤثر بشدة على الهيكل المطبوع ثلاثي الأبعاد ، كما تم التحقق منه في عملنا السابق37.
لوحظت نتائج مماثلة للتجارب التي أجريت في عينات كبيرة الحجم. ومع ذلك ، نظرا لوفرة أكبر من العناصر الغذائية في هذه العينات ، يمكن للتجارب الحفاظ على النمو الخلوي على مدى فترات زمنية أطول. على سبيل المثال ، يتم عرض النتائج باستخدام مصفوفات الهيدروجيل الحبيبية حيث كان متوسط حجم المسام أقل من حجم الخلية - وبالتالي ، كان الانتشار الخلوي يرجع في المقام الأول إلى النمو. تم تصوير العينات لمدة ~ 30 يوما في مصفوفات الهيدروجيل الحبيبية ولاحظت توسعا مساحيا مشابها لكل من الخلايا غير المتحركة والمتحركة لأول 150 ساعة. ومع ذلك ، في أوقات أطول ، لوحظ تباين قوي بين العينات ، حيث تظهر بعض العينات معدلات انتشار أسرع (الشكل 9 والشكل 10). ومن المثير للاهتمام ، عند إعادة أخذ عينات من مصفوفة الهيدروجيل بعد التجربة - وهي فائدة من الحجم الكبير لمصفوفة الهيدروجيل - يتم قياس انخفاض في إجهاد الخضوع ووحدات التخزين ووحدات الخسارة (الشكل 11) ، مما يشير إلى أن المصفوفات أصبحت أكثر ليونة. قد يكون هذا التغيير بسبب إنتاج V. cholerae لجزيء يغير خصائص مصفوفة الهيدروجيل ويعزز الانتشار الخلوي في أوقات طويلة ، وهو أمر مثير للاهتمام لاختباره في الأبحاث المستقبلية. يوضح الشكل 10 أمثلة على مورفولوجيا المستعمرات الخشنة الشبيهة بالفركتلات التي تؤدي إلى هذه التجارب.

الشكل 1: صور للطابعة الحيوية 3D المصممة خصيصا. (أ) طابعة حيوية برأس بثق مضخة حقنة معدلة مع حقنة وإبرة قفل Luer يمكن التخلص منها. الطابعة الحيوية بعرض ~ 46 سم. (ب) صورة لطباعة 3D لخلايا في قوارير مملوءة بمصفوفة هيدروجيل محشورة. عرض الصورة 87 ملم. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
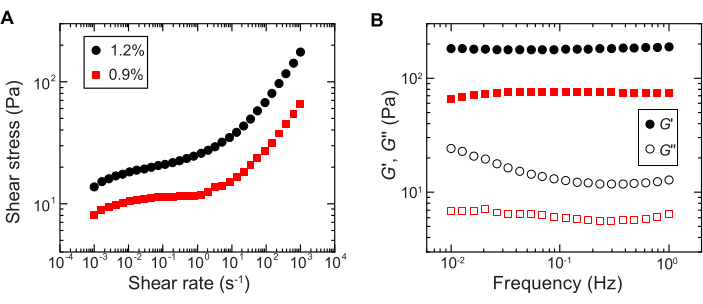
الشكل 2: توصيف الخواص الريولوجية لمصفوفات الهيدروجيل الحبيبي. (أ) إجهاد القص كدالة لمعدل القص المطبق. (ب) وحدات التخزين والفقد ، G ' و G' على التوالي ، كدالة لتردد التذبذب. تشير وسيلة الإيضاح إلى جزء كتلة الهيدروجيل المستخدم لإعداد كل مصفوفة هيدروجيل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
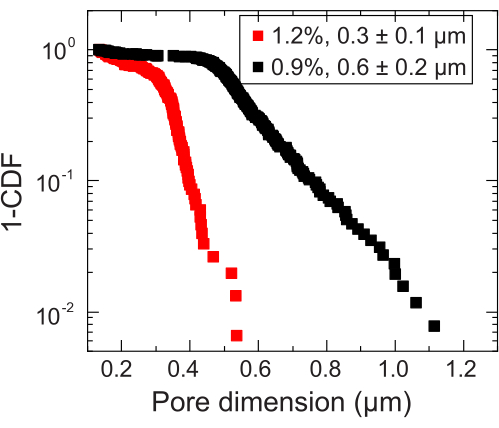
الشكل 3: قياسات حجم المسام لمصفوفتين حبيبيتين تمثيليتين للهيدروجيل. من خلال تتبع المتتبعات ، يتم تحديد توزيع أبعاد المسام المميزة لكل مصفوفة هيدروجيل. يتم تمثيل البيانات بواسطة 1-CDF ، حيث CDF هي دالة التوزيع التراكمي. تشير وسيلة الإيضاح إلى جزء كتلة الهيدروجيل المستخدم لإعداد كل مصفوفة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
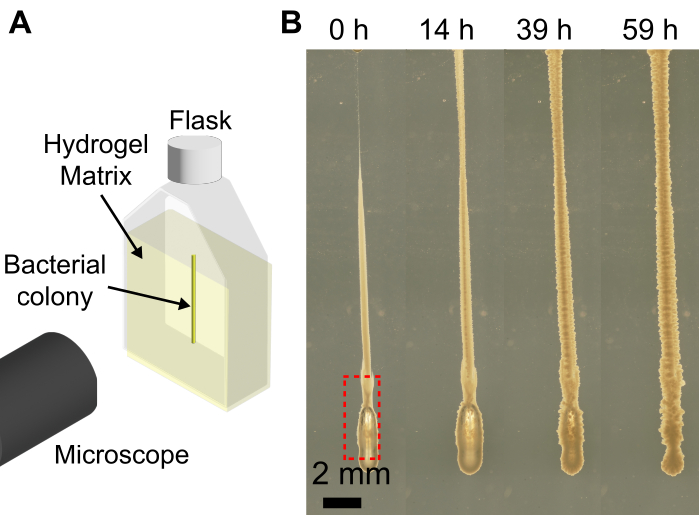
الشكل 4: أمثلة على الفقاعات التي تشكلت أثناء الطباعة ثلاثية الأبعاد للبكتيريا. (أ) رسم تخطيطي لإعداد التصوير. (ب) لقطات لنمو بكتيريا الكوليرا مع وجود فقاعة في أسفل الطباعة (صندوق أحمر) في مصفوفة هيدروجيل 1.2٪ منتفخة في رطل. بعد 59 ساعة من النمو عند 37 درجة مئوية ، تذوب فقاعة الهواء بالكامل ، وتنهار المستعمرة مرة أخرى بسبب مرونة مصفوفة الهيدروجيل. شريط المقياس = 2 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: صور للخط الأفقي لبكتيريا الكوليرا المتحركة المطبوعة في صفيحة من ستة آبار مملوءة بمصفوفة هيدروجيل 1.2٪ منتفخة في LB والأغشية الحيوية التي تشكلت على السطح العلوي بعد 48 ساعة من الحضانة عند 37 درجة مئوية. (أ) رسم تخطيطي لإعداد التصوير. (ب) تشكيل الأغشية الحيوية على السطح العلوي بسبب التلوث أثناء الطباعة ثلاثية الأبعاد يقلل من العتامة ولا يسمح بتصوير واضح للخط الأفقي. يشكل السطح العلوي التجاعيد ، على الأرجح بسبب النمو التفاضلي. شريط المقياس = 5 مم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
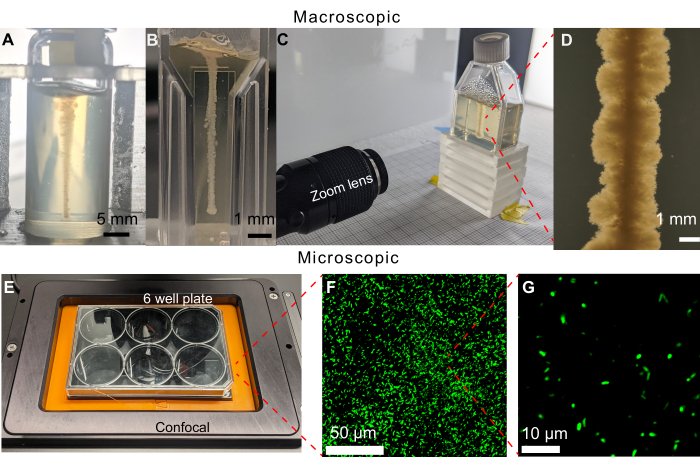
الشكل 6: أمثلة على حاويات العينات المختلفة التي يمكن استخدامها في هذه الطريقة. (أ) V. cholerae مطبوعة في قنينة زجاجية مملوءة بمصفوفة هيدروجيل حبيبية بنسبة 1.2٪ بعد 470 ساعة. انحناء القارورة يجعل تصوير النمو صعبا. قضبان المقياس = 5 مم. (B) V. الكوليرا مطبوعة في كفيت دقيق مملوء بمصفوفة هيدروجيل حبيبية بنسبة 1.2٪. تسمح الجوانب المسطحة بالتصوير الواضح ، ومع ذلك ، فإن الأحجام الصغيرة تحد من طول التجارب قبل نفاد ركائز النمو للخلايا. (C) إعداد التصوير باستخدام عدسة تكبير لتصوير V. cholerae مطبوعة في دورق زراعة الأنسجة مملوء بمصفوفة هيدروجيل حبيبية بنسبة 1.2٪. على غرار علبة كوفيت الدقيقة ، تسمح الجوانب المسطحة بالتصوير الواضح. يمكن ملء قوارير زراعة الأنسجة بكميات أكبر من مصفوفة الهيدروجيل الحبيبية ، وبالتالي إطالة الفترة الزمنية التجريبية. (د) صورة من عدسة التكبير لبكتيريا ضمة الكوليرا مطبوعة داخل مصفوفة هيدروجيل حبيبية بنسبة 1.2٪ بعد 100 ساعة من الحضانة عند 37 درجة مئوية. شريط المقياس = 1 مم. (ه) إعداد التصوير باستخدام مجهر متحد البؤر لتصوير الخلايا الفلورية. (و) إسقاط ثلاثي الأبعاد للصور المجهرية متحدة البؤر للإشريكية القولونية الفلورية داخل مصفوفة الهيدروجيل الحبيبي 1.2٪ بعد 10 أيام من الحضانة عند 37 درجة مئوية. شريط المقياس = 50 ميكرومتر. (G) صورة مجهرية متحدة البؤر ذات دقة خلية واحدة للإشريكية القولونية الفلورية داخل مصفوفة الهيدروجيل. شريط المقياس = 10 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
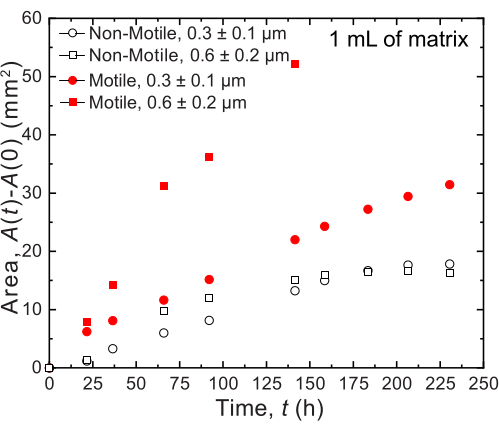
الشكل 7: تمدد المساحة كدالة لزمن مستعمرات V. cholerae المطبوعة في 1 مل من مصفوفات دعم الهيدروجيل الحبيبي. البيانات الموجودة على الرسم مأخوذة من تحليل الصور في الشكل 8. وقد لوحظ أن الخلايا المتحركة (الدائرة الحمراء المغلقة والمربعة) تنتشر بمعدل أسرع من الخلايا غير المتحركة ، مما يعكس انتشارها عن طريق النمو والحركة. بالإضافة إلى ذلك ، تنتشر الخلايا المتحركة في مصفوفة الهيدروجيل ذات حجم المسام الكبير (المربعات الحمراء) بمعدل أسرع من الخلايا الموجودة في مصفوفة الهيدروجيل مع مسام 0.3 ميكرومتر (دوائر حمراء). لا تظهر الخلايا غير المتحركة أي فرق في معدل التمدد المساحي بين حجمي المسام ، لأنها تنمو فقط. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8: مستعمرات ضمة الكوليرا المطبوعة في 1 مل من مصفوفات دعم الهيدروجيل الحبيبي. (أ) لقطات لنمو وحركة بكتيريا الكوليرا المتحركة في مصفوفة هيدروجيل حبيبية بنسبة 0.9٪ حيث يكون حجم المسام أكبر من متوسط قطر الخلية. تشير الأسهم إلى عمود منتشر يتشكل بسبب تحرك الخلايا عبر مصفوفة الهيدروجيل. (ب) لقطات لنمو وحركة ضمة الكوليرا المتحركة في مصفوفة هيدروجيل حبيبية بنسبة 1.2٪ حيث يكون حجم المسام أصغر من متوسط قطر الخلية. تشير الأسهم إلى عمود خشن يشبه الفركتل يتشكل بسبب النمو الخلوي. (ج) لقطات من التطور الزمني لبكتيريا الكوليرا غير المتحركة في مصفوفة هيدروجيل حبيبية بنسبة 0.9٪ حيث يكون حجم المسام أكبر من متوسط قطر الخلية. في هذه الحالة ، لا يمكن ملاحظة أعمدة منتشرة تعكس الحركة. (د) لقطات لنمو بكتيريا الكوليرا غير المتحركة في مصفوفة دعم هيدروجيل حبيبي بنسبة 1.2٪ حيث يكون حجم المسام أصغر من متوسط قطر الخلية. في هذه الحالة ، يمكن ملاحظة أعمدة خشنة تشبه الفركتلات تعكس النمو مرة أخرى. قضبان المقياس = 1 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
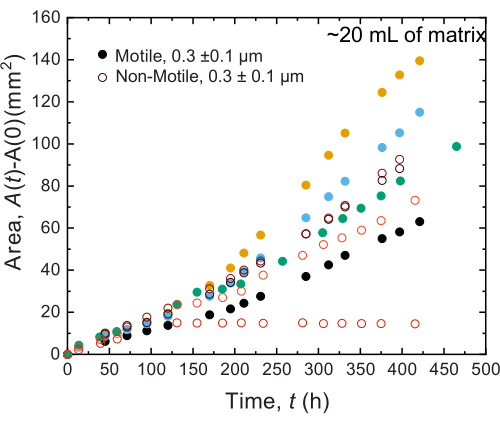
الشكل 9: توسع المنطقة كدالة لزمن مستعمرات V. cholerae المطبوعة في 20 مل من مصفوفات دعم الهيدروجيل الحبيبي 1.2٪. لوحظ أن الخلايا غير المتحركة (الدوائر المفتوحة) والخلايا المتحركة (الدوائر المغلقة) تنتشر بمعدلات مماثلة لأول 100 ساعة. بعد 100 ساعة ، لوحظت اختلافات في معدلات التوسع المساحي ، ربما بسبب تطور التباين في أوقات طويلة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 10: مستعمرات V. cholerae مطبوعة في 22 مل من مصفوفات هيدروجيل حبيبية 1.2٪ نمت عند 37 درجة مئوية. (أعلى) لقطات من نمو V. الكوليرا المتحركة. (أسفل) لقطات من نمو غير متحرك V. الكوليرا. في كلتا الحالتين ، يمكن ملاحظة أعمدة خشنة تشبه الفركتلات تعكس النمو. قضبان المقياس = 2 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
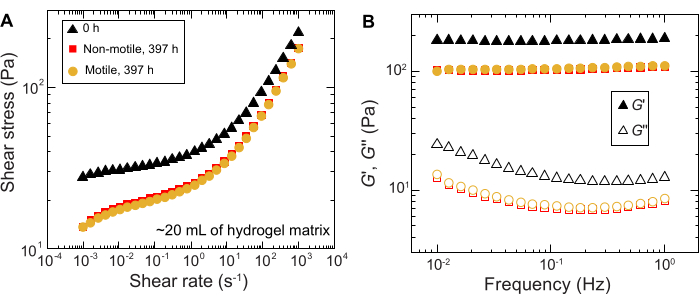
الشكل 11: توصيف الخواص الريولوجية لمصفوفة الهيدروجيل الحبيبي 1.2٪ قبل (0 ساعة) وبعد التجربة (397 ساعة). (أ) إجهاد القص كدالة لمعدل القص المطبق. (ب) وحدات التخزين والفقد ، G 'و G' على التوالي ، كدالة لتردد التذبذب المطبق. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| أوامر Gcode | المهام | |||
| م82 | وضع البثق المطلق | |||
| M302 S0 | تمكين البثق البارد | |||
| M92 E14575 | اضبط خطوات البثق لكل مم | |||
| G92 X35.61 Y81 Z0 E0.0 | اضبط المحور z وموضع البثق على الصفر ، والموضع x ، y على 35.71 مم و y 88 مم حيث يكون رأس الطباعة عند بدء تشغيل رمز g | |||
| M221 S100 T0 | يضبط معدل التدفق على 100٪ | |||
| م107 | قم بإيقاف تشغيل المروحة | |||
| G1 F1 X35.61 Y81 E0.1 | بثق 20 ميكرولتر من الحبر الحيوي في المصفوفة بمعدل تغذية 50 ميكرولتر / دقيقة حيث تم ضبط الموضع الحالي | |||
| G0 F200 Z60 | اسحب الإبرة من المصفوفة وعينة كونتيانر بسرعة 200 مم / دقيقة | |||
| G0 F500 X65.81 Y81.0 | حرك الإبرة إلى أداة توصيل العينة التالية بسرعة 500 مم / دقيقة | |||
| G0 F100 Z0 | قم بإدخال الإبرة السفلية في العينة التالية إلى نفس الموضع z حيث بدأت الطباعة بسرعة 100 مم / دقيقة | |||
| G1 F1 X65.81 Y81.0 E0.2 | بثق 20 ميكرولتر من الحبر الحيوي في المصفوفة بمعدل تغذية 50 ميكرولتر / دقيقة حيث تم ضبط الموضع الحالي | |||
| G0 F200 Z60 | اسحب الإبرة من المصفوفة وعينة كونتيانر بسرعة 200 مم / دقيقة | |||
| G0 F500 X96.01 Y81.0 | حرك الإبرة إلى أداة توصيل العينة التالية بسرعة 500 مم / دقيقة | |||
| G0 F100 Z0 | الإبرة السفلية في أداة توصيل العينة إلى نفس الموضع z حيث بدأت الطباعة بسرعة 100 مم / دقيقة | |||
| G1 F1 X96.01 Y81.0 E0.3 | بثق 20 ميكرولتر من الحبر الحيوي في المصفوفة بمعدل تغذية 50 ميكرولتر / دقيقة حيث تم ضبط الموضع الحالي | |||
| G0 F200 Z60 | اسحب الإبرة من المصفوفة وعينة كونتيانر بسرعة 200 مم / دقيقة | |||
| G0 F500 X126.21 Y81.0 | حرك الإبرة إلى أداة توصيل العينة التالية بسرعة 500 مم / دقيقة | |||
| G0 F100 Z0 | قم بإدخال الإبرة السفلية في العينة التالية إلى نفس الموضع z حيث بدأت الطباعة بسرعة 100 مم / دقيقة | |||
| G1 F1 X126.21 Y81.0 E0.4 | بثق 20 ميكرولتر من الحبر الحيوي في المصفوفة بمعدل تغذية 50 ميكرولتر / دقيقة حيث تم ضبط الموضع الحالي | |||
| G0 F200 Z80 | اسحب الإبرة من المصفوفة وعينة كونتيانر بسرعة 200 مم / دقيقة | |||
الجدول 1: برمجة G-code لطباعة الخطوط الرأسية للتعليق البكتيري.
الملف التكميلي 1: ملف STL للمشبك السفلي 1 مل محاقن قفل Luer يمكن التخلص منها لآلة بثق المحقنة. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 2: ملف STL للمشبك العلوي لمحاقن قفل Luer سعة 1 مل يمكن التخلص منها لآلة بثق المحقنة. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 3: ملف STL لمحول المحقنة لمحاقن Luer التي تستخدم لمرة واحدة سعة 1 مل لآلة بثق المحقنة. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 4: ملف STL لحامل عينة كوفيت. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 5: ملف STL لحامل عينة قارورة الأنسجة. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 6: ملف STL للوحة 6 آبار وسرير طباعة أطباق بتري مقاس 35 مم. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 7: برنامج نصي مخصص لتتبع الجسيمات. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
الخطوات الحاسمة في البروتوكول
من المهم التأكد من أنه عند إعداد كل مصفوفة هيدروجيل ، يتم إجراء المصفوفة في بيئة معقمة. إذا لم يكن الأمر كذلك ، يمكن أن يحدث التلوث ، والذي يتجلى ، على سبيل المثال ، microcolonies (كرويات صغيرة) في المصفوفة بعد عدة أيام. أثناء عملية الخلط ، من المهم إذابة جميع جزيئات الهيدروجيل الحبيبية الجافة. بالإضافة إلى ذلك ، عند ضبط الرقم الهيدروجيني لكل مصفوفة هيدروجيل باستخدام هيدروكسيد الصوديوم ، ستبدأ الحبيبات في الانتفاخ ، مما يزيد من لزوجة مصفوفة الهيدروجيل ، مما يؤدي إلى زيادة صعوبة الخلط. سيساعد استخدام الخلاط العمودي على ضمان خلط هيدروكسيد الصوديوم جيدا في مصفوفة الهيدروجيل. أثناء تحميل كل تعليق بكتيري ، يمكن أن تتشكل جيوب هوائية في الإبرة. لتجنب هذه المشكلة ، تأكد من أن طرف الإبرة يجلس دائما في التعليق البكتيري في أنبوب الطرد المركزي وليس في أسفل الأنبوب أو بالقرب من السطح العلوي. هناك طريقة أخرى للتغلب على هذه المشكلة وهي زراعة كميات كبيرة من الخلايا وبالتالي الحصول على كميات أكبر من التعليق البكتيري للطباعة.
القيود
حاليا ، أثناء الطباعة ، تحد اللزوجة المنخفضة للتعليق البكتيري من الأشكال الهندسية التي يمكن طباعتها وغالبا ما تؤدي إلى تكوين غشاء حيوي ونمو على الجزء العلوي من سطح مصفوفة الهيدروجيل بسبب الخلايا النزرة. هناك بعض الطرق المحتملة للتغلب على هذا القيد ، بما في ذلك زيادة لزوجة التعليق البكتيري أو زيادة تحسين إعدادات طابعة 3D. لزيادة لزوجة التعليق البكتيري ، يمكن للمرء أن يخلط التعليق البكتيري مع بوليمر آخر - على سبيل المثال ، الجينات ، التي تم استخدامها قبل الطباعة ثلاثية الأبعاد للبكتيريا على الأسطح المستوية38. يمكن تحسين إعدادات الطابعة بشكل أكبر لتمكين سحب مكبس المحقنة أثناء سحب الإبرة من مصفوفة الهيدروجيل الحبيبية ، والتي سيكون لها القدرة على إيقاف الخلايا من الترسيب أثناء إزالة الإبرة من مصفوفة الهيدروجيل.
أهمية الطريقة فيما يتعلق بالطرق الحالية / البديلة
تسمح الطريقة الموضحة هنا بطباعة المستعمرات البكتيرية في مصفوفات هيدروجيل حبيبية. تسمح مصفوفات الهيدروجيل الحبيبية بدراسة تأثير العوامل البيئية الخارجية (على سبيل المثال ، حجم المسام ، تشوه المصفوفة) على حركة البكتيريا ونموها. بالإضافة إلى ذلك ، أثناء استخدام LB في هذا العمل كوسيط نمو سائل لتضخيم مصفوفة الهيدروجيل ، يمكن أن تنتفخ مصفوفة الهيدروجيل مع وسائط نمو سائلة أخرى ، بما في ذلك الوسائط التي تحتوي على مضادات حيوية. كانت الطرق السابقة لدراسة البكتيريا في البيئات المحصورة محدودة بسبب طول الوقت التجريبي ، وحجم شبكة البوليمر ، وصلابة مصفوفة الهيدروجيل المحيطة37,38. توجد بالفعل بروتوكولات لصنع مصفوفات هيدروجيل حبيبية من بوليمرات مختلفة ، وبالتالي فإن إمكانية دراسة تأثيرات الظروف البيئية المختلفة على حركة البكتيريا ونموها هائلة. تسمح هذه الطريقة بدراسة البكتيريا في بيئات التحكم التي تلخص بسهولة أكبر البيئات التي تعيش فيها البكتيريا في العالم الحقيقي ، مثل مخاط المضيف أو التربة. قيد آخر للعديد من الطرق الأخرى هو عتامة المصفوفة المحيطة. ومع ذلك ، فإن هذا النهج باستخدام مواد شفافة بصريا يوفر القدرة على استكشاف ، على سبيل المثال ، التحكم البصري الوراثي وأنماط البكتيريا في 3D.
بالإضافة إلى دراسة الحركة والنمو ، تتغلب طريقة الطباعة 3D الموصوفة هنا على قيود العديد من طرق الطباعة الحيوية الأخرى التي تتطلب ترسب الحبر الحيوي على الركيزة ، وبالتالي فهي محدودة في ارتفاع المواد الحية الهندسية التي يمكن أن تنتجها. في المستقبل ، يمكن توسيع بروتوكول الطباعة الحيوية هذا لتصنيع المواد الهجينة الحيوية عن طريق خلط البوليمرات مع الخلايا المكونة للأغشية الحيوية. توفر مصفوفات الهيدروجيل الحبيبية الدعم لطباعة 3D أكثر سمكا ومواد حية هندسية على نطاق أوسع وأشكال هندسية أكثر تعقيدا من العديد من طرق الطباعة الحيوية للبكتيريا الحالية الأخرى. في حين أن هذا العمل استخدم فقط V. cholerae و E. coli ، فإن الأنواع الأخرى ، مثل Pseudomonas aeruginosa ، قد نجحت أيضا في طباعة3D 37. بالإضافة إلى الطباعة ، يمكن تكييف الطابعة للقيام بأخذ عينات مضبوطة من البكتيريا بعد النمو لمعرفة ما إذا كانت هناك أي تغييرات جينية ، على سبيل المثال.
Disclosures
المنصة التجريبية المستخدمة لطباعة وتصوير المجتمعات البكتيرية ثلاثية الأبعاد في هذا المنشور هي موضوع طلب براءة اختراع قدمته جامعة برينستون نيابة عن تابوموي بهاتاشارجي و S.S.D. (رقم طلب معاهدة التعاون بشأن البراءات PCT / US / 2020 / 030213).
Acknowledgements
يقر RK بالدعم المقدم من برنامج زمالة أبحاث ما بعد الدكتوراه الرئاسي. تستند هذه المادة أيضا إلى العمل المدعوم من منحة برنامج زمالة أبحاث الدراسات العليا NSF DGE-2039656 (إلى AMH). أ.س.د.-م. و H.N.L. تقر بالدعم المقدم من صندوق Lidow للعمل المستقل / أطروحة التخرج في جامعة برينستون. كما نشكر مختبر بوني باسلر على توفير سلالات من بكتيريا الكوليرا. تعترف SSD بالدعم المقدم من NSF Grants CBET-1941716 و DMR-2011750 و EF-2124863 ، بالإضافة إلى صندوق Eric and Wendy Schmidt للتكنولوجيا التحويلية ، ومؤسسة New Jersey Health Foundation ، وبرنامج Pew Biomedical Scholars ، وبرنامج Camille Dreyfus Teacher-Scholar.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL cuvettes | VWR | 97000-586 | |
| 1 mL Luer lock syringe | BH Supplies | BH1LL | |
| 10 M NaOH | Sigma-Aldrich | 72068 | |
| 100 nm carboxylated fluorescent polystyrene nanoparticles (FluoSpheres) | Invitrogen, (ThermoFischer Scientific) | F8803 | |
| 15 mL centrifuge tubes | ThermoFischer Scientific | 14-955-237 | |
| 20 G blunt needle | McMaster Carr | 75165A252 | |
| 25 mL tissue culture flasks | VWR | 10861-566 | |
| 3D printer | Lulzbot | LulzBot Mini 2 | |
| 3D printing software | Cura | Cura-Lulzbot | |
| 50 mL centrifuge tubes | ThermoFischer Scientific | 14-955-239 | |
| Agar | Sigma-Aldrich | A1296 | |
| Carbomer Granular Hydrogel Particles | Lubrizol | Carbopol 980NF | dry granules of crosslinked acrylic acid/alkyl acrylate copolymers |
| Centrifuge (2 mL tube capacity) | VWR | 2405-37 | |
| Centrifuge (50 mL tube capacity) | ThermoFischer Scientific | 75007200 | Sorvall (brand) ST 8 (model) |
| Confocal Microscope | Nikon | A1R+ inverted laserscanning confocal microscope | |
| Glass bottom petri dish | Cellvis | D35-10-1-N | |
| Lennox LB (Lubria Broth) | Sigma-Aldrich | L3022 | |
| M8 × 1.25 mm, 150 mm long, Fully Threaded Socket Cap | McMaster Carr | 91290A478 | |
| M8 × 1.25 mm, Brass Thin Hex Nut | McMaster Carr | 93187A300 | |
| Open-source syringe pump | Custom-made | Replistruder 4 | https://www.sciencedirect.com/science/article/pii/S2468067220300791 |
| Petri dish (60 mm round) | ThermoFischer Scientific | FB0875713A | |
| Shear Rheometer | Anton Paar | MCR 501 | |
| Ultrasonic cleaner | VWR | 97043-992 |
References
- Persat, A., et al. The mechanical world of bacteria. Cell. 161 (5), 988-997 (2015).
- Stoodley, P., Dodds, I., Beer, D. D., Scott, H. L., Boyle, J. D. Flowing biofilms as a transport mechanism for biomass through porous media under laminar and turbulent conditions in a laboratory reactor system. Biofouling. 21 (3-4), 161-168 (2005).
- Ludemann, H., Arth, I., Liesack, W. Spatial changes in the bacterial community structure along a vertical oxygen gradient in flooded paddy soil cores. Applied and Environmental Microbiology. 66 (2), 754-762 (2000).
- Sicard, J. F., Bihan, G. L., Vogeleer, P., Jacques, M., Harel, J. Interactions of intestinal bacteria with components of the intestinal mucus. Frontiers in Cellular and Infection Microbiology. 7, 387 (2017).
- Grice, E. A., Segre, J. A. The skin microbiome. Nature Reviews Microbiology. 9 (4), 244-253 (2011).
- Balzan, S., Quadros, C. D. A., Cleva, R. D., Zilberstein, B., Cecconello, I. Bacterial translocation: Overview of mechanisms and clinical impact. Journal of Gastroenterology and Hepatology. 22 (4), 464-471 (2007).
- Chaban, B., Hughes, H. V., Beeby, M. The flagellum in bacterial pathogens: For motility and a whole lot more. Seminars in Cell & Developmental Biology. 46, 91-103 (2015).
- Datta, S. S., Steinberg, A. P., Ismagilov, R. F. Polymers in the gut compress the colonic mucus hydrogel. Proceedings of the National Academy of Sciences. 113 (26), 7041-7046 (2016).
- Harman, M. W., et al. The heterogeneous motility of the Lyme disease spirochete in gelatin mimics dissemination through tissue. Proceedings of the National Academy of Sciences. 109 (8), 3059-3064 (2012).
- Ribet, D., Cossart, P. How bacterial pathogens colonize their hosts and invade deeper tissues. Microbes and Infection. 17 (3), 173-183 (2015).
- Siitonen, A., Nurminen, M. Bacterial motility is a colonization factor in experimental urinary tract infection. Infection and Immunity. 60 (9), 3918-3920 (1992).
- Lux, R., Miller, J. N., Park, N. H., Shi, W. Motility and chemotaxis in tissue penetration of oral epithelial cell layers by Treponema denticola. Infection and Immunity. 69 (10), 6276-6283 (2001).
- O’Neil, H. S., Marquis, H. Listeria monocytogenes flagella are used for motility, not as adhesins, to increase host cell invasion. Infection and Immunity. 74 (12), 6675-6681 (2006).
- Gill, C. O., Penney, N. Penetration of bacteria into meat. Applied and Environmental Microbiology. 33 (6), 1284-1286 (1977).
- Shirai, H., Datta, A. K., Oshita, S. Penetration of aerobic bacteria into meat: A mechanistic understanding. Journal of Food Engineering. 196, 193-207 (2017).
- Thornlow, D. N., Brackett, E. L., Gigas, J. M., Dessel, N. V., Forbes, N. S. Persistent enhancement of bacterial motility increases tumor penetration: Motility enhances bacterial tumor penetration. Biotechnology and Bioengineering. 112 (11), 2397-2405 (2015).
- Toley, B. J., Forbes, N. S. Motility is critical for effective distribution and accumulation of bacteria in tumor tissue. Integrative Biology. 4 (2), 165-176 (2011).
- Dechesne, A., Wang, G., Gülez, G., Or, D., Smets, B. F. Hydration-controlled bacterial motility and dispersal on surfaces. Proceedings of the National Academy of Sciences. 107 (32), 14369-14372 (2010).
- de Souza, R., Ambrosini, A., Passaglia, L. M. P. Plant growth-promoting bacteria as inoculants in agricultural soils. Genetics and Molecular Biology. 38 (4), 401-419 (2015).
- Turnbull, G. A., Morgan, J. A. W., Whipps, J. M., Saunders, J. R. The role of bacterial motility in the survival and spread of Pseudomonas fluorescens in soil and in the attachment and colonisation of wheat roots. FEMS Microbiology Ecology. 36 (1), 21-31 (2001).
- Watt, M., Kirkegaard, J. A., Passioura, J. B. Rhizosphere biology and crop productivity—a review. Soil Research. 44 (4), 299-317 (2006).
- Adadevoh, J. S. T., Ramsburg, C. A., Ford, R. M. Chemotaxis Increases the Retention of Bacteria in Porous Media with Residual NAPL Entrapment. Environmental Science & Technology. 52 (13), 7289-7295 (2018).
- Adadevoh, J. S. T., Triolo, S., Ramsburg, C. A., Ford, R. M. Chemotaxis Increases the Residence Time of Bacteria in Granular Media Containing Distributed Contaminant Sources. Environmental Science & Technology. 50 (1), 181-187 (2016).
- Ford, R. M., Harvey, R. W. Role of chemotaxis in the transport of bacteria through saturated porous media. Advances in Water Resources. 30 (6-7), 1608-1617 (2007).
- Wang, M., Ford, R. M., Harvey, R. W. Coupled effect of chemotaxis and growth on microbial distributions in organic-amended aquifer sediments: Observations from laboratory and field studies. Environmental Science & Technology. 42 (10), 3556-3562 (2008).
- Amchin, D. B., Ott, J. A., Bhattacharjee, T., Datta, S. S. Influence of confinement on the spreading of bacterial populations. PLoS Computational Biology. 18 (5), e1010063 (2022).
- Moore-Ott, J. A., Chiu, S., Amchin, D. B., Bhattacharjee, T., Datta, S. S. A biophysical threshold for biofilm formation. eLife. 11, e76380 (2022).
- Tittsler, R. P., Sandholzer, L. A. The use of semi-solid agar for the detection of bacterial motility. Journal of Bacteriology. 31 (6), 575-580 (1936).
- Bhattacharjee, T., et al. Polyelectrolyte scaling laws for microgel yielding near jamming. Soft Matter. 14 (9), 1559-1570 (2018).
- Bhattacharjee, T., Datta, S. S. Confinement and activity regulate bacterial motion in porous media. Soft Matter. 15 (48), 9920-9930 (2019).
- Bhattacharjee, T., Datta, S. S. Bacterial hopping and trapping in porous media. Nature Communications. 10 (1), 2075 (2019).
- Bhattacharjee, T., Amchin, D. B., Ott, J. A., Kratz, F., Datta, S. S. Chemotactic migration of bacteria in porous media. Biophysical Journal. 120 (16), 3483-3497 (2021).
- Bhattacharjee, T., Amchin, D. B., Alert, R., Ott, J. A., Datta, S. S. Chemotactic smoothing of collective migration. eLife. 11, e71226 (2022).
- Tashman, J. W., Shiwarski, D. J., Feinberg, A. W. A high performance open-source syringe extruder optimized for extrusion and retraction during FRESH 3D bioprinting. HardwareX. 9, e00170 (2021).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. Journal of Colloid and Interface Science. 179 (1), 298-310 (1996).
- Chatterjee, T., Chatterjee, B. K., Chakrabarti, P. Modelling of growth kinetics of Vibrio cholerae in presence of gold nanoparticles: Effect of size and morphology. Scientific Reports. 7 (1), 9671 (2017).
- Martínez-Calvo, A., et al. Morphological instability and roughening of growing 3D bacterial colonies. Proceedings of the National Academy of Sciences. 119 (43), e2208019119 (2022).
- Lehner, B. A. E., Schmieden, D. T., Meyer, A. S. A Straightforward approach for 3D bacterial printing. ACS Synthetic Biology. 6 (7), 1124-1130 (2017).
- Zhang, Q., et al. Morphogenesis and cell ordering in confined bacterial biofilms. Proceedings of the National Academy of Sciences. 118 (31), e2107107118 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved