Method Article
3D打印细菌研究复杂3D多孔介质中的运动和生长
摘要
该协议描述了细菌菌落的三维(3D)打印程序,以研究它们在复杂的3D多孔水凝胶基质中的运动和生长,这些基质比传统的液体培养物或培养皿更类似于其自然栖息地。
摘要
细菌在复杂的三维 (3D) 多孔环境中无处不在,例如生物组织和凝胶,以及地下土壤和沉积物。然而,以前的大多数工作都集中在对散装液体或平坦表面的细胞的研究上,这并不能完全概括许多天然细菌栖息地的复杂性。在这里,通过描述一种将致密的细菌菌落3D打印成卡住的颗粒状水凝胶基质的方法的发展,解决了这一知识空白。这些基质具有可调的孔径和机械性能;它们在物理上限制了细胞,从而在3D中支持它们。它们是光学透明的,允许使用成像直接可视化细菌在周围环境中的传播。作为这一原理的证明,在这里,通过3D打印和成像非运动和运动 性霍乱弧菌以及非运动性 大肠杆菌, 在具有不同间质孔径的卡住颗粒水凝胶基质中证明了该协议的能力。
引言
细菌通常栖息在多样化、复杂的 3D 多孔环境中,从肠道和肺部的粘膜凝胶到地下的土壤1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、 16,17,18,19,20,21,
22,23,24,25.在这些环境中,细菌通过运动或生长的运动可能会受到周围障碍物的阻碍,例如聚合物网络或固体矿物颗粒的堆积物,从而影响细胞在其环境中扩散的能力26,获取营养来源,在新地形上定植,并形成保护性生物膜群落27.然而,传统的实验室研究通常采用高度简化的几何形状,专注于液体培养物或平面上的细胞。虽然这些方法对微生物学产生了关键的见解,但它们并没有完全概括自然栖息地的复杂性,导致与在现实世界环境中进行的测量相比,生长速度和运动行为存在巨大差异。因此,迫切需要一种方法来定义细菌菌落并研究它们在更类似于其许多自然栖息地的 3D 多孔环境中的运动和生长。
将细胞接种到琼脂凝胶中,然后通过肉眼或使用相机观察它们的宏观扩散,提供了一种实现此目的的直接方法,正如 Tittsler 和 Sandholzer 于 1936年首次提出的那样 28.然而,这种方法存在许多关键的技术挑战:(1)虽然原则上可以通过改变琼脂糖浓度来改变孔径,但这种凝胶的孔结构定义不清;(2)光散射导致这些凝胶浑浊,难以以高分辨率和高保真度在单个尺度上可视化细胞,特别是在大样品中;(3)当琼脂浓度过大时,细胞迁移仅限于凝胶的顶部平坦表面;(4) 这种凝胶的复杂流变性使得引入具有明确几何形状的接种物具有挑战性。
为了解决这些局限性,在之前的工作中,Datta的实验室开发了一种替代方法,使用颗粒状水凝胶基质 - 由在液体细菌培养物中膨胀的卡住的生物相容性水凝胶颗粒组成 - 作为"多孔培养皿"来限制3D细胞。这些基质是柔软的、自愈的屈服应力固体;因此,与用于其他生物打印工艺的交联凝胶不同,注射微喷嘴可以通过局部重新排列水凝胶颗粒29,沿着任何规定的3D路径在基质内自由移动。然后,这些颗粒迅速重新致密化并在注射的细菌周围自我修复,从而在没有任何额外有害处理的情况下将细胞支撑到位。因此,该过程是3D打印的一种形式,它使细菌细胞能够以所需的3D结构排列,具有确定的群落组成,位于具有可调物理化学性质的多孔基质中。此外,水凝胶基质是完全透明的,可以使用成像直接可视化细胞。
这种方法的实用性之前已经通过两种方式得到了证明。在一组研究中,稀释的细胞分散在整个水凝胶基质中,这使得研究单个细菌的运动性成为可能30,31。在另一组研究中,使用安装在可编程显微镜载物台上的注射喷嘴在厘米级凝胶中3D打印多细胞群落,这使得研究细菌群落在其周围环境中的传播成为可能32,33。在这两种情况下,这些研究都揭示了与液体培养/平面上的细菌相比,栖息在多孔环境中的细菌的传播特性存在以前未知的差异。然而,鉴于它们被安装在显微镜载物台上,这些先前的研究仅限于小样品体积(~1 mL),因此实验时间尺度很短。它们在定义具有高空间分辨率的接种物几何形状方面的能力也受到限制。
在这里,描述了解决这两个限制的下一代实验平台。具体来说,提供了协议,通过该协议,人们可以使用带有注射器挤出机的改进的3D打印机进行3D打印并大规模成像细菌菌落。此外,代表性数据表明,以生物膜形成 霍乱弧 菌和浮游 大肠杆 菌为例,这种方法可用于研究细菌的运动和生长。这种方法使细菌菌落能够长时间维持,并使用各种成像技术进行可视化。因此,这种方法在3D多孔生境中研究细菌群落的能力具有巨大的研究和应用潜力,影响了肠道、皮肤、肺和土壤中微生物的治疗和研究。此外,这种方法将来可用于将基于细菌的工程生物材料3D打印成更复杂的独立形状。
研究方案
这种方法是使用 Tashman 等人先前建立的协议将商用 3D 熔融沉积建模打印机转换为 3D 生物打印机34。简而言之,Tashman等人用定制的注射泵挤出机取代了商用挤出机头。该挤出机能够以 3D 形式打印细菌细胞的高浓度液体悬浮液,其挤出体积和 3D 位置由 G 代码编程语言控制。挤出体积在软件中通过挤出机步骤(E-step)指定,并按照下文进一步说明进行校准。因此,这些细菌悬浮液被直接打印到颗粒状水凝胶基质中,该基质充当细胞的 3D 支持。下面,该协议还描述了如何制备具有不同聚合物浓度的基质,表征由此产生的孔径和流变特性的变化,并使用直接成像表征随后的细菌运动和生长。
1. 将商用3D打印机转换为3D生物打印机
- 从商用 3D 打印机上拆下挤出机和加热器(参见 材料表)。
- 按照先前的协议制造注射泵挤出机34,并进行额外的修改以容纳一次性鲁尔锁注射器。将注射泵挤出机安装到打印机上。
注意:修改塑料注射器注射器泵挤出机所需的 CAD 文件在补充文件 1-3 中提供。 - 在计算机上安装并打开 3D 打印机软件(请参阅 材料表)。将 3D 打印机连接到计算机。
- 通过对齐机构的上半部分和下半部分,将带有适当尺寸针头的 1 mL 一次性注射器装入 3D 打印夹具中(图 1)。使用三个 M8 套筒螺栓和薄钢六角螺母将夹子固定在注射器周围(参见 材料表)。注射器柱塞与注射泵挤出机中的丝杠连接。通过旋转丝杠手动升高柱塞,以在注射器中产生 0.5 mL 的气隙。
- 如果污染是实验的问题,请将注射器夹复合物运输到生物罩中,并在进入时用 70% 乙醇喷雾灭菌,然后再完成以下步骤。
2.细菌悬浮液的制备
- 对于 霍乱弧菌和大肠杆菌, 在37°C的2%Lennox LB(Luria肉汤,参见 材料表)琼脂平板上生长过夜。
- 对于 霍乱弧菌, 将细胞接种到 3 mL 液体 LB 中,并带有 10 个无菌玻璃珠。将细胞在37°C的振荡培养箱中生长5-6小时,直到指数中期至光密度(OD)600~0.9。
- 对于 大肠杆菌, 将细胞接种到3mL液体LB中,在37°C的振荡培养箱中培养细胞过夜。将 200 μL 过夜培养物接种在新鲜 LB 中 3 小时,直至 OD 达到 0.6。
- 将培养物转移到 10 mL 离心管中。在室温下以5,000× g 离心培养物5分钟以形成沉淀。除去上清液。用 ~10 μL 液体 LB 重悬,以达到 ~9 x 1010 个细胞/mL 的细胞密度。
3. 将细菌悬浮液装入注射器中
注意:提供了两种将细菌加载到注射器中的方法(步骤3.1和步骤3.2)。步骤 3.1 用于加载少量细菌悬浮液 <200 μL,步骤 3.2 用于加载较大体积的细菌悬浮液 >200 μL。 步骤 3.1 用于此处所示的代表性结果。
- 将空的 1 mL 塑料鲁尔锁注射器装入 3D 生物打印机。将注射器柱塞与丝杠连接。手动缩回注射器以添加 0.2 mL 的气隙,为柱塞在注射器中移动提供空间,因为每批实验使用少量细胞 ~20-50 μL。
- 将钝针头连接到注射器尖端,其针头尺寸与所需的打印特征尺寸相符。在这里,使用 2 英寸 20 G 针头。
- 通过将细菌接种物置于针头下方的 10 mL 离心管,将细菌悬浮液加载到注射器中。手动旋转螺钉以缩回注射器柱塞并将细胞加载到注射器中。细菌细胞体积非常小,通常细胞只被加载到针头中。
- 从注射器 - 夹复合物中取出柱塞,并使用另一个注射器和针头小心地将所需的细菌悬浮液加载到注射器 - 夹复合物中,小心避免捕获气泡。注射器 - 夹复合物应用所需的细菌悬浮液稍微填充边缘,然后转移到生物打印机上。
- 小心地将没有柱塞的注射器夹复合物插入生物打印机挤出机主芯上的相应插座中。
- 确保打印机托架大约在丝杠的一半处,并且装载的注射器下方有一个收集盘。然后,小心地将柱塞插入托架和注射器夹复合体,直到它卡在托架上。将柱塞缓慢压入细菌悬浮液中,以避免气泡滞留在注射器中。
- 将适配器夹滑到柱塞背面的托架上,以将其固定到位,以便进行挤压和缩回操作。
4. 挤出机步骤校准至沉积体积
- 要将挤出机步骤(E-step)校准到沉积体积,首先使用实验中使用的精确注射器,注射器针头和沉积细菌悬浮液设置生物打印机。在这里,使用 1 mL 鲁尔锁注射器。
- 通过挤出任意 E 步长编号 (~200) 确定要校准的估计 E 步长范围,并使用注射器体积标记记录柱塞体积变化。
- 使用此粗略的 E 步进与体积比来确定 E-step 设置以执行校准扫描。例如,如果 200 的 E 步长通过目视检查挤出约 20 μL,并且想要沉积 10-200 μL,则测试 100-2000 之间的 E-step。
- 要进行线性校准扫描,首先在灵敏度为 0.1 mg 的分析天平上标记并测量 20 个 1.5 mL 采样管的干质量。
- 将细菌悬浮液挤出到预先测量的 1.5 mL 管中。对于每个 E 步骤,至少执行 2 次重复。对线性范围内的所有 E 步重复,必要时更换细菌悬浮液。如果污染是实验的问题,则在每次样品后用浸有 70% 乙醇的无绒抹布擦拭注射器针头的外部。
- 使用相同的分析天平测量所有 1.5 mL 试管的质量数。从第二个中减去第一个质量值,得到沉积的细菌悬浮液的净质量。
- 将细菌悬浮液的质量转换为具有材料密度的体积。对于许多主要由水组成的细菌悬浮液,1 g/mL 是适当的密度近似值。
- 在 E-step 和挤出体积之间执行线性配合以完成校准过程。
5.颗粒状水凝胶基质的制备
- 在生物安全柜中,将交联丙烯酸/烷基丙烯酸酯共聚物的干燥颗粒(参见 材料表)加入 400 mL 2% Lennox Luria-Bertani (LB) 中,以保持基质无菌;然而,其他液体细胞培养基也可用于使水凝胶基质膨胀。
注意:添加到LB中的颗粒的重量百分比取决于目标孔径。在本研究中,对于0.9%颗粒状水凝胶基质,向LB中加入3.6 g干颗粒,对于1.2%颗粒状水凝胶基质,向LB中加入4.8 g干颗粒。通过在立式混合器中混合2分钟,将水凝胶颗粒均匀分散。 - 混合后,通过添加 20 至 500 μL 增量的 10 M 氢氧化钠 (NaOH) 将 pH 调节至 7.4,以确保细胞活力。每次添加NaOH后,通过将移液管吸头浸入混合物中,然后将水凝胶基质擦拭到pH测试纸上来测量pH值。
注意:随着NaOH的加入,混合物的粘度会随着水凝胶颗粒开始膨胀而增加。膨胀的水凝胶颗粒直径为 ~5 μm 至 10 μm,并挤在水凝胶基质中。颗粒的内部网格尺寸为~40nm至100nm,如前所述32。网孔尺寸足够大,小分子(例如氧气和营养物质)可以自由扩散,但足够小,细菌可以限制在间隙孔之间。 - 接下来,使用 50 mL 无菌塑料注射器将颗粒水凝胶基质转移到 50 mL 离心管中。在室温下以161× g 离心水凝胶基质1分钟,以除去混合过程中形成的气泡。
- 让水凝胶基质在室温下静置至少 2 天,以确保没有发生污染。污染表现为悬浮在水凝胶基质中的微菌落。两天后,将水凝胶基质以161× g 离心1分钟,以除去形成的任何其他气泡。
注意:通过将水凝胶基质在室温下储存长达一周,可以在此处暂停该协议。 - 在生物安全柜中,使用 30 mL 无菌塑料注射器,将所需量的水凝胶基质转移到将要进行打印的容器中(此处 ~20 mL 用于 20 mL 组织培养瓶或 1 mL 用于 1 mL 塑料微量比色皿)。
6. 颗粒状水凝胶基质流变特性的表征
- 将 ~3 mL 的水凝胶基质加载到剪切流变仪(参见 材料表)中,粗糙的 50 mm 直径平行板之间留有 1 mm 的间隙,以测量流变特性。
- 通过测量剪切应力作为剪切速率从 10-4 s-1 到 102 s-1 的对数扫描的函数,在剪切流变仪上使用单向剪切测量来量化屈服行为(例如, 图 2A)。
注意:在低剪切速率下,水凝胶基体将具有与剪切速率无关的恒定剪切应力(屈服应力)。在高剪切速率下,剪切应力将随着幂律对剪切速率的依赖而增加,表明水凝胶基体的流化。这种屈服-应力行为允许细菌在颗粒水凝胶基质内被3D打印29。 - 使用应变幅度为 1% 且频率介于 0.1 至 1 Hz 之间的小振幅振荡流变学分别测量存储模量和损耗模量 G' 和 G'' 作为频率的函数(例如, 图 2B)。
注:用于3D打印的理想颗粒状水凝胶基质应具有大于损耗模量的存储模量,这表明介质充当卡住的弹性固体29。
7. 颗粒状水凝胶基质间隙孔径的表征
- 将 100 nm 羧化荧光聚苯乙烯纳米颗粒(~3.6 x10 13 粒/mL,参见 材料表)在其包装中超声处理 15 分钟以重悬以分解任何聚集/颗粒簇。将 50 μL 纳米颗粒转移到 1.5 mL 微量离心管中。
- 在室温下以9,500× g 离心10分钟,直到沉淀形成并且上清液澄清。除去上清液并将沉淀重悬于用于制备颗粒水凝胶基质的 1 mL 液体生长培养基(此处为 LB)中。
注意:通过将重悬的纳米颗粒在4°C下储存长达3个月,可以在此处暂停该协议。
- 在室温下以9,500× g 离心10分钟,直到沉淀形成并且上清液澄清。除去上清液并将沉淀重悬于用于制备颗粒水凝胶基质的 1 mL 液体生长培养基(此处为 LB)中。
- 将重悬的纳米颗粒超声处理30分钟。将 1 mL 颗粒水凝胶基质转移到 1.5 mL 微量离心管中。将 1 μL 重悬的纳米颗粒加入颗粒状水凝胶基质中,并用移液器吸头混合。混合后,在室温下以161× g 离心30秒。
- 将水凝胶基质和纳米颗粒混合物转移到直径为35mm的培养皿中,培养皿的玻璃底孔厚为0.1mm。该井的直径为20毫米,深度为1毫米。将玻璃盖玻片放在顶部并向下按压以禁用成像过程中的流动和蒸发。玻璃盖玻片的替代方法是在顶部加入 1 mL 石蜡油。
- 使用共聚焦显微镜对纳米颗粒进行成像,该显微镜具有40倍油物镜,并在成像软件中增加了8倍的变焦(参见 材料表)。
注意:可以使用更高放大倍率的物镜,而不是在软件中使用额外的数码变焦。- 在单个 z 平面上对无延迟(理想情况下为 ~19 帧/秒)的时间循环进行 2 分钟的成像,视场内至少有四个纳米粒子。在不同位置重复 15 到 20 次,以收集足够的数据进行统计(100 到 200 个纳米颗粒)。
- 使用粒子跟踪软件分析粒子的位移。在这里,使用基于经典 Crocker-Grier 算法的自定义脚本来跟踪纳米粒子35 的质心(参见 补充文件 7)。
- 根据粒子跟踪,计算均方位移 (MSD)。MSD 将在短长度和时间尺度上表现出孔隙空间中的自由扩散,并且由于限制35,将在大长度和时间尺度上过渡到亚扩散缩放。
- 确定向亚扩散缩放过渡的长度尺度,以估计局部孔径。通过将此长度刻度添加到纳米颗粒直径来计算孔径。对测量的每个纳米颗粒重复孔径分析。这将产生一个孔径分布,从中可以计算出平均孔径(例如, 图3)。
8. 3D印刷工艺
- 用于样品容器的 3D 打印定制支架(CAD 文件参见 补充文件 4-6 )。在这里,使用组织培养瓶和微量比色皿的支架。支架允许对打印机进行编程,以在一次打印会话中打印多个样品。将装有水凝胶培养基的样品容器放在构建平台上的支架中。
- 打开3D打印软件。将预编程的 g 代码加载到软件中。对于具有代表性的结果,步骤3.1用于将细菌悬浮液加载到3D打印机中。
注: 表 1 给出了用于打印线性垂直几何形状的 g 代码示例。 - 通过 3D 打印软件,移动 x-y-z 平面,使打印头在 x-y 平面上居中,成为第一个容器,然后归位 z 轴。归位 z 轴将抬起打印头。手动缓慢旋转螺钉以压下注射器柱塞,直到在针尖处可以看到少量细菌悬浮液。
- 用无菌一次性湿巾轻轻擦去多余的细菌悬浮液。根据样品架、针头和注射器的高度,使用 3D 打印软件,将打印头降低到所选样品容器中的水凝胶介质中固定距离。单击"打印"开始打印过程。
- 打印完成后,关闭样品容器。用 70% 乙醇擦拭打印机。妥善处理注射器和针头。
9. 霍乱弧菌的生长和成像
- 对于大视场成像,请使用带有变焦镜头附件的相机,通过灯箱对细胞生长进行成像。在室温下打印后立即对样品进行成像,然后将它们转移到培养箱中。在实验期间,在成像会话之间将样品保持在固定培养箱中的37°C。
- 在所需的时间内捕获图像,以观察颗粒状水凝胶基质中长时间的生长行为。
结果
使用带有颗粒水凝胶基质的3D生物打印机扩展了生物打印机的功能,将细菌菌落打印成形状,当打印在平坦的基材上时,由于细菌悬浮液的低粘度,这些形状会坍塌。这里介绍的方法的分辨率取决于挤出速度、针头尺寸、打印头速度、针中的空气和细菌悬浮液的粘度。由于细菌悬浮液的体积小,在将细菌悬浮液装入注射器和针头的过程中,可能会无意中引入气泡。这可能导致气泡沉积在最终的打印结构中(图4)。将气泡引入打印的另一种方法是,如果在打印前不按下柱塞以在针尖处形成一小滴细菌悬浮液,并且针尖存在气隙。打印前不按下注射器柱塞也会导致在同一批次中打印不同体积的细胞。然而,随着时间的流逝,气泡会溶解到周围的介质中,如 图 4 所示。
对于校准挤出步骤,沉积的体积取决于打印头的线性执行器如何平移注射器柱塞,注射器的内径将直接影响体积。此外,细菌悬浮液的流变特性将影响它们通过针头收缩剪切以顺利打印的难易程度。因此,对于每个注射器/针头/细菌悬浮液设置,都应重做此校准程序。原则上,注射器校准可以自动化。然而,在实践中,编写这样一条广泛适用于许多用例的代码将具有挑战性。例如,如果用户打算校准 1 mL 注射器约 300 μL 的挤出量,则需要比在 30 μL 目标体积附近校准的用户更频繁地重新加载注射器。由于校准过程开始时 E 步进到体积的校准常数是未知的,因此用户可能无法准确预测实际需要重新加载的频率。此外,为了实现校准过程的自动化,需要指定每个预称量的 1.5 mL 试管的确切位置。为确保所有生物墨水都从针头沉积到管子中以进行精确校准,必须在针头和管底/壁之间进行精确接触。如果没有良好的接触,小液滴可能会保持湿润并附着在针头上。因此,管子之间的任何位置变化都可能极大地导致校准过程中的误差。出于这些原因,作者建议每个用户构建一个适合其独特需求的校准程序。
这里介绍的方法的一个关键特征是能够使用成像直接通过运动和生长可视化细菌在其环境中传播。在早期版本的成像方案中,6 孔板填充了 19 mL 颗粒状水凝胶基质。然而,即使成功地在倒置显微镜上观察到水平细胞线的3D打印,密集的菌落也会在培养基的顶面生长,从而限制了明场显微镜的可视化(图5)。顶面的菌落可能是由于在打印过程中将注射器针头放入介质中或从介质中取出时受到污染造成的。为了规避这个问题,在闪烁小瓶中打印了细胞的垂直线(图6A)。然而,圆柱形小瓶的曲率在成像过程中会导致失真。这导致选择平壁比色皿和组织培养瓶作为打印样品容器,从而实现不失真的成像(图6B-D)。组织培养瓶的一个局限性是小倾斜的颈部,这限制了可以打印的几何形状。
综上所述,该协议允许在长时间尺度上观察复杂多孔环境中的细菌运动和生长。图6B-G显示了使用明场显微镜形成生物膜的霍乱弧菌以及使用激光扫描荧光共聚焦显微镜的大肠杆菌浮游细胞的一些示例,证明了这种方法的多功能性。事实上,水凝胶基质的一个潜在问题是,当使用荧光显微镜成像时,它们可能会产生自发荧光;然而,图6F,G中显示的图像表明,在本文介绍的实验平台中,这种自发荧光是最小的。这种光学显微镜方法的另一个局限性是它们的空间分辨率,这是由~100 s纳米的衍射极限设定的;然而,这个长度尺度远小于单个细菌细胞的大小,因此,光学技术提供了从单个细胞的尺度(图6G)到更大的多细胞菌落的尺度30,31,32,33对细菌细胞进行成像的能力。下面将介绍其他示例。
如上所述,此处介绍的方法可用于对小 (1 mL) 和大 (20 mL) 基质体积中的细菌菌落进行 3D 打印和成像。因此,下面描述了使用不同体积获得的结果的差异,使用3D打印的运动 和非运动霍乱弧菌 菌落作为代表性示例。打印件的空间分辨率(线条宽度)由喷嘴的内径决定。在下面描述的示例中,内径为 0.6 mm 的针会产生 0.6 mm 的初始圆柱形菌落。先前的研究表明,通过使用内径为 ~100-200 μm33 的拉动玻璃毛细管,可以进一步降低打印分辨率。
对于小体积,使用具有两种不同孔径分布的两种不同的颗粒水凝胶基质:一种的平均孔径大于霍乱弧菌细胞的平均直径,0.2-0.4μm36,另一种平均孔径小于该直径。通过对菌落随时间扩展的图像分析,对12天内的样品进行成像和测量(图7和图8)。对于只能通过细胞生长在周围环境中扩散的非运动细胞,所研究的不同基质之间的区域扩张速率相似(图7),表明基质孔径的差异不会影响细胞通过生长的扩散 - 正如预期的那样。相比之下,对于通过主动运动在周围环境中扩散的运动细胞,霍乱弧菌的面扩展速率对于具有较大孔隙的水凝胶基质更高 - 水凝胶颗粒的限制对细胞运动的阻碍较小。细菌传播的这些差异在菌落形态中也很明显(图8)。霍乱弧菌在具有较大孔隙的水凝胶基质中的菌落通过光滑的弥漫羽流扩散(图8A),反映了通过先前观察到的主动运动传播32。事实上,与这种解释一致,在非运动细胞的情况下没有观察到这些弥漫性羽流(图8C)。此外,孔隙足够大,以至于细胞在游过孔隙时不会推动珠子。此外,游泳施加的粘性应力小于1 Pa,不足以使周围的水凝胶基质明显变形。相比之下,具有较小孔隙的水凝胶基质中的菌落仅通过运动和非运动细胞的粗糙分形状羽流扩散(图8B,D),反映仅通过细胞生长扩散,而细胞生长时它们瞬时变形并产生周围的基质。事实上,鉴于水凝胶基质的屈服应力远小于细胞的膨胀压力,在这种小孔径的限制下,基质仅提供微弱的细胞生长抵抗力,并且似乎不会强烈影响3D打印结构,正如我们之前的工作37所验证的那样。
在大体积样品中进行的实验也观察到类似的结果;然而,鉴于这些样品中营养物质的丰度更高,实验可以在更长的时间尺度上维持细胞生长。例如,使用平均孔径小于细胞大小的颗粒水凝胶基质的结果显示 - 因此,细胞扩散主要是由于生长。将样品在颗粒水凝胶基质中成像~30天,并在前150小时内观察到非运动细胞和运动细胞的相似区域扩张;然而,在更长的时间内,观察到样品之间的强烈变异性,一些样品表现出更快的扩散速率(图9 和 图10)。有趣的是,在实验后对水凝胶基质重新取样时(水凝胶基质体积大的一个好处),测量到屈服应力、储存模量和损耗模量的降低(图11),表明基质变得更软。这种变化可能是由于 霍乱弧菌 产生的分子正在改变水凝胶基质的性质并长时间促进细胞扩散,这将在未来的研究中进行有趣的测试。 图 10 显示了导致这些实验的粗糙、分形状菌落形态的示例。

图 1:定制 3D 生物打印机的图像。 (A) 带有改进的注射泵挤出机头的生物打印机,带有一次性鲁尔锁注射器和针头。生物打印机的宽度为 ~46 厘米。(B)在装满卡住水凝胶基质的烧瓶中3D打印细胞的图像。图像的宽度为 87 毫米。 请点击这里查看此图的较大版本.
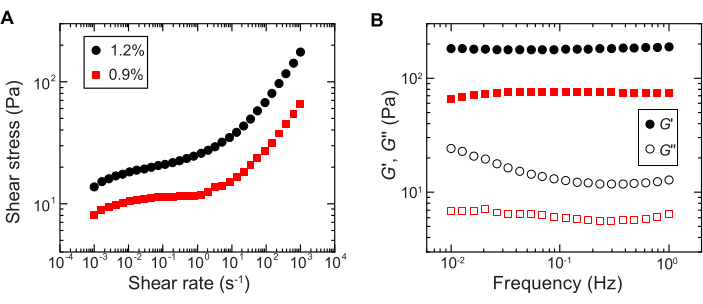
图2:颗粒水凝胶基质流变特性的表征。 (A) 剪切应力与外加剪切速率的函数关系。(B) 存储模量和损耗模量, 分别为G' 和 G'',作为振荡频率的函数。图例表示用于制备每个水凝胶基质的水凝胶质量分数。 请点击这里查看此图的较大版本.
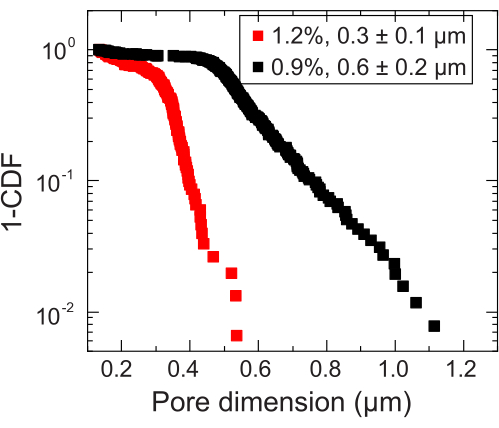
图 3:两种代表性颗粒水凝胶基质的孔径测量。 通过跟踪示踪剂,确定每个水凝胶基质的特征孔尺寸分布。数据用 1-CDF 表示,其中 CDF 是累积分布函数。图例表示用于制备每个基质的水凝胶质量分数。 请点击这里查看此图的较大版本.
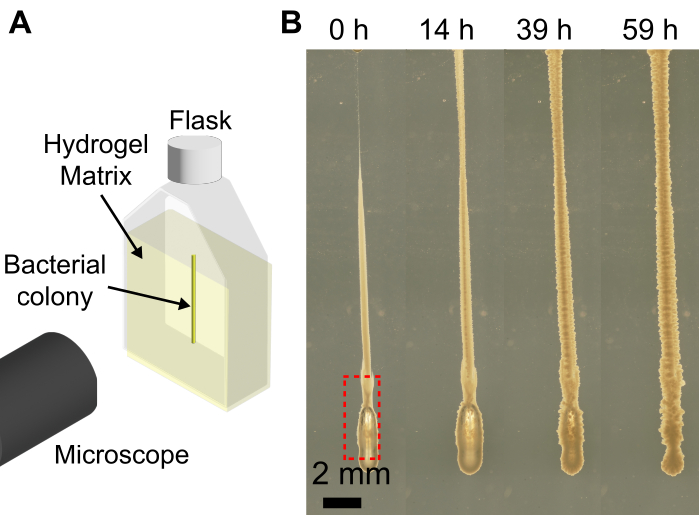
图4:细菌3D打印过程中形成的气泡示例。 (A) 成像装置示意图。(B) 霍 乱弧菌 生长的快照,在 LB 中肿胀的 1.2% 水凝胶基质中,打印底部(红框)有一个气泡。在37°C下生长59小时后,气泡完全溶解,并且由于水凝胶基质的弹性,菌落塌陷。比例尺 = 2 毫米。 请点击这里查看此图的较大版本.

图5:在6孔板中打印的活态霍乱弧菌水平线的图像,该平板填充了1.2%水凝胶基质,在LB中膨胀,并在37°C下孵育48小时后在顶表面上形成的生物膜。 (A) 成像设置示意图。(B)在3D打印过程中由于污染而在顶面形成的生物膜降低了不透明度,并且无法对水平线进行清晰成像。顶面形成皱纹,可能是由于生长差异造成的。比例尺 = 5 mm. 请点击这里查看此图的较大版本.
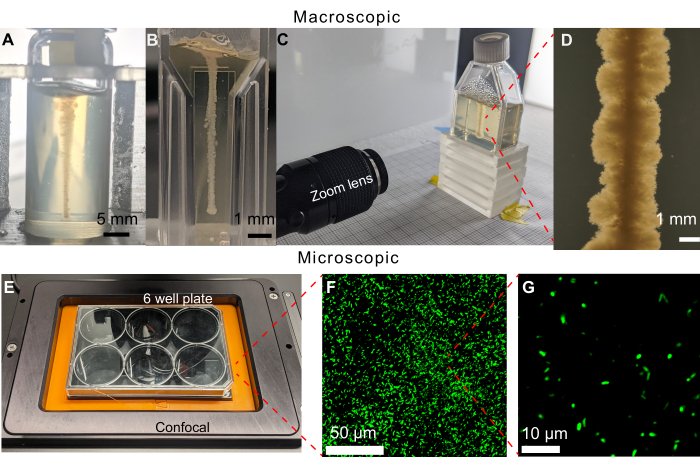
图 6:可用于此方法的不同样品容器的示例。(A)在470小时后在装有1.2%颗粒水凝胶基质的玻璃小瓶中打印霍乱弧菌。小瓶的曲率使生长成像变得困难。比例尺 = 5 mm。 (B) 霍 乱弧菌 打印在填充有 1.2% 颗粒水凝胶基质的微比色皿中。平坦的侧面允许清晰的成像,然而,小体积限制了细胞用完生长底物之前的实验时间。(C) 使用变焦镜头成像装置,以在填充有 1.2% 颗粒水凝胶基质的组织培养瓶中打印霍 乱弧菌 。与微型比色皿盒类似,平坦的侧面可以实现清晰的成像。组织培养瓶可以填充更大体积的颗粒状水凝胶基质,从而延长实验时间跨度。(D)在37°C下孵育100小时后,打印在1.2%颗粒水凝胶基质内的 霍乱弧菌 变焦镜头的图像。 比例尺 = 1 mm。 (E) 使用共聚焦显微镜对荧光细胞进行成像设置。(F)在37°C孵育10天后,1.2%颗粒水凝胶基质内荧光 大肠杆 菌共聚焦显微照片的3D投影。 比例尺 = 50 μm。 (G) 水凝胶基质内荧光 大肠杆菌 的单细胞分辨率共聚焦显微照片。比例尺 = 10 μm。 请点击这里查看此图的较大版本.
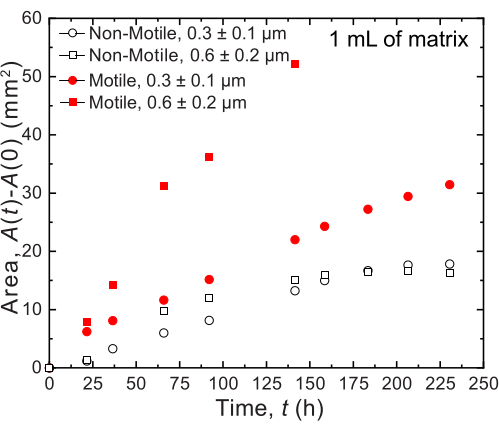
图 7:打印在 1 mL 颗粒水凝胶支持基质中的 霍乱弧菌 菌落随时间变化的面积扩展。 图上的数据来自 图8的图像分析。观察到运动细胞(闭合的红色圆圈和正方形)比非运动细胞以更快的速度扩散,反映了生长和运动的扩散。此外,具有大孔径(红色方块)的水凝胶基质中的运动细胞比具有0.3μm孔(红色圆圈)的水凝胶基质中的细胞以更快的速度扩散。非运动细胞在两种孔径之间的面膨胀率没有差异,因为它们只是在生长。 请点击这里查看此图的较大版本.

图 8:打印在 1 mL 颗粒水凝胶支持基质中的 霍乱弧 菌菌落。 (A) 0.9%颗粒水凝胶基质中运动 霍乱弧 菌的生长和运动快照,其中孔径大于平均细胞直径。箭头表示由于细胞在水凝胶基质中移动而形成的弥漫羽流。(B) 在孔径小于平均细胞直径的 1.2% 颗粒水凝胶基质中运动霍 乱弧 菌的生长和运动快照。箭头表示由于细胞生长而形成的粗糙的分形状羽流。(C) 0.9%颗粒状水凝胶基质中非运动 霍乱弧 菌的时间演变快照,其中孔径大于平均细胞直径。在这种情况下,无法观察到反映运动的漫射羽流。(D) 在孔径小于平均细胞直径的 1.2% 颗粒水凝胶支持基质中非运动霍 乱弧 菌生长的快照。在这种情况下,再次可以观察到反映生长的粗糙的分形羽流。比例尺 = 1 mm. 请点击这里查看此图的较大版本.
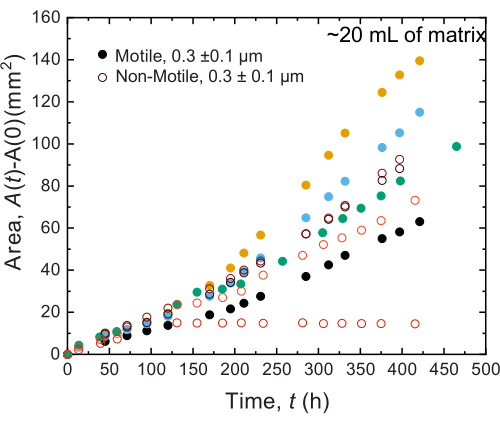
图 9:在 20 mL 1.2% 颗粒水凝胶支持基质中打印的 霍乱弧菌 菌落随时间变化的面积扩展。 观察到非运动细胞(开放圈)和运动细胞(闭圈)在前 100 小时内以相似的速率扩散。100小时后,观察到面膨胀率的差异,这可能是由于长时间变化的演变。 请点击这里查看此图的较大版本.

图10:在37°C下生长的22 mL 1.2%颗粒水凝胶基质中打印的 霍乱弧菌 菌落。 (顶部)运动 霍乱弧菌生长的快照。(底部)非运动 霍乱弧菌生长的快照。在这两种情况下,都可以观察到反映生长的粗糙的分形状羽流。比例尺 = 2 mm. 请点击这里查看此图的较大版本.
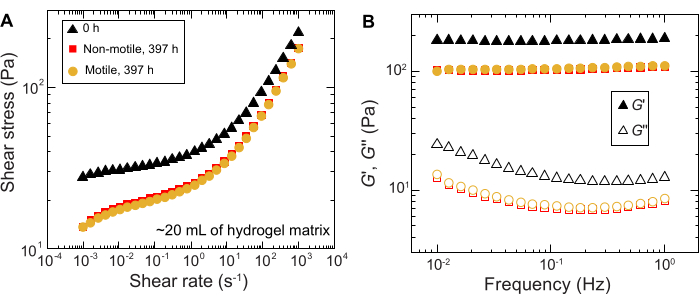
图11:实验前(0小时)和实验后(397小时)1.2%颗粒水凝胶基质的流变特性表征。 (A) 剪切应力与外加剪切速率的函数关系。(B) 存储模量和损耗模量,分别为 G'和 G'',作为外加振荡频率的函数。 请点击这里查看此图的较大版本.
| Gcode 命令 | 任务 | |||
| M82型 | 绝对挤出模式 | |||
| M302 S0 | 启用冷挤压 | |||
| M92 E14575 | 设置每毫米的挤出步长 | |||
| G92 X35.61 Y81 Z0 E0.0 | 将 z 轴和挤出位置设置为零,将 x,y- 位置设置为 35.71 mm 和 y 88 mm,其中 g 代码启动时打印头所在的位置 | |||
| M221 S100 T0 | 将流速设置为 100% | |||
| 货号 M107 | 关闭风扇 | |||
| G1 F1 X35.61 Y81 E0.1 | 将 20 μL 生物墨水以 50 μL/min 的进料速率挤出到基质中,其中设置了当前位置 | |||
| G0 F200 Z60型 | 将针从基质中拉出,并以 200 mm/min 的速度对样品进行采样 | |||
| G0 F500 X65.81 Y81.0 | 以 500 mm/min 的速度将针头移动到下一个样品连接器 | |||
| G0 F100 Z0 | 将针头降低到下一个样品中,使其以100 mm / min的速度开始打印的相同z位置 | |||
| G1 F1 X65.81 Y81.0 E0.2 | 将 20 μL 生物墨水以 50 μL/min 的进料速率挤出到基质中,其中设置了当前位置 | |||
| G0 F200 Z60型 | 将针从基质中拉出,并以 200 mm/min 的速度对样品进行采样 | |||
| G0 F500 X96.01 Y81.0 | 以 500 mm/min 的速度将针头移动到下一个样品连接器 | |||
| G0 F100 Z0 | 将针头放入样品连接器中,以100 mm / min的速度开始打印的相同z位置 | |||
| G1 F1 X96.01 Y81.0 E0.3 | 将 20 μL 生物墨水以 50 μL/min 的进料速率挤出到基质中,其中设置了当前位置 | |||
| G0 F200 Z60型 | 将针从基质中拉出,并以 200 mm/min 的速度对样品进行采样 | |||
| G0 F500 X126.21 Y81.0 | 以 500 mm/min 的速度将针头移动到下一个样品连接器 | |||
| G0 F100 Z0 | 将针头降低到下一个样品中,使其以100 mm / min的速度开始打印的相同z位置 | |||
| G1 F1 X126.21 Y81.0 E0.4 | 将 20 μL 生物墨水以 50 μL/min 的进料速率挤出到基质中,其中设置了当前位置 | |||
| G0 F200 Z80系列 | 将针从基质中拉出,并以 200 mm/min 的速度对样品进行采样 | |||
表 1:用于打印细菌悬浮液垂直线的 G 代码编程。
补充文件 1:用于注射器挤出机的底部夹 1 mL 一次性鲁尔锁注射器的 STL 文件。请点击此处下载此文件。
补充文件 2:用于注射器挤出机的 1 mL 一次性鲁尔锁注射器顶部夹具的 STL 文件。请点击此处下载此文件。
补充文件 3:用于注射器挤出机的 1 mL 一次性鲁尔锁注射器的注射器适配器的 STL 文件。请点击此处下载此文件。
补充文件4:比色皿样品架的STL文件。请点击此处下载此文件。
补充文件 5:用于组织烧瓶样品架的 STL 文件。请点击此处下载此文件。
补充文件6:用于6孔板和35 mm培养皿打印床的STL文件。请点击此处下载此文件。
补充文件 7:用于粒子跟踪的自定义脚本。请点击此处下载此文件。
讨论
协议中的关键步骤
重要的是要确保在制备每种水凝胶基质时,基质是在无菌环境中制备的。否则,可能会发生污染,例如,几天后基质中出现微菌落(小球体)。在混合过程中,重要的是所有干燥的颗粒状水凝胶颗粒都被溶解。此外,当用NaOH调节每个水凝胶基质的pH值时,颗粒会开始膨胀,这会增加水凝胶基质的粘度,导致混合更加困难。使用立式混合器将有助于确保NaOH充分混合到水凝胶基质中。在加载每种细菌悬浮液的过程中,针头中会形成气穴。为避免此问题,请确保针尖始终位于离心管的细菌悬浮液中,而不是在管的底部或靠近顶面。克服这个问题的另一种方法是培养大量细胞,从而具有更大体积的细菌悬浮液用于打印。
局限性
目前,在打印过程中,细菌悬浮液的低粘度限制了可以打印的几何形状,并且由于痕量细胞,通常会导致生物膜形成并在水凝胶基质表面的顶部生长。有几种潜在的方法可以克服这一限制,包括增加细菌悬浮液的粘度或进一步优化3D打印机设置。为了增加细菌悬浮液的粘度,可以将细菌悬浮液与另一种聚合物混合 - 例如,海藻酸盐,海藻酸盐之前已用于将细菌3D打印到平面上38。可以进一步优化打印机设置,以便在针头从颗粒水凝胶基质中取出时使注射器柱塞缩回,这有可能阻止细胞在从水凝胶基质中取出针头时沉积。
该方法相对于现有/替代方法的意义
这里描述的方法允许将细菌菌落打印成颗粒状水凝胶基质。颗粒状水凝胶基质可以研究外部环境因素(例如孔径、基质变形能力)对细菌运动和生长的影响。此外,虽然在这项工作中,LB被用作液体生长培养基来使水凝胶基质膨胀,但水凝胶基质可以被其他液体生长培养基(包括含有抗生素的培养基)肿胀。以前在密闭环境中研究细菌的方法受到实验时间长短、聚合物网格尺寸和周围水凝胶基质刚度的限制37,38。已经存在用不同聚合物制造颗粒状水凝胶基质的方案,因此研究不同环境条件对细菌运动和生长的影响的潜力是巨大的。这种方法允许在对照环境中研究细菌,这些环境更容易概括细菌在现实世界中栖息的环境,例如宿主粘液或土壤。许多其他方法的另一个局限性是周围基质的不透明度;然而,这种使用光学透明材料的方法提供了探索的能力,例如,光遗传学控制和3D细菌的图案化。
除了研究运动和生长之外,这里描述的3D打印方法克服了许多其他生物打印方法的局限性,这些方法需要将生物墨水沉积在基材上,因此,它们可以产生的工程生物材料的高度受到限制。未来,这种生物打印协议可以进一步扩展,通过将聚合物与生物膜形成细胞混合来制造生物杂化材料。与许多其他当前的细菌生物打印方法相比,颗粒状水凝胶基质为3D打印更厚,更大规模的工程生物材料和更复杂的几何形状提供支持。虽然这项工作只使用了 霍乱弧菌 和 大肠杆菌, 但其他物种,如 铜绿假单胞菌, 也成功地被3D打印37。除了打印之外,打印机还可以调整为在生长后对细菌进行受控采样,例如,查看是否有任何遗传变化。
披露声明
本出版物中用于3D打印和成像细菌群落的实验平台是普林斯顿大学代表Tapomoy Bhattacharjee和S.S.D.提交的专利申请的主题(PCT申请号PCT/US/2020/030213)。
致谢
R.K.B. 感谢总统博士后研究员计划的支持。本材料还基于 NSF 研究生研究奖学金计划资助 DGE-2039656(致 A.M.H.)支持的工作。A.S.D.-M.和 H.N.L. 感谢普林斯顿大学 Lidow 独立工作/高级论文基金的支持。我们还要感谢邦妮·巴斯勒(Bonnie Bassler)的实验室提供 霍乱弧菌菌株。S.S.D. 感谢 NSF 资助 CBET-1941716、DMR-2011750 和 EF-2124863 以及 Eric 和 Wendy Schmidt 变革技术基金、新泽西州健康基金会、皮尤生物医学学者计划和 Camille Dreyfus 教师学者计划的支持。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL cuvettes | VWR | 97000-586 | |
| 1 mL Luer lock syringe | BH Supplies | BH1LL | |
| 10 M NaOH | Sigma-Aldrich | 72068 | |
| 100 nm carboxylated fluorescent polystyrene nanoparticles (FluoSpheres) | Invitrogen, (ThermoFischer Scientific) | F8803 | |
| 15 mL centrifuge tubes | ThermoFischer Scientific | 14-955-237 | |
| 20 G blunt needle | McMaster Carr | 75165A252 | |
| 25 mL tissue culture flasks | VWR | 10861-566 | |
| 3D printer | Lulzbot | LulzBot Mini 2 | |
| 3D printing software | Cura | Cura-Lulzbot | |
| 50 mL centrifuge tubes | ThermoFischer Scientific | 14-955-239 | |
| Agar | Sigma-Aldrich | A1296 | |
| Carbomer Granular Hydrogel Particles | Lubrizol | Carbopol 980NF | dry granules of crosslinked acrylic acid/alkyl acrylate copolymers |
| Centrifuge (2 mL tube capacity) | VWR | 2405-37 | |
| Centrifuge (50 mL tube capacity) | ThermoFischer Scientific | 75007200 | Sorvall (brand) ST 8 (model) |
| Confocal Microscope | Nikon | A1R+ inverted laserscanning confocal microscope | |
| Glass bottom petri dish | Cellvis | D35-10-1-N | |
| Lennox LB (Lubria Broth) | Sigma-Aldrich | L3022 | |
| M8 × 1.25 mm, 150 mm long, Fully Threaded Socket Cap | McMaster Carr | 91290A478 | |
| M8 × 1.25 mm, Brass Thin Hex Nut | McMaster Carr | 93187A300 | |
| Open-source syringe pump | Custom-made | Replistruder 4 | https://www.sciencedirect.com/science/article/pii/S2468067220300791 |
| Petri dish (60 mm round) | ThermoFischer Scientific | FB0875713A | |
| Shear Rheometer | Anton Paar | MCR 501 | |
| Ultrasonic cleaner | VWR | 97043-992 |
参考文献
- Persat, A., et al. The mechanical world of bacteria. Cell. 161 (5), 988-997 (2015).
- Stoodley, P., Dodds, I., Beer, D. D., Scott, H. L., Boyle, J. D. Flowing biofilms as a transport mechanism for biomass through porous media under laminar and turbulent conditions in a laboratory reactor system. Biofouling. 21 (3-4), 161-168 (2005).
- Ludemann, H., Arth, I., Liesack, W. Spatial changes in the bacterial community structure along a vertical oxygen gradient in flooded paddy soil cores. Applied and Environmental Microbiology. 66 (2), 754-762 (2000).
- Sicard, J. F., Bihan, G. L., Vogeleer, P., Jacques, M., Harel, J. Interactions of intestinal bacteria with components of the intestinal mucus. Frontiers in Cellular and Infection Microbiology. 7, 387 (2017).
- Grice, E. A., Segre, J. A. The skin microbiome. Nature Reviews Microbiology. 9 (4), 244-253 (2011).
- Balzan, S., Quadros, C. D. A., Cleva, R. D., Zilberstein, B., Cecconello, I. Bacterial translocation: Overview of mechanisms and clinical impact. Journal of Gastroenterology and Hepatology. 22 (4), 464-471 (2007).
- Chaban, B., Hughes, H. V., Beeby, M. The flagellum in bacterial pathogens: For motility and a whole lot more. Seminars in Cell & Developmental Biology. 46, 91-103 (2015).
- Datta, S. S., Steinberg, A. P., Ismagilov, R. F. Polymers in the gut compress the colonic mucus hydrogel. Proceedings of the National Academy of Sciences. 113 (26), 7041-7046 (2016).
- Harman, M. W., et al. The heterogeneous motility of the Lyme disease spirochete in gelatin mimics dissemination through tissue. Proceedings of the National Academy of Sciences. 109 (8), 3059-3064 (2012).
- Ribet, D., Cossart, P. How bacterial pathogens colonize their hosts and invade deeper tissues. Microbes and Infection. 17 (3), 173-183 (2015).
- Siitonen, A., Nurminen, M. Bacterial motility is a colonization factor in experimental urinary tract infection. Infection and Immunity. 60 (9), 3918-3920 (1992).
- Lux, R., Miller, J. N., Park, N. H., Shi, W. Motility and chemotaxis in tissue penetration of oral epithelial cell layers by Treponema denticola. Infection and Immunity. 69 (10), 6276-6283 (2001).
- O’Neil, H. S., Marquis, H. Listeria monocytogenes flagella are used for motility, not as adhesins, to increase host cell invasion. Infection and Immunity. 74 (12), 6675-6681 (2006).
- Gill, C. O., Penney, N. Penetration of bacteria into meat. Applied and Environmental Microbiology. 33 (6), 1284-1286 (1977).
- Shirai, H., Datta, A. K., Oshita, S. Penetration of aerobic bacteria into meat: A mechanistic understanding. Journal of Food Engineering. 196, 193-207 (2017).
- Thornlow, D. N., Brackett, E. L., Gigas, J. M., Dessel, N. V., Forbes, N. S. Persistent enhancement of bacterial motility increases tumor penetration: Motility enhances bacterial tumor penetration. Biotechnology and Bioengineering. 112 (11), 2397-2405 (2015).
- Toley, B. J., Forbes, N. S. Motility is critical for effective distribution and accumulation of bacteria in tumor tissue. Integrative Biology. 4 (2), 165-176 (2011).
- Dechesne, A., Wang, G., Gülez, G., Or, D., Smets, B. F. Hydration-controlled bacterial motility and dispersal on surfaces. Proceedings of the National Academy of Sciences. 107 (32), 14369-14372 (2010).
- de Souza, R., Ambrosini, A., Passaglia, L. M. P. Plant growth-promoting bacteria as inoculants in agricultural soils. Genetics and Molecular Biology. 38 (4), 401-419 (2015).
- Turnbull, G. A., Morgan, J. A. W., Whipps, J. M., Saunders, J. R. The role of bacterial motility in the survival and spread of Pseudomonas fluorescens in soil and in the attachment and colonisation of wheat roots. FEMS Microbiology Ecology. 36 (1), 21-31 (2001).
- Watt, M., Kirkegaard, J. A., Passioura, J. B. Rhizosphere biology and crop productivity—a review. Soil Research. 44 (4), 299-317 (2006).
- Adadevoh, J. S. T., Ramsburg, C. A., Ford, R. M. Chemotaxis Increases the Retention of Bacteria in Porous Media with Residual NAPL Entrapment. Environmental Science & Technology. 52 (13), 7289-7295 (2018).
- Adadevoh, J. S. T., Triolo, S., Ramsburg, C. A., Ford, R. M. Chemotaxis Increases the Residence Time of Bacteria in Granular Media Containing Distributed Contaminant Sources. Environmental Science & Technology. 50 (1), 181-187 (2016).
- Ford, R. M., Harvey, R. W. Role of chemotaxis in the transport of bacteria through saturated porous media. Advances in Water Resources. 30 (6-7), 1608-1617 (2007).
- Wang, M., Ford, R. M., Harvey, R. W. Coupled effect of chemotaxis and growth on microbial distributions in organic-amended aquifer sediments: Observations from laboratory and field studies. Environmental Science & Technology. 42 (10), 3556-3562 (2008).
- Amchin, D. B., Ott, J. A., Bhattacharjee, T., Datta, S. S. Influence of confinement on the spreading of bacterial populations. PLoS Computational Biology. 18 (5), e1010063 (2022).
- Moore-Ott, J. A., Chiu, S., Amchin, D. B., Bhattacharjee, T., Datta, S. S. A biophysical threshold for biofilm formation. eLife. 11, e76380 (2022).
- Tittsler, R. P., Sandholzer, L. A. The use of semi-solid agar for the detection of bacterial motility. Journal of Bacteriology. 31 (6), 575-580 (1936).
- Bhattacharjee, T., et al. Polyelectrolyte scaling laws for microgel yielding near jamming. Soft Matter. 14 (9), 1559-1570 (2018).
- Bhattacharjee, T., Datta, S. S. Confinement and activity regulate bacterial motion in porous media. Soft Matter. 15 (48), 9920-9930 (2019).
- Bhattacharjee, T., Datta, S. S. Bacterial hopping and trapping in porous media. Nature Communications. 10 (1), 2075 (2019).
- Bhattacharjee, T., Amchin, D. B., Ott, J. A., Kratz, F., Datta, S. S. Chemotactic migration of bacteria in porous media. Biophysical Journal. 120 (16), 3483-3497 (2021).
- Bhattacharjee, T., Amchin, D. B., Alert, R., Ott, J. A., Datta, S. S. Chemotactic smoothing of collective migration. eLife. 11, e71226 (2022).
- Tashman, J. W., Shiwarski, D. J., Feinberg, A. W. A high performance open-source syringe extruder optimized for extrusion and retraction during FRESH 3D bioprinting. HardwareX. 9, e00170 (2021).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. Journal of Colloid and Interface Science. 179 (1), 298-310 (1996).
- Chatterjee, T., Chatterjee, B. K., Chakrabarti, P. Modelling of growth kinetics of Vibrio cholerae in presence of gold nanoparticles: Effect of size and morphology. Scientific Reports. 7 (1), 9671 (2017).
- Martínez-Calvo, A., et al. Morphological instability and roughening of growing 3D bacterial colonies. Proceedings of the National Academy of Sciences. 119 (43), e2208019119 (2022).
- Lehner, B. A. E., Schmieden, D. T., Meyer, A. S. A Straightforward approach for 3D bacterial printing. ACS Synthetic Biology. 6 (7), 1124-1130 (2017).
- Zhang, Q., et al. Morphogenesis and cell ordering in confined bacterial biofilms. Proceedings of the National Academy of Sciences. 118 (31), e2107107118 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。