Method Article
複雑な3D多孔質媒体の運動性と増殖を研究するための3Dプリンティングバクテリア
要約
このプロトコルは慣習的な液体培養かペトリ皿より自然な生息地に類似している複雑な3D多孔質のヒドロゲルのマトリックスの運動性そして成長を調査する細菌のコロニーの三次元(3D)印刷のためのプロシージャを記述する。
要約
バクテリアは、生体組織やゲル、地下の土壌や堆積物など、複雑な3次元(3D)多孔質環境に遍在しています。しかし、これまでの研究の大部分は、バルク液体や平らな表面の細胞の研究に焦点を当てており、多くの天然の細菌生息地の複雑さを完全には再現していません。ここでは、バクテリアの密集したコロニーを詰まった粒状ハイドロゲルマトリックスに3Dプリントする方法の開発を説明することで、この知識のギャップに対処します。これらのマトリックスは、調整可能な細孔サイズと機械的特性を備えています。細胞を物理的に閉じ込め、3Dで支えます。光学的に透明であるため、イメージングを使用して周囲に広がる細菌を直接視覚化できます。この原理の証拠として、ここでは、このプロトコルの能力を、さまざまな間質細孔サイズを持つ詰まった粒状ヒドロゲルマトリックス中の非運動性および運動性 コレラ菌、および非運動性 大腸菌 の3D印刷およびイメージングによって実証されています。
概要
バクテリアは、腸や肺の粘膜ゲルから地面の土壌まで、多様で複雑な3D多孔質環境に生息することがよくあります1,2,3,4,5,6,7,8,9,10,11,12,13,14,15、16、17、18、19、20、21、
22、23、24、25。これらの環境では、運動性または増殖による細菌の移動は、ポリマーネットワークや固体ミネラル粒子のパッキンなどの周囲の障害物によって妨げられる可能性があり、細胞が環境中に広がり26、栄養源にアクセスし、新しい地形にコロニーを形成し、保護バイオフィルムコミュニティを形成する能力に影響を与えます27.しかし、従来のラボ研究では、液体培養や平らな表面の細胞に焦点を当て、非常に単純化された形状が採用されているのが一般的です。これらのアプローチは、微生物学に関する重要な洞察をもたらすが、自然生息地の複雑さを完全には再現しておらず、現実世界の環境で行われた測定と比較して、成長率と運動行動に劇的な違いをもたらしている。したがって、細菌のコロニーを定義し、多くの自然生息地に類似した3D多孔質環境での細菌の運動性と成長を研究する方法が決定的に必要とされています。
細胞を寒天ゲルに接種し、その肉眼的な広がりを目視またはカメラで視覚化することは、1936年にTittslerとSandholzerによって最初に提案されたように、これを達成するための1つの簡単な方法を提供します28。しかし、このアプローチには多くの重要な技術的課題があります:(1)原理的には、アガロース濃度を変化させることで細孔径を変えることができますが、そのようなゲルの細孔構造は十分に定義されていません。(2)光散乱により、これらのゲルが濁り、特に大きなサンプルでは、個々のスケールで細胞を高解像度と忠実度で可視化することが困難になります。(3)寒天濃度が大きすぎると、細胞の移動がゲルの上部の平らな表面に制限されます。(4)このようなゲルの複雑なレオロジーは、明確に定義された形状を持つ接種物の導入を困難にします。
これらの制限に対処するために、Datta氏の研究室では、以前の研究で、顆粒状のハイドロゲルマトリックス(液体細菌培養で膨潤した詰まった生体適合性のハイドロゲル粒子で構成される)を「多孔質ペトリ皿」として使用して、細胞を3Dに閉じ込める別のアプローチを開発しました。これらのマトリックスは、柔らかく、自己修復性があり、降伏応力の固体です。したがって、他のバイオプリンティングプロセスで使用される架橋ゲルとは異なり、注入マイクロノズルは、ヒドロゲル粒子29を局所的に再配置することによって、任意の所定の3D経路に沿ってマトリックス内を自由に移動することができる。その後、これらの粒子は急速に再高密度化し、注入されたバクテリアの周りで自己修復し、追加の有害な処理を行うことなく細胞を所定の位置にサポートします。したがって、このプロセスは、調整可能な物理化学的特性を持つ多孔質マトリックス内に、細菌細胞を目的の3D構造で、定義されたコミュニティ組成で配置できるようにする3Dプリンティングの一形態です。さらに、ハイドロゲルマトリックスは完全に透明であるため、イメージングを使用して細胞を直接可視化できます。
このアプローチの有用性は、以前に 2 つの方法で実証されています。ある一連の研究では、希薄な細胞がハイドロゲルマトリックス全体に分散し、個々の細菌の運動性の研究が可能になりました30,31。別の一連の研究では、プログラム可能な顕微鏡ステージに取り付けられた注入ノズルを使用して、多細胞コミュニティをセンチメートルスケールのゲルに3Dプリントし、周囲への細菌集団の拡散の研究を可能にしました32,33。いずれの場合も、多孔質環境に生息する細菌の拡散特性に、液体培養や平坦面に生息する細菌と比較して、これまで知られていなかった違いが明らかになりました。しかし、顕微鏡ステージに取り付けられていたため、これらの先行研究は少量のサンプル(~1 mL)に限定されていたため、実験時間スケールが短かったのです。また、高い空間分解能で接種形状を定義する能力にも限界がありました。
ここでは、両方の制限に対処する次世代の実験プラットフォームについて説明します。具体的には、シリンジ押出機を取り付けた改造3Dプリンターを使用して、細菌コロニーを大規模に3Dプリントおよび画像化するためのプロトコルが提供されています。さらに、代表的なデータは、バイオフィルム形成コ レラ菌 とプランクトン性 大腸菌 を例に、このアプローチが細菌の運動性と増殖の研究にどのように役立つかを示しています。このアプローチにより、細菌のコロニーを長期間にわたって維持し、さまざまなイメージング技術を使用して視覚化することができます。したがって、3D多孔質生息地の細菌群集を研究するこのアプローチの能力は、腸、皮膚、肺、土壌の微生物の処理と研究に影響を与える、非常に大きな研究と応用の可能性を秘めています。さらに、このアプローチは、将来的には、バクテリアベースの人工生体材料をより複雑な自立型形状に3Dプリントするために使用できる可能性があります。
プロトコル
このアプローチは、Tashmanらによって以前に確立されたプロトコルを使用して、市販の3D溶融堆積モデリングプリンターを3Dバイオプリンターに変換することです34。簡単に言うと、Tashmanらは、市販の押出機ヘッドをカスタムメイドのシリンジポンプ押出機に置き換えました。この押出機は、Gコードプログラミング言語によって制御された押出量と3D位置により、細菌細胞の高濃度液体懸濁液を3Dで印刷することができます。押し出された体積は、押出機ステップ(Eステップ)によってソフトウェアで指定され、さらに以下で説明するように追加で校正されます。これにより、これらの細菌懸濁液は、細胞の3D支持体として機能する粒状ヒドロゲルマトリックスに直接印刷されます。以下では、プロトコルでは、異なるポリマー濃度のマトリックスを調製する方法、細孔サイズとレオロジー特性の変化を特徴付ける方法、および直接イメージングを使用してその後の細菌の運動性と増殖を特徴付ける方法についても説明します。
1. 業務用3Dプリンターの3Dバイオプリンター化
- 市販の3Dプリンターから押出機とヒーターを取り外します( 材料表を参照)。
- 以前のプロトコルに従って、シリンジポンプ押出機34を製造し、使い捨てのルアーロックシリンジを収容するための追加の修正を加えた。シリンジポンプエクストルーダーをプリンターに取り付けます。
注:プラスチックシリンジ用のシリンジポンプ押出機を変更するために必要なCADファイルは、補足ファイル1〜3に記載されています。 - 3Dプリンタソフトウェア( 材料表を参照)をコンピュータにインストールして開きます。3Dプリンターをコンピューターに接続します。
- 1 mLの使い捨てシリンジと適切なサイズの針をセットし、機構の上半分と下半分を合わせて、3Dプリントしたクランプにセットします(図1)。3本のM8ソケットボルトと細いスチール製の六角ナットを使用して、シリンジの周りにクランプを固定します( 材料表を参照)。シリンジプランジャーは、シリンジポンプ押出機のリードスクリューと接続します。親ネジを回転させてプランジャーを手動で持ち上げ、シリンジに0.5 mLのエアギャップを作成します。
- コンタミネーションが懸念される場合は、シリンジクランプ複合体をバイオフードに輸送し、入室時に70%エタノールスプレーで滅菌してから、次の手順を完了してください。
2.細菌懸濁液の調製
- コレラ菌および大腸菌については、2% Lennox LB(Luria Broth、材料表を参照)寒天プレート上で37°Cで一晩増殖させます。
- コレラ菌の場合は、10個の滅菌ガラスビーズを3 mLの液体LBに細胞を接種します。37°Cの振とうインキュベーターで5〜6時間、中指数関数的相になるまで細胞を光学密度(OD)600~0.9まで増殖させます。
- 大腸菌の場合は、細胞を3 mLの液体LBに接種し、37°Cの振とうインキュベーターで一晩培養します。200 μL のオーバーナイト培養液を新鮮な LB に 3 時間、OD が 0.6 に達するまで接種します。
- 培養液を10 mLの遠心チューブに移します。培養液を室温で5,000× g で5分間遠心分離し、ペレットを形成します。上澄みを取り除きます。~10 μL の液体 LB で再懸濁し、細胞密度を ~9 x 1010 細胞あたり mL にします。
3.細菌懸濁液をシリンジに入れる
注:バクテリアをシリンジにロードするには、2つの方法があります(ステップ3.1とステップ3.2)。ステップ3.1は少量の細菌懸濁液(<200 μL)をロードし、ステップ3.2は>200 μLの大容量の細菌懸濁液をロードする場合に機能します。 ステップ 3.1 は、ここに示した代表的な結果に利用されました。
- 空の1 mLプラスチックルアーロックシリンジを3Dバイオプリンターにロードします。シリンジプランジャーを親ネジで接続します。シリンジを手動で引っ込めて0.2 mLのエアギャップを追加し、実験の各バッチに少量の細胞~20-50 μLを使用するため、プランジャーがシリンジ内を移動するスペースを確保します。
- シリンジの先端に鈍い針を取り付け、必要な印刷機能のサイズに必要な針サイズにします。ここでは、2インチの20G針を使用しています。
- 細菌接種液を針の下に入れた10 mL遠心チューブをシリンジにロードします。手動でネジを回してシリンジプランジャーを引っ込め、セルをシリンジにロードします。バクテリアの細胞体積は非常に小さいため、多くの場合、細胞は針にロードされるだけです。
- シリンジクランプ複合体からプランジャーを取り外し、別のシリンジとニードルを使用して、気泡を閉じ込めないように注意しながら、シリンジクランプ複合体に目的の細菌懸濁液を慎重にロードします。.シリンジクランプ複合体は、目的の細菌懸濁液で縁のわずかに満たし、バイオプリンターに移す必要があります。
- プランジャーなしでシリンジクランプコンプレックスを、バイオプリンターエクストルーダーのメインコアの対応するソケットに慎重に挿入します。
- プリンタキャリッジが親ネジの約半分にあり、セットされたシリンジの下に収集皿があることを確認します。次に、プランジャーをキャリッジとシリンジクランプコンプレックスの両方に慎重に挿入し、キャリッジに引っ掛かります。プランジャーを細菌懸濁液にゆっくりと押し下げて、シリンジに気泡を閉じ込めないようにします。.
- アダプタークランプをプランジャーの背面のキャリッジにスライドさせて、押し出し操作と引き込み操作の両方のために所定の位置に固定します。
4. 堆積量に対する押出機ステップの校正
- エクストルーダーステップ(Eステップ)を堆積量に較正するには、まず、実験に使用する正確なシリンジ、シリンジ針、および堆積細菌懸濁液を備えたバイオプリンターをセットアップします。ここでは、1 mLのルアーロックシリンジを使用します。
- 任意のEステップ番号(~200)を押し出して校正する推定Eステップ範囲を決定し、シリンジ容量マーカーでプランジャー容量の変化を記録します。
- この粗いEステップと体積の比率を使用して、キャリブレーションスイープオーバーを実行するためのEステップ設定を決定します。例えば、200のEステップが目視検査で約20μL押し出され、10-200μLを堆積させたい場合、100-2000の間でEステップをテストします。
- リニアキャリブレーションスイープを実行するには、まず、0.1 mg の感度を持つ分析天びん上で 20 本の 1.5 mL サンプリングチューブの乾燥質量を標識して測定します。
- 事前に測定した1.5 mLチューブに細菌懸濁液を押し出します。各Eステップについて、少なくとも2回の反復を実行します。線形範囲のすべてのEステップについて繰り返し、必要に応じて細菌懸濁液を交換します。コンタミネーションが懸念される場合は、各サンプルの後に、70%エタノールで飽和した糸くずの出ないワイプでシリンジニードルの外側を拭きます。
- すべての 1.5 mL チューブの質量を同じ分析天びんで測定します。第1の質量値を第2の質量値から減算して、堆積した細菌懸濁液の正味質量を求めます。
- バクテリア懸濁液の質量を材料密度の体積に変換します。主に水で構成される多くの細菌懸濁液では、1 g/mLが適切な密度近似値です。
- Eステップと押し出されたボリュームの間に線形フィットを実行して、キャリブレーションプロセスを終了します。
5. 顆粒状ヒドロゲルマトリックスの調製
- バイオセーフティキャビネットで、架橋アクリル酸/アクリル酸アルキル共重合体の乾燥顆粒( 材料表を参照)を400 mLの2%レノックスルリア-ベルタニ(LB)に加え、マトリックスを無菌状態に保ちます。しかしながら、他の液体細胞培養培地もまた、ヒドロゲルマトリックスを膨潤させるために用いることができる。
注:LBに添加される顆粒の重量パーセントは、目指す細孔サイズによって異なります。本研究では、0.9%顆粒ヒドロゲルマトリックスの場合、3.6gの乾燥顆粒をLBに添加し、1.2%顆粒ヒドロゲルマトリックスの場合、4.8gの乾燥顆粒をLBに添加します。ヒドロゲル顆粒は、スタンドミキサーで2分間混合することにより均一に分散されます。 - 混合したら、10 Mの水酸化ナトリウム(NaOH)を20〜500 μL刻みで添加してpHを7.4に調整し、細胞の生存率を確保します。NaOHを添加するたびに、ピペットチップを混合物に浸し、ヒドロゲルマトリックスをpH試験紙に拭き取ってpHを測定します。
注:NaOHを添加すると、ヒドロゲル顆粒が膨潤し始めると、混合物の粘度が上昇します。膨潤したヒドロゲル顆粒は直径が5~10μmで、ヒドロゲルマトリックス中に詰まっています。顆粒の内部メッシュサイズは、以前に確立されたように、~40nmから100nmです32。メッシュサイズは、小分子(酸素や栄養素など)が自由に拡散するのに十分な大きさですが、細菌が間質孔の間に閉じ込められるのに十分な大きさです。 - 次に、50 mLの滅菌プラスチックシリンジを使用して、粒状ヒドロゲルマトリックスを50 mLの遠心チューブに移します。ヒドロゲルマトリックスを室温で161 x g で1分間遠心分離し、混合プロセス中に形成された気泡を除去します。
- ヒドロゲルマトリックスを室温で少なくとも2日間放置し、コンタミネーションが発生していないことを確認します。コンタミネーションは、ハイドロゲルマトリックス中に浮遊するミクロコロニーとして現れます。2 日後、ヒドロゲルマトリックスを 161 x g で 1 分間遠心分離し、形成された追加の気泡を除去します。
注:プロトコルは、ハイドロゲルマトリックスを室温で最大1週間保存することにより、ここで一時停止できます。 - バイオセーフティキャビネット内で、30 mLの滅菌プラスチックシリンジを使用して、所望の量のハイドロゲルマトリックスを印刷が行われる容器に移します(ここでは、20 mLの組織培養フラスコの場合は~20 mL、1 mLのプラスチックマイクロキュベットの場合は1 mLを使用しました)。
6. 粒状ヒドロゲルマトリックスのレオロジー特性の解析
- 粗面化した直径50 mmの平行プレートの間に1 mmの隙間を空けて、~3 mLのハイドロゲルマトリックスをせん断レオメーター( 材料表を参照)にロードし、レオロジー特性を測定します。
- せん断レオメーターで一方向せん断測定を行い、せん断応力をせん断速度の対数スイープの関数として測定することにより、降伏挙動を定量化します(例:図2A)。
注:低いせん断速度では、ハイドロゲルマトリックスはせん断速度とは無関係に一定のせん断応力(降伏応力)を持ちます。せん断速度が高い場合、せん断応力はせん断速度のべき乗則依存性で増加し、ヒドロゲルマトリックスの流動化を示します。この収率−応力挙動により、粒状ヒドロゲルマトリックス29内に細菌を3Dプリントすることができる。 - ひずみ振幅が1%、周波数が0.1〜1Hzの小振幅振動レオロジーを使用して、蓄電弾性率と損失弾性率G''をそれぞれ周波数の関数として測定します(例:図2B)。
注:3Dプリンティングのための理想的な粒状ヒドロゲルマトリックスは、媒体が詰まった弾性固体29として作用することを示す損失弾性率よりも大きい貯蔵弾性率を有するべきである。
7. 顆粒状ヒドロゲルマトリックス間質孔径の特性評価
- 100 nm カルボキシル化蛍光ポリスチレンナノ粒子 (~3.6 x 1013 粒子/mL、 材料表を参照) をパッケージ内で 15 分間超音波処理し、再懸濁して粒子の凝集体/クラスターを分解します。50 μLのナノ粒子を1.5 mLの微量遠心チューブに移します。
- ペレットが形成され、上清が透明になるまで、室温で9,500 x g で10分間遠心分離します。上清を除去し、顆粒状ヒドロゲルマトリックスの調製に使用した1 mLの液体増殖培地(ここではLB)にペレットを再懸濁します。
注:再懸濁したナノ粒子を4°Cで最大3ヶ月間保存することにより、ここでプロトコルを一時停止することができます。
- ペレットが形成され、上清が透明になるまで、室温で9,500 x g で10分間遠心分離します。上清を除去し、顆粒状ヒドロゲルマトリックスの調製に使用した1 mLの液体増殖培地(ここではLB)にペレットを再懸濁します。
- 再懸濁したナノ粒子を30分間超音波処理します。1 mLの顆粒ハイドロゲルマトリックスを1.5 mLの微量遠心チューブに移します。再懸濁したナノ粒子1μLを顆粒状ハイドロゲルマトリックスに加え、ピペットチップで混合します。混合後、室温で161 x g で30秒間遠心分離します。
- ハイドロゲルマトリックスとナノ粒子混合物を、厚さ0.1mmのガラス底ウェルを備えた直径35mmのペトリ皿に移します。井戸は直径20mm、深さ1mmです。ガラス製のカバーガラスを上に置き、押し下げて、イメージング中の流れと蒸発を無効にします。ガラスカバーガラスの代わりに、上部に1 mLのパラフィンオイルを追加することもできます。
- 40倍のオイル対物レンズを備えた共焦点顕微鏡を使用して、イメージングソフトウェアで8倍のズームを追加してナノ粒子をイメージングします( 材料表を参照)。
注:ソフトウェアで追加のデジタルズームを使用する代わりに、より高い倍率の対物レンズを使用できます。- 視野内に少なくとも4つのナノ粒子がある状態で、単一のz平面で2分間、遅延のないタイムループ(理想的には~19フレーム/秒)を画像化します。統計に十分なデータ(100〜200個のナノ粒子)を収集するために、異なる場所で15〜20回繰り返します。
- 粒子追跡ソフトウェアを使用して、粒子の変位を解析します。ここでは、ナノ粒子35 の重心を追跡するために、古典的なCrocker-Grierアルゴリズムに基づいてカスタム記述されたスクリプトが使用される( 補足ファイル7参照)。
- 粒子追跡から、平均二乗変位 (MSD) を計算します。MSDは、閉じ込めにより、短い長さと時間スケールで細孔空間に自由拡散を示し、大きな長さと時間スケールでサブ拡散スケーリングに移行します35。
- サブ拡散スケーリングへの移行が発生する長さスケールを特定して、局所的な細孔サイズを推定します。この長さスケールをナノ粒子の直径に追加して、細孔サイズを計算します。測定したすべてのナノ粒子について、細孔径分析を繰り返します。これにより、平均細孔径を計算できる細孔径分布が得られます(例: 図3)。
8. 3D印刷プロセス
- サンプルコンテナ用のカスタムメイドホルダーを3Dプリントします(CADファイルについては、 補足ファイル4-6 を参照)。ここでは、組織培養フラスコおよびマイクロキュベット用のホルダーが使用される。ホルダーを使用すると、1回の印刷セッションで複数のサンプルを印刷するようにプリンターをプログラミングできます。ハイドロゲル培地の入ったサンプルコンテナをビルドプラットフォーム上のホルダーに入れます。
- 3Dプリントソフトウェアを開きます。事前にプログラムされたgコードをソフトウェアにロードします。代表的な結果については、ステップ3.1を使用して細菌懸濁液を3Dプリンターにロードします。
注:線形垂直形状を印刷するためのgコードの例を 表1に示します。 - 3Dプリントソフトウェアを使用して、 x-y-z 平面を動かして、プリントヘッドをx-y平面の中央に配置して最初のコンテナにし、 次にz軸をホームにします。原点復帰 のz軸はプリントヘッドを上昇させます。手動でスクリューをゆっくりと回転させて、ニードルの先端に少量の細菌懸濁液が見えるまでシリンジプランジャーを押し下げます。.
- 滅菌済みの使い捨てワイプで余分な細菌懸濁液を軽く拭き取ります。サンプルホルダー、ニードル、シリンジの高さに基づいて、3Dプリンティングソフトウェアを使用して、選択したサンプル容器内のハイドロゲル培地にプリントヘッドを一定距離下げます。[印刷]をクリックして印刷プロセスを開始します。
- 印刷が完了したら、サンプル容器を閉じます。70%エタノールでプリンタを拭き取ります。注射器と針は適切に廃棄してください。
9. コレラ菌の増殖とイメージング
- 広い視野のイメージングでは、ズームレンズを取り付けたカメラを使用して、ライトボックスで細胞の成長を画像化します。室温でプリントした直後にサンプルをイメージングし、インキュベーターに移します。実験中のイメージングセッションの合間に、固定インキュベーターでサンプルを37°Cに維持します。
- 所望の時間にわたって画像を撮影し、粒状ハイドロゲルマトリックス中の長時間の成長挙動を観察します。
結果
粒状ハイドロゲルマトリックスを備えた3Dバイオプリンターを使用すると、バイオプリンターの機能を拡張して、細菌のコロニーを、平らな基板に印刷すると、細菌懸濁液の粘度が低いためにスランプする形状に印刷できます。ここで紹介するアプローチの分解能は、押し出し速度、ニードルのサイズ、プリントヘッドの速度、ニードル内の空気、およびバクテリア懸濁液の粘度によって異なります。細菌懸濁液の量が少ないため、細菌懸濁液をシリンジと針に装填する際に気泡が不注意に導入される可能性があります。これにより、最終的な印刷構造に気泡が堆積する可能性があります(図4)。気泡がプリントに導入される別の方法は、プリント前にプランジャーを押し下げて針の先端に細菌懸濁液の小さな滴を形成せず、針の先端にエアギャップが存在する場合です。また、プリント前にシリンジプランジャーを押し下げないと、同じバッチでプリントされる細胞の量が異なる可能性があります。しかし、時間が経つにつれて、 図4に示すように、気泡は周囲の媒体に溶解します。
押出ステップを較正する場合、堆積物量は、プリントヘッドのリニアアクチュエーターがシリンジプランジャーをどのように移動するかに依存し、シリンジの内径は体積に直接影響します。さらに、バクテリア懸濁液のレオロジー特性は、ニードルの収縮によってせん断しやすさに影響を与え、スムーズに印刷します。したがって、この校正手順は、シリンジ/ニードル/細菌懸濁液のセットアップごとにやり直す必要があります。原則として、シリンジのキャリブレーションは自動化できます。しかし、実際には、多くのユースケースに広く適用されるようなコードを記述することは困難です。例えば、1 mLのシリンジから約300 μLの押し出しを校正するユーザーは、目標容量30 μLで校正するユーザーよりもはるかに頻繁にシリンジを再装填する必要があります。キャリブレーションプロセスの開始時にEステップから体積へのキャリブレーションの定数が不明であるため、ユーザーは実際にリロードが必要な頻度を正確に予測できない場合があります。さらに、キャリブレーションプロセスを自動化するには、事前に計量された各1.5 mLチューブの正確な位置を指定する必要があります。すべてのバイオインクがニードルからチューブに堆積し、正確なキャリブレーションを行うには、ニードルとチューブの底面/壁の間に正確な接触を行う必要があります。接触が良好でないと、小さな液滴が濡れたまま針に付着する可能性があります。したがって、チューブ間の位置のばらつきは、校正プロセスの誤差に大きく寄与する可能性があります。これらの理由から、著者らは、各ユーザーが独自のニーズに合ったキャリブレーションプログラムを構築することを推奨しています。
今回紹介したアプローチの大きな特徴は、細菌が環境中に広がる様子を、運動性や増殖性を介してイメージングで直接可視化できることです。イメージング用のプロトコルの以前のバージョンでは、6ウェルプレートに19 mLの顆粒状ハイドロゲルマトリックスを充填していました。しかし、倒立顕微鏡で観察できる細胞の水平線の3Dプリントに成功したとしても、培地の上面にも高密度のコロニーが成長し、明視野顕微鏡による可視化が制限されます(図5)。上面のコロニーは、印刷中にシリンジ針を培地に挿入したり、培地から取り除いたりした際の汚染が原因である可能性があります。この問題を回避するために、細胞の垂直線をシンチレーションバイアルに印刷します(図6A)。しかし、円筒形のバイアルの曲率により、イメージング中に歪みが発生しました。そのため、印刷用のサンプル容器として平壁キュベットと組織培養フラスコを選択し、歪みのないイメージングを可能にしました(図6B-D)。組織培養フラスコの限界の1つは、首が小さく傾いているため、プリントできる形状が制限されることです。
まとめると、このプロトコルは、複雑な多孔質環境での細菌の運動性と成長を長期間にわたって観察することを可能にします。図6B-Gには、明視野顕微鏡を用いたバイオフィルム形成コレラ菌や、レーザー走査型蛍光共焦点顕微鏡を用いた大腸菌のプランクトン細胞の例が示されており、このアプローチの汎用性が実証されています。実際、ハイドロゲルマトリックスの潜在的な問題は、蛍光顕微鏡で画像化した場合に自家蛍光を発する可能性があることです。しかし、図6F,Gに示す画像は、ここに示した実験プラットフォームでは、そのような自家蛍光が最小限であることを示しています。このような光学顕微鏡アプローチのもう一つの限界は、~100秒ナノメートルの回折限界によって設定される空間分解能です。しかし、この長さスケールは個々の細菌細胞のサイズよりもはるかに小さいため、光学技術により、個々の細胞のスケール(図6G)からより大きな多細胞コロニーのスケールまで細菌細胞を画像化する機能が提供されます30,31,32,33。その他の例を以下に説明します。
上述したように、ここで紹介したアプローチは、小容量(1 mL)および大容量(20 mL)のマトリックスで細菌コロニーを3Dプリントおよびイメージングするために使用できます。したがって、運動性および非運動性の コレラ菌 の3Dプリントコロニーを代表例として、異なるボリュームを使用して得られた結果の違いを以下に説明します。印刷物の空間分解能(線の幅)は、ノズルの内径によって設定されます。以下に説明する例では、内径が0.6mmの針は、0.6mmの初期円筒コロニーをもたらす。以前の研究では、内径が~100-200μmのプルガラスキャピラリーを使用することで、印刷解像度をさらに低下させることができることが実証されています33。
小容量の場合、2つの異なる細孔径分布を有する2つの異なる顆粒ハイドロゲルマトリックスが使用される:1つは、コレラ菌細胞の平均直径よりも大きい平均細孔径、0.2〜0.4μm36、およびもう1つは、この直径よりも小さい平均細孔径を有する。12日間にわたるサンプルは、コロニーの経時的な面拡大の画像分析によって画像化され、測定されます(図7および図8)。細胞増殖によってのみ周囲に広がる非運動性細胞については、調査した異なるマトリックス間で面膨張率が類似しており(図7)、マトリックス孔径の違いは、予想どおり、成長による細胞拡散に影響を与えないことが示されました。対照的に、活発な運動性によって周囲に広がる運動性細胞では、ヒドロゲル粒子による閉じ込めが細胞運動性を妨げにくい、孔の大きいヒドロゲルマトリックスの方がコレラ菌の面拡大速度が高かった。細菌の拡散におけるこれらの違いは、コロニーの形態にも明らかでした(図8)。より大きな細孔を持つヒドロゲルマトリックス中のコレラ菌のコロニーは、滑らかで拡散したプルームを通して広がり(図8A)、以前に観察されたように活発な運動性を介して広がることを反映している32。実際、この解釈と一致して、これらの拡散プルームは非運動性細胞の場合には観察されません(図8C)。さらに、細孔は十分に大きいため、細胞が細孔を泳ぐときにビーズを押し出すことはありません。さらに、遊泳によって加えられる粘性応力は1Pa未満であり、周囲のハイドロゲルマトリックスを著しく変形させるには不十分です。対照的に、細孔の小さいハイドロゲルマトリックスのコロニーは、運動性細胞と非運動性細胞の両方で、粗いフラクタル状のプルームを介してのみ広がり(図8B、D)、細胞増殖のみによる広がりを反映していますが、細胞は成長し、一過性に変形して周囲のマトリックスを生成します。実際、ハイドロゲルマトリックスの降伏応力が細胞の膨圧よりもはるかに小さいことを考えると、この小さな孔径の限界では、マトリックスは細胞増殖に対して弱い抵抗性しか提供せず、以前の研究でも検証されたように、3Dプリントされた構造に強く影響しないようです37。
同様の結果は、大量のサンプルで行われた実験でも観察されます。しかし、これらのサンプルには栄養素が豊富に含まれているため、この実験はより長い時間スケールで細胞の成長を維持できる可能性があります。一例として、平均細孔径が細胞径よりも小さい粒状ハイドロゲルマトリックスを用いた結果が示されており、細胞の広がりは主に増殖によるものであった。サンプルは、顆粒状ハイドロゲルマトリックスで~30日間画像化され、最初の150時間、非運動性細胞と運動性細胞の両方で同様の面拡張が観察されました。ただし、さらに長い時間では、サンプル間で強いばらつきが観察され、一部のサンプルはより速い拡散速度を示します(図9 および 図10)。興味深いことに、実験後にハイドロゲルマトリックスをリサンプリングすると(ハイドロゲルマトリックスの体積が大きいため)、降伏応力、貯蔵弾性率、損失弾性率の減少が測定され(図11)、マトリックスが軟らかくなったことが示されました。この変化は、 コレラ菌 がヒドロゲルマトリックスの特性を変化させ、細胞の拡散を長時間促進する分子を産生していることが原因である可能性があり、今後の研究で検証する興味深いものとなるでしょう。これらの実験の結果となる粗いフラクタル状のコロニー形態の例を 図10に示します。

図1:特注3Dバイオプリンターの画像。 (A)使い捨てのルアーロックシリンジとニードルを備えた改良型シリンジポンプ押出機ヘッドを備えたバイオプリンター。バイオプリンターの幅は~46cmです。(B)詰まったハイドロゲルマトリックスで満たされたフラスコ内の細胞の3Dプリントの画像。画像の幅は87mmです。 この図の拡大版を見るには、ここをクリックしてください。
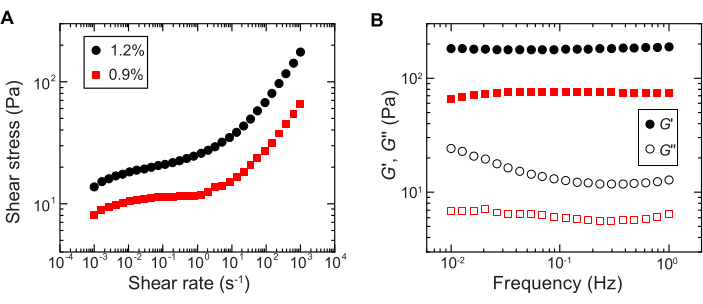
図2:粒状ハイドロゲルマトリックスのレオロジー特性の特性評価。 (A)加えられたせん断速度の関数としてのせん断応力。(B)発振周波数の関数としての貯蔵弾性と損失係数、 それぞれG' と G''。凡例は、各ヒドロゲルマトリックスの調製に使用されたヒドロゲルの質量分率を示しています。 この図の拡大版をご覧になるには、ここをクリックしてください。
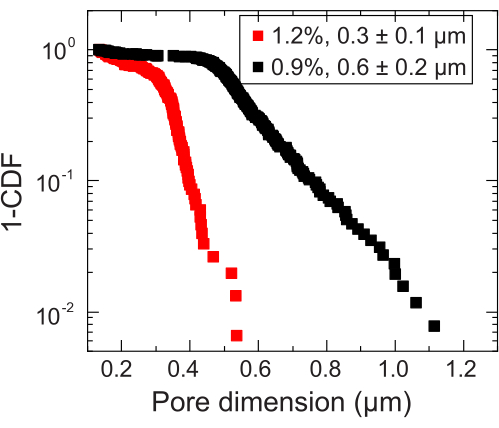
図3:2つの代表的な顆粒状ハイドロゲルマトリックスの細孔径測定。 トレーサーを追跡することにより、特徴的な細孔寸法の分布が各ハイドロゲルマトリックスについて決定されます。データは 1-CDF で表され、CDF は累積分布関数です。凡例は、各マトリックスの調製に使用したヒドロゲルの質量分率を示しています。 この図の拡大版をご覧になるには、ここをクリックしてください。
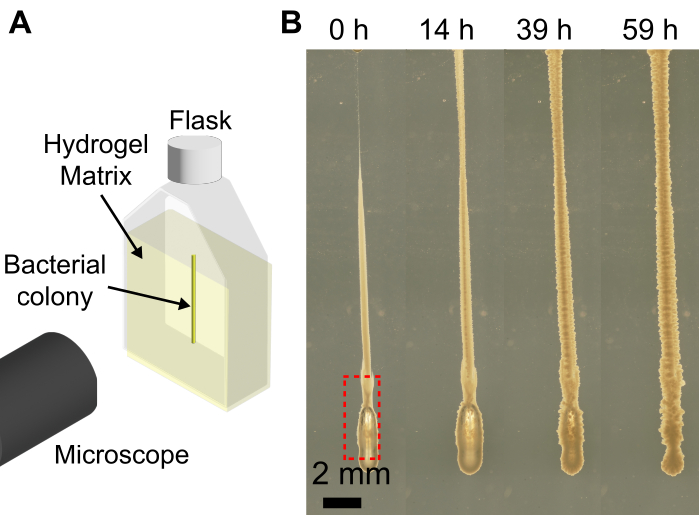
図4:バクテリアの3Dプリント中に形成される気泡の例。 (A)イメージングセットアップの概略図。(B)LBで膨潤した1.2%ハイドロゲルマトリックス中のプリント(赤枠)の下部に気泡があるコ レラ菌 の増殖のスナップショット。37°Cで59時間増殖すると、気泡は完全に溶解し、ヒドロゲルマトリックスの弾力性によりコロニーが崩壊します。スケールバー = 2 mm。 この図の拡大版をご覧になるには、ここをクリックしてください。

図5:LBで膨潤した1.2%ハイドロゲルマトリックスと、37°Cで48時間のインキュベーション後に上面に形成されたバイオフィルムを充填した6ウェルプレートにプリントした運動性コレラ菌の水平線の画像。 (A)イメージングセットアップの概略図。(B)3Dプリンティング時のコンタミネーションによる上面のバイオフィルム形成により、不透明度が低下し、水平線の鮮明なイメージングができなくなります。上面は、おそらく成長の違いによるしわを形成します。スケールバー = 5 mm。 この図の拡大版をご覧になるには、ここをクリックしてください。
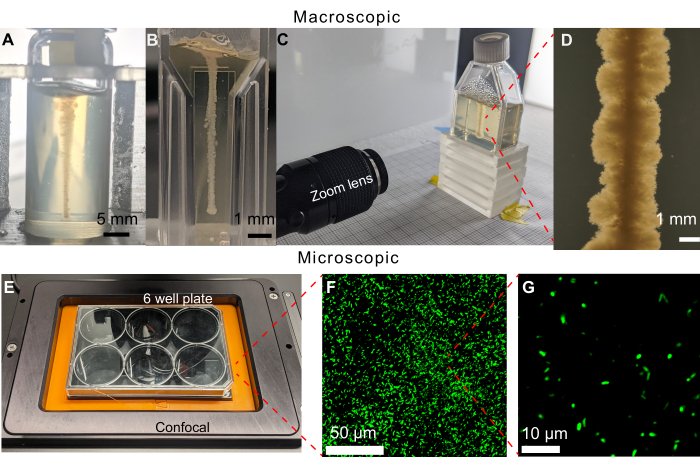
図6:このメソッドで使用できるさまざまなサンプル容器の例。(A)470時間後に1.2%顆粒状ヒドロゲルマトリックスを充填したガラスバイアルに印刷したコレラ菌。バイアルの湾曲により、成長のイメージングが困難になります。スケールバー = 5 mm。 (B) 1.2%顆粒状ハイドロゲルマトリックスを充填したマイクロキュベットにプリントした コレラ菌 。平坦な面は鮮明なイメージングを可能にしますが、容量が小さいため、細胞が増殖基質を使い果たすまでの実験時間が制限されます。(C)1.2%顆粒状ハイドロゲルマトリックスを充填した組織培養フラスコでプリントした コレラ菌 を画像化するためのズームレンズによるイメージングセットアップ。マイクロキュベットケースと同様に、平らな側面により鮮明なイメージングが可能です。組織培養フラスコには、大量の顆粒状ハイドロゲルマトリックスを充填できるため、実験期間が長くなります。(D)37°Cで100時間インキュベートした後、1.2%顆粒状ヒドロゲルマトリックス内にプリントした コレラ菌 のズームレンズからの画像。 スケールバー = 1 mm。 (E) 蛍光細胞をイメージングするための共焦点顕微鏡によるイメージングセットアップ。(F)37°Cで10日間インキュベートした後の1.2%顆粒ハイドロゲルマトリックス内の蛍光 大腸菌 の共焦点顕微鏡写真の3D投影。 スケールバー = 50 μm。 (G)ハイドロゲルマトリックス内の蛍光 大腸菌 の単一細胞分解能共焦点顕微鏡写真。スケールバー = 10 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
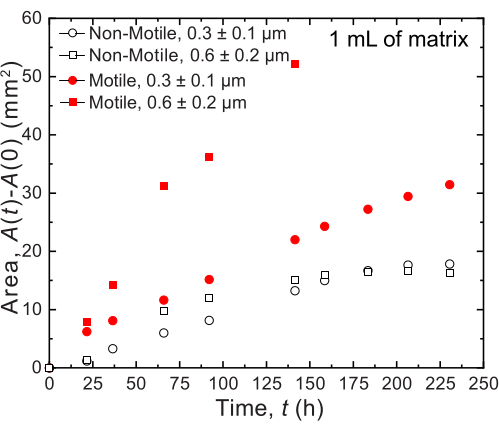
図7:1 mLの顆粒状ハイドロゲル支持体マトリックスに印刷した コレラ菌 のコロニーの時間の関数としての面積拡大。 プロット上のデータは、 図8の画像解析によるものです。運動性細胞(閉じた赤い丸と四角)は、非運動性細胞よりも速い速度で広がることが観察され、成長と運動性の両方による広がりを反映しています。さらに、孔径の大きいハイドロゲルマトリックス中の運動性細胞(赤い四角)は、0.3 μmの細孔を持つハイドロゲルマトリックス中の細胞(赤丸)よりも速い速度で広がりました。非運動性細胞は、成長しているだけなので、2つの細孔サイズ間で面膨張率に違いはありません。 この図の拡大版をご覧になるには、ここをクリックしてください。

図8:1 mLの顆粒状ヒドロゲル支持体マトリックスにプリントした コレラ菌 のコロニー。 (A)細孔径が平均細胞径よりも大きい0.9%顆粒状ハイドロゲルマトリックスにおける運動性 コレラ菌 の成長と運動性のスナップショット。矢印は、細胞がハイドロゲルマトリックス内を移動することによって形成される拡散プルームを示しています。(B)細孔径が平均細胞径より小さい1.2%顆粒ハイドロゲルマトリックスにおける運動性 コレラ菌 の成長と運動性のスナップショット。矢印は、細胞の成長によって形成される粗いフラクタル状のプルームを示しています。(C)細孔径が平均細胞径よりも大きい0.9%顆粒ハイドロゲルマトリックスにおける非運動性 コレラ菌 の時間進化のスナップショット。この場合、運動性を反映した拡散プルームは観測できない。(D)細孔径が平均細胞径より小さい1.2%顆粒状ヒドロゲル支持体マトリックスにおける非運動性 コレラ菌 の増殖のスナップショット。この場合、成長を反映した粗いフラクタル状のプルームが再び観察されます。スケールバー = 1 mm。 この図の拡大版をご覧になるには、ここをクリックしてください。
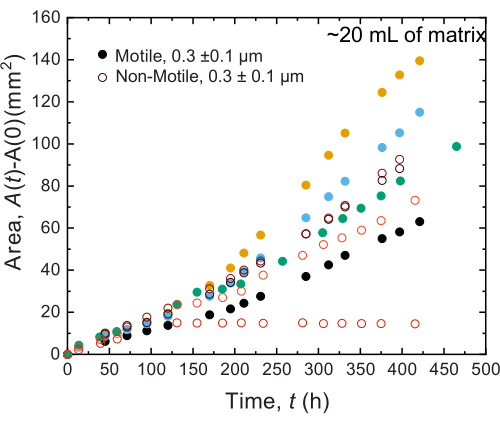
図9:20 mLの1.2%顆粒ヒドロゲル支持体マトリックスにプリントした コレラ菌 のコロニーの時間の関数としての面積拡大。 非運動性細胞(開いた円)と運動性細胞(閉じた円)は、最初の100時間で同様の速度で広がることが観察されます。100時間後には、面膨張率の違いが観察されますが、これは長時間の変動の進化によるものと考えられます。 この図の拡大版をご覧になるには、ここをクリックしてください。

図10:37°Cで増殖させた22 mLの1.2%顆粒ハイドロゲルマトリックスにプリントした コレラ菌 のコロニー。 (上)運動性 コレラ菌の生育スナップショット。(下)非運動性 コレラ菌の成長のスナップショット。どちらの場合も、成長を反映した粗いフラクタル状のプルームが観察されます。スケールバー = 2 mm。 この図の拡大版をご覧になるには、ここをクリックしてください。
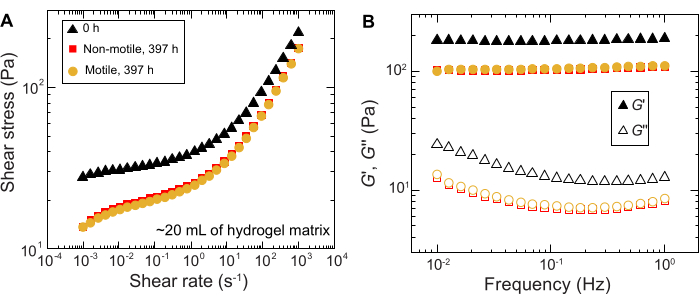
図11:実験前(0時間)および実験後(397時間)の1.2%粒状ハイドロゲルマトリックスのレオロジー特性の特性評価。 (A)加えられたせん断速度の関数としてのせん断応力。(B)蓄積弾性率と損失弾性率、 それぞれG'と G''、印加振動周波数の関数として。 この図の拡大版をご覧になるには、ここをクリックしてください。
| Gcodeコマンド | 用事 | |||
| M82の | 絶対押し出しモード | |||
| M302 S0の | 冷間押出を有効にする | |||
| M92 E14575 | 押し出しステップ/mmの設定 | |||
| G92 X35.61 Y81 Z0 E0.0 | z軸と押し出し位置をゼロに設定し、x、y-位置を35.71mmとy88mmに設定します。 | |||
| M221 S100 T0の | 流量を100%に設定します | |||
| M107の | ファンをオフにします | |||
| G1 F1 X35.61 Y81 E0.1 | 20 μL のバイオインクを、現在位置を設定した 50 μL/分の供給速度でマトリックスに押し出します | |||
| G0 F200 Z60 | ニードルをマトリックスから引き出し、200 mm/minの速度でコンティアナをサンプリングします | |||
| G0 F500 X65.81 Y81.0 | ニードルを500 mm/minの速度で次のサンプルコンティアイナーに移動します | |||
| G0 F100 Z0 | 針を次のサンプルコンティアイナーに下げ、100 mm/minの速度で印刷を開始したのと同じz位置にします。 | |||
| G1 F1 X65.81 Y81.0 E0.2 | 20 μL のバイオインクを、現在位置を設定した 50 μL/分の供給速度でマトリックスに押し出します | |||
| G0 F200 Z60 | ニードルをマトリックスから引き出し、200 mm/minの速度でコンティアナをサンプリングします | |||
| G0 F500 X96.01 Y81.0 | ニードルを500 mm/minの速度で次のサンプルコンティアイナーに移動します | |||
| G0 F100 Z0 | 100 mm/minの速度で印刷を開始したのと同じz位置にサンプルコンティオイナーに針を下ろします | |||
| G1 F1 X96.01 Y81.0 E0.3 | 20 μL のバイオインクを、現在位置を設定した 50 μL/分の供給速度でマトリックスに押し出します | |||
| G0 F200 Z60 | ニードルをマトリックスから引き出し、200 mm/minの速度でコンティアナをサンプリングします | |||
| G0 F500 X126.21 Y81.0 | ニードルを500 mm/minの速度で次のサンプルコンティアイナーに移動します | |||
| G0 F100 Z0 | 針を次のサンプルコンティアイナーに下げ、100 mm/minの速度で印刷を開始したのと同じz位置にします。 | |||
| G1 F1 X126.21 Y81.0 E0.4 | 20 μL のバイオインクを、現在位置を設定した 50 μL/分の供給速度でマトリックスに押し出します | |||
| G0 F200 Z80 | ニードルをマトリックスから引き出し、200 mm/minの速度でコンティアナをサンプリングします | |||
表1:バクテリア懸濁液の垂直線を印刷するためのGコードプログラミング。
補足ファイル1:シリンジ押出機用のボトムクランプ1mL使い捨てルアーロックシリンジのSTLファイル。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル2:シリンジ押出機用の1 mLディスポーザブルルアーロックシリンジ用トップクランプのSTLファイル。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル3:シリンジ押出機用の1 mL使い捨てルアーロックシリンジ用シリンジアダプターのSTLファイル。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル4:キュベットサンプルホルダーのSTLファイル。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル5:ティッシュフラスコサンプルホルダーのSTLファイル。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル6:6ウェルプレートおよび35 mmペトリディッシュプリントベッドのSTLファイル。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル7:パーティクル追跡用のカスタムスクリプト。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
プロトコルの重要なステップ
各ヒドロゲルマトリックスを調製する際には、マトリックスが無菌環境で作られていることを確認することが重要です。そうでない場合は、コンタミネーションが発生する可能性があり、数日後にマトリックス内のマイクロコロニー(小さなスフェロイド)などとして現れます。混合プロセス中に、すべての乾燥粒状ヒドロゲル粒子が溶解することが重要です。さらに、各ハイドロゲルマトリックスのpHをNaOHで調整すると、顆粒が膨潤し始め、ハイドロゲルマトリックスの粘度が上昇し、混合が困難になります。スタンドミキサーを使用すると、NaOHがハイドロゲルマトリックスに十分に混合されます。各細菌懸濁液の装填中に、針にエアポケットが形成される可能性があります。この問題を回避するには、針先がチューブの底部や上面付近ではなく、常に遠心チューブ内の細菌懸濁液に収まっていることを確認してください。この問題を克服する別の方法は、大量の細胞を増殖させ、印刷用の細菌懸濁液を大量に持つことです。
制限
現在、印刷中、細菌懸濁液の粘度が低いため、印刷できる形状が制限され、微量細胞によるヒドロゲルマトリックス表面の上部でのバイオフィルム形成および成長につながることがよくあります。この制限を克服するには、バクテリア懸濁液の粘度を上げたり、3Dプリンターの設定をさらに最適化したりするなど、いくつかの方法が考えられます。バクテリア懸濁液の粘度を上昇させるために、バクテリア懸濁液を別のポリマー、例えば、平らな表面へのバクテリアの3Dプリントに以前に使用されていたアルギン酸塩と混合することができる38。顆粒状ヒドロゲルマトリックスから針を回収する際にシリンジプランジャーを引っ込めることができるように、プリンタの設定をさらに最適化することができ、これにより、ヒドロゲルマトリックスから針が除去される間に細胞が沈着するのを止める可能性がある。
既存/代替法に対する方法の重要性
ここで説明する方法は、細菌コロニーを顆粒状のハイドロゲルマトリックスに印刷することを可能にします。粒状ハイドロゲルマトリックスは、細菌の運動性と増殖に対する外部環境要因(細孔径、マトリックス変形性など)の影響を研究することができます。さらに、この研究では、ヒドロゲルマトリックスを膨潤させるための液体増殖培地としてLBが使用されていますが、ヒドロゲルマトリックスは、抗生物質を含む培地を含む他の液体増殖培地で膨潤させることができます。限られた環境でバクテリアを研究する以前の方法は、実験時間の長さ、ポリマーメッシュサイズ、および周囲のハイドロゲルマトリックスの剛性37,38によって制限されていました。さまざまなポリマーから粒状ハイドロゲルマトリックスを製造するためのプロトコルはすでに存在するため、さまざまな環境条件が細菌の運動性と増殖に与える影響を研究する可能性は膨大です。この方法により、宿主の粘液や土壌など、細菌が現実世界で生息する環境をより容易に再現する制御環境で細菌を研究することができます。他の多くの方法のもう一つの制限は、周囲の行列の不透明度です。しかし、光学的に透明な材料を用いたこのアプローチは、例えば、光遺伝学的制御やバクテリアの3Dでのパターニングを探索する能力を提供します。
ここで説明する3Dプリンティング法は、運動性と成長を研究するだけでなく、基材上にバイオインクを堆積させる必要があるため、製造できる人工生体材料の高さが制限される他の多くのバイオプリンティング方法の限界を克服しています。将来的には、このバイオプリンティングプロトコルをさらに拡張して、ポリマーとバイオフィルム形成細胞を混合することにより、バイオハイブリッド材料を製造することができます。粒状ハイドロゲルマトリックスは、現在の他の多くのバクテリアバイオプリンティング法よりも、より厚く、より大規模な人工生体材料とより複雑な形状の3Dプリンティングをサポートします。この研究はコ レラ菌 と 大腸菌 のみを使用したが、 緑膿菌 などの他の種も3Dプリントに成功している37。印刷だけでなく、例えば、遺伝子の変化があったかどうかを確認するために、増殖後に細菌の制御されたサンプリングを行うようにプリンターを適応させることができます。
開示事項
本書で細菌群集の3Dプリントと画像化に使用されている実験プラットフォームは、Tapomoy BhattacharjeeとS.S.D.に代わってプリンストン大学が出願した特許出願の対象です(PCT出願番号PCT/US/2020/030213)。
謝辞
R.K.B.は、大統領ポスドク研究員プログラムからの支援を認めています。この資料は、NSF大学院研究フェローシッププログラム助成金DGE-2039656(AMHへ)の支援を受けた研究にも基づいています。A.S.D.-M.(エー・エス・ディー・エム)H.N.L.は、プリンストン大学のLidow Independent Work/Senior Thesis Fundからの支援を認めています。また、 コレラ菌の菌株を提供してくださったBonnie Basslerの研究室にも感謝します。S.S.D.は、NSF助成金CBET-1941716、DMR-2011750、EF-2124863、Eric and Wendy Schmidt Transformative Technology Fund、New Jersey Health Foundation、Pew Biomedical Scholars Program、Camille Dreyfus Teacher-Scholar Programからの支援に感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL cuvettes | VWR | 97000-586 | |
| 1 mL Luer lock syringe | BH Supplies | BH1LL | |
| 10 M NaOH | Sigma-Aldrich | 72068 | |
| 100 nm carboxylated fluorescent polystyrene nanoparticles (FluoSpheres) | Invitrogen, (ThermoFischer Scientific) | F8803 | |
| 15 mL centrifuge tubes | ThermoFischer Scientific | 14-955-237 | |
| 20 G blunt needle | McMaster Carr | 75165A252 | |
| 25 mL tissue culture flasks | VWR | 10861-566 | |
| 3D printer | Lulzbot | LulzBot Mini 2 | |
| 3D printing software | Cura | Cura-Lulzbot | |
| 50 mL centrifuge tubes | ThermoFischer Scientific | 14-955-239 | |
| Agar | Sigma-Aldrich | A1296 | |
| Carbomer Granular Hydrogel Particles | Lubrizol | Carbopol 980NF | dry granules of crosslinked acrylic acid/alkyl acrylate copolymers |
| Centrifuge (2 mL tube capacity) | VWR | 2405-37 | |
| Centrifuge (50 mL tube capacity) | ThermoFischer Scientific | 75007200 | Sorvall (brand) ST 8 (model) |
| Confocal Microscope | Nikon | A1R+ inverted laserscanning confocal microscope | |
| Glass bottom petri dish | Cellvis | D35-10-1-N | |
| Lennox LB (Lubria Broth) | Sigma-Aldrich | L3022 | |
| M8 × 1.25 mm, 150 mm long, Fully Threaded Socket Cap | McMaster Carr | 91290A478 | |
| M8 × 1.25 mm, Brass Thin Hex Nut | McMaster Carr | 93187A300 | |
| Open-source syringe pump | Custom-made | Replistruder 4 | https://www.sciencedirect.com/science/article/pii/S2468067220300791 |
| Petri dish (60 mm round) | ThermoFischer Scientific | FB0875713A | |
| Shear Rheometer | Anton Paar | MCR 501 | |
| Ultrasonic cleaner | VWR | 97043-992 |
参考文献
- Persat, A., et al. The mechanical world of bacteria. Cell. 161 (5), 988-997 (2015).
- Stoodley, P., Dodds, I., Beer, D. D., Scott, H. L., Boyle, J. D. Flowing biofilms as a transport mechanism for biomass through porous media under laminar and turbulent conditions in a laboratory reactor system. Biofouling. 21 (3-4), 161-168 (2005).
- Ludemann, H., Arth, I., Liesack, W. Spatial changes in the bacterial community structure along a vertical oxygen gradient in flooded paddy soil cores. Applied and Environmental Microbiology. 66 (2), 754-762 (2000).
- Sicard, J. F., Bihan, G. L., Vogeleer, P., Jacques, M., Harel, J. Interactions of intestinal bacteria with components of the intestinal mucus. Frontiers in Cellular and Infection Microbiology. 7, 387 (2017).
- Grice, E. A., Segre, J. A. The skin microbiome. Nature Reviews Microbiology. 9 (4), 244-253 (2011).
- Balzan, S., Quadros, C. D. A., Cleva, R. D., Zilberstein, B., Cecconello, I. Bacterial translocation: Overview of mechanisms and clinical impact. Journal of Gastroenterology and Hepatology. 22 (4), 464-471 (2007).
- Chaban, B., Hughes, H. V., Beeby, M. The flagellum in bacterial pathogens: For motility and a whole lot more. Seminars in Cell & Developmental Biology. 46, 91-103 (2015).
- Datta, S. S., Steinberg, A. P., Ismagilov, R. F. Polymers in the gut compress the colonic mucus hydrogel. Proceedings of the National Academy of Sciences. 113 (26), 7041-7046 (2016).
- Harman, M. W., et al. The heterogeneous motility of the Lyme disease spirochete in gelatin mimics dissemination through tissue. Proceedings of the National Academy of Sciences. 109 (8), 3059-3064 (2012).
- Ribet, D., Cossart, P. How bacterial pathogens colonize their hosts and invade deeper tissues. Microbes and Infection. 17 (3), 173-183 (2015).
- Siitonen, A., Nurminen, M. Bacterial motility is a colonization factor in experimental urinary tract infection. Infection and Immunity. 60 (9), 3918-3920 (1992).
- Lux, R., Miller, J. N., Park, N. H., Shi, W. Motility and chemotaxis in tissue penetration of oral epithelial cell layers by Treponema denticola. Infection and Immunity. 69 (10), 6276-6283 (2001).
- O’Neil, H. S., Marquis, H. Listeria monocytogenes flagella are used for motility, not as adhesins, to increase host cell invasion. Infection and Immunity. 74 (12), 6675-6681 (2006).
- Gill, C. O., Penney, N. Penetration of bacteria into meat. Applied and Environmental Microbiology. 33 (6), 1284-1286 (1977).
- Shirai, H., Datta, A. K., Oshita, S. Penetration of aerobic bacteria into meat: A mechanistic understanding. Journal of Food Engineering. 196, 193-207 (2017).
- Thornlow, D. N., Brackett, E. L., Gigas, J. M., Dessel, N. V., Forbes, N. S. Persistent enhancement of bacterial motility increases tumor penetration: Motility enhances bacterial tumor penetration. Biotechnology and Bioengineering. 112 (11), 2397-2405 (2015).
- Toley, B. J., Forbes, N. S. Motility is critical for effective distribution and accumulation of bacteria in tumor tissue. Integrative Biology. 4 (2), 165-176 (2011).
- Dechesne, A., Wang, G., Gülez, G., Or, D., Smets, B. F. Hydration-controlled bacterial motility and dispersal on surfaces. Proceedings of the National Academy of Sciences. 107 (32), 14369-14372 (2010).
- de Souza, R., Ambrosini, A., Passaglia, L. M. P. Plant growth-promoting bacteria as inoculants in agricultural soils. Genetics and Molecular Biology. 38 (4), 401-419 (2015).
- Turnbull, G. A., Morgan, J. A. W., Whipps, J. M., Saunders, J. R. The role of bacterial motility in the survival and spread of Pseudomonas fluorescens in soil and in the attachment and colonisation of wheat roots. FEMS Microbiology Ecology. 36 (1), 21-31 (2001).
- Watt, M., Kirkegaard, J. A., Passioura, J. B. Rhizosphere biology and crop productivity—a review. Soil Research. 44 (4), 299-317 (2006).
- Adadevoh, J. S. T., Ramsburg, C. A., Ford, R. M. Chemotaxis Increases the Retention of Bacteria in Porous Media with Residual NAPL Entrapment. Environmental Science & Technology. 52 (13), 7289-7295 (2018).
- Adadevoh, J. S. T., Triolo, S., Ramsburg, C. A., Ford, R. M. Chemotaxis Increases the Residence Time of Bacteria in Granular Media Containing Distributed Contaminant Sources. Environmental Science & Technology. 50 (1), 181-187 (2016).
- Ford, R. M., Harvey, R. W. Role of chemotaxis in the transport of bacteria through saturated porous media. Advances in Water Resources. 30 (6-7), 1608-1617 (2007).
- Wang, M., Ford, R. M., Harvey, R. W. Coupled effect of chemotaxis and growth on microbial distributions in organic-amended aquifer sediments: Observations from laboratory and field studies. Environmental Science & Technology. 42 (10), 3556-3562 (2008).
- Amchin, D. B., Ott, J. A., Bhattacharjee, T., Datta, S. S. Influence of confinement on the spreading of bacterial populations. PLoS Computational Biology. 18 (5), e1010063 (2022).
- Moore-Ott, J. A., Chiu, S., Amchin, D. B., Bhattacharjee, T., Datta, S. S. A biophysical threshold for biofilm formation. eLife. 11, e76380 (2022).
- Tittsler, R. P., Sandholzer, L. A. The use of semi-solid agar for the detection of bacterial motility. Journal of Bacteriology. 31 (6), 575-580 (1936).
- Bhattacharjee, T., et al. Polyelectrolyte scaling laws for microgel yielding near jamming. Soft Matter. 14 (9), 1559-1570 (2018).
- Bhattacharjee, T., Datta, S. S. Confinement and activity regulate bacterial motion in porous media. Soft Matter. 15 (48), 9920-9930 (2019).
- Bhattacharjee, T., Datta, S. S. Bacterial hopping and trapping in porous media. Nature Communications. 10 (1), 2075 (2019).
- Bhattacharjee, T., Amchin, D. B., Ott, J. A., Kratz, F., Datta, S. S. Chemotactic migration of bacteria in porous media. Biophysical Journal. 120 (16), 3483-3497 (2021).
- Bhattacharjee, T., Amchin, D. B., Alert, R., Ott, J. A., Datta, S. S. Chemotactic smoothing of collective migration. eLife. 11, e71226 (2022).
- Tashman, J. W., Shiwarski, D. J., Feinberg, A. W. A high performance open-source syringe extruder optimized for extrusion and retraction during FRESH 3D bioprinting. HardwareX. 9, e00170 (2021).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. Journal of Colloid and Interface Science. 179 (1), 298-310 (1996).
- Chatterjee, T., Chatterjee, B. K., Chakrabarti, P. Modelling of growth kinetics of Vibrio cholerae in presence of gold nanoparticles: Effect of size and morphology. Scientific Reports. 7 (1), 9671 (2017).
- Martínez-Calvo, A., et al. Morphological instability and roughening of growing 3D bacterial colonies. Proceedings of the National Academy of Sciences. 119 (43), e2208019119 (2022).
- Lehner, B. A. E., Schmieden, D. T., Meyer, A. S. A Straightforward approach for 3D bacterial printing. ACS Synthetic Biology. 6 (7), 1124-1130 (2017).
- Zhang, Q., et al. Morphogenesis and cell ordering in confined bacterial biofilms. Proceedings of the National Academy of Sciences. 118 (31), e2107107118 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved