A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إنتاج ثقافة التعليق وتنقية الفيروسات المرتبطة بالغدين بواسطة الطرد المركزي المتدرج لكثافة اليوديكسانول للتطبيقات في الجسم الحي
In This Article
Summary
يتم إنتاج الفيروس المرتبط بالغدي في زراعة الخلايا المعلقة ويتم تنقيته عن طريق الطرد المركزي المتدرج لكثافة اليوديكسانول المزدوج. يتم تضمين خطوات لزيادة إجمالي محصول الفيروس ، وتقليل خطر هطول الأمطار ، وزيادة تركيز المنتج النهائي للفيروس. يصل التتر النهائي المتوقع إلى 1012 جسيما فيروسيا / مل وهو مناسب للاستخدام قبل السريري في الجسم الحي .
Abstract
يصف هذا البروتوكول إنتاج الفيروس الغدي المؤتلف وتنقيته بواسطة الطرد المركزي المتدرج لكثافة اليوديكسانول ، وهي طريقة محايدة مصلية لتنقية AAV تم وصفها لأول مرة في عام 1999. تستخدم ناقلات rAAV على نطاق واسع في تطبيقات العلاج الجيني لتوصيل جينات التحوير إلى أنواع مختلفة من الخلايا البشرية. في هذا العمل ، يتم إنتاج الفيروس المؤتلف عن طريق نقل خلايا Expi293 في مزرعة معلقة مع البلازميدات التي تشفر الجينات المحورة ، والقفيصة المتجهة ، والجينات المساعدة للفيروسات الغدية. يعمل الطرد المركزي المتدرج لكثافة اليوديكسانول على تنقية جزيئات AAV الكاملة بناء على كثافة الجسيمات. بالإضافة إلى ذلك ، يتم تضمين ثلاث خطوات في هذه المنهجية المنتشرة في كل مكان الآن من أجل زيادة إجمالي إنتاج الفيروس ، وتقليل خطر هطول الأمطار بسبب البروتينات الملوثة ، وزيادة تركيز المنتج النهائي للفيروس ، على التوالي: ترسيب الجسيمات الفيروسية من وسائط الخلية باستخدام محلول البولي إيثيلين جلايكول (PEG) وكلوريد الصوديوم ، إدخال جولة ثانية من الطرد المركزي المتدرج لكثافة اليوديكسانول ، وتبادل المخزن المؤقت عبر مرشح الطرد المركزي. باستخدام هذه الطريقة ، من الممكن تحقيق التتر باستمرار في حدود 1012 جسيما فيروسيا / مل من النقاء الاستثنائي للاستخدام في الجسم الحي .
Introduction
النواقل الفيروسية المرتبطة بالغدي المؤتلف (rAAV) هي أدوات تستخدم على نطاق واسع لعلاج الأمراض الوراثية ، بما في ذلك ضمور العضلات الشوكي وضمور الشبكية والهيموفيليا A1،2،3. تم تصميم ناقلات rAAV لتفتقر إلى الجينات الفيروسية الموجودة في AAV4 من النوع البري ، وهو فيروس صغير غير مغلف مع جينوم DNA خطي أحادي الشريط 4.7 كيلو بايت. تم اكتشاف AAV لأول مرة في ستينيات القرن العشرين كملوث لمستحضرات الفيروس الغدي5. وعلى الرغم من صغر حجم قفيصة النسخة، الذي يحد من حجم جين التحوير الذي يمكن تعبئته بحد أقصى قدره 4,9 كيلوبايت باستثناء لوائح الاتصالات الدولية6، فإن AAV مفيد لتوصيل الجينات المحورة لأنه غير ممرض في البشر، ويسمح بالتعبير عن الجينات المحورة في العديد من أنواع الخلايا المنقسمة وغير المنقسمة، وله تأثيرات مناعية محدودة7.
كأعضاء في جنس الفيروس المعتمد ، يعتمد إنتاج rAAVs على التعبير عن الجينات المساعدة الموجودة في الفيروس الغدي أو فيروس الهربس البسيط8. تم تطوير العديد من الاستراتيجيات لإنتاج rAAV ، ولكن الإنتاج في خلايا HEK293 التي تم تحويلها باستخدام الجينات المساعدة E1A / E1B الفيروسية الغدية هي الطريقة الأكثر رسوخا المستخدمة اليوم9. يبدأ النهج العام لإنتاج rAAV بنقل خلايا HEK293 بثلاثة بلازميدات تحتوي على جين التحوير داخل التكرارات الطرفية المقلوبة (ITRs) ، وجينات AAV rep و cap ، وجينات مساعدة إضافية للفيروسات الغدية ، على التوالي. بعد اثنتين وسبعين ساعة من النقل ، يتم حصاد الخلايا ومعالجتها لتنقية rAAV التي تحتوي على جين التحوير.
في تطوير ناقلات rAAV جديدة للأغراض العلاجية ، يتمثل الهدف الرئيسي في إنتاج نواقل ذات كفاءة نقل متزايدة. إن الزيادة في كفاءة نقل الخلايا المستهدفة تعني انخفاضا في الجرعة السريرية اللازمة من rAAV ، مما يقلل من احتمال حدوث تأثيرات مناعية ضارة تتراوح من التحييد بوساطة الأجسام المضادة إلى السمية الحادة10,11. لتحسين فعالية نقل ناقلات rAAV ، يمكن إجراء تعديلات على الجينوم المعبأ أو على القفيصة. تشمل الطرق القابلة للتطبيق لضبط فعالية النقل عبر تصميم الجينوم المعبأ دمج محفزات قوية ومحددة الأنسجة ، والاختيار المدروس لعناصر معالجة mRNA ، وتحسين تسلسل الترميز لتحسين كفاءة الترجمة12. يتم إجراء تعديلات على القفيصة بهدف زيادة الانتحاء لأنواع الخلايا البشرية المستهدفة. تتميز الجهود المبذولة لتطوير قفيصات ناقلة جديدة لتوصيل الجينات المحورة rAAV بشكل عام بالتركيز إما على التصميم العقلاني لقفيصات AAV مع طفرات محددة تستهدف مستقبلات خلايا معينة أو التطور الموجه لتحديد القفيصات ذات الانتحاء لأنواع معينة من الخلايا من مكتبات قفيصة اندماجية عالية التعقيد دون استهداف مستقبل واحد محدد (على الرغم من أن بعض المجموعات تجمع بين هذه الأساليب)13 ، 14,15. في نهج التطور الموجه ، يتم إنشاء مكتبات القفيصة التوافقية باستخدام عمود فقري مصلي معين مع مناطق متغيرة متحولة على السطح الخارجيللقفيصة 16. غالبا ما يتم إنشاء مكتبات القفيصة التوافقية من الأنماط المصلية AAV التي لا تنشأ في البشر ، مما يقلل من خطر المناعة الموجودة مسبقا أثناء الاستخدام السريري10. لذلك ، تعتبر طرق التنقية التي يمكن تطبيقها على أي نمط مصلي مثالية للتخلص من الحاجة إلى تحسين النمط المصلي الخاص بالأنماط المصلية الأقل استخداما والتي تعمل كأعمدة أساسية لهذه المكتبات.
يستخدم الطرد المركزي المتدرج لكثافة يوديكسانول لتنقية التتر العالي من rAAV مع عدوى عالية17. في هذا البروتوكول ، يتم إنتاج rAAV في زراعة الخلايا المعلقة لتقليل كمية العمالة اللازمة لإنتاج عيارات كبيرة من AAV. يتم أيضا تضمين خطوة الطرد المركزي لمسح تحلل الخلايا لتقليل وجود البروتينات الملوثة وتقليل خطر ترسيب الفيروس. هذا البروتوكول هو طريقة فعالة من حيث التكلفة لإنتاج مستحضرات rAAV عالية النقاء مناسبة للاستخدام قبل السريري.
Protocol
يتم توفير تكوين الحلول والمخازن المؤقتة المستخدمة في هذا البروتوكول في الجدول 1.
| حل | تكوين | |
| العازلة تحلل AAV | 1.2 مل من محلول كلوريد الصوديوم 5 M | |
| 2 مل من محلول Tris-HCl pH 8.5 1 M | ||
| 80 ميكرولتر من محلول 1 M MgCl2 | ||
| mQ الماء إلى 40 مل | ||
| حل هطول الأمطار AAV | 40 جرام بيج 8000 | |
| 50 مل من محلول كلوريد الصوديوم 5 M | ||
| mQ الماء إلى 100 مل | ||
| 15٪ جزء يوديكسانول | 7.5 مل أوبتيبريب | |
| 3 مل من 10X DPBS | ||
| 6 مل من محلول كلوريد الصوديوم 5 M | ||
| 30 ميكرولتر من محلول 1 M MgCl2 | ||
| mQ إلى 30 مل | ||
| 25٪ جزء يوديكسانول | 12. 5 مل أوبتيبريب | |
| 3 مل من 10X DPBS | ||
| 30 ميكرولتر من محلول 1 M MgCl2 | ||
| 60 ميكرولتر محلول الفينول الأحمر | ||
| mQ إلى 30 مل | ||
| 40٪ جزء يوديكسانول | 33.3 مل أوبتيبريب | |
| 5 مل من 10X DPBS | ||
| 50 ميكرولتر من محلول 1 M MgCl2 | ||
| mQ إلى 50 مل | ||
| 60٪ جزء يوديكسانول | 50 مل أوبتيبريب | |
| 100 ميكرولتر محلول الفينول الأحمر | ||
| حل العازلة AAV | 8 مل من 5 M كلوريد الصوديوم | |
| 20 ميكرولتر من 10٪ بلورونيك F-68 | ||
| برنامج تلفزيوني إلى 200 مل | ||
الجدول 1: تركيبات الحلول للحلول المستخدمة في هذا البروتوكول.
1. النقل الثلاثي لخلايا Expi293
- خلايا البذور Expi293 (انظر جدول المواد) بكثافة أولية تبلغ 5 × 105 خلايا قابلة للحياة (vc) / مل.
- اسمح للخلايا بالحضانة عند 37 درجة مئوية مع 8٪ CO2 وسرعة شاكر تبلغ 125 دورة في الدقيقة حتى تصل إلى كثافة 3-5 × 106 vc / mL. راقب كثافة الخلايا وصلاحيتها باستخدام استبعاد تريبان الأزرق مع عداد خلية آلي (انظر جدول المواد).
- عندما تصل الخلايا إلى كثافة الخلية المطلوبة ، قم بتقسيمها من 1 إلى 10 عن طريق إضافة وسائط جديدة بحيث يكون حجمها الإجمالي عشرة أضعاف حجمها الأصلي. إذا لزم الأمر ، انقل الخلايا إلى دورق أكبر. العودة إلى الحضانة.
- استمر في توسيع الخلايا كما هو موضح في الخطوات 1.2-1.3 حتى تصل إلى كثافة لا تقل عن 2 × 106 vc / mL في 250 مل من الوسائط في دورق 1 L.
- في اليوم السابق للتحويل ، قم بتخفيف الخلايا إلى 2 × 106 vc / mL في 250 مل من الوسائط ، مع التخلص من الخلايا الزائدة حسب الضرورة. احتضان الخلايا بين عشية وضحاها.
- في يوم النقل ، يقوم الطرد المركزي بنصف الخلايا عند 58 × جم لمدة 5 دقائق عند 18 درجة مئوية. أعد تعليق حبيبات الخلية بنفس الحجم (125 مل) من الوسط الطازج. يجب أن تكون صلاحية الخلية قريبة من 98٪.
- تحضير اثنين من الأنابيب المخروطية 50 مل. قم بتسمية أحدهما "PEI" والآخر "DNA".
- في الأنبوب المخروطي المسمى PEI ، قم بتخفيف 1.2 مل من PEI (Polyethylenimine ، انظر جدول المواد) إلى حجم إجمالي قدره 12.5 مل في وسائط OptiMEM.
- في الأنبوب المخروطي المسمى DNA ، قم بإعداد محلول متساوي المولي من الحمض النووي البلازميد إلى ما مجموعه 500 ميكروغرام من الحمض النووي في حجم إجمالي قدره 12.5 مل في وسائط OptiMEM.
- أضف محلول الحمض النووي إلى محلول جزيرة الأمير إدوارد ، واقلبه عدة مرات حتى يمتزج تماما ، واتركه في درجة حرارة الغرفة لمدة 10 دقائق.
ملاحظة: من الأهمية بمكان أن يسمح لمحلول DNA-PEI بالاحتضان لمدة 10 دقائق كاملة حتى يتمكن PEI من تكوين معقدات مشحونة مع الحمض النووي. - بعد تحضين محلول DNA-PEI لمدة 10 دقائق ، استخدم ماصة مصلية لتطبيق محلول DNA-PEImax ببطء على خلايا Expi293. أعد الخلايا المنقولة إلى الحاضنة واتركها تحضن لمدة 72 ساعة (الشكل 1).
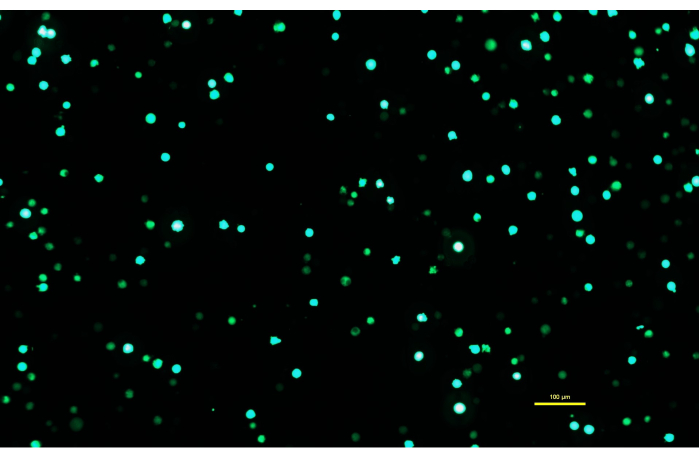
الشكل 1: خلايا Expi293 تعبر عن GFP بعد يومين من النقل. بعد النقل مع بلازميد يحتوي على جين ل GFP ، تعبر خلايا Expi293 بشكل عابر عن eGFP. مورفولوجيا الخلية مستديرة. تم التقاط الصورة بوقت تعريض 15 مللي ثانية. يتم الحصول على صور المجهر باستخدام مجهر مقلوب مجهز بإضاءة مضان epi-fluorescence وهدف 10x / 0.30. شريط المقياس = 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
2. تنقية ناقلات rAAV
- بعد 72 ساعة ، انقل الخلايا المعلقة إلى أنبوبين مخروطيين سعة 250 مل وقم بتدويرها لأسفل عند 415 × جم لمدة 10 دقائق عند 4 درجات مئوية.
- صب الوسائط الطافية في أنبوب مخروطي جديد سعة 500 مل واحفظه على حرارة 0 درجة مئوية على الثلج لمعالجته لاحقا.
- أعد تعليق كل حبيبة خلية في 10 مل من المخزن المؤقت لتحلل AAV (الجدول 1). اجمع المحللين معا في أحد الأنابيب. اشطف الأنبوب الآخر ب 5 مل إضافية من محلول تحلل AAV ، ثم أضفه إلى المحلول المجمع. تجمد عند -70 درجة مئوية.
ملاحظة: يمكن إيقاف التجربة مؤقتا عند هذه النقطة. قم بتخزين الوسائط الطافية في -70 درجة مئوية بدلا من وضعها على الجليد. - أضف حجم 1: 4 من محلول هطول الأمطار AAV إلى الوسائط الطافية من الخطوة 2.2. اقلب عدة مرات للخلط جيدا واحتضانه عند 0 درجة مئوية على الثلج لمدة 2 ساعة على الأقل أو طوال الليل.
- طرد مركزي المحلول المحتضن عند 3000 × جم لمدة 1 ساعة عند 4 درجات مئوية.
- تخلص من المادة الطافية وأعد تعليق الحبيبات التي تحتوي على راسب فيروسي في 5 مل من محلول تحلل AAV.
- قم بإذابة الخلية المحللة عند 37 درجة مئوية في حمام مائي.
- تجمع الراسب الفيروسي مع الخلية المحللة. هذا هو المحللة الخام. شطف أنبوب الطرد المركزي الذي يحتوي على الراسب الفيروسي مع 5 مل إضافية من المخزن المؤقت تحلل AAV وتجمع مع المحللة الخام.
- تجمد المحللة الخام إلى -70 درجة مئوية ، ثم تذوب عند 37 درجة مئوية. كرر هذه الدورة مرة أخرى.
ملاحظة: لا ينبغي ترك المحللة الخام عند 37 درجة مئوية لفترة أطول مما هو ضروري لإذابتها. - بمجرد إذابته للمرة الثالثة ، أضف على الفور 4 ميكرولتر من البنزوناز إلى المحللة الخام ، واقلبها للخلط ، واحتضانها لمدة 30 دقيقة عند 37 درجة مئوية.
- الطرد المركزي المحللة الخام لمدة 10 دقائق عند 650 × غرام عند 18 درجة مئوية.
- انقل المادة الطافية إلى أنبوب مخروطي نظيف سعة 50 مل. هذا هو الفيروس الخام. تخلص من الحبيبات.
- طرد مركزي للفيروس الخام لمدة 30 دقيقة إضافية عند 3000 × جم عند 18 درجة مئوية لإزالة البروتينات الملوثة.
- انقل المادة الطافية إلى أنبوب مخروطي نظيف سعة 50 مل. هذا هو الفيروس الواضح.
ملاحظة: يمكن إيقاف التجربة مؤقتا عند هذه النقطة. قم بتجميد الفيروس الموضح إلى -70 درجة مئوية. - قم بإعداد المضخة التمعجية متعددة القنوات بأربعة أنابيب تمعجية (انظر جدول المواد). نعلق الشعيرات الدموية على طرفي كل أنبوب.
- ضع الشعيرات الدموية على جانب إدخال المضخة في كأس زجاجية مملوءة بالماء منزوع الأيونات. ضع الشعيرات الدموية على جانب خرج المضخة في كأس زجاجية فارغة. قم بتشغيل المضخة التمعجية عند 25.0 دورة في الدقيقة لشطف الأنبوب بالماء منزوع الأيونات (DI).
- عند شطفه جيدا ، أفرغ الأنبوب التمعجي عن طريق تشغيل المضخة حتى يتم ملء الأنبوب بالهواء فقط. ضع جميع الشعيرات الدموية على مناديل نظيفة خالية من الوبر.
- ضع أربعة أنابيب طرد مركزي فائقة في رف على جانب الإخراج من المضخة.
- استخدم ماصة مصلية سعة 10 مل لتوزيع 10 مل من الفيروس الموضح بعناية في كل أنبوب طرد مركزي فائق. احرص على عدم إدخال فقاعات الهواء.
ملاحظة: يمكن تمديد حجم الفيروس الموضح في كل أنبوب إلى ما يصل إلى 12 مل لكل أنبوب ، إذا لزم الأمر. قلل كمية 60٪ يوديكسانول بشكل مناسب في الخطوة 2.25 أدناه. - يتم تغطية الفيروس الموضح بكسور اليوديكسانول (الجدول 1) من أدنى كثافة إلى أعلى كثافة باستخدام المضخة التمعجية. يضاف الكسر 15٪ أولا ، يليه الكسر 25٪ ، والكسر 40٪ ، وأخيرا الكسر 60٪. انقل 22 مل (5.5 مل لكل أنبوب طرد مركزي فائق) من جزء اليوديكسانول 15٪ إلى أنبوب مخروطي نظيف سعة 50 مل. ضع الشعيرات الدموية على جانب إدخال المضخة في الأنبوب ، مع الحرص على أن جميع الشعيرات الدموية تلامس قاع الأنبوب.
- ابدأ تشغيل المضخة واترك الأنبوب يمتلئ بجزء اليوديكسانول. عندما يصل جزء اليوديكسانول إلى نهايات الشعيرات الدموية على جانب خرج المضخة ، أوقف المضخة.
- أدخل شعرية إخراج واحدة في كل أنابيب طرد مركزي فائقة مع فيروس موضح ، مع الحرص على أن الشعيرات الدموية تلامس الجزء السفلي من كل أنبوب طرد مركزي فائق.
ملاحظة: من الأهمية بمكان عدم وجود هواء في الشعيرات الدموية. قد يتدفق يوديكسانول عبر الأنبوب التمعجي بمعدلات مختلفة قليلا ، لذا تأكد من أن كل شعرية ناتجة فردية مملوءة تماما باليوديكسانول قبل إدخالها في الفيروس الواضح. قد يكون من الضروري إيقاف المضخة وبدء تشغيلها عدة مرات. - ابدأ تشغيل المضخة واترك أنابيب الطرد المركزي الفائقة تمتلئ. عندما يكون آخر جزء من 15٪ على وشك أن يؤخذ إلى الشعيرات الدموية المدخلة ، أوقف المضخة. من الأهمية بمكان عدم دخول فقاعات الهواء إلى الأنبوب التمعجي.
ملاحظة: إذا دخلت فقاعات الهواء إلى الشعيرات الدموية المدخلة ، فيمكن تشغيل المضخة لفترة وجيزة في الاتجاه العكسي لدفعها للخارج. - نقل 22 مل (5.5 مل لكل أنبوب طرد مركزي فائق) من جزء اليوديكسانول 25٪ إلى الأنبوب المخروطي 50 مل. احرص على أن تلامس جميع الشعيرات الدموية قاع الأنبوب وابدأ المضخة. عندما يكون آخر جزء من 25٪ على وشك أن يؤخذ إلى الشعيرات الدموية المدخلة ، أوقف المضخة.
- كرر الخطوة 2.24 مع 20 مل (5 مل لكل أنبوب طرد مركزي فائق) من جزء اليوديكسانول 40٪ ثم مع 24 مل (6 مل لكل أنبوب طرد مركزي فائق) من جزء 60٪.
- إذا كان لا يزال هناك حجم غير مملوء في أنبوب الطرد المركزي الفائق ، فاستمر في إضافة المزيد من جزء 60٪ حتى تمتلئ أنابيب الطرد المركزي الفائق بالكامل بالسائل.
- املأ كل أنبوب حتى تصنع المحللة قبة فوق الجزء العلوي ولكنها لا تفيض من الأنبوب. أوقف المضخة وقم بإزالة كل شعيرات دموية بعناية ، مع الحرص على عدم إزعاج تدرج اليوديكسانول.
- قم بتغطية كل أنبوب طرد مركزي فائق بفاصل وقم بتحميله في دوار من النوع 70 Ti (انظر جدول المواد).
ملاحظة: تأكد من أن الدوار متوازن بشكل مناسب. لا تحاول تشغيل أجهزة الطرد المركزي الفائقة دون تدريب مناسب. - قم بتحميل الدوار من النوع 70 Ti في جهاز الطرد المركزي الفائق وأجهزة الطرد المركزي عند 489000 × جم لمدة 1 ساعة عند 18 درجة مئوية.
- بعد الطرد المركزي ، قم بتفريغ الدوار من جهاز الطرد المركزي الفائق. استخدم كماشة الأنف الإبرة لإزالة كل أنبوب طرد مركزي فائق بعناية من الدوار ، مع الحرص على عدم إزعاج تدرج اليوديكسانول.
- استخدم حامل حلقة دعم مع مشبك لتأمين أنبوب طرد مركزي واحد.
- نعلق إبرة 20 GA على حقنة 5 مل وتوضع جانبا. استخدم منديلا خاليا من النسالة لإزالة الغطاء من أنبوب الطرد المركزي الفائق.
- اخترق جدار أنبوب الطرد المركزي الفائق بالإبرة حوالي 3 مم أسفل واجهة اليوديكسانول 40٪ -60٪ (الشكل 2).
- استنشاق ببطء واجهة وجزء من جزء 40٪. تجنب استنشاق الجزء العلوي من جزء 40٪ ، للحصول على سحب إجمالي يبلغ حوالي 4 مل.
- ضع إصبعا واحدا على الجزء العلوي المفتوح من أنبوب الطرد المركزي الفائق ، واسحب المحقنة وانقل جزء AAV المستنشق إلى أنبوب مخروطي سعة 50 مل. تخلص من المحقنة في وعاء الأدوات الحادة. تخلص من أنبوب الطرد المركزي الفائق.
- كرر الخطوات 2.31-2.35 لكل أنبوب طرد مركزي فائق.
- قم بتخفيف جزء AAV المستنشق مرتين تقريبا في المخزن المؤقت لتحلل AAV إلى حجم 40 مل.
- اغسل الأنبوب التمعجي كما هو موضح في الخطوات 2.16-2.17.
ملاحظة: يمكن إيقاف التجربة مؤقتا عند هذه النقطة. قم بتخزين جزء AAV المخفف عند 0 درجة مئوية طوال الليل. - قم بتحميل 20 مل لكل جزء من جزء AAV المخفف في أنبوبين جديدين للطرد المركزي الفائق.
- بالنسبة للجولة الثانية من الطرد المركزي المتدرج لكثافة اليوديكسانول ، يتم تغطية جزء AAV المخفف كما هو موضح أعلاه باستخدام 10 مل فقط (5 مل لكل أنبوب طرد مركزي فائق) من جزء 40٪ و 14 مل (7 مل لكل أنبوب طرد مركزي فائق) من جزء 60٪. كرر الخطوات 2.29-2.36 للطرد المركزي الفائق والطموح.
ملاحظة: قبل تخزين المضخة التمعجية والأنابيب ، اغسل الأنبوب بماء DI كما هو موضح في الخطوات 2.16-2.17.

الشكل 2: تدرج يوديكسانول مع واجهة يوديكسانول 40٪ -60٪ مصنفة. أ: تدرج اليوديكسانول الأول. يستخدم الفينول الأحمر في 40٪ يوديكسانول و 60٪ يوديكسانول. يظهر كلون مختلف بسبب الاختلاف في الرقم الهيدروجيني بين الكسرين. يشير السهم إلى المكان الذي يجب إدخال المحقنة فيه لحصاد جزء rAAV ، أسفل واجهة اليوديكسانول 40٪ -60٪ مباشرة. ب: تدرج اليوديكسانول الثاني. يتم استخدام كسور اليوديكسانول 40٪ و 60٪ فقط في هذه الخطوة. يشير السهم إلى المكان الذي يجب إدخال المحقنة فيه لحصاد جزء rAAV. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. تبادل العازلة وتركيز الفيروس
- بعد الحصول على جزء AAV من الجولة الثانية من الطرد المركزي المتدرج لكثافة اليوديكسانول ، قم بتخفيفه مرتين باستخدام محلول عازلة AAV.
- قم بموازنة مرشح الطرد المركزي بإضافة 20 مل من محلول المخزن المؤقت AAV إلى الجزء العلوي من الفلتر. قم بطرد الجهاز عند 3000 × جم عند 18 درجة مئوية لمدة 5 دقائق وتجاهل التدفق من خلاله.
- أضف جزء AAV المخفف إلى مرشح الطرد المركزي. قم بطرد الجهاز عند 3000 × جم عند 18 درجة مئوية لمدة 5 دقائق وتجاهل التدفق من خلاله.
- أضف 20 مل من محلول المخزن المؤقت AAV إلى الجزء العلوي من الفلتر. قم بطرد الجهاز عند 3000 × جم عند 18 درجة مئوية لمدة 5 دقائق وتجاهل التدفق من خلاله.
ملاحظة: إذا أصبح غشاء مرشح الطرد المركزي مسدودا ، مما تسبب في تدفق المحلول بشكل غير فعال ، فاستخدم بعناية ماصة P200 الدقيقة لسحب المحلول لأعلى ولأسفل في الجزء العلوي من الفلتر. احرص بشدة على عدم لمس الفلتر بطرف الماصة الدقيقة. - كرر الخطوة 3.4 مرتين أخريين.
ملاحظة: تأكد من عدم فرط تركيز AAV عن طريق الحفاظ على حجم 1 مل على الأقل في الجزء العلوي من الفلتر. قد يكون من الضروري ضبط أوقات الطرد المركزي لمنع التركيز الزائد. إذا كان AAV مفرط التركيز ، يمكن أن يحدث هطول الأمطار. - للحصول على عيار نهائي في نطاق 1012 vg / mL ، قم بتدوير الفيروس إلى حجم نهائي يبلغ حوالي 1 مل.
ملاحظة: اعتمادا على العمود الفقري للنمط المصلي المستخدم وكفاءة تغليف الفيروس ، قد تضطر إلى تركيز الفيروس في حجم أصغر. - استخدم ماصة دقيقة p1000 لنقل AAV المركز من أعلى مرشح الطرد المركزي إلى أنبوب طرد مركزي دقيق. استخدم ماصة صغيرة p200 لغسل مرشح الطرد المركزي ب 50 ميكرولتر من المخزن المؤقت AAV لجمع أي فيروس متبقي والتجمع مع بقية AAV المركزة.
- ضع جانبا حصة 2 ميكرولتر من AAV المركز للمعايرة. انظر الجدول التكميلي 1 للاطلاع على المواد الأولية للوائح الاتصالات الدولية التي يمكن استخدامها ل qPCR.
- مرر AAV المركز من خلال مرشح حقنة 0.2 ميكرومتر لتعقيمه.
ملاحظة: عند تعقيم حجم صغير ، احرص على اختيار مرشح حقنة بقطر صغير لتقليل فقد الفيروس. سيؤدي استخدام مرشح ربط منخفض البروتين بقطر صغير إلى الحد الأدنى من فقدان الفيروس (البيانات غير معروضة). - يمكن استخدام AAV المعقم على الفور لتحويل الخلايا أو تخزينها في 4 درجات مئوية لاستخدامها في غضون أربعة أسابيع. يجب تخزينه في -70 درجة مئوية للتخزين على المدى الطويل.
النتائج
يمكن استخدام هذه الطريقة للحصول على عيار لا يقل عن 1012 جسيما فيروسيا لكل مل. يمكن الحصول على عيار (الشكل 3) بواسطة qPCR باستخدام بادئات ITR الواردة في الجدول التكميلي 1 ، بواسطة ddPCR ، أو بأي طريقة معايرة أخرى. يمكن أن ينتج التتر دون المستوى الأمثل عن استخدام جين غط...
Discussion
بروتوكول تنقية تدرج كثافة اليوديكسانول المزدوج هو الطريقة العالمية لأنه ينطبق على أي متغيرات متحولة AAV ، بغض النظر عن خصوصية مستقبلاتها. اعتمدت الطرق المبكرة لتنقية AAV على كثافة الجسيمات وشملت الطرد المركزي isopycnic في CsCl والطرد المركزي المتدرج المستمر لكثافة السكروز19. في وقت ل?...
Disclosures
ليس لدى المؤلفين أي إفصاحات للإبلاغ عنها.
Acknowledgements
اي.
Materials
| Name | Company | Catalog Number | Comments |
| 5810 R benchtop centrifuge | Eppendorf | 22625501 | |
| 8-channel peristaltic pump | Watson-Marlow | 020.3708.00A | |
| Automated cell counter | NanoEntek | EVE-MC | |
| Avanti J-E high-speed centrifuge | Beckman Coulter | 369001 | |
| Benzonase | Thermo Scientific | 88701 | |
| Biological safety cabinet | Labconco | 322491101 | |
| CO2 incubator with shaker | Set at 8% CO2 and 37 °C | ||
| Conical centrifuge tubes | Thermo Scientific | 339652 | 50 mL |
| Conical centrifuge tubes | Thermo Scientific | 339650 | 15 mL |
| Disposable micro-pipets | Fisherbrand | 21-164-2G | Capillaries |
| Dulbecco's phosphate buffered saline without CaCl2 and MgCl2 (DPBS) (10x) | Sigma-Aldrich | D1408 | |
| ECLIPSE Ts2R-FL inverted microscope | Nikon | ||
| Expi293 Expression Medium | Gibco | A1435101 | |
| Expi293F cells | Gibco | A14527 | |
| Filter tips | USA Scientific | 1126-7810 | 1000 µL |
| Filter tips | USA Scientific | 1120-8810 | 200 µL |
| Filter tips | USA Scientific | 1120-1810 | 20 µL |
| Filter tips | USA Scientific | 1121-3810 | 10 µL |
| Hypodermic needles | Tyco Healthcare | 820112 | 20 GA x 1-1/2 A |
| Ice bucket with lid | VWR | 10146-184 | |
| JS-5.3 rotor | Beckman Coulter | 368690 | |
| Magnesium chloride solution (1 M) | Millipore Sigma | M1028-100ML | |
| Metal stand and clamp | Fisherbrand | 05-769-6Q | |
| Microcentrifuge tubes | Eppendorf | 22600028 | 1.5 mL |
| Needle nose pliers | |||
| Optima XE-90 ultracentrifuge | Beckman Coulter | A94471 | |
| Opti-MEM I Reduced-Serum Medium | Gibco | 31985062 | |
| OptiPrep density gradient media (iodixanol) | Serumwerk | AXS-1114542 | 60% iodixanol solution |
| P1000 Pipet | Gilson | F144059M | |
| P2 Pipet | Gilson | F144054M | |
| P20 Pipet | Gilson | F144056M | |
| P200 Pipet | Gilson | F144058M | |
| Phenol red solution | Sigma-Aldrich | P0290 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich | P4474 | |
| Pipet-Aid XP pipette controller | Drummond Scientific | 4-000-101 | |
| Plasmid pCapsid | De novo or Addgene, etc. | N/A | We used pACGrh74. |
| Plasmid pHelper | Addgene | 112867 | |
| Plasmid pTransgene | De novo or Addgene, etc. | N/A | We used pdsAAV-GFP. |
| Pluronic F-68 polyol solution (10%) | Mp Biomedicals | 92750049 | |
| Polyethylene glycol 8000 | Research Products International | P48080-500.0 | |
| Polyethylenimine HCl Max (PEI-Max) | Polysciences | NC1038561 | Dilute in water to 40 μM |
| Polypropylene centrifuge tubes, sterile | Corning | 431123 | 500 mL |
| Polypropylene centrifuge tubes, sterile | Corning | 430776 | 250 mL |
| Polypropylene Optiseal tubes | Beckman Coulter | 361625 | |
| Serological pipettes | Alkali Scientific | SP250-B | 50 mL |
| Serological pipettes | Alkali Scientific | SP225-B | 25 mL |
| Serological pipettes | Alkali Scientific | SP210-B | 10 mL |
| Serological pipettes | Alkali Scientific | SP205-B | 5 mL |
| Shaker flasks | Fisherbrand | PBV1000 | 1 L |
| Shaker flasks | Fisherbrand | PBV50-0 | 500 mL |
| Shaker flasks | Fisherbrand | PBV250 | 250 mL |
| Shaker flasks | Fisherbrand | PBV12-5 | 125 mL |
| Sodium chloride solution (5 M) | Fisher Scientific | NC1752640 | |
| Sterile syringes | Fisherbrand | 14-955-458 | 5 mL |
| Syringe filter | Millipore | SLGV013SL | 0.22 micron |
| Tris-HCl pH 8.5 (1 M) | Kd Medical | RGE3363 | |
| Trypan blue solution | Gibco | 15250061 | |
| Tube rack assembly | Beckman Coulter | 361646 | |
| Tube spacers (x4) | Beckman Coulter | 361669 | |
| Tubing for peristaltic pump | Fisher Scientific | 14190516 | |
| Type 70 Ti fixed-angle titanium rotor | Beckman Coulter | 337922 | |
| Ultra low temperature freezer | Set at -70 °C | ||
| Vivaspin 20 centrifugal concentrator | Sartorius | VS2041 | |
| Water bath | Set at 37 °C |
References
- Strauss, K. A., et al. Onasemnogene abeparvovec for presymptomatic infants with three copies of SMN2 at risk for spinal muscular atrophy: the Phase III SPR1NT trial. Nat Med. 28 (7), 1390-1397 (2022).
- Fuller-Carter, P. I., Basiri, H., Harvey, A. R., Carvalho, L. S. Focused update on AAV-based gene therapy clinical trials for inherited retinal degeneration. BioDrugs. 34 (6), 763-781 (2020).
- George, L. A., et al. Multiyear factor VIII expression after AAV gene transfer for hemophilia A. N Engl J Med. 385 (21), 1961-1973 (2021).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-Associated Virus (AAV) as a vector for gene therapy. Biodrugs. 31 (4), 317-334 (2017).
- Atchison, R. W., Casto, B. C., Hammon, W. M. c. D. Adenovirus-associated defective virus particles. Science. 149 (3685), 754-756 (1965).
- Wu, Z., Yang, H., Colosi, P. Effect of genome size on AAV vector packaging. Mol Ther. 18 (1), 80-86 (2010).
- Samulski, R. J., Muzyczka, N. AAV-mediated gene therapy for research and therapeutic purposes. Annu Rev Virol. 1 (1), 427-451 (2014).
- Zolotukhin, S. Production of recombinant adeno-associated virus vectors. Hum Gene Ther. 16 (5), 551-557 (2005).
- Penaud-Budloo, M., François, A., Clément, N., Ayuso, E. Pharmacology of recombinant adeno-associated virus production. Mol Ther - Methods Clin Dev. 8, 166-180 (2018).
- Costa-Verdera, H., et al. Understanding and Tackling immune responses to adeno-associated viral vectors. Hum Gene Ther. 34 (17-18), 836-852 (2023).
- Ertl, H. C. J. Mitigating serious adverse events in gene therapy with AAV Vectors: Vector dose and immunosuppression. Drugs. 83 (4), 287-298 (2023).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Marsic, D., et al. Vector design tour de force: Integrating combinatorial and rational approaches to derive novel adeno-associated virus variants. Mol Ther. 22 (11), 1900-1909 (2014).
- Grimm, D., Zolotukhin, S. E Pluribus Unum: 50 Years of research, millions of viruses, and one goal-tailored acceleration of AAV evolution. Mol Ther. 23 (12), 1819-1831 (2015).
- Biswas, M., et al. Engineering and in vitro selection of a novel AAV3B variant with high hepatocyte tropism and reduced seroreactivity. Mol Ther - Methods Clin Dev. 19, 347-361 (2020).
- Perabo, L., et al. In vitro selection of viral vectors with modified tropism: the adeno-associated virus display. Mol Ther. 8 (1), 151-157 (2003).
- Crosson, S. M., Dib, P., Smith, J. K., Zolotukhin, S. Helper-free production of laboratory grade AAV and purification by iodixanol density gradient centrifugation. Mol Ther - Methods Clin Dev. 10, 1-7 (2018).
- Chan, C., Harris, K. K., Zolotukhin, S., Keeler, G. D. Rational design of AAV-rh74, AAV3B, and AAV8 with limited liver targeting. Viruses. 15 (11), 2168 (2023).
- Schmidt, O. W., Cooney, M. K., Foy, H. M. Adeno-associated virus in adenovirus type 3 conjunctivitis. Infect Immun. 11 (6), 1362-1370 (1975).
- Grimm, D., Kern, A., Rittner, K., Kleinschmidt, J. A. Novel tools for production and purification of recombinant adenoassociated virus vectors. Hum Gene Ther. 9 (18), 2745-2760 (1998).
- Zolotukhin, S., et al. Recombinant adeno-associated virus purification using novel methods improves infectious titer and yield. Gene Ther. 6 (6), 973-985 (1999).
- Clark, K. R., Liu, X., Mcgrath, J. P., Johnson, P. R. Highly purified recombinant adeno-associated virus vectors are biologically active and free of detectable helper and wild-type viruses. Hum Gene Ther. 10 (6), 1031-1039 (1999).
- Debelak, D., et al. Cation-exchange high-performance liquid chromatography of recombinant adeno-associated virus type 2. J Chromatogr B Biomed Sci App. 740 (2), 195-202 (2000).
- Burova, E., Ioffe, E. Chromatographic purification of recombinant adenoviral and adeno-associated viral vectors: methods and implications. Gene Ther. 12 (1), S5-S17 (2005).
- Adams, B., Bak, H., Tustian, A. D. Moving from the bench towards a large scale, industrial platform process for adeno-associated viral vector purification. Biotechnol Bioeng. 117 (10), 3199-3211 (2020).
- Grieger, J. C., Choi, V. W., Samulski, R. J. Production and characterization of adeno-associated viral vectors. Nat Protoc. 1 (3), 1412-1428 (2006).
- Florea, M., et al. High-efficiency purification of divergent AAV serotypes using AAVX affinity chromatography. Mol Ther Methods Clin Dev. 28, 146-159 (2022).
- Chamberlain, K., Riyad, J. M., Weber, T. Expressing transgenes that exceed the packaging capacity of adeno-associated virus capsids. Hum Gene Ther Methods. 27 (1), 1-12 (2016).
- Green, E. A., Hamaker, N. K., Lee, K. H. Comparison of vector elements and process conditions in transient and stable suspension HEK293 platforms using SARS-CoV-2 receptor binding domain as a model protein. BMC Biotechnol. 23 (1), 7 (2023).
- Erbacher, P., Zou, S., Bettinger, T., Steffan, A. M., Remy, J. S. Chitosan-based vector/DNA complexes for gene delivery: Biophysical characteristics and transfection ability. Pharm Res. 15 (9), 1332-1339 (1998).
- Vandenberghe, L. H., et al. Efficient serotype-dependent release of functional vector into the culture medium during adeno-associated virus manufacturing. Hum Gene Ther. 21 (10), 1251-1257 (2010).
- Summerford, C., Samulski, R. J. Membrane-associated heparan sulfate proteoglycan is a receptor for adeno-associated virus type 2 virions. J Virol. 72 (2), 1438-1445 (1998).
- Wright, J. F., et al. Identification of factors that contribute to recombinant AAV2 particle aggregation and methods to prevent its occurrence during vector purification and formulation. Mol Ther. 12 (1), 171-178 (2005).
- Gruntman, A. M., et al. Stability and compatibility of recombinant adeno-associated virus under conditions commonly encountered in human gene therapy trials. Hum Gene Ther Methods. 26 (2), 71-76 (2015).
- Srivastava, A. Rationale and strategies for the development of safe and effective optimized AAV vectors for human gene therapy. Mol Ther Nucleic Acids. 32, 949-959 (2023).
- Mullard, A. FDA approves first gene therapy for Duchenne muscular dystrophy, despite internal objections. Nat Rev Drug Discov. 22 (8), 610-610 (2023).
- Center for Biologics Evaluation and Research. Approved Cellular and Gene Therapy Products. US Food Drug Adm. , (2023).
- Kang, L., et al. AAV vectors applied to the treatment of CNS disorders: Clinical status and challenges. J Control Release Off J Control Release Soc. 355, 458-473 (2023).
- De Wolf, D., Singh, K., Chuah, M. K., VandenDriessche, T. Hemophilia gene therapy: The end of the beginning. Hum Gene Ther. 34 (17-18), 782-792 (2023).
- Simons, E. J., Trapani, I. The opportunities and challenges of gene therapy for treatment of inherited forms of vision and hearing loss. Hum Gene Ther. 34 (17-18), 808-820 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved