Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Producción de cultivos en suspensión y purificación de virus adenoasociados mediante centrifugación en gradiente de densidad de yodixanol para aplicaciones in vivo
En este artículo
Resumen
El virus adenoasociado se produce en cultivo celular en suspensión y se purifica mediante centrifugación de doble gradiente de densidad de yodixanol. Se incluyen medidas para aumentar el rendimiento total del virus, disminuir el riesgo de precipitación del virus y concentrar aún más el producto final del virus. Los títulos finales esperados alcanzan las 1012 partículas virales/ml y son adecuados para el uso preclínico in vivo .
Resumen
Este protocolo describe la producción y purificación de virus adenoasociados recombinantes (rAAV) mediante centrifugación en gradiente de densidad de yodixanol, un método independiente del serotipo para purificar AAV descrito por primera vez en 1999. Los vectores rAAV se utilizan ampliamente en aplicaciones de terapia génica para administrar transgenes a varios tipos de células humanas. En este trabajo, el virus recombinante se produce por transfección de células Expi293 en cultivo en suspensión con plásmidos que codifican los genes transgénicos, de la cápside del vector y de los genes auxiliares adenovirales. La centrifugación en gradiente de densidad de yodixanol purifica las partículas AAV completas en función de la densidad de partículas. Además, se incluyen tres pasos en esta metodología ahora omnipresente para aumentar el rendimiento total del virus, disminuir el riesgo de precipitación debido a proteínas contaminantes y concentrar aún más el producto final del virus, respectivamente: precipitación de partículas virales de medios celulares utilizando una solución de polietilenglicol (PEG) y cloruro de sodio, la introducción de una segunda ronda de centrifugación en gradiente de densidad de yodixanol, y el intercambio de tampón a través de un filtro centrífugo. Con este método, es posible lograr títulos consistentes en el rango de 10a 12 partículas virales/ml de pureza excepcional para uso in vivo .
Introducción
Los vectores virales adenoasociados recombinantes (rAAV) son herramientas ampliamente utilizadas para el tratamiento de enfermedades genéticas, como la atrofia muscular espinal, la distrofia retiniana y la hemofilia A 1,2,3. Los vectores rAAV están diseñados para carecer de genes virales presentes en el AAV4 de tipo salvaje, un virus icosaédrico pequeño y sin envoltura con un genoma lineal de ADN monocatenario de 4,7 kb. El AAV se descubrió por primera vez en la década de 1960 como un contaminante de las preparaciones de adenovirus5. A pesar de su pequeño tamaño de cápside, que limita el tamaño del transgén que se puede empaquetar a un máximo de 4,9 kb excluyendo los RTI6, el AAV es útil para la administración de transgenes porque no es patógeno en humanos, permite la expresión del transgén en muchos tipos de células que se dividen y no se dividen, y tiene efectos inmunogénicos limitados7.
Como miembros del género dependoparvovirus, la producción de rAAVs se basa en la expresión de genes auxiliares presentes en el adenovirus o virus del herpes simple8. Se han desarrollado varias estrategias para producir rAAV, pero la producción en células HEK293 transformadas con los genes auxiliares adenovirales E1A/E1B es el método más establecido y utilizado en la actualidad9. El enfoque general de la producción de rAAV comienza con la transfección de células HEK293 con tres plásmidos que contienen el transgén dentro de repeticiones terminales invertidas (ITR), genes AAV rep y cap , y genes auxiliares adenovirales adicionales, respectivamente. Setenta y dos horas después de la transfección, las células se cosechan y procesan para purificar el rAAV que contiene el transgén.
En el desarrollo de nuevos vectores rAAV con fines terapéuticos, uno de los principales objetivos es producir vectores con una mayor eficiencia de transducción. Un aumento en la eficiencia de transducción de las células diana significaría una disminución de la dosis clínica necesaria de rAAV, disminuyendo así la probabilidad de efectos inmunogénicos adversos que van desde la neutralización mediada por anticuerpos hasta toxicidades agudas10,11. Para mejorar la eficacia de la transducción de los vectores rAAV, se pueden realizar alteraciones en el genoma empaquetado o en la cápside. Los métodos viables para ajustar la eficacia de la transducción a través del diseño del genoma empaquetado incluyen la incorporación de promotores fuertes y específicos de tejido, la selección cuidadosa de los elementos de procesamiento del ARNm y la optimización de la secuencia de codificación para mejorar la eficiencia de la traducción12. Las alteraciones de la cápside se realizan con el objetivo de aumentar el tropismo para los tipos de células humanas diana. Los esfuerzos para desarrollar nuevas cápsidas de vectores de administración de transgenes rAAV generalmente se caracterizan por un enfoque en el diseño racional de cápsidas de AAV con mutaciones específicas dirigidas a receptores celulares específicos o la evolución dirigida para identificar cápsidas con tropismo para tipos celulares específicos a partir de bibliotecas de cápside combinatorias de alta complejidad sin dirigirse a un receptor específico (aunque algunos grupos combinan estos enfoques)13, 14,15. En el enfoque de evolución dirigida, las bibliotecas combinatorias de la cápside se construyen utilizando una columna vertebral de serotipo particular con regiones variables mutadas en el exterior de la cápside16. Las bibliotecas combinatorias de cápside a menudo se construyen a partir de serotipos de AAV que no se originan en humanos, lo que disminuye el riesgo de inmunidad preexistente durante el uso clínico10. Por lo tanto, los métodos de purificación que se pueden aplicar a cualquier serotipo son ideales para eliminar la necesidad de una optimización específica del serotipo para los serotipos menos utilizados que sirven como columna vertebral para estas bibliotecas.
La centrifugación en gradiente de densidad de yodixanol se utiliza para purificar altos títulos de rAAV con alta infectividad17. En este protocolo, el rAAV se produce en cultivo celular en suspensión para disminuir la cantidad de mano de obra necesaria para producir grandes títulos de AAV. También se incluye un paso de centrifugación para limpiar el lisado celular para reducir la presencia de proteínas contaminantes y disminuir el riesgo de precipitación de virus. Este protocolo es un método rentable para producir preparaciones de rAAV de alta pureza adecuadas para uso preclínico.
Protocolo
La composición de las soluciones y tampones utilizados en este protocolo se proporciona en la Tabla 1.
| Solución | Composición | |
| Tampón de lisis AAV | 1,2 ml de solución de NaCl 5 M | |
| 2 ml de solución de Tris-HCl 1 M pH 8,5 | ||
| 80 uL de solución de 1 M de MgCl2 | ||
| mQ de agua a 40 mL | ||
| Solución de precipitación AAV | 40 g PEG 8000 | |
| 50 ml de solución de NaCl 5 M | ||
| mQ de agua hasta 100 mL | ||
| Fracción de yodixanol al 15% | OptiPrep de 7,5 ml | |
| 3 ml de DPBS 10X | ||
| 6 ml de solución de NaCl 5 M | ||
| 30 uL de solución de 1 M de MgCl2 | ||
| mQ a 30 mL | ||
| Fracción de yodixanol al 25% | 12. 5 ml de OptiPrep | |
| 3 ml de DPBS 10X | ||
| 30 uL de solución de 1 M de MgCl2 | ||
| 60 uL de solución de rojo de fenol | ||
| mQ a 30 mL | ||
| Fracción de yodixanol al 40% | 33.3 mL OptiPrep | |
| 5 ml de DPBS 10X | ||
| 50 uL de solución de 1 M de MgCl2 | ||
| mQ a 50 mL | ||
| Fracción de yodixanol al 60% | 50 ml de OptiPrep | |
| 100 uL de solución de rojo de fenol | ||
| Solución tampón AAV | 8 mL de NaCl 5 M | |
| 20 uL de F-68 plurónico al 10% | ||
| PBS hasta 200 mL | ||
Tabla 1: Composiciones de soluciones para las soluciones utilizadas en este protocolo.
1. Triple transfección de células Expi293
- Siembra de células Expi293 (ver Tabla de Materiales) a una densidad inicial de 5 x 105 células viables (vc)/mL.
- Dejar incubar las células a 37 °C con 8% de CO2 y una velocidad de agitación de 125 rpm hasta que alcancen una densidad de 3-5 x 106 vc/mL. Monitoree la densidad celular y la viabilidad utilizando la exclusión de azul de tripano con un contador de células automatizado (consulte la tabla de materiales).
- Cuando las células alcancen la densidad celular deseada, divídalas de 1 a 10 añadiendo medios nuevos para que su volumen total sea diez veces mayor que su volumen original. Si es necesario, transfiera las células a un matraz más grande. Regrese a la incubación.
- Continúe expandiendo las células como se describe en los pasos 1.2-1.3 hasta que alcancen una densidad de al menos 2 x 106 vc/mL en 250 mL de medio en un matraz de 1 L.
- El día antes de la transfección, diluir las células a 2 x 106 vc/mL en 250 mL de medio, desechando el exceso de células según sea necesario. Incuba las células durante la noche.
- El día de la transfección, centrifugar la mitad de las células a 58 x g durante 5 min a 18 °C. Vuelva a suspender el gránulo celular en el mismo volumen (125 ml) de medio fresco. La viabilidad celular debe ser cercana al 98%.
- Prepare dos tubos cónicos de 50 ml. Etiqueta uno como "PEI" y el otro como "ADN".
- En el tubo cónico marcado como PEI, diluya 1,2 mL de PEI (Polietilenimina, ver Tabla de Materiales) hasta un volumen total de 12,5 mL en medios OptiMEM.
- En el tubo cónico marcado con ADN, prepare una solución equimolar de ADN plasmídico hasta un total de 500 μg de ADN en un volumen total de 12,5 ml en medios OptiMEM.
- Agregue la solución de ADN a la solución de PEI, invierta varias veces para combinar bien y deje incubar a temperatura ambiente durante 10 minutos.
NOTA: Es fundamental que se permita que la solución de ADN-PEI se incube durante los 10 minutos completos para que el PEI forme complejos cargados con el ADN. - Después de que la solución de ADN-PEI se haya incubado durante 10 minutos, use una pipeta serológica para aplicar lentamente la solución de ADN-PEImax a las células Expi293. Regrese las células transfectadas a la incubadora y déjelas incubar durante 72 h (Figura 1).
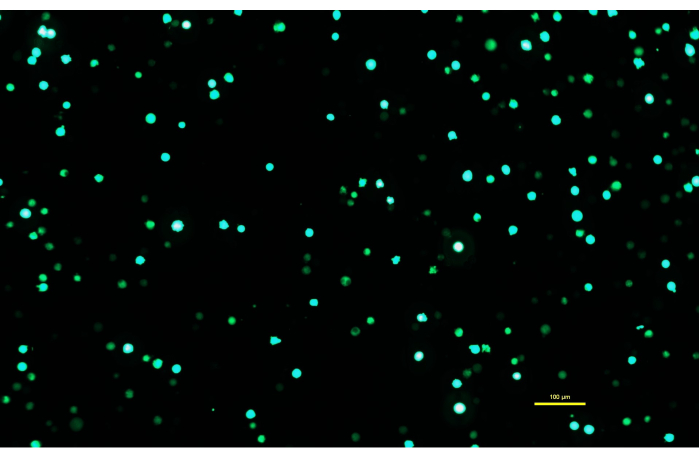
Figura 1: Células Expi293 que expresan GFP dos días después de la transfección. Después de la transfección con un plásmido que contiene un gen para GFP, las células Expi293 expresan eGFP transitoriamente. La morfología celular es redonda. La imagen fue capturada con un tiempo de exposición de 15 ms. Las imágenes microscópicas se adquieren utilizando un microscopio invertido equipado con iluminación de epifluorescencia y un objetivo de 10x/0,30. Barra de escala = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
2. Purificación del vector rAAV
- Después de 72 h, transfiera las células en suspensión a dos tubos cónicos de 250 ml y gírelos a 415 x g durante 10 min a 4 °C.
- Vierta el medio sobrenadante en un tubo cónico fresco de 500 ml y guárdelo a 0 °C en hielo para su posterior procesamiento.
- Vuelva a suspender cada gránulo celular en 10 ml de tampón de lisis AAV (Tabla 1). Agrupa los dos lisados juntos en uno de los tubos. Enjuague el otro tubo con 5 ml adicionales de tampón de lisis AAV, luego agréguelo a los lisados agrupados. Congelar a -70 °C.
NOTA: El experimento se puede pausar en este punto. Almacene el medio sobrenadante a -70 °C en lugar de sobre hielo. - Agregue un volumen 1:4 de solución de precipitación AAV al medio sobrenadante del paso 2.2. Invierta varias veces para mezclar bien e incubar a 0 °C en hielo durante al menos 2 h o toda la noche.
- Centrifugar la solución incubada a 3000 x g durante 1 h a 4 °C.
- Deseche el sobrenadante y vuelva a suspender el gránulo que contiene el precipitado viral en 5 ml de tampón de lisis AAV.
- Descongelar el lisado celular a 37 °C en un baño de agua.
- Agrupar el precipitado viral con el lisado celular. Este es el lisado crudo. Enjuague el tubo de centrifugación que contenía el precipitado viral con 5 ml adicionales de tampón de lisis AAV y mezcle con el lisado crudo.
- Congelar el lisado crudo a -70 °C y luego descongelar a 37 °C. Repite este ciclo una vez más.
NOTA: El lisado crudo no debe dejarse a 37 °C durante más tiempo del necesario para descongelarlo. - Una vez descongelado por tercera vez, añadir inmediatamente 4 μL de benzonasa al lisado crudo, invertir para mezclar e incubar durante 30 min a 37 °C.
- Centrifugar el lisado crudo durante 10 min a 650 x g a 18 °C.
- Transfiera el sobrenadante a un tubo cónico limpio de 50 ml. Este es el virus crudo. Deseche el gránulo.
- Centrifugar el virus crudo durante 30 minutos adicionales a 3000 x g a 18 °C para eliminar las proteínas contaminantes.
- Transfiera el sobrenadante a un tubo cónico limpio de 50 ml. Este es el virus aclarado.
NOTA: El experimento se puede pausar en este punto. Congele el virus clarificado a -70 °C. - Configure la bomba peristáltica multicanal con cuatro tubos peristálticos (consulte la tabla de materiales). Conecte los capilares a ambos extremos de cada tubo.
- Coloque los capilares en el lado de entrada de la bomba en un vaso de precipitados lleno de agua desionizada. Coloque los capilares en el lado de salida de la bomba en un vaso de precipitados vacío. Haga funcionar la bomba peristáltica a 25.0 rpm para enjuagar la tubería con agua desionizada (DI).
- Cuando esté completamente enjuagado, vacíe el tubo peristáltico haciendo funcionar la bomba hasta que el tubo se llene solo con aire. Coloque todos los capilares sobre una toallita limpia y sin pelusa.
- Coloque cuatro tubos de ultracentrífuga en una rejilla en el lado de salida de la bomba.
- Utilice una pipeta serológica de 10 ml para dispensar cuidadosamente 10 ml de virus clarificado en cada tubo de ultracentrífuga. Tenga cuidado de no introducir burbujas de aire.
NOTA: El volumen de virus clarificado en cada tubo se puede estirar hasta 12 ml por tubo, si es necesario. Reduzca la cantidad de yodixanol al 60% de manera adecuada en el paso 2.25 a continuación. - El virus clarificado se recubre con fracciones de yodixanol (Tabla 1) de menor a mayor densidad utilizando la bomba peristáltica. Primero se agrega la fracción del 15%, seguida de la fracción del 25%, la fracción del 40% y finalmente la fracción del 60%. Transfiera 22 ml (5,5 ml por tubo de ultracentrífuga) de la fracción de yodixanol al 15 % a un tubo cónico limpio de 50 ml. Coloque los capilares en el lado de entrada de la bomba en el tubo, teniendo cuidado de que todos los capilares toquen la parte inferior del tubo.
- Encienda la bomba y deje que el tubo se llene con la fracción de yodixanol. Cuando la fracción de yodixanol llegue a los extremos de los capilares en el lado de salida de la bomba, detenga la bomba.
- Inserte un capilar de salida en cada tubo de ultracentrífuga con virus clarificado, teniendo cuidado de que los capilares toquen el fondo de cada tubo de ultracentrífuga.
NOTA: Es de vital importancia que no quede aire en los capilares. El yodixanol puede fluir a través del tubo peristáltico a velocidades ligeramente diferentes, así que asegúrese de que cada capilar de salida individual esté completamente lleno de yodixanol antes de insertarlo en el virus clarificado. Puede ser necesario detener y arrancar la bomba varias veces. - Encienda la bomba y deje que los tubos de ultracentrífuga se llenen. Cuando la última fracción del 15% esté a punto de ser introducida en los capilares de entrada, detenga la bomba. Es fundamental que no entren burbujas de aire en el tubo peristáltico.
NOTA: Si las burbujas de aire entran en los capilares de entrada, la bomba puede funcionar brevemente en la dirección inversa para empujarlas hacia afuera. - Transfiera 22 ml (5,5 ml por tubo de ultracentrífuga) de la fracción de yodixanol al 25 % en el tubo cónico de 50 ml. Tenga cuidado de que todos los capilares toquen el fondo del tubo y encienda la bomba. Cuando la última fracción del 25% esté a punto de ser introducida en los capilares de entrada, detenga la bomba.
- Repita el paso 2.24 con 20 ml (5 ml por tubo de ultracentrífuga) de la fracción de yodixanol al 40 % y luego con 24 ml (6 ml por tubo de ultracentrífuga) de la fracción al 60 %.
- Si todavía queda volumen sin llenar en el tubo de ultracentrífuga, continúe agregando más de la fracción del 60% hasta que los tubos de ultracentrífuga estén completamente llenos de líquido.
- Llene cada tubo hasta que el lisado forme una cúpula sobre la parte superior, pero no se desborde del tubo. Detenga la bomba y retire con cuidado cada capilar de salida, teniendo cuidado de no alterar el gradiente de yodixanol.
- Tape cada tubo de ultracentrífuga con un espaciador y cárguelo en un rotor Tipo 70 Ti (consulte la Tabla de materiales).
NOTA: Asegúrese de que el rotor esté correctamente equilibrado. No intente operar la ultracentrífuga sin la capacitación adecuada. - Cargue el rotor Tipo 70 Ti en la ultracentrífuga y centrifugue a 489.000 x g durante 1 h a 18 °C.
- Después de la centrifugación, descargue el rotor de la ultracentrífuga. Utilice unos alicates de punta fina para retirar con cuidado cada tubo de ultracentrífuga del rotor, teniendo cuidado de no alterar el gradiente de yodixanol.
- Utilice un soporte de anillo de soporte con abrazadera para asegurar un tubo de ultracentrífuga.
- Coloque una aguja de 20 GA en una jeringa de 5 ml y déjela a un lado. Use una toallita sin pelusa para quitar la tapa del tubo de ultracentrífuga.
- Penetrar en la pared del tubo de ultracentrífuga con la aguja unos 3 mm por debajo de la interfase de yodixanol al 40%-60% (Figura 2).
- Aspirar lentamente la interfaz y parte de la fracción del 40%. Evite aspirar la parte superior de la fracción del 40%, para un consumo total de aproximadamente 4 ml.
- Sosteniendo un dedo sobre la parte superior abierta del tubo de ultracentrífuga, saque la jeringa y transfiera la fracción AAV aspirada a un tubo cónico de 50 ml. Deseche la jeringa en un recipiente para objetos punzocortantes. Deseche el tubo de ultracentrífuga.
- Repita los pasos 2.31-2.35 para cada tubo de ultracentrífuga.
- Diluir la fracción de AAV aspirada aproximadamente dos veces en tampón de lisis de AAV a un volumen de 40 ml.
- Enjuague el tubo peristáltico como se describe en los pasos 2.16-2.17.
NOTA: El experimento se puede pausar en este punto. Almacenar la fracción diluida de AAV a 0 °C durante la noche. - Cargue 20 ml de cada fracción diluida de AAV en dos nuevos tubos de ultracentrífuga.
- Para la segunda ronda de centrifugación en gradiente de densidad de yodixanol, la fracción diluida de AAV se superpone como se describió anteriormente utilizando solo 10 ml (5 ml por tubo de ultracentrífuga) de la fracción del 40% y 14 ml (7 ml por tubo de ultracentrífuga) de la fracción del 60%. Repita los pasos 2.29-2.36 para la ultracentrifugación y la aspiración.
NOTA: Antes de almacenar la bomba peristáltica y el tubo, enjuague el tubo con agua desionizada como se describe en los pasos 2.16-2.17.

Figura 2: Gradiente de yodixanol con una interfaz de iodixanol del 40%-60% marcada. (A) Primer gradiente de yodixanol. El rojo de fenol se utiliza en las fracciones de 40% de yodixanol y 60% de yodixanol. Aparece como un color diferente debido a la diferencia de pH entre las dos fracciones. La flecha indica dónde se debe insertar la jeringa para recolectar la fracción rAAV, justo debajo de la interfaz de 40%-60% de yodixanol. (B) Segundo gradiente de yodixanol. Solo se utilizan las fracciones de yodixanol al 40% y al 60% en este paso. La flecha indica dónde se debe insertar la jeringa para recolectar la fracción rAAV. Haga clic aquí para ver una versión más grande de esta figura.
3. Intercambio de tampones y concentración del virus
- Después de obtener la fracción AAV de la segunda ronda de centrifugación en gradiente de densidad de yodixanol, diluirla dos veces con una solución tampón AAV.
- Equilibre el filtro centrífugo agregando 20 ml de solución tampón AAV en la parte superior del filtro. Centrifugar el aparato a 3000 x g a 18 °C durante 5 min y desechar el flujo.
- Agregue la fracción AAV diluida al filtro centrífugo. Centrifugar el aparato a 3000 x g a 18 °C durante 5 min y desechar el flujo.
- Agregue 20 ml de solución tampón AAV en la parte superior del filtro. Centrifugar el aparato a 3000 x g a 18 °C durante 5 min y desechar el flujo.
NOTA: Si la membrana del filtro centrífugo se bloquea, lo que hace que la solución fluya de manera ineficiente, use con cuidado una micropipeta P200 para extraer la solución hacia arriba y hacia abajo en la parte superior del filtro. Tenga mucho cuidado de no tocar el filtro con la punta de la micropipeta. - Repita el paso 3.4 dos veces más.
NOTA: Asegúrese de que el AAV no esté demasiado concentrado manteniendo al menos 1 ml de volumen en la parte superior del filtro. Puede ser necesario ajustar los tiempos de centrifugación para evitar la sobreconcentración. Si el AAV está sobreconcentrado, puede producirse precipitación. - Para obtener un título final en el rango de 10a 12 vg/mL, reduzca el virus hasta un volumen final de aproximadamente 1 mL.
NOTA: Dependiendo de la columna vertebral del serotipo utilizada y de la eficiencia de empaquetamiento del virus, es posible que tenga que concentrar el virus en un volumen menor. - Utilice una micropipeta p1000 para transferir el AAV concentrado desde la parte superior del filtro centrífugo a un tubo de microcentrífuga. Utilice una micropipeta p200 para lavar el filtro centrífugo con 50 μL de tampón AAV para recoger cualquier virus restante y acumularlo con el resto del AAV concentrado.
- Reserve una alícuota de 2 μL del AAV concentrado para la valoración. Consulte la Tabla complementaria 1 para ver los cebadores ITR que se pueden utilizar para la qPCR.
- Pase el AAV concentrado a través de un filtro de jeringa de 0,2 μm para esterilizarlo.
NOTA: Al esterilizar un volumen pequeño, tenga cuidado de seleccionar un filtro de jeringa con un diámetro pequeño para minimizar la pérdida de virus. El uso de un filtro de unión a proteínas de bajo contenido de un diámetro pequeño dará como resultado una pérdida viral mínima (datos no mostrados). - El AAV esterilizado puede utilizarse inmediatamente para transducir células o almacenarse a 4 °C para su uso en un plazo de cuatro semanas. Debe almacenarse a -70 °C para un almacenamiento más prolongado.
Resultados
Este método se puede utilizar para obtener títulos de al menos 10a 12 partículas virales por ml. Se puede obtener un título (Figura 3) por qPCR utilizando los cebadores ITR proporcionados en la Tabla Suplementaria 1, por ddPCR o por cualquier otro método de titulación. Los títulos subóptimos podrían ser el resultado del uso de un gen de la cápsula que codifica una cápside con una eficiencia de envasado deficiente.
Ot...
Discusión
El protocolo de purificación de doble gradiente de densidad de yodixanol es el método universal porque es aplicable a cualquier variante mutante de AAV, independientemente de su especificidad de receptor. Los primeros métodos de purificación de AAV se basaban en la densidad de partículas e incluían la centrifugación isopícnica en CsCl y la centrifugación continua en gradiente de densidad de sacarosa19. Posteriormente, se desarrollaron abordajes seroespecíficos que hicieron uso de anticue...
Divulgaciones
Los autores no tienen revelaciones que informar.
Agradecimientos
Ninguno.
Materiales
| Name | Company | Catalog Number | Comments |
| 5810 R benchtop centrifuge | Eppendorf | 22625501 | |
| 8-channel peristaltic pump | Watson-Marlow | 020.3708.00A | |
| Automated cell counter | NanoEntek | EVE-MC | |
| Avanti J-E high-speed centrifuge | Beckman Coulter | 369001 | |
| Benzonase | Thermo Scientific | 88701 | |
| Biological safety cabinet | Labconco | 322491101 | |
| CO2 incubator with shaker | Set at 8% CO2 and 37 °C | ||
| Conical centrifuge tubes | Thermo Scientific | 339652 | 50 mL |
| Conical centrifuge tubes | Thermo Scientific | 339650 | 15 mL |
| Disposable micro-pipets | Fisherbrand | 21-164-2G | Capillaries |
| Dulbecco's phosphate buffered saline without CaCl2 and MgCl2 (DPBS) (10x) | Sigma-Aldrich | D1408 | |
| ECLIPSE Ts2R-FL inverted microscope | Nikon | ||
| Expi293 Expression Medium | Gibco | A1435101 | |
| Expi293F cells | Gibco | A14527 | |
| Filter tips | USA Scientific | 1126-7810 | 1000 µL |
| Filter tips | USA Scientific | 1120-8810 | 200 µL |
| Filter tips | USA Scientific | 1120-1810 | 20 µL |
| Filter tips | USA Scientific | 1121-3810 | 10 µL |
| Hypodermic needles | Tyco Healthcare | 820112 | 20 GA x 1-1/2 A |
| Ice bucket with lid | VWR | 10146-184 | |
| JS-5.3 rotor | Beckman Coulter | 368690 | |
| Magnesium chloride solution (1 M) | Millipore Sigma | M1028-100ML | |
| Metal stand and clamp | Fisherbrand | 05-769-6Q | |
| Microcentrifuge tubes | Eppendorf | 22600028 | 1.5 mL |
| Needle nose pliers | |||
| Optima XE-90 ultracentrifuge | Beckman Coulter | A94471 | |
| Opti-MEM I Reduced-Serum Medium | Gibco | 31985062 | |
| OptiPrep density gradient media (iodixanol) | Serumwerk | AXS-1114542 | 60% iodixanol solution |
| P1000 Pipet | Gilson | F144059M | |
| P2 Pipet | Gilson | F144054M | |
| P20 Pipet | Gilson | F144056M | |
| P200 Pipet | Gilson | F144058M | |
| Phenol red solution | Sigma-Aldrich | P0290 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich | P4474 | |
| Pipet-Aid XP pipette controller | Drummond Scientific | 4-000-101 | |
| Plasmid pCapsid | De novo or Addgene, etc. | N/A | We used pACGrh74. |
| Plasmid pHelper | Addgene | 112867 | |
| Plasmid pTransgene | De novo or Addgene, etc. | N/A | We used pdsAAV-GFP. |
| Pluronic F-68 polyol solution (10%) | Mp Biomedicals | 92750049 | |
| Polyethylene glycol 8000 | Research Products International | P48080-500.0 | |
| Polyethylenimine HCl Max (PEI-Max) | Polysciences | NC1038561 | Dilute in water to 40 μM |
| Polypropylene centrifuge tubes, sterile | Corning | 431123 | 500 mL |
| Polypropylene centrifuge tubes, sterile | Corning | 430776 | 250 mL |
| Polypropylene Optiseal tubes | Beckman Coulter | 361625 | |
| Serological pipettes | Alkali Scientific | SP250-B | 50 mL |
| Serological pipettes | Alkali Scientific | SP225-B | 25 mL |
| Serological pipettes | Alkali Scientific | SP210-B | 10 mL |
| Serological pipettes | Alkali Scientific | SP205-B | 5 mL |
| Shaker flasks | Fisherbrand | PBV1000 | 1 L |
| Shaker flasks | Fisherbrand | PBV50-0 | 500 mL |
| Shaker flasks | Fisherbrand | PBV250 | 250 mL |
| Shaker flasks | Fisherbrand | PBV12-5 | 125 mL |
| Sodium chloride solution (5 M) | Fisher Scientific | NC1752640 | |
| Sterile syringes | Fisherbrand | 14-955-458 | 5 mL |
| Syringe filter | Millipore | SLGV013SL | 0.22 micron |
| Tris-HCl pH 8.5 (1 M) | Kd Medical | RGE3363 | |
| Trypan blue solution | Gibco | 15250061 | |
| Tube rack assembly | Beckman Coulter | 361646 | |
| Tube spacers (x4) | Beckman Coulter | 361669 | |
| Tubing for peristaltic pump | Fisher Scientific | 14190516 | |
| Type 70 Ti fixed-angle titanium rotor | Beckman Coulter | 337922 | |
| Ultra low temperature freezer | Set at -70 °C | ||
| Vivaspin 20 centrifugal concentrator | Sartorius | VS2041 | |
| Water bath | Set at 37 °C |
Referencias
- Strauss, K. A., et al. Onasemnogene abeparvovec for presymptomatic infants with three copies of SMN2 at risk for spinal muscular atrophy: the Phase III SPR1NT trial. Nat Med. 28 (7), 1390-1397 (2022).
- Fuller-Carter, P. I., Basiri, H., Harvey, A. R., Carvalho, L. S. Focused update on AAV-based gene therapy clinical trials for inherited retinal degeneration. BioDrugs. 34 (6), 763-781 (2020).
- George, L. A., et al. Multiyear factor VIII expression after AAV gene transfer for hemophilia A. N Engl J Med. 385 (21), 1961-1973 (2021).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-Associated Virus (AAV) as a vector for gene therapy. Biodrugs. 31 (4), 317-334 (2017).
- Atchison, R. W., Casto, B. C., Hammon, W. M. c. D. Adenovirus-associated defective virus particles. Science. 149 (3685), 754-756 (1965).
- Wu, Z., Yang, H., Colosi, P. Effect of genome size on AAV vector packaging. Mol Ther. 18 (1), 80-86 (2010).
- Samulski, R. J., Muzyczka, N. AAV-mediated gene therapy for research and therapeutic purposes. Annu Rev Virol. 1 (1), 427-451 (2014).
- Zolotukhin, S. Production of recombinant adeno-associated virus vectors. Hum Gene Ther. 16 (5), 551-557 (2005).
- Penaud-Budloo, M., François, A., Clément, N., Ayuso, E. Pharmacology of recombinant adeno-associated virus production. Mol Ther - Methods Clin Dev. 8, 166-180 (2018).
- Costa-Verdera, H., et al. Understanding and Tackling immune responses to adeno-associated viral vectors. Hum Gene Ther. 34 (17-18), 836-852 (2023).
- Ertl, H. C. J. Mitigating serious adverse events in gene therapy with AAV Vectors: Vector dose and immunosuppression. Drugs. 83 (4), 287-298 (2023).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Marsic, D., et al. Vector design tour de force: Integrating combinatorial and rational approaches to derive novel adeno-associated virus variants. Mol Ther. 22 (11), 1900-1909 (2014).
- Grimm, D., Zolotukhin, S. E Pluribus Unum: 50 Years of research, millions of viruses, and one goal-tailored acceleration of AAV evolution. Mol Ther. 23 (12), 1819-1831 (2015).
- Biswas, M., et al. Engineering and in vitro selection of a novel AAV3B variant with high hepatocyte tropism and reduced seroreactivity. Mol Ther - Methods Clin Dev. 19, 347-361 (2020).
- Perabo, L., et al. In vitro selection of viral vectors with modified tropism: the adeno-associated virus display. Mol Ther. 8 (1), 151-157 (2003).
- Crosson, S. M., Dib, P., Smith, J. K., Zolotukhin, S. Helper-free production of laboratory grade AAV and purification by iodixanol density gradient centrifugation. Mol Ther - Methods Clin Dev. 10, 1-7 (2018).
- Chan, C., Harris, K. K., Zolotukhin, S., Keeler, G. D. Rational design of AAV-rh74, AAV3B, and AAV8 with limited liver targeting. Viruses. 15 (11), 2168 (2023).
- Schmidt, O. W., Cooney, M. K., Foy, H. M. Adeno-associated virus in adenovirus type 3 conjunctivitis. Infect Immun. 11 (6), 1362-1370 (1975).
- Grimm, D., Kern, A., Rittner, K., Kleinschmidt, J. A. Novel tools for production and purification of recombinant adenoassociated virus vectors. Hum Gene Ther. 9 (18), 2745-2760 (1998).
- Zolotukhin, S., et al. Recombinant adeno-associated virus purification using novel methods improves infectious titer and yield. Gene Ther. 6 (6), 973-985 (1999).
- Clark, K. R., Liu, X., Mcgrath, J. P., Johnson, P. R. Highly purified recombinant adeno-associated virus vectors are biologically active and free of detectable helper and wild-type viruses. Hum Gene Ther. 10 (6), 1031-1039 (1999).
- Debelak, D., et al. Cation-exchange high-performance liquid chromatography of recombinant adeno-associated virus type 2. J Chromatogr B Biomed Sci App. 740 (2), 195-202 (2000).
- Burova, E., Ioffe, E. Chromatographic purification of recombinant adenoviral and adeno-associated viral vectors: methods and implications. Gene Ther. 12 (1), S5-S17 (2005).
- Adams, B., Bak, H., Tustian, A. D. Moving from the bench towards a large scale, industrial platform process for adeno-associated viral vector purification. Biotechnol Bioeng. 117 (10), 3199-3211 (2020).
- Grieger, J. C., Choi, V. W., Samulski, R. J. Production and characterization of adeno-associated viral vectors. Nat Protoc. 1 (3), 1412-1428 (2006).
- Florea, M., et al. High-efficiency purification of divergent AAV serotypes using AAVX affinity chromatography. Mol Ther Methods Clin Dev. 28, 146-159 (2022).
- Chamberlain, K., Riyad, J. M., Weber, T. Expressing transgenes that exceed the packaging capacity of adeno-associated virus capsids. Hum Gene Ther Methods. 27 (1), 1-12 (2016).
- Green, E. A., Hamaker, N. K., Lee, K. H. Comparison of vector elements and process conditions in transient and stable suspension HEK293 platforms using SARS-CoV-2 receptor binding domain as a model protein. BMC Biotechnol. 23 (1), 7 (2023).
- Erbacher, P., Zou, S., Bettinger, T., Steffan, A. M., Remy, J. S. Chitosan-based vector/DNA complexes for gene delivery: Biophysical characteristics and transfection ability. Pharm Res. 15 (9), 1332-1339 (1998).
- Vandenberghe, L. H., et al. Efficient serotype-dependent release of functional vector into the culture medium during adeno-associated virus manufacturing. Hum Gene Ther. 21 (10), 1251-1257 (2010).
- Summerford, C., Samulski, R. J. Membrane-associated heparan sulfate proteoglycan is a receptor for adeno-associated virus type 2 virions. J Virol. 72 (2), 1438-1445 (1998).
- Wright, J. F., et al. Identification of factors that contribute to recombinant AAV2 particle aggregation and methods to prevent its occurrence during vector purification and formulation. Mol Ther. 12 (1), 171-178 (2005).
- Gruntman, A. M., et al. Stability and compatibility of recombinant adeno-associated virus under conditions commonly encountered in human gene therapy trials. Hum Gene Ther Methods. 26 (2), 71-76 (2015).
- Srivastava, A. Rationale and strategies for the development of safe and effective optimized AAV vectors for human gene therapy. Mol Ther Nucleic Acids. 32, 949-959 (2023).
- Mullard, A. FDA approves first gene therapy for Duchenne muscular dystrophy, despite internal objections. Nat Rev Drug Discov. 22 (8), 610-610 (2023).
- Center for Biologics Evaluation and Research. Approved Cellular and Gene Therapy Products. US Food Drug Adm. , (2023).
- Kang, L., et al. AAV vectors applied to the treatment of CNS disorders: Clinical status and challenges. J Control Release Off J Control Release Soc. 355, 458-473 (2023).
- De Wolf, D., Singh, K., Chuah, M. K., VandenDriessche, T. Hemophilia gene therapy: The end of the beginning. Hum Gene Ther. 34 (17-18), 782-792 (2023).
- Simons, E. J., Trapani, I. The opportunities and challenges of gene therapy for treatment of inherited forms of vision and hearing loss. Hum Gene Ther. 34 (17-18), 808-820 (2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados