Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herstellung und Aufreinigung von Suspensionskulturen von Adeno-assoziierten Viren durch Iodixanol-Dichtegradientenzentrifugation für In-vivo-Anwendungen
In diesem Artikel
Zusammenfassung
Adeno-assoziiertes Virus wird in Suspensionszellkultur hergestellt und durch doppelte Iodixanol-Dichtegradientenzentrifugation gereinigt. Es sind Schritte enthalten, um die Gesamtvirusausbeute zu erhöhen, das Risiko von Virusausfällungen zu verringern und das endgültige Virusprodukt weiter zu konzentrieren. Die erwarteten Endtiter erreichen 10bis 12 Viruspartikel/ml und sind für die präklinische In-vivo-Anwendung geeignet.
Zusammenfassung
Dieses Protokoll beschreibt die Herstellung und Aufreinigung rekombinanter Adeno-assoziierter Viren (rAAV) durch Iodixanol-Dichtegradientenzentrifugation, eine serotypagnostische Methode zur Aufreinigung von AAV, die erstmals 1999 beschrieben wurde. rAAV-Vektoren werden häufig in Gentherapieanwendungen verwendet, um Transgene an verschiedene menschliche Zelltypen zu liefern. In dieser Arbeit wird das rekombinante Virus durch Transfektion von Expi293-Zellen in Suspensionskultur mit Plasmiden hergestellt, die für das Transgen, das Vektorkapsid und die adenoviralen Helfergene kodieren. Die Iodixanol-Dichtegradientenzentrifugation reinigt vollständige AAV-Partikel basierend auf der Partikeldichte. Darüber hinaus sind drei Schritte in dieser inzwischen allgegenwärtigen Methodik enthalten, um die Gesamtvirusausbeute zu erhöhen, das Risiko von Ausfällungen aufgrund kontaminierender Proteine zu verringern bzw. das Endprodukt des Virus weiter zu konzentrieren: Ausfällung von Viruspartikeln aus Zellmedien unter Verwendung einer Lösung aus Polyethylenglykol (PEG) und Natriumchlorid, Einführung einer zweiten Runde der Iodixanol-Dichtegradientenzentrifugation, und Pufferaustausch über einen Zentrifugalfilter. Mit dieser Methode ist es möglich, konsistent Titer im Bereich von 10bis 12 Viruspartikeln/ml von außergewöhnlicher Reinheit für die In-vivo-Anwendung zu erreichen.
Einleitung
Rekombinante adeno-assoziierte virale (rAAV) Vektoren sind weit verbreitete Instrumente zur Behandlung genetischer Erkrankungen, einschließlich spinaler Muskelatrophie, Netzhautdystrophie und Hämophilie A 1,2,3. rAAV-Vektoren sind so konstruiert, dass ihnen virale Gene fehlen, die in Wildtyp-AAV4 vorhanden sind, einem kleinen, nicht umhüllenden Ikosaedervirus mit einem linearen einzelsträngigen 4,7 kb DNA-Genom. AAV wurde erstmals in den 1960er Jahren als Kontaminante von Adenovirus-Präparaten entdeckt5. Trotz seiner kleinen Kapsidgröße, die die Größe des Transgens, das ohne ITRs verpackt werden kann, auf maximal 4,9 kb begrenzt6, ist AAV für die Transgenabgabe nützlich, da es beim Menschen nicht pathogen ist, die Expression des Transgens in vielen sich teilenden und nicht teilenden Zelltypen ermöglicht und begrenzte immunogene Wirkungen hat7.
Als Mitglieder der Gattung Dependoparvovirus hängt die Produktion von rAAVs von der Expression von Helfergenen ab, die im Adenovirus oder Herpes-simplex-Virusvorhanden sind 8. Es wurden mehrere Strategien zur Herstellung von rAAV entwickelt, aber die Produktion in HEK293-Zellen, die mit den adenoviralen E1A/E1B-Helfergenen transformiert wurden, ist die etablierteste Methode, die heute verwendet wird9. Der allgemeine Ansatz der rAAV-Produktion beginnt mit der Transfektion von HEK293-Zellen mit drei Plasmiden, die das Transgen in invertierten terminalen Wiederholungen (ITRs), AAV-Rep- und Cap-Genen bzw. zusätzlichen adenoviralen Helfergenen enthalten. Zweiundsiebzig Stunden nach der Transfektion werden die Zellen geerntet und verarbeitet, um rAAV zu reinigen, das das Transgen enthält.
Bei der Entwicklung neuer rAAV-Vektoren für therapeutische Zwecke ist ein wesentliches Ziel die Herstellung von Vektoren mit erhöhter Transduktionseffizienz. Eine Erhöhung der Transduktionseffizienz von Zielzellen würde eine Verringerung der erforderlichen klinischen Dosis von rAAV bedeuten und somit die Wahrscheinlichkeit unerwünschter immunogener Wirkungen verringern, die von Antikörper-vermittelter Neutralisation bis hin zu akuten Toxizitäten reichen10,11. Um die Transduktionseffizienz von rAAV-Vektoren zu verbessern, können Änderungen am verpackten Genom oder am Kapsid vorgenommen werden. Praktikable Methoden zur Abstimmung der Transduktionswirksamkeit über das Design des verpackten Genoms umfassen den Einbau starker und gewebespezifischer Promotoren, die sorgfältige Auswahl von mRNA-Verarbeitungselementen und die Optimierung der Kodierungssequenz zur Verbesserung der Translationseffizienz12. Veränderungen am Kapsid werden mit dem Ziel vorgenommen, den Tropismus für menschliche Zielzelltypen zu erhöhen. Die Bemühungen zur Entwicklung neuer rAAV-Transgen-Verabreichungsvektor-Kapside sind im Allgemeinen gekennzeichnet durch einen Fokus entweder auf das rationale Design von AAV-Kapsiden mit spezifischen Mutationen, die auf spezifische Zellrezeptoren abzielen, oder auf die gerichtete Evolution zur Identifizierung von Kapsiden mit Tropismus für bestimmte Zelltypen aus hochkomplexen kombinatorischen Kapsidbibliotheken, ohne auf einen bestimmten Rezeptor abzuzielen (obwohl einige Gruppen diese Ansätze kombinieren)13, 14,15. Beim gerichteten Evolutionsansatz werden kombinatorische Kapsidbibliotheken unter Verwendung eines bestimmten Serotyp-Rückgrats mit mutierten variablen Regionen an der Kapsidaußenseitekonstruiert 16. Kombinatorische Kapsidbibliotheken werden häufig aus AAV-Serotypen konstruiert, die nicht vom Menschen stammen, wodurch das Risiko einer bereits bestehenden Immunität während der klinischen Anwendung verringertwird 10. Daher sind Aufreinigungsmethoden, die auf jeden Serotyp angewendet werden können, ideal, um die Notwendigkeit einer serotypspezifischen Optimierung für die weniger häufig verwendeten Serotypen, die als Rückgrat für diese Bibliotheken dienen, zu eliminieren.
Die Iodixanol-Dichtegradientenzentrifugation wird verwendet, um hohe Titer von rAAV mit hoher Infektiositätzu reinigen 17. In diesem Protokoll wird rAAV in Suspensionszellkultur hergestellt, um den Arbeitsaufwand für die Herstellung großer AAV-Titer zu verringern. Ein Zentrifugationsschritt ist ebenfalls enthalten, um Zelllysat zu reinigen, um das Vorhandensein kontaminierender Proteine zu reduzieren und das Risiko einer Virusausfällung zu verringern. Dieses Protokoll ist eine kostengünstige Methode zur Herstellung von Präparaten aus hochreinem rAAV, die für den präklinischen Einsatz geeignet sind.
Protokoll
Die Zusammensetzung der in diesem Protokoll verwendeten Lösungen und Puffer ist in Tabelle 1 angegeben.
| Lösung | Zusammensetzung | |
| AAV-Lyse-Puffer | 1,2 ml 5 M NaCl-Lösung | |
| 2 ml 1 M Tris-HCl pH 8,5 Lösung | ||
| 80 μl 1 M MgCl2-Lösung | ||
| mQ Wasser bis 40 mL | ||
| AAV-Fällungslösung | 40 g PEG 8000 | |
| 50 ml 5 M NaCl-Lösung | ||
| mQ Wasser bis 100 mL | ||
| 15% Iodixanol-Fraktion | 7,5 ml OptiPrep | |
| 3 ml 10X DPBS | ||
| 6 ml 5 M NaCl-Lösung | ||
| 30 μl 1 M MgCl2-Lösung | ||
| mQ bis 30 mL | ||
| 25% Iodixanol-Fraktion | 12. 5 ml OptiPrep | |
| 3 ml 10X DPBS | ||
| 30 μl 1 M MgCl2-Lösung | ||
| 60 μl Phenolrotlösung | ||
| mQ bis 30 mL | ||
| 40% Iodixanol-Fraktion | 33,3 ml OptiPrep | |
| 5 ml 10X DPBS | ||
| 50 μl 1 M MgCl2-Lösung | ||
| mQ bis 50 mL | ||
| 60% Iodixanol-Fraktion | 50 ml OptiPrep | |
| 100 μl Phenolrotlösung | ||
| AAV-Pufferlösung | 8 ml von 5 M NaCl | |
| 20 μl 10 % Pluronic F-68 | ||
| PBS bis 200 ml | ||
Tabelle 1: Lösungszusammensetzungen für Lösungen, die in diesem Protokoll verwendet werden.
1. Dreifache Transfektion von Expi293-Zellen
- Expi293-Zellen (siehe Materialtabelle) mit einer Anfangsdichte von 5 x 105 lebensfähigen Zellen (vc)/ml ausseeden.
- Lassen Sie die Zellen bei 37 °C mit 8 % CO2 und einer Schütteldrehzahl von 125 U/min inkubieren, bis sie eine Dichte von 3-5 x 106 vc/ml erreichen. Überwachen Sie die Zelldichte und -viabilität mithilfe des Trypanblau-Ausschlusses mit einem automatisierten Zellzähler (siehe Materialtabelle).
- Wenn die Zellen die gewünschte Zelldichte erreicht haben, teilen Sie sie 1 bis 10 auf, indem Sie frisches Medium hinzufügen, so dass ihr Gesamtvolumen das Zehnfache ihres ursprünglichen Volumens beträgt. Falls erforderlich, werden die Zellen in einen größeren Kolben überführt. Zurück zur Inkubation.
- Die Zellen werden wie in den Schritten 1.2 bis 1.3 beschrieben weiter expandiert, bis sie eine Dichte von mindestens 2 x 106 vc/ml in 250 ml Medien in einem 1-Liter-Kolben erreichen.
- Verdünnen Sie die Zellen am Tag vor der Transfektion auf 2 x 106 vc/ml in 250 ml Medien und verwerfen Sie überschüssige Zellen nach Bedarf. Inkubieren Sie die Zellen über Nacht.
- Am Tag der Transfektion die Hälfte der Zellen bei 58 x g für 5 min bei 18 °C zentrifugieren. Resuspendieren Sie das Zellpellet im gleichen Volumen (125 ml) Frischmedium. Die Zellviabilität sollte nahe bei 98% liegen.
- Bereiten Sie zwei konische 50-ml-Röhrchen vor. Beschriften Sie einen mit "PEI" und den anderen mit "DNA".
- In dem konischen Röhrchen mit der Bezeichnung PEI 1,2 ml PEI (Polyethylenimin, siehe Materialtabelle) auf ein Gesamtvolumen von 12,5 ml in OptiMEM-Medien verdünnen.
- Bereiten Sie in dem konischen Röhrchen mit markierter DNA eine äquimolare Lösung von Plasmid-DNA zu insgesamt 500 μg DNA in einem Gesamtvolumen von 12,5 ml in OptiMEM-Medien vor.
- Geben Sie die DNA-Lösung in die PEI-Lösung, invertieren Sie sie mehrmals, um sie gründlich zu kombinieren, und lassen Sie sie 10 Minuten bei Raumtemperatur inkubieren.
HINWEIS: Es ist wichtig, dass die DNA-PEI-Lösung die vollen 10 Minuten inkubieren kann, damit PEI geladene Komplexe mit der DNA bilden kann. - Nachdem die DNA-PEI-Lösung 10 Minuten lang inkubiert wurde, tragen Sie die DNA-PEImax-Lösung mit einer serologischen Pipette langsam auf die Expi293-Zellen auf. Die transfizierten Zellen werden wieder in den Inkubator gegeben und 72 Stunden lang inkubiert (Abbildung 1).
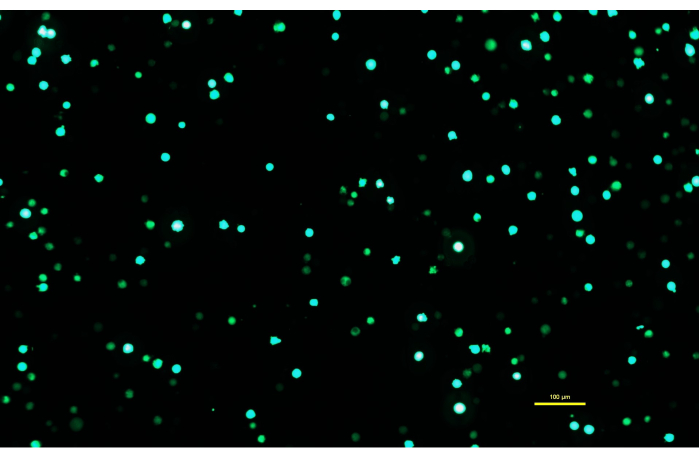
Abbildung 1: Expi293-Zellen, die GFP zwei Tage nach der Transfektion exprimieren. Nach der Transfektion mit einem Plasmid, das ein Gen für GFP enthält, exprimieren die Expi293-Zellen vorübergehend eGFP. Die Zellmorphologie ist rund. Das Bild wurde mit einer Belichtungszeit von 15 ms aufgenommen. Die Mikroskopbilder werden mit einem inversen Mikroskop aufgenommen, das mit Epifluoreszenzbeleuchtung und einem 10x/0,30-Objektiv ausgestattet ist. Maßstabsbalken = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Aufreinigung von rAAV-Vektoren
- Nach 72 h werden die Zellen in Suspension in zwei konische 250-ml-Röhrchen überführt und 10 min bei 415 x g bei 4 °C heruntergeschleudert.
- Das überstehende Medium wird in ein frisches konisches 500-ml-Röhrchen gegossen und zur späteren Verarbeitung bei 0 °C auf Eis gelagert.
- Resuspendieren Sie jedes Zellpellet in 10 ml AAV-Lysepuffer (Tabelle 1). Sammeln Sie die beiden Lysate zusammen in einem der Röhrchen. Spülen Sie das andere Röhrchen mit zusätzlichen 5 ml AAV-Lysepuffer und fügen Sie es dann zu den gepoolten Lysaten hinzu. Bei -70 °C einfrieren.
HINWEIS: Das Experiment kann an dieser Stelle angehalten werden. Lagern Sie die überstehenden Medien bei -70 °C und nicht auf Eis. - Geben Sie 1:4 Volumen AAV-Fällungslösung in das überstehende Medium aus Schritt 2.2. Mehrmals umdrehen, gründlich mischen und bei 0 °C auf Eis mindestens 2 h oder über Nacht inkubieren.
- Die inkubierte Lösung bei 3000 x g für 1 h bei 4 °C zentrifugieren.
- Entsorgen Sie den Überstand und resuspendieren Sie das Pellet mit viralem Niederschlag in 5 ml AAV-Lysepuffer.
- Das Zelllysat bei 37 °C im Wasserbad auftauen.
- Poolen Sie den Virusniederschlag mit dem Zelllysat. Dies ist das Rohlysat. Spülen Sie das Zentrifugationsröhrchen, das den viralen Niederschlag enthielt, mit zusätzlichen 5 ml AAV-Lysepuffer und füllen Sie es mit dem Rohlysat.
- Das Rohlysat auf -70 °C einfrieren und dann bei 37 °C auftauen. Wiederholen Sie diesen Zyklus noch einmal.
HINWEIS: Das Rohlysat sollte nicht länger bei 37 °C belassen werden, als es zum Auftauen erforderlich ist. - Nach dem dritten Auftauen sofort 4 μl Benzonase zum Rohlysat geben, zum Mischen invertieren und 30 Minuten bei 37 °C inkubieren.
- Das Rohlysat wird 10 min lang bei 650 x g bei 18 °C zentrifugiert.
- Übertragen Sie den Überstand in ein sauberes konisches 50-ml-Röhrchen. Das ist das rohe Virus. Entsorgen Sie das Pellet.
- Zentrifugieren Sie das Rohvirus für weitere 30 Minuten bei 3000 x g bei 18 °C, um kontaminierende Proteine zu entfernen.
- Übertragen Sie den Überstand in ein sauberes konisches 50-ml-Röhrchen. Dies ist das geklärte Virus.
HINWEIS: Das Experiment kann an dieser Stelle angehalten werden. Frieren Sie das geklärte Virus auf -70 °C ein. - Richten Sie die Mehrkanal-Schlauchpumpe mit vier Schlauchschläuchen ein (siehe Materialtabelle). Befestigen Sie Kapillaren an beiden Enden jedes Röhrchens.
- Legen Sie die Kapillaren auf der Eingangsseite der Pumpe in ein mit deionisiertem Wasser gefülltes Becherglas. Legen Sie die Kapillaren auf der Ausgangsseite der Pumpe in ein leeres Becherglas. Lassen Sie die Schlauchpumpe mit 25,0 U/min laufen, um den Schlauch mit deionisiertem (DI) Wasser zu spülen.
- Entleeren Sie nach gründlicher Spülung den Schlauch, indem Sie die Pumpe laufen lassen, bis der Schlauch nur noch mit Luft gefüllt ist. Legen Sie alle Kapillaren auf ein sauberes, fusselfreies Tuch.
- Legen Sie vier Ultrazentrifugenröhrchen in ein Gestell auf der Ausgangsseite der Pumpe.
- Verwenden Sie eine serologische 10-ml-Pipette, um vorsichtig 10 ml geklärtes Virus in jedes Ultrazentrifugenröhrchen zu dosieren. Achten Sie darauf, keine Luftblasen einzuführen.
HINWEIS: Das Volumen des geklärten Virus in jedem Röhrchen kann bei Bedarf auf bis zu 12 ml pro Röhrchen gedehnt werden. Reduzieren Sie die Menge von 60% Iodixanol entsprechend in Schritt 2.25 unten. - Das geklärte Virus wird mit Hilfe der Peristaltikpumpe mit Iodixanolfraktionen (Tabelle 1) von der niedrigsten bis zur höchsten Dichte unterlegt. Zuerst wird die 15%-Fraktion hinzugefügt, gefolgt von der 25%-Fraktion, der 40%-Fraktion und schließlich der 60%-Fraktion. 22 ml (5,5 ml pro Ultrazentrifugenröhrchen) der 15%igen Iodixanolfraktion in ein sauberes konisches 50-ml-Röhrchen überführen. Legen Sie die Kapillaren auf der Eingangsseite der Pumpe in den Schlauch und achten Sie darauf, dass alle Kapillaren den Boden des Schlauchs berühren.
- Starten Sie die Pumpe und lassen Sie den Schlauch mit der Iodixanolfraktion füllen. Wenn die Iodixanolfraktion die Enden der Kapillaren auf der Ausgangsseite der Pumpe erreicht, stoppen Sie die Pumpe.
- Führen Sie eine Ausgangskapillare in jedes Ultrazentrifugenröhrchen mit geklärtem Virus ein und achten Sie darauf, dass die Kapillaren den Boden jedes Ultrazentrifugenröhrchens berühren.
HINWEIS: Es ist von entscheidender Bedeutung, dass sich keine Luft mehr in den Kapillaren befindet. Iodixanol kann mit leicht unterschiedlichen Geschwindigkeiten durch den Peristaltikschlauch fließen, stellen Sie also sicher, dass jede einzelne Ausgangskapillare vollständig mit Iodixanol gefüllt ist, bevor Sie es in das geklärte Virus einführen. Es kann erforderlich sein, die Pumpe mehrmals zu stoppen und zu starten. - Starten Sie die Pumpe und lassen Sie die Ultrazentrifugenröhrchen füllen. Wenn der letzte Teil der 15%igen Fraktion in die Eingangskapillaren aufgenommen werden soll, stoppen Sie die Pumpe. Es ist wichtig, dass keine Luftblasen in den Schlauch gelangen.
Anmerkungen: Wenn Luftblasen in die Eingangskapillaren gelangen, kann die Pumpe kurz in umgekehrter Richtung betrieben werden, um sie wieder herauszudrücken. - 22 ml (5,5 ml pro Ultrazentrifugenröhrchen) der 25%igen Iodixanolfraktion in das konische 50-ml-Röhrchen überführen. Achten Sie darauf, dass alle Kapillaren den Boden des Schlauchs berühren, und starten Sie die Pumpe. Wenn der letzte Teil der 25%igen Fraktion in die Eingangskapillaren aufgenommen werden soll, stoppen Sie die Pumpe.
- Schritt 2.24 wird mit 20 ml (5 ml pro Ultrazentrifugenröhrchen) der 40%igen Iodixanolfraktion und dann mit 24 ml (6 ml pro Ultrazentrifugenröhrchen) der 60%igen Fraktion wiederholt.
- Wenn im Ultrazentrifugenröhrchen noch ungefülltes Volumen vorhanden ist, fügen Sie weitere 60%ige Fraktion hinzu, bis die Ultrazentrifugenröhrchen vollständig mit Flüssigkeit gefüllt sind.
- Füllen Sie jedes Röhrchen, bis das Lysat eine Kuppel bildet, aber nicht aus dem Röhrchen überläuft. Stoppen Sie die Pumpe und entfernen Sie vorsichtig jede Ausgangskapillare, wobei Sie darauf achten, den Iodixanolgradienten nicht zu stören.
- Verschließen Sie jedes Ultrazentrifugenröhrchen mit einem Abstandshalter und laden Sie es in einen Ti-Rotor vom Typ 70 (siehe Materialtabelle).
Anmerkungen: Stellen Sie sicher, dass der Rotor richtig ausgewuchtet ist. Versuchen Sie nicht, die Ultrazentrifuge ohne entsprechende Schulung zu bedienen. - Laden Sie den Typ 70 Ti-Rotor in die Ultrazentrifuge und zentrifugieren Sie ihn bei 489.000 x g für 1 h bei 18 °C.
- Entladen Sie den Rotor nach der Zentrifugation von der Ultrazentrifuge. Entfernen Sie jedes Ultrazentrifugenröhrchen vorsichtig mit einer Spitzzange vom Rotor und achten Sie darauf, den Iodixanolgradienten nicht zu stören.
- Verwenden Sie einen Stützringständer mit Klemme, um ein Ultrazentrifugenröhrchen zu sichern.
- Befestigen Sie eine 20-GA-Nadel an einer 5-ml-Spritze und legen Sie sie beiseite. Verwenden Sie ein fusselfreies Tuch, um die Kappe vom Ultrazentrifugenröhrchen zu entfernen.
- Durchdringen Sie die Wand des Ultrazentrifugenröhrchens mit der Nadel etwa 3 mm unterhalb der 40%-60%igen Iodixanol-Grenzfläche (Abbildung 2).
- Saugen Sie die Grenzfläche und einen Teil der 40%-Fraktion langsam an. Vermeiden Sie es, die Oberseite der 40%igen Fraktion anzusaugen, um eine Gesamtentnahme von etwa 4 ml zu erzielen.
- Halten Sie einen Finger über die offene Oberseite des Ultrazentrifugenröhrchens, ziehen Sie die Spritze heraus und übertragen Sie die aspirierte AAV-Fraktion in ein konisches 50-ml-Röhrchen. Entsorgen Sie die Spritze in einem Behälter für scharfe Gegenstände. Entsorgen Sie das Ultrazentrifugenröhrchen.
- Wiederholen Sie die Schritte 2.31-2.35 für jedes Ultrazentrifugenröhrchen.
- Verdünnen Sie die aspirierte AAV-Fraktion ungefähr um das Zweifache in AAV-Lysepuffer auf ein Volumen von 40 ml.
- Spülen Sie den Schlauch wie in den Schritten 2.16-2.17 beschrieben.
HINWEIS: Das Experiment kann an dieser Stelle angehalten werden. Die verdünnte AAV-Fraktion über Nacht bei 0 °C lagern. - Laden Sie jeweils 20 ml der verdünnten AAV-Fraktion in zwei neue Ultrazentrifugenröhrchen.
- Für die zweite Runde der Iodixanol-Dichtegradientenzentrifugation wird die verdünnte AAV-Fraktion wie oben beschrieben mit nur 10 ml (5 ml pro Ultrazentrifugenröhrchen) der 40%igen Fraktion und 14 ml (7 ml pro Ultrazentrifugenröhrchen) der 60%igen Fraktion unterlegt. Wiederholen Sie die Schritte 2.29-2.36 für die Ultrazentrifugation und Aspiration.
Anmerkungen: Spülen Sie vor der Lagerung der Schlauchpumpe und des Schlauchs den Schlauch mit DI-Wasser aus, wie in den Schritten 2.16-2.17 beschrieben.

Abbildung 2: Iodixanol-Gradient mit markierter 40%-60%-Iodixanol-Grenzfläche. (A) Erster Iodixanol-Gradient. Phenolrot wird in den Fraktionen 40% Iodixanol und 60% Iodixanol verwendet. Es erscheint aufgrund des unterschiedlichen pH-Werts zwischen den beiden Fraktionen als eine andere Farbe. Der Pfeil zeigt an, wo die Spritze eingeführt werden sollte, um die rAAV-Fraktion zu ernten, direkt unter der Grenzfläche von 40 % bis 60 % Iodixanol. (B) Zweiter Iodixanol-Gradient. In diesem Schritt werden nur die 40%igen und 60%igen Iodixanolfraktionen verwendet. Der Pfeil zeigt an, wo die Spritze eingeführt werden sollte, um die rAAV-Fraktion zu ernten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Pufferaustausch und Viruskonzentration
- Nachdem Sie die AAV-Fraktion aus der zweiten Runde der Iodixanol-Dichtegradientenzentrifugation erhalten haben, verdünnen Sie sie zweifach mit AAV-Pufferlösung.
- Äquilibrieren Sie den Zentrifugalfilter, indem Sie 20 ml AAV-Pufferlösung auf die Oberseite des Filters geben. Das Gerät wird bei 3000 x g bei 18 °C 5 min lang zentrifugiert und der Durchfluss verworfen.
- Geben Sie die verdünnte AAV-Fraktion in den Zentrifugalfilter. Das Gerät wird bei 3000 x g bei 18 °C 5 min lang zentrifugiert und der Durchfluss verworfen.
- Geben Sie 20 ml AAV-Pufferlösung oben in den Filter. Das Gerät wird bei 3000 x g bei 18 °C 5 min lang zentrifugiert und der Durchfluss verworfen.
Anmerkungen: Wenn die Zentrifugalfiltermembran verstopft ist und die Lösung ineffizient durchfließt, verwenden Sie vorsichtig eine P200-Mikropipette, um die Lösung oben im Filter auf und ab zu ziehen. Achten Sie darauf, den Filter nicht mit der Mikropipettenspitze zu berühren. - Wiederholen Sie Schritt 3.4 noch zweimal.
Anmerkungen: Stellen Sie sicher, dass das AAV nicht überkonzentriert ist, indem Sie mindestens 1 ml Volumen oben im Filter halten. Es kann notwendig sein, die Zentrifugationszeiten anzupassen, um eine Überkonzentration zu vermeiden. Wenn AAV überkonzentriert ist, kann es zu Niederschlägen kommen. - Für einen Endtiter im Bereich von 10bis 12 vg/ml wird das Virus auf ein Endvolumen von etwa 1 ml heruntergeschleudert.
HINWEIS: Abhängig vom verwendeten Serotyp-Rückgrat und der Verpackungseffizienz des Virus müssen Sie das Virus möglicherweise in einem kleineren Volumen konzentrieren. - Verwenden Sie eine p1000-Mikropipette, um das konzentrierte AAV von der Oberseite des Zentrifugalfilters in ein Mikrozentrifugenröhrchen zu übertragen. Verwenden Sie eine p200-Mikropipette, um den Zentrifugalfilter mit 50 μl AAV-Puffer zu waschen, um verbleibende Viren aufzufangen und mit dem Rest des konzentrierten AAV zu sammeln.
- Ein 2 μl Aliquot des konzentrierten AAV zum Titern beiseite stellen. In der ergänzenden Tabelle 1 finden Sie ITR-Primer, die für die qPCR verwendet werden können.
- Führen Sie das konzentrierte AAV durch einen 0,2-μm-Spritzenvorsatzfilter, um es zu sterilisieren.
HINWEIS: Achten Sie bei der Sterilisation eines kleinen Volumens darauf, einen Spritzenvorsatzfilter mit kleinem Durchmesser zu wählen, um den Virusverlust zu minimieren. Die Verwendung eines proteinarmen Bindungsfilters mit kleinem Durchmesser führt zu minimalem Virusverlust (Daten nicht gezeigt). - Das sterilisierte AAV kann sofort zur Zelltransduktion verwendet oder bei 4 °C gelagert werden, um innerhalb von vier Wochen verwendet zu werden. Für eine längerfristige Lagerung sollte es bei -70 °C gelagert werden.
Ergebnisse
Mit dieser Methode können Titer von mindestens 10bis 12 Viruspartikeln pro ml erhalten werden. Ein Titer kann (Abbildung 3) durch qPCR unter Verwendung der in der ergänzenden Tabelle 1 angegebenen ITR-Primer, durch ddPCR oder durch eine andere Titermethode erhalten werden. Suboptimale Titer könnten sich aus der Verwendung eines Cap-Gens ergeben, das für ein Kapsid mit schlechter Verpackungseffizienz kodiert.
Eine weitere m?...
Diskussion
Das Protokoll zur doppelten Iodixanol-Dichtegradientenreinigung ist die universelle Methode, da es auf alle AAV-Mutantenvarianten anwendbar ist, unabhängig von ihrer Rezeptorspezifität. Frühe Methoden der AAV-Reinigung beruhten auf der Partikeldichte und umfassten die isopyknische Zentrifugation in CsCl und die kontinuierliche Saccharose-Dichtegradientenzentrifugation19. Später wurden Serotyp-spezifische Ansätze entwickelt, bei denen monoklonale Antikörper verwendet wurden, die an Sepharoses...
Offenlegungen
Die Autoren haben keine Offenlegungen zu berichten.
Danksagungen
Nichts.
Materialien
| Name | Company | Catalog Number | Comments |
| 5810 R benchtop centrifuge | Eppendorf | 22625501 | |
| 8-channel peristaltic pump | Watson-Marlow | 020.3708.00A | |
| Automated cell counter | NanoEntek | EVE-MC | |
| Avanti J-E high-speed centrifuge | Beckman Coulter | 369001 | |
| Benzonase | Thermo Scientific | 88701 | |
| Biological safety cabinet | Labconco | 322491101 | |
| CO2 incubator with shaker | Set at 8% CO2 and 37 °C | ||
| Conical centrifuge tubes | Thermo Scientific | 339652 | 50 mL |
| Conical centrifuge tubes | Thermo Scientific | 339650 | 15 mL |
| Disposable micro-pipets | Fisherbrand | 21-164-2G | Capillaries |
| Dulbecco's phosphate buffered saline without CaCl2 and MgCl2 (DPBS) (10x) | Sigma-Aldrich | D1408 | |
| ECLIPSE Ts2R-FL inverted microscope | Nikon | ||
| Expi293 Expression Medium | Gibco | A1435101 | |
| Expi293F cells | Gibco | A14527 | |
| Filter tips | USA Scientific | 1126-7810 | 1000 µL |
| Filter tips | USA Scientific | 1120-8810 | 200 µL |
| Filter tips | USA Scientific | 1120-1810 | 20 µL |
| Filter tips | USA Scientific | 1121-3810 | 10 µL |
| Hypodermic needles | Tyco Healthcare | 820112 | 20 GA x 1-1/2 A |
| Ice bucket with lid | VWR | 10146-184 | |
| JS-5.3 rotor | Beckman Coulter | 368690 | |
| Magnesium chloride solution (1 M) | Millipore Sigma | M1028-100ML | |
| Metal stand and clamp | Fisherbrand | 05-769-6Q | |
| Microcentrifuge tubes | Eppendorf | 22600028 | 1.5 mL |
| Needle nose pliers | |||
| Optima XE-90 ultracentrifuge | Beckman Coulter | A94471 | |
| Opti-MEM I Reduced-Serum Medium | Gibco | 31985062 | |
| OptiPrep density gradient media (iodixanol) | Serumwerk | AXS-1114542 | 60% iodixanol solution |
| P1000 Pipet | Gilson | F144059M | |
| P2 Pipet | Gilson | F144054M | |
| P20 Pipet | Gilson | F144056M | |
| P200 Pipet | Gilson | F144058M | |
| Phenol red solution | Sigma-Aldrich | P0290 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich | P4474 | |
| Pipet-Aid XP pipette controller | Drummond Scientific | 4-000-101 | |
| Plasmid pCapsid | De novo or Addgene, etc. | N/A | We used pACGrh74. |
| Plasmid pHelper | Addgene | 112867 | |
| Plasmid pTransgene | De novo or Addgene, etc. | N/A | We used pdsAAV-GFP. |
| Pluronic F-68 polyol solution (10%) | Mp Biomedicals | 92750049 | |
| Polyethylene glycol 8000 | Research Products International | P48080-500.0 | |
| Polyethylenimine HCl Max (PEI-Max) | Polysciences | NC1038561 | Dilute in water to 40 μM |
| Polypropylene centrifuge tubes, sterile | Corning | 431123 | 500 mL |
| Polypropylene centrifuge tubes, sterile | Corning | 430776 | 250 mL |
| Polypropylene Optiseal tubes | Beckman Coulter | 361625 | |
| Serological pipettes | Alkali Scientific | SP250-B | 50 mL |
| Serological pipettes | Alkali Scientific | SP225-B | 25 mL |
| Serological pipettes | Alkali Scientific | SP210-B | 10 mL |
| Serological pipettes | Alkali Scientific | SP205-B | 5 mL |
| Shaker flasks | Fisherbrand | PBV1000 | 1 L |
| Shaker flasks | Fisherbrand | PBV50-0 | 500 mL |
| Shaker flasks | Fisherbrand | PBV250 | 250 mL |
| Shaker flasks | Fisherbrand | PBV12-5 | 125 mL |
| Sodium chloride solution (5 M) | Fisher Scientific | NC1752640 | |
| Sterile syringes | Fisherbrand | 14-955-458 | 5 mL |
| Syringe filter | Millipore | SLGV013SL | 0.22 micron |
| Tris-HCl pH 8.5 (1 M) | Kd Medical | RGE3363 | |
| Trypan blue solution | Gibco | 15250061 | |
| Tube rack assembly | Beckman Coulter | 361646 | |
| Tube spacers (x4) | Beckman Coulter | 361669 | |
| Tubing for peristaltic pump | Fisher Scientific | 14190516 | |
| Type 70 Ti fixed-angle titanium rotor | Beckman Coulter | 337922 | |
| Ultra low temperature freezer | Set at -70 °C | ||
| Vivaspin 20 centrifugal concentrator | Sartorius | VS2041 | |
| Water bath | Set at 37 °C |
Referenzen
- Strauss, K. A., et al. Onasemnogene abeparvovec for presymptomatic infants with three copies of SMN2 at risk for spinal muscular atrophy: the Phase III SPR1NT trial. Nat Med. 28 (7), 1390-1397 (2022).
- Fuller-Carter, P. I., Basiri, H., Harvey, A. R., Carvalho, L. S. Focused update on AAV-based gene therapy clinical trials for inherited retinal degeneration. BioDrugs. 34 (6), 763-781 (2020).
- George, L. A., et al. Multiyear factor VIII expression after AAV gene transfer for hemophilia A. N Engl J Med. 385 (21), 1961-1973 (2021).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-Associated Virus (AAV) as a vector for gene therapy. Biodrugs. 31 (4), 317-334 (2017).
- Atchison, R. W., Casto, B. C., Hammon, W. M. c. D. Adenovirus-associated defective virus particles. Science. 149 (3685), 754-756 (1965).
- Wu, Z., Yang, H., Colosi, P. Effect of genome size on AAV vector packaging. Mol Ther. 18 (1), 80-86 (2010).
- Samulski, R. J., Muzyczka, N. AAV-mediated gene therapy for research and therapeutic purposes. Annu Rev Virol. 1 (1), 427-451 (2014).
- Zolotukhin, S. Production of recombinant adeno-associated virus vectors. Hum Gene Ther. 16 (5), 551-557 (2005).
- Penaud-Budloo, M., François, A., Clément, N., Ayuso, E. Pharmacology of recombinant adeno-associated virus production. Mol Ther - Methods Clin Dev. 8, 166-180 (2018).
- Costa-Verdera, H., et al. Understanding and Tackling immune responses to adeno-associated viral vectors. Hum Gene Ther. 34 (17-18), 836-852 (2023).
- Ertl, H. C. J. Mitigating serious adverse events in gene therapy with AAV Vectors: Vector dose and immunosuppression. Drugs. 83 (4), 287-298 (2023).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Marsic, D., et al. Vector design tour de force: Integrating combinatorial and rational approaches to derive novel adeno-associated virus variants. Mol Ther. 22 (11), 1900-1909 (2014).
- Grimm, D., Zolotukhin, S. E Pluribus Unum: 50 Years of research, millions of viruses, and one goal-tailored acceleration of AAV evolution. Mol Ther. 23 (12), 1819-1831 (2015).
- Biswas, M., et al. Engineering and in vitro selection of a novel AAV3B variant with high hepatocyte tropism and reduced seroreactivity. Mol Ther - Methods Clin Dev. 19, 347-361 (2020).
- Perabo, L., et al. In vitro selection of viral vectors with modified tropism: the adeno-associated virus display. Mol Ther. 8 (1), 151-157 (2003).
- Crosson, S. M., Dib, P., Smith, J. K., Zolotukhin, S. Helper-free production of laboratory grade AAV and purification by iodixanol density gradient centrifugation. Mol Ther - Methods Clin Dev. 10, 1-7 (2018).
- Chan, C., Harris, K. K., Zolotukhin, S., Keeler, G. D. Rational design of AAV-rh74, AAV3B, and AAV8 with limited liver targeting. Viruses. 15 (11), 2168 (2023).
- Schmidt, O. W., Cooney, M. K., Foy, H. M. Adeno-associated virus in adenovirus type 3 conjunctivitis. Infect Immun. 11 (6), 1362-1370 (1975).
- Grimm, D., Kern, A., Rittner, K., Kleinschmidt, J. A. Novel tools for production and purification of recombinant adenoassociated virus vectors. Hum Gene Ther. 9 (18), 2745-2760 (1998).
- Zolotukhin, S., et al. Recombinant adeno-associated virus purification using novel methods improves infectious titer and yield. Gene Ther. 6 (6), 973-985 (1999).
- Clark, K. R., Liu, X., Mcgrath, J. P., Johnson, P. R. Highly purified recombinant adeno-associated virus vectors are biologically active and free of detectable helper and wild-type viruses. Hum Gene Ther. 10 (6), 1031-1039 (1999).
- Debelak, D., et al. Cation-exchange high-performance liquid chromatography of recombinant adeno-associated virus type 2. J Chromatogr B Biomed Sci App. 740 (2), 195-202 (2000).
- Burova, E., Ioffe, E. Chromatographic purification of recombinant adenoviral and adeno-associated viral vectors: methods and implications. Gene Ther. 12 (1), S5-S17 (2005).
- Adams, B., Bak, H., Tustian, A. D. Moving from the bench towards a large scale, industrial platform process for adeno-associated viral vector purification. Biotechnol Bioeng. 117 (10), 3199-3211 (2020).
- Grieger, J. C., Choi, V. W., Samulski, R. J. Production and characterization of adeno-associated viral vectors. Nat Protoc. 1 (3), 1412-1428 (2006).
- Florea, M., et al. High-efficiency purification of divergent AAV serotypes using AAVX affinity chromatography. Mol Ther Methods Clin Dev. 28, 146-159 (2022).
- Chamberlain, K., Riyad, J. M., Weber, T. Expressing transgenes that exceed the packaging capacity of adeno-associated virus capsids. Hum Gene Ther Methods. 27 (1), 1-12 (2016).
- Green, E. A., Hamaker, N. K., Lee, K. H. Comparison of vector elements and process conditions in transient and stable suspension HEK293 platforms using SARS-CoV-2 receptor binding domain as a model protein. BMC Biotechnol. 23 (1), 7 (2023).
- Erbacher, P., Zou, S., Bettinger, T., Steffan, A. M., Remy, J. S. Chitosan-based vector/DNA complexes for gene delivery: Biophysical characteristics and transfection ability. Pharm Res. 15 (9), 1332-1339 (1998).
- Vandenberghe, L. H., et al. Efficient serotype-dependent release of functional vector into the culture medium during adeno-associated virus manufacturing. Hum Gene Ther. 21 (10), 1251-1257 (2010).
- Summerford, C., Samulski, R. J. Membrane-associated heparan sulfate proteoglycan is a receptor for adeno-associated virus type 2 virions. J Virol. 72 (2), 1438-1445 (1998).
- Wright, J. F., et al. Identification of factors that contribute to recombinant AAV2 particle aggregation and methods to prevent its occurrence during vector purification and formulation. Mol Ther. 12 (1), 171-178 (2005).
- Gruntman, A. M., et al. Stability and compatibility of recombinant adeno-associated virus under conditions commonly encountered in human gene therapy trials. Hum Gene Ther Methods. 26 (2), 71-76 (2015).
- Srivastava, A. Rationale and strategies for the development of safe and effective optimized AAV vectors for human gene therapy. Mol Ther Nucleic Acids. 32, 949-959 (2023).
- Mullard, A. FDA approves first gene therapy for Duchenne muscular dystrophy, despite internal objections. Nat Rev Drug Discov. 22 (8), 610-610 (2023).
- Center for Biologics Evaluation and Research. Approved Cellular and Gene Therapy Products. US Food Drug Adm. , (2023).
- Kang, L., et al. AAV vectors applied to the treatment of CNS disorders: Clinical status and challenges. J Control Release Off J Control Release Soc. 355, 458-473 (2023).
- De Wolf, D., Singh, K., Chuah, M. K., VandenDriessche, T. Hemophilia gene therapy: The end of the beginning. Hum Gene Ther. 34 (17-18), 782-792 (2023).
- Simons, E. J., Trapani, I. The opportunities and challenges of gene therapy for treatment of inherited forms of vision and hearing loss. Hum Gene Ther. 34 (17-18), 808-820 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten