É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Produção e purificação de vírus adenoassociados em cultura de suspensão por centrifugação por gradiente de densidade de iodixanol para aplicações in vivo
Neste Artigo
Resumo
O vírus adenoassociado é produzido em cultura de células de suspensão e purificado por centrifugação com duplo gradiente de densidade de iodixanol. Etapas são incluídas para aumentar o rendimento total do vírus, diminuir o risco de precipitação do vírus e concentrar ainda mais o produto final do vírus. Os títulos finais esperados atingem 10a 12 partículas virais/mL e são adequados para uso pré-clínico in vivo .
Resumo
Este protocolo descreve a produção e purificação de vírus adenoassociados recombinantes (rAAV) por centrifugação por gradiente de densidade de iodixanol, um método agnóstico de sorotipo para purificação de AAV descrito pela primeira vez em 1999. Os vetores rAAV são amplamente utilizados em aplicações de terapia gênica para entregar transgenes a vários tipos de células humanas. Neste trabalho, o vírus recombinante é produzido pela transfecção de células Expi293 em cultura de suspensão com plasmídeos que codificam os genes transgene, capsídeo vetorial e adenoviral auxiliar. A centrifugação por gradiente de densidade de iodixanol purifica partículas completas de AAV com base na densidade de partículas. Além disso, três etapas são incluídas nesta metodologia agora onipresente para aumentar o rendimento total do vírus, diminuir o risco de precipitação devido a proteínas contaminantes e concentrar ainda mais o produto final do vírus, respectivamente: precipitação de partículas virais do meio celular usando uma solução de polietilenoglicol (PEG) e cloreto de sódio, a introdução de uma segunda rodada de centrifugação por gradiente de densidade de iodixanol, e troca de buffer através de filtro centrífugo. Usando este método, é possível obter consistentemente títulos na faixa de 10a 12 partículas virais/mL de pureza excepcional para uso in vivo .
Introdução
Os vetores virais adenoassociados recombinantes (rAAV) são ferramentas amplamente utilizadas para o tratamento de doenças genéticas, incluindo atrofia muscular espinhal, distrofia retiniana e hemofilia A 1,2,3. Os vetores rAAV são projetados para não ter genes virais presentes no AAV4 selvagem, um vírus icosaédrico pequeno e não envelope com um genoma linear de DNA de fita simples de 4,7 kb. O AAV foi descoberto na década de 1960 como contaminante de preparações de adenovírus5. Apesar de seu pequeno tamanho do capsídeo, que limita o tamanho do transgene que pode ser empacotado a um máximo de 4,9 kb excluindo ITRs6, o AAV é útil para a liberação de transgênicos porque não é patogênico em humanos, permite a expressão de transgênicos em muitos tipos celulares em divisão e não em divisão e tem efeitos imunogênicos limitados7.
Como membros do gênero dependoparvovirus, a produção de rAAVs depende da expressão de genes auxiliares presentes no adenovírus ou herpes simplexvírus 8. Várias estratégias para produzir o rAAV têm sido desenvolvidas, mas a produção em células HEK293 transformadas com os genes auxiliares adenovirais E1A/E1B é o método mais utilizadoatualmente9. A abordagem geral da produção de rAAV começa com a transfecção de células HEK293 com três plasmídeos contendo o transgene dentro de repetições terminais invertidas (ITRs), genes de AAV rep e cap e genes auxiliares adenovirais adicionais, respectivamente. Setenta e duas horas após a transfecção, as células são colhidas e processadas para purificar o rAAV contendo o transgene.
No desenvolvimento de novos vetores de rAAV para fins terapêuticos, um dos principais objetivos é a produção de vetores com maior eficiência de transdução. Um aumento na eficiência de transdução das células-alvo significaria uma diminuição na dose clínica necessária de rAAV, diminuindo, assim, a probabilidade de efeitos imunogênicos adversos que vão desde a neutralização mediada por anticorpos até toxicidades agudas10,11. Para melhorar a eficácia da transdução de vetores rAAV, alterações podem ser feitas no genoma empacotado ou no capsídeo. Métodos viáveis para ajustar a eficácia da transdução via projeto de genoma empacotado incluem a incorporação de promotores fortes e tecido-específicos, seleção cuidadosa de elementos de processamento de mRNA e otimização de sequência de codificação para melhorar a eficiência da tradução12. Alterações no capsídeo são feitas com o objetivo de aumentar o tropismo por tipos celulares humanos alvo. Os esforços para o desenvolvimento de novos capsídeos do vetor de entrega de transgenes rAAV são geralmente caracterizados por um foco no planejamento racional de capsídeos de AAV com mutações específicas visando receptores celulares específicos ou evolução direcionada para identificar capsídeos com tropismo para tipos celulares específicos de bibliotecas combinatórias de capsídeos de alta complexidade sem ter como alvo um receptor específico (embora alguns grupos combinem essas abordagens)13, 14,15. Na abordagem de evolução dirigida, bibliotecas combinatórias do capsídeo são construídas usando uma espinha dorsal do sorotipo particular com regiões variáveis mutadas no exterior do capsídeo16. Bibliotecas combinatórias de capsídeos são frequentemente construídas a partir de sorotipos de AAV não originários de humanos, diminuindo o risco de imunidade preexistente durante o uso clínico10. Portanto, métodos de purificação que podem ser aplicados a qualquer sorotipo são ideais para eliminar a necessidade de otimização sorotipo-específica para os sorotipos menos comumente usados servindo como espinhas dorsais para essas bibliotecas.
A centrifugação por gradiente de densidade de iodixanol é utilizada para purificar altos títulos de VAr com alta infectividade17. Nesse protocolo, o rAAV é produzido em cultura de células de suspensão para diminuir a quantidade de trabalho necessário para produzir grandes títulos de AAV. Uma etapa de centrifugação também está incluída para limpar o lisado celular para reduzir a presença de proteínas contaminantes e diminuir o risco de precipitação do vírus. Este protocolo é um método custo-efetivo para produzir preparações de rAAV de alta pureza, adequadas para uso pré-clínico.
Protocolo
A composição das soluções e buffers utilizados neste protocolo são apresentados na Tabela 1.
| Solução | Composição | |
| Tampão de lise AAV | 1,2 mL de solução de NaCl 5 M | |
| 2 mL de solução 1 M Tris-HCl pH 8,5 | ||
| 80 uL de solução de 1 M MgCl2 | ||
| mQ água até 40 mL | ||
| Solução de precipitação AAV | 40 g PEG 8000 | |
| 50 mL de solução de NaCl 5 M | ||
| mQ água até 100 mL | ||
| Fração de iodixanol a 15% | 7,5 mL de OptiPrep | |
| 3 mL de 10X DPBS | ||
| 6 mL de solução de NaCl 5 M | ||
| 30 uL de solução de 1 M MgCl2 | ||
| mQ a 30 mL | ||
| Fração de 25% de iodixanol | 12. 5 mL de OptiPrep | |
| 3 mL de 10X DPBS | ||
| 30 uL de solução de 1 M MgCl2 | ||
| 60 uL de solução vermelha de fenol | ||
| mQ a 30 mL | ||
| Fração iodixanol 40% | 33,3 mL OptiPrep | |
| 5 mL de 10X DPBS | ||
| 50 uL de solução de 1 M MgCl2 | ||
| mQ a 50 mL | ||
| Fração de iodixanol 60% | 50 mL de OptiPrep | |
| Solução vermelha de fenol 100 uL | ||
| Solução tampão AAV | 8 mL de NaCl 5 M | |
| 20 uL de 10% Pluronic F-68 | ||
| PBS até 200 mL | ||
Tabela 1: Composições das soluções utilizadas neste protocolo.
1. Tripla transfecção de células Expi293
- Sementes Expi293 células (ver Tabela de Materiais) a uma densidade inicial de 5 x 105 células viáveis (vc)/mL.
- Deixar incubar as células a 37 °C com 8% de CO2 e uma velocidade de agitação de 125 rpm até atingirem uma densidade de 3-5 x 106 vc/mL. Monitore a densidade e a viabilidade celular usando a exclusão de azul de tripano com um contador de células automatizado (consulte a Tabela de Materiais).
- Quando as células atingirem a densidade celular desejada, divida-as de 1 a 10 adicionando meios frescos para que seu volume total seja dez vezes maior do que o volume original. Se necessário, transferir as células para um balão maior. Retorno à incubação.
- Continuar a expandir as células conforme descrito nos passos 1.2-1.3 até atingirem uma densidade de pelo menos 2 x 106 vc/ml em 250 ml de meio num balão de 1 L.
- Na véspera da transfecção, diluir as células para 2 x 106 vc/mL em 250 mL de meio, descartando o excesso de células conforme necessário. Incubar as células durante a noite.
- No dia da transfecção, centrifugar metade das células a 58 x g por 5 min a 18 °C. Ressuspender o pellet celular no mesmo volume (125 mL) do meio fresco. A viabilidade celular deve ser próxima de 98%.
- Preparar dois tubos cônicos de 50 mL. Rotule um "PEI" e o outro "DNA".
- No tubo cônico marcado com PEI, diluir 1,2 mL de PEI (Polietilenimina, ver Tabela de Materiais) para um volume total de 12,5 mL em meio OptiMEM.
- No tubo cônico marcado com DNA, preparar uma solução equimolar de DNA plasmidial para um total de 500 μg de DNA em um volume total de 12,5 mL em meio OptiMEM.
- Adicione a solução de DNA à solução de PEI, inverta várias vezes para combinar completamente e deixe incubar à temperatura ambiente por 10 min.
NOTA: É fundamental que a solução de DNA-PEI seja incubada por 10 min para que o PEI forme complexos carregados com o DNA. - Após a incubação da solução de DNA-PEI por 10 min, use uma pipeta sorológica para aplicar lentamente a solução de DNA-PEImax nas células Expi293. Retornar as células transfectadas à incubadora e deixá-las incubar por 72 h (Figura 1).
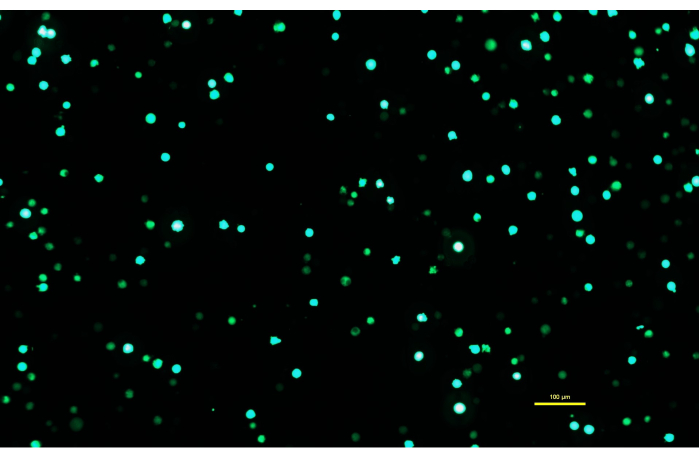
Figura 1: Expi293 células expressando GFP dois dias após a transfecção. Após a transfecção com um plasmídeo contendo um gene para GFP, as células Expi293 expressam transitoriamente eGFP. A morfologia celular é redonda. A imagem foi capturada com um tempo de exposição de 15 ms. As imagens do microscópio são adquiridas utilizando-se microscópio invertido equipado com iluminação por epifluorescência e objetiva de 10x/0,30. Barra de escala = 100 μm. Clique aqui para ver uma versão maior desta figura.
2. purificação do vetor rAAV
- Após 72 h, transferir as células em suspensão para dois tubos cônicos de 250 mL e girá-las para baixo a 415 x g por 10 min a 4 °C.
- Despeje o sobrenadante em um tubo cônico fresco de 500 mL e armazene a 0 °C em gelo para processamento posterior.
- Ressuspender cada pastilha celular em 10 mL de tampão de lise AAV (Tabela 1). Junte os dois lisados em um dos tubos. Enxaguar o outro tubo com mais 5 mL de tampão de lise AAV e, em seguida, adicioná-lo aos lisados agrupados. Congelar a -70 °C.
Observação : o experimento pode ser pausado neste ponto. Conservar o sobrenadante a -70 °C em vez de no gelo. - Adicionar o volume 1:4 da solução de precipitação de AAV ao meio sobrenadante do passo 2.2. Inverter várias vezes para misturar completamente e incubar a 0 °C no gelo durante pelo menos 2 h ou durante a noite.
- Centrifugar a solução incubada a 3000 x g durante 1 h a 4 °C.
- Eliminar o sobrenadante e ressuspender o pellet contendo precipitado viral em 5 mL de tampão de lise AAV.
- Descongelar o lisado celular a 37 °C em banho-maria.
- Junte o precipitado viral com o lisado celular. Este é o lisado bruto. Enxaguar o tubo de centrifugação que continha o precipitado viral com mais 5 mL de tampão de lise AAV e agrupar com o lisado bruto.
- Congelar o lisado bruto a -70 °C e, em seguida, descongelar a 37 °C. Repita este ciclo mais uma vez.
NOTA: O lisado bruto não deve ser deixado a 37 °C durante mais tempo do que o necessário para o descongelar. - Uma vez descongelado pela terceira vez, adicionar imediatamente 4 μL de benzonase ao lisado bruto, inverter para misturar e incubar durante 30 minutos a 37 °C.
- Centrifugar o lisado bruto durante 10 min a 650 x g a 18 °C.
- Transfira o sobrenadante para um tubo cônico limpo de 50 mL. Este é o vírus bruto. Descarte o pellet.
- Centrifugar o vírus bruto durante mais 30 minutos a 3000 x g a 18 °C para eliminar as proteínas contaminantes.
- Transfira o sobrenadante para um tubo cônico limpo de 50 mL. Este é o vírus esclarecido.
Observação : o experimento pode ser pausado neste ponto. Congelar o vírus clarificado a -70 °C. - Configure a bomba peristáltica multicanal com quatro tubos peristálticos (ver Tabela de Materiais). Fixar capilares em ambas as extremidades de cada tubo.
- Coloque os capilares no lado de entrada da bomba em um copo cheio de água deionizada. Coloque os capilares no lado de saída da bomba em um copo vazio. Acione a bomba peristáltica a 25,0 rpm para lavar a tubulação com água deionizada (DI).
- Quando estiver completamente lavado, esvazie a tubulação peristáltica acionando a bomba até que a tubulação seja preenchida apenas com ar. Coloque todos os capilares em um lenço limpo sem fiapos.
- Coloque quatro tubos de ultracentrífuga em um rack no lado de saída da bomba.
- Use uma pipeta sorológica de 10 mL para distribuir cuidadosamente 10 mL de vírus clarificado em cada tubo de ultracentrífuga. Tome cuidado para não introduzir bolhas de ar.
NOTA: O volume de vírus clarificado em cada tubo pode ser esticado até 12 mL por tubo, se necessário. Reduza a quantidade de iodixanol a 60% adequadamente no passo 2.25 abaixo. - O vírus clarificado é coberto com frações de iodixanol (Tabela 1) da menor densidade para a maior densidade usando a bomba peristáltica. A fração de 15% é adicionada primeiro, seguida pela fração de 25%, a fração de 40% e, finalmente, a fração de 60%. Transferir 22 mL (5,5 mL por tubo de ultracentrífuga) da fração de iodixanol a 15% para um tubo cônico limpo de 50 mL. Coloque os capilares no lado de entrada da bomba para dentro do tubo, tomando cuidado para que todos os capilares estejam tocando o fundo do tubo.
- Ligue a bomba e deixe a tubulação encher com a fração de iodixanol. Quando a fração iodixanol atingir as extremidades dos capilares no lado de saída da bomba, pare a bomba.
- Insira um capilar de saída em cada tubo de ultracentrífuga com vírus clarificado, tomando cuidado para que os capilares estejam tocando o fundo de cada tubo de ultracentrífuga.
OBS: É de fundamental importância que não haja mais ar nos capilares. O iodixanol pode fluir através da tubulação peristáltica a taxas ligeiramente diferentes, portanto, certifique-se de que cada capilar de saída individual seja completamente preenchido com iodixanol antes de inseri-lo no vírus clarificado. Pode ser necessário parar e ligar a bomba várias vezes. - Ligue a bomba e deixe os tubos ultracentrífugos encherem. Quando o último da fração de 15% estiver prestes a ser levado para os capilares de entrada, pare a bomba. É fundamental que nenhuma bolha de ar entre na tubulação peristáltica.
NOTA: Se bolhas de ar entrarem nos capilares de entrada, a bomba pode ser executada brevemente no sentido inverso para empurrá-los de volta para fora. - Transferir 22 mL (5,5 mL por tubo ultracentrífugo) da fração de iodixanol a 25% para o tubo cônico de 50 mL. Tome cuidado para que todos os capilares estejam tocando o fundo do tubo e ligue a bomba. Quando o último da fração de 25% estiver prestes a ser levado para os capilares de entrada, pare a bomba.
- Repetir o passo 2,24 com 20 mL (5 mL por tubo de ultracentrífuga) da fração iodixanol 40% e, em seguida, com 24 mL (6 mL por tubo ultracentrífugo) da fração 60%.
- Se ainda houver volume não preenchido no tubo da ultracentrífuga, continue a adicionar mais da fração de 60% até que os tubos da ultracentrífuga estejam completamente cheios de líquido.
- Encha cada tubo até que o lisado faça uma cúpula por cima, mas não transborde do tubo. Pare a bomba e remova cuidadosamente cada capilar de saída, tomando cuidado para não perturbar o gradiente de iodixanol.
- Tampe cada tubo ultracentrífugo com um espaçador e carregue-o em um rotor Tipo 70 Ti (consulte a Tabela de Materiais).
NOTA: Certifique-se de que o rotor está adequadamente equilibrado. Não tente operar a ultracentrífuga sem o treinamento adequado. - Coloque o rotor Tipo 70 Ti na ultracentrífuga e centrifugar a 489.000 x g por 1 h a 18 °C.
- Após a centrifugação, descarregue o rotor da ultracentrífuga. Use alicates nasais de agulha para remover cuidadosamente cada tubo ultracentrífugo do rotor, tomando cuidado para não perturbar o gradiente de iodixanol.
- Use um suporte de anel de apoio com braçadeira para fixar um tubo ultracentrífugo.
- Coloque uma agulha de 20 GA a uma seringa de 5 mL e reserve. Use um lenço sem fiapos para remover a tampa do tubo de ultracentrífuga.
- Penetrar na parede do tubo de ultracentrífuga com a agulha cerca de 3 mm abaixo da interface iodixanol 40%-60% (Figura 2).
- Aspirar lentamente a interface e parte da fração de 40%. Evite aspirar o topo da fração de 40%, para um sorteio total de cerca de 4 mL.
- Segurando um dedo sobre a parte superior aberta do tubo de ultracentrífuga, puxe a seringa e transfira a fração de AAV aspirado para um tubo cônico de 50 mL. Descarte a seringa em um recipiente para materiais perfurocortantes. Descarte o tubo ultracentrífugo.
- Repita as etapas 2.31-2.35 para cada tubo de ultracentrífuga.
- Diluir a fração aspirada de AAV aproximadamente duas vezes em tampão de lise de AAV para um volume de 40 mL.
- Lavar a tubulação peristáltica conforme descrito nas etapas 2.16-2.17.
Observação : o experimento pode ser pausado neste ponto. Conservar a fracção de AAV diluída a 0 °C durante a noite. - Carregar 20 mL de cada fração diluída de AAV em dois novos tubos de ultracentrífuga.
- Para a segunda rodada de centrifugação por gradiente de densidade de iodixanol, a fração diluída de AAV é submersa como descrito acima usando apenas 10 mL (5 mL por tubo de ultracentrífuga) da fração de 40% e 14 mL (7 mL por tubo de ultracentrífuga) da fração de 60%. Repita os passos 2.29-2.36 para ultracentrifugação e aspiração.
NOTA: Antes de armazenar a bomba peristáltica e a tubulação, lave a tubulação com água DI conforme descrito nas etapas 2.16-2.17.

Figura 2: Gradiente de iodixanol com interface iodixanol marcada com 40%-60%. (A) Primeiro gradiente de iodixanol. O vermelho de fenol é usado nas frações de iodixanol 40% e iodixanol 60%. Aparece como uma cor diferente por causa da diferença de pH entre as duas frações. A seta indica onde a seringa deve ser inserida para colher a fração rAAV, logo abaixo da interface iodixanol 40%-60%. (B) Segundo gradiente de iodixanol. Apenas as frações iodixanol 40% e 60% são utilizadas nesta etapa. A seta indica onde a seringa deve ser inserida para colher a fração rAAV. Clique aqui para ver uma versão maior desta figura.
3. Troca de tampão e concentração do vírus
- Após obter a fração AAV da segunda rodada de centrifugação do gradiente de densidade de iodixanol, dilua-a duas vezes com solução tampão de AAV.
- Equilibrar o filtro centrífugo adicionando 20 mL de solução tampão AAV à parte superior do filtro. Centrifugar o aparelho a 3000 x g a 18 °C durante 5 min e eliminar o fluxo.
- Adicionar a fracção AAV diluída ao filtro centrífugo. Centrifugar o aparelho a 3000 x g a 18 °C durante 5 min e eliminar o fluxo.
- Adicionar 20 ml de solução tampão AAV à parte superior do filtro. Centrifugar o aparelho a 3000 x g a 18 °C durante 5 min e eliminar o fluxo.
NOTA: Se a membrana do filtro centrífugo ficar bloqueada, fazendo com que a solução flua de forma ineficiente, use cuidadosamente uma micropipeta P200 para puxar para cima e para baixo a solução na parte superior do filtro. Tome extremo cuidado para não tocar no filtro com a ponta da micropipeta. - Repita a etapa 3.4 mais duas vezes.
NOTA: Certifique-se de que o AAV não está excessivamente concentrado, mantendo pelo menos 1 mL de volume na parte superior do filtro. Pode ser necessário ajustar os tempos de centrifugação para evitar a concentração excessiva. Se o AAV estiver superconcentrado, pode ocorrer precipitação. - Para um título final na faixa de 10a 12 vg/mL, gire o vírus para um volume final de cerca de 1 mL.
NOTA: Dependendo da espinha dorsal do sorotipo usado e da eficiência da embalagem do vírus, você pode ter que concentrar o vírus em um volume menor. - Use uma micropipeta p1000 para transferir o AAV concentrado da parte superior do filtro centrífugo para um tubo de microcentrífuga. Use uma micropipeta p200 para lavar o filtro centrífugo com 50 μL de tampão AAV para coletar qualquer vírus restante e agrupar com o restante do AAV concentrado.
- Separe uma alíquota de 2 μL do AAV concentrado para titulação. Consulte a Tabela Suplementar 1 para visualizar os primers ITR que podem ser usados para qPCR.
- Passe o AAV concentrado através de um filtro de seringa de 0,2 μm para esterilizá-lo.
NOTA: Ao esterilizar um pequeno volume, tenha o cuidado de selecionar um filtro de seringa com um diâmetro pequeno, a fim de minimizar a perda de vírus. O uso de um filtro de ligação de baixa proteína de um pequeno diâmetro resultará em perda viral mínima (dados não mostrados). - O AAV esterilizado pode ser usado imediatamente para transduzir células ou armazenado a 4 °C para uso dentro de quatro semanas. Deve ser armazenado a -70 °C para armazenamento a longo prazo.
Resultados
Este método pode ser usado para obter títulos de pelo menos10 a 12 partículas virais por mL. Um título pode ser obtido (Figura 3) por qPCR usando os primers ITR fornecidos na Tabela Suplementar 1, por ddPCR ou por qualquer outro método de titulação. Títulos subótimos podem resultar do uso de um gene de tampa que codifica um capsídeo com baixa eficiência de embalagem.
Outra possível fonte de resultados subótimos é ...
Discussão
O protocolo de purificação com gradiente de densidade de iodixanol duplo é o método universal, pois é aplicável a qualquer variante mutante do AAV, independentemente de sua especificidade receptora. Os primeiros métodos de purificação de AAV baseavam-se na densidade de partículas e incluíam centrifugação isopicnica em CsCl e centrifugação contínua por gradiente de densidade de sacarose19. Posteriormente, foram desenvolvidas abordagens sorotipo-específicas, que utilizaram anticorpo...
Divulgações
Os autores não têm divulgações a relatar.
Agradecimentos
Nenhum.
Materiais
| Name | Company | Catalog Number | Comments |
| 5810 R benchtop centrifuge | Eppendorf | 22625501 | |
| 8-channel peristaltic pump | Watson-Marlow | 020.3708.00A | |
| Automated cell counter | NanoEntek | EVE-MC | |
| Avanti J-E high-speed centrifuge | Beckman Coulter | 369001 | |
| Benzonase | Thermo Scientific | 88701 | |
| Biological safety cabinet | Labconco | 322491101 | |
| CO2 incubator with shaker | Set at 8% CO2 and 37 °C | ||
| Conical centrifuge tubes | Thermo Scientific | 339652 | 50 mL |
| Conical centrifuge tubes | Thermo Scientific | 339650 | 15 mL |
| Disposable micro-pipets | Fisherbrand | 21-164-2G | Capillaries |
| Dulbecco's phosphate buffered saline without CaCl2 and MgCl2 (DPBS) (10x) | Sigma-Aldrich | D1408 | |
| ECLIPSE Ts2R-FL inverted microscope | Nikon | ||
| Expi293 Expression Medium | Gibco | A1435101 | |
| Expi293F cells | Gibco | A14527 | |
| Filter tips | USA Scientific | 1126-7810 | 1000 µL |
| Filter tips | USA Scientific | 1120-8810 | 200 µL |
| Filter tips | USA Scientific | 1120-1810 | 20 µL |
| Filter tips | USA Scientific | 1121-3810 | 10 µL |
| Hypodermic needles | Tyco Healthcare | 820112 | 20 GA x 1-1/2 A |
| Ice bucket with lid | VWR | 10146-184 | |
| JS-5.3 rotor | Beckman Coulter | 368690 | |
| Magnesium chloride solution (1 M) | Millipore Sigma | M1028-100ML | |
| Metal stand and clamp | Fisherbrand | 05-769-6Q | |
| Microcentrifuge tubes | Eppendorf | 22600028 | 1.5 mL |
| Needle nose pliers | |||
| Optima XE-90 ultracentrifuge | Beckman Coulter | A94471 | |
| Opti-MEM I Reduced-Serum Medium | Gibco | 31985062 | |
| OptiPrep density gradient media (iodixanol) | Serumwerk | AXS-1114542 | 60% iodixanol solution |
| P1000 Pipet | Gilson | F144059M | |
| P2 Pipet | Gilson | F144054M | |
| P20 Pipet | Gilson | F144056M | |
| P200 Pipet | Gilson | F144058M | |
| Phenol red solution | Sigma-Aldrich | P0290 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich | P4474 | |
| Pipet-Aid XP pipette controller | Drummond Scientific | 4-000-101 | |
| Plasmid pCapsid | De novo or Addgene, etc. | N/A | We used pACGrh74. |
| Plasmid pHelper | Addgene | 112867 | |
| Plasmid pTransgene | De novo or Addgene, etc. | N/A | We used pdsAAV-GFP. |
| Pluronic F-68 polyol solution (10%) | Mp Biomedicals | 92750049 | |
| Polyethylene glycol 8000 | Research Products International | P48080-500.0 | |
| Polyethylenimine HCl Max (PEI-Max) | Polysciences | NC1038561 | Dilute in water to 40 μM |
| Polypropylene centrifuge tubes, sterile | Corning | 431123 | 500 mL |
| Polypropylene centrifuge tubes, sterile | Corning | 430776 | 250 mL |
| Polypropylene Optiseal tubes | Beckman Coulter | 361625 | |
| Serological pipettes | Alkali Scientific | SP250-B | 50 mL |
| Serological pipettes | Alkali Scientific | SP225-B | 25 mL |
| Serological pipettes | Alkali Scientific | SP210-B | 10 mL |
| Serological pipettes | Alkali Scientific | SP205-B | 5 mL |
| Shaker flasks | Fisherbrand | PBV1000 | 1 L |
| Shaker flasks | Fisherbrand | PBV50-0 | 500 mL |
| Shaker flasks | Fisherbrand | PBV250 | 250 mL |
| Shaker flasks | Fisherbrand | PBV12-5 | 125 mL |
| Sodium chloride solution (5 M) | Fisher Scientific | NC1752640 | |
| Sterile syringes | Fisherbrand | 14-955-458 | 5 mL |
| Syringe filter | Millipore | SLGV013SL | 0.22 micron |
| Tris-HCl pH 8.5 (1 M) | Kd Medical | RGE3363 | |
| Trypan blue solution | Gibco | 15250061 | |
| Tube rack assembly | Beckman Coulter | 361646 | |
| Tube spacers (x4) | Beckman Coulter | 361669 | |
| Tubing for peristaltic pump | Fisher Scientific | 14190516 | |
| Type 70 Ti fixed-angle titanium rotor | Beckman Coulter | 337922 | |
| Ultra low temperature freezer | Set at -70 °C | ||
| Vivaspin 20 centrifugal concentrator | Sartorius | VS2041 | |
| Water bath | Set at 37 °C |
Referências
- Strauss, K. A., et al. Onasemnogene abeparvovec for presymptomatic infants with three copies of SMN2 at risk for spinal muscular atrophy: the Phase III SPR1NT trial. Nat Med. 28 (7), 1390-1397 (2022).
- Fuller-Carter, P. I., Basiri, H., Harvey, A. R., Carvalho, L. S. Focused update on AAV-based gene therapy clinical trials for inherited retinal degeneration. BioDrugs. 34 (6), 763-781 (2020).
- George, L. A., et al. Multiyear factor VIII expression after AAV gene transfer for hemophilia A. N Engl J Med. 385 (21), 1961-1973 (2021).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-Associated Virus (AAV) as a vector for gene therapy. Biodrugs. 31 (4), 317-334 (2017).
- Atchison, R. W., Casto, B. C., Hammon, W. M. c. D. Adenovirus-associated defective virus particles. Science. 149 (3685), 754-756 (1965).
- Wu, Z., Yang, H., Colosi, P. Effect of genome size on AAV vector packaging. Mol Ther. 18 (1), 80-86 (2010).
- Samulski, R. J., Muzyczka, N. AAV-mediated gene therapy for research and therapeutic purposes. Annu Rev Virol. 1 (1), 427-451 (2014).
- Zolotukhin, S. Production of recombinant adeno-associated virus vectors. Hum Gene Ther. 16 (5), 551-557 (2005).
- Penaud-Budloo, M., François, A., Clément, N., Ayuso, E. Pharmacology of recombinant adeno-associated virus production. Mol Ther - Methods Clin Dev. 8, 166-180 (2018).
- Costa-Verdera, H., et al. Understanding and Tackling immune responses to adeno-associated viral vectors. Hum Gene Ther. 34 (17-18), 836-852 (2023).
- Ertl, H. C. J. Mitigating serious adverse events in gene therapy with AAV Vectors: Vector dose and immunosuppression. Drugs. 83 (4), 287-298 (2023).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Marsic, D., et al. Vector design tour de force: Integrating combinatorial and rational approaches to derive novel adeno-associated virus variants. Mol Ther. 22 (11), 1900-1909 (2014).
- Grimm, D., Zolotukhin, S. E Pluribus Unum: 50 Years of research, millions of viruses, and one goal-tailored acceleration of AAV evolution. Mol Ther. 23 (12), 1819-1831 (2015).
- Biswas, M., et al. Engineering and in vitro selection of a novel AAV3B variant with high hepatocyte tropism and reduced seroreactivity. Mol Ther - Methods Clin Dev. 19, 347-361 (2020).
- Perabo, L., et al. In vitro selection of viral vectors with modified tropism: the adeno-associated virus display. Mol Ther. 8 (1), 151-157 (2003).
- Crosson, S. M., Dib, P., Smith, J. K., Zolotukhin, S. Helper-free production of laboratory grade AAV and purification by iodixanol density gradient centrifugation. Mol Ther - Methods Clin Dev. 10, 1-7 (2018).
- Chan, C., Harris, K. K., Zolotukhin, S., Keeler, G. D. Rational design of AAV-rh74, AAV3B, and AAV8 with limited liver targeting. Viruses. 15 (11), 2168 (2023).
- Schmidt, O. W., Cooney, M. K., Foy, H. M. Adeno-associated virus in adenovirus type 3 conjunctivitis. Infect Immun. 11 (6), 1362-1370 (1975).
- Grimm, D., Kern, A., Rittner, K., Kleinschmidt, J. A. Novel tools for production and purification of recombinant adenoassociated virus vectors. Hum Gene Ther. 9 (18), 2745-2760 (1998).
- Zolotukhin, S., et al. Recombinant adeno-associated virus purification using novel methods improves infectious titer and yield. Gene Ther. 6 (6), 973-985 (1999).
- Clark, K. R., Liu, X., Mcgrath, J. P., Johnson, P. R. Highly purified recombinant adeno-associated virus vectors are biologically active and free of detectable helper and wild-type viruses. Hum Gene Ther. 10 (6), 1031-1039 (1999).
- Debelak, D., et al. Cation-exchange high-performance liquid chromatography of recombinant adeno-associated virus type 2. J Chromatogr B Biomed Sci App. 740 (2), 195-202 (2000).
- Burova, E., Ioffe, E. Chromatographic purification of recombinant adenoviral and adeno-associated viral vectors: methods and implications. Gene Ther. 12 (1), S5-S17 (2005).
- Adams, B., Bak, H., Tustian, A. D. Moving from the bench towards a large scale, industrial platform process for adeno-associated viral vector purification. Biotechnol Bioeng. 117 (10), 3199-3211 (2020).
- Grieger, J. C., Choi, V. W., Samulski, R. J. Production and characterization of adeno-associated viral vectors. Nat Protoc. 1 (3), 1412-1428 (2006).
- Florea, M., et al. High-efficiency purification of divergent AAV serotypes using AAVX affinity chromatography. Mol Ther Methods Clin Dev. 28, 146-159 (2022).
- Chamberlain, K., Riyad, J. M., Weber, T. Expressing transgenes that exceed the packaging capacity of adeno-associated virus capsids. Hum Gene Ther Methods. 27 (1), 1-12 (2016).
- Green, E. A., Hamaker, N. K., Lee, K. H. Comparison of vector elements and process conditions in transient and stable suspension HEK293 platforms using SARS-CoV-2 receptor binding domain as a model protein. BMC Biotechnol. 23 (1), 7 (2023).
- Erbacher, P., Zou, S., Bettinger, T., Steffan, A. M., Remy, J. S. Chitosan-based vector/DNA complexes for gene delivery: Biophysical characteristics and transfection ability. Pharm Res. 15 (9), 1332-1339 (1998).
- Vandenberghe, L. H., et al. Efficient serotype-dependent release of functional vector into the culture medium during adeno-associated virus manufacturing. Hum Gene Ther. 21 (10), 1251-1257 (2010).
- Summerford, C., Samulski, R. J. Membrane-associated heparan sulfate proteoglycan is a receptor for adeno-associated virus type 2 virions. J Virol. 72 (2), 1438-1445 (1998).
- Wright, J. F., et al. Identification of factors that contribute to recombinant AAV2 particle aggregation and methods to prevent its occurrence during vector purification and formulation. Mol Ther. 12 (1), 171-178 (2005).
- Gruntman, A. M., et al. Stability and compatibility of recombinant adeno-associated virus under conditions commonly encountered in human gene therapy trials. Hum Gene Ther Methods. 26 (2), 71-76 (2015).
- Srivastava, A. Rationale and strategies for the development of safe and effective optimized AAV vectors for human gene therapy. Mol Ther Nucleic Acids. 32, 949-959 (2023).
- Mullard, A. FDA approves first gene therapy for Duchenne muscular dystrophy, despite internal objections. Nat Rev Drug Discov. 22 (8), 610-610 (2023).
- Center for Biologics Evaluation and Research. Approved Cellular and Gene Therapy Products. US Food Drug Adm. , (2023).
- Kang, L., et al. AAV vectors applied to the treatment of CNS disorders: Clinical status and challenges. J Control Release Off J Control Release Soc. 355, 458-473 (2023).
- De Wolf, D., Singh, K., Chuah, M. K., VandenDriessche, T. Hemophilia gene therapy: The end of the beginning. Hum Gene Ther. 34 (17-18), 782-792 (2023).
- Simons, E. J., Trapani, I. The opportunities and challenges of gene therapy for treatment of inherited forms of vision and hearing loss. Hum Gene Ther. 34 (17-18), 808-820 (2023).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados