A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التحليل الطيفي بالأشعة تحت الحمراء القريبة أثناء احتقان الدم التفاعلي لتقييم وظيفة الأوعية الدموية للأطراف السفلية
In This Article
Summary
هنا ، نصف نهجا غير جراحي باستخدام التحليل الطيفي للأشعة تحت الحمراء القريبة لتقييم احتقان الدم التفاعلي في الطرف السفلي. يوفر هذا البروتوكول تقييما موحدا لاستجابة الأوعية الدموية والأوعية الدموية الدقيقة التي يمكن استخدامها لتحديد وجود خلل وظيفي في الأوعية الدموية وكذلك فعالية التدخلات العلاجية.
Abstract
تساهم أمراض الأوعية الدموية في الطرف السفلي بشكل كبير في العبء العالمي لأمراض القلب والأوعية الدموية والأمراض المصاحبة مثل مرض السكري. الأهم من ذلك ، يمكن أن يحدث خلل وظيفي في الأوعية الدموية الدقيقة قبل أو جنبا إلى جنب مع أمراض الأوعية الدموية الكبيرة ، وكلاهما يحتمل أن يساهم في أعراض المريض وعبء المرض. هنا ، نصف نهجا غير جراحي باستخدام التحليل الطيفي للأشعة تحت الحمراء القريبة (NIRS) أثناء احتقان الدم التفاعلي ، والذي يوفر تقييما موحدا لوظيفة الأوعية الدموية للأطراف السفلية (dys) وطريقة محتملة لتقييم فعالية التدخلات العلاجية. على عكس الطرق البديلة ، مثل الموجات فوق الصوتية المحسنة بالتباين ، لا يتطلب هذا النهج وصولا وريديا أو تحليلا متطورا للصور ، وهو غير مكلف وأقل اعتمادا على المشغل. يتضمن هذا الوصف لطريقة NIRS نتائج تمثيلية ومصطلحات قياسية إلى جانب مناقشة اعتبارات القياس والقيود والطرق البديلة. سيؤدي التطبيق المستقبلي لهذا العمل إلى تحسين توحيد تصميم أبحاث الأوعية الدموية ، وإجراءات جمع البيانات ، وإعداد التقارير المنسقة ، وبالتالي تعزيز نتائج البحوث الانتقالية في مجالات وظيفة الأوعية الدموية للأطراف السفلية (DYS) والمرض والعلاج.
Introduction
أمراض القلب والأوعية الدموية (CVD) هي المساهم الرئيسي في الوفيات العالمية1. في حين أن احتشاء عضلة القلب والسكتة الدماغية هي المظاهر الأكثر شيوعا للأمراض القلبية الوعائية ، فإن أمراض الأوعية الدموية في الأطراف السفلية ، مثل أمراض الشرايين الطرفية (PAD) وأمراض القدم السكرية ، تساهم بشكل كبير في العبء الشخصي والاجتماعي والرعاية الصحية للأمراض القلبية الوعائية2،3،4. الأهم من ذلك ، تتميز هذه الحالات المرضية بخلل وظيفي في الأوعية الدموية الدقيقةوالأوعية الدموية الكبيرة 5 التي تساهم في الأعراض (على سبيل المثال ، العرج المتقطع) ، والضعف الوظيفي ، وضعف الحركة ، فضلا عن العزلة الاجتماعية وانخفاض نوعية الحياة6. تاريخيا ، تم استخدام تقنيات تقييم الأوعية الدموية للأطراف العلوية كمقياس لوظيفة الأوعية الدموية الجهازية والمخاطر القلبية الوعائية المرتبطة بها. ومع ذلك ، من المحتمل ألا تكون هذه الطرق حساسة للإعاقات الموضعية في وظيفة الأوعية الدموية للأطراف السفلية 7,8. في حين أن هناك حاليا مجموعة من التقنيات المستخدمة لتقييم وظيفة الأوعية الدموية في الطرف السفلي ، مثل التوسع بوساطة التدفق (FMD) والموجات فوق الصوتية المحسنة بالتباين ، فإن كل طريقة لها عيوب وقيود ، مثل تكلفة المعدات أو مهارة المشغل أو الحاجة إلى الوصول الوريدي الغازي. لهذه الأسباب ، هناك حاجة إلى تقنيات موحدة وفعالة لتقييم وظيفة الأوعية الدموية للأطراف السفلية (dys) التي يمكن تنفيذها بسهولة أكبر في البيئات البحثية والسريرية.
التحليل الطيفي للموجة المستمرة القريبة من الأشعة تحت الحمراء (CW-NIRS) هو طريقة غير جراحية ومنخفضة التكلفة ومحمولة تحدد التغيرات النسبية في أكسجة الهيموجلوبين في الجسم الحي. نظرا لأن إشارات الهيموجلوبين المؤكسجة وغير المؤكسجة NIRS مشتقة من الأوعية الصغيرة (قطرها <1 مم) ، يمكن تقييم استقلاب العضلات الهيكلية المحلية ووظيفة الأوعية الدموية الدقيقة9. على وجه التحديد ، يوفر مؤشر تشبع الأنسجة (TSI) [TSI = الهيموغلوبين المؤكسج / (الهيموغلوبين المؤكسج + الهيموغلوبين غير المؤكسج) × 100] ، مقياسا كميا لأكسجة الأنسجة9. عند قياسها قبل وأثناء وبعد الانسداد واحتقان الدم التفاعلي ، تشير التغييرات في TSI إلى استجابة الأوعية الدموية "للعضو النهائي" ، بالنسبة إلى خط الأساس قبل الانسداد. الأهم من ذلك ، أن هذه الطريقة حساسة للتغيرات في استجابة الأوعية الدموية الدقيقة للعضلات والتروية المرتبطة بالشيخوخة10 ، وتطور المرض11 ، والتدخلات السريرية (على سبيل المثال ، جراحة إعادة التوعي12،13 أو إعادة تأهيل التمرين14،15،16،17) في الأفراد الذين يعانون من خلل وظيفي في الأوعية الدموية الدقيقة أو معرضين لخطر الإصابة به.
أدى توافر أنظمة NIRS إلى ارتفاع سريع في عدد الدراسات البحثية التي تبلغ عن وظيفة الأوعية الدموية الدقيقة18. ومع ذلك ، فإن الاختلافات في بروتوكولات اختبار احتقان الدم التفاعلي ، وإغفال طرق NIRS التفصيلية والقابلة للتكرار ، فضلا عن عدم التوحيد في وصف وعرض وتحليل معلمات استجابة NIRS تجعل المقارنات عبر التجارب الفردية صعبة. هذا يحد من تجميع البيانات للتحليل التلوي وصياغة توصيات التقييم السريري 9,15.
لذلك ، في هذه المقالة ، نصف بروتوكولات NIRS وبروتوكولات اختبار انسداد الأوعية الدموية القياسية في مختبرنا لتقييم احتقان الدم التفاعلي للأطراف السفلية. من خلال نشر هذه الأساليب ، نهدف إلى المساهمة في تحسين توحيد وتكرار إجراءات جمع البيانات وتنسيق التقارير.
Protocol
تمت الموافقة على جميع الطرق الموضحة هنا من قبل لجنة أخلاقيات البحث البشري بجامعة صن شاين كوست. وعلاوة على ذلك، أعطى جميع المشاركين موافقتهم الخطية المستنيرة على المشاركة في القياسات المبينة في هذا البروتوكول. يرجى ملاحظة أن اختبار انسداد الأوعية الدموية في الطرف السفلي هو بطلان في الأفراد الذين سبق لهم إجراء إعادة التوعي التي تنطوي على ترقيع الأوعية الدموية أو الدعامات في الشرايين الفخذية أو المأبضية. بعد إعداد المعدات ، يطلب من المشارك الراحة في وضع ضعيف لمدة 10 دقائق. في هذه المرحلة ، يبدأ جمع بيانات NIRS ، مع فترة أولية 2 دقيقة ، مما يسمح بتحقيق استقرار إشارات NIRS. ثم يتم جمع بيانات خط الأساس لمدة 1 دقيقة ، وعند هذه النقطة يتم نفخ الكفة الموجودة في الفخذ على الفور لتحقيق انسداد الشرايين. يتم الحفاظ على الانسداد لمدة 5 دقائق قبل تفريغ الكفة بسرعة. يستمر جمع البيانات طوال فترة احتقان الدم التفاعلي حتى تتعافى الإشارات إلى خط الأساس. يوضح الشكل 1 نظرة عامة على بروتوكول احتقان الدم التفاعلي ، والخطوات التفصيلية مذكورة أدناه. المعدات المستخدمة في الدراسة مدرجة في جدول المواد.
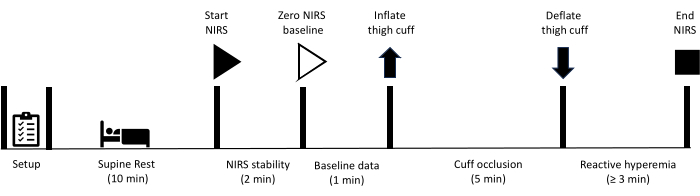
الشكل 1: رسم تخطيطي يحدد بروتوكول قياس احتقان الدم التفاعلي NIRS وتوقيتاته. NIRS: التحليل الطيفي للأشعة تحت الحمراء القريبة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. إعداد المعدات
ملاحظة: يمكن استخدام مختلف NIRS ، وتضخم الكفة / انسداد ، وأنظمة جمع البيانات للحصول على النتائج التمثيلية الموضحة أدناه. من المهم أن يراجع الباحثون أدلة المستخدم الخاصة بهم وأن يكونوا على دراية بالبرامج الفريدة والمعايرة والإضاءة المحيطة والاعتبارات الخاصة بالمشاركين / الفوج.
- تأكد من إجراء جميع القياسات في غرفة هادئة يتم التحكم في درجة حرارتها (21-23 درجة مئوية).
- تأكد من توفر جميع المعدات والمواد (انظر جدول المواد).
- تأكد من أن جهاز CW-NIRS والكمبيوتر الذي يرسل إليه الجهاز مشحونان بالكامل ويعملان بالطاقة.
- تحقق من أن جهاز NIRS مقترن بالكمبيوتر الذي يعرض بيانات NIRS عبر Bluetooth وأن معلمات القياس لوحدة NIRS محددة وفقا للموقع التجريبي وتصميم الدراسة (مثال: تحديد عامل طول المسار التفاضلي (DPF) لضوء الأشعة تحت الحمراء القريبة).
ملاحظة: تستند معظم خطوات بروتوكول NIRS وإعدادات النظام إلى مجموعة من توصيات الشركة المصنعة وخبرة الباحثين ورأي الخبراء / الإجماع. كن على علم بأن القيم التي تم إنشاؤها أثناء القياس تعتمد على الجهاز المعين والمجسات المستخدمة بالإضافة إلى الإعدادات المختارة في برنامج الجهاز. هناك أيضا إمكانية لدرجة عالية من التباين بين الأفراد في الإشارات التي تم جمعها. علاوة على ذلك ، للسماح بمقارنة محسنة بين الدراسات ، من المهم الإبلاغ عن تفاصيل أجهزة NIRS (على سبيل المثال ، بما في ذلك تصميم المسبار ، ومسافات فصل المصدر والكاشف والأطوال الموجية المستخدمة) ، وإعدادات النظام ، وموضع / اتجاه المسبار فيما يتعلق بهندسة العضلات ومعلمات التحليل / معالجة البيانات عند نشر النتائج من هذه القياسات. - أدخل بيانات المشارك وفقا لتفاصيل برنامج جهاز NIRS.
- قم بتوصيل منفاخ الكفة السريع بمصادر الهواء والطاقة.
2. إعداد المشاركين
- تأكد من أن المشارك قد قرأ بيان معلومات المشارك ونموذج الموافقة وأعطى موافقته على المشاركة في القياس قبل البدء.
- اشرح للمشارك ما يمكن توقعه أثناء القياس أثناء خلع أحذيته وجواربه والوقوف ثابتا لإجراء القياسات البشرية ذات الصلة.
- خذ قياس ثنايا الجلد (في ثلاث نسخ) على موقع قياس NIRS المخطط له (على سبيل المثال ، على الجانب الإنسي عند نقطة محيط ربلة الساق الأقصى).
ملاحظة: يسمح هذا بتأكيد عمق الجلد والأنسجة الدهنية (يشار إليها بشكل روتيني باسم سمك الأنسجة الدهنية - ATT) فيما يتعلق بعمق اختراق إشارة NIRS. بدلا من ذلك ، يمكن استخدام الموجات فوق الصوتية لتحديد سمك الأنسجة الدهنية. ضع في اعتبارك دائما أن عمق إشارة / قياس NIRS هو ما يقرب من نصف مسافة جهاز الاستقبال والإرسال9. - لزيادة جودة الإشارة إلى أقصى حد ، تحقق من الموقع المخطط لمسبار جهاز الإرسال / الاستقبال NIRS بحثا عن أي شعر قد يمتص الضوء ويزيل الشعر عن طريق الحلاقة إذا لزم الأمر.
ملاحظة: إذا تعرض الجلد للخطر ، على سبيل المثال ، من التهاب النسيج الخلوي ، أو في حالة وجود وذمة ، فكر في مدى ملاءمة القياس ، حيث تتعلق هذه المشكلات بانخفاض جودة الإشارة ، وعمق / أنسجة اختراق الإشارة التي يتم أخذ القياس منها ، وكذلك عقم جرح المشارك. - أخذ قياسات و / أو تحديد موضع موضع مسبار NIRS المخطط له فيما يتعلق بالمعالم التشريحية ذات الصلة (على سبيل المثال ، السطح العلوي للقمة الإنسية) للسماح بوضع دقيق لمسبار NIRS بين المشاركين وداخلها (اعتمادا على تصميم الدراسة وتصميم / شكل المسبار) حيث يمكن أن تظهر استجابات الأوكسجين عدم تجانس كبير بين العضلات المختلفة أو حتى داخل مناطق من نفس العضلات.
- اطلب من المشارك الاستلقاء في وضع ضعيف على قاعدة الفحص أو السرير. ثم يستريح المشارك لمدة 10 دقائق.
- ضع الكفة حول الفخذ ، بالقرب من الركبة ، مع التأكد من أن الأنابيب لا تتلامس مع ربلة الساق أو جهاز NIRS (الشكل 2).
- ارفع الساق (~ 10 سم) بالقدم والكاحل على دعامة رغوية ، مع ترك الجزء السفلي من الساق مستقرا ويمكن الوصول إليه للقياسات (الشكل 3).
ملاحظة: إذا كان الاختبار مطلوبا في كلتا الساقين خلال مناسبات متعددة ، فإن ترتيب الاختبار يكون عشوائيا (قبل الاختبار الأولي) ، ويتم الحفاظ على ترتيب الاختبار للتقييمات اللاحقة لكل مشارك. - قم بتشغيل وحدة نفخ الكفة السريعة.
ملاحظة: تأكد من أن إعدادات الوضع والضغط لمنفاخ الكفة السريع متوافقة مع تعليمات الشركة المصنعة ومواصفات بروتوكول انسداد الأوعية الدموية. - قم بتشغيل مصدر هواء منفاخ الكفة ، وتحقق من أن الهواء يمكن أن ينتقل عبر الخرطوم ، وقم بتوصيل الخرطوم بكفة الفخذ.
- تأكد من أن خرطوم منفاخ الكفة لا يزال غير ملامس للعجل.
- ثبت مسبار جهاز الإرسال / الاستقبال NIRS بإحكام على الجلد الذي يغطي موقع (مواقع) القياس (بشكل روتيني الجانب الإنسي من الساق ؛ ومع ذلك ، يتم أيضا استخدام مواقع أخرى مثل ظهر القدم والظنبوب الأمامي اعتمادا على الدراسة وتفاصيل المشارك).
ملاحظة: تسمح بعض أنظمة NIRS بإمكانية إجراء قياسات متعددة للموقع في وقت واحد. - قم بتغطية المسبار بشريط حركي أسود أو شيء مشابه ، مع الحرص على إغلاق الحواف لمنع الضوء المحيط من التأثير على جودة / قيم إشارة NIRS (الشكل 3).
ملاحظة: عند تثبيت المسبار والغطاء اللاصق ، تأكد من التخلص من حركة المسبار ، ولكن تجنب ضغط الجلد / الأنسجة الدهنية / العضلات.
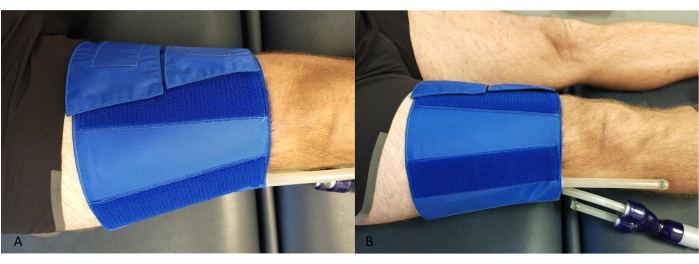
الشكل 2: مثال على وضع الكفة الانسدادية عند الفخذ. (أ) من الأعلى. (ب) من الجانب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
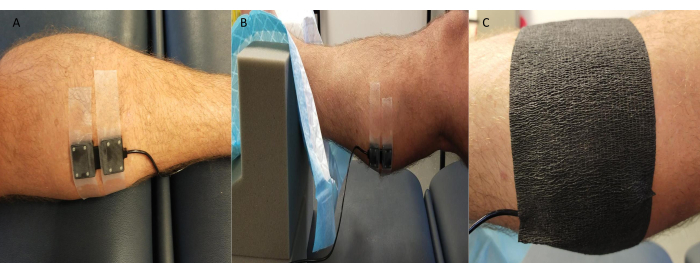
الشكل 3: مثال على موضع مسبار التحليل الطيفي للأشعة تحت الحمراء القريبة. (أ) مسبار متصل بالجلد المحلوق في الساق الإنسي. (ب) وضع المسبار أثناء الكاحل في دعامة الرغوة للسماح بالوصول وضمان الاستقرار. (ج) التدريع من الضوء المحيط في مكانه. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. جمع بيانات خط الأساس
- اطلب من المشارك أن يظل مسترخيا ، وأن يمتنع عن التحدث ، وأن يبقي ساقه (ساقيه) ثابتة طوال مدة جمع البيانات.
- ابدأ تسجيل جهاز NIRS عبر واجهة الكمبيوتر.
ملاحظة: إذا تم تمكين جمع البيانات دون اتصال وتفضيله ، فقم بتشغيل جهاز NIRS مباشرة. - اسمح بالحصول على 2 دقيقة على الأقل من البيانات قبل بدء بدء القياس. وهذا يضمن تحقيق إشارات الحالة المستقرة قبل الحصول على البيانات.
- راقب شاشة الكمبيوتر لضمان سلامة إشارة البيانات والقيم المعقولة من الناحية الفسيولوجية. على سبيل المثال ، توفر قيم الحصول على البيانات (DAQ) معلومات تتعلق بجودة الإشارة ومقدار الضوء المحيط المكتشف بواسطة جهاز NIRS. يجب أن تبقى في نطاق مقبول طوال فترة القياس.
- إذا لم يلاحظ أي تقلبات في إشارة NIRS بعد 2 دقيقة (على سبيل المثال ، بسبب قطعة أثرية للحركة) ، فقم بتعيين خط الأساس لبيانات NIRS عن طريق الضغط على الزر المقابل على جهاز الكمبيوتر / الجهاز / وحدة المزامنة. يعكس خط الأساس هذا نقطة البداية المقارنة للقياس. سيتم تفسير التغيرات في الهيموجلوبين المؤكسج وغير المؤكسج بالنسبة إلى خط الأساس هذا.
ملاحظة: أثناء جمع البيانات ، أدخل علامات الأحداث المستندة إلى البرامج لمعالم محددة ، وهي بداية ونهاية خط الأساس ، وبداية ونهاية انسداد الكفة وما إلى ذلك ، للمساعدة في تحليل البيانات. - اجمع ما لا يقل عن 1 دقيقة من بيانات خط الأساس ، وتأكد مرة أخرى من عدم حدوث تقلبات أو آثار حركة خلال هذا الوقت.
ملاحظة: ستؤثر التقلبات في بيانات خط الأساس على تفسير بعض المتغيرات المحتملة، مثل الاحتياطي المفرط (انظر قسم النتائج التمثيلية).
4. انسداد الأوعية الدموية
- اضبط ضغط الكفة على 200 مم زئبق على منفاخ الكفة السريع قبل التبديل إلى وضع الكفة (أو الإعداد ذي الصلة في الأنظمة البديلة).
ملاحظة: بينما يوصي بعض المؤلفين بالتضخم إلى 250 مم زئبق عند الفخذ 9,19 ، في تجربتنا ، هذا لا يتحمله بعض المشاركين جيدا ، مما يؤدي إلى إيقاف القياس. التضخم إلى 200 مم زئبق يكفي ، في معظم مجموعات المشاركين ، لسد تدفق الشرايين أثناء الراحة بينما يكون مقبولا ولا يؤدي إلى كدمات في الجلد. لضمان تحقيق انسداد فعال عند 200 مم زئبق ، تستخدم مجموعتنا بشكل روتيني تخطيط التحجم بمقياس الإجهاد في وقت واحد مع NIRS لتأكيد عدم وجود تدفق دم في اتجاه مجرى النهر خلال فترة تضخم الكفة. - قدم المشورة للمشارك بشأن ما يمكن توقعه (عدم الراحة ، والإحساس بالوخز ، وما إلى ذلك) أثناء عملية تضخيم الكفة إلى 200 مم زئبق لمدة 5 دقائق ، متبوعة بانكماش الكفة الكلي. ذكر المشارك مرة أخرى بالبقاء مسترخيا ، والامتناع عن التحدث ، والحفاظ على ساقه (أرجله) غير متحركة طوال مدة جمع البيانات.
ملاحظة: من تجربتنا أن أول 30-60 ثانية من فترة الانسداد هي الأقل راحة للمشاركين. عندما يترك المشاركون أرجلهم تسترخي ، فإنهم يميلون إلى العثور على انسداد أكثر تحملا. - عندما تكون مستعدا لبدء تضخم الكفة ، حدد نهاية فترة خط الأساس في برنامج NIRS.
- قم بتضخيم الكفة الفخذية إلى ضغط فوق انقباضي يبلغ 200 مم زئبق ، أو بدلا من ذلك إلى 220 مم زئبق في حالات نادرة حيث ثبت أن 200 مم زئبق غير فعالة.
- راقب الكمبيوتر أو الشاشة لضمان سلامة البيانات أثناء فترة الانسداد.
- مع اقتراب نهاية 5 دقائق من انسداد الكفة ، قم بإعداد المشارك من خلال تذكيره بإبقاء ساقه ثابتة قدر الإمكان والامتناع عن التحدث لمدة 3 دقائق تقريبا بعد انكماش الكفة (بينما يتم جمع البيانات من استجابات الأوعية الدموية لاحتقان الدم التفاعلي).
ملاحظة: هذا التذكير للمشارك بالبقاء ثابتا أمر مهم ، حيث قد يميل المشاركون إلى تحريك الطرف لتخفيف / تخفيف الانزعاج أثناء استعادة الدورة الدموية.
5. احتقان الدم التفاعلي
- بعد مرور 5 دقائق من الانسداد ، قم بتفريغ الكفة الفخذية بسرعة تماما (إلى 0 مم زئبق). في الوقت نفسه ، حدد نهاية فترة الانسداد في برنامج NIRS. ستكون استجابة احتقان الدم التفاعلي ، بسبب استئناف تدفق الدم والعوامل ذات الصلة ، مرئية في شاشة برنامج NIRS (الشكل 4).
- بعد 3 دقائق على الأقل بعد الانسداد ، أو بدلا من ذلك ، بعد عودة بيانات NIRS إلى خط الأساس ، حدد نهاية فترة الاسترداد في برنامج NIRS وأوقف القياس.
ملاحظة: تعتمد مدة التعافي، جزئيا، على البحث أو السؤال السريري الذي يجري التحقيق فيه، وبالتالي، على بارامترات NIRS المحددة المختارة للتحليل، فضلا عن إمكانية اتخاذ تدابير مصاحبة (مثل مرض الحمى القلاعية) التي قد تتطلب فترة تعافي أطول. - بدء حفظ البيانات وتصدير نتائج NIRS لمعالجة البيانات وتحليلها.
6. متابعة الإجراءات
- قم بإزالة جهاز (أجهزة) NIRS والكفة من المشارك.
- إذا لزم الأمر ، قم بتنظيف جهاز NIRS (وحزام الانسداد) باتباع تعليمات الشركة المصنعة ومعايير النظافة ذات الصلة.
- افحص جهاز NIRS لضمان سلامة جهاز الإرسال / الاستقبال وأداء البطارية للقياسات المستقبلية.
النتائج
التحليل الطيفي للأشعة تحت الحمراء القريبة
تقيس أجهزة التحليل الطيفي للموجة المستمرة القريبة من الأشعة تحت الحمراء التغيرات النسبية في الهيموجلوبين المؤكسج (O2Hb) وغير المؤكسج (HHb) ، والتي تعكس توصيل O2 المحلي واستخدامه عبر مصادر باعثة للضوء وأجهزة الكشف الضوئي ، ?...
Discussion
توضح هذه المقالة الإجراءات الموحدة لتقييم احتقان الدم التفاعلي للأطراف السفلية باستخدام CW-NIRS TSI لتقييم وظيفة الأوعية الدموية الدقيقة. تم تحسين هذا البروتوكول عن طريق فحص مدة انسداد الكفة على حجم الاستجابة ، وموثوقية اختبار NIRS وإعادة الاختبار أثناء احتقان الدم التفاعلي ، وكذلك مستوى الات...
Disclosures
ليس لدى المؤلفين أي إفصاحات أو مصالح متنافسة.
Acknowledgements
مينيسيس الذي ساهم عمله السابق في صقل البروتوكول الموصوف هنا. بالإضافة إلى ذلك ، يود المؤلفون أن يشكروا جميع المشاركين في البحث الذين تبرعوا بوقتهم لتمكين تطوير بروتوكولات مثل هذه من أجل تعزيز الفهم السريري والعلمي.
Materials
| Name | Company | Catalog Number | Comments |
| Cuff Inflator Air Source | Hokanson | AG101 AIR SOURCE | |
| Elastic Cohesive Bandage | MaxoWrap | 18228-BL | For blocking out ambient light |
| OxySoft | Artinis | 3.3.341 x64 | |
| PortaLite (NIRS) | Artinis | 0302-00019-00 | |
| PortaSync MKII (Remote) | Artinis | 0702-00860-00 | For Marking milestones during measurement |
| Rapid Cuff Inflator | Hokanson | E20 RAPID CUFF INFLATOR | |
| Thigh Cuff | Hokanson | CC17 | |
| Transpore Surgical Tape | 3M | 1527-1 | For fixing probe to skin |
References
- Hasani, W. S. R., et al. The global estimate of premature cardiovascular mortality: A systematic review and meta-analysis of age-standardized mortality rate. BMC Public Health. 23 (1), 1561 (2023).
- Horvath, L., et al. Epidemiology of peripheral artery disease: Narrative review. Life (Basel). 12 (7), 1041 (2022).
- Jodheea-Jutton, A., Hindocha, S., Bhaw-Luximon, A. Health economics of diabetic foot ulcer and recent trends to accelerate treatment). Foot (Edinb). 52, 101909 (2022).
- Rodrigues, B. T., Vangaveti, V. N., Urkude, R., Biros, E., Malabu, U. H. Prevalence and risk factors of lower limb amputations in patients with diabetic foot ulcers: A systematic review and meta-analysis. Diabetes Metab Syndr-Clinin Res Rev. 16 (2), 102397 (2022).
- Jung, F., et al. Microcirculation in hypertensive patients. Biorheology. 50 (5-6), 241-255 (2013).
- Bethel, M., Annex, B. H. Peripheral arterial disease: A small and large vessel problem. AmHeart J Plus: Cardio Res Prac. 28, 133291 (2023).
- Thijssen, D. H. J., et al. Expert consensus and evidence-based recommendations for the assessment of flow-mediated dilation in humans. Eur Heart J. 40 (30), 2534-2547 (2019).
- Sanada, H., et al. Vascular function in patients with lower extremity peripheral arterial disease: A comparison of functions in upper and lower extremities. Atherosclerosis. 178 (1), 179-185 (2005).
- Barstow, T. J. Understanding near-infrared spectroscopy and its application to skeletal muscle research. J App Phys. 126 (5), 1360-1376 (2019).
- Rogers, E. M., Banks, N. F., Jenkins, N. D. M. Metabolic and microvascular function assessed using near-infrared spectroscopy with vascular occlusion in women: Age differences and reliability. Exp Physiol. 108 (1), 123-134 (2023).
- Manfredini, F., et al. A toe flexion nirs assisted test for rapid assessment of foot perfusion in peripheral arterial disease: Feasibility, validity, and diagnostic accuracy. Eur J Vasc Endovasc Surg. 54 (2), 187-194 (2017).
- Boezeman, R. P., Moll, F. L., Unlu, C., De Vries, J. P. Systematic review of clinical applications of monitoring muscle tissue oxygenation with near-infrared spectroscopy in vascular disease. Microvasc Res. 104, 11-22 (2016).
- Baltrunas, T., et al. Measurement of revascularization effect using near-infrared spectroscopy in below the knee arteries. Rev Cardiovasc Med. 23 (9), 299 (2022).
- Tuesta, M., Yanez-Sepulveda, R., Verdugo-Marchese, H., Mateluna, C., Alvear-Ordenes, I. Near-infrared spectroscopy used to assess physiological muscle adaptations in exercise clinical trials: A systematic review. Biology (Basel). 11 (7), 1073 (2022).
- Cornelis, N., et al. The use of near-infrared spectroscopy to evaluate the effect of exercise on peripheral muscle oxygenation in patients with lower extremity artery disease: A systematic review. Eur J Vasc Endovasc Surg. 61 (5), 837-847 (2021).
- Whyte, E., Thomas, S., Marzolini, S. Muscle oxygenation of the paretic and nonparetic legs during and after exercise in chronic stroke: Implications for mobility. PM R. 15 (10), 1239-1248 (2023).
- Soares, R. N., George, M. A., Proctor, D. N., Murias, J. M. Differences in vascular function between trained and untrained limbs assessed by near-infrared spectroscopy. Eur J Appl Physiol. 118 (10), 2241-2248 (2018).
- Joseph, S., et al. Near infrared spectroscopy in peripheral artery disease and the diabetic foot: A systematic review. Diabetes Metab Res Rev. 38 (7), 3571 (2022).
- Willingham, T. B., Southern, W. M., Mccully, K. K. Measuring reactive hyperemia in the lower limb using near-infrared spectroscopy. J Biomed Opt. 21 (9), 091302 (2016).
- Jones, S., Chiesa, S. T., Chaturvedi, N., Hughes, A. D. Recent developments in near-infrared spectroscopy (nirs) for the assessment of local skeletal muscle microvascular function and capacity to utilise oxygen. Artery Res. 16, 25-33 (2016).
- Soares, R. N., et al. Effects of a rehabilitation program on microvascular function of CHD patients assessed by near-infrared spectroscopy. Physiol Rep. 7 (11), e14145 (2019).
- Baltrunas, T., et al. The use of near-infrared spectroscopy in the diagnosis of peripheral artery disease: A systematic review. Vascular. 30 (4), 715-727 (2022).
- Young, G. M., et al. Influence of cuff-occlusion duration on contrast-enhanced ultrasound assessments of calf muscle microvascular blood flow responsiveness in older adults. Exp Physiol. 105 (12), 2238-2245 (2020).
- Young, G. M., et al. The association between contrast-enhanced ultrasound and near-infrared spectroscopy-derived measures of calf muscle microvascular responsiveness in older adults. Heart Lung Circ. 30 (11), 1726-1733 (2021).
- Rosenberry, R., Nelson, M. D. Reactive hyperemia: A review of methods, mechanisms, and considerations. Am J Physiol Regul Integr Comp Physiol. 318 (3), R605-R618 (2020).
- Iannetta, D., et al. Reliability of microvascular responsiveness measures derived from near-infrared spectroscopy across a variety of ischemic periods in young and older individuals. Microvasc Res. 122, 117-124 (2019).
- Celermajer, D. S., et al. Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis. Lancet. 340 (8828), 1111-1115 (1992).
- Thijssen, D. H. J., et al. Assessment of flow-mediated dilation in humans: A methodological and physiological guideline. Am J Physiol-Heart Circ Physiol. 300 (1), H2-H12 (2011).
- Inaba, Y., Chen, J. A., Bergmann, S. R. Prediction of future cardiovascular outcomes by flow-mediated vasodilatation of brachial artery: A meta-analysis. Int J Cardiovasc Imaging. 26 (6), 631-640 (2010).
- Soares, R. N., De Oliveira, G. V., Alvares, T. S., Murias, J. M. The effects of the analysis strategy on the correlation between the NIRS reperfusion measures and the FMD response. Microvasc Res. 127, 103922 (2020).
- Tucker, W. J., et al. Studies into the determinants of skeletal muscle oxygen consumption: Novel insight from near-infrared diffuse correlation spectroscopy. J Physiol-London. 597 (11), 2887-2901 (2019).
- Tucker, W. J., et al. Near-infrared diffuse correlation spectroscopy tracks changes in oxygen delivery and utilization during exercise with and without isolated arterial compression. Am J Physiol Regul Integr Comp Physiol. 318 (1), R81-R88 (2020).
- Wassenaar, E. B., Van Den Brand, J. G. Reliability of near-infrared spectroscopy in people with dark skin pigmentation. J Clinic Monit Comput. 19 (3), 195-199 (2005).
- Soares, R. N., Murias, J. M. Near-infrared spectroscopy assessment of microvasculature detects difference in lower limb vascular responsiveness in obese compared to lean individuals. Microvasc Res. 118, 31-35 (2018).
- Boezeman, R. P., et al. Monitoring of foot oxygenation with near-infrared spectroscopy in patients with critical limb ischemia undergoing percutaneous transluminal angioplasty: A pilot study. Eur J Vasc Endovasc Surg. 52 (5), 650-656 (2016).
- Lin, B. S., et al. Using wireless near-infrared spectroscopy to predict wound prognosis in diabetic foot ulcers. Adv Skin Wound Care. 33 (1), 1-12 (2020).
- Weingarten, M. S., et al. Diffuse near-infrared spectroscopy prediction of healing in diabetic foot ulcers: A human study and cost analysis. Wound Repair. 20 (2), A44-A44 (2012).
- Murrow, J. R., et al. Near-infrared spectroscopy-guided exercise training for claudication in peripheral arterial disease. Eur J Prev Cardiol. 26 (5), 471-480 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved