Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Spectroscopie proche infrarouge au cours d’une hyperémie réactive pour l’évaluation de la fonction vasculaire des membres inférieurs
Dans cet article
Résumé
Ici, nous décrivons une approche non invasive utilisant la spectroscopie proche infrarouge pour évaluer l’hyperémie réactive dans le membre inférieur. Ce protocole fournit une évaluation standardisée de la réponse vasculaire et microvasculaire qui peut être utilisée pour déterminer la présence d’un dysfonctionnement vasculaire ainsi que l’efficacité des interventions thérapeutiques.
Résumé
Les maladies vasculaires des membres inférieurs contribuent de manière substantielle au fardeau mondial des maladies cardiovasculaires et des comorbidités telles que le diabète. Il est important de noter que le dysfonctionnement microvasculaire peut survenir avant ou parallèlement à la pathologie macrovasculaire, et les deux peuvent contribuer aux symptômes du patient et au fardeau de la maladie. Ici, nous décrivons une approche non invasive utilisant la spectroscopie proche infrarouge (NIRS) au cours de l’hyperémie réactive, qui fournit une évaluation standardisée de la fonction vasculaire des membres inférieurs et une méthode potentielle pour évaluer l’efficacité des interventions thérapeutiques. Contrairement à d’autres méthodes, telles que l’échographie avec produit de contraste, cette approche ne nécessite pas d’accès veineux ou d’analyse d’image sophistiquée, et elle est peu coûteuse et moins dépendante de l’opérateur. Cette description de la méthode NIRS comprend des résultats représentatifs et une terminologie standard, ainsi qu’une discussion sur les considérations de mesure, les limites et les méthodes alternatives. L’application future de ces travaux améliorera la normalisation de la conception de la recherche vasculaire, les procédures de collecte de données et l’harmonisation des rapports, améliorant ainsi les résultats de la recherche translationnelle dans les domaines de la (dys)fonction, de la maladie et du traitement vasculaires des membres inférieurs.
Introduction
Les maladies cardiovasculaires (MCV) sont le principal facteur de mortalité mondiale1. Alors que l’infarctus du myocarde et l’accident vasculaire cérébral sont les manifestations les plus courantes des MCV, les maladies vasculaires des membres inférieurs, telles que la maladie artérielle périphérique (MAP) et la maladie du pied diabétique, contribuent de manière substantielle au fardeau personnel, social et de santé des MCV 2,3,4. Il est important de noter que ces états pathologiques sont caractérisés par un dysfonctionnement microvasculaire et macrovasculaire5 qui contribuent aux symptômes (par exemple, une claudication intermittente), une déficience fonctionnelle, une faible mobilité ainsi qu’un isolement social et une qualité de vie réduite6. Historiquement, les techniques d’évaluation vasculaire des membres supérieurs ont été utilisées comme mesure de la fonction vasculaire systémique et du risque cardiovasculaire associé ; Cependant, ces méthodes ne sont potentiellement pas sensibles aux déficiences locales de la fonction vasculaire des membres inférieurs 7,8. Bien qu’il existe actuellement une gamme de techniques utilisées pour évaluer la fonction vasculaire du membre inférieur, telles que la dilatation médiée par le flux (FMD) et l’échographie avec produit de contraste, chaque méthode présente des inconvénients et des limites, tels que le coût de l’équipement, les compétences de l’opérateur ou la nécessité d’un accès veineux invasif. Pour ces raisons, il est nécessaire de disposer de techniques normalisées et efficaces pour évaluer la fonction vasculaire des membres inférieurs qui peuvent être plus facilement mises en œuvre dans la recherche et les milieux cliniques.
La spectroscopie proche infrarouge à ondes continues (CW-NIRS) est une méthode non invasive, peu coûteuse et portable qui quantifie les changements relatifs de l’oxygénation de l’hémoglobine in vivo. Comme les signaux d’hémoglobine oxygénée et désoxygénée du SRNI proviennent des petits vaisseaux (<1 mm de diamètre), le métabolisme local des muscles squelettiques et la fonction microvasculaire peuvent être évalués9. Plus précisément, l’indice de saturation tissulaire (TSI) [TSI = hémoglobine oxygénée / (hémoglobine oxygénée + hémoglobine désoxygénée) x 100], fournit une mesure quantitative de l’oxygénation tissulaire9. Lorsqu’elles sont mesurées avant, pendant et après l’occlusion et l’hyperémie réactive, les modifications de l’ITT indiquent une réactivité vasculaire de l’organe cible, par rapport à la ligne de base avant l’occlusion. Il est important de noter que cette méthode est sensible aux altérations de la réactivité microvasculaire musculaire et de la perfusion associées au vieillissement10, à la progression de la maladie11 et aux interventions cliniques (par exemple, la chirurgie de revascularisation12,13 ou la réadaptation par l’exercice 14,15,16,17) chez les personnes atteintes ou à risque de dysfonctionnement microvasculaire.
La disponibilité des systèmes NIRS a entraîné une augmentation rapide du nombre d’études de recherche faisant état de la fonction microvasculaire18. Cependant, les différences dans les protocoles de test de l’hyperémie réactive, l’omission de méthodes NIRS détaillées et reproductibles, ainsi que le manque d’uniformité dans la description, la présentation et l’analyse des paramètres de réponse NIRS rendent les comparaisons entre les essais individuels difficiles. Cela limite la compilation des données pour la méta-analyse et la formulation de recommandations d’évaluation clinique 9,15.
Par conséquent, dans cet article, nous décrivons les protocoles standardisés de test NIRS et d’occlusion vasculaire de notre laboratoire pour l’évaluation de l’hyperémie réactive des membres inférieurs. En diffusant ces méthodes, nous visons à contribuer à l’amélioration de la normalisation et de la répétabilité des procédures de collecte de données et à l’harmonisation des rapports.
Protocole
Toutes les méthodes décrites ici ont été approuvées par le comité d’éthique de la recherche humaine de l’Université de la Sunshine Coast. De plus, tous les participants ont donné leur consentement éclairé écrit à participer aux mesures décrites dans le présent protocole. Veuillez noter que le test d’occlusion vasculaire dans le membre inférieur est contre-indiqué chez les personnes qui ont déjà subi une procédure de revascularisation impliquant une greffe vasculaire ou une endoprothèse des artères fémorales ou poplitées. Après avoir préparé l’équipement, le participant est invité à se reposer en position couchée pendant 10 min. À ce stade, la collecte des données NIRS commence, avec une période initiale de 2 minutes, ce qui permet d’atteindre la stabilité des signaux NIRS. Les données de base sont ensuite recueillies pendant 1 min, après quoi un brassard situé au niveau de la cuisse est rapidement gonflé pour obtenir une occlusion artérielle. L’occlusion est maintenue pendant 5 minutes avant que le brassard ne se dégonfle rapidement. La collecte de données se poursuit tout au long de la période d’hyperémie réactive jusqu’à ce que les signaux soient revenus à la valeur initiale. La figure 1 présente un aperçu du protocole d’hyperémie réactive, et les étapes détaillées sont fournies ci-dessous. Les équipements utilisés pour l’étude sont répertoriés dans la table des matériaux.
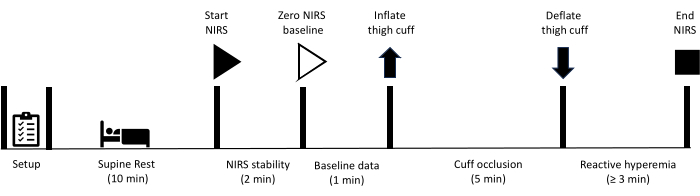
Figure 1 : Schéma décrivant le protocole et les délais de mesure de l’hyperémie réactive NIRS. NIRS : spectroscopie proche infrarouge. Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Préparation de l’équipement
REMARQUE : Divers systèmes de NIRS, de gonflage/occlusion du brassard et de collecte de données peuvent être utilisés pour obtenir les résultats représentatifs décrits ci-dessous. Il est important que les chercheurs consultent leurs propres manuels d’utilisation et qu’ils soient conscients des logiciels, de l’étalonnage, de la lumière ambiante et des considérations propres aux participants ou à la cohorte.
- Assurez-vous que toutes les mesures sont effectuées dans une pièce calme et à température contrôlée (21-23 °C).
- Confirmez que tout l’équipement et les matériaux (voir le tableau des matériaux) sont disponibles.
- Assurez-vous que le périphérique CW-NIRS et l’ordinateur auquel il transmet sont complètement chargés et sous tension.
- Vérifiez que le dispositif NIRS est couplé à l’ordinateur affichant les données NIRS via Bluetooth et que les paramètres de mesure de l’unité NIRS sont définis en fonction du site d’expérimentation et du plan d’étude (un exemple : définir le facteur de longueur de trajet différentiel (DPF) de la lumière proche infrarouge).
REMARQUE : La plupart des étapes du protocole NIRS et des paramètres du système sont basés sur une combinaison de recommandations du fabricant, de l’expérience des chercheurs et de l’opinion d’experts/consensus. Sachez que les valeurs générées lors de la mesure dépendent de l’appareil et des sondes utilisés ainsi que des paramètres choisis dans le logiciel de l’appareil. Il existe également un potentiel de grande variabilité interindividuelle dans les signaux collectés. De plus, afin de permettre une meilleure comparaison entre les études, il est important de communiquer les détails de l’instrumentation NIRS (p. ex., la conception de la sonde, les distances de séparation source-détecteur et les longueurs d’onde utilisées), les paramètres du système, la position et l’orientation de la sonde par rapport à la géométrie musculaire et les paramètres d’analyse et le traitement des données lors de la publication des résultats de ces mesures. - Entrez les données du participant en fonction des caractéristiques logicielles du dispositif NIRS.
- Connectez le gonfleur rapide du brassard à l’air et aux sources d’alimentation.
2. Préparation du participant
- Assurez-vous que le participant a lu la déclaration d’information et le formulaire de consentement du participant et qu’il a donné son consentement à participer à la mesure avant le début.
- Expliquez au participant à quoi s’attendre pendant la mesure pendant qu’il enlève ses chaussures et ses chaussettes et se tient immobile pour les mesures anthropométriques pertinentes.
- Prenez une mesure du pli cutané (en trois exemplaires) sur le site de mesure NIRS prévu (par exemple, sur la face médiale au point de circonférence maximale du mollet).
REMARQUE : Cela permet de confirmer la profondeur de la peau et du tissu adipeux (communément appelée épaisseur du tissu adipeux - ATT) par rapport à la profondeur de pénétration du signal NIRS. Alternativement, l’échographie peut être utilisée pour déterminer l’épaisseur du tissu adipeux. Gardez toujours à l’esprit que la profondeur du signal/mesure NIRS est d’environ la moitié de la distance récepteur-émetteur9. - Pour maximiser la qualité du signal, vérifiez l’emplacement prévu de la sonde émettrice/réceptrice NIRS pour tout poil susceptible d’absorber la lumière et éliminez les poils en vous rasant si nécessaire.
REMARQUE : Si la peau est compromise, par exemple, par une cellulite, ou si un œdème est présent, considérez la pertinence de la mesure, car ces problèmes sont liés à une réduction potentielle de la qualité du signal, à la profondeur de pénétration du signal/au tissu à partir duquel la mesure est prise, ainsi qu’à la stérilité de la plaie du participant. - Prendre des mesures et/ou marquer la position de l’emplacement prévu de la sonde NIRS par rapport aux repères anatomiques pertinents (par exemple, la surface supérieure du condyle médial) pour permettre un placement précis de la sonde NIRS entre et à l’intérieur des participants (en fonction de la conception de l’étude et de la conception/forme de la sonde), car les réponses d’oxygénation peuvent présenter une grande hétérogénéité entre différents muscles ou même à l’intérieur des régions d’un même muscle.
- Demandez au participant de s’allonger en position couchée sur un socle ou un lit d’examen. Le participant se repose ensuite pendant 10 min.
- Placez un brassard autour de la cuisse, à proximité du genou, en veillant à ce que les tubes n’entrent pas en contact avec le mollet ou le dispositif NIRS (Figure 2).
- Surélevez la jambe (~10 cm) avec le pied et la cheville sur un support en mousse, en laissant le bas de la jambe stable et accessible pour les mesures (Figure 3).
REMARQUE : S’il est nécessaire d’effectuer le test dans les deux étapes à plusieurs reprises, l’ordre des tests est aléatoire (avant le test initial) et l’ordre des tests est conservé pour les évaluations ultérieures de chaque participant. - Allumez le module de gonflage rapide du brassard.
REMARQUE : Assurez-vous que les réglages de mode et de pression du gonfleur rapide sont conformes aux instructions du fabricant et aux spécifications du protocole d’occlusion vasculaire. - Allumez la source d’air du gonfleur du brassard, vérifiez que l’air peut circuler à travers le tuyau et connectez le tuyau au brassard de cuisse.
- Assurez-vous que le tuyau du gonfleur du ballonnet n’est toujours pas en contact avec le mollet.
- Fixez solidement la sonde émettrice/réceptrice NIRS sur la peau recouvrant le(s) site(s) de mesure (généralement la face médiale du gastrocnémien ; cependant, d’autres sites tels que le dos du pied et le tibial antérieur sont également utilisés en fonction de l’étude et des spécificités du participant).
REMARQUE : Certains systèmes NIRS permettent d’effectuer plusieurs mesures de site simultanément. - Couvrez la sonde avec du ruban de kinésiologie noir ou quelque chose de similaire, en prenant soin de sceller les bords pour éviter que la lumière ambiante n’affecte la qualité/les valeurs du signal NIRS (Figure 3).
REMARQUE : Lors de la fixation de la sonde et du revêtement adhésif, assurez-vous d’éliminer le mouvement de la sonde, mais évitez de comprimer la peau/le tissu adipeux/les muscles.
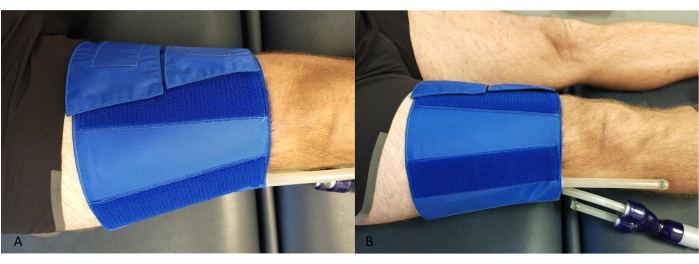
Figure 2 : Exemple de placement du brassard occlusif au niveau de la cuisse. (A) D’en haut. (B) De côté. Veuillez cliquer ici pour voir une version agrandie de cette figure.
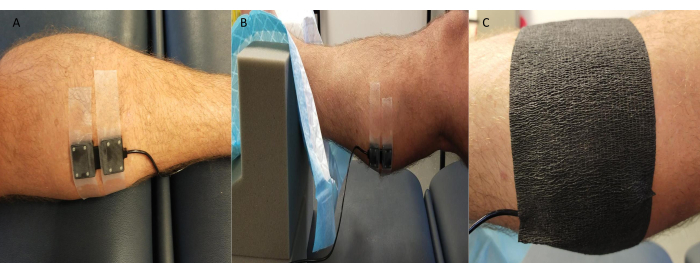
Figure 3 : Exemple de position de la sonde de spectroscopie dans le proche infrarouge. (A) Sonde fixée à la peau rasée au niveau du gastrocnémien médial. (B) Placement de la sonde pendant la cheville dans un support en mousse pour permettre l’accès et assurer la stabilité. (C) Blindage contre la lumière ambiante en place. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Collecte de données de référence
- Demandez au participant de rester détendu, de s’abstenir de parler et de garder sa ou ses jambes immobiles pendant toute la durée de la collecte de données.
- Démarrez l’enregistrement de l’appareil NIRS via l’interface de l’ordinateur.
REMARQUE : Si la collecte de données hors ligne est activée et préférée, démarrez directement le périphérique NIRS. - Prévoyez d’acquérir au moins 2 minutes de données avant de lancer le début de la mesure. Cela permet de s’assurer que les signaux en régime permanent sont obtenus avant l’acquisition des données.
- Surveillez l’écran de l’ordinateur pour vous assurer de l’intégrité des données, du signal et des valeurs physiologiquement plausibles. Par exemple, les valeurs d’acquisition de données (DAQ) fournissent des informations sur la qualité du signal et la quantité de lumière ambiante détectée par le dispositif NIRS. Ils doivent être maintenus à une plage acceptable tout au long de la mesure.
- Si, après 2 minutes, aucune fluctuation du signal NIRS n’est notée (par exemple, en raison d’un artefact de mouvement), réglez la référence des données NIRS en appuyant sur le bouton correspondant de l’ordinateur/de l’appareil/de l’unité de synchronisation. Cette base de référence reflète le point de départ comparatif de la mesure. Les changements dans l’hémoglobine oxygénée et désoxygénée seront interprétés par rapport à cette ligne de base.
REMARQUE : Pendant la collecte de données, insérez des marqueurs d’événements logiciels pour des étapes spécifiques, à savoir le début et la fin de la ligne de base, le début et la fin de l’occlusion du brassard, etc., pour faciliter l’analyse des données. - Collectez au moins 1 minute de données de base, en vous assurant à nouveau qu’il n’y a pas de fluctuations ou d’artefacts de mouvement pendant cette période.
REMARQUE : Les fluctuations des données de référence auront une incidence sur l’interprétation de certaines variables potentielles, comme la réserve hyperémique (voir la section sur les résultats représentatifs).
4. Occlusion vasculaire
- Réglez la pression du brassard à 200 mmHg sur le gonfleur rapide du brassard avant de passer en mode brassard (ou réglage approprié sur d’autres systèmes).
REMARQUE : Bien que certains auteurs recommandent l’inflation à 250 mmHg au niveau de la cuisse 9,19, d’après notre expérience, cela n’est pas bien toléré par certains participants, ce qui conduit à l’arrêt de la mesure. L’inflation à 200 mmHg est suffisante, dans la plupart des groupes de participants, pour obstruer l’afflux artériel au repos tout en étant tolérable et en n’entraînant pas d’ecchymoses sur la peau. Pour s’assurer qu’une occlusion efficace est atteinte à 200 mmHg, notre groupe utilise régulièrement la pléthysmographie à jauge de contrainte en même temps que la NIRS pour confirmer l’absence de flux sanguin en aval pendant la période de gonflage du ballonnet. - Informez le participant de ce à quoi il doit s’attendre (inconfort, sensations de picotement, etc.) pendant le processus de gonflage du brassard à 200 mmHg pendant une période de 5 min, suivi d’un dégonflage total du brassard. Rappelez à nouveau au participant de rester détendu, de s’abstenir de parler et de garder sa ou ses jambes immobiles pendant toute la durée de la collecte de données.
REMARQUE : D’après notre expérience, les 30 à 60 premières secondes de la période d’occlusion sont les moins confortables pour les participants. Lorsque les participants laissent leurs jambes se détendre, ils ont tendance à trouver l’occlusion plus tolérable. - Lorsque vous êtes prêt à lancer le gonflage du brassard, marquez la fin de la période de référence dans le logiciel NIRS.
- Gonflez le brassard de la cuisse à une pression suprasystolique de 200 mmHg, ou alternativement à 220 mmHg dans les rares cas où 200 mmHg se sont avérés inefficaces.
- Surveillez l’ordinateur ou l’écran pour garantir l’intégrité des données pendant la période d’occlusion.
- À l’approche de la fin des 5 minutes d’occlusion du ballonnet, préparez le participant en lui rappelant de garder sa jambe aussi immobile que possible et de s’abstenir de parler pendant environ 3 minutes après le dégonflage du ballonnet (pendant que les données des réponses vasculaires à l’hyperémie réactive sont recueillies).
REMARQUE : Ce rappel au participant de rester immobile est important, car les participants peuvent être tentés de bouger le membre pour soulager/soulager l’inconfort pendant que la circulation est rétablie.
5. Hyperémie réactive
- Après 5 minutes d’occlusion, dégonflez rapidement et complètement le brassard de la cuisse (à 0 mmHg). Simultanément, marquez la fin de la période occlusive dans le logiciel NIRS. La réponse réactive de l’hyperémie, due à la reprise du flux sanguin et aux facteurs associés, sera visible sur l’écran du logiciel NIRS (Figure 4).
- Après un minimum de 3 minutes après l’occlusion, ou alternativement, après que les données NIRS sont revenues à la ligne de base, marquez la fin de la période de récupération dans le logiciel NIRS et arrêtez la mesure.
REMARQUE : La durée de la récupération dépend, en partie, de la recherche ou de la question clinique étudiée et, par conséquent, des paramètres spécifiques de la SNIR choisis pour l’analyse, ainsi que de la possibilité de mesures concomitantes (comme la fièvre aphteuse) qui peuvent nécessiter une durée de récupération plus longue. - Lancer l’enregistrement et l’exportation des résultats NIRS pour le traitement et l’analyse des données.
6. Procédures de suivi
- Retirez le(s) dispositif(s) NIRS et le brassard du participant.
- Si nécessaire, nettoyez l’appareil NIRS (et le brassard d’occlusion) en suivant les instructions du fabricant et les normes d’hygiène pertinentes.
- Inspectez l’appareil NIRS pour vous assurer de l’intégrité de l’émetteur/récepteur et des performances de la batterie pour les mesures futures.
Résultats
Spectroscopie dans le proche infrarouge
Les appareils de spectroscopie proche infrarouge à ondes continues mesurent les changements relatifs de l’hémoglobine oxygénée (O2Hb) et désoxygénée (HHb), qui reflètent l’administration et l’utilisation locales d’O2 via des sources électroluminescentes et des photodétecteurs, à des distances spécifiques. Des longueurs d’onde de lumière comprises entre ~700 nm et 850 nm sont émises, ce qui correspond à l’...
Discussion
Cet article décrit les procédures standardisées pour l’évaluation de l’hyperémie réactive des membres inférieurs à l’aide de la TSI CW-NIRS pour évaluer la fonction microvasculaire. Ce protocole a été affiné par l’examen de la durée de l’occlusion du ballonnet en fonction de l’amplitude de la réponse, de la fiabilité test-retest NIRS pendant l’hyperémie réactive, ainsi que du niveau de concordance entre la NIRS et d’autres méthodes d’évaluation microvasculaire telles que l’échograp...
Déclarations de divulgation
Les auteurs n’ont pas de divulgations ou d’intérêts concurrents.
Remerciements
Les auteurs tiennent à remercier le Dr A. Meneses, dont les travaux antérieurs ont contribué à l’amélioration du protocole décrit dans le présent document. De plus, les auteurs tiennent à remercier tous les participants à la recherche qui ont donné de leur temps pour permettre l’élaboration de protocoles comme celui-ci afin d’approfondir la compréhension clinique et scientifique.
matériels
| Name | Company | Catalog Number | Comments |
| Cuff Inflator Air Source | Hokanson | AG101 AIR SOURCE | |
| Elastic Cohesive Bandage | MaxoWrap | 18228-BL | For blocking out ambient light |
| OxySoft | Artinis | 3.3.341 x64 | |
| PortaLite (NIRS) | Artinis | 0302-00019-00 | |
| PortaSync MKII (Remote) | Artinis | 0702-00860-00 | For Marking milestones during measurement |
| Rapid Cuff Inflator | Hokanson | E20 RAPID CUFF INFLATOR | |
| Thigh Cuff | Hokanson | CC17 | |
| Transpore Surgical Tape | 3M | 1527-1 | For fixing probe to skin |
Références
- Hasani, W. S. R., et al. The global estimate of premature cardiovascular mortality: A systematic review and meta-analysis of age-standardized mortality rate. BMC Public Health. 23 (1), 1561 (2023).
- Horvath, L., et al. Epidemiology of peripheral artery disease: Narrative review. Life (Basel). 12 (7), 1041 (2022).
- Jodheea-Jutton, A., Hindocha, S., Bhaw-Luximon, A. Health economics of diabetic foot ulcer and recent trends to accelerate treatment). Foot (Edinb). 52, 101909 (2022).
- Rodrigues, B. T., Vangaveti, V. N., Urkude, R., Biros, E., Malabu, U. H. Prevalence and risk factors of lower limb amputations in patients with diabetic foot ulcers: A systematic review and meta-analysis. Diabetes Metab Syndr-Clinin Res Rev. 16 (2), 102397 (2022).
- Jung, F., et al. Microcirculation in hypertensive patients. Biorheology. 50 (5-6), 241-255 (2013).
- Bethel, M., Annex, B. H. Peripheral arterial disease: A small and large vessel problem. AmHeart J Plus: Cardio Res Prac. 28, 133291 (2023).
- Thijssen, D. H. J., et al. Expert consensus and evidence-based recommendations for the assessment of flow-mediated dilation in humans. Eur Heart J. 40 (30), 2534-2547 (2019).
- Sanada, H., et al. Vascular function in patients with lower extremity peripheral arterial disease: A comparison of functions in upper and lower extremities. Atherosclerosis. 178 (1), 179-185 (2005).
- Barstow, T. J. Understanding near-infrared spectroscopy and its application to skeletal muscle research. J App Phys. 126 (5), 1360-1376 (2019).
- Rogers, E. M., Banks, N. F., Jenkins, N. D. M. Metabolic and microvascular function assessed using near-infrared spectroscopy with vascular occlusion in women: Age differences and reliability. Exp Physiol. 108 (1), 123-134 (2023).
- Manfredini, F., et al. A toe flexion nirs assisted test for rapid assessment of foot perfusion in peripheral arterial disease: Feasibility, validity, and diagnostic accuracy. Eur J Vasc Endovasc Surg. 54 (2), 187-194 (2017).
- Boezeman, R. P., Moll, F. L., Unlu, C., De Vries, J. P. Systematic review of clinical applications of monitoring muscle tissue oxygenation with near-infrared spectroscopy in vascular disease. Microvasc Res. 104, 11-22 (2016).
- Baltrunas, T., et al. Measurement of revascularization effect using near-infrared spectroscopy in below the knee arteries. Rev Cardiovasc Med. 23 (9), 299 (2022).
- Tuesta, M., Yanez-Sepulveda, R., Verdugo-Marchese, H., Mateluna, C., Alvear-Ordenes, I. Near-infrared spectroscopy used to assess physiological muscle adaptations in exercise clinical trials: A systematic review. Biology (Basel). 11 (7), 1073 (2022).
- Cornelis, N., et al. The use of near-infrared spectroscopy to evaluate the effect of exercise on peripheral muscle oxygenation in patients with lower extremity artery disease: A systematic review. Eur J Vasc Endovasc Surg. 61 (5), 837-847 (2021).
- Whyte, E., Thomas, S., Marzolini, S. Muscle oxygenation of the paretic and nonparetic legs during and after exercise in chronic stroke: Implications for mobility. PM R. 15 (10), 1239-1248 (2023).
- Soares, R. N., George, M. A., Proctor, D. N., Murias, J. M. Differences in vascular function between trained and untrained limbs assessed by near-infrared spectroscopy. Eur J Appl Physiol. 118 (10), 2241-2248 (2018).
- Joseph, S., et al. Near infrared spectroscopy in peripheral artery disease and the diabetic foot: A systematic review. Diabetes Metab Res Rev. 38 (7), 3571 (2022).
- Willingham, T. B., Southern, W. M., Mccully, K. K. Measuring reactive hyperemia in the lower limb using near-infrared spectroscopy. J Biomed Opt. 21 (9), 091302 (2016).
- Jones, S., Chiesa, S. T., Chaturvedi, N., Hughes, A. D. Recent developments in near-infrared spectroscopy (nirs) for the assessment of local skeletal muscle microvascular function and capacity to utilise oxygen. Artery Res. 16, 25-33 (2016).
- Soares, R. N., et al. Effects of a rehabilitation program on microvascular function of CHD patients assessed by near-infrared spectroscopy. Physiol Rep. 7 (11), e14145 (2019).
- Baltrunas, T., et al. The use of near-infrared spectroscopy in the diagnosis of peripheral artery disease: A systematic review. Vascular. 30 (4), 715-727 (2022).
- Young, G. M., et al. Influence of cuff-occlusion duration on contrast-enhanced ultrasound assessments of calf muscle microvascular blood flow responsiveness in older adults. Exp Physiol. 105 (12), 2238-2245 (2020).
- Young, G. M., et al. The association between contrast-enhanced ultrasound and near-infrared spectroscopy-derived measures of calf muscle microvascular responsiveness in older adults. Heart Lung Circ. 30 (11), 1726-1733 (2021).
- Rosenberry, R., Nelson, M. D. Reactive hyperemia: A review of methods, mechanisms, and considerations. Am J Physiol Regul Integr Comp Physiol. 318 (3), R605-R618 (2020).
- Iannetta, D., et al. Reliability of microvascular responsiveness measures derived from near-infrared spectroscopy across a variety of ischemic periods in young and older individuals. Microvasc Res. 122, 117-124 (2019).
- Celermajer, D. S., et al. Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis. Lancet. 340 (8828), 1111-1115 (1992).
- Thijssen, D. H. J., et al. Assessment of flow-mediated dilation in humans: A methodological and physiological guideline. Am J Physiol-Heart Circ Physiol. 300 (1), H2-H12 (2011).
- Inaba, Y., Chen, J. A., Bergmann, S. R. Prediction of future cardiovascular outcomes by flow-mediated vasodilatation of brachial artery: A meta-analysis. Int J Cardiovasc Imaging. 26 (6), 631-640 (2010).
- Soares, R. N., De Oliveira, G. V., Alvares, T. S., Murias, J. M. The effects of the analysis strategy on the correlation between the NIRS reperfusion measures and the FMD response. Microvasc Res. 127, 103922 (2020).
- Tucker, W. J., et al. Studies into the determinants of skeletal muscle oxygen consumption: Novel insight from near-infrared diffuse correlation spectroscopy. J Physiol-London. 597 (11), 2887-2901 (2019).
- Tucker, W. J., et al. Near-infrared diffuse correlation spectroscopy tracks changes in oxygen delivery and utilization during exercise with and without isolated arterial compression. Am J Physiol Regul Integr Comp Physiol. 318 (1), R81-R88 (2020).
- Wassenaar, E. B., Van Den Brand, J. G. Reliability of near-infrared spectroscopy in people with dark skin pigmentation. J Clinic Monit Comput. 19 (3), 195-199 (2005).
- Soares, R. N., Murias, J. M. Near-infrared spectroscopy assessment of microvasculature detects difference in lower limb vascular responsiveness in obese compared to lean individuals. Microvasc Res. 118, 31-35 (2018).
- Boezeman, R. P., et al. Monitoring of foot oxygenation with near-infrared spectroscopy in patients with critical limb ischemia undergoing percutaneous transluminal angioplasty: A pilot study. Eur J Vasc Endovasc Surg. 52 (5), 650-656 (2016).
- Lin, B. S., et al. Using wireless near-infrared spectroscopy to predict wound prognosis in diabetic foot ulcers. Adv Skin Wound Care. 33 (1), 1-12 (2020).
- Weingarten, M. S., et al. Diffuse near-infrared spectroscopy prediction of healing in diabetic foot ulcers: A human study and cost analysis. Wound Repair. 20 (2), A44-A44 (2012).
- Murrow, J. R., et al. Near-infrared spectroscopy-guided exercise training for claudication in peripheral arterial disease. Eur J Prev Cardiol. 26 (5), 471-480 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon