È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Spettroscopia nel vicino infrarosso durante l'iperemia reattiva per la valutazione della funzione vascolare degli arti inferiori
In questo articolo
Riepilogo
Qui, descriviamo un approccio non invasivo che utilizza la spettroscopia nel vicino infrarosso per valutare l'iperemia reattiva nell'arto inferiore. Questo protocollo fornisce una valutazione standardizzata della responsività vascolare e microvascolare che può essere utilizzata per determinare la presenza di disfunzione vascolare e l'efficacia degli interventi terapeutici.
Abstract
Le malattie vascolari degli arti inferiori contribuiscono in modo sostanziale al carico globale di malattie cardiovascolari e comorbidità come il diabete. È importante sottolineare che la disfunzione microvascolare può verificarsi prima o insieme alla patologia macrovascolare ed entrambe contribuiscono potenzialmente ai sintomi del paziente e al carico della malattia. Qui, descriviamo un approccio non invasivo che utilizza la spettroscopia nel vicino infrarosso (NIRS) durante l'iperemia reattiva, che fornisce una valutazione standardizzata della (dis)funzione vascolare degli arti inferiori e un potenziale metodo per valutare l'efficacia degli interventi terapeutici. A differenza dei metodi alternativi, come l'ecografia con mezzo di contrasto, questo approccio non richiede l'accesso venoso o un'analisi sofisticata delle immagini, ed è economico e meno dipendente dall'operatore. Questa descrizione del metodo NIRS include risultati rappresentativi e terminologia standard insieme alla discussione di considerazioni sulla misurazione, limiti e metodi alternativi. L'applicazione futura di questo lavoro migliorerà la standardizzazione della progettazione della ricerca vascolare, le procedure di raccolta dei dati e la reportistica armonizzata, migliorando così i risultati della ricerca traslazionale nelle aree della (dis)funzione vascolare degli arti inferiori, della malattia e del trattamento.
Introduzione
Le malattie cardiovascolari (CVD) sono il principale fattore che contribuisce alla mortalità globale1. Mentre l'infarto del miocardio e l'ictus sono le manifestazioni più comuni delle CVD, le malattie vascolari degli arti inferiori, come l'arteriopatia periferica (PAD) e la malattia del piede diabetico, contribuiscono in modo sostanziale al carico personale, sociale e sanitario delle CVD 2,3,4. È importante sottolineare che questi stati patologici sono caratterizzati da disfunzione microvascolare e macrovascolare5 che contribuiscono ai sintomi (ad esempio, claudicatio intermittens), compromissione funzionale, scarsa mobilità, isolamento sociale e ridotta qualità della vita6. Storicamente, le tecniche di valutazione vascolare degli arti superiori sono state utilizzate come misura della funzione vascolare sistemica e del rischio cardiovascolare associato; Tuttavia, questi metodi non sono potenzialmente sensibili alle compromissioni locali della funzione vascolare degli arti inferiori 7,8. Sebbene attualmente esista una serie di tecniche utilizzate per valutare la funzione vascolare nell'arto inferiore, come la dilatazione flusso-mediata (FMD) e l'ecografia con mezzo di contrasto, ogni metodo presenta svantaggi e limitazioni, come il costo dell'attrezzatura, l'abilità dell'operatore o la necessità di un accesso venoso invasivo. Per questi motivi, c'è bisogno di tecniche standardizzate ed efficaci per valutare la (dis)funzione vascolare degli arti inferiori che possono essere più facilmente implementate nella ricerca e in contesti clinici.
La spettroscopia nel vicino infrarosso a onda continua (CW-NIRS) è un metodo non invasivo, a basso costo e portatile che quantifica i cambiamenti relativi nell'ossigenazione dell'emoglobina in vivo. Poiché i segnali dell'emoglobina ossigenata e deossigenata NIRS derivano dai piccoli vasi (<1 mm di diametro), è possibile valutare il metabolismo locale del muscolo scheletrico e la funzione microvascolare9. In particolare, l'indice di saturazione tissutale (TSI) [TSI = emoglobina ossigenata/ (emoglobina ossigenata + emoglobina deossigenata) x 100], fornisce una misura quantitativa dell'ossigenazione tissutale9. Quando misurate prima, durante e dopo l'occlusione e l'iperemia reattiva, le variazioni della TSI indicano una risposta vascolare "end-organo", rispetto al basale pre-occlusione. È importante sottolineare che questo metodo è sensibile alle alterazioni della reattività microvascolare muscolare e della perfusione associate all'invecchiamento10, alla progressione della malattia11 e agli interventi clinici (ad esempio, chirurgia di rivascolarizzazione12,13 o riabilitazione fisica 14,15,16,17) in individui con o a rischio di disfunzione microvascolare.
La disponibilità di sistemi NIRS ha portato a un rapido aumento del numero di studi di ricerca che riportano la funzione microvascolare18. Tuttavia, le differenze nei protocolli di test dell'iperemia reattiva, l'omissione di metodi NIRS dettagliati e ripetibili, nonché la mancanza di uniformità nella descrizione, presentazione e analisi dei parametri di risposta NIRS rendono difficili i confronti tra i singoli studi. Ciò limita la raccolta dei dati per la meta-analisi e la formulazione di raccomandazioni per la valutazione clinica 9,15.
Pertanto, in questo articolo, descriviamo i protocolli standardizzati NIRS e di test di occlusione vascolare del nostro laboratorio per la valutazione dell'iperemia reattiva degli arti inferiori. Con la diffusione di questi metodi, miriamo a contribuire a migliorare la standardizzazione e la ripetibilità delle procedure di raccolta dei dati e la comunicazione armonizzata.
Protocollo
Tutti i metodi qui descritti sono stati approvati dal comitato etico per la ricerca umana dell'Università della Sunshine Coast. Inoltre, tutti i partecipanti hanno dato il loro consenso informato scritto a partecipare alle misurazioni descritte in questo protocollo. Si prega di notare che il test di occlusione vascolare nell'arto inferiore è controindicato nei soggetti che hanno precedentemente subito una procedura di rivascolarizzazione che prevede un innesto vascolare o uno stent delle arterie femorali o poplitee. Dopo aver preparato l'attrezzatura, il partecipante viene istruito a riposare in posizione supina per 10 minuti. A questo punto, inizia la raccolta dei dati NIRS, con un periodo iniziale di 2 minuti, che consente di raggiungere la stabilità dei segnali NIRS. I dati di base vengono quindi raccolti per 1 minuto, a quel punto un bracciale situato sulla coscia viene prontamente gonfiato per ottenere l'occlusione arteriosa. L'occlusione viene mantenuta per 5 minuti prima che la cuffia si sgonfi rapidamente. La raccolta dei dati continua per tutto il periodo di iperemia reattiva fino a quando i segnali non sono tornati al basale. La Figura 1 illustra una panoramica del protocollo di iperemia reattiva e i passaggi dettagliati sono forniti di seguito. Le attrezzature utilizzate per lo studio sono elencate nella Tabella dei Materiali.
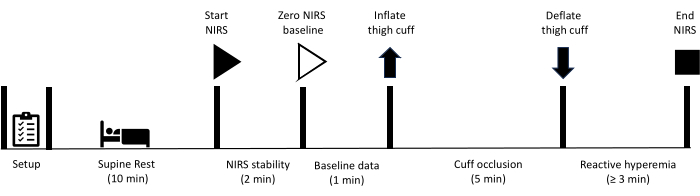
Figura 1: Schema che illustra il protocollo di misurazione dell'iperemia reattiva NIRS e i tempi. NIRS: spettroscopia nel vicino infrarosso. Clicca qui per visualizzare una versione più grande di questa figura.
1. Preparazione dell'attrezzatura
NOTA: Vari sistemi NIRS, di inflazione/occlusione della cuffia e di raccolta dati possono essere utilizzati per ottenere i risultati rappresentativi descritti di seguito. È importante che gli investigatori consultino i propri manuali utente specifici e siano consapevoli del software unico, della calibrazione, della luce ambientale e delle considerazioni specifiche del partecipante/coorte.
- Assicurarsi che tutte le misurazioni vengano eseguite in una stanza silenziosa e a temperatura controllata (21-23 °C).
- Verificare che tutte le attrezzature e i materiali (vedere la tabella dei materiali) siano disponibili.
- Assicurarsi che il dispositivo CW-NIRS e il computer a cui il dispositivo sta trasmettendo siano completamente carichi e accesi.
- Verificare che il dispositivo NIRS sia accoppiato con il computer che visualizza i dati NIRS tramite Bluetooth e che i parametri di misura dell'unità NIRS siano definiti in base al sito sperimentale e al disegno dello studio (un esempio: definire il fattore di lunghezza del percorso differenziale (DPF) della luce nel vicino infrarosso).
NOTA: La maggior parte dei passaggi del protocollo NIRS e delle impostazioni di sistema si basano su una combinazione di raccomandazioni del produttore, esperienza dei ricercatori e opinioni di esperti/consenso. Tenere presente che i valori generati durante la misurazione dipendono dal dispositivo e dalle sonde utilizzati, nonché dalle impostazioni scelte nel software del dispositivo. Esiste anche il potenziale per un alto grado di variabilità interindividuale nei segnali raccolti. Inoltre, per consentire un migliore confronto tra gli studi, è importante riportare i dettagli della strumentazione NIRS (ad esempio, includere il design della sonda, le distanze di separazione sorgente-rivelatore e le lunghezze d'onda utilizzate), le impostazioni del sistema, la posizione/orientamento della sonda in relazione alla geometria muscolare e i parametri di analisi/trattamento dei dati quando si pubblicano i risultati di queste misurazioni. - Inserire i dati del partecipante in base ai dettagli del software del dispositivo NIRS.
- Collegare il gonfiatore rapido del bracciale all'aria e alle fonti di alimentazione.
2. Preparazione dei partecipanti
- Assicurarsi che il partecipante abbia letto l'informativa e il modulo di consenso e abbia dato il proprio consenso a partecipare alla misurazione prima dell'inizio.
- Spiegare al partecipante cosa aspettarsi durante la misurazione mentre si toglie le scarpe e i calzini e rimane fermo per le misurazioni antropometriche pertinenti.
- Effettuare una misurazione delle pliche cutanee (in triplice copia) sul sito di misurazione NIRS pianificato (ad esempio, sull'aspetto mediale nel punto di massima circonferenza del polpaccio).
NOTA: Ciò consente di confermare la profondità della pelle e del tessuto adiposo (di solito indicato come spessore del tessuto adiposo - ATT) in relazione alla profondità di penetrazione del segnale NIRS. In alternativa, gli ultrasuoni possono essere utilizzati per determinare lo spessore del tessuto adiposo. Tenere sempre presente che la profondità del segnale/misura NIRS è circa la metà della distanza ricevitore-trasmettitore9. - Per massimizzare la qualità del segnale, controllare il sito pianificato della sonda trasmettitore/ricevitore NIRS per eventuali peli che potrebbero assorbire la luce e rimuovere i peli mediante rasatura, se necessario.
NOTA: Se la pelle è compromessa, ad esempio, a causa della cellulite o se è presente un edema, considerare l'adeguatezza della misurazione, poiché questi problemi riguardano la qualità del segnale potenzialmente ridotta, la profondità di penetrazione del segnale/il tessuto da cui viene effettuata la misurazione, nonché la sterilità della ferita del partecipante. - Effettuare misurazioni e/o contrassegnare la posizione del posizionamento pianificato della sonda NIRS in relazione ai punti di riferimento anatomici rilevanti (ad esempio, la superficie superiore del condilo mediale) per consentire un posizionamento accurato della sonda NIRS tra e all'interno dei partecipanti (a seconda del disegno dello studio e del design/forma della sonda) poiché le risposte all'ossigenazione possono mostrare una grande eterogeneità tra diversi muscoli o anche all'interno di regioni dello stesso muscolo.
- Chiedi al partecipante di sdraiarsi in posizione supina su un plinto o un letto d'esame. Il partecipante si riposa quindi per 10 minuti.
- Posizionare un bracciale intorno alla coscia, prossimalmente al ginocchio, assicurandosi che i tubi non entrino in contatto con il polpaccio o con il dispositivo NIRS (Figura 2).
- Sollevare la gamba (~10 cm) con il piede e la caviglia su un supporto in schiuma, lasciando la parte inferiore della gamba stabile e accessibile per le misurazioni (Figura 3).
NOTA: Se il test deve essere condotto in entrambe le tappe in più occasioni, l'ordine del test viene randomizzato (prima del test iniziale) e l'ordine dei test viene mantenuto per le valutazioni successive per ciascun partecipante. - Accendere il modulo di gonfiaggio rapido del bracciale.
NOTA: Assicurarsi che le impostazioni della modalità e della pressione del gonfiatore rapido del bracciale siano coerenti con le istruzioni del produttore e le specifiche del protocollo di occlusione vascolare. - Accendere la fonte d'aria del gonfiatore del bracciale, verificare che l'aria possa viaggiare attraverso il tubo e collegare il tubo al bracciale della coscia.
- Assicurarsi che il tubo del gonfiatore del bracciale non sia ancora a contatto con il polpaccio.
- Fissare saldamente la sonda trasmettitore/ricevitore NIRS sulla pelle sovrastante i siti di misurazione (di solito l'aspetto mediale del gastrocnemio; tuttavia, vengono utilizzati anche altri siti come il dorso del piede e il tibiale anteriore a seconda dello studio e delle specifiche dei partecipanti).
NOTA: Alcuni sistemi NIRS consentono la possibilità di effettuare più misurazioni in sito contemporaneamente. - Coprire la sonda con nastro kinesiologico nero o qualcosa di simile, facendo attenzione a sigillare i bordi per evitare che la luce ambientale influisca sulla qualità/valori del segnale NIRS (Figura 3).
NOTA: Quando si fissa la sonda e il rivestimento adesivo, assicurarsi di eliminare il movimento della sonda, ma evitare di comprimere la pelle/il tessuto adiposo/i muscoli.
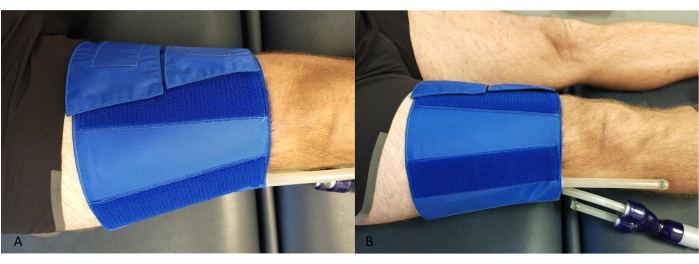
Figura 2: Esempio di posizionamento del bracciale occlusivo sulla coscia. (A) Dall'alto. (B) Di lato. Clicca qui per visualizzare una versione più grande di questa figura.
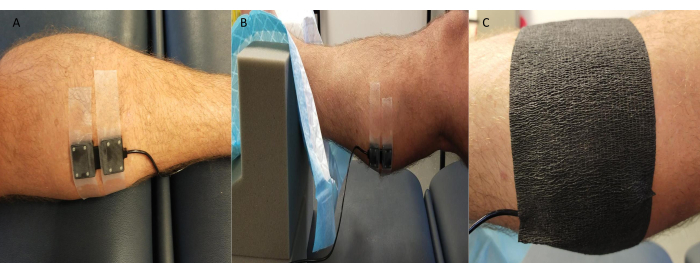
Figura 3: Esempio di posizione della sonda per spettroscopia nel vicino infrarosso. (A) Sonda attaccata alla pelle rasata al gastrocnemio mediale. (B) Posizionamento della sonda mentre la caviglia è in un supporto in schiuma per consentire l'accesso e garantire stabilità. (C) Schermatura dalla luce ambientale in posizione. Clicca qui per visualizzare una versione più grande di questa figura.
3. Raccolta dei dati di base
- Chiedi al partecipante di rimanere rilassato, di astenersi dal parlare e di tenere le gambe ferme per tutta la durata della raccolta dei dati.
- Avviare la registrazione del dispositivo NIRS tramite l'interfaccia del computer.
NOTA: Se la raccolta dati offline è abilitata e preferita, avviare direttamente il dispositivo NIRS. - Attendere l'acquisizione di almeno 2 minuti di dati prima di avviare l'inizio della misurazione. Ciò garantisce il raggiungimento di segnali in stato stazionario prima dell'acquisizione dei dati.
- Monitorare lo schermo del computer per garantire l'integrità del segnale dei dati e valori fisiologicamente plausibili. Ad esempio, i valori di acquisizione dati (DAQ) forniscono informazioni sulla qualità del segnale e sulla quantità di luce ambientale rilevata dal dispositivo NIRS. Devono essere mantenuti a un intervallo accettabile per tutta la durata della misurazione.
- Se, dopo 2 minuti, non si notano fluttuazioni nel segnale NIRS (ad esempio, a causa di artefatti di movimento), impostare la linea di base dei dati NIRS premendo il pulsante corrispondente sul computer/dispositivo/unità di sincronizzazione. Questa linea di base riflette il punto di partenza comparativo della misurazione. Le variazioni dell'emoglobina ossigenata e deossigenata saranno interpretate in relazione a questa linea di base.
NOTA: Durante la raccolta dei dati, inserire marcatori di eventi basati su software di tappe specifiche, vale a dire inizio e fine della linea di base, inizio e fine dell'occlusione della cuffia, ecc., per facilitare l'analisi dei dati. - Raccogli almeno 1 minuto di dati di base, assicurandoti ancora una volta che non si verifichino fluttuazioni o artefatti di movimento durante questo periodo.
NOTA: Le fluttuazioni dei dati di base influenzeranno l'interpretazione di alcune variabili potenziali, come la riserva iperemica (vedere la sezione dei risultati rappresentativi).
4. Occlusione vascolare
- Impostare la pressione del bracciale a 200 mmHg sul dispositivo di gonfiaggio rapido del bracciale prima di passare alla modalità bracciale (o all'impostazione pertinente su sistemi alternativi).
NOTA: Mentre alcuni autori raccomandano il gonfiaggio a 250 mmHg alla coscia 9,19, nella nostra esperienza, questo non è ben tollerato da alcuni partecipanti, portando all'interruzione della misurazione. Il gonfiaggio a 200 mmHg è sufficiente, nella maggior parte dei gruppi di partecipanti, per occludere l'afflusso arterioso a riposo, pur essendo tollerabile e senza provocare lividi sulla pelle. Per garantire un'occlusione efficace a 200 mmHg, il nostro gruppo utilizza abitualmente la pletismografia estensimetrica contemporaneamente al NIRS per confermare l'assenza di flusso sanguigno a valle durante il periodo di gonfiaggio del bracciale. - Consigliare il partecipante su cosa aspettarsi (disagio, sensazioni di formicolio, ecc.) durante il processo di gonfiaggio del bracciale a 200 mmHg per un periodo di 5 minuti, seguito da uno sgonfiaggio totale del bracciale. Ricorda nuovamente al partecipante di rimanere rilassato, astenersi dal parlare e mantenere le gambe immobili per tutta la durata della raccolta dei dati.
NOTA: È nostra esperienza che i primi 30-60 secondi del periodo di occlusione sono i meno confortevoli per i partecipanti. Quando i partecipanti lasciano che le gambe si rilassino, tendono a trovare l'occlusione più tollerabile. - Quando si è pronti per avviare il gonfiaggio del bracciale, segnare la fine del periodo di riferimento nel software NIRS.
- Gonfiare la cuffia della coscia a una pressione soprasistolica di 200 mmHg o, in alternativa, a 220 mmHg nei rari casi in cui 200 mmHg si sono dimostrati inefficaci.
- Monitorare il computer o lo schermo per garantire l'integrità dei dati durante il periodo di occlusione.
- Con l'avvicinarsi della fine dei 5 minuti di occlusione della cuffia, preparare il partecipante ricordandogli di mantenere la gamba il più ferma possibile e di astenersi dal parlare per circa 3 minuti dopo lo sgonfiaggio della cuffia (mentre vengono raccolti i dati delle risposte vascolari all'iperemia reattiva).
NOTA: Questo promemoria per il partecipante di rimanere fermo è importante, poiché i partecipanti potrebbero essere tentati di muovere l'arto per alleviare/alleviare il disagio quando la circolazione viene ripristinata.
5. Iperemia reattiva
- Trascorsi 5 minuti dall'occlusione, sgonfiare rapidamente e completamente la cuffia della coscia (a 0 mmHg). Contemporaneamente, segnare la fine del periodo occlusivo nel software NIRS. La risposta reattiva all'iperemia, dovuta alla ripresa del flusso sanguigno e ai fattori correlati, sarà visibile nel display del software NIRS (Figura 4).
- Dopo un minimo di 3 minuti dopo l'occlusione o, in alternativa, dopo che i dati NIRS sono tornati al basale, segnare la fine del periodo di recupero nel software NIRS e interrompere la misurazione.
NOTA: La durata del recupero dipende, in parte, dalla ricerca o dalla questione clinica oggetto di indagine e, quindi, dai parametri NIRS specifici scelti per l'analisi, nonché dal potenziale di misure concomitanti (come l'afta epizootica) che possono richiedere una durata di recupero più lunga. - Avvia il salvataggio dei dati e l'esportazione dei risultati NIRS per il trattamento e l'analisi dei dati.
6. Procedure di follow-up
- Rimuovere il/i dispositivo/i NIRS e il bracciale dal partecipante.
- Se necessario, pulire il dispositivo NIRS (e il bracciale per occlusione) seguendo le istruzioni del produttore e gli standard igienici pertinenti.
- Ispezionare il dispositivo NIRS per garantire l'integrità del trasmettitore/ricevitore e le prestazioni della batteria per misurazioni future.
Risultati
Spettroscopia nel vicino infrarosso
I dispositivi di spettroscopia nel vicino infrarosso a onda continua misurano le variazioni relative dell'emoglobina ossigenata (O2Hb) e deossigenata (HHb), che riflettono l'erogazione e l'utilizzo locale di O2 tramite sorgenti luminose e fotorivelatori, distinguendo distanze specifiche. Vengono emesse lunghezze d'onda della luce comprese tra ~700 nm e 850 nm, corrispondenti al picco di assorbenza di O2Hb e HHb. Una volta ch...
Discussione
Questo articolo delinea procedure standardizzate per la valutazione dell'iperemia reattiva degli arti inferiori utilizzando CW-NIRS TSI per valutare la funzione microvascolare. Questo protocollo è stato perfezionato esaminando la durata dell'occlusione della cuffia sull'entità della risposta, l'affidabilità del test-retest NIRS durante l'iperemia reattiva, nonché il livello di concordanza tra NIRS e altri metodi di valutazione microvascolare come l'ecografia con mezzo di contrasto23,24
Divulgazioni
Gli autori non hanno divulgazioni o interessi concorrenti.
Riconoscimenti
Gli autori ringraziano il Dr. A. Meneses, il cui lavoro precedente ha contribuito al perfezionamento del protocollo qui descritto. Inoltre, gli autori desiderano ringraziare tutti i partecipanti alla ricerca che hanno donato il loro tempo per consentire lo sviluppo di protocolli come questo al fine di approfondire la comprensione clinica e scientifica.
Materiali
| Name | Company | Catalog Number | Comments |
| Cuff Inflator Air Source | Hokanson | AG101 AIR SOURCE | |
| Elastic Cohesive Bandage | MaxoWrap | 18228-BL | For blocking out ambient light |
| OxySoft | Artinis | 3.3.341 x64 | |
| PortaLite (NIRS) | Artinis | 0302-00019-00 | |
| PortaSync MKII (Remote) | Artinis | 0702-00860-00 | For Marking milestones during measurement |
| Rapid Cuff Inflator | Hokanson | E20 RAPID CUFF INFLATOR | |
| Thigh Cuff | Hokanson | CC17 | |
| Transpore Surgical Tape | 3M | 1527-1 | For fixing probe to skin |
Riferimenti
- Hasani, W. S. R., et al. The global estimate of premature cardiovascular mortality: A systematic review and meta-analysis of age-standardized mortality rate. BMC Public Health. 23 (1), 1561 (2023).
- Horvath, L., et al. Epidemiology of peripheral artery disease: Narrative review. Life (Basel). 12 (7), 1041 (2022).
- Jodheea-Jutton, A., Hindocha, S., Bhaw-Luximon, A. Health economics of diabetic foot ulcer and recent trends to accelerate treatment). Foot (Edinb). 52, 101909 (2022).
- Rodrigues, B. T., Vangaveti, V. N., Urkude, R., Biros, E., Malabu, U. H. Prevalence and risk factors of lower limb amputations in patients with diabetic foot ulcers: A systematic review and meta-analysis. Diabetes Metab Syndr-Clinin Res Rev. 16 (2), 102397 (2022).
- Jung, F., et al. Microcirculation in hypertensive patients. Biorheology. 50 (5-6), 241-255 (2013).
- Bethel, M., Annex, B. H. Peripheral arterial disease: A small and large vessel problem. AmHeart J Plus: Cardio Res Prac. 28, 133291 (2023).
- Thijssen, D. H. J., et al. Expert consensus and evidence-based recommendations for the assessment of flow-mediated dilation in humans. Eur Heart J. 40 (30), 2534-2547 (2019).
- Sanada, H., et al. Vascular function in patients with lower extremity peripheral arterial disease: A comparison of functions in upper and lower extremities. Atherosclerosis. 178 (1), 179-185 (2005).
- Barstow, T. J. Understanding near-infrared spectroscopy and its application to skeletal muscle research. J App Phys. 126 (5), 1360-1376 (2019).
- Rogers, E. M., Banks, N. F., Jenkins, N. D. M. Metabolic and microvascular function assessed using near-infrared spectroscopy with vascular occlusion in women: Age differences and reliability. Exp Physiol. 108 (1), 123-134 (2023).
- Manfredini, F., et al. A toe flexion nirs assisted test for rapid assessment of foot perfusion in peripheral arterial disease: Feasibility, validity, and diagnostic accuracy. Eur J Vasc Endovasc Surg. 54 (2), 187-194 (2017).
- Boezeman, R. P., Moll, F. L., Unlu, C., De Vries, J. P. Systematic review of clinical applications of monitoring muscle tissue oxygenation with near-infrared spectroscopy in vascular disease. Microvasc Res. 104, 11-22 (2016).
- Baltrunas, T., et al. Measurement of revascularization effect using near-infrared spectroscopy in below the knee arteries. Rev Cardiovasc Med. 23 (9), 299 (2022).
- Tuesta, M., Yanez-Sepulveda, R., Verdugo-Marchese, H., Mateluna, C., Alvear-Ordenes, I. Near-infrared spectroscopy used to assess physiological muscle adaptations in exercise clinical trials: A systematic review. Biology (Basel). 11 (7), 1073 (2022).
- Cornelis, N., et al. The use of near-infrared spectroscopy to evaluate the effect of exercise on peripheral muscle oxygenation in patients with lower extremity artery disease: A systematic review. Eur J Vasc Endovasc Surg. 61 (5), 837-847 (2021).
- Whyte, E., Thomas, S., Marzolini, S. Muscle oxygenation of the paretic and nonparetic legs during and after exercise in chronic stroke: Implications for mobility. PM R. 15 (10), 1239-1248 (2023).
- Soares, R. N., George, M. A., Proctor, D. N., Murias, J. M. Differences in vascular function between trained and untrained limbs assessed by near-infrared spectroscopy. Eur J Appl Physiol. 118 (10), 2241-2248 (2018).
- Joseph, S., et al. Near infrared spectroscopy in peripheral artery disease and the diabetic foot: A systematic review. Diabetes Metab Res Rev. 38 (7), 3571 (2022).
- Willingham, T. B., Southern, W. M., Mccully, K. K. Measuring reactive hyperemia in the lower limb using near-infrared spectroscopy. J Biomed Opt. 21 (9), 091302 (2016).
- Jones, S., Chiesa, S. T., Chaturvedi, N., Hughes, A. D. Recent developments in near-infrared spectroscopy (nirs) for the assessment of local skeletal muscle microvascular function and capacity to utilise oxygen. Artery Res. 16, 25-33 (2016).
- Soares, R. N., et al. Effects of a rehabilitation program on microvascular function of CHD patients assessed by near-infrared spectroscopy. Physiol Rep. 7 (11), e14145 (2019).
- Baltrunas, T., et al. The use of near-infrared spectroscopy in the diagnosis of peripheral artery disease: A systematic review. Vascular. 30 (4), 715-727 (2022).
- Young, G. M., et al. Influence of cuff-occlusion duration on contrast-enhanced ultrasound assessments of calf muscle microvascular blood flow responsiveness in older adults. Exp Physiol. 105 (12), 2238-2245 (2020).
- Young, G. M., et al. The association between contrast-enhanced ultrasound and near-infrared spectroscopy-derived measures of calf muscle microvascular responsiveness in older adults. Heart Lung Circ. 30 (11), 1726-1733 (2021).
- Rosenberry, R., Nelson, M. D. Reactive hyperemia: A review of methods, mechanisms, and considerations. Am J Physiol Regul Integr Comp Physiol. 318 (3), R605-R618 (2020).
- Iannetta, D., et al. Reliability of microvascular responsiveness measures derived from near-infrared spectroscopy across a variety of ischemic periods in young and older individuals. Microvasc Res. 122, 117-124 (2019).
- Celermajer, D. S., et al. Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis. Lancet. 340 (8828), 1111-1115 (1992).
- Thijssen, D. H. J., et al. Assessment of flow-mediated dilation in humans: A methodological and physiological guideline. Am J Physiol-Heart Circ Physiol. 300 (1), H2-H12 (2011).
- Inaba, Y., Chen, J. A., Bergmann, S. R. Prediction of future cardiovascular outcomes by flow-mediated vasodilatation of brachial artery: A meta-analysis. Int J Cardiovasc Imaging. 26 (6), 631-640 (2010).
- Soares, R. N., De Oliveira, G. V., Alvares, T. S., Murias, J. M. The effects of the analysis strategy on the correlation between the NIRS reperfusion measures and the FMD response. Microvasc Res. 127, 103922 (2020).
- Tucker, W. J., et al. Studies into the determinants of skeletal muscle oxygen consumption: Novel insight from near-infrared diffuse correlation spectroscopy. J Physiol-London. 597 (11), 2887-2901 (2019).
- Tucker, W. J., et al. Near-infrared diffuse correlation spectroscopy tracks changes in oxygen delivery and utilization during exercise with and without isolated arterial compression. Am J Physiol Regul Integr Comp Physiol. 318 (1), R81-R88 (2020).
- Wassenaar, E. B., Van Den Brand, J. G. Reliability of near-infrared spectroscopy in people with dark skin pigmentation. J Clinic Monit Comput. 19 (3), 195-199 (2005).
- Soares, R. N., Murias, J. M. Near-infrared spectroscopy assessment of microvasculature detects difference in lower limb vascular responsiveness in obese compared to lean individuals. Microvasc Res. 118, 31-35 (2018).
- Boezeman, R. P., et al. Monitoring of foot oxygenation with near-infrared spectroscopy in patients with critical limb ischemia undergoing percutaneous transluminal angioplasty: A pilot study. Eur J Vasc Endovasc Surg. 52 (5), 650-656 (2016).
- Lin, B. S., et al. Using wireless near-infrared spectroscopy to predict wound prognosis in diabetic foot ulcers. Adv Skin Wound Care. 33 (1), 1-12 (2020).
- Weingarten, M. S., et al. Diffuse near-infrared spectroscopy prediction of healing in diabetic foot ulcers: A human study and cost analysis. Wound Repair. 20 (2), A44-A44 (2012).
- Murrow, J. R., et al. Near-infrared spectroscopy-guided exercise training for claudication in peripheral arterial disease. Eur J Prev Cardiol. 26 (5), 471-480 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon