Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Espectroscopia de infrarrojo cercano durante la hiperemia reactiva para la evaluación de la función vascular de las extremidades inferiores
En este artículo
Resumen
En este trabajo describimos un enfoque no invasivo que utiliza espectroscopia de infrarrojo cercano para evaluar la hiperemia reactiva en el miembro inferior. Este protocolo proporciona una evaluación estandarizada de la capacidad de respuesta vascular y microvascular que puede utilizarse para determinar la presencia de disfunción vascular, así como la eficacia de las intervenciones terapéuticas.
Resumen
Las enfermedades vasculares de las extremidades inferiores contribuyen sustancialmente a la carga mundial de enfermedades cardiovasculares y comorbilidades como la diabetes. Es importante destacar que la disfunción microvascular puede ocurrir antes o junto con la patología macrovascular, y ambas pueden contribuir a los síntomas del paciente y a la carga de la enfermedad. Aquí, describimos un enfoque no invasivo que utiliza espectroscopia de infrarrojo cercano (NIRS) durante la hiperemia reactiva, que proporciona una evaluación estandarizada de la (dis)función vascular de las extremidades inferiores y un método potencial para evaluar la eficacia de las intervenciones terapéuticas. A diferencia de los métodos alternativos, como la ecografía con contraste, este enfoque no requiere acceso venoso ni análisis sofisticado de imágenes, y es barato y menos dependiente del operador. Esta descripción del método NIRS incluye resultados representativos y terminología estándar junto con la discusión de las consideraciones de medición, limitaciones y métodos alternativos. La aplicación futura de este trabajo mejorará la estandarización del diseño de la investigación vascular, los procedimientos de recopilación de datos y la presentación armonizada de informes, mejorando así los resultados de la investigación traslacional en las áreas de (dis)función, enfermedad y tratamiento vascular de las extremidades inferiores.
Introducción
Las enfermedades cardiovasculares (ECV) son el principal contribuyente a la mortalidad mundial1. Si bien el infarto de miocardio y el accidente cerebrovascular son las manifestaciones más comunes de las ECV, las enfermedades vasculares de las extremidades inferiores, como la enfermedad arterial periférica (EAP) y la enfermedad del pie diabético, contribuyen sustancialmente a la carga personal, social y sanitaria de las ECV 2,3,4. Es importante destacar que estos estados de enfermedad se caracterizan por disfunción microvascular y macrovascular5 que contribuyen a los síntomas (por ejemplo, claudicación intermitente), deterioro funcional, poca movilidad, así como aislamiento social y reducción de la calidad de vida6. Históricamente, las técnicas de evaluación vascular de las extremidades superiores se han utilizado como medida de la función vascular sistémica y el riesgo cardiovascular asociado; Sin embargo, estos métodos no son potencialmente sensibles a las alteraciones locales en la función vascular de los miembros inferiores 7,8. Si bien actualmente existe una variedad de técnicas utilizadas para evaluar la función vascular en la extremidad inferior, como la dilatación mediada por flujo (FMD) y la ecografía con contraste, cada método tiene desventajas y limitaciones, como el costo del equipo, la habilidad del operador o la necesidad de acceso venoso invasivo. Por estas razones, existe la necesidad de técnicas estandarizadas y efectivas para evaluar la función vascular (dis) de las extremidades inferiores que puedan implementarse más fácilmente en entornos clínicos y de investigación.
La espectroscopia de onda continua de infrarrojo cercano (CW-NIRS) es un método no invasivo, de bajo costo y portátil que cuantifica los cambios relativos en la oxigenación de la hemoglobina in vivo. Dado que las señales de hemoglobina oxigenada y desoxigenada NIRS se derivan de los vasos pequeños (<1 mm de diámetro), se puede evaluar el metabolismo del músculo esquelético local y la función microvascular9. En concreto, el índice de saturación tisular (TSI) [TSI = hemoglobina oxigenada/ (hemoglobina oxigenada + hemoglobina desoxigenada) x 100], proporciona una medida cuantitativa de la oxigenación tisular9. Cuando se miden antes, durante y después de la oclusión y la hiperemia reactiva, los cambios en la TSI indican la capacidad de respuesta vascular de los "órganos terminales", en relación con la línea de base previa a la oclusión. Es importante destacar que este método es sensible a las alteraciones en la capacidad de respuesta y perfusión microvascular muscular asociadas con el envejecimiento10, la progresión de la enfermedad11 y las intervenciones clínicas (p. ej., cirugía de revascularización12,13 o rehabilitación con ejercicios 14,15,16,17) en individuos con disfunción microvascular o en riesgo de padecerla.
La disponibilidad de sistemas NIRS ha llevado a un rápido aumento en el número de estudios de investigación que informan sobre la función microvascular18. Sin embargo, las diferencias en los protocolos de prueba de hiperemia reactiva, la omisión de métodos NIRS detallados y repetibles, así como la falta de uniformidad en la descripción, presentación y análisis de los parámetros de respuesta NIRS hacen que las comparaciones entre ensayos individuales sean difíciles. Esto limita la recopilación de datos para el metanálisis y la formulación de recomendaciones de evaluación clínica 9,15.
Por lo tanto, en este artículo, describimos los protocolos estandarizados de pruebas NIRS y de oclusión vascular de nuestro laboratorio para la evaluación de la hiperemia reactiva de miembros inferiores. Con la difusión de estos métodos, nuestro objetivo es contribuir a mejorar la normalización y la repetibilidad de los procedimientos de recopilación de datos y la presentación de informes armonizados.
Protocolo
Todos los métodos descritos aquí han sido aprobados por el comité de ética de investigación en humanos de la Universidad de Sunshine Coast. Además, todos los participantes dieron su consentimiento informado por escrito para participar en las mediciones descritas en este protocolo. Tenga en cuenta que la prueba de oclusión vascular en la extremidad inferior está contraindicada en personas que se han sometido previamente a un procedimiento de revascularización que implica un injerto vascular o la colocación de un stent en las arterias femoral o poplítea. Después de preparar el equipo, se indica al participante que descanse en posición supina durante 10 minutos. En este punto, comienza la recopilación de datos NIRS, con un período inicial de 2 minutos, lo que permite lograr la estabilidad de las señales NIRS. A continuación, se recogen los datos basales durante 1 minuto, momento en el que se infla rápidamente un manguito situado en el muslo para lograr la oclusión arterial. La oclusión se mantiene durante 5 minutos antes de que el manguito se desinfle rápidamente. La recopilación de datos continúa durante todo el período de hiperemia reactiva hasta que las señales se hayan recuperado a la línea de base. La Figura 1 muestra una descripción general del protocolo de hiperemia reactiva, y los pasos detallados se proporcionan a continuación. Los equipos utilizados para el estudio se enumeran en la Tabla de Materiales.
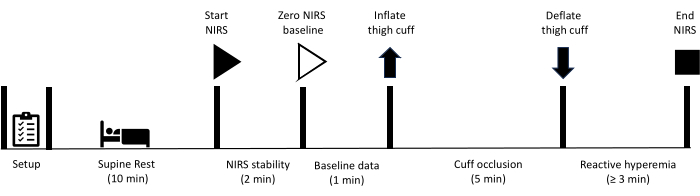
Figura 1: Esquema que describe el protocolo de medición de la hiperemia reactiva NIRS y los tiempos. NIRS: espectroscopía de infrarrojo cercano. Haga clic aquí para ver una versión más grande de esta figura.
1. Preparación del equipo
NOTA: Se pueden utilizar varios sistemas de NIRS, inflado/oclusión del manguito y de recopilación de datos para obtener los resultados representativos que se describen a continuación. Es importante que los investigadores consulten sus propios manuales de usuario específicos y estén al tanto del software único, la calibración, la luz ambiental y las consideraciones específicas de los participantes/cohortes.
- Asegúrese de que todas las mediciones se realicen en una habitación tranquila y con temperatura controlada (21-23 °C).
- Confirme que todos los equipos y materiales (consulte la Tabla de materiales) estén disponibles.
- Asegúrese de que el dispositivo CW-NIRS y la computadora a la que transmite el dispositivo estén completamente cargados y encendidos.
- Compruebe que el dispositivo NIRS esté emparejado con el ordenador que muestra los datos NIRS a través de Bluetooth y que los parámetros de medición de la unidad NIRS estén definidos de acuerdo con el sitio experimental y el diseño del estudio (por ejemplo: definir el factor de longitud de paso diferencial (DPF) de la luz infrarroja cercana).
NOTA: La mayoría de los pasos del protocolo NIRS y la configuración del sistema se basan en una combinación de las recomendaciones del fabricante, la experiencia de los investigadores y la opinión de expertos/consenso. Tenga en cuenta que los valores generados durante la medición dependen del dispositivo y las sondas concretas utilizadas, así como de los ajustes elegidos en el software del dispositivo. También existe la posibilidad de un alto grado de variabilidad interindividual en las señales recogidas. Además, para permitir una mejor comparación entre los estudios, es importante informar sobre los detalles de la instrumentación NIRS (por ejemplo, incluir el diseño de la sonda, las distancias de separación fuente-detector y las longitudes de onda utilizadas), la configuración del sistema, la posición/orientación de la sonda en relación con la geometría del músculo y los parámetros de análisis/tratamiento de datos al publicar los resultados de estas mediciones. - Introduzca los datos del participante de acuerdo con las especificaciones del software del dispositivo NIRS.
- Conecte el inflador rápido de manguito al aire y a las fuentes de energía.
2. Preparación de los participantes
- Asegúrese de que el participante haya leído la declaración de información del participante y el formulario de consentimiento y haya dado su consentimiento para participar en la medición antes del inicio.
- Explique al participante qué esperar durante la medición mientras se quita los zapatos y los calcetines y permanece inmóvil para las mediciones antropométricas relevantes.
- Realice una medición del pliegue cutáneo (por triplicado) sobre el sitio de medición NIRS planificado (p. ej., en la cara medial en el punto de circunferencia máxima de la pantorrilla).
NOTA: Esto permite confirmar la profundidad de la piel y el tejido adiposo (lo que se conoce habitualmente como grosor del tejido adiposo - ATT) en relación con la profundidad de penetración de la señal NIRS. Alternativamente, se puede utilizar la ecografía para determinar el grosor del tejido adiposo. Tenga siempre en cuenta que la profundidad de la señal/medición NIRS es aproximadamente la mitad de la distancia receptor-transmisor9. - Para maximizar la calidad de la señal, compruebe el emplazamiento previsto de la sonda transmisora/receptora NIRS para ver si hay pelo que pueda absorber luz y elimine el vello afeitándolo si es necesario.
NOTA: Si la piel está comprometida, por ejemplo, por celulitis, o si hay edema, considere la idoneidad de la medición, ya que estos problemas se relacionan con la calidad de la señal potencialmente reducida, la profundidad de penetración de la señal/tejido del que se toma la medición, así como la esterilidad de la herida del participante. - Tomar medidas y/o marcar la posición de la colocación planificada de la sonda NIRS en relación con los puntos de referencia anatómicos relevantes (por ejemplo, la superficie superior del cóndilo medial) para permitir la colocación precisa de la sonda NIRS entre y dentro de los participantes (dependiendo del diseño del estudio y del diseño/forma de la sonda), ya que las respuestas de oxigenación pueden mostrar una gran heterogeneidad entre diferentes músculos o incluso dentro de regiones del mismo músculo.
- Pida al participante que se acueste en posición supina sobre un pedestal o cama de examen. A continuación, el participante descansa durante 10 minutos.
- Coloque un brazalete alrededor del muslo, proximal a la rodilla, asegurándose de que los tubos no entren en contacto con la pantorrilla o el dispositivo NIRS (Figura 2).
- Eleve la pierna (~10 cm) con el pie y el tobillo sobre un soporte de espuma, dejando la parte inferior de la pierna estable y accesible para las mediciones (Figura 3).
NOTA: Si se requiere que la prueba se realice en ambos tramos en varias ocasiones, el orden de la prueba es aleatorio (antes de la prueba inicial) y el orden de la prueba se mantiene para las evaluaciones posteriores de cada participante. - Encienda el módulo de inflado rápido del manguito.
NOTA: Asegúrese de que los ajustes de modo y presión del inflador rápido de manguito sean consistentes con las instrucciones del fabricante y las especificaciones del protocolo de oclusión vascular. - Encienda la fuente de aire del inflador del manguito, verifique que el aire pueda viajar a través de la manguera y conecte la manguera al manguito del muslo.
- Asegúrese de que la manguera del inflador del manguito no esté en contacto con la pantorrilla.
- Fije la sonda transmisora/receptora NIRS de forma segura en la piel que recubre los sitios de medición (rutinariamente la cara medial del gastrocnemio; sin embargo, también se utilizan otros sitios como el dorso del pie y el tibial anterior, según el estudio y las características específicas de los participantes).
NOTA: Algunos sistemas NIRS permiten la posibilidad de realizar múltiples mediciones en el sitio simultáneamente. - Cubra la sonda con cinta de kinesiología negra o algo similar, teniendo cuidado de sellar los bordes para evitar que la luz ambiental afecte la calidad/valores de la señal NIRS (Figura 3).
NOTA: Al fijar la sonda y la cubierta adhesiva, asegúrese de eliminar el movimiento de la sonda, pero evite comprimir la piel/tejido adiposo/músculo.
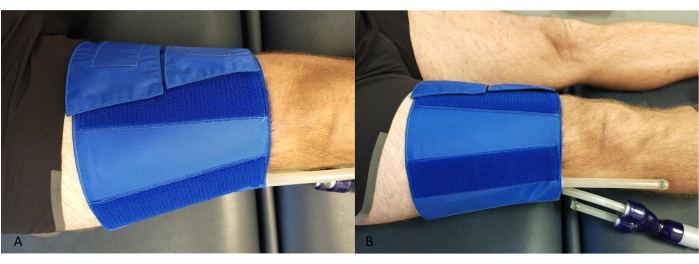
Figura 2: Ejemplo de la colocación del manguito oclusivo en el muslo. (A) Desde arriba. (B) Desde el costado. Haga clic aquí para ver una versión más grande de esta figura.
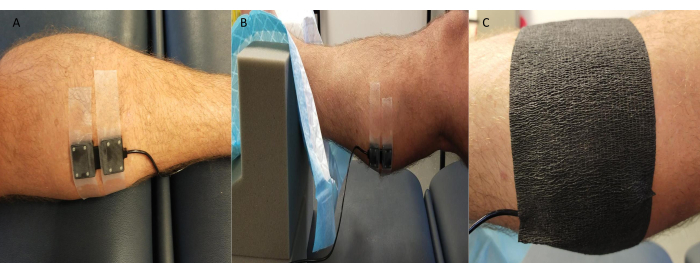
Figura 3: Ejemplo de la posición de la sonda de espectroscopia de infrarrojo cercano. (A) Sonda adherida a la piel afeitada en el gastrocnemio medial. (B) Colocación de la sonda mientras el tobillo está en soporte de espuma para permitir el acceso y garantizar la estabilidad. (C) Blindaje de luz ambiental en su lugar. Haga clic aquí para ver una versión más grande de esta figura.
3. Recopilación de datos de referencia
- Pida al participante que permanezca relajado, que se abstenga de hablar y que mantenga sus piernas quietas durante la recolección de datos.
- Inicie la grabación del dispositivo NIRS a través de la interfaz del ordenador.
NOTA: Si la recopilación de datos sin conexión está habilitada y se prefiere, inicie el dispositivo NIRS directamente. - Permita que se adquieran al menos 2 minutos de datos antes de iniciar el inicio de la medición. Esto garantiza que se logren señales de estado estacionario antes de la adquisición de datos.
- Monitoree la pantalla de la computadora para garantizar la integridad de la señal de datos y los valores fisiológicamente plausibles. Por ejemplo, los valores de adquisición de datos (DAQ) proporcionan información sobre la calidad de la señal y la cantidad de luz ambiental detectada por el dispositivo NIRS. Deben mantenerse a un rango aceptable durante toda la medición.
- Si, después de 2 minutos, no se observan fluctuaciones en la señal NIRS (por ejemplo, debido a un artefacto de movimiento), establezca la línea de base de datos NIRS presionando el botón correspondiente en la computadora / dispositivo / unidad de sincronización. Esta línea de base refleja el punto de partida comparativo de la medición. Los cambios en la hemoglobina oxigenada y desoxigenada se interpretarán en relación con esta línea de base.
NOTA: Durante la recopilación de datos, inserte marcadores de eventos basados en software de hitos específicos, a saber, inicio y final de la línea de base, inicio y final de la oclusión del manguito, etc., para ayudar en el análisis de datos. - Recopile al menos 1 minuto de datos de referencia, asegurándose de nuevo de que no se produzcan fluctuaciones ni artefactos de movimiento durante este tiempo.
NOTA: Las fluctuaciones en los datos de referencia afectarán la interpretación de algunas variables potenciales, como la reserva hiperémica (ver sección de resultados representativos).
4. Oclusión vascular
- Ajuste la presión del manguito a 200 mmHg en el inflador rápido del manguito antes de cambiar al modo de manguito (o la configuración correspondiente en sistemas alternativos).
NOTA: Si bien algunos autores recomiendan el inflado a 250 mmHg en el muslo 9,19, en nuestra experiencia, esto no es bien tolerado por algunos participantes, lo que lleva a suspender la medición. El inflado a 200 mmHg es suficiente, en la mayoría de los grupos de participantes, para ocluir la entrada arterial en reposo, mientras que es tolerable y no provoca hematomas en la piel. Para garantizar que se logre una oclusión efectiva a 200 mmHg, nuestro grupo utiliza de forma rutinaria la pletismografía con galgas extensométricas simultáneamente con NIRS para confirmar la ausencia de flujo sanguíneo aguas abajo durante el período de inflado del manguito. - Aconseje al participante sobre lo que puede esperar (molestias, sensaciones de hormigueo, etc.) durante el proceso de inflado del manguito a 200 mmHg durante un período de 5 minutos, seguido de un desinflado total del manguito. Recuérdele nuevamente al participante que permanezca relajado, se abstenga de hablar y mantenga su(s) pierna(s) inmóvil(es) durante la recolección de datos.
NOTA: Según nuestra experiencia, los primeros 30-60 s del período de oclusión son los menos cómodos para los participantes. Cuando los participantes dejan que sus piernas se relajen, tienden a encontrar la oclusión más tolerable. - Cuando esté listo para iniciar el inflado del manguito, marque el final del período de referencia en el software NIRS.
- Inflar el manguito del muslo a una presión suprasistólica de 200 mmHg, o alternativamente a 220 mmHg en casos raros en los que 200 mmHg ha demostrado ser ineficaz.
- Supervise la computadora o la pantalla para garantizar la integridad de los datos durante el período de oclusión.
- A medida que se acerca el final de los 5 minutos de oclusión del manguito, prepare al participante recordándole que mantenga la pierna lo más quieta posible y que se abstenga de hablar durante aproximadamente 3 minutos después del desinflado del manguito (mientras se recopilan los datos de las respuestas vasculares a la hiperemia reactiva).
NOTA: Este recordatorio para que el participante permanezca quieto es importante, ya que los participantes pueden sentirse tentados a mover la extremidad para aliviar/aliviar el malestar a medida que se restablece la circulación.
5. Hiperemia reactiva
- Después de que hayan pasado 5 minutos de oclusión, desinfle rápidamente el manguito del muslo por completo (a 0 mmHg). Al mismo tiempo, marque el final del período oclusivo en el software NIRS. La respuesta reactiva a la hiperemia, debido a la reanudación del flujo sanguíneo y los factores relacionados, será visible en la pantalla del software NIRS (Figura 4).
- Después de un mínimo de 3 minutos después de la oclusión, o alternativamente, después de que los datos NIRS hayan vuelto a la línea de base, marque el final del período de recuperación en el software NIRS y detenga la medición.
NOTA: La duración de la recuperación depende, en parte, de la investigación o de la pregunta clínica que se esté investigando y, por lo tanto, de los parámetros NIRS específicos elegidos para el análisis, así como de la posibilidad de medidas concomitantes (como la fiebre aftosa) que puedan requerir una duración de recuperación más larga. - Inicie el almacenamiento de datos y la exportación de los resultados NIRS para el tratamiento y análisis de datos.
6. Procedimientos de seguimiento
- Retire el/los dispositivo(s) NIRS y el brazalete del participante.
- Si es necesario, limpie el dispositivo NIRS (y el manguito de oclusión) siguiendo las instrucciones del fabricante y las normas de higiene pertinentes.
- Inspeccione el dispositivo NIRS para garantizar la integridad del transmisor/receptor y el rendimiento de la batería para futuras mediciones.
Resultados
Espectroscopía de infrarrojo cercano
Los dispositivos de espectroscopia de onda continua en el infrarrojo cercano miden los cambios relativos en la hemoglobina oxigenada (O2Hb) y desoxigenada (HHb), que reflejan la entrega y utilización local deO2 a través de fuentes emisoras de luz y fotodetectores, separadas por distancias específicas. Se emiten longitudes de onda de luz entre ~700 nm y 850 nm, correspondientes a la absorbencia máxima deO2Hb y HHb. Una ...
Discusión
Este artículo describe los procedimientos estandarizados para la evaluación de la hiperemia reactiva de las extremidades inferiores utilizando CW-NIRS TSI para evaluar la función microvascular. Este protocolo ha sido refinado mediante el examen de la duración de la oclusión del manguito en la magnitud de la respuesta, la fiabilidad del NIRS test-retest durante la hiperemia reactiva, así como el nivel de concordancia entre el NIRS y otros métodos de evaluación microvascular como la ecografía con contraste
Divulgaciones
Los autores no tienen divulgaciones ni intereses contrapuestos.
Agradecimientos
Los autores desean expresar su agradecimiento al Dr. A. Meneses, cuyo trabajo previo contribuyó al perfeccionamiento del protocolo aquí descrito. Además, los autores quieren agradecer a todos los participantes en la investigación que han donado su tiempo para permitir que se desarrollen protocolos como este con el fin de avanzar en la comprensión clínica y científica.
Materiales
| Name | Company | Catalog Number | Comments |
| Cuff Inflator Air Source | Hokanson | AG101 AIR SOURCE | |
| Elastic Cohesive Bandage | MaxoWrap | 18228-BL | For blocking out ambient light |
| OxySoft | Artinis | 3.3.341 x64 | |
| PortaLite (NIRS) | Artinis | 0302-00019-00 | |
| PortaSync MKII (Remote) | Artinis | 0702-00860-00 | For Marking milestones during measurement |
| Rapid Cuff Inflator | Hokanson | E20 RAPID CUFF INFLATOR | |
| Thigh Cuff | Hokanson | CC17 | |
| Transpore Surgical Tape | 3M | 1527-1 | For fixing probe to skin |
Referencias
- Hasani, W. S. R., et al. The global estimate of premature cardiovascular mortality: A systematic review and meta-analysis of age-standardized mortality rate. BMC Public Health. 23 (1), 1561 (2023).
- Horvath, L., et al. Epidemiology of peripheral artery disease: Narrative review. Life (Basel). 12 (7), 1041 (2022).
- Jodheea-Jutton, A., Hindocha, S., Bhaw-Luximon, A. Health economics of diabetic foot ulcer and recent trends to accelerate treatment). Foot (Edinb). 52, 101909 (2022).
- Rodrigues, B. T., Vangaveti, V. N., Urkude, R., Biros, E., Malabu, U. H. Prevalence and risk factors of lower limb amputations in patients with diabetic foot ulcers: A systematic review and meta-analysis. Diabetes Metab Syndr-Clinin Res Rev. 16 (2), 102397 (2022).
- Jung, F., et al. Microcirculation in hypertensive patients. Biorheology. 50 (5-6), 241-255 (2013).
- Bethel, M., Annex, B. H. Peripheral arterial disease: A small and large vessel problem. AmHeart J Plus: Cardio Res Prac. 28, 133291 (2023).
- Thijssen, D. H. J., et al. Expert consensus and evidence-based recommendations for the assessment of flow-mediated dilation in humans. Eur Heart J. 40 (30), 2534-2547 (2019).
- Sanada, H., et al. Vascular function in patients with lower extremity peripheral arterial disease: A comparison of functions in upper and lower extremities. Atherosclerosis. 178 (1), 179-185 (2005).
- Barstow, T. J. Understanding near-infrared spectroscopy and its application to skeletal muscle research. J App Phys. 126 (5), 1360-1376 (2019).
- Rogers, E. M., Banks, N. F., Jenkins, N. D. M. Metabolic and microvascular function assessed using near-infrared spectroscopy with vascular occlusion in women: Age differences and reliability. Exp Physiol. 108 (1), 123-134 (2023).
- Manfredini, F., et al. A toe flexion nirs assisted test for rapid assessment of foot perfusion in peripheral arterial disease: Feasibility, validity, and diagnostic accuracy. Eur J Vasc Endovasc Surg. 54 (2), 187-194 (2017).
- Boezeman, R. P., Moll, F. L., Unlu, C., De Vries, J. P. Systematic review of clinical applications of monitoring muscle tissue oxygenation with near-infrared spectroscopy in vascular disease. Microvasc Res. 104, 11-22 (2016).
- Baltrunas, T., et al. Measurement of revascularization effect using near-infrared spectroscopy in below the knee arteries. Rev Cardiovasc Med. 23 (9), 299 (2022).
- Tuesta, M., Yanez-Sepulveda, R., Verdugo-Marchese, H., Mateluna, C., Alvear-Ordenes, I. Near-infrared spectroscopy used to assess physiological muscle adaptations in exercise clinical trials: A systematic review. Biology (Basel). 11 (7), 1073 (2022).
- Cornelis, N., et al. The use of near-infrared spectroscopy to evaluate the effect of exercise on peripheral muscle oxygenation in patients with lower extremity artery disease: A systematic review. Eur J Vasc Endovasc Surg. 61 (5), 837-847 (2021).
- Whyte, E., Thomas, S., Marzolini, S. Muscle oxygenation of the paretic and nonparetic legs during and after exercise in chronic stroke: Implications for mobility. PM R. 15 (10), 1239-1248 (2023).
- Soares, R. N., George, M. A., Proctor, D. N., Murias, J. M. Differences in vascular function between trained and untrained limbs assessed by near-infrared spectroscopy. Eur J Appl Physiol. 118 (10), 2241-2248 (2018).
- Joseph, S., et al. Near infrared spectroscopy in peripheral artery disease and the diabetic foot: A systematic review. Diabetes Metab Res Rev. 38 (7), 3571 (2022).
- Willingham, T. B., Southern, W. M., Mccully, K. K. Measuring reactive hyperemia in the lower limb using near-infrared spectroscopy. J Biomed Opt. 21 (9), 091302 (2016).
- Jones, S., Chiesa, S. T., Chaturvedi, N., Hughes, A. D. Recent developments in near-infrared spectroscopy (nirs) for the assessment of local skeletal muscle microvascular function and capacity to utilise oxygen. Artery Res. 16, 25-33 (2016).
- Soares, R. N., et al. Effects of a rehabilitation program on microvascular function of CHD patients assessed by near-infrared spectroscopy. Physiol Rep. 7 (11), e14145 (2019).
- Baltrunas, T., et al. The use of near-infrared spectroscopy in the diagnosis of peripheral artery disease: A systematic review. Vascular. 30 (4), 715-727 (2022).
- Young, G. M., et al. Influence of cuff-occlusion duration on contrast-enhanced ultrasound assessments of calf muscle microvascular blood flow responsiveness in older adults. Exp Physiol. 105 (12), 2238-2245 (2020).
- Young, G. M., et al. The association between contrast-enhanced ultrasound and near-infrared spectroscopy-derived measures of calf muscle microvascular responsiveness in older adults. Heart Lung Circ. 30 (11), 1726-1733 (2021).
- Rosenberry, R., Nelson, M. D. Reactive hyperemia: A review of methods, mechanisms, and considerations. Am J Physiol Regul Integr Comp Physiol. 318 (3), R605-R618 (2020).
- Iannetta, D., et al. Reliability of microvascular responsiveness measures derived from near-infrared spectroscopy across a variety of ischemic periods in young and older individuals. Microvasc Res. 122, 117-124 (2019).
- Celermajer, D. S., et al. Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis. Lancet. 340 (8828), 1111-1115 (1992).
- Thijssen, D. H. J., et al. Assessment of flow-mediated dilation in humans: A methodological and physiological guideline. Am J Physiol-Heart Circ Physiol. 300 (1), H2-H12 (2011).
- Inaba, Y., Chen, J. A., Bergmann, S. R. Prediction of future cardiovascular outcomes by flow-mediated vasodilatation of brachial artery: A meta-analysis. Int J Cardiovasc Imaging. 26 (6), 631-640 (2010).
- Soares, R. N., De Oliveira, G. V., Alvares, T. S., Murias, J. M. The effects of the analysis strategy on the correlation between the NIRS reperfusion measures and the FMD response. Microvasc Res. 127, 103922 (2020).
- Tucker, W. J., et al. Studies into the determinants of skeletal muscle oxygen consumption: Novel insight from near-infrared diffuse correlation spectroscopy. J Physiol-London. 597 (11), 2887-2901 (2019).
- Tucker, W. J., et al. Near-infrared diffuse correlation spectroscopy tracks changes in oxygen delivery and utilization during exercise with and without isolated arterial compression. Am J Physiol Regul Integr Comp Physiol. 318 (1), R81-R88 (2020).
- Wassenaar, E. B., Van Den Brand, J. G. Reliability of near-infrared spectroscopy in people with dark skin pigmentation. J Clinic Monit Comput. 19 (3), 195-199 (2005).
- Soares, R. N., Murias, J. M. Near-infrared spectroscopy assessment of microvasculature detects difference in lower limb vascular responsiveness in obese compared to lean individuals. Microvasc Res. 118, 31-35 (2018).
- Boezeman, R. P., et al. Monitoring of foot oxygenation with near-infrared spectroscopy in patients with critical limb ischemia undergoing percutaneous transluminal angioplasty: A pilot study. Eur J Vasc Endovasc Surg. 52 (5), 650-656 (2016).
- Lin, B. S., et al. Using wireless near-infrared spectroscopy to predict wound prognosis in diabetic foot ulcers. Adv Skin Wound Care. 33 (1), 1-12 (2020).
- Weingarten, M. S., et al. Diffuse near-infrared spectroscopy prediction of healing in diabetic foot ulcers: A human study and cost analysis. Wound Repair. 20 (2), A44-A44 (2012).
- Murrow, J. R., et al. Near-infrared spectroscopy-guided exercise training for claudication in peripheral arterial disease. Eur J Prev Cardiol. 26 (5), 471-480 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados