需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Methods Article
反应性充血期间的近红外光谱评估下肢血管功能
摘要
在这里,我们描述了一种使用近红外光谱来评估下肢反应性充血的非侵入性方法。该方案提供了血管和微血管反应性的标准化评估,可用于确定血管功能障碍的存在以及治疗干预的疗效。
摘要
下肢血管疾病对心血管疾病和糖尿病等合并症的全球负担造成了重大影响。重要的是,微血管功能障碍可能发生在大血管病变之前或同时发生,并且都可能导致患者的症状和疾病负担。在这里,我们描述了一种在反应性充血期间使用近红外光谱 (NIRS) 的无创方法,该方法提供了下肢血管(异常)功能的标准化评估和评估治疗干预疗效的潜在方法。与对比增强超声等替代方法不同,这种方法不需要静脉通路或复杂的图像分析,而且价格低廉,对操作员的依赖性较小。NIRS 方法的描述包括代表性结果和标准术语,以及对测量注意事项、局限性和替代方法的讨论。这项工作的未来应用将提高血管研究设计、数据收集程序和协调报告的标准化,从而加强下肢血管(异常)功能、疾病和治疗领域的转化研究成果。
引言
心血管疾病 (CVD) 是导致全球死亡的主要原因1。虽然心肌梗死和中风是 CVD 最常见的表现,但下肢血管疾病,如外周动脉疾病 (PAD) 和糖尿病足病,对 CVD 的个人、社会和医疗保健负担有很大影响 2,3,4。重要的是,这些疾病状态的特征是微血管和大血管功能障碍5 (microvascular and macrovascular dysfunction),这会导致症状(例如间歇性跛行)、功能障碍、行动不便以及社会孤立和生活质量下降6 (life quality)。从历史上看,上肢血管评估技术一直被用作全身血管功能和相关心血管风险的衡量标准;然而,这些方法可能对下肢血管功能的局部损伤不敏感 7,8。虽然目前有一系列技术用于评估下肢血管功能,例如血流介导的扩张 (FMD) 和对比增强超声,但每种方法都有缺点和局限性,例如设备成本、操作者技能或需要有创静脉通路。由于这些原因,需要标准化和有效的技术来评估下肢血管(异常)功能,这些技术可以更容易地在研究和临床环境中实施。
连续波近红外光谱 (CW-NIRS) 是一种非侵入性、低成本且便携的方法,可量化体内血红蛋白氧合的相对变化。由于 NIRS 氧合和脱氧血红蛋白信号来自小血管(直径 <1 mm),因此能够评估局部骨骼肌代谢和微血管功能9。具体来说,组织饱和度指数 (TSI) [TSI = 氧合血红蛋白/(氧合血红蛋白 + 脱氧血红蛋白)x 100]提供了组织氧合的定量测量9。在闭塞和反应性充血之前、期间和之后测量时,TSI 的变化表明相对于闭塞前基线的"终末器官"血管反应性。重要的是,这种方法对与衰老10、疾病进展11 和临床干预(例如,血运重建手术12,13 或运动康复14,15,16,17)相关的肌肉微血管反应性和灌注的改变敏感,对于患有微血管功能障碍或有微血管功能障碍风险的个体。
NIRS 系统的可用性导致报告微血管功能的研究数量迅速增加18。然而,反应性充血检测方案的差异,遗漏了详细、可重复的 NIRS 方法,以及 NIRS 反应参数的描述、表示和分析缺乏统一性,使得单个试验之间的比较具有挑战性。这限制了用于荟萃分析和临床评估建议制定的数据整理 9,15。
因此,在本文中,我们描述了我们实验室用于评估下肢反应性充血的标准化 NIRS 和血管闭塞测试方案。通过传播这些方法,我们的目标是为提高数据收集程序和统一报告的标准化和可重复性做出贡献。
研究方案
此处描述的所有方法均已获得阳光海岸大学人类研究伦理委员会的批准。此外,所有参与者都书面知情同意参与本协议中概述的测量。请注意,下肢血管闭塞测试禁用于以前接受过涉及股动脉或腘动脉血管移植术的血运重建手术的个体。准备好设备后,指示参与者仰卧休息 10 分钟。此时,NIRS 数据收集开始,初始周期为 2 分钟,可实现 NIRS 信号的稳定性。然后收集基线数据 1 分钟,此时立即给位于大腿的袖带充气以实现动脉闭塞。在袖带快速放气之前,闭塞保持 5 分钟。数据收集在整个反应性充血期间持续进行,直到信号恢复到基线。 图 1 描述了反应性充血方案的概述,详细步骤如下。用于研究的设备列在 材料表中。
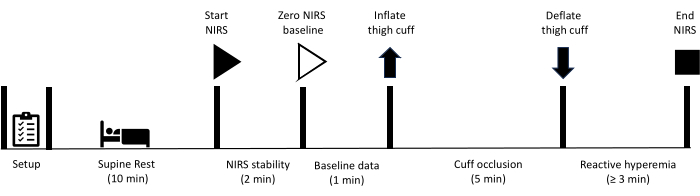
图 1:概述的 NIRS 反应性充血测量方案和时间的示意图。 NIRS:近红外光谱。 请单击此处查看此图的较大版本。
1. 设备准备
注意:各种 NIRS、袖带充气/闭塞和数据收集系统可用于获得下面概述的代表性结果。重要的是,研究人员要查阅他们自己的特定用户手册,并了解独特的软件、校准、环境光和参与者/队列特定的注意事项。
- 确保所有测量都在安静、温度受控的房间 (21-23 °C) 中进行。
- 确认所有设备和材料(请参阅 材料表)均可用。
- 确保 CW-NIRS 设备和设备传输到的计算机已充满电并已开机。
- 检查 NIRS 设备是否与 通过 蓝牙显示 NIRS 数据的计算机配对,以及 NIRS 单元的测量参数是否根据实验地点和研究设计定义(例如:定义近红外光的差分光程因子 (DPF))。
注意:大多数 NIRS 方案步骤和系统设置都基于制造商的建议、研究人员的经验和专家/共识意见的组合。请注意,测量过程中生成的值取决于所使用的特定设备和探头,以及在设备软件中选择的设置。收集到的信号也可能存在高度的个体间差异。此外,为了改进研究之间的比较,在发布这些测量结果时,报告近红外光谱仪器的详细信息(例如,包括探头设计、源-探测器间隔距离和使用的波长)、系统设置、与肌肉几何形状相关的探头位置/方向以及分析参数/数据处理非常重要。 - 根据 NIRS 设备软件详细信息输入参与者的数据。
- 将快速袖带充气机连接到空气和电源。
2. 参与者准备
- 确保参与者已阅读参与者信息声明和同意书,并同意在开始前参与测量。
- 向参与者解释在测量过程中会发生什么,同时他们脱掉鞋子和袜子并静止站立以进行相关的人体测量。
- 在计划的 NIRS 测量部位(例如,在最大小腿围点的内侧)进行皮褶测量(一式三份)。
注意:这允许根据 NIRS 信号穿透深度来确认皮肤和脂肪组织的深度(通常称为脂肪组织厚度 - ATT)。或者,超声可用于确定脂肪组织厚度。请始终记住,NIRS 信号/测量的深度大约是接收器-发射器距离9 的一半。 - 为了最大限度地提高信号质量,请检查 NIRS 发射器/接收器探头的计划位置是否有任何可能吸收光线的头发,并在必要时通过剃须去除头发。
注意:如果皮肤受损,例如蜂窝织炎,或者存在水肿,请考虑测量的适当性,因为这些问题与可能降低的信号质量、信号穿透深度/进行测量的组织以及参与者伤口无菌有关。 - 测量和/或标记计划的 NIRS 探针放置相对于相关解剖标志(例如,内侧髁的上表面)的位置,以允许在参与者之间和参与者内部准确放置 NIRS 探针(取决于研究设计和探针设计/形状),因为氧合反应可以显示不同肌肉之间甚至同一肌肉区域内的巨大异质性。
- 让参与者仰卧在检查台或床上。然后参与者休息 10 分钟。
- 在大腿周围放置一个袖带,靠近膝盖,确保管子不会与小腿或 NIRS 设备接触(图 2)。
- 将脚和脚踝放在泡沫支撑上抬高腿部 (~10 cm),使小腿保持稳定并可进行测量(图 3)。
注意:如果需要多次在双腿中进行测试,则测试顺序是随机的(在初始测试之前),并且测试顺序保持不变,以便为每个参与者进行后续评估。 - 打开快速袖带充气机模块。
注意: 确保快速袖带充气机的模式和压力设置与制造商的说明和血管闭塞方案规范一致。 - 打开袖带充气机气源,检查空气是否能穿过软管,然后将软管连接到大腿袖带。
- 确保袖带充气机的软管仍未与小腿接触。
- 将 NIRS 发射器/接收器探头牢固地固定在测量部位上方的皮肤上(通常是腓肠肌的内侧;但是,根据研究和参与者的具体情况,也可以使用其他部位,例如足背和胫骨前部)。
注意:一些 NIRS 系统允许同时进行多个站点测量。 - 用黑色运动机能胶带或类似的东西覆盖探头,小心密封边缘以防止环境光影响 NIRS 信号质量/值(图 3)。
注意:固定探头和粘合剂覆盖物时,请务必避免探头移动,但要避免压迫皮肤/脂肪组织/肌肉。
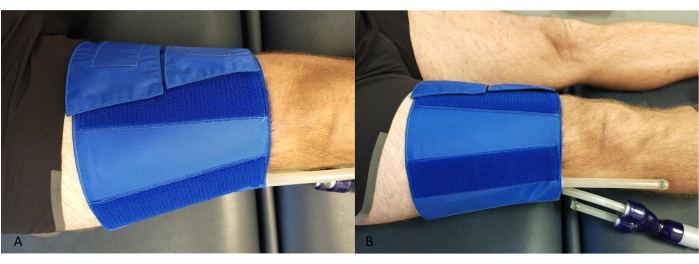
图 2:大腿封闭袖带放置示例。 (A) 从上面。(B) 从侧面。 请单击此处查看此图的较大版本。
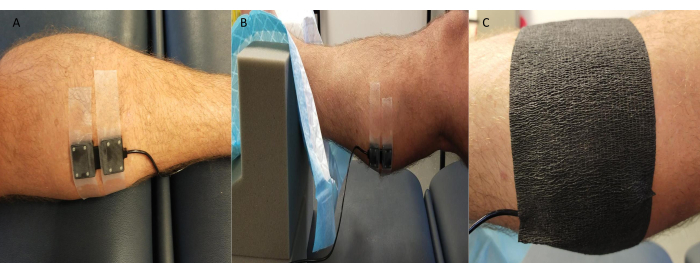
图 3:近红外光谱探头位置示例。 (A) 探针连接到内侧腓肠肌处剃光的皮肤上。(B) 在脚踝处于泡沫支撑中时放置探针,以允许进入并确保稳定性。(C) 环境光屏蔽到位。 请单击此处查看此图的较大版本。
3. 基线数据收集
- 要求参与者在数据收集期间保持放松,不要说话,并保持双腿不动。
- 通过计算机界面开始 NIRS 设备记录。
注意:如果启用并首选离线数据收集,请直接启动 NIRS 设备。 - 在开始测量之前,请至少采集 2 分钟的数据。这可确保在数据采集之前获得稳态信号。
- 监控计算机屏幕以确保数据信号完整性和生理上合理的值。例如,数据采集 (DAQ) 值提供有关信号质量和 NIRS 设备检测到的环境光量的信息。在整个测量过程中,它们应保持在可接受的范围内。
- 如果 2 分钟后没有注意到 NIRS 信号的波动(例如,由于移动伪影),请通过按下计算机/设备/同步单元上的相应按钮来设置 NIRS 数据基线。此基线反映了测量的比较起点。氧合血红蛋白和脱氧血红蛋白的变化将相对于该基线进行解释。
注意:在数据收集过程中,插入特定里程碑的基于软件的事件标记,即基线的开始和结束、袖带闭塞的开始和结束等,以协助数据分析。 - 收集至少 1 分钟的基线数据,再次确保在此期间不会发生波动或移动伪影。
注意:基线数据的波动将影响对一些潜在变量的解释,例如充血储备(参见代表性结果部分)。
4. 血管闭塞
- 在切换到气囊模式(或其他系统上的相关设置)之前,将快速气囊充气器上的气囊压力设置为 200 mmHg。
注意:虽然一些作者建议在大腿处充气至 250 mmHg 9,19,但根据我们的经验,一些参与者不能很好地容忍这一点,导致测量中断。在大多数参与者群体中,充气至 200 mmHg 足以在静息时阻塞动脉流入,同时可耐受且不会导致皮肤瘀伤。为了确保在 200 mmHg 时获得有效闭塞,我们小组常规同时使用应变计体积脉搏波和 NIRS,以确认在袖带充气期间没有下游血流。 - 告知参与者在将袖带充气至 200 mmHg 5 分钟,然后进行袖带完全放气的过程中会发生什么(不适、刺痛感等)。再次提醒参与者在数据收集期间保持放松,不要说话,并保持双腿不动。
注意:根据我们的经验,闭塞期的前 30-60 秒对参与者来说是最不舒服的。当参与者放松双腿时,他们往往会发现咬合更容易忍受。 - 当准备好开始袖带充气时,在 NIRS 软件中标记基线期的结束。
- 将大腿袖带充气至 200 mmHg 的收缩上压,或者在 200 mmHg 无效的罕见情况下充气至 220 mmHg。
- 监视计算机或屏幕以确保遮挡期间的数据完整性。
- 随着袖带闭塞 5 分钟的结束临近,提醒参与者做好准备,提醒他们尽可能保持腿部不动,并在袖带放气后约 3 分钟内不要说话(同时收集来自反应性充血的血管反应数据)。
注意:提醒参与者保持静止很重要,因为随着血液循环的恢复,参与者可能会想移动肢体以缓解/缓解不适。
5. 反应性充血
- 闭塞 5 分钟后,迅速将大腿袖带完全放气(至 0 mmHg)。同时,在 NIRS 软件中标记闭塞期的结束。由于血流恢复和相关因素引起的反应性充血反应将在 NIRS 软件显示屏中可见(图 4)。
- 闭塞后至少 3 分钟后,或者 NIRS 数据恢复到基线后,在 NIRS 软件中标记恢复期的结束并停止测量。
注意:恢复的持续时间部分取决于正在研究的研究或临床问题,因此,选择用于分析的特定 NIRS 参数,以及可能需要更长恢复持续时间的伴随措施(如 FMD)的可能性。 - 启动数据保存和 NIRS 结果导出,以进行数据处理和分析。
6. 后续程序
- 从参与者身上取下 NIRS 设备和袖带。
- 如有需要,请按照制造商的说明和相关卫生标准清洁 NIRS 设备(和闭塞袖带)。
- 检查 NIRS 设备,以确保发射器/接收器的完整性和电池性能,以便将来测量。
结果
近红外光谱
连续波近红外光谱设备测量含氧 (O2Hb) 和脱氧 (HHb) 血红蛋白的相对变化,这些血红蛋白通过发光源和光电探测器反映局部 O2 的输送 和利用, 从而设置特定距离。发射的光波长在 ~700 nm 和 850 nm 之间,对应于 O2Hb 和 HHb 的峰值吸光度。一旦近红外光穿透骨骼肌,光的散射和吸收就取决于波长。骨骼肌是一种异质组织,因此散射和吸收?...
讨论
本文概述了使用 CW-NIRS TSI 评估下肢反应性充血以评估微血管功能的标准化程序。通过检查袖带闭塞持续时间对反应幅度、反应性充血期间 NIRS 重测信度以及 NIRS 与其他微血管评估方法(如对比增强超声)之间的一致性水平,该协议已得到改进23,24。较长的袖带闭塞持续时间对应于较低的 TSIMIN23,如图 8 和...
披露声明
作者没有披露或利益争夺。
致谢
作者要感谢 A. Meneses 博士,他之前的工作为完善本文描述的方案做出了贡献。此外,作者要感谢所有为制定此类方案而贡献时间以进一步理解临床和科学的研究参与者。
材料
| Name | Company | Catalog Number | Comments |
| Cuff Inflator Air Source | Hokanson | AG101 AIR SOURCE | |
| Elastic Cohesive Bandage | MaxoWrap | 18228-BL | For blocking out ambient light |
| OxySoft | Artinis | 3.3.341 x64 | |
| PortaLite (NIRS) | Artinis | 0302-00019-00 | |
| PortaSync MKII (Remote) | Artinis | 0702-00860-00 | For Marking milestones during measurement |
| Rapid Cuff Inflator | Hokanson | E20 RAPID CUFF INFLATOR | |
| Thigh Cuff | Hokanson | CC17 | |
| Transpore Surgical Tape | 3M | 1527-1 | For fixing probe to skin |
参考文献
- Hasani, W. S. R., et al. The global estimate of premature cardiovascular mortality: A systematic review and meta-analysis of age-standardized mortality rate. BMC Public Health. 23 (1), 1561 (2023).
- Horvath, L., et al. Epidemiology of peripheral artery disease: Narrative review. Life (Basel). 12 (7), 1041 (2022).
- Jodheea-Jutton, A., Hindocha, S., Bhaw-Luximon, A. Health economics of diabetic foot ulcer and recent trends to accelerate treatment). Foot (Edinb). 52, 101909 (2022).
- Rodrigues, B. T., Vangaveti, V. N., Urkude, R., Biros, E., Malabu, U. H. Prevalence and risk factors of lower limb amputations in patients with diabetic foot ulcers: A systematic review and meta-analysis. Diabetes Metab Syndr-Clinin Res Rev. 16 (2), 102397 (2022).
- Jung, F., et al. Microcirculation in hypertensive patients. Biorheology. 50 (5-6), 241-255 (2013).
- Bethel, M., Annex, B. H. Peripheral arterial disease: A small and large vessel problem. AmHeart J Plus: Cardio Res Prac. 28, 133291 (2023).
- Thijssen, D. H. J., et al. Expert consensus and evidence-based recommendations for the assessment of flow-mediated dilation in humans. Eur Heart J. 40 (30), 2534-2547 (2019).
- Sanada, H., et al. Vascular function in patients with lower extremity peripheral arterial disease: A comparison of functions in upper and lower extremities. Atherosclerosis. 178 (1), 179-185 (2005).
- Barstow, T. J. Understanding near-infrared spectroscopy and its application to skeletal muscle research. J App Phys. 126 (5), 1360-1376 (2019).
- Rogers, E. M., Banks, N. F., Jenkins, N. D. M. Metabolic and microvascular function assessed using near-infrared spectroscopy with vascular occlusion in women: Age differences and reliability. Exp Physiol. 108 (1), 123-134 (2023).
- Manfredini, F., et al. A toe flexion nirs assisted test for rapid assessment of foot perfusion in peripheral arterial disease: Feasibility, validity, and diagnostic accuracy. Eur J Vasc Endovasc Surg. 54 (2), 187-194 (2017).
- Boezeman, R. P., Moll, F. L., Unlu, C., De Vries, J. P. Systematic review of clinical applications of monitoring muscle tissue oxygenation with near-infrared spectroscopy in vascular disease. Microvasc Res. 104, 11-22 (2016).
- Baltrunas, T., et al. Measurement of revascularization effect using near-infrared spectroscopy in below the knee arteries. Rev Cardiovasc Med. 23 (9), 299 (2022).
- Tuesta, M., Yanez-Sepulveda, R., Verdugo-Marchese, H., Mateluna, C., Alvear-Ordenes, I. Near-infrared spectroscopy used to assess physiological muscle adaptations in exercise clinical trials: A systematic review. Biology (Basel). 11 (7), 1073 (2022).
- Cornelis, N., et al. The use of near-infrared spectroscopy to evaluate the effect of exercise on peripheral muscle oxygenation in patients with lower extremity artery disease: A systematic review. Eur J Vasc Endovasc Surg. 61 (5), 837-847 (2021).
- Whyte, E., Thomas, S., Marzolini, S. Muscle oxygenation of the paretic and nonparetic legs during and after exercise in chronic stroke: Implications for mobility. PM R. 15 (10), 1239-1248 (2023).
- Soares, R. N., George, M. A., Proctor, D. N., Murias, J. M. Differences in vascular function between trained and untrained limbs assessed by near-infrared spectroscopy. Eur J Appl Physiol. 118 (10), 2241-2248 (2018).
- Joseph, S., et al. Near infrared spectroscopy in peripheral artery disease and the diabetic foot: A systematic review. Diabetes Metab Res Rev. 38 (7), 3571 (2022).
- Willingham, T. B., Southern, W. M., Mccully, K. K. Measuring reactive hyperemia in the lower limb using near-infrared spectroscopy. J Biomed Opt. 21 (9), 091302 (2016).
- Jones, S., Chiesa, S. T., Chaturvedi, N., Hughes, A. D. Recent developments in near-infrared spectroscopy (nirs) for the assessment of local skeletal muscle microvascular function and capacity to utilise oxygen. Artery Res. 16, 25-33 (2016).
- Soares, R. N., et al. Effects of a rehabilitation program on microvascular function of CHD patients assessed by near-infrared spectroscopy. Physiol Rep. 7 (11), e14145 (2019).
- Baltrunas, T., et al. The use of near-infrared spectroscopy in the diagnosis of peripheral artery disease: A systematic review. Vascular. 30 (4), 715-727 (2022).
- Young, G. M., et al. Influence of cuff-occlusion duration on contrast-enhanced ultrasound assessments of calf muscle microvascular blood flow responsiveness in older adults. Exp Physiol. 105 (12), 2238-2245 (2020).
- Young, G. M., et al. The association between contrast-enhanced ultrasound and near-infrared spectroscopy-derived measures of calf muscle microvascular responsiveness in older adults. Heart Lung Circ. 30 (11), 1726-1733 (2021).
- Rosenberry, R., Nelson, M. D. Reactive hyperemia: A review of methods, mechanisms, and considerations. Am J Physiol Regul Integr Comp Physiol. 318 (3), R605-R618 (2020).
- Iannetta, D., et al. Reliability of microvascular responsiveness measures derived from near-infrared spectroscopy across a variety of ischemic periods in young and older individuals. Microvasc Res. 122, 117-124 (2019).
- Celermajer, D. S., et al. Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis. Lancet. 340 (8828), 1111-1115 (1992).
- Thijssen, D. H. J., et al. Assessment of flow-mediated dilation in humans: A methodological and physiological guideline. Am J Physiol-Heart Circ Physiol. 300 (1), H2-H12 (2011).
- Inaba, Y., Chen, J. A., Bergmann, S. R. Prediction of future cardiovascular outcomes by flow-mediated vasodilatation of brachial artery: A meta-analysis. Int J Cardiovasc Imaging. 26 (6), 631-640 (2010).
- Soares, R. N., De Oliveira, G. V., Alvares, T. S., Murias, J. M. The effects of the analysis strategy on the correlation between the NIRS reperfusion measures and the FMD response. Microvasc Res. 127, 103922 (2020).
- Tucker, W. J., et al. Studies into the determinants of skeletal muscle oxygen consumption: Novel insight from near-infrared diffuse correlation spectroscopy. J Physiol-London. 597 (11), 2887-2901 (2019).
- Tucker, W. J., et al. Near-infrared diffuse correlation spectroscopy tracks changes in oxygen delivery and utilization during exercise with and without isolated arterial compression. Am J Physiol Regul Integr Comp Physiol. 318 (1), R81-R88 (2020).
- Wassenaar, E. B., Van Den Brand, J. G. Reliability of near-infrared spectroscopy in people with dark skin pigmentation. J Clinic Monit Comput. 19 (3), 195-199 (2005).
- Soares, R. N., Murias, J. M. Near-infrared spectroscopy assessment of microvasculature detects difference in lower limb vascular responsiveness in obese compared to lean individuals. Microvasc Res. 118, 31-35 (2018).
- Boezeman, R. P., et al. Monitoring of foot oxygenation with near-infrared spectroscopy in patients with critical limb ischemia undergoing percutaneous transluminal angioplasty: A pilot study. Eur J Vasc Endovasc Surg. 52 (5), 650-656 (2016).
- Lin, B. S., et al. Using wireless near-infrared spectroscopy to predict wound prognosis in diabetic foot ulcers. Adv Skin Wound Care. 33 (1), 1-12 (2020).
- Weingarten, M. S., et al. Diffuse near-infrared spectroscopy prediction of healing in diabetic foot ulcers: A human study and cost analysis. Wound Repair. 20 (2), A44-A44 (2012).
- Murrow, J. R., et al. Near-infrared spectroscopy-guided exercise training for claudication in peripheral arterial disease. Eur J Prev Cardiol. 26 (5), 471-480 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。