É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Espectroscopia de infravermelho próximo durante hiperemia reativa para avaliação da função vascular de membros inferiores
Neste Artigo
Resumo
Aqui, descrevemos uma abordagem não invasiva usando espectroscopia de infravermelho próximo para avaliar a hiperemia reativa no membro inferior. Este protocolo fornece uma avaliação padronizada da capacidade de resposta vascular e microvascular que pode ser usada para determinar a presença de disfunção vascular, bem como a eficácia das intervenções terapêuticas.
Resumo
As doenças vasculares do membro inferior contribuem substancialmente para a carga global de doenças cardiovasculares e comorbidades como diabetes. É importante ressaltar que a disfunção microvascular pode ocorrer antes ou ao lado da patologia macrovascular, e ambas contribuem potencialmente para os sintomas do paciente e a carga da doença. Aqui, descrevemos uma abordagem não invasiva usando espectroscopia de infravermelho próximo (NIRS) durante a hiperemia reativa, que fornece uma avaliação padronizada da (dis)função vascular dos membros inferiores e um método potencial para avaliar a eficácia de intervenções terapêuticas. Ao contrário de métodos alternativos, como ultrassom com contraste, essa abordagem não requer acesso venoso ou análise sofisticada de imagens, além de ser barata e menos dependente do operador. Esta descrição do método NIRS inclui resultados representativos e terminologia padrão, juntamente com a discussão de considerações de medição, limitações e métodos alternativos. A aplicação futura deste trabalho melhorará a padronização do projeto de pesquisa vascular, procedimentos de coleta de dados e relatórios harmonizados, melhorando assim os resultados da pesquisa translacional nas áreas de (dis)função, doença e tratamento vascular dos membros inferiores.
Introdução
A doença cardiovascular (DCV) é o principal contribuinte para a mortalidade global1. Embora o infarto do miocárdio e o acidente vascular cerebral sejam as manifestações mais comuns das DCV, as doenças vasculares dos membros inferiores, como a doença arterial periférica (DAP) e a doença do pé diabético, contribuem substancialmente para a sobrecarga pessoal, social e de saúde das DCV2,3,4. É importante ressaltar que esses estados de doença são caracterizados por disfunção microvascular e macrovascular5 que contribuem para sintomas (por exemplo, claudicação intermitente), comprometimento funcional, baixa mobilidade, bem como isolamento social e redução da qualidade de vida6. Historicamente, as técnicas de avaliação vascular dos membros superiores têm sido usadas como uma medida da função vascular sistêmica e do risco cardiovascular associado; no entanto, esses métodos são potencialmente não sensíveis a comprometimentos locais na função vascular dos membros inferiores 7,8. Embora atualmente exista uma variedade de técnicas usadas para avaliar a função vascular no membro inferior, como dilatação mediada por fluxo (FMD) e ultrassom com contraste, cada método tem desvantagens e limitações, como custo do equipamento, habilidade do operador ou necessidade de acesso venoso invasivo. Por essas razões, há necessidade de técnicas padronizadas e eficazes para avaliar a (dis)função vascular dos membros inferiores que possam ser mais prontamente implementadas em ambientes clínicos e de pesquisa.
A espectroscopia de infravermelho próximo de onda contínua (CW-NIRS) é um método não invasivo, de baixo custo e portátil que quantifica as mudanças relativas na oxigenação da hemoglobina in vivo. Como os sinais da hemoglobina oxigenada e desoxigenada NIRS são derivados dos pequenos vasos (<1 mm de diâmetro), o metabolismo do músculo esquelético local e a função microvascular podem ser avaliados9. Especificamente, o índice de saturação tecidual (TSI) [TSI = hemoglobina oxigenada/ (hemoglobina oxigenada + hemoglobina desoxigenada) x 100], fornece uma medida quantitativa da oxigenação tecidual9. Quando medidas antes, durante e após a oclusão e hiperemia reativa, as alterações no TSI indicam responsividade vascular de 'órgão-alvo', em relação à linha de base pré-oclusão. É importante ressaltar que esse método é sensível a alterações na capacidade de resposta e perfusão microvascular muscular associadas aoenvelhecimento10, progressão dadoença11 e intervenções clínicas (por exemplo, cirurgia de revascularização12,13 ou reabilitação por exercícios14,15,16,17) em indivíduos com ou em risco de disfunção microvascular.
A disponibilidade de sistemas NIRS levou a um rápido aumento no número de estudos de pesquisa relatando a função microvascular18. No entanto, as diferenças nos protocolos de teste de hiperemia reativa, a omissão de métodos NIRS detalhados e repetíveis, bem como a falta de uniformidade na descrição, apresentação e análise dos parâmetros de resposta NIRS, tornam as comparações entre ensaios individuais desafiadoras. Isso limita a coleta de dados para metanálise e a formulação de recomendações de avaliação clínica 9,15.
Portanto, neste artigo, descrevemos os protocolos padronizados de teste NIRS e oclusão vascular de nosso laboratório para a avaliação da hiperemia reativa de membros inferiores. Ao disseminar esses métodos, pretendemos contribuir para a melhor padronização e repetibilidade dos procedimentos de coleta de dados e relatórios harmonizados.
Protocolo
Todos os métodos descritos aqui foram aprovados pelo comitê de ética em pesquisa humana da University of the Sunshine Coast. Além disso, todos os participantes assinaram o termo de consentimento livre e esclarecido para participar das medidas descritas neste protocolo. Observe que o teste de oclusão vascular no membro inferior é contra-indicado em indivíduos que já tiveram um procedimento de revascularização envolvendo enxerto vascular ou implante de stent nas artérias femoral ou poplítea. Após o preparo do equipamento, o participante é orientado a repousar em decúbito dorsal por 10 min. Neste ponto, a coleta de dados NIRS começa, com um período inicial de 2 minutos, permitindo que a estabilidade dos sinais NIRS seja alcançada. Os dados basais são então coletados por 1 min, momento em que um manguito localizado na coxa é prontamente inflado para atingir a oclusão arterial. A oclusão é mantida por 5 minutos antes que o manguito seja rapidamente esvaziado. A coleta de dados continua durante todo o período de hiperemia reativa até que os sinais se recuperem para a linha de base. A Figura 1 mostra uma visão geral do protocolo de hiperemia reativa e as etapas detalhadas são fornecidas abaixo. Os equipamentos utilizados para o estudo estão listados na Tabela de Materiais.
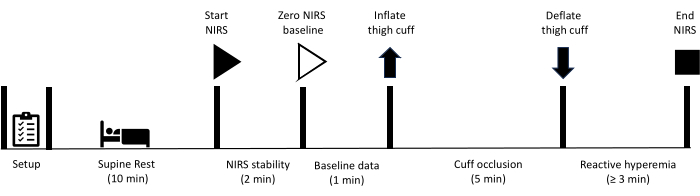
Figura 1: Esquema descrevendo o protocolo de medição de hiperemia reativa NIRS e os tempos. NIRS: espectroscopia de infravermelho próximo. Clique aqui para ver uma versão maior desta figura.
1. Preparação do equipamento
NOTA: Vários NIRS, insuflação/oclusão do manguito e sistemas de coleta de dados podem ser usados para obter os resultados representativos descritos abaixo. É importante que os investigadores consultem seus próprios manuais de usuário específicos e estejam cientes do software exclusivo, calibração, luz ambiente e considerações específicas do participante/coorte.
- Certifique-se de que todas as medições sejam realizadas em uma sala silenciosa e com temperatura controlada (21-23 °C).
- Confirme se todos os equipamentos e materiais (consulte a Tabela de Materiais) estão disponíveis.
- Certifique-se de que o dispositivo CW-NIRS e o computador para o qual o dispositivo está transmitindo estejam totalmente carregados e ligados.
- Verifique se o dispositivo NIRS está emparelhado com o computador que exibe os dados NIRS via Bluetooth e se os parâmetros de medição da unidade NIRS são definidos de acordo com o local experimental e o projeto do estudo (um exemplo: defina o fator de comprimento de caminho diferencial (DPF) da luz infravermelha próxima).
NOTA: A maioria das etapas do protocolo NIRS e configurações do sistema são baseadas em uma combinação de recomendações do fabricante, experiência dos pesquisadores e opinião de especialistas/consenso. Esteja ciente de que os valores gerados durante a medição dependem do dispositivo específico e das sondas usadas, bem como das configurações escolhidas no software do dispositivo. Também existe potencial para um alto grau de variabilidade interindividual nos sinais coletados. Além disso, para permitir uma melhor comparação entre os estudos, é importante relatar os detalhes da instrumentação NIRS (por exemplo, incluir o design da sonda, as distâncias de separação fonte-detector e os comprimentos de onda usados), configurações do sistema, posição/orientação da sonda em relação à geometria muscular e os parâmetros de análise/tratamento de dados ao publicar os resultados dessas medições. - Insira os dados do participante de acordo com os detalhes do software do dispositivo NIRS.
- Conecte o inflador de manguito rápido às fontes de ar e energia.
2. Preparação dos participantes
- Certifique-se de que o participante leu a declaração de informações do participante e o formulário de consentimento e deu seu consentimento para participar da medição antes do início.
- Explique ao participante o que esperar durante a medição enquanto ele tira os sapatos e as meias e fica parado para as medidas antropométricas relevantes.
- Faça uma medição das dobras cutâneas (em triplicata) sobre o local de medição NIRS planejado (por exemplo, no aspecto medial no ponto da circunferência máxima da panturrilha).
NOTA: Isso permite que a profundidade da pele e do tecido adiposo (rotineiramente chamada de espessura do tecido adiposo - ATT) seja confirmada em relação à profundidade de penetração do sinal NIRS. Alternativamente, o ultrassom pode ser usado para determinar a espessura do tecido adiposo. Lembre-se sempre de que a profundidade do sinal/medição NIRS é aproximadamente metade da distância receptor-transmissor9. - Para maximizar a qualidade do sinal, verifique o local planejado da sonda transmissora/receptora NIRS para ver se há pêlos que possam absorver luz e remova os pêlos raspando, se necessário.
NOTA: Se a pele estiver comprometida, por exemplo, por celulite, ou se houver edema, considere a adequação da medição, pois esses problemas estão relacionados à qualidade do sinal potencialmente reduzida, profundidade de penetração do sinal/tecido do qual a medição é feita, bem como esterilidade da ferida do participante. - Faça medições e/ou marque a posição da colocação planejada da sonda NIRS em relação aos pontos anatômicos relevantes (por exemplo, superfície superior do côndilo medial) para permitir a colocação precisa da sonda NIRS entre e dentro dos participantes (dependendo do desenho do estudo e do projeto/forma da sonda), pois as respostas de oxigenação podem exibir grande heterogeneidade entre diferentes músculos ou mesmo dentro de regiões do mesmo músculo.
- Peça ao participante para deitar em decúbito dorsal em um pedestal ou cama de exame. O participante então descansa por 10 min.
- Coloque um manguito ao redor da coxa, proximal ao joelho, garantindo que os tubos não entrem em contato com a panturrilha ou com o dispositivo NIRS (Figura 2).
- Eleve a perna (~10 cm) com o pé e o tornozelo sobre um suporte de espuma, deixando a perna estável e acessível para as medições (Figura 3).
NOTA: Se o teste for necessário para ser realizado em ambas as pernas em várias ocasiões, a ordem do teste é aleatória (antes do teste inicial) e a ordem do teste é mantida para avaliações subsequentes para cada participante. - Ligue o módulo de enchimento rápido do manguito.
NOTA: Certifique-se de que as configurações de modo e pressão do inflador rápido do manguito sejam consistentes com as instruções do fabricante e as especificações do protocolo de oclusão vascular. - Ligue a fonte de ar do inflador do manguito, verifique se o ar pode passar pela mangueira e conecte a mangueira ao manguito da coxa.
- Certifique-se de que a mangueira do inflador de braçadeira ainda não esteja em contato com a panturrilha.
- Fixe a sonda transmissora/receptora NIRS com segurança na pele sobrejacente ao(s) local(is) de medição (rotineiramente, o aspecto medial do gastrocnêmio; no entanto, outros locais, como o dorso do pé e o tibial anterior, também são utilizados, dependendo do estudo e das especificidades do participante).
NOTA: Alguns sistemas NIRS permitem a possibilidade de várias medições do local simultaneamente. - Cubra a sonda com fita adesiva preta ou algo semelhante, tomando cuidado para vedar as bordas para evitar que a luz ambiente afete a qualidade/valores do sinal NIRS (Figura 3).
NOTA: Ao fixar a sonda e a cobertura adesiva, certifique-se de eliminar o movimento da sonda, mas evite comprimir a pele/tecido adiposo/músculo.
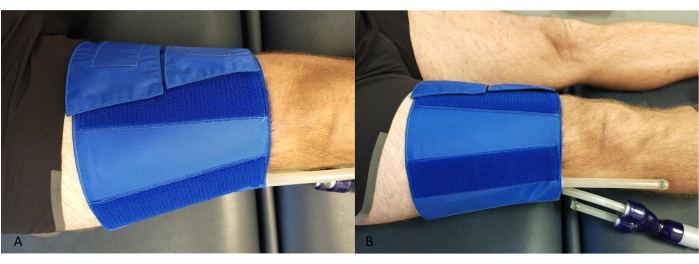
Figura 2: Exemplo da colocação do manguito oclusivo na coxa. (A) De cima. (B) De lado. Clique aqui para ver uma versão maior desta figura.
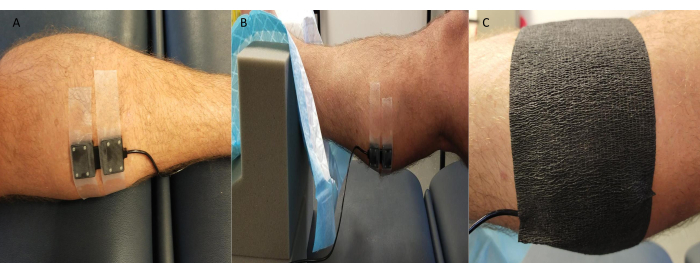
Figura 3: Exemplo de posição da sonda de espectroscopia de infravermelho próximo. (A) Sonda conectada à pele raspada no gastrocnêmio medial. (B) Colocação da sonda enquanto o tornozelo estiver em suporte de espuma para permitir o acesso e garantir a estabilidade. (C) Blindagem contra luz ambiente no lugar. Clique aqui para ver uma versão maior desta figura.
3. Coleta de dados de linha de base
- Peça ao participante que permaneça relaxado, evite falar e mantenha a(s) perna(s) imóvel(is) durante a coleta de dados.
- Inicie a gravação do dispositivo NIRS através da interface do computador.
NOTA: Se a coleta de dados offline estiver habilitada e preferida, inicie o dispositivo NIRS diretamente. - Permita que pelo menos 2 minutos de dados sejam adquiridos antes de iniciar o início da medição. Isso garante que os sinais de estado estacionário sejam alcançados antes da aquisição de dados.
- Monitore a tela do computador para garantir a integridade do sinal de dados e valores fisiologicamente plausíveis. Por exemplo, os valores de aquisição de dados (DAQ) fornecem informações sobre a qualidade do sinal e a quantidade de luz ambiente detectada pelo dispositivo NIRS. Eles devem ser mantidos em uma faixa aceitável durante toda a medição.
- Se, após 2 min, nenhuma flutuação no sinal NIRS for observada (por exemplo, devido a um artefato de movimento), defina a linha de base de dados NIRS pressionando o botão correspondente no computador/dispositivo/unidade de sincronização. Esta linha de base reflete o ponto de partida comparativo da medição. As alterações na hemoglobina oxigenada e desoxigenada serão interpretadas em relação a esta linha de base.
NOTA: Durante a coleta de dados, insira marcadores de eventos baseados em software de marcos específicos, ou seja, início e fim da linha de base, início e fim da oclusão do manguito, etc., para auxiliar na análise dos dados. - Colete pelo menos 1 minuto de dados de linha de base, garantindo novamente que nenhuma flutuação ou artefato de movimento ocorra durante esse período.
NOTA: As flutuações nos dados basais afetarão a interpretação de algumas variáveis potenciais, como a reserva hiperêmica (consulte a seção de resultados representativos).
4. Oclusão vascular
- Defina a pressão do manguito para 200 mmHg no inflador rápido do manguito antes de mudar para o modo de manguito (ou configuração relevante em sistemas alternativos).
NOTA: Embora alguns autores recomendem a insuflação para 250 mmHg na coxa 9,19, em nossa experiência, isso não é bem tolerado por alguns participantes, levando à descontinuação da medição. A insuflação para 200 mmHg é suficiente, na maioria dos grupos de participantes, para ocluir o influxo arterial em repouso, embora seja tolerável e não resulte em hematomas na pele. Para garantir que a oclusão efetiva seja alcançada a 200 mmHg, nosso grupo usa rotineiramente a pletismografia de strain gauge simultaneamente com o NIRS para confirmar a ausência de fluxo sanguíneo a jusante durante o período de insuflação do balonete. - Aconselhe o participante sobre o que esperar (desconforto, sensações de formigamento, etc.) durante o processo de inflar o manguito a 200 mmHg por um período de 5 min, seguido de uma desinsuflação total do manguito. Lembre o participante novamente de permanecer relaxado, abster-se de falar e manter a(s) perna(s) imóvel(is) durante a coleta de dados.
NOTA: É nossa experiência que os primeiros 30-60 s do período de oclusão são os menos confortáveis para os participantes. Quando os participantes deixam as pernas relaxarem, eles tendem a achar a oclusão mais tolerável. - Quando estiver pronto para iniciar a inflação do manguito, marque o fim do período de linha de base no software NIRS.
- Infle o manguito da coxa a uma pressão suprassistólica de 200 mmHg ou, alternativamente, a 220 mmHg em casos raros em que 200 mmHg se mostraram ineficazes.
- Monitore o computador ou a tela para garantir a integridade dos dados durante o período de oclusão.
- À medida que o final dos 5 minutos de oclusão do manguito se aproxima, prepare o participante lembrando-o de manter a perna o mais imóvel possível e abster-se de falar por aproximadamente 3 minutos após a desinsuflação do manguito (enquanto os dados das respostas vasculares à hiperemia reativa estão sendo coletados).
NOTA: Este lembrete para o participante permanecer imóvel é importante, pois os participantes podem ficar tentados a mover o membro para aliviar/aliviar o desconforto à medida que a circulação é restaurada.
5. Hiperemia reativa
- Após 5 minutos de oclusão, esvazie rapidamente o manguito da coxa completamente (até 0 mmHg). Simultaneamente, marque o fim do período oclusivo no software NIRS. A resposta de hiperemia reativa, devido à retomada do fluxo sanguíneo e fatores relacionados, será visível no display do software NIRS (Figura 4).
- Após um mínimo de 3 minutos após a oclusão, ou alternativamente, após os dados NIRS retornarem à linha de base, marque o fim do período de recuperação no software NIRS e interrompa a medição.
NOTA: A duração da recuperação depende, em parte, da investigação ou da questão clínica que está a ser investigada e, portanto, dos parâmetros NIRS específicos escolhidos para análise, bem como do potencial para medidas concomitantes (como a febre aftosa) que podem exigir uma duração de recuperação mais longa. - Inicie o salvamento de dados e a exportação dos resultados do NIRS para tratamento e análise de dados.
6. Procedimentos de acompanhamento
- Remova o(s) dispositivo(s) NIRS e a braçadeira do participante.
- Se necessário, limpe o dispositivo NIRS (e o manguito de oclusão) seguindo as instruções do fabricante e os padrões de higiene relevantes.
- Inspecione o dispositivo NIRS para garantir a integridade do transmissor/receptor e o desempenho da bateria para medições futuras.
Resultados
Espectroscopia de infravermelho próximo
Dispositivos de espectroscopia de infravermelho próximo de onda contínua medem mudanças relativas na hemoglobina oxigenada (O2Hb) e desoxigenada (HHb), que refletem a entrega e utilização local de O2 por meio de fontes emissoras de luz e fotodetectores, separando distâncias específicas. Comprimentos de onda de luz entre ~ 700 nm e 850 nm são emitidos, correspondendo ao pico de absorção de O2Hb e HHb. Uma vez q...
Discussão
Este artigo descreve procedimentos padronizados para a avaliação da hiperemia reativa de membros inferiores usando o CW-NIRS TSI para avaliar a função microvascular. Esse protocolo foi refinado pelo exame da duração da oclusão do manguito na magnitude da resposta, confiabilidade teste-reteste NIRS durante a hiperemia reativa, bem como o nível de concordância entre o NIRS e outros métodos de avaliação microvascular, como ultrassom com contraste23,24. M...
Divulgações
Os autores não têm divulgações ou interesses conflitantes.
Agradecimentos
Os autores gostariam de agradecer ao Dr. A. Meneses, cujo trabalho anterior contribuiu para o refinamento do protocolo aqui descrito. Além disso, os autores gostariam de agradecer a todos os participantes da pesquisa que doaram seu tempo para permitir que protocolos como esse fossem desenvolvidos, a fim de aprofundar a compreensão clínica e científica.
Materiais
| Name | Company | Catalog Number | Comments |
| Cuff Inflator Air Source | Hokanson | AG101 AIR SOURCE | |
| Elastic Cohesive Bandage | MaxoWrap | 18228-BL | For blocking out ambient light |
| OxySoft | Artinis | 3.3.341 x64 | |
| PortaLite (NIRS) | Artinis | 0302-00019-00 | |
| PortaSync MKII (Remote) | Artinis | 0702-00860-00 | For Marking milestones during measurement |
| Rapid Cuff Inflator | Hokanson | E20 RAPID CUFF INFLATOR | |
| Thigh Cuff | Hokanson | CC17 | |
| Transpore Surgical Tape | 3M | 1527-1 | For fixing probe to skin |
Referências
- Hasani, W. S. R., et al. The global estimate of premature cardiovascular mortality: A systematic review and meta-analysis of age-standardized mortality rate. BMC Public Health. 23 (1), 1561 (2023).
- Horvath, L., et al. Epidemiology of peripheral artery disease: Narrative review. Life (Basel). 12 (7), 1041 (2022).
- Jodheea-Jutton, A., Hindocha, S., Bhaw-Luximon, A. Health economics of diabetic foot ulcer and recent trends to accelerate treatment). Foot (Edinb). 52, 101909 (2022).
- Rodrigues, B. T., Vangaveti, V. N., Urkude, R., Biros, E., Malabu, U. H. Prevalence and risk factors of lower limb amputations in patients with diabetic foot ulcers: A systematic review and meta-analysis. Diabetes Metab Syndr-Clinin Res Rev. 16 (2), 102397 (2022).
- Jung, F., et al. Microcirculation in hypertensive patients. Biorheology. 50 (5-6), 241-255 (2013).
- Bethel, M., Annex, B. H. Peripheral arterial disease: A small and large vessel problem. AmHeart J Plus: Cardio Res Prac. 28, 133291 (2023).
- Thijssen, D. H. J., et al. Expert consensus and evidence-based recommendations for the assessment of flow-mediated dilation in humans. Eur Heart J. 40 (30), 2534-2547 (2019).
- Sanada, H., et al. Vascular function in patients with lower extremity peripheral arterial disease: A comparison of functions in upper and lower extremities. Atherosclerosis. 178 (1), 179-185 (2005).
- Barstow, T. J. Understanding near-infrared spectroscopy and its application to skeletal muscle research. J App Phys. 126 (5), 1360-1376 (2019).
- Rogers, E. M., Banks, N. F., Jenkins, N. D. M. Metabolic and microvascular function assessed using near-infrared spectroscopy with vascular occlusion in women: Age differences and reliability. Exp Physiol. 108 (1), 123-134 (2023).
- Manfredini, F., et al. A toe flexion nirs assisted test for rapid assessment of foot perfusion in peripheral arterial disease: Feasibility, validity, and diagnostic accuracy. Eur J Vasc Endovasc Surg. 54 (2), 187-194 (2017).
- Boezeman, R. P., Moll, F. L., Unlu, C., De Vries, J. P. Systematic review of clinical applications of monitoring muscle tissue oxygenation with near-infrared spectroscopy in vascular disease. Microvasc Res. 104, 11-22 (2016).
- Baltrunas, T., et al. Measurement of revascularization effect using near-infrared spectroscopy in below the knee arteries. Rev Cardiovasc Med. 23 (9), 299 (2022).
- Tuesta, M., Yanez-Sepulveda, R., Verdugo-Marchese, H., Mateluna, C., Alvear-Ordenes, I. Near-infrared spectroscopy used to assess physiological muscle adaptations in exercise clinical trials: A systematic review. Biology (Basel). 11 (7), 1073 (2022).
- Cornelis, N., et al. The use of near-infrared spectroscopy to evaluate the effect of exercise on peripheral muscle oxygenation in patients with lower extremity artery disease: A systematic review. Eur J Vasc Endovasc Surg. 61 (5), 837-847 (2021).
- Whyte, E., Thomas, S., Marzolini, S. Muscle oxygenation of the paretic and nonparetic legs during and after exercise in chronic stroke: Implications for mobility. PM R. 15 (10), 1239-1248 (2023).
- Soares, R. N., George, M. A., Proctor, D. N., Murias, J. M. Differences in vascular function between trained and untrained limbs assessed by near-infrared spectroscopy. Eur J Appl Physiol. 118 (10), 2241-2248 (2018).
- Joseph, S., et al. Near infrared spectroscopy in peripheral artery disease and the diabetic foot: A systematic review. Diabetes Metab Res Rev. 38 (7), 3571 (2022).
- Willingham, T. B., Southern, W. M., Mccully, K. K. Measuring reactive hyperemia in the lower limb using near-infrared spectroscopy. J Biomed Opt. 21 (9), 091302 (2016).
- Jones, S., Chiesa, S. T., Chaturvedi, N., Hughes, A. D. Recent developments in near-infrared spectroscopy (nirs) for the assessment of local skeletal muscle microvascular function and capacity to utilise oxygen. Artery Res. 16, 25-33 (2016).
- Soares, R. N., et al. Effects of a rehabilitation program on microvascular function of CHD patients assessed by near-infrared spectroscopy. Physiol Rep. 7 (11), e14145 (2019).
- Baltrunas, T., et al. The use of near-infrared spectroscopy in the diagnosis of peripheral artery disease: A systematic review. Vascular. 30 (4), 715-727 (2022).
- Young, G. M., et al. Influence of cuff-occlusion duration on contrast-enhanced ultrasound assessments of calf muscle microvascular blood flow responsiveness in older adults. Exp Physiol. 105 (12), 2238-2245 (2020).
- Young, G. M., et al. The association between contrast-enhanced ultrasound and near-infrared spectroscopy-derived measures of calf muscle microvascular responsiveness in older adults. Heart Lung Circ. 30 (11), 1726-1733 (2021).
- Rosenberry, R., Nelson, M. D. Reactive hyperemia: A review of methods, mechanisms, and considerations. Am J Physiol Regul Integr Comp Physiol. 318 (3), R605-R618 (2020).
- Iannetta, D., et al. Reliability of microvascular responsiveness measures derived from near-infrared spectroscopy across a variety of ischemic periods in young and older individuals. Microvasc Res. 122, 117-124 (2019).
- Celermajer, D. S., et al. Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis. Lancet. 340 (8828), 1111-1115 (1992).
- Thijssen, D. H. J., et al. Assessment of flow-mediated dilation in humans: A methodological and physiological guideline. Am J Physiol-Heart Circ Physiol. 300 (1), H2-H12 (2011).
- Inaba, Y., Chen, J. A., Bergmann, S. R. Prediction of future cardiovascular outcomes by flow-mediated vasodilatation of brachial artery: A meta-analysis. Int J Cardiovasc Imaging. 26 (6), 631-640 (2010).
- Soares, R. N., De Oliveira, G. V., Alvares, T. S., Murias, J. M. The effects of the analysis strategy on the correlation between the NIRS reperfusion measures and the FMD response. Microvasc Res. 127, 103922 (2020).
- Tucker, W. J., et al. Studies into the determinants of skeletal muscle oxygen consumption: Novel insight from near-infrared diffuse correlation spectroscopy. J Physiol-London. 597 (11), 2887-2901 (2019).
- Tucker, W. J., et al. Near-infrared diffuse correlation spectroscopy tracks changes in oxygen delivery and utilization during exercise with and without isolated arterial compression. Am J Physiol Regul Integr Comp Physiol. 318 (1), R81-R88 (2020).
- Wassenaar, E. B., Van Den Brand, J. G. Reliability of near-infrared spectroscopy in people with dark skin pigmentation. J Clinic Monit Comput. 19 (3), 195-199 (2005).
- Soares, R. N., Murias, J. M. Near-infrared spectroscopy assessment of microvasculature detects difference in lower limb vascular responsiveness in obese compared to lean individuals. Microvasc Res. 118, 31-35 (2018).
- Boezeman, R. P., et al. Monitoring of foot oxygenation with near-infrared spectroscopy in patients with critical limb ischemia undergoing percutaneous transluminal angioplasty: A pilot study. Eur J Vasc Endovasc Surg. 52 (5), 650-656 (2016).
- Lin, B. S., et al. Using wireless near-infrared spectroscopy to predict wound prognosis in diabetic foot ulcers. Adv Skin Wound Care. 33 (1), 1-12 (2020).
- Weingarten, M. S., et al. Diffuse near-infrared spectroscopy prediction of healing in diabetic foot ulcers: A human study and cost analysis. Wound Repair. 20 (2), A44-A44 (2012).
- Murrow, J. R., et al. Near-infrared spectroscopy-guided exercise training for claudication in peripheral arterial disease. Eur J Prev Cardiol. 26 (5), 471-480 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados