このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
下肢血管機能評価のための反応性充血中の近赤外分光法
要約
ここでは、近赤外分光法を使用して下肢の反応性充血を評価するための非侵襲的アプローチについて説明します。このプロトコルは、血管機能障害の存在と治療介入の有効性を判断するために使用できる、血管および微小血管の応答性の標準化された評価を提供します。
要約
下肢の血管疾患は、心血管疾患や糖尿病などの併存疾患の世界的な負担に大きく寄与しています。重要なことは、微小血管機能障害は、大血管の病状に先立って、またはそれと並行して発生する可能性があり、どちらも患者の症状と疾患の負担に寄与する可能性があります。ここでは、反応性充血時に近赤外分光法(NIRS)を使用した非侵襲的アプローチについて説明し、下肢の血管(障害)機能の標準化された評価と、治療介入の有効性を評価する可能性のある方法を提供します。コントラスト増強超音波などの代替方法とは異なり、このアプローチは静脈アクセスや高度な画像分析を必要とせず、安価でオペレーターへの依存度が低いです。このNIRS法の説明には、代表的な結果と標準的な用語、および測定に関する考慮事項、制限、および代替法の説明が含まれています。この研究の将来の適用により、血管研究デザイン、データ収集手順、および調和のとれた報告の標準化が改善され、それによって下肢の血管(機能不全)、疾患、および治療の分野におけるトランスレーショナル研究の成果が向上します。
概要
心血管疾患(CVD)は、世界の死亡率の主な原因です1。心筋梗塞と脳卒中がCVDの最も一般的な症状ですが、末梢動脈疾患(PAD)や糖尿病性足疾患などの下肢の血管疾患は、CVDの個人的、社会的、および医療的負担に大きく寄与しています2,3,4。重要なことに、これらの病状は、症状(間欠性跛行など)、機能障害、運動障害、社会的孤立、生活の質の低下6に寄与する微小血管および大血管機能障害5によって特徴付けられます。歴史的に、上肢の血管評価技術は、全身の血管機能と関連する心血管リスクの尺度として使用されてきました。しかし、これらの方法は、下肢血管機能の局所的な障害に感受性がない可能性がある7,8。現在、下肢の血管機能を評価するために、血流介在性拡張術(FMD)や造影超音波など、さまざまな技術が使用されていますが、どの方法にも、機器のコスト、オペレーターのスキル、侵襲的な静脈アクセスの必要性など、欠点や制限があります。これらの理由から、研究や臨床現場でより容易に実施できる、下肢の血管(障害)機能を評価するための標準化された効果的な技術が必要です。
連続波近赤外分光法(CW-NIRS)は、生体内でのヘモグロビン酸素化の相対的な変化を定量化する、非侵襲的で低コストのポータブルな方法です。NIRSの酸素化および脱酸素化ヘモグロビンシグナルは小血管(直径<1 mm)に由来するため、局所骨格筋代謝と微小血管機能を評価することができます9。具体的には、組織飽和度指数(TSI)[TSI = Oxygenated Hemoglobin/ (Oxygenated Hemoglobin + Deoxygenated Hemoglobin) x 100]は、組織酸素化の定量的尺度を提供する9。閉塞および反応性充血の前、最中、および後に測定した場合、TSI の変化は、閉塞前のベースラインと比較して「末端器官」血管反応性を示します。重要なことに、この方法は、微小血管機能障害を有する、または微小血管機能障害のリスクがある個人における、老化10、疾患の進行11、および臨床的介入(例えば、血行再建術12,13または運動リハビリテーション14,15,16,17)に関連する筋肉微小血管反応性および灌流の変化に敏感である。
NIRSシステムの利用可能性は、微小血管機能18を報告する調査研究の数の急速な増加につながっています。しかし、反応性充血検査プロトコルの違い、詳細で再現性のあるNIRS法の省略、NIRS反応パラメータの説明、提示、分析の統一性の欠如により、個々の試験間での比較は困難になっています。これにより、メタアナリシスのためのデータの照合と臨床評価の推奨事項の策定が制限されます9,15。
したがって、この記事では、下肢反応性充血の評価のための当研究室の標準化されたNIRSおよび血管閉塞検査プロトコルについて説明します。これらの手法を普及させることで、データ収集手順の標準化と再現性の向上、および調和のとれた報告に貢献することを目指しています。
プロトコル
ここに記載されているすべての方法は、サンシャインコースト大学の人間研究倫理委員会によって承認されています。さらに、すべての参加者は、このプロトコルで概説されている測定に参加するための書面によるインフォームド コンセントを与えました。下肢の血管閉塞検査は、以前に血管移植または大腿動脈または膝窩動脈のステント留置を含む血行再建術を受けたことのある個人には禁忌であることに注意してください。機器を準備した後、参加者は仰臥位で10分間休むように指示されます。この時点で、NIRSデータの収集は最初の2分間隔で開始され、NIRS信号の安定性を達成することができます。その後、ベースライン データを 1 分間収集し、その時点で大腿部にあるカフを迅速に膨らませて動脈閉塞を実現します。カフが急速に収縮する前に、閉塞は5分間維持されます。データ収集は、シグナルがベースラインに回復するまで、反応性充血期間を通じて継続されます。. 図1 は、反応性充血プロトコルの概要を示しており、詳細な手順を以下に示します。研究に使用した機器は 、資料表に記載されています。
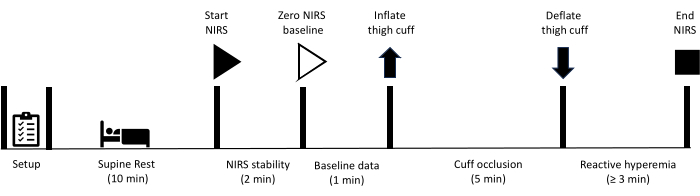
図1:NIRS反応性充血の測定プロトコルとタイミングを概説した概略図。 NIRS:近赤外分光法。 この図の拡大版を表示するには、ここをクリックしてください。
1. 機器の準備
注:さまざまなNIRS、カフインフレーション/オクルージョン、およびデータ収集システムを使用して、以下に概説する代表的な結果を取得できます。研究者は、独自のユーザーマニュアルを参照し、独自のソフトウェア、キャリブレーション、周囲光、および参加者/コホート固有の考慮事項を認識していることが重要です。
- すべての測定が静かで温度管理された部屋(21-23°C)で行われることを確認してください。
- すべての機器と材料( 材料の表を参照)が利用可能であることを確認します。
- CW-NIRS デバイス、およびデバイスが送信先のコンピュータが完全に充電され、電源がオンになっていることを確認します。
- NIRSデバイスがBluetooth 経由で NIRSデータを表示するコンピューターとペアリングされていること、およびNIRSユニットの測定パラメータが実験サイトと研究デザインに従って定義されていることを確認してください(例:近赤外光の微分光路長係数(DPF)を定義します)。
注:NIRSプロトコルの手順とシステム設定のほとんどは、メーカーの推奨事項、研究者の経験、および専門家/コンセンサスの意見の組み合わせに基づいています。測定中に生成される値は、使用する特定のデバイスとプローブ、およびデバイスソフトウェアで選択した設定によって異なることに注意してください。また、収集されるシグナルには、個人間で大きなばらつきが生じる可能性もあります。さらに、研究間の比較を改善するために、NIRS機器の詳細(プローブの設計、ソース-検出器の分離距離や使用した波長など)、システム設定、筋肉の形状に対するプローブの位置/向き、およびこれらの測定結果を公開する際の分析パラメータ/データの取り扱いを報告することが重要です。 - NIRSデバイスソフトウェアの詳細に従って、参加者のデータを入力します。
- ラピッドカフインフレーターを空気と電源に接続します。
2. 参加者の準備
- 参加者が参加者情報ステートメントと同意書を読み、開始前に測定に参加することに同意したことを確認してください。
- 参加者が靴と靴下を脱いで、関連する人体測定のために静止している間、測定中に何を期待するかを参加者に説明します。
- 計画されたNIRS測定部位(たとえば、ふくらはぎの円周が最大になる点の内側面)でスキンフォールド測定(3回)を行います。
注:これにより、皮膚と脂肪組織の深さ(日常的に脂肪組織の厚さ-ATT)をNIRS信号の浸透深さに関連して確認できます。あるいは、超音波を使用して脂肪組織の厚さを決定することもできます。NIRS信号/測定値の深さは、受信機-送信機距離9の約半分であることを常に念頭に置いてください。 - 信号品質を最大化するには、NIRS送信機/受信機プローブの計画部位に光を吸収する可能性のある髪の毛がないか確認し、必要に応じてシェービングして髪の毛を取り除きます。
注:皮膚が蜂巣炎などで損なわれている場合、または浮腫がある場合は、これらの問題は信号品質の低下、信号の浸透深さ/測定が行われる組織、および参加者の創傷の無菌性に関連するため、測定の適切性を検討してください。 - 関連する解剖学的ランドマーク(例:内側顆の上面)に関連して計画されたNIRSプローブの配置の位置を測定したり、マークしたりして、参加者間および参加者内でNIRSプローブを正確に配置できるようにします(研究デザインとプローブデザイン/形状によって異なります)酸素化応答は、異なる筋肉間または同じ筋肉の領域内でも大きな不均一性を示す可能性があるためです。
- 参加者に、診察台座またはベッドに仰臥位で横になるように依頼します。その後、参加者は10分間休憩します。
- 膝の近位にある大腿部の周りにカフを配置し、チューブがふくらはぎやNIRSデバイスに接触しないようにします(図2)。
- フォームサポートで足と足首を乗せて脚を持ち上げ(~10 cm)、下肢を安定して測定できるようにします(図3)。
注: テストを両方のレグで複数回実施する必要がある場合は、テスト順序がランダム化され (初期テストの前)、テストの順序は各参加者のその後の評価で維持されます。 - ラピッドカフインフレーターモジュールをオンにします。
注意: ラピッドカフインフレーターのモードと圧力設定が、製造元の指示と血管閉塞プロトコルの仕様と一致していることを確認してください。 - カフインインフレーターの空気源をオンにし、空気がホースを通って移動できることを確認し、ホースを大腿部の袖口に接続します。
- カフインフレーターのホースがまだふくらはぎに接触していないことを確認してください。
- NIRS トランスミッタ/レシーバー プローブを測定部位 (通常は腓腹筋の内側面) を覆う皮膚にしっかりと固定します (ただし、研究や参加者の詳細によっては、足の背側や前脛骨筋などの他の部位も利用されます)。
注:一部のNIRSシステムでは、複数のサイトを同時に測定できます。 - プローブを黒いキネシオロジーテープなどで覆い、周囲光がNIRS信号の品質/値に影響を与えないようにエッジを密閉するように注意します(図3)。
注意: プローブと接着剤カバーを固定するときは、プローブの動きを排除し、皮膚/脂肪組織/筋肉を圧迫しないようにしてください。
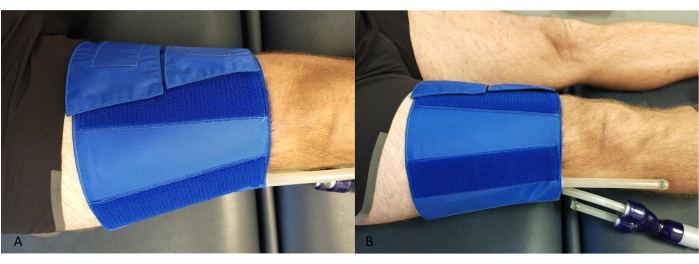
図2:大腿部の閉塞性カフ留置例(A)上から。(B)側面から。この図の拡大版を表示するには、ここをクリックしてください。
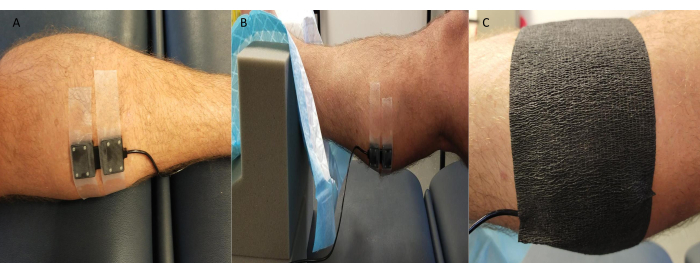
図3:近赤外分光プローブの位置の例。 (A)内側腓腹筋の剃毛皮膚に取り付けられたプローブ。(B)足首をフォームサポートに取り付けてプローブを配置し、アクセスを可能にし、安定性を確保します。(C)環境光を所定の位置に遮蔽します。 この図の拡大版を表示するには、ここをクリックしてください。
3. ベースライン データ収集
- データ収集中は、参加者にリラックスし、話すのを控え、足を動かさないように依頼します。
- コンピューターインターフェース を介して NIRSデバイスの記録を開始します。
注: オフライン データ収集が有効になっていて、推奨されている場合は、NIRS デバイスを直接起動します。 - 測定を開始する前に、少なくとも2分間のデータを取得する必要があります。これにより、データ集録前に定常状態の信号が得られます。
- コンピュータの画面を監視して、データのシグナルインテグリティと生理学的に妥当な値を確認します。たとえば、データ集録(DAQ)値は、NIRSデバイスによって検出される信号品質と周囲光の量に関する情報を提供します。測定中は、許容範囲に保つ必要があります。
- 2分後、NIRS信号の変動が見られない場合(動きのアーチファクトなど)、コンピューター/デバイス/同期ユニットの対応するボタンを押してNIRSデータのベースラインを設定します。このベースラインは、測定の比較開始点を反映しています。酸素化ヘモグロビンと脱酸素化ヘモグロビンの変化は、このベースラインに対して相対的に解釈されます。
注:データ収集中は、特定のマイルストーン、つまりベースラインの開始と終了、カフ閉塞の開始と終了などのソフトウェアベースのイベントマーカーを挿入して、データ分析を支援します。 - 少なくとも 1 分間のベースライン データを収集し、この間に変動や動きのアーティファクトが発生しないようにします。
注:ベースラインデータの変動は、充血予備能などの一部の潜在的な変数の解釈に影響を与えます(代表的な結果のセクションを参照)。
4. 血管閉塞
- ラピッドカフインフレーターでカフ圧力を200mmHgに設定してから、カフモード(または代替システムの関連設定)に切り替えてください。
注:一部の著者は、大腿部9,19で250mmHgへの膨張を推奨していますが、私たちの経験では、これは一部の参加者には十分に許容されず、測定の中止につながります。200 mmHg へのインフレーションは、ほとんどの参加者グループで、安静時の動脈流入を閉塞するのに十分であり、耐容性があり、皮膚の打撲傷を引き起こさずに済みます。200 mmHgで効果的な閉塞を確実に達成するために、私たちのグループは、NIRSと同時にひずみゲージプレチスモグラフィーを日常的に使用して、カフインフの期間中に下流の血流がないことを確認します。 - カフを 200 mmHg まで 5 分間膨らませ、その後カフが完全に収縮する過程で何を期待するか (不快感、チクチクする感覚など) について参加者にアドバイスします。データ収集中は、リラックスしたままで、話すのを控え、足を動かさないように参加者に再度注意を促します。
注:私たちの経験では、閉塞期間の最初の30〜60秒は参加者にとって最も快適ではありません。参加者が足をリラックスさせると、閉塞がより許容できると感じる傾向があります。 - カフインフレーションを開始する準備ができたら、NIRSソフトウェアでベースライン期間の終了をマークします。
- 大腿部のカフを収縮上圧力200mmHgまで膨らませるか、まれに200mmHgでは効果がないことが証明されている場合は220mmHgまで膨らませます。
- コンピューターまたは画面を監視して、閉塞期間中のデータの整合性を確認します。
- 5 分間のカフ閉塞の終了が近づいたら、参加者に脚をできるだけ動かさないように注意し、カフ収縮後約 3 分間は話すのを控えるように促して準備します (反応性充血に対する血管反応のデータが収集されている間)。
注:循環が回復するにつれて、参加者は不快感を和らげたり緩和したりするために手足を動かしたくなる可能性があるため、参加者にじっとしているように注意喚起することは重要です。
5. 反応性充血
- 閉塞から5分が経過したら、大腿部のカフを急速に完全に収縮させます(0 mmHgまで)。同時に、NIRSソフトウェアで閉塞期間の終了をマークします。血流の再開と関連要因による反応性充血反応は、NIRSソフトウェアディスプレイに表示されます(図4)。
- 閉塞後最低3分後、またはNIRSデータがベースラインに戻った後、NIRSソフトウェアで回復期間の終了をマークし、測定を停止します。
注:回復の期間は、部分的には、調査されている研究または臨床上の問題、したがって、分析のために選択された特定のNIRSパラメータ、およびより長い回復期間を必要とする可能性のある付随する手段(FMDなど)の可能性に依存します。 - データの処理と分析のためのNIRS結果のデータ保存とエクスポートを開始します。
6. フォローアップ手続き
- NIRSデバイスとカフを参加者から取り外します。
- 必要に応じて、製造元の指示と関連する衛生基準に従って、NIRSデバイス(および閉塞カフ)を清掃します。
- NIRSデバイスを検査して、送信機/受信機の完全性と将来の測定のためのバッテリー性能を確認します。
結果
近赤外分光法
連続波近赤外分光装置は、酸素化(O2Hb)ヘモグロビンと脱酸素化(HHb)ヘモグロビンの相対的な変化を測定し、発光源と光検出器を介した局所的なO2の送達と利用を反映して、特定の距離を際立たせます。~700 nm から 850 nm の波長の光が放出され、O2Hb と HHb のピーク吸収性に対応します。近赤外光が骨格筋を透過すると、光の散乱と吸収?...
ディスカッション
この記事では、CW-NIRS TSIを使用して微小血管機能を評価するための下肢反応性充血の評価のための標準化された手順について概説します。このプロトコルは、反応の大きさに対するカフ閉塞期間、反応性充血中のNIRSテスト-再テストの信頼性、およびNIRSと造影超音波23,24などの他の微小血管評価方法との一致レベルを調べることによって洗練されて?...
開示事項
著者には、開示や競合する利益はありません。
謝辞
著者らは、以前の研究が本書に記載されているプロトコルの改良に貢献したA.Meneses博士に感謝したいと思います。さらに、著者らは、臨床的および科学的理解を深めるために、このようなプロトコルの開発を可能にするために時間を割いてくださったすべての研究参加者に感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Cuff Inflator Air Source | Hokanson | AG101 AIR SOURCE | |
| Elastic Cohesive Bandage | MaxoWrap | 18228-BL | For blocking out ambient light |
| OxySoft | Artinis | 3.3.341 x64 | |
| PortaLite (NIRS) | Artinis | 0302-00019-00 | |
| PortaSync MKII (Remote) | Artinis | 0702-00860-00 | For Marking milestones during measurement |
| Rapid Cuff Inflator | Hokanson | E20 RAPID CUFF INFLATOR | |
| Thigh Cuff | Hokanson | CC17 | |
| Transpore Surgical Tape | 3M | 1527-1 | For fixing probe to skin |
参考文献
- Hasani, W. S. R., et al. The global estimate of premature cardiovascular mortality: A systematic review and meta-analysis of age-standardized mortality rate. BMC Public Health. 23 (1), 1561 (2023).
- Horvath, L., et al. Epidemiology of peripheral artery disease: Narrative review. Life (Basel). 12 (7), 1041 (2022).
- Jodheea-Jutton, A., Hindocha, S., Bhaw-Luximon, A. Health economics of diabetic foot ulcer and recent trends to accelerate treatment). Foot (Edinb). 52, 101909 (2022).
- Rodrigues, B. T., Vangaveti, V. N., Urkude, R., Biros, E., Malabu, U. H. Prevalence and risk factors of lower limb amputations in patients with diabetic foot ulcers: A systematic review and meta-analysis. Diabetes Metab Syndr-Clinin Res Rev. 16 (2), 102397 (2022).
- Jung, F., et al. Microcirculation in hypertensive patients. Biorheology. 50 (5-6), 241-255 (2013).
- Bethel, M., Annex, B. H. Peripheral arterial disease: A small and large vessel problem. AmHeart J Plus: Cardio Res Prac. 28, 133291 (2023).
- Thijssen, D. H. J., et al. Expert consensus and evidence-based recommendations for the assessment of flow-mediated dilation in humans. Eur Heart J. 40 (30), 2534-2547 (2019).
- Sanada, H., et al. Vascular function in patients with lower extremity peripheral arterial disease: A comparison of functions in upper and lower extremities. Atherosclerosis. 178 (1), 179-185 (2005).
- Barstow, T. J. Understanding near-infrared spectroscopy and its application to skeletal muscle research. J App Phys. 126 (5), 1360-1376 (2019).
- Rogers, E. M., Banks, N. F., Jenkins, N. D. M. Metabolic and microvascular function assessed using near-infrared spectroscopy with vascular occlusion in women: Age differences and reliability. Exp Physiol. 108 (1), 123-134 (2023).
- Manfredini, F., et al. A toe flexion nirs assisted test for rapid assessment of foot perfusion in peripheral arterial disease: Feasibility, validity, and diagnostic accuracy. Eur J Vasc Endovasc Surg. 54 (2), 187-194 (2017).
- Boezeman, R. P., Moll, F. L., Unlu, C., De Vries, J. P. Systematic review of clinical applications of monitoring muscle tissue oxygenation with near-infrared spectroscopy in vascular disease. Microvasc Res. 104, 11-22 (2016).
- Baltrunas, T., et al. Measurement of revascularization effect using near-infrared spectroscopy in below the knee arteries. Rev Cardiovasc Med. 23 (9), 299 (2022).
- Tuesta, M., Yanez-Sepulveda, R., Verdugo-Marchese, H., Mateluna, C., Alvear-Ordenes, I. Near-infrared spectroscopy used to assess physiological muscle adaptations in exercise clinical trials: A systematic review. Biology (Basel). 11 (7), 1073 (2022).
- Cornelis, N., et al. The use of near-infrared spectroscopy to evaluate the effect of exercise on peripheral muscle oxygenation in patients with lower extremity artery disease: A systematic review. Eur J Vasc Endovasc Surg. 61 (5), 837-847 (2021).
- Whyte, E., Thomas, S., Marzolini, S. Muscle oxygenation of the paretic and nonparetic legs during and after exercise in chronic stroke: Implications for mobility. PM R. 15 (10), 1239-1248 (2023).
- Soares, R. N., George, M. A., Proctor, D. N., Murias, J. M. Differences in vascular function between trained and untrained limbs assessed by near-infrared spectroscopy. Eur J Appl Physiol. 118 (10), 2241-2248 (2018).
- Joseph, S., et al. Near infrared spectroscopy in peripheral artery disease and the diabetic foot: A systematic review. Diabetes Metab Res Rev. 38 (7), 3571 (2022).
- Willingham, T. B., Southern, W. M., Mccully, K. K. Measuring reactive hyperemia in the lower limb using near-infrared spectroscopy. J Biomed Opt. 21 (9), 091302 (2016).
- Jones, S., Chiesa, S. T., Chaturvedi, N., Hughes, A. D. Recent developments in near-infrared spectroscopy (nirs) for the assessment of local skeletal muscle microvascular function and capacity to utilise oxygen. Artery Res. 16, 25-33 (2016).
- Soares, R. N., et al. Effects of a rehabilitation program on microvascular function of CHD patients assessed by near-infrared spectroscopy. Physiol Rep. 7 (11), e14145 (2019).
- Baltrunas, T., et al. The use of near-infrared spectroscopy in the diagnosis of peripheral artery disease: A systematic review. Vascular. 30 (4), 715-727 (2022).
- Young, G. M., et al. Influence of cuff-occlusion duration on contrast-enhanced ultrasound assessments of calf muscle microvascular blood flow responsiveness in older adults. Exp Physiol. 105 (12), 2238-2245 (2020).
- Young, G. M., et al. The association between contrast-enhanced ultrasound and near-infrared spectroscopy-derived measures of calf muscle microvascular responsiveness in older adults. Heart Lung Circ. 30 (11), 1726-1733 (2021).
- Rosenberry, R., Nelson, M. D. Reactive hyperemia: A review of methods, mechanisms, and considerations. Am J Physiol Regul Integr Comp Physiol. 318 (3), R605-R618 (2020).
- Iannetta, D., et al. Reliability of microvascular responsiveness measures derived from near-infrared spectroscopy across a variety of ischemic periods in young and older individuals. Microvasc Res. 122, 117-124 (2019).
- Celermajer, D. S., et al. Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis. Lancet. 340 (8828), 1111-1115 (1992).
- Thijssen, D. H. J., et al. Assessment of flow-mediated dilation in humans: A methodological and physiological guideline. Am J Physiol-Heart Circ Physiol. 300 (1), H2-H12 (2011).
- Inaba, Y., Chen, J. A., Bergmann, S. R. Prediction of future cardiovascular outcomes by flow-mediated vasodilatation of brachial artery: A meta-analysis. Int J Cardiovasc Imaging. 26 (6), 631-640 (2010).
- Soares, R. N., De Oliveira, G. V., Alvares, T. S., Murias, J. M. The effects of the analysis strategy on the correlation between the NIRS reperfusion measures and the FMD response. Microvasc Res. 127, 103922 (2020).
- Tucker, W. J., et al. Studies into the determinants of skeletal muscle oxygen consumption: Novel insight from near-infrared diffuse correlation spectroscopy. J Physiol-London. 597 (11), 2887-2901 (2019).
- Tucker, W. J., et al. Near-infrared diffuse correlation spectroscopy tracks changes in oxygen delivery and utilization during exercise with and without isolated arterial compression. Am J Physiol Regul Integr Comp Physiol. 318 (1), R81-R88 (2020).
- Wassenaar, E. B., Van Den Brand, J. G. Reliability of near-infrared spectroscopy in people with dark skin pigmentation. J Clinic Monit Comput. 19 (3), 195-199 (2005).
- Soares, R. N., Murias, J. M. Near-infrared spectroscopy assessment of microvasculature detects difference in lower limb vascular responsiveness in obese compared to lean individuals. Microvasc Res. 118, 31-35 (2018).
- Boezeman, R. P., et al. Monitoring of foot oxygenation with near-infrared spectroscopy in patients with critical limb ischemia undergoing percutaneous transluminal angioplasty: A pilot study. Eur J Vasc Endovasc Surg. 52 (5), 650-656 (2016).
- Lin, B. S., et al. Using wireless near-infrared spectroscopy to predict wound prognosis in diabetic foot ulcers. Adv Skin Wound Care. 33 (1), 1-12 (2020).
- Weingarten, M. S., et al. Diffuse near-infrared spectroscopy prediction of healing in diabetic foot ulcers: A human study and cost analysis. Wound Repair. 20 (2), A44-A44 (2012).
- Murrow, J. R., et al. Near-infrared spectroscopy-guided exercise training for claudication in peripheral arterial disease. Eur J Prev Cardiol. 26 (5), 471-480 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved