Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Nahinfrarotspektroskopie bei reaktiver Hyperämie zur Beurteilung der Gefäßfunktion der unteren Extremitäten
In diesem Artikel
Zusammenfassung
Hier beschreiben wir einen nicht-invasiven Ansatz mit Nahinfrarotspektroskopie zur Beurteilung einer reaktiven Hyperämie in der unteren Extremität. Dieses Protokoll bietet eine standardisierte Beurteilung der vaskulären und mikrovaskulären Reaktionsfähigkeit, die zur Bestimmung des Vorhandenseins einer vaskulären Dysfunktion sowie der Wirksamkeit therapeutischer Interventionen verwendet werden kann.
Zusammenfassung
Gefäßerkrankungen der unteren Extremität tragen wesentlich zur weltweiten Belastung durch Herz-Kreislauf-Erkrankungen und Begleiterkrankungen wie Diabetes bei. Wichtig ist, dass mikrovaskuläre Dysfunktionen vor oder neben der makrovaskulären Pathologie auftreten können, und beide tragen möglicherweise zu Patientensymptomen und Krankheitslast bei. In dieser Arbeit beschreiben wir einen nicht-invasiven Ansatz mit Nahinfrarotspektroskopie (NIRS) bei reaktiver Hyperämie, der eine standardisierte Beurteilung der vaskulären (Dys)funktion der unteren Extremitäten und eine mögliche Methode zur Bewertung der Wirksamkeit therapeutischer Interventionen bietet. Im Gegensatz zu alternativen Methoden, wie z. B. kontrastmittelverstärktem Ultraschall, erfordert dieser Ansatz keinen venösen Zugang oder eine ausgefeilte Bildanalyse, ist kostengünstig und weniger bedienerabhängig. Diese Beschreibung der NIRS-Methode enthält repräsentative Ergebnisse und Standardterminologie sowie die Erörterung von Messüberlegungen, Einschränkungen und alternativen Methoden. Die zukünftige Anwendung dieser Arbeit wird die Standardisierung des vaskulären Forschungsdesigns, der Datenerhebungsverfahren und der harmonisierten Berichterstattung verbessern und dadurch die translationalen Forschungsergebnisse in den Bereichen vaskuläre (Dys)funktion der unteren Extremitäten, Krankheit und Behandlung verbessern.
Einleitung
Herz-Kreislauf-Erkrankungen (CVD) sind die Hauptursache für die weltweite Sterblichkeit1. Während Myokardinfarkt und Schlaganfall die häufigsten Manifestationen von Herz-Kreislauf-Erkrankungen sind, tragen Gefäßerkrankungen der unteren Extremitäten, wie die periphere arterielle Verschlusskrankheit (pAVK) und die diabetische Fußerkrankung, wesentlich zur persönlichen, sozialen und gesundheitlichen Belastung durch Herz-Kreislauf-Erkrankungen bei 2,3,4. Wichtig ist, dass diese Krankheitszustände durch mikrovaskuläre und makrovaskuläre Dysfunktionengekennzeichnet sind 5, die zu Symptomen (z. B. Claudicatio intermittens), Funktionsbeeinträchtigungen, eingeschränkter Mobilität sowie sozialer Isolation und verminderter Lebensqualitätbeitragen 6. In der Vergangenheit wurden Techniken zur Beurteilung der Gefäße der oberen Gliedmaßen als Maß für die systemische Gefäßfunktion und das damit verbundene kardiovaskuläre Risiko verwendet. Diese Methoden sind jedoch möglicherweise nicht sensitiv gegenüber lokalen Beeinträchtigungen der Gefäßfunktion der unteren Extremitäten 7,8. Obwohl es derzeit eine Reihe von Techniken gibt, die zur Beurteilung der Gefäßfunktion in der unteren Extremität verwendet werden, wie z. B. die flussvermittelte Dilatation (FMD) und der kontrastmittelverstärkte Ultraschall, hat jede Methode Nachteile und Einschränkungen, wie z. B. die Kosten für die Ausrüstung, die Fähigkeiten des Bedieners oder die Notwendigkeit eines invasiven venösen Zugangs. Aus diesen Gründen besteht ein Bedarf an standardisierten und effektiven Techniken zur Bewertung der vaskulären (Dys)funktion der unteren Extremitäten, die in Forschung und Klinik leichter implementiert werden können.
Die kontinuierliche Nahinfrarotspektroskopie (CW-NIRS) ist eine nicht-invasive, kostengünstige und tragbare Methode, die die relativen Veränderungen der Hämoglobin-Oxygenierung in vivo quantifiziert. Da die NIRS-sauerstoff- und -desoxygenierten Hämoglobinsignale von den kleinen Gefäßen (<1 mm Durchmesser) stammen, können der lokale Skelettmuskelstoffwechsel und die mikrovaskuläre Funktion ausgewertet werden9. Konkret liefert der Gewebesättigungsindex (TSI) [TSI = oxygeniertes Hämoglobin/ (oxygeniertes Hämoglobin + desoxygeniertes Hämoglobin) x 100] ein quantitatives Maß für die Oxygenierung des Gewebes9. Bei der Messung vor, während und nach Okklusion und reaktiver Hyperämie deuten die Veränderungen des TSI auf eine vaskuläre Reaktionsfähigkeit der Endorgane im Vergleich zum Ausgangswert vor der Okklusion hin. Wichtig ist, dass diese Methode empfindlich auf Veränderungen der mikrovaskulären Reaktionsfähigkeit und Durchblutung der Muskeln reagiert, die mit dem Alter10, dem Fortschreiten der Krankheit11 und klinischen Eingriffen (z. B. Revaskularisationschirurgie12,13 oder Bewegungsrehabilitation 14,15,16,17) bei Personen mit mikrovaskulärer Dysfunktion oder einem Risiko dafür verbunden sind.
Die Verfügbarkeit von NIRS-Systemen hat zu einem raschen Anstieg der Zahl der Forschungsstudien geführt, die über die mikrovaskuläre Funktion berichten18. Unterschiede in den Testprotokollen für reaktive Hyperämie, das Fehlen detaillierter, wiederholbarer NIRS-Methoden sowie ein Mangel an Einheitlichkeit bei der Beschreibung, Darstellung und Analyse der NIRS-Reaktionsparameter machen Vergleiche zwischen einzelnen Studien jedoch zu einer Herausforderung. Dies schränkt die Zusammenstellung von Daten für die Metaanalyse und die Formulierung von Empfehlungen für die klinische Bewertungein 9,15.
Aus diesem Grund beschreiben wir in diesem Artikel die standardisierten NIRS- und Gefäßverschluss-Testprotokolle unseres Labors zur Beurteilung der reaktiven Hyperämie der unteren Extremitäten. Durch die Verbreitung dieser Methoden wollen wir zu einer besseren Standardisierung und Wiederholbarkeit der Datenerhebungsverfahren und einer harmonisierten Berichterstattung beitragen.
Protokoll
Alle hier beschriebenen Methoden wurden von der Ethikkommission für die Humanforschung der University of the Sunshine Coast genehmigt. Darüber hinaus gaben alle Teilnehmer ihre schriftliche Einverständniserklärung zur Teilnahme an den in diesem Protokoll beschriebenen Messungen. Bitte beachten Sie, dass ein Gefäßverschlusstest in der unteren Extremität bei Personen kontraindiziert ist, die sich zuvor einem Revaskularisationsverfahren unterzogen haben, bei dem ein Gefäßtransplantat oder ein Stenting der Oberschenkel- oder Kniekehlenarterien durchgeführt wurde. Nach der Vorbereitung der Ausrüstung wird der Teilnehmer angewiesen, sich 10 Minuten lang in Rückenlage auszuruhen. Zu diesem Zeitpunkt beginnt die NIRS-Datenerfassung mit einer anfänglichen Periode von 2 Minuten, so dass die Stabilität der NIRS-Signale erreicht werden kann. Die Ausgangsdaten werden dann 1 Minute lang gesammelt, woraufhin eine Manschette am Oberschenkel sofort aufgeblasen wird, um einen arteriellen Verschluss zu erreichen. Die Okklusion wird 5 Minuten lang aufrechterhalten, bevor die Manschette schnell entleert wird. Die Datenerfassung wird während der gesamten Periode der reaktiven Hyperämie fortgesetzt, bis sich die Signale auf den Ausgangswert erholt haben. Abbildung 1 zeigt einen Überblick über das Protokoll für reaktive Hyperämie, und die detaillierten Schritte sind unten aufgeführt. Die für die Studie verwendeten Geräte sind in der Materialtabelle aufgeführt.
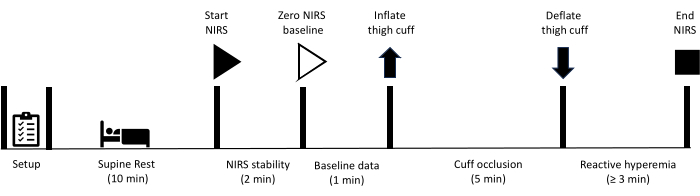
Abbildung 1: Schematische Darstellung des Protokolls und der Zeitpläne für die NIRS-reaktive Hyperämie. NIRS: Nahinfrarotspektroskopie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
1. Vorbereitung der Ausrüstung
HINWEIS: Verschiedene NIRS-, Manschetteninflations-/-okklusions- und Datenerfassungssysteme können verwendet werden, um die unten beschriebenen repräsentativen Ergebnisse zu erhalten. Es ist wichtig, dass die Prüfärzte ihre eigenen spezifischen Benutzerhandbücher konsultieren und sich der einzigartigen Software, der Kalibrierung, des Umgebungslichts und der teilnehmer-/kohortenspezifischen Überlegungen bewusst sind.
- Stellen Sie sicher, dass alle Messungen in einem ruhigen, klimatisierten Raum (21-23 °C) durchgeführt werden.
- Vergewissern Sie sich, dass alle Geräte und Materialien (siehe Materialtabelle) verfügbar sind.
- Stellen Sie sicher, dass das CW-NIRS-Gerät und der Computer, an den das Gerät sendet, vollständig aufgeladen und eingeschaltet sind.
- Vergewissern Sie sich, dass das NIRS-Gerät mit dem Computer gekoppelt ist, auf dem die NIRS-Daten über Bluetooth angezeigt werden, und ob die Messparameter des NIRS-Geräts entsprechend dem Versuchsort und dem Studiendesign definiert sind (ein Beispiel: Definieren Sie den differentiellen Weglängenfaktor (DPF) des Nahinfrarotlichts).
HINWEIS: Die meisten Schritte und Systemeinstellungen des NIRS-Protokolls basieren auf einer Kombination aus Herstellerempfehlungen, Erfahrungen von Forschern und Experten-/Konsensmeinungen. Beachten Sie, dass die während der Messung erzeugten Werte vom jeweiligen Gerät und den verwendeten Sonden sowie von den in der Gerätesoftware gewählten Einstellungen abhängen. Es besteht auch das Potenzial für ein hohes Maß an interindividueller Variabilität bei den gesammelten Signalen. Um einen besseren Vergleich zwischen den Studien zu ermöglichen, ist es außerdem wichtig, bei der Veröffentlichung der Ergebnisse dieser Messungen Einzelheiten zu den NIRS-Instrumenten (z. B. Sondendesign, Abstände zwischen Quelle und Detektor und verwendete Wellenlängen), Systemeinstellungen, Sondenposition/-ausrichtung in Bezug auf die Muskelgeometrie und die Analyseparameter/Datenbehandlung anzugeben. - Geben Sie die Daten des Teilnehmers gemäß den Angaben in der NIRS-Gerätesoftware ein.
- Verbinden Sie den Schnellmanschetten-Inflator mit den Luft- und Stromquellen.
2. Vorbereitung der Teilnehmer
- Stellen Sie sicher, dass der Teilnehmer die Teilnehmerinformationserklärung und die Einverständniserklärung gelesen und vor Beginn seine Zustimmung zur Teilnahme an der Messung gegeben hat.
- Erklären Sie dem Teilnehmer, was ihn während der Messung erwartet, während er seine Schuhe und Socken auszieht und für relevante anthropometrische Messungen stationär steht.
- Nehmen Sie eine Hautfaltenmessung (in dreifacher Ausfertigung) über der geplanten NIRS-Messstelle vor (z. B. an der medialen Seite an der Stelle des maximalen Wadenumfangs).
HINWEIS: Auf diese Weise kann die Tiefe der Haut und des Fettgewebes (routinemäßig als Fettgewebsdicke - ATT bezeichnet) in Bezug auf die Eindringtiefe des NIRS-Signals bestätigt werden. Alternativ kann Ultraschall verwendet werden, um die Dicke des Fettgewebes zu bestimmen. Denken Sie immer daran, dass die Tiefe des NIRS-Signals/der NIRS-Messung etwa die Hälfte des Empfänger-Sender-Abstands9 beträgt. - Um die Signalqualität zu maximieren, überprüfen Sie die geplante Stelle der NIRS-Sender-/Empfängersonde auf Haare, die Licht absorbieren können, und entfernen Sie die Haare bei Bedarf durch Rasieren.
HINWEIS: Wenn die Haut beeinträchtigt ist, z. B. durch Cellulite oder wenn ein Ödem vorliegt, sollten Sie die Angemessenheit der Messung in Betracht ziehen, da sich diese Probleme auf eine möglicherweise verminderte Signalqualität, die Signaleindringtiefe/das Gewebe, von dem die Messung durchgeführt wird, sowie die Wundsterilität der Teilnehmer beziehen. - Nehmen Sie Messungen vor und/oder markieren Sie die Position der geplanten NIRS-Sondenplatzierung in Bezug auf relevante anatomische Orientierungspunkte (z. B. die obere Oberfläche des medialen Kondylus), um eine genaue Platzierung der NIRS-Sonde zwischen und innerhalb der Teilnehmer zu ermöglichen (abhängig vom Studiendesign und dem Sondendesign/-form), da die Oxygenierungsreaktionen eine große Heterogenität zwischen verschiedenen Muskeln oder sogar innerhalb von Regionen desselben Muskels aufweisen können.
- Bitten Sie den Teilnehmer, sich in Rückenlage auf einen Untersuchungssockel oder ein Bett zu legen. Der Teilnehmer ruht sich dann für 10 Minuten aus.
- Legen Sie eine Manschette proximal zum Knie um den Oberschenkel und achten Sie darauf, dass die Schläuche nicht mit der Wade oder dem NIRS-Gerät in Berührung kommen (Abbildung 2).
- Heben Sie das Bein (~10 cm) mit Fuß und Knöchel auf einer Schaumstoffstütze an, so dass der Unterschenkel stabil und für Messungen zugänglich bleibt (Abbildung 3).
HINWEIS: Wenn der Test in beiden Beinen mehrmals durchgeführt werden muss, wird die Testreihenfolge randomisiert (vor dem ersten Test), und die Reihenfolge der Tests wird für nachfolgende Bewertungen für jeden Teilnehmer beibehalten. - Schalten Sie das Schnellmanschetten-Inflator-Modul ein.
HINWEIS: Stellen Sie sicher, dass die Modus- und Druckeinstellungen des Schnellmanschetten-Inflators mit den Anweisungen des Herstellers und den Spezifikationen des Gefäßverschlussprotokolls übereinstimmen. - Schalten Sie die Luftquelle des Manschetten-Inflators ein, prüfen Sie, ob Luft durch den Schlauch strömen kann, und verbinden Sie den Schlauch mit der Oberschenkelmanschette.
- Stellen Sie sicher, dass der Schlauch des Manschetten-Inflators immer noch nicht mit der Wade in Berührung kommt.
- Befestigen Sie die NIRS-Sender-/Empfängersonde sicher auf der Haut über der Messstelle(n) (routinemäßig der mediale Aspekt des Gastrocnemius; je nach Studie und Teilnehmerspezifika werden jedoch auch andere Stellen wie der Fußrücken und der Tibialis anterior verwendet).
HINWEIS: Einige NIRS-Systeme ermöglichen die gleichzeitige Durchführung von Messungen vor Ort. - Decken Sie die Sonde mit schwarzem Kinesiologie-Klebeband oder ähnlichem ab und achten Sie darauf, die Ränder zu versiegeln, um zu verhindern, dass das Umgebungslicht die Qualität/Werte des NIRS-Signals beeinträchtigt (Abbildung 3).
HINWEIS: Achten Sie beim Befestigen der Sonde und der Klebeabdeckung darauf, dass keine Sondenbewegungen vermieden werden, aber vermeiden Sie es, Haut/Fettgewebe/Muskeln zu komprimieren.
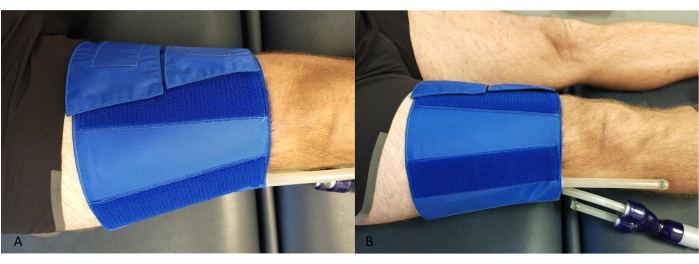
Abbildung 2: Beispiel für die Platzierung der Okklusivmanschette am Oberschenkel. (A) Von oben. (B) Von der Seite. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
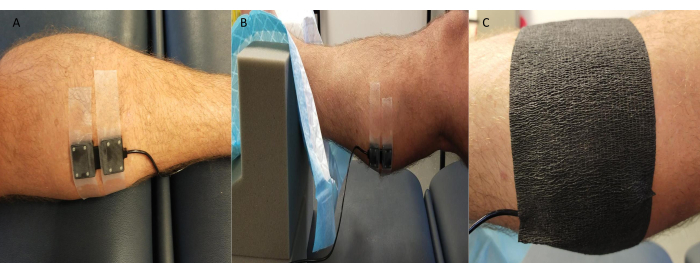
Abbildung 3: Beispiel für eine Sondenposition in der Nahinfrarotspektroskopie. (A) Sonde an der rasierten Haut am medialen Gastrocnemius. (B) Platzierung der Sonde mit Knöchel in Schaumstoffstütze, um den Zugang zu ermöglichen und Stabilität zu gewährleisten. (C) Umgebungslichtabschirmung an Ort und Stelle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Erhebung von Basisdaten
- Bitten Sie den Teilnehmer, entspannt zu bleiben, nicht zu reden und für die Dauer der Datenerhebung das/die Bein(e) ruhig zu halten.
- Starten Sie die Aufzeichnung des NIRS-Geräts über die Computerschnittstelle.
HINWEIS: Wenn die Offline-Datenerfassung aktiviert und bevorzugt ist, starten Sie das NIRS-Gerät direkt. - Warten Sie, bis mindestens 2 Minuten Daten erfasst werden, bevor Sie mit dem Start der Messung beginnen. Dadurch wird sichergestellt, dass stationäre Signale vor der Datenerfassung erreicht werden.
- Überwachen Sie den Computerbildschirm, um die Integrität des Datensignals und physiologisch plausible Werte sicherzustellen. Die Datenerfassungswerte (Data Acquisition, Datenerfassungswerte) geben beispielsweise Auskunft über die Signalqualität und die Menge des vom NIRS-Gerät erfassten Umgebungslichts. Sie sollten während der gesamten Messung in einem akzeptablen Bereich gehalten werden.
- Wenn nach 2 Minuten keine Schwankungen im NIRS-Signal festgestellt werden (z. B. aufgrund von Bewegungsartefakten), stellen Sie die NIRS-Datenbasis ein, indem Sie die entsprechende Taste am Computer/Gerät/Synchronisationseinheit drücken. Diese Basislinie spiegelt den vergleichenden Ausgangspunkt der Messung wider. Die Veränderungen des sauerstoffhaltigen und desoxygenierten Hämoglobins werden relativ zu diesem Ausgangswert interpretiert.
HINWEIS: Fügen Sie während der Datenerfassung softwarebasierte Ereignismarker für bestimmte Meilensteine ein, nämlich Beginn und Ende der Baseline, Beginn und Ende der Manschettenokklusion usw., um die Datenanalyse zu unterstützen. - Sammeln Sie mindestens 1 Minute Basisdaten, und stellen Sie erneut sicher, dass während dieser Zeit keine Schwankungen oder Bewegungsartefakte auftreten.
HINWEIS: Schwankungen in den Ausgangsdaten wirken sich auf die Interpretation einiger potenzieller Variablen aus, wie z. B. der hyperämischen Reserve (siehe Abschnitt "Repräsentative Ergebnisse").
4. Gefäßverschluss
- Stellen Sie den Manschettendruck am Schnellmanschetten-Inflator auf 200 mmHg ein, bevor Sie in den Manschettenmodus wechseln (oder die entsprechende Einstellung bei alternativen Systemen).
HINWEIS: Während einige Autoren ein Aufblasen auf 250 mmHg am Oberschenkel 9,19 empfehlen, wird dies nach unserer Erfahrung von einigen Teilnehmern nicht gut vertragen, was zum Abbruch der Messung führt. Das Aufblasen auf 200 mmHg ist in den meisten Teilnehmergruppen ausreichend, um den arteriellen Zufluss in Ruhe zu verschließen, während es erträglich ist und nicht zu Blutergüssen der Haut führt. Um sicherzustellen, dass eine effektive Okklusion bei 200 mmHg erreicht wird, verwendet unsere Gruppe routinemäßig die DMS-Plethysmographie gleichzeitig mit NIRS, um das Fehlen eines nachgeschalteten Blutflusses während der Zeit des Aufblasens der Manschette zu bestätigen. - Informieren Sie den Teilnehmer darüber, was ihn während des Aufblasens der Manschette auf 200 mmHg für einen Zeitraum von 5 Minuten erwartet (Unwohlsein, Kribbeln usw.), gefolgt von einer vollständigen Entleerung der Manschette. Erinnern Sie den Teilnehmer noch einmal daran, entspannt zu bleiben, nicht zu reden und die Beine(n) für die Dauer der Datenerfassung unbeweglich zu halten.
HINWEIS: Wir haben die Erfahrung gemacht, dass die ersten 30-60 s der Okklusionsphase für die Teilnehmer am unbequemsten sind. Wenn die Teilnehmer ihre Beine entspannen lassen, neigen sie dazu, die Okklusion erträglicher zu finden. - Wenn Sie bereit sind, das Aufblasen der Manschette zu starten, markieren Sie das Ende des Basiszeitraums in der NIRS-Software.
- Pumpen Sie die Oberschenkelmanschette auf einen suprasystolischen Druck von 200 mmHg auf, alternativ auf 220 mmHg in seltenen Fällen, in denen sich 200 mmHg als unwirksam erwiesen haben.
- Überwachen Sie den Computer oder Bildschirm, um die Datenintegrität während der Okklusionsphase sicherzustellen.
- Wenn sich das Ende der 5-minütigen Manschettenokklusion nähert, bereiten Sie den Teilnehmer vor, indem Sie ihn daran erinnern, sein Bein so ruhig wie möglich zu halten und etwa 3 Minuten nach der Manschettendeflation nicht zu sprechen (während die Daten aus den vaskulären Reaktionen auf reaktive Hyperämie gesammelt werden).
HINWEIS: Diese Erinnerung an den Teilnehmer, still zu bleiben, ist wichtig, da die Teilnehmer versucht sein könnten, die Gliedmaßen zu bewegen, um Beschwerden zu lindern, wenn die Durchblutung wiederhergestellt wird.
5. Reaktive Hyperämie
- Nachdem 5 Minuten der Okklusion vergangen sind, entleeren Sie die Oberschenkelmanschette schnell vollständig (auf 0 mmHg). Markieren Sie gleichzeitig das Ende der Okklusionsperiode in der NIRS-Software. Die reaktive Hyperämiereaktion aufgrund der Wiederaufnahme des Blutflusses und verwandter Faktoren wird auf dem Display der NIRS-Software sichtbar sein (Abbildung 4).
- Nach mindestens 3 Minuten nach der Okklusion oder alternativ, nachdem die NIRS-Daten wieder zum Ausgangswert zurückgekehrt sind, markieren Sie das Ende der Erholungsphase in der NIRS-Software und stoppen Sie die Messung.
HINWEIS: Die Dauer der Genesung hängt zum Teil von der untersuchten Forschungs- oder klinischen Fragestellung und damit von den spezifischen NIRS-Parametern ab, die für die Analyse ausgewählt werden, sowie von der Möglichkeit begleitender Maßnahmen (wie MKS), die eine längere Erholungsdauer erfordern können. - Initiieren Sie die Datenspeicherung und den Export von NIRS-Ergebnissen für die Datenaufbereitung und -analyse.
6. Follow-up-Verfahren
- Entfernen Sie das/die NIRS-Gerät(e) und die Manschette vom Teilnehmer.
- Reinigen Sie das NIRS-Gerät (und die Okklusionsmanschette) bei Bedarf gemäß den Anweisungen des Herstellers und den einschlägigen Hygienestandards.
- Überprüfen Sie das NIRS-Gerät, um die Integrität des Senders/Empfängers und die Batterieleistung für zukünftige Messungen sicherzustellen.
Ergebnisse
Nahinfrarot-Spektroskopie
Dauerstrich-Nahinfrarotspektroskopiegeräte messen relative Änderungen des sauerstoffhaltigen (O2Hb) und desoxygenierten (HHb) Hämoglobins, die die lokale O2 -Abgabe und -Nutzung über lichtemittierende Quellen und Photodetektoren widerspiegeln, die in bestimmten Abständen voneinander angeordnet sind. Es werden Wellenlängen des Lichts zwischen ~700 nm und 850 nm emittiert, was der maximalen Absorption vonO2Hb und HHb entspricht. S...
Diskussion
In diesem Artikel werden standardisierte Verfahren zur Beurteilung der reaktiven Hyperämie der unteren Extremitäten unter Verwendung der CW-NIRS TSI zur Beurteilung der mikrovaskulären Funktion beschrieben. Dieses Protokoll wurde verfeinert durch die Untersuchung der Dauer des Verschlusses der Manschette in Bezug auf das Ausmaß des Ansprechens, der Reliabilität des NIRS-Tests bei reaktiver Hyperämie sowie des Grades der Übereinstimmung zwischen NIRS und anderen Methoden der mikrovaskulären Beurteilung, wie z. B. ...
Offenlegungen
Die Autoren haben keine Offenlegungen oder konkurrierende Interessen.
Danksagungen
Die Autoren danken Dr. A. Meneses, dessen frühere Arbeiten zur Verfeinerung des hier beschriebenen Protokolls beigetragen haben. Darüber hinaus danken die Autoren allen Forschungsteilnehmern, die ihre Zeit gespendet haben, um die Entwicklung solcher Protokolle zu ermöglichen und das klinische und wissenschaftliche Verständnis zu fördern.
Materialien
| Name | Company | Catalog Number | Comments |
| Cuff Inflator Air Source | Hokanson | AG101 AIR SOURCE | |
| Elastic Cohesive Bandage | MaxoWrap | 18228-BL | For blocking out ambient light |
| OxySoft | Artinis | 3.3.341 x64 | |
| PortaLite (NIRS) | Artinis | 0302-00019-00 | |
| PortaSync MKII (Remote) | Artinis | 0702-00860-00 | For Marking milestones during measurement |
| Rapid Cuff Inflator | Hokanson | E20 RAPID CUFF INFLATOR | |
| Thigh Cuff | Hokanson | CC17 | |
| Transpore Surgical Tape | 3M | 1527-1 | For fixing probe to skin |
Referenzen
- Hasani, W. S. R., et al. The global estimate of premature cardiovascular mortality: A systematic review and meta-analysis of age-standardized mortality rate. BMC Public Health. 23 (1), 1561 (2023).
- Horvath, L., et al. Epidemiology of peripheral artery disease: Narrative review. Life (Basel). 12 (7), 1041 (2022).
- Jodheea-Jutton, A., Hindocha, S., Bhaw-Luximon, A. Health economics of diabetic foot ulcer and recent trends to accelerate treatment). Foot (Edinb). 52, 101909 (2022).
- Rodrigues, B. T., Vangaveti, V. N., Urkude, R., Biros, E., Malabu, U. H. Prevalence and risk factors of lower limb amputations in patients with diabetic foot ulcers: A systematic review and meta-analysis. Diabetes Metab Syndr-Clinin Res Rev. 16 (2), 102397 (2022).
- Jung, F., et al. Microcirculation in hypertensive patients. Biorheology. 50 (5-6), 241-255 (2013).
- Bethel, M., Annex, B. H. Peripheral arterial disease: A small and large vessel problem. AmHeart J Plus: Cardio Res Prac. 28, 133291 (2023).
- Thijssen, D. H. J., et al. Expert consensus and evidence-based recommendations for the assessment of flow-mediated dilation in humans. Eur Heart J. 40 (30), 2534-2547 (2019).
- Sanada, H., et al. Vascular function in patients with lower extremity peripheral arterial disease: A comparison of functions in upper and lower extremities. Atherosclerosis. 178 (1), 179-185 (2005).
- Barstow, T. J. Understanding near-infrared spectroscopy and its application to skeletal muscle research. J App Phys. 126 (5), 1360-1376 (2019).
- Rogers, E. M., Banks, N. F., Jenkins, N. D. M. Metabolic and microvascular function assessed using near-infrared spectroscopy with vascular occlusion in women: Age differences and reliability. Exp Physiol. 108 (1), 123-134 (2023).
- Manfredini, F., et al. A toe flexion nirs assisted test for rapid assessment of foot perfusion in peripheral arterial disease: Feasibility, validity, and diagnostic accuracy. Eur J Vasc Endovasc Surg. 54 (2), 187-194 (2017).
- Boezeman, R. P., Moll, F. L., Unlu, C., De Vries, J. P. Systematic review of clinical applications of monitoring muscle tissue oxygenation with near-infrared spectroscopy in vascular disease. Microvasc Res. 104, 11-22 (2016).
- Baltrunas, T., et al. Measurement of revascularization effect using near-infrared spectroscopy in below the knee arteries. Rev Cardiovasc Med. 23 (9), 299 (2022).
- Tuesta, M., Yanez-Sepulveda, R., Verdugo-Marchese, H., Mateluna, C., Alvear-Ordenes, I. Near-infrared spectroscopy used to assess physiological muscle adaptations in exercise clinical trials: A systematic review. Biology (Basel). 11 (7), 1073 (2022).
- Cornelis, N., et al. The use of near-infrared spectroscopy to evaluate the effect of exercise on peripheral muscle oxygenation in patients with lower extremity artery disease: A systematic review. Eur J Vasc Endovasc Surg. 61 (5), 837-847 (2021).
- Whyte, E., Thomas, S., Marzolini, S. Muscle oxygenation of the paretic and nonparetic legs during and after exercise in chronic stroke: Implications for mobility. PM R. 15 (10), 1239-1248 (2023).
- Soares, R. N., George, M. A., Proctor, D. N., Murias, J. M. Differences in vascular function between trained and untrained limbs assessed by near-infrared spectroscopy. Eur J Appl Physiol. 118 (10), 2241-2248 (2018).
- Joseph, S., et al. Near infrared spectroscopy in peripheral artery disease and the diabetic foot: A systematic review. Diabetes Metab Res Rev. 38 (7), 3571 (2022).
- Willingham, T. B., Southern, W. M., Mccully, K. K. Measuring reactive hyperemia in the lower limb using near-infrared spectroscopy. J Biomed Opt. 21 (9), 091302 (2016).
- Jones, S., Chiesa, S. T., Chaturvedi, N., Hughes, A. D. Recent developments in near-infrared spectroscopy (nirs) for the assessment of local skeletal muscle microvascular function and capacity to utilise oxygen. Artery Res. 16, 25-33 (2016).
- Soares, R. N., et al. Effects of a rehabilitation program on microvascular function of CHD patients assessed by near-infrared spectroscopy. Physiol Rep. 7 (11), e14145 (2019).
- Baltrunas, T., et al. The use of near-infrared spectroscopy in the diagnosis of peripheral artery disease: A systematic review. Vascular. 30 (4), 715-727 (2022).
- Young, G. M., et al. Influence of cuff-occlusion duration on contrast-enhanced ultrasound assessments of calf muscle microvascular blood flow responsiveness in older adults. Exp Physiol. 105 (12), 2238-2245 (2020).
- Young, G. M., et al. The association between contrast-enhanced ultrasound and near-infrared spectroscopy-derived measures of calf muscle microvascular responsiveness in older adults. Heart Lung Circ. 30 (11), 1726-1733 (2021).
- Rosenberry, R., Nelson, M. D. Reactive hyperemia: A review of methods, mechanisms, and considerations. Am J Physiol Regul Integr Comp Physiol. 318 (3), R605-R618 (2020).
- Iannetta, D., et al. Reliability of microvascular responsiveness measures derived from near-infrared spectroscopy across a variety of ischemic periods in young and older individuals. Microvasc Res. 122, 117-124 (2019).
- Celermajer, D. S., et al. Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis. Lancet. 340 (8828), 1111-1115 (1992).
- Thijssen, D. H. J., et al. Assessment of flow-mediated dilation in humans: A methodological and physiological guideline. Am J Physiol-Heart Circ Physiol. 300 (1), H2-H12 (2011).
- Inaba, Y., Chen, J. A., Bergmann, S. R. Prediction of future cardiovascular outcomes by flow-mediated vasodilatation of brachial artery: A meta-analysis. Int J Cardiovasc Imaging. 26 (6), 631-640 (2010).
- Soares, R. N., De Oliveira, G. V., Alvares, T. S., Murias, J. M. The effects of the analysis strategy on the correlation between the NIRS reperfusion measures and the FMD response. Microvasc Res. 127, 103922 (2020).
- Tucker, W. J., et al. Studies into the determinants of skeletal muscle oxygen consumption: Novel insight from near-infrared diffuse correlation spectroscopy. J Physiol-London. 597 (11), 2887-2901 (2019).
- Tucker, W. J., et al. Near-infrared diffuse correlation spectroscopy tracks changes in oxygen delivery and utilization during exercise with and without isolated arterial compression. Am J Physiol Regul Integr Comp Physiol. 318 (1), R81-R88 (2020).
- Wassenaar, E. B., Van Den Brand, J. G. Reliability of near-infrared spectroscopy in people with dark skin pigmentation. J Clinic Monit Comput. 19 (3), 195-199 (2005).
- Soares, R. N., Murias, J. M. Near-infrared spectroscopy assessment of microvasculature detects difference in lower limb vascular responsiveness in obese compared to lean individuals. Microvasc Res. 118, 31-35 (2018).
- Boezeman, R. P., et al. Monitoring of foot oxygenation with near-infrared spectroscopy in patients with critical limb ischemia undergoing percutaneous transluminal angioplasty: A pilot study. Eur J Vasc Endovasc Surg. 52 (5), 650-656 (2016).
- Lin, B. S., et al. Using wireless near-infrared spectroscopy to predict wound prognosis in diabetic foot ulcers. Adv Skin Wound Care. 33 (1), 1-12 (2020).
- Weingarten, M. S., et al. Diffuse near-infrared spectroscopy prediction of healing in diabetic foot ulcers: A human study and cost analysis. Wound Repair. 20 (2), A44-A44 (2012).
- Murrow, J. R., et al. Near-infrared spectroscopy-guided exercise training for claudication in peripheral arterial disease. Eur J Prev Cardiol. 26 (5), 471-480 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten