Method Article
أحادي اللون متعدد الإرسال الكمي PCR قياس طول التيلومير
* These authors contributed equally
In This Article
Summary
نقدم هنا بروتوكولا لقياس طول التيلومير النسبي (TL) باستخدام مقايسة تفاعل البوليميراز الكمي المتسلسل أحادي اللون (MMqPCR). مقايسة MMqPCR هي طريقة قابلة للتكرار وفعالة وفعالة من حيث التكلفة لقياس TL من الحمض النووي البشري في الدراسات السكانية.
Abstract
التيلوميرات هي هياكل البروتين النووي الريبي في نهاية جميع الكروموسومات حقيقية النواة التي تحمي الحمض النووي من التلف وتحافظ على استقرار الكروموسوم. ارتبط طول التيلومير (TL) بالعديد من التعرضات والعمليات البيولوجية والنتائج الصحية. توضح هذه المقالة بروتوكول فحص تفاعل البوليميراز الكمي المتسلسل أحادي اللون (MMqPCR) الذي يتم إجراؤه بشكل روتيني في مختبرنا لقياس متوسط TL النسبي من الحمض النووي البشري. هناك العديد من طرق قياس TL المختلفة القائمة على تفاعل البوليميراز المتسلسل ، ولكن البروتوكول المحدد لطريقة MMqPCR المقدم في هذا المنشور قابل للتكرار وفعال وفعال من حيث التكلفة ومناسب للدراسات السكانية. يحدد هذا البروتوكول التفصيلي جميع المعلومات اللازمة للمحققين لإنشاء هذا الفحص في مختبرهم. بالإضافة إلى ذلك ، يوفر هذا البروتوكول خطوات محددة لزيادة قابلية استنساخ قياس TL بواسطة هذا الفحص ، المحدد بواسطة معامل الارتباط داخل الفئة (ICC) عبر القياسات المتكررة لنفس العينة. تعد غرفة التجارة الدولية عاملا حاسما في تقييم القوة المتوقعة لمجموعة دراسة محددة. على هذا النحو ، يعد الإبلاغ عن ICCs الخاصة بالأتراب لأي اختبار TL خطوة ضرورية لتعزيز الدقة الشاملة للدراسات السكانية ل TL. تظهر نتائج الأمثلة التي تستخدم عينات الحمض النووي المستخرجة من خلايا الدم أحادية النواة المحيطية جدوى توليد بيانات TL قابلة للتكرار للغاية باستخدام بروتوكول MMqPCR هذا.
Introduction
التيلوميرات هي مجمعات واقية توجد في نهاية جميع الكروموسومات حقيقية النواة ، وتتكون من تسلسلات الحمض النووي المتكررة المحفوظة للغاية والبروتينات المرتبطة بها. يحمي التيلومير سلامة الحمض النووي ، ويحافظ على استقرار الكروموسوم. يحدث التقصير التدريجي للتيلوميرات في الخلايا المنقسمة نتيجة لتخليق الحمض النووي المتأخر غير المكتمل ، وتلف الحمض النووي ، وعوامل أخرى 1,2. ترافقت زيادة الأدلة التي تدعم طول التيلومير (TL) كعلامة حيوية للشيخوخة والأمراض المرتبطة بالعمر عبر عمر الإنسان مع زيادة في أنواع مقايسات قياس TL المستخدمة لتقييم دور TL في دراسات التعرض البشري والمرض والصحة3،4،5. أبلغت التحليلات التلوية عن ارتباطات TL بالوفيات الإجمالية والتعرض البيئي والنتائج الصحية ، بما في ذلك السرطان وأمراض القلب والأوعية الدموية والسكري6،7،8،9،10،11،12،13. تستمد هذه الارتباطات التلوية من الدراسات التي تستخدم واحدة من أكثر من عشرين منهجية مختلفة لقياس TL حيث تميل نقاط القوة في الجمعيات إلى الاختلاف بين المنهجيات المختلفة14،15،16. يعد اختيار طريقة قياس TL المثلى لدراسة بحثية خطوة حاسمة لضمان نتائج دقيقة ، حيث تمتلك كل طريقة مزاياها وعيوبها 5,17.
نظرا للتكلفة المنخفضة نسبيا للكواشف ، والتحول السريع للفحص ، وقابلية التوسع ، وانخفاض متطلبات الحمض النووي الأولية ، غالبا ما يتم استخدام تقنيات قياس TL القائمة على تفاعل البوليميراز المتسلسل بشكل تفضيلي عند إجراء دراسات مع مجموعات كبيرة من العينات ، أو الدراسات ذات الوصول المحدود إلى العينات ذات تركيزات الحمض النووي العالية ، أو الدراسات التي تعطي الأولوية للإنتاجية العالية. أول طريقة قائمة على تفاعل البوليميراز المتسلسل لقياس TL ، تفاعل البلمرة المتسلسل الكمي المفرد (qPCR) الذي طوره ريتشارد كاوثون في الأصل ، تستخدم نسبة إشارات التألق للتيلومير (T) وتضخيم جين النسخة الواحدة (S) ، تعمل على لوحات PCR منفصلة18. في هذا النهج ، يتم استخدام الباشيئات المكملة لتسلسل الحمض النووي للتيلومير المتكرر (T) لتضخيم محتوى الحمض النووي التيلوميري الكلي في العينة وقياسه عن طريق الكشف عن المراسل الفلوري SYBR الأخضر. وبالمثل ، يتم استخدام الأعداد الأولية المكملة لمنطقة بين الجينات لجين نسخة واحدة محفوظة (S) لتحديد عدد نسخة الجينوم. يتم تحديد هذين التقديرين كميا بالنسبة إلى منحنى معيار الحمض النووي الجينومي المستخدم في جميع المقايسات في مشروع للتحكم في الاختلاف من لوحة إلى أخرى. ينتج عن قسمة إجمالي الحمض النووي التيلوميري (T) على رقم نسخة الجينوم الفردي (S) نسبة T / S ، وهو قياس نسبي بدون وحدة يمثل متوسط محتوى التيلومير لكل خلية لعينة الحمض النووي الفردية18,19. وبالتالي ، فإن نسبة T / S ليست قياسا محددا للطول الوظيفي ؛ ومع ذلك ، تمشيا مع معايير الأدب ، فإننا نستخدم مصطلح متوسط TL لكل عينة في جميع أنحاء هذا البروتوكول.
تم تطوير هذه الطريقة في عام 2009 عندما وصف ريتشارد كاوثون مقايسة qPCR متعددة الإرسال أحادية اللون (MMqPCR) كنهج لتقليل التباين المحتمل في نسبة T / S بالنسبة إلى طريقة qPCR أحادية الإرسالالأصلية 19. يمتلك اختبار MMqPCR فوائد مقايسة qPCR مع ميزة إضافية تتمثل في قياس إشارات T و S داخل نفس بئر التفاعل باستخدام فلوروفور إبلاغ واحد ، وبالتالي تقليل الخطأ بالنسبة إلى qPCR أحادي الإرسال ويؤدي إلى دقة أعلى وقابلية استنساخ19. علاوة على ذلك ، من المحتمل أن تؤدي طريقة تعدد الإرسال هذه إلى خفض التكاليف وتعزيز الإنتاجية نظرا لأن نصف عدد التفاعلات مطلوبة مقارنة بمقايسة الإرسال الفردي19.
نظرا لمزايا قياس MMqPCR TL ، فإن هذه الطريقة مناسبة تماما للدراسات السكانية لارتباطات TL مع التعرض والنتائج الصحية والعمليات البيولوجية. ومع ذلك ، قد يكون بدء الطريقة أمرا صعبا. لمواجهة هذه التحديات ، نصف بالتفصيل بروتوكول قياس MMqPCR TL المستخدم في مختبرنا ، مع تسليط الضوء على الخطوات الرئيسية المنفذة لزيادة دقة الفحص وتقليل مخاطر التلوث وتعزيز قابلية التكرار.
علاوة على ذلك ، يحدد هذا البروتوكول خطوات تنظيف البيانات وحساب معامل الارتباط داخل الفئة (ICC) ، وهو مقياس إحصائي مهم لاستنساخ قياسات TL2. من خلال نتائجنا التمثيلية ، نظهر القدرة على إنشاء ICCs عالية باستخدام هذا البروتوكول. بالإضافة إلى ذلك ، نحدد خطوات مراقبة الجودة (QC) واستكشاف الأخطاء وإصلاحها المتوقع أن تقلل من التباين في قياسات TL وتزيد من ICC الناتج. نظرا لقابلية التكرار العالية لهذه الطريقة وكفاءتها وفعاليتها من حيث التكلفة ، فإن قياس MMqPCR TL مثالي لأبحاث TL الوبائية. يقدم الشكل 1 نظرة عامة مرئية على طريقة MMqPCR كما هو موضح في هذا البروتوكول.
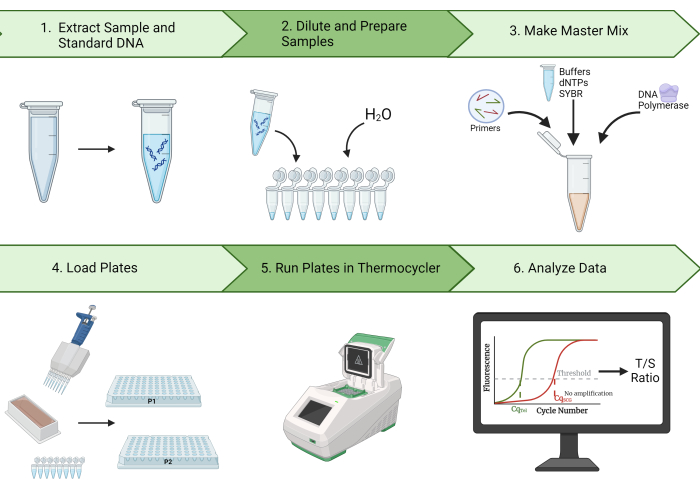
الشكل 1: نظرة عامة على الطريقة. نظرة عامة واسعة على طريقة تفاعل البلمرة المتسلسل الكمي أحادي اللون لقياس طول التيلومير. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
تم إجراء هذا البحث وفقا للمبادئ التوجيهية المؤسسية. يصف هذا البروتوكول مقايسة MMqPCR التي أجريت على عمق قياس ثلاثي مكرر ، أي قياسات ثلاثية لكل عينة مكررة عبر لوحات مكررة ، يتم تنفيذها باستخدام اثنين من التدوير الحراري في وقت واحد لتعزيز الإنتاجية. يعد استخدام اللوحات المكررة اعتبارا رئيسيا في تنفيذ هذا البروتوكول لتحقيق قابلية عالية للتكرار كما هو موضح في ICCs العالية. على الرغم من أنه من الممكن استخدام عدد أقل من النسخ المتماثلة ، إلا أن التأثير على ICC ، وبالتالي القوة وحجم العينة المطلوب ، يحتاج إلى النظر بعناية وقياسه مع كل مجموعة من قبل كل مختبر20,21. في حالة توفر جهاز تدوير حراري واحد فقط ، نقترح الحفاظ على عمق القياس (أي ثلاث نسخ ثلاثية مكررة) ، وتشغيل 2 لوحة بالتتابع.
1. إعداد المخزون وظروف التخزين
- للاطلاع على جميع المواد والمعدات المستخدمة في هذا البروتوكول، انظر جدول المواد. بالإضافة إلى ذلك ، بالنسبة لكواشف المزيج الرئيسي المحددة والكميات المستخدمة في اختبار MMqPCR ، انظر الجدول 1. في حالة تشغيل لوحين بالتتابع ، نصف حجم المزيج الرئيسي مع الحفاظ على التركيز ، مما يضمن استخدام نفس حصص الكاشف عبر لوحات متسلسلة من نفس الفحص.
ملاحظة: يجب تحضير جميع كواشف المخزون مسبقا ويجب إذابة الكواشف المقتبسة تماما قبل الاستخدام. - Aliquot وتخزين 1x Tris-EDTA ، درجة الحموضة 7.6 (TE) في أنابيب 5 مل في أحجام 3 مل في درجة حرارة الغرفة لمدة تصل إلى 2 سنوات.
- القسمة وتخزين 5 M البيتين في أنابيب 5 مل في أحجام 1280 ميكرولتر في -20 درجة مئوية لمدة تصل إلى 1 سنة.
- قم بتخزين وتخزين SYBR Green في أحجام 3 ميكرولتر في أنابيب شريط PCR فردية عند -20 درجة مئوية لمدة تصل إلى عامين ، مغطاة بورق القصدير ومعرضة للضوء إلى الحد الأدنى.
- تخزين بوليميراز الحمض النووي في أنابيب الأصلي في -20 °C لمدة تصل إلى 1 سنة.
- القسمة وتخزين 10x بوليميراز العازلة في أنابيب 1.5 مل في أحجام 660 ميكرولتر في -20 درجة مئوية لمدة تصل إلى 1 سنة.
- بالنسبة للتخفيفات العازلة 1x من 10x polymerase buffer ، أضف 9.9 μL من المخزن المؤقت 10x إلى 89.1 μL من PCR grade H2O في أنابيب 0.5 مل ؛ يحفظ في -20 درجة مئوية لمدة تصل إلى 1 سنة.
- قم بتخزين وتخزين 1 M MgCl2 في أنابيب 0.5 مل في أحجام 70 ميكرولتر عند 4 درجات مئوية بعيدا عن الضوء لمدة تصل إلى عام واحد.
- قم بتخزين التيلومير الأمامي والخلفي (T) ونسخة واحدة (S) من البادئات المجففة بالتجميد من الجين قليل النوكليوتيد في درجة حرارة الغرفة بعيدا عن الضوء. يتم عرض تسلسلات أوليج قليل النوكليوتيد الأربعة المحددة في الجدول 2.
ملاحظة: جين النسخة الواحدة في هذا البروتوكول هو الزلال. في حالة اختيار جين نسخة واحدة مختلفة ، قد تحتاج تركيزات التمهيدي إلى التعديل لضمان كفاءة PCR المقبولة.- إعادة تكوين التمهيدي: دوامة كل أنبوب تمهيدي مجفف بالتجميد لمدة 10 ثوان ثم ضع الأنابيب في جهاز طرد مركزي صغير لمدة 5 ثوان لضمان وجود الحبيبات المجففة بالتجميد في قاع الأنبوب قبل إضافة 1x TE buffer.
- تحقق من كل أنبوب تمهيدي فردي لتركيز نانومتر ([نانومتر] = ألفا) وأعد ترطيب كل أنبوب تمهيدي بإضافة 1x TE يساوي 10x من قيمة ألفا في ميكرولتر (على سبيل المثال ، إذا كان تركيز نانومتر على الأنبوب يقرأ 24.6 نانومتر ، ثم أضف 246 ميكرولتر من 1x TE إلى الأنبوب التمهيدي) لإنشاء محلول 100 ميكرومتر لكل برايمر.
- الاقتباسة التمهيدي التيلومير الأمامي والخلفي بشكل منفصل في أحجام 16 ميكرولتر والتمهيدئات الألبومين الأمامية والعكسية بشكل منفصل في أحجام 11 ميكرولتر. قم بتخزين جميع الأنواع الأربعة من القسامات الأولية في -20 درجة مئوية لمدة تصل إلى 6 أشهر.
- خليط dNTP: دوامة 4-8 أنابيب لكل نوع من أنواع dNTPS الأربعة لحلول مخزون 25 مللي متر (أي إجمالي 16-32 أنبوبا) لمدة 10 ثوان متبوعا بدوران سريع في درجة حرارة الغرفة باستخدام جهاز طرد مركزي صغير. ضع الأنابيب في توزيع متساو في مواضع الأنبوب في جهاز الطرد المركزي الصغير ، ثم أغلق الغطاء للسماح للآلة بالوصول إلى السرعة الكاملة ، والدوران لمدة 5 ثوان تقريبا.
- في أنبوب سعة 5 مل ، أضف 200-250 ميكرولتر من كل أنبوب ، مما يضمن إضافة أجزاء متساوية من كل نوع من أنواع dNTP الأربعة ، ودوامة خليط dNTP.
- Aliquot 210 ميكرولتر من الخليط في أنابيب 0.5 مل وتخزينها في -20 درجة مئوية لمدة تصل إلى 1 سنة.
- قم بتخزين مخزون DTT عند -20 درجة مئوية وقم بتخزين 3 أمتار من أسيتات الصوديوم في درجة حرارة الغرفة.
- محلول DTT: قم بقياس 0.1545 جم DTT في قارب وزن قطران على ميزان باستخدام ملعقة من الفولاذ المقاوم للصدأ.
تنبيه: ديثيوثريتول (DTT) هو كاشف خطير. DTT ضار إذا تم ابتلاعه ، ويسبب تهيج الجلد ، ويمكن أن يسبب تلفا خطيرا للعين. يجب على الأفراد ارتداء القفازات الواقية وحماية العين وحماية الوجه عند التعامل مع DTT. بالإضافة إلى ذلك ، يجب على الأفراد تجنب استنشاق أبخرة DTT ، والعمل في غطاء PCR عند التعامل مع DTT ، وتجنب التعرض لفترات طويلة أو متكررة. - اصنع 10 مل من 0.01 M من أسيتات الصوديوم عن طريق إضافة 33.33 ميكرولتر من 3 M أسيتات الصوديوم و 9,967 ميكرولتر من PCR درجة H2O في أنبوب 15 مل وبئر دوامة. أضف DTT المقاس إلى أنبوب 15 مل من أسيتات الصوديوم 0.01 M. انقل ما يقرب من 100 ميكرولتر من محلول أسيتات الصوديوم 0.01 متر إلى وعاء الوزن لجمع DTT المتبقي. ماصة 100 ميكرولتر مرة أخرى في أنبوب 15 مل. بمجرد أن يكون كل DTT في المحلول ، دوامة الأنبوب حتى يذوب تماما.
- صب محتويات الأنبوب سعة 15 مل في حوض التحميل ، ونضح المحلول بأكمله في حقنة بلاستيكية سعة 10 مل من أحد طرفي حوض التحميل. قم بتوصيل مرشح حقنة خلات السليلوز المعقم 0.2 ميكرومتر 25 مم بنهاية المحقنة المملوءة ، واتركها تتشبع بالكامل لمدة دقيقة واحدة ، وقم بتقطير المحلول ببطء في أنبوب جديد سعة 15 مل عن طريق دفع مكبس المحقنة لأسفل برفق ، مما يضمن أن المحلول بأكمله يقطر عبر المرشح إلى أنبوب 15 مل الجديد.
- محلول القسمة DTT في أحجام 200 ميكرولتر في أنابيب 0.5 مل وتخزينها في -20 درجة مئوية لمدة تصل إلى 6 أسابيع.
- محلول DTT: قم بقياس 0.1545 جم DTT في قارب وزن قطران على ميزان باستخدام ملعقة من الفولاذ المقاوم للصدأ.
الجدول 1: الأحجام النهائية وتركيزات الكواشف. أحجام وتركيزات الكواشف في الحصص الفردية ، والمزيج الرئيسي ، وفي آبار PCR. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 2: التيلومير ونسخة واحدة من تسلسل أوليغونيوكليوتيد الجين. قائمة تسلسلات التيلومير والألبومين أحادية النسخة الجينية الأولية المستخدمة في المنهجية. الرجاء الضغط هنا لتنزيل هذا الجدول.
2. استخراج الحمض النووي الجينومي وإعداد العينات
- استخراج العينات التحليلية: إجراء استخراج الحمض النووي الجينومي للعينات وفقا لإرشادات الشركة المصنعة باستخدام مجموعات أو طرق ثابتة داخل المختبر.
- تحقق من جودة عينة الحمض النووي باستخدام مقياس الطيف الضوئي والحمض النووي المزدوج الذي تقطعت به السبل (dsDNA) باستخدام مقياس الفلور. لا ينبغي تحليل العينات ذات المتوسط غير المقبول بنسب 260/280 و 260/230 أو تركيز dsDNA أقل من الكشف (<0.20 نانوغرام / ميكرولتر) مقابلTL 22,23. بالإضافة إلى ذلك ، إذا كان تركيز dsDNA مرتفعا جدا لتوليد قراءة باستخدام مقياس الفلور (>1000 نانوغرام / ميكرولتر) ، فقم بتخفيف العينة وكرر الفحص.
ملاحظة: بالنسبة للنتائج المعروضة هنا ، كانت القيم المقبولة لنقاء الأحماض النووية هي نسبة 260/280 بين 1.6 إلى 2.0 ونسبة 260/230 بين 2.0 و 2.2.
- تحقق من جودة عينة الحمض النووي باستخدام مقياس الطيف الضوئي والحمض النووي المزدوج الذي تقطعت به السبل (dsDNA) باستخدام مقياس الفلور. لا ينبغي تحليل العينات ذات المتوسط غير المقبول بنسب 260/280 و 260/230 أو تركيز dsDNA أقل من الكشف (<0.20 نانوغرام / ميكرولتر) مقابلTL 22,23. بالإضافة إلى ذلك ، إذا كان تركيز dsDNA مرتفعا جدا لتوليد قراءة باستخدام مقياس الفلور (>1000 نانوغرام / ميكرولتر) ، فقم بتخفيف العينة وكرر الفحص.
- استخراج عينات التحكم: إجراء استخراج الحمض النووي الجينومي على عينة تحكم مشتقة من نفس المادة البيولوجية مثل العينات الخاضعة التي يتم فحصها لمشروع معين. تأكد من استخراج الحمض النووي للتحكم الكافي لجميع اللوحات المتوقع تشغيلها للمجموعة بأكملها ، بحيث يتم استخدام معيار DNA واحد لجميع المقايسات.
- تحقق من جودة عينة الحمض النووي للتحكم عن طريق مقياس الطيف الضوئي ومقياس الفلور. يجب أن يكون لعينة التحكم متوسط مقبول 260/280 و 260/230 وتركيزات قابلة للكشف من dsDNA22,23.
- يتحكم الحمض النووي في القسمة بتركيز 2 نانوغرام / ميكرولتر بكميات 150 ميكرولتر في أنابيب 0.5 مل موسومة بنوع العينة وتاريخها. قم بتخزين حصص الحمض النووي للتحكم عند -20 درجة مئوية لمدة تصل إلى 5 سنوات. استخدم عينة واحدة من الحمض النووي الضابط لجميع لوحات جميع العينات من نفس المجموعة أو المشروع البحثي. إعداد هذه القساومات الأسهم مقدما.
- تحضير العينات التحليلية: بالنسبة للعينات التي يكون تركيزها الأولي >5 نانوغرام / ميكرولتر ، قم بإنشاء حصص تخفيف باستخدام عامل تخفيف عدد صحيح ، مع إضافة الكمية المناسبة من عينة الحمض النووي المستخرجة (الملف التكميلي 1 ورقة إعداد MMqPCR ، العمود F) ودرجة PCR H2O (ورقة إعداد الملف التكميلي 1 MMqPCR ، العمود G) لتخفيف التركيز ليكون بين 2.5 - 5.0 نانوغرام / ميكرولتر (الملف التكميلي 1 ورقة إعداد MMqPCR ، العمود K). لا تخفف العينات بتركيز <5 نانوغرام / ميكرولتر ، ومع ذلك ، فإن حجم القسمة كاف لفحص العينة 3x باستخدام هذا البروتوكول.
ملاحظة: يجب إجراء حصص التخفيف أثناء تحضير العينة بحيث يمكن إضافة 15 نانوغرام من الحمض النووي إلى أنبوب شريط PCR المقابل لكل عينة. تسمح حصص العينات للفنيين بتجنب دورات التجميد والذوبان غير الضرورية من التأثير على سلامة الحمض النووي لعينة المخزون إذا فشلت العينة في اجتياز معايير الجودة وتحتاج إلى إعادة التشغيل. يمكن أن يساعد نموذج MMqPCR الموجود في الملف التكميلي 1 في تحديد عامل التخفيف الصحيح والأحجام لإعداد حصص التخفيف (الملف التكميلي 1 ، ورقة إعداد MMqPCR ، الأعمدة E-I).- املأ شرائط تفاعل البوليميراز المتسلسل بالعينات A1-8 في شريط تفاعل البوليميراز المتسلسل A ، والعينات B1-8 في شريط PCR B ، والعينات C1-8 في شريط PRC C ، كما هو مفصل في ورقة إعداد الملف التكميلي 1 MMqPCR والمدرجة في الجدول 3 مع كميات العينات المخففة بشكل مناسب (الملف التكميلي 1 ورقة إعداد MMqPCR ، العمود L) ومبالغ PCR من الدرجة H2O (الملف التكميلي 1 ورقة إعداد MMqPCR ، العمود M) لكمية إجمالية قدرها 15 نانوغرام من الحمض النووي لكل أنبوب PCR وحجم إجمالي قدره 75 ميكرولتر. ضعه جانبا.
ملاحظة: يمكن تخزين العينات في شرائط PCR طوال الليل عند 4 درجات مئوية ليتم طلاءها في اليوم التالي.
- املأ شرائط تفاعل البوليميراز المتسلسل بالعينات A1-8 في شريط تفاعل البوليميراز المتسلسل A ، والعينات B1-8 في شريط PCR B ، والعينات C1-8 في شريط PRC C ، كما هو مفصل في ورقة إعداد الملف التكميلي 1 MMqPCR والمدرجة في الجدول 3 مع كميات العينات المخففة بشكل مناسب (الملف التكميلي 1 ورقة إعداد MMqPCR ، العمود L) ومبالغ PCR من الدرجة H2O (الملف التكميلي 1 ورقة إعداد MMqPCR ، العمود M) لكمية إجمالية قدرها 15 نانوغرام من الحمض النووي لكل أنبوب PCR وحجم إجمالي قدره 75 ميكرولتر. ضعه جانبا.
- تحضير المنحنى القياسي: قم بإذابة قسامة الحمض النووي للتحكم ، دوامة لمدة 30 ثانية ، أجهزة طرد مركزي لمدة 5 ثوان ، ونضح الحجم الكامل (150 ميكرولتر) في الأنبوب الأول في شريط أنبوب PCR المنحنى القياسي (SC).
- ماصة 70 ميكرولتر من درجة PCR H2O في الأنابيب من الثاني إلى الثامن من شريط SC PCR. أعد تعليق الحمض النووي للتحكم تماما في الأنبوب الأول قبل شفط 70 ميكرولتر وتوزيعه في أنبوب تفاعل البوليميراز المتسلسل الثاني. انتظر 30 ثانية ، ثم أعد تعليق المحلول تماما في أنبوب PCR الثاني قبل شفط 70 ميكرولتر وتوزيعه في أنبوب PCR الثالث. كرر هذا للأنابيب من ثلاثة إلى سبعة لإنشاء تخفيف تسلسلي 2 أضعاف من سبعة معايير. يجب أن يحتوي الأنبوب النهائي فقط على درجة PCR H2O ليعمل كعنصر تحكم غير قالب (NTC). ضع شريط SC PCR جانبا.
الجدول 3: تنظيم العينات ومعيار التحكم في اللوحة. موقع جميع العينات والمعايير على لوحة PCR 96 بئرا. الرجاء الضغط هنا لتنزيل هذا الجدول.
3. إعداد مزيج ماجستير MMqPCR
- اجمع حصصا كاشف المزيج الرئيسي المدرجة في الجدول 1 ، باستثناء بوليميراز الحمض النووي ، واسمح لها بالوصول إلى درجة حرارة الغرفة داخل غطاء PCR. أضف 1 ميكرولتر من القسمة الخضراء SYBR إلى القسمة العازلة 1x.
ملاحظة: هناك حاجة إلى هذه الكمية الدقيقة لتوليد التركيز الصحيح ل SYBR بسبب قيود دقة الماصة أثناء الفحص ، لذلك حتى إذا تم تشغيل لوحة واحدة فقط في كل مرة ، يجب أن تظل هذه الكمية دون تغيير. - دوامة جميع القسامات لمدة 10 ثوان ، وأجهزة الطرد المركزي لمدة 5 ثوان ، ثم أضف الكميات التالية من الكواشف إلى أنبوب 5 مل الذي يحمل البيتين 5 M (الآن أنبوب المزيج الرئيسي): 1,235.2 ميكرولتر من درجة PCR H2O ، 640 ميكرولتر من المخزن المؤقت 10x ، 204.8 ميكرولتر من dNTPs ، 192 ميكرولتر من DTT ، 64 ميكرولتر من MgCl2 ، 48 ميكرولتر من المخزن المؤقت SYBR Green / 1x (من الخطوة 3.1) ، 14.4 ميكرولتر من كل من بادئات التيلومير ، و 9.6 ميكرولتر من كل من بادئات الألبومين ، كما هو موضح في الجدول 1.
- أخرج بوليميراز الحمض النووي من تخزين -20 درجة مئوية ، دوامة لمدة 10 ثوان ، أجهزة طرد مركزي لمدة 5 ثوان ، ثم أضف ببطء 128 ميكرولتر إلى المزيج الرئيسي ؛ انقل بوليميراز الحمض النووي على الفور إلى تخزين -20 درجة مئوية.
- دوامة أنبوب المزيج الرئيسي 5 مل لمدة 30 ثانية.
4. إعداد لوحة 96 بئر
- ضع لوحين من 96 بئرا ، وحوض تحميل ، وأطراف ماصة متعددة القنوات داخل غطاء PCR. قم بتسمية كل لوحة برقم اللوحة (1 أو 2). أدر اللوحة الأولى (لوحة P1) 180 درجة بحيث تكون أرقام الأعمدة مقلوبة رأسا على عقب. اترك اللوحة الثانية (P2) في مواجهة الفني.
- صب محتويات أنبوب المزيج الرئيسي سعة 5 مل في حوض التحميل. استخدم طرف ماصة لجمع وتوزيع أي محلول متبقي في الأنبوب.
- قم بتحميل الأطراف على الماصة متعددة القنوات ، وادفع قاعدة كل طرف ماصة لضمان إحكام الغلق. تأكد من أن النصائح لا تحتوي على أي مرشح داخل منطقة الإخراج حيث سيتم استنشاق المزيج الرئيسي ؛ إذا كان هناك قطعة من الفلتر ، فاستبدل الحافة.
- استخدم السحب العكسي لملء الألواح بالمزيج الرئيسي اللزج ، وقم بتدوير حوض التحميل ثم اضغط على مكبس الماصة بعد المحطة الأولى ، مع استنشاق أكبر من 15 ميكرولتر في أطراف الماصة ، مع التأكد من ملء الأطراف في نفس الوقت بنفس الحجم. عند طرد المزيج الرئيسي في عمود ، اضغط على المكبس إلى المحطة الأولى ، مع ترك المزيج الرئيسي الإضافي في أطراف الماصة. ترك المكبس مكتئبا ، اغمر الأطراف مرة أخرى في حوض التحميل وحرر المكبس لملء الأطراف ب 15 ميكرولتر أخرى. استخدم نفس النصائح لملء كلا اللوحتين.
- املأ الألواح عن طريق طرد المزيج الرئيسي إما إلى جميع الأعمدة الزوجية أو الفردية أولا ، بالتناوب بين اللوحات (على سبيل المثال ، إذا اختار الفني البدء بأرقام الأعمدة الفردية ، ملء العمود 1 في P2 أولا ، متبوعا بالعمود 11 على P1 ، ثم العمود 3 على P2 ، وما إلى ذلك). بعد أن يملأ الفني جميع آبار السلسلة (الفردية أو الزوجية) التي تعمل من اليسار إلى اليمين ، قم بعمل السلسلة الأخرى (الزوجية أو الفردية) من الأعمدة بنفس الطريقة. انظر الشكل 2 للحصول على مخطط لهذه العملية.
ملاحظة: تعمل هذه الطريقة من وظائف تعبئة الألواح للتحكم في تأثيرات الموضع عبر الألواح.
- املأ الألواح عن طريق طرد المزيج الرئيسي إما إلى جميع الأعمدة الزوجية أو الفردية أولا ، بالتناوب بين اللوحات (على سبيل المثال ، إذا اختار الفني البدء بأرقام الأعمدة الفردية ، ملء العمود 1 في P2 أولا ، متبوعا بالعمود 11 على P1 ، ثم العمود 3 على P2 ، وما إلى ذلك). بعد أن يملأ الفني جميع آبار السلسلة (الفردية أو الزوجية) التي تعمل من اليسار إلى اليمين ، قم بعمل السلسلة الأخرى (الزوجية أو الفردية) من الأعمدة بنفس الطريقة. انظر الشكل 2 للحصول على مخطط لهذه العملية.
- دوامة شرائط PCR الأربعة المغلقة التي تحتوي على العينات والمنحنى القياسي ثم تدور كل منها في جهاز طرد مركزي صغير لمدة 5 ثوان.
- قم بمحاذاة شرائط PCR في رف أنبوب PCR بترتيب كيفية وضعها على اللوحة. بالنسبة ل P1 ، فإن الأعمدة الثلاثة الأولى هي عينات (شريط PCR A) ، والأعمدة 4-6 هي المعيار (شريط PCR S) ، والأعمدة 7-9 هي عينات (شريط PCR B) ، والأعمدة 10-12 هي عينات (شريط PCR C ؛ انظر الشكل 3 والجدول 3). نظرا لأن P2 مملوء أثناء الدوران بمقدار 180 درجة فيما يتعلق بالفني ، فإن الأعمدة ستكون عكس ذلك.
- أدر كلتا اللوحتين 180 درجة بحيث يتم قلب أرقام الأعمدة بالنسبة للفني لكل لوحة (على سبيل المثال ، إذا واجه الفني ملصق P2 سابقا ، فسيواجه الآن ملصق P1 على حافة اللوحة).
- اضبط الماصة متعددة القنوات على 10 ميكرولتر وقم بتحميل أطراف الماصة على الماصة متعددة القنوات كما هو موضح في الخطوة 4.3.
- استخدم الماصة متعددة القنوات لإعادة تعليق المحاليل ، ثم قم بإجراء سحب عكسي كما هو موضح في الخطوة 4.4 لشفط وتوزيع 10 ميكرولتر من العينات والمحاليل القياسية ، بدءا من شريط PCR A.
- املأ أول 3 أعمدة من كل لوحة باستخدام شريط PCR A عن طريق تبديل الأعمدة بطريقة مماثلة لوضع المزيج الرئيسي في اللوحة (أي زوجي أو فردي).
- املأ الأعمدة الثلاثة التالية باستخدام شريط PCR المنحنى القياسي. بالنسبة لهذا الشريط ، أعد تعليق أنبوبالتخفيف القياسي 7 (الثاني إلى الأخير) ، باستخدام ماصة 200 ميكرولتر مضبوطة على ~ 90 ميكرولتر ، تماما قبل إعادة تعليق الشريط بالكامل باستخدام ماصة متعددة القنوات.
ملاحظة: يؤدي الحجم الأكبر وتركيز الحمض النووي الأصغر في هذا الأنبوب في كثير من الأحيان إلى قياسات متنوعة عبر آبار لوحة PCR بسبب سوء الخلط. يؤدي استخدام حجم أكبر لخلط هذا الأنبوب إلى تجانس محلول الحمض النووي بشكل أفضل. - املأ الأعمدة الثلاثة التالية بشريط PCR B والثلاثة الأخيرة بشريط PCR C. استبدل أطراف الماصة بين كل شريط PCR ، واملأ جميع الآبار البالغ عددها 96 بئرا على كلا اللوحين بالعينات المقابلة ومعيار التحكم كما هو موضح في الشكل 3.
- بمجرد ملء الألواح ، اضغط برفق على اللوحة الموجودة على سطح الطاولة لضمان تدفق السائل على جوانب الآبار إلى القاع ، ثم قم بتغطية أسطح الألواح باستخدام أغشية مانعة للتسرب. استخدم أطراف الأصابع للضغط لأسفل على جميع حواف الفيلم لضمان إحكام الغلق.
- امزج الألواح عن طريق الدوران على سطح غطاء المحرك لمدة 30 ثانية ، ثم ضع الألواح المختومة في دوار اللوحة لمدة 2 دقيقة مع فتحات البئر التي تواجه المركز.
- ضع الألواح في جهاز تدوير حراري ، مع أرقام أعمدة الألواح بترتيب مقروء. استخدم منديلا نظيفا لتنظيف الجزء العلوي من كل لوحة قبل إغلاق الجزء العلوي من جهاز التدوير الحراري.
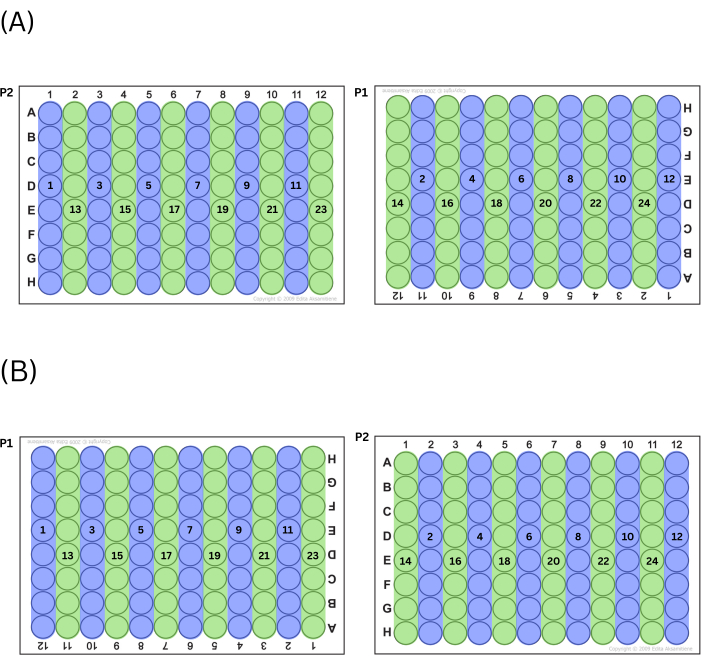
الشكل 2: عملية ملء الألواح. (أ) إذا اخترت ملء أعمدة فردية أولا، فهذا هو الترتيب الذي تملأ به الآبار. (ب) إذا اخترت ملء الأعمدة الزوجية أولا، فهذا هو الترتيب الذي تملأ به الآبار. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
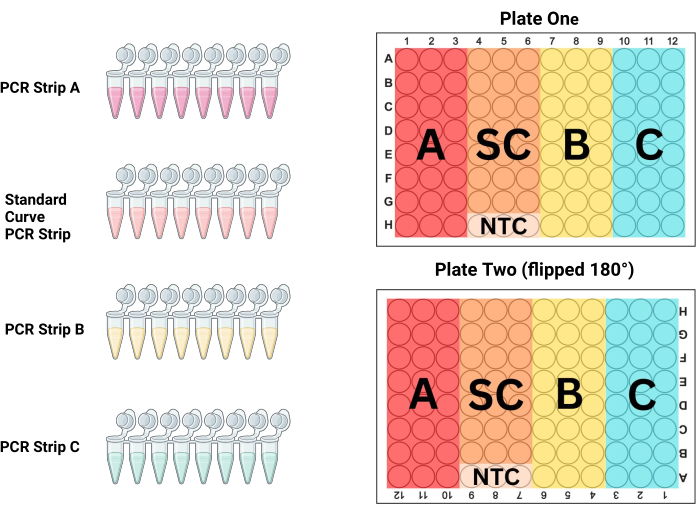
الشكل 3: تخطيط اللوحة. يجب استخدام شريط PCR A والشريط B والشريط C وشريط المنحنى القياسي (SC) لملء ثلاثة أعمدة على كل لوحة لإنتاج ثلاث نسخ مكررة من كل عينة وتخفيف قياسي. يوضح هذا الرسم البياني أي من الأعمدة يجب ملؤه بكل شريط. يتم قلب اللوحة الثانية 180 درجة (لاحظ أن رؤوس الأعمدة والصفوف مقلوبة) قبل التحميل ، ولكن يتم ملء اللوحة بشكل مماثل للوحة الأولى ، مما يلغي أخطاء السحب المحتملة مع الاستمرار في التحكم في تأثيرات الموضع عبر اللوحات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. MMqPCR بالحرارة
- أثناء دوران الألواح في الخطوة 4.8.1 ، قم بتشغيل الكمبيوتر وأجهزة التدوير الحراري. افتح برنامج thermocycler. يصف هذا البروتوكول استخدام برنامج CFX Maestro.
- قم بإنشاء بروتوكول التدوير الحراري TL وفقا لبروتوكول التدوير الحراري MMqPCR19 (الشكل 4).
- أضف خطوة حضانة لتنشيط بوليميراز الحمض النووي عند 95 درجة مئوية لمدة 15 دقيقة.
- لتجنب ربط التمهيدي ، قم بتشغيل دورتين من 94 درجة مئوية لمدة 15 ثانية ، 49 درجة مئوية لمدة 1 دقيقة ، ثم 3 دورات من 94 درجة مئوية لمدة 15 ثانية ، 59 درجة مئوية لمدة 15 ثانية.
- لتضخيم التيلومير ، أضف 27 دورة من 85 درجة مئوية لمدة 15 ثانية ، 74 درجة مئوية لمدة 30 ثانية ، ثم اكتساب الإشارة.
- لتضخيم الألبومين ، أضف 31 دورة من 94 درجة مئوية لمدة 15 ثانية ، 84 درجة مئوية لمدة 30 ثانية ، ثم اكتساب الإشارة.
- قم بتضمين منحنى ذوبان من 59 درجة مئوية إلى 95 درجة مئوية على فترات 5 ثوان لكل درجة متزايدة في بروتوكول الدورة الحرارية.
- انقر فوق بدء التشغيل لكلا الدراجين الحراريين. عند المطالبة، قم بتوفير عنوان لملفات التحليل.
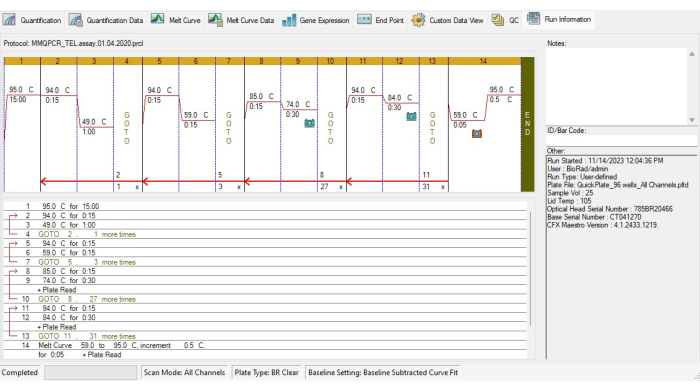
الشكل 4: ملف تعريف التدوير الحراري لمقايسة MMqPCR. بروتوكول MMqPCR الذي تم إنشاؤه في البرنامج وفقا لبروتوكول الدورة الحرارية الأصلي19. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. تحليل بيانات MMqPCR
- عند اكتمال الدورة الحرارية ، قم بتحليل البيانات بالطريقة التالية لإنتاج قيم TL للعينات التي تمت معالجتها.
- في البرنامج ، حدد ميزة إعداد اللوحة . في القائمة المنسدلة ، انقر فوق عرض / تحرير اللوحة.
- قم بتمييز جميع الآبار وانقر فوق تحديد Fluorophores ، ثم حدد المربع المسمى SYBR وقم بإلغاء تحديد جميع المربعات الأخرى. انقر فوق موافق.
- بينما لا تزال جميع الآبار مظللة ، بجانب كلمة تحميل ، حدد المربع بجوار SYBR. الآن يجب أن تحتوي جميع الآبار على SYBR مكتوب عليها.
- بعد ذلك ، قم بتمييز آبار NTC الثلاثة في الجزء العلوي أو السفلي من التخفيف التسلسلي للتحكم القياسي وحدد NTC من قائمة نوع العينة على اليمين. يجب أن تكون الآبار الثلاثة الآن صفراء وأن تسمى NTC. يوضح الشكل 5A الآبار التي يجب اختيارها ل P1 ويبين الشكل 5B الآبار التي يجب اختيارها ل P2.
ملاحظة: سيتم عكس P2 من P1 ، لذلك سيكون NTC في أسفل الأعمدة 4-6 ل P1 وأعلى الأعمدة 7-9 ل P2. - قم بتمييز 21 بئرا للتخفيف التسلسلي للتحكم القياسي وحدد قياسي من قائمة نوع العينة. يجب أن تكون هذه الآبار خضراء. بينما لا يزال يتم تمييز هذه الآبار ، انقر فوق النسخ المتماثل التقني. حدد 3 من قائمة حجم النسخ المتماثل، ثم حدد أفقي > تطبيق. يجب تسمية هذه الآبار في مجموعات من ثلاثة من Std-1 حتى Std-7.
- بينما لا يزال المعيار مميزا ، قم بالتمرير لأسفل ، وحدد سلسلة التخفيف. في حقل عامل التخفيف ، أدخل 2 ثم اكتب تركيز بدء التخفيف واتجاهه وفقا لرقم اللوحة كما هو موضح في الخطوات التالية.
- بالنسبة للوحة P1 ، أدخل 2.00E-03 في حقل تركيز البداية ، وحدد المربع الخاص ب تناقص ثم حدد تطبيق. يجب أن تحتوي القيم الموجودة في الآبار ال 21 على قيم تركيز مكتوبة في كل بئر تتراوح من 2.00E-03 إلى 3.13E-05 من أعلى إلى أسفل.
- بالنسبة للوحة P2 ، أدخل 3.13E-5 في حقل تركيز البداية ، وحدد مربع زيادة ثم حدد تطبيق. يجب أن تحتوي القيم الموجودة في الآبار ال 21 على قيم تركيز مكتوبة في كل بئر تتراوح من 3.13E-05 إلى 2.00E-03 من أعلى إلى أسفل.
- بالنسبة للعينات، قم بتمييز أعمدة شريط PCR A (1-3 ل P1 و P2)، وحدد غير معروف من قائمة نوع العينة، ثم حدد النسخ المتماثل الفني. حدد 3 من قائمة حجم النسخ المتماثل ، ثم حدد أفقي > تطبيق. يجب أن تكون آبار هذه الأعمدة زرقاء وأن يتم تصنيفها حسب الصف في مجموعات من 3 من Unk-1 إلى Unk-8.
- كرر الخطوة 6.3 للأعمدة لشريط PCR B (الأعمدة 7-9 ل P1 و 4-6 ل P2). يجب تسميتها Unk-9 من خلال Unk-16.
- كرر الخطوة 6.3 للأعمدة لشريط PCR C (الأعمدة 10-12 ل P1 و P2). يجب تسميتها Unk-17 إلى Unk-24. عند اكتمال الخطوات 6.2-6.3.2 ، يجب أن تشبه نوافذ إعداد اللوحة الشكل 5A ، B.
- حدد موافق في أسفل يمين نافذة محرر اللوحة. انقر فوق نعم لتطبيق التغييرات عند مطالبتك بذلك.
- بالنسبة لمراقبة الجودة على مستوى الفحص ، تأكد من أن المنحنيات في علامة تبويب القياس الكمي مناسبة (على سبيل المثال ، لا توجد منحنيات تضخيم مقلوبة) لكل من الخطوة 9 والخطوة 12 من ملف تعريف الدورة الحرارية ، والتي تتوافق مع مضخمات التيلومير والألبومين على التوالي. يتم الوصول إلى المنحنيات من خلال القائمة المنسدلة في الجانب الأيمن الأوسط من نافذة البرنامج. الشكل 6 أ ، ب يعرض المنحنيات المناسبة.
- تأكد من أن كفاءات تفاعل البوليميراز المتسلسل المبلغ عنها في كل من الخطوتين 9 و 12 تتراوح بين 90٪ و 110٪ وأن هاتين الكفاعتين لا تختلفان عن بعضهما البعض بأكثر من 10٪ (أي أن 92.4٪ للخطوة 9 و 98٪ للخطوة 12 مناسبة ولكن 92.4٪ للخطوة 9 و 108٪ للخطوة 12 غير مناسبة). بالإضافة إلى ذلك ، تأكد من أن منحنى R2 القياسي هو >0.995. في حالة فشل P1 أو P2 في تلبية هذه المعايير ، يجب إعادة تشغيل اللوحات.
- بالنسبة إلى P1 ، حدد الخطوة 9 وقم بتمييز 21 بئرا المقابلة للمنحنى القياسي كما هو موضح في الشكل 6A ، B. انسخ قيم Cq في الركن الأيمن السفلي من نافذة البرنامج. افتح قالب ورقة بيانات التيلومير المتاح كملف تكميلي 1 ، والصق هذه القيم في الورقة 1 القياسية ، العمود B. حدد الخطوة 12 ثم انسخ قيم Cq هذه. الصق هذه القيم في الورقة 1 القياسية ، العمود I.
- حدد قيمة الميل في الخطوة 9 واكتبها في الخلية C4 في الورقة 1 القياسية. حدد قيمة الميل في الخطوة 12 واكتبها في الخلية J4 في الورقة 1 القياسية.
ملاحظة: يحسب النظام النسبة المئوية لكفاءة البادئات باستخدام منحدرات المنحنى القياسي المحدد في الخطوة 6.6.1. يمكن حساب النسبة المئوية للكفاءة يدويا باستخدام الصيغة التالية: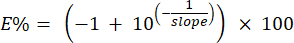
- تأكد من أن معامل الاختلاف (CV) لكل ثلاث نسخ تخفيف قياسية أقل من 0.1. إذا كانت أكبر من أو تساوي 0.1 ، استبعد ما يصل إلى ثلاثة آبار فردية إجمالا من جميع تركيزات عينات التحكم المدرجة في منحنى التخفيف التسلسلي القياسي المكون من 7 نقاط على اللوحة. يجب استبعاد بئر واحد فقط من أي مجموعة ثلاثية.
ملاحظة: سيؤدي استبعاد النقاط القياسية من التحليل على البرنامج إلى تغيير الميل المبلغ عنه و R وتقاطع y والكفاءة لكلا البادئين. وبالتالي ، بعد إزالة أي بئر قياسي من التحليل ، يجب تكرار الخطوات 6.5.1-6.6.1. - كرر الخطوات 6.6.1 إلى 6.6.2 لملف التحليل P2 والورقة القياسية 2 المقابلة.
- فقط عند اكتمال كل من الأوراق القياسية 1 و 2 مع السير الذاتية المقبولة ، قم بجمع بيانات عينة فردية من ملفات التحليل. تأكد من الإبلاغ عن تعديلات مراقبة الجودة في عمود الورقة P1 v P2 L ، على سبيل المثال ، عدد الآبار التي تم استبعادها في ملف تحليل P1.
- حدد قيمة الميل في الخطوة 9 واكتبها في الخلية C4 في الورقة 1 القياسية. حدد قيمة الميل في الخطوة 12 واكتبها في الخلية J4 في الورقة 1 القياسية.
- تأكد من تمييز آبار العينات البالغ عددها 72 بئرا فقط في ملف تحليل P1 باللون الأزرق في علامة التبويب "القياس الكمي" كما هو موضح في الشكل 7 أ، ب. اختار الخطوة 9. انسخ قيم Cq و SQ في الركن الأيمن السفلي من نافذة البرنامج. الصق هذه القيم في ورقة العينات P1، بدءا من الخلية D3. اختار الخطوة 12 ثم انسخ قيم Cq و SQ هذه ، والصقها في ورقة العينات P1 ، بدءا من الخلية F3.
- كرر هذه الخطوة للعينات الموجودة في ملف تحليل P2 والعينات المقابلة ورقة P2. يتم حساب نسب التيلومير إلى النسخة المفردة (T / S) (العمود H) تلقائيا ، ولكن يمكن حسابها يدويا باستخدام الصيغة التالية:
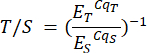
حيث ET / S هي كفاءة التضخيم الأسي للتفاعلات التي تستهدف التيلومير أو جين النسخة الواحدة على التوالي ، و CqT / S هي الدورة التي يصل فيها تكرار معين يستهدف المحتوى التيلوميري أو الجين أحادي النسخة إلى العتبة الحرجة للقياس الكمي الفلوري. يتم حساب متوسط نسب T / S (العمود I) عبر ستة قياسات لكل عينة.
ملاحظة: أرقام معرف العينة في CFX لا تتوافق مع نفس العينة البيولوجية عبر اللوحتين. يحسب قالب ورقة بيانات التيلومير هذا الاختلاف وسيقوم بمحاذاة النسخ الثلاثية المكررة المناسبة. - في CFX Maestro ، تحقق من أن قيم Cq لجميع العينات التحليلية تقع بين أدنى وأعلى قيمة Cq للمنحنى القياسي كما هو موضح في الشكل 7B. إذا كانت العينة خارج النطاق كما هو موضح في الشكل 7 أ ، فستحتاج إلى إعادة تشغيلها بعد ضبط التركيز. يجب تخفيف العينة ذات قيمة Cq أقل من أعلى معيار تركيز بعامل يقترب من عدد دورات التضخيم التي تكون خارج النطاق ، ويجب تركيز العينة ذات قيمة Cq أعلى من أدنى معيار تركيز بعامل تقريبي لعدد دورات التضخيم خارج العتبة.
ملاحظة: يؤدي التباين الواسع في تركيز العينات التحليلية إلى مستوى إضافي محتمل من التباين ويجب أن يتم ذلك بحذر. - تأكد من أن التركيز الأولي في NTC كان أقل من 5٪ من متوسط كمية الحمض النووي الموجودة في آبار العينة. يمكن التحقق من ذلك من خلال عرض النسبة المئوية لتلوث المياه على العينات P1 وعينات أوراق P2 من MMqPCR. إذا كان NTC يشير إلى تلوث ، فأعد تشغيل اللوحات.
ملاحظة: نظرا لحساسية مقايسة MMqPCR ، قد يتسبب التلوث الطفيف الذي لا يمكن السيطرة عليه أحيانا في تضخيم آبار NTC. ومع ذلك ، يجب أن يكون هذا التضخيم طفيفا ويحدث عدة دورات بعد تضخيم جين نسخة واحدة في الخطوة 12 من بروتوكول التدوير الحراري. - بالنسبة لمراقبة الجودة على مستوى العينة، راجع الانحرافات المعيارية (SD) (العمود J) والسير الذاتية (العمود K) في العينات P1 والعينات P2 صحائف. تأكد من أن السير الذاتية داخل اللوحة عبر نسب T / S ثلاثية العينة أقل من 0.10 (10٪). لتصحيح أي سير ذاتية داخل اللوحة أكبر من 0.1 ، قد يتم استبعاد نسبة T / S واحدة من مجموعة من ثلاث نسخ.
ملاحظة: يمكن استبعاد نسخة مكررة إجمالية واحدة فقط عبر القياسات الستة لكل عينة ، أي أنه لا يمكن استبعاد نسخة متماثلة لنفس العينة في كل من P1 و P2. - تأكد من أن عينة السير الذاتية الفردية في ورقة P1 v P2 ، العمود G ، أقل من 0.05 (5٪). لتصحيح أي سير ذاتية أكبر من 0.05 ، قم بإجراء استبعاد نسبة T / S واحدة من القياسات الستة لكل عينة عبر كلتا اللوحتين. استبعد العينات بعد الفحص البصري عبر ثلاث نسخ داخل اللوحة وجميع القياسات الستة حسب الضرورة.
ملاحظة: يمكن فقط تضمين العينات التي تجتاز معايير مراقبة الجودة هذه ، والسيرة الذاتية داخل اللوحة < 10٪ والسيرة الذاتية بين الألواح < 5٪ ، في نتائج TL النهائية. خلاف ذلك ، يجب استبعاد العينة من صحائف بيانات P1 v P2 و ICC لهذا التشغيل ، ويجب إعادة تقييم العينة على اختبار MMqPCR ثان. - بالنسبة لمراقبة الجودة على مستوى اللوحة، تحقق من أن متوسط التباين داخل اللوحة عبر جميع العينات على كل لوحة، الموجودة في الجزء السفلي من العينات P1 وعينات P2 الأوراق، أقل من 0.05 (5٪). للحصول على مراقبة الجودة الإضافية على مستوى اللوحة ، تحقق من أن الاختلاف الكلي بين الألواح في ورقة P1 v P2 ، الخلية G29 ، أقل من 0.06 (6٪). تأكد من إزالة العينات التي لم تجتاز مراقبة الجودة من حساب السيرة الذاتية بين الألواح في الخلية G30.
ملاحظة: عند العمل مع مجموعات العينات ذات الصلة (على سبيل المثال ، أفراد الأسرة ، والنقاط الزمنية المختلفة ، وما إلى ذلك) ، يجب تشغيل جميع العينات في المجموعة على نفس اللوحة. لذلك، إذا فشلت عينة واحدة من المجموعة في اجتياز معايير مراقبة الجودة، فيجب إعادة تشغيل كافة العينات في المجموعة. - في ملف بيانات مجموعة أو تجربة إجمالية منفصلة ، سجل بيانات TL النهائية لكل عينة اجتازت QC (P1 v P2 Sheet ، العمود I) ، وحسابات ICC لكل عينة اجتازت QC (ورقة بيانات ICC ، الأعمدة E-K) ، والمقايسة النهائية تشغيل بيانات مراقبة الجودة من P1 v P2 ورقة (الأعمدة J-L)
- كرر هذه الخطوة للعينات الموجودة في ملف تحليل P2 والعينات المقابلة ورقة P2. يتم حساب نسب التيلومير إلى النسخة المفردة (T / S) (العمود H) تلقائيا ، ولكن يمكن حسابها يدويا باستخدام الصيغة التالية:
- استخدم الملف التكميلي 2 الذي أنشأته شبكة أبحاث التيلومير (TRN) لحساب ICC للمشروع20.
- أخيرا ، لتحسين قابلية المقارنة بين دراسات TL ، قم بتحويل بيانات TL النهائية لكل عينة في ملف بيانات المجموعة أو التجربة الإجمالي المنفصل إلى درجات Z باستخدام المعادلة التالية حيث يتم طرح متوسط نسبة T / S لجميع العينات في المجموعة من نسبة T / S للعينة الفردية ثم قسمتها على SD عبر جميع العينات في المجموعة.
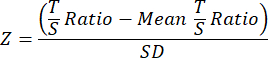
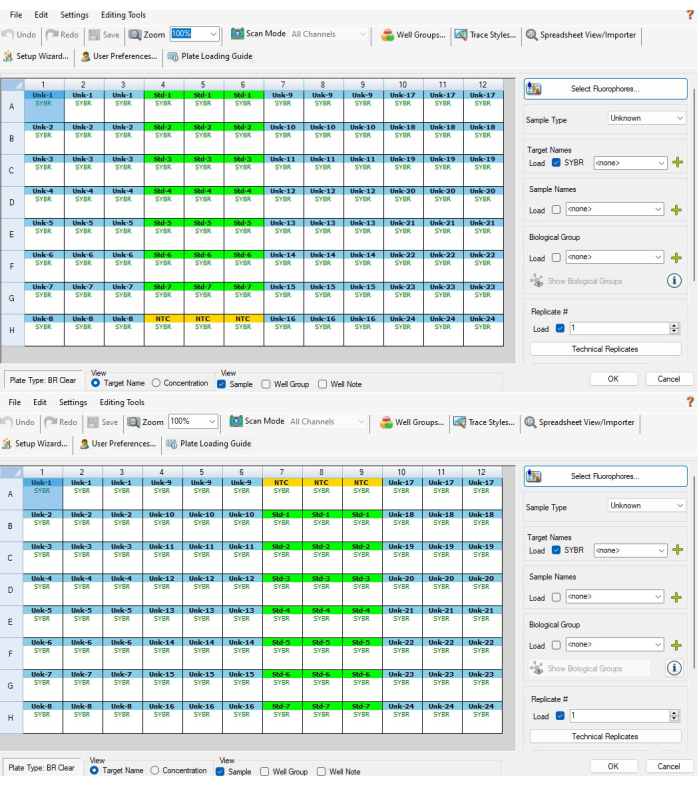
الشكل 5: إعداد اللوحة القائمة على البرامج. (أ) إعداد لوحة قائمة على البرامج للوحة P1 بعد إكمال الخطوات 6.2-6.4. (ب) إعداد لوحة قائمة على البرامج للوحة P2 بعد إكمال الخطوات 6.2-6.4. لا يتم محاذاة العينة والمعرفات القياسية بين لوحتي CFX بسبب الطريقة التي يعين بها البرنامج معرفات العينة بناء على موضع البئر (أي عينة CFX 1 على P1 هي عينة CFX 24 على P2). يراعي قالب Excel المقدم في الملف التكميلي 1 هذا ، مما يضمن محاذاة القياسات البينية التي تم إجراؤها على نفس العينة البيولوجية بشكل صحيح مع بعضها البعض يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
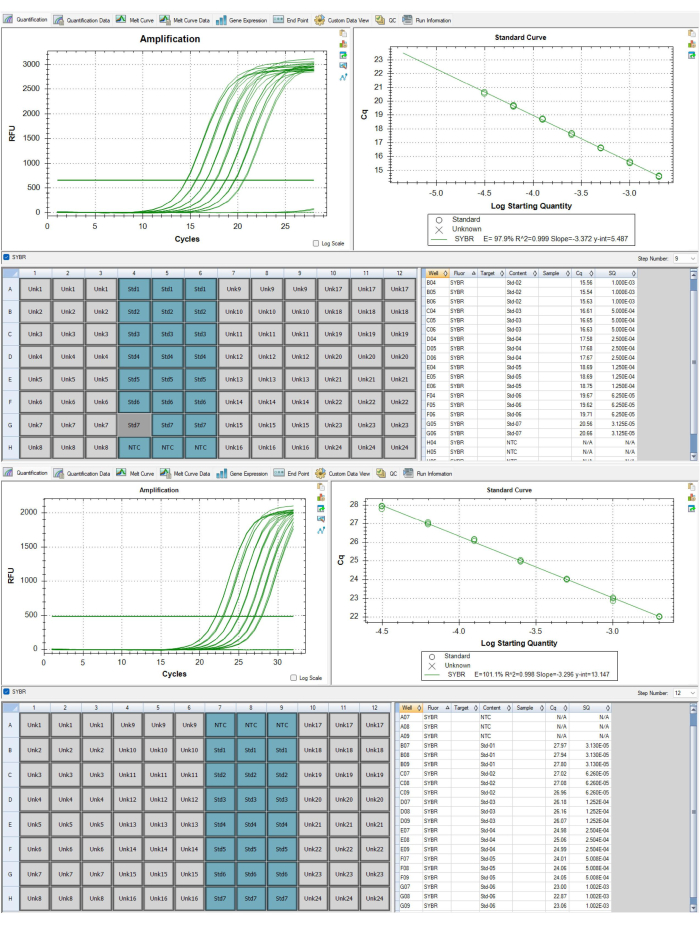
الشكل 6: المنحنيات القياسيةلمضخمات t elomere والألبومين. (أ) هذا المنحنى القياسي مأخوذ من أمبليكون التيلومير P1 لمجموعة بيانات النتائج التمثيلية. تمت إزالة معيار واحد لأنه فشل في تلبية معايير مراقبة الجودة. (ب) هذا المنحنى القياسي مأخوذ من أمبليكون الألبومين P2 لمجموعة بيانات النتائج التمثيلية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
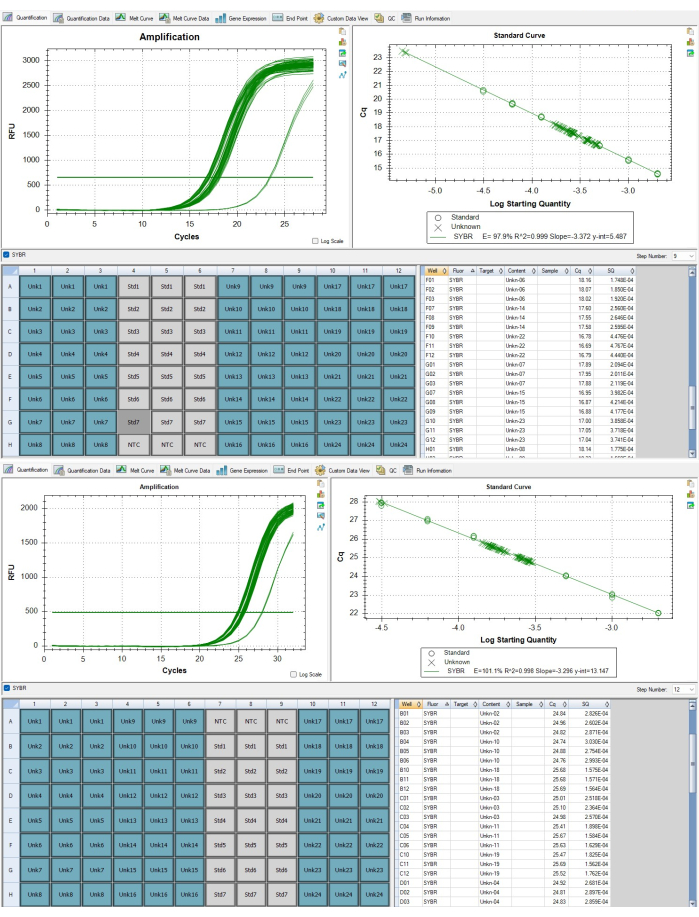
الشكل 7: مضخمات التيلومير ونسخة جينية واحدة. (أ) تضخيم التيلومير، (ب) تضخيم جين الألبومين للعينات المبلغ عنها في النتائج التمثيلية المعروضة في البرنامج. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
7. الإبلاغ عن بيانات MMqPCR
- عند الإبلاغ عن نتائج البحث باستخدام بيانات TL التي تم إنشاؤها من MMqPCR ، تأكد من الإبلاغ عن العناصر الموضحة في إرشادات الحد الأدنى للإبلاغ عن TRN. يمكن العثور على هذه الإرشادات على موقع TRN (https://trn.tulane.edu/resources/reporting-guidelines/) ويرد نموذج للإبلاغ عن هذه المعلومات في الملف التكميلي 3. استشهد بهذا البروتوكول وإرشادات وموارد TRN الأخرى عند الاقتضاء.
النتائج
تقدم النتائج المعروضة في الجدول 4 والجدول 5 مثالا على قياسات TL القابلة للتكرار بشكل كبير والتي تم الحصول عليها باتباع البروتوكول. لهذه النتائج ، تم استخراج الحمض النووي من 24 عينة من خلايا الدم أحادية النواة المحيطية (PBMC) باستخدام مجموعة تجارية وفقا لإرشادات الشركات المصنعة. تم تشغيل هذه العينات ال 24 عبر لوحين من 96 بئرا. تم فحص جميع عينات الحمض النووي للتأكد من جودتها عبر مقياس الطيف الضوئي ومقياس الفلور ، باستخدام متوسط نسبة 260/280 ، ومتوسط نسبة 260/230 ، وتركيز dsDNA لتحديد أهلية الفحص وعامل تخفيف العينة (الجدول 6). يسلط الجدول 6 الضوء أيضا على أهمية القياس الكمي لتركيز dsDNA ، والذي يمكن أن يختلف عن تركيز الحمض النووي المقاس باستخدام مقياس الطيف الضوئي. هذا التباين هو نتيجة لنهج مختلفة للقياس الكمي. على وجه التحديد ، يستمد مقياس الطيف الضوئي تركيز الحمض النووي على أساس الامتصاص عند 280 نانومتر وهو عرضة للتقلبات بسبب الملوثات (مثل البروتين والملح وما إلى ذلك) التي تؤثر على قراءات الامتصاص. على النقيض من ذلك ، يتم تحديد تركيزات dsDNA المقاسة باستخدام مقياس الفلور من خلال مضان صبغة ترتبط على وجه التحديد ب dsDNA ، وعلى هذا النحو ، يفترض أنها انعكاس أكثر دقة لمحتوى الحمض النووي. شهدت عينات الحمض النووي ما يصل إلى ثلاث دورات تجميد وذوبان قبل تحليل MMqPCR TL. تم إنشاء الحمض النووي الضابط من عمليات استخراج الحمض النووي المجمعة ل PBMCs من فرد واحد ، والذي تم استخدامه لإنشاء تخفيف تسلسلي من سبع نقاط من 2 نانوغرام / ميكرولتر إلى 0.0313 نانوغرام / ميكرولتر من الحمض النووي. يتم عرض المنحنيات القياسية المستقلة التي تم إنشاؤها ل PCR الخطوة 9 (تيلومير amplicon) والخطوة 12 (نسخة واحدة من الجين amplicon ، الألبومين في هذا البروتوكول) في الشكل 6أ ، ب. تم تشغيل المقايسات على نظام تجاري للكشف عن تفاعل البوليميراز المتسلسل في الوقت الفعلي والذي ولد منحنى ذوبان يوضح منتجات amplicon الفردية التي يتم إنتاجها في درجات حرارة مميزة كما هو موضح في الشكل 8.
الجدول 4: بيانات الإخراج من قياس MMqPCR للحصول على نتائج تمثيلية مثالية. متوسط نسب T / S و SDs و CVs و TL ذات درجة Z ل 24 عينة. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 5: إخراج بيانات طول التيلومير. يتم تحليل البيانات الأولية من مقايسة MMqPCR في البرنامج ثم إضافتها إلى قالب جدول البيانات المرفق كملف تكميلي 1 لمزيد من التحليل ومراقبة الجودة. تقدم ورقة إخراج قالب TL هذه ملخصا للبيانات ، وتعرض معرفات العينة ، ومتوسط TLs ، و SDs ، والسير الذاتية لكل عينة عبر كلتا اللوحتين. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 6: مقياس الطيف الضوئي ومقاييس جودة الحمض النووي للفلورومتر لنتائج العينة. بيانات مراقبة الجودة من تحليل مقياس الطيف الضوئي المكرر وقياس مقياس الفلور المفرد ل dsDNA وأي ملوثات لكل عينة. الرجاء الضغط هنا لتنزيل هذا الجدول.
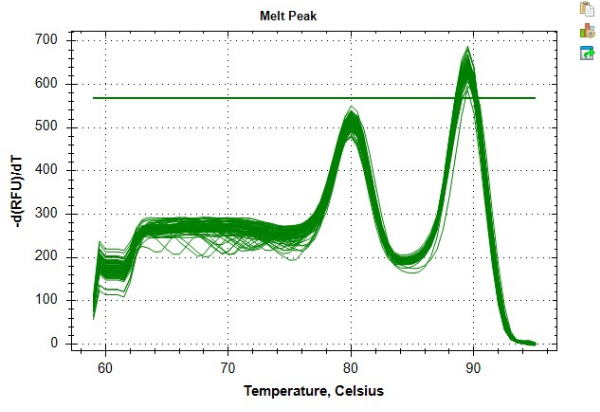
الشكل 8: مثال على منحنى الذوبان. منحنى الذوبان لعينة البيانات كما تم إنشاؤها في البرنامج. تمثل الذروة السابقة ~ 80 °C أمبليكون التيلومير والذروة الثانوية عند ~ 89 °C تمثل amplicon الألبومين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
بالنسبة لهذا المشروع ، كان متوسط كفاءة التيلومير 98.6٪ مع نطاق من 90.7 إلى 102.1 وكان متوسط كفاءة الألبومين 102.3٪ مع نطاق من 93.6 إلى 108.2 عبر جميع الأشواط. كان هناك متوسط 0.97 مكررة تمت إزالتها من المنحنيات القياسية ، والتي تفي بمعايير مراقبة الجودة لهذا البروتوكول. كان متوسط السيرة الذاتية بين الألواح 1.83٪ مع SD من 0.00616 وكان متوسط السيرة الذاتية داخل اللوحة 3.78٪ مع SD من 0.00658. ويرد متوسط مؤشرات التعلم لهذه العينات التمثيلية في الجدول 4 والجدول 5. كان متوسط TL 1.37 مع SD من 0.24 ونطاق من 0.84 إلى 2.32. يتم سرد نسبة T / S و SD و CV و TL ذات النقاط Z لكل عينة في الجدول 4. نظرا لأن ناتج نسبة T / S لمقايسة MMqPCR هو قياس نسبي ل TL ، فقد تم تحويل النسب إلى درجة Z هذه للسماح بإجراء مقارنة عبر الدراسة. تم حساب ICC لهذا المشروع باستخدام البرنامج النصي R كما هو موضح في إرشادات TRN الموجودة في الملف التكميلي 2 ، وهو ما يمثل تأثيرات الدفعات والتشغيل20. من أجل حساب ICC داخل المشروع ، قمنا بإعادة تشغيل 10٪ من العينات الناجحة ، مع التأكد من ملء لوحات ICC بعينة واحدة على الأقل من كل لوحة من المجموعة. يشير إجمالي ICC للمشروع البالغ 0.801 [CI: 0.703 ، 0.86] إلى قابلية عالية لاستنساخ نتائج TL.
لن تكون جميع النتائج مثالية. تظهر النتائج في الشكل 9 والجدول 7 نتائج دون المستوى الأمثل من مقايسة MMqPCR. يعرض الشكل 9 منحنى قياسي بكفاءة تيلومير أقل من 90٪ ، وهو أقل من معايير مراقبة الجودة ، مما يتطلب تكرار اللوحة بأكملها. عادة ما تكون مشاكل كفاءات البرايمر ناتجة عن مشكلة في الكواشف ، لذلك من المهم تتبع تواريخ تحديد الكواشف ومتى تنتهي صلاحيتها كخطوة أولى في تحديد الكاشف المسؤول عن انخفاض الكفاءة. يجب استبدال الكواشف منتهية الصلاحية قبل تشغيل اللوحة مرة أخرى. يعرض الجدول 7 لوحة اجتازت معايير مراقبة الجودة الأولية على مستوى العينة ولكن لديها مستوى عال من التباين بين اللوحات ، مما يؤدي إلى فشل مراقبة الجودة على مستوى اللوحة. عادة ما يكون الاختلاف بين الألواح بسبب أخطاء في تقنيات سحب العينات وملء الألواح. في هذه الحالة ، يجب على الفني تقييم أي مشكلات حدثت أثناء إعداد اللوحة والتأكد من معايرة الماصات.
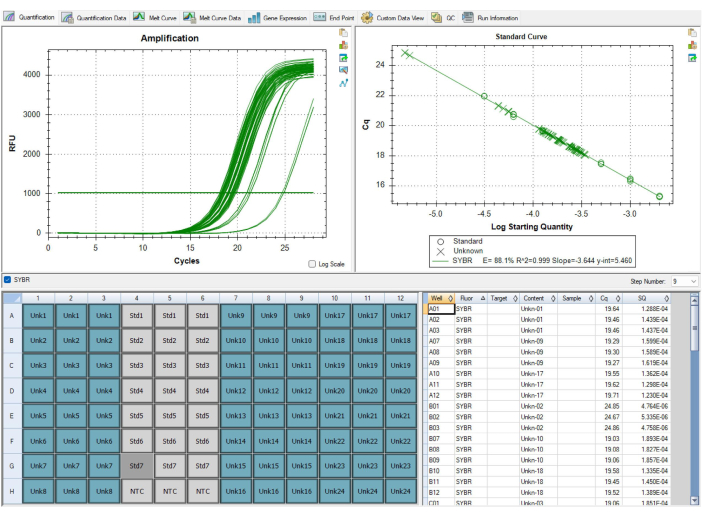
الشكل 9: نتائج دون المستوى الأمثل. فشل هذا المنحنى القياسي المعروض في البرنامج في اجتياز مراقبة الجودة ، نظرا لأن كفاءة التضخيم لبرايمر التيلومير كانت أقل من 90٪. الصورة مأخوذة من P1 ، لكن P2 كان لديه كفاءات منخفضة بالمثل. تعذر استخدام البيانات من هذا التشغيل وكان من الضروري تشغيل جميع العينات مرة أخرى بعد استبدال الكاشف السببي الذي انتهت صلاحيته. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 7: النتائج دون المستوى الأمثل. يعرض الجدول قالب بيانات التيلومير لتشغيل حيث فشلت العديد من العينات في تلبية معايير مراقبة الجودة. تم تحديد العينات التي تحتاج إلى إعادة تشغيل بناء على قيم السيرة الذاتية ثم تم تغيير اسم العينة إلى خط أحمر لسهولة التعرف عليها. الرجاء الضغط هنا لتنزيل هذا الجدول.
الملف التكميلي 1: قالب جدول بيانات بيانات التيلومير. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 2: حساب غرفة التجارة الدولية. تم إنشاء هذا البروتوكول بواسطة شبكة أبحاث التيلومير (TRN). تم تعديل هذا الملف من20. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 3: المبادئ التوجيهية للإبلاغ عن TRN. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
كانت الطريقة الأكثر استخداما لقياس TL في الدراسات السكانية الأكبر ، قبل عام 2002 ، هي تحليل اللطخة الجنوبية لأطوال شظايا التقييد النهائي (TRF) 24,25. TRF ، على الرغم من توفير دقة ممتازة وقابلية للتكرار في المختبرات المتخصصة ، إلا أنه محدود في التطبيق بسبب كمية ونوعية الحمض النووي المطلوب والإنتاجية المحدودة ، مما يوفر خلفية لزيادة استخدام مقايسات TL القائمة على qPCR ، وبالتالي مقايسة MMqPCR. توفر طريقة MMqPCR TL قياس TL قابل للتكرار عند الإعداد والتحسين والصيانة مع الاهتمام الدقيق بكل معيار من معايير مراقبة الجودة. مطلوب حساب والإبلاغ عن ICC المحدد لكل مجموعة تم تحليلها لضمان موثوقية الفحص. على الرغم من خضوعها لجودة الحمض النووي والخبرة الفنية ، فإن طريقة MMqPCR مناسبة تماما للدراسات السكانية الكبيرة التي تبحث في TL لأنها تتطلب كميات صغيرة من الحمض النووي ، وهي أكثر موثوقية من تفاعل البوليميراز المتسلسل الفردي ، وهي أكثر كفاءة في تكاليف الكاشف ووقت الفني من الطرق الأخرى. توفر القدرة على توليد ICCs عالية بيانات إضافية لدعم استخدام MMqPCR للدراسات السكانية الكبيرة ل TL. يمكن تطبيق قياس MMqPCR TL على مجموعة واسعة من الدراسات التي تسعى إلى تحديد دور TL كمؤشر حيوي لجميع الأسباب للوفيات ، والشيخوخة ، والإجهاد مدى الحياة ، والتعرض البيئي ، ونتائج الصحة البدنية مثل أمراض القلب والأوعية الدموية والسرطان4،7،8،10،11،12،13،26،27،28 ، 29,30,31.
أحد قيود طريقة MMqPCR هو أنها تبلغ عن TL كنسبة T / S ، وهو تقدير نسبي للطول يختلف اعتمادا على اختيار الجين أحادي النسخة ، وتكوين المزيج الرئيسي ، ومعلمات دورة PCR32. نسبة T / S بدون وحدات. وبالتالي ، بدون الجمع مع منهجيات قياس TL الأخرى ، فإن هذه الطريقة غير قادرة على الإبلاغ عن التقديرات في قيم الزوج الأساسي18،33،34. نتيجة لذلك ، يجب تحويل نسبة T / S إلى درجة Z لتكون ذات صلة عبر الدراسات35. يجب توخي الحذر الشديد عند القيام بذلك عبر المختبرات والأساليب والمقايسات. علاوة على ذلك ، يمكن أن تشمل هذه الطريقة ، كما هو الحال مع مقايسات التهجين القائمة على الهلام ، القياس الكمي للتيلوميرات الخلالية. ومع ذلك ، فإن هذه التسلسلات تشكل نسبة صغيرة جدا من إجمالي محتوى الحمض النووي للتيلومير لكل جينوم. بالإضافة إلى ذلك ، من المرجح أن تحتوي التسلسلات التيلوميرية الخلالية على تسلسلات أزواج أساسية غير متطابقة تنحرف عن تكرار التيلومير الكنسي ، مما يقلل من احتمالية ارتباط التمهيدي وتضخيمه. بالإضافة إلى ذلك ، في حين أن الحد الأدنى من الحمض النووي اللازم لمقايسة MMqPCR مفيد ، فمن المهم ملاحظة أن القياسات القائمة على qPCR ل TL تتأثر بالعوامل التحليلية المسبقة التي تؤثر على جودة الحمض النووي وسلامته ، بما في ذلك ظروف تخزين العينات ومنهجية استخراج الحمض النووي والأنسجة البيولوجية 36,37. لقد ثبت أن التحكم التحليلي لهذه العوامل يمكن أن يعزز الصلاحية الخارجية لقياسات TL الناتجة باستخدام qPCR38. ومع ذلك ، فإن تأثير الاختلافات في جودة الحمض النووي على TL الناتج عن مقايسة MMqPCR يحتاج على وجه التحديد إلى تقييم منهجي ، حيث لا توجد إرشادات حالية مستنيرة بالبيانات لتحديد ما إذا كانت العينة ذات جودة كافية لتوليد تقدير دقيق ل TL باستخدام هذا النهج. على الرغم من هذه القيود ، فإن تطبيقات هذا الاختبار للدراسات حول النتائج الصحية على مستوى السكان كبيرة.
عند استخدام مقايسة MMqPCR ، هناك حاجة إلى تقييم مستمر للدقة والإنتاجية. كما هو مصمم حاليا ، يقوم الفنيون بتشغيل ثلاث نسخ من العينات في وقت واحد على لوحات مكررة باستخدام اثنين من الدراجات الحرارية. في حالة عدم وجود العديد من أجهزة التدوير الحراري ، نوصي بالاحتفاظ بقياسات ثلاثية النسخ المكررة وتشغيل الألواح بالتتابع لتحسين الدقة حتى على حساب الإنتاجية المتناقصة. وينبغي أن يكون أي قرار بإعطاء الأولوية للإنتاجية على الدقة، مثلا باستخدام قياسات ثلاثية المفردة، مصحوبا باختبار وتقييم شاملين للقياسات الميدانية الوطنية الناتجة قبل الشروع في تحليل العينات التحليلية. عند اتخاذ القرارات المتعلقة بالإنتاجية والدقة ، يجب على المرء أن يأخذ في الاعتبار حجم العينة وجودة عينة الحمض النووي. يتطلب حجم العينة الأصغر أو عينات الحمض النووي ذات الجودة الرديئة إعطاء الأولوية لدقة أعلى23. هذا له أهمية أكبر عند العمل مع عينات من المجموعات ذات الصلة (على سبيل المثال ، أفراد الأسرة ، الموضوعات ذات النقاط الزمنية المتعددة). في هذه الحالات ، يعد التخطيط الدقيق ، على سبيل المثال تعيين عينات ذات صلة لنفس اللوحة قبل بدء التجربة ، إحدى الطرق لمنع فقدان القوة الإحصائية من خلال المجموعة غير المقصودة من خلال إرباك اللوحة.
لهذا الفحص ، تم استخدام مقياس الطيف الضوئي لتقييم جودة عينة الحمض النووي: العينات في نطاق 1.6-2.0 لنسب 260/280 و 2.0-2.2 لنسب 260/230 اعتبرت مقبولة. يعد تقييم الجودة هذا والتقييم الدقيق للحمض النووي المزدوج الذي تقطعت به السبل عبر مقياس الفلور خطوات حاسمة في هذا البروتوكول للحصول على بيانات TL القابلة للتكرار. يمكن أيضا استخدام مقاييس أخرى أكثر وصفية لسلامة الحمض النووي ، مثل حجم الشظية و / أو المقاييس الموجزة لجودة الحمض النووي المحددة بواسطة هلام الأغاروز (على سبيل المثال ، رقم سلامة الحمض النووي) في تحديد جودة العينة38. نوصي أيضا بأن يحدث تخفيف العينات فقط في وقت تحضير العينة لتشغيل مقايسة MMqPCR. هذا يضمن أن تخضع حصص الحمض النووي لأقل قدر ممكن من التلاعب بعد الاستخراج ، مما يقلل من التباين في معالجة ما قبل الفحص. إذا كانت هناك حاجة لنقل عينات الحمض النووي ، فيجب شحنها على ثلج جاف بأعلى تركيز ممكن للتخفيف من التدهور الذي يحدث في عينات الحمض النووي بتركيزات أقل39,40. بسبب تدهور الحمض النووي الذي يحدث مع دورات التجميد والذوبان ، يجب تقليل عدد ذوبان الجليد لتخزين الحمض النووي41. يجب إنشاء حصص الحمض النووي للتحكم المجمع قبل تشغيل المجموعة ويجب إنشاء حصص عينات الحمض النووي التحليلية الفردية قبل تشغيل الفحص.
تشمل المقاييس الرئيسية لأداء الفحص ومراقبة الجودة إشارة NTC ، والسير الذاتية بين الألواح وداخل اللوحة ، والمنحنى القياسي R2. يمكن التخفيف من الفشل في تلبية معايير مراقبة الجودة بعدة طرق. سيؤدي تغيير مخزون PCR من الدرجةH 2O بانتظام واقتباس المخزونات الفرعية PCR من الدرجةH 2O لكل زوج من الألواح إلى تقليل مصادر التلوث بالإضافة إلى تضخيم NTC. وتشمل الخطوات الإضافية لتخفيف التلوث ما يلي: تعيين غطاء PCR محدد مخصص لمقايسة MMqPCR فقط؛ مسح غطاء PCR والمعدات بمحلول تطهير الحمض النووي ؛ تشعيع الغرفة بالأشعة فوق البنفسجية ؛ وممارسة تقنية التعقيم عندما تكون في غطاء PCR. لتعزيز تكرار الفحص وتقليل السير الذاتية ، يوصى بعينات الدوامة والتخفيفات وشرائط تفاعل البوليميراز المتسلسل بقوة عند خطوات الدوامة الخاصة بها وإعادة تعليقها جيدا عند سحب عينات الحمض النووي. من المرجح أن يعزى منحنى R2 القياسي تحت العتبة (<0.995) إلى أخطاء السحب أثناء تحميل اللوحة. لتجنب ذلك ، انتبه جيدا إلى السحب الدقيق ومعايرة الماصات سنويا ، وامزج شرائط PCR القياسية بقوة قبل التحميل ، وقم بتنظيم الإمدادات بعناية لتعزيز سير العمل الفعال. إذا لوحظ استخدام جهازين ولوحة واحدة لإنتاج سير ذاتية أعلى باستمرار ، فيجب صيانة الجهاز كطريقة محتملة لتحسين المشكلة. يجب تشغيل لوحات مراقبة الجودة من الشركة المصنعة على الألواح بانتظام لتقييم أداء جهاز التدوير الحراري.
إذا استمرت المشكلات حتى بعد تطبيق الخطوات الموصى بها أعلاه ، فيمكن استخدام الخطوات التالية لاستكشاف أخطاء البروتوكول وإصلاحها. يمكن أن يساعد الاحتفاظ بسجل لوقت تحديد جميع الكواشف وأي تواريخ انتهاء صلاحية ذات صلة في تبسيط عملية استكشاف الأخطاء وإصلاحها عندما تنشأ صعوبات لا محالة. جزء مهم من أي عملية استكشاف الأخطاء وإصلاحها هو ضبط كاشف واحد فقط في كل مرة لتحديد السبب المحدد لعدم اجتياز اللوحات لمعايير مراقبة الجودة ، بدءا من الكاشف الأقل تكلفة المعني. على سبيل المثال ، إذا كان لكل من التيلومير وجين النسخة الواحدة كفاءة منخفضة ، فمن المرجح أن تكون الكواشف المشتركة مثل DTT أو dNTPs أو SYBR Aliquot هي السبب أكثر من البرايمرات الخاصة بالأمبليكون. بالسعر المدرج ، يجب اختبار القسامات الجديدة بترتيب DTT ، ثم dNTPs ، ثم أخيرا ، إذا استمرت المشكلة ، فإن حصص SYBR الجديدة. على العكس من ذلك ، إذا كان واحد فقط من amplicons (التيلومير أو جين نسخة واحدة) لديه كفاءة منخفضة ، فإن سبب الصعوبة هو على الأرجح أحد الاشعال. يمكن أن يكون تفسير قمم منحنى الذوبان المعروضة في الشكل 8 بمثابة مصدر للمعلومات الأساسية لاستكشاف الأخطاء وإصلاحها. يمكن استخدام تصور قمتي منحنى الذوبان لتحديد المشكلات المحتملة مع عينة معينة ، حيث ستبرز عينة مشكلة فردية من الاتجاه العام للقمم التي تعرضها المعايير أو العينات التحليلية المتبقية. يمكن أيضا استخدام منحنى الذوبان لتشخيص مشاكل برايمر معين إذا كانت قمم أمبليكون معين أقل حدة بشكل منهجي من الآخر.
توضح هذه المخطوطة كيفية إعداد اختبار MMqPCR بنجاح لقياس TL مع إمكانية تطبيق واسعة على أبحاث الصحة العامة وتقدم توصيات رئيسية لمراقبة الجودة واستكشاف الأخطاء وإصلاحها بهدف زيادة إمكانية الوصول والموثوقية لهذه الطريقة الفعالة والفعالة من حيث التكلفة.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
يود المؤلفون أن يشكروا اللجنة الاستشارية لشبكة أبحاث التيلومير والمعهد الوطني للشيخوخة / المعهد الوطني لعلوم الصحة البيئية (U24 AG066528 و U24 AG066528-S1) التي جعلت هذا العمل ممكنا.
Materials
| Name | Company | Catalog Number | Comments |
| 0.5mL Tubes | USA Scientific | 1605-0099 | Seal-Rite 0.5mL Microcentrifuge Tubes, Sterile Storage Temperature and Conditions: Room temperature |
| 1.5mL Tubes | USA Scientific | 1615-5599 | Seal-Rite 1.5mL Microcentrifuge Tubes, Sterile Storage Temperature and Conditions: Room temperature |
| 100mM DTT | In House | Not Applicable | Made with stock DTT, diluted sodium acetate, and PCR Grade H2O Storage Temperature and Conditions: minus 20 °C |
| 15mL Tubes | Thermo Fisher | 14-959-53A | Corning 352196 Falcon 15mL Conical Centrifuge Tubes Storage Temperature and Conditions: Room temperature |
| 1M MgCl2 | Thermo Fisher | 50152107 | Biotang Inc 1M MgCl2 1M Magnesium Chloride Solution, Prepared in 18.2 Megohms Water and Filtered through 0.22 Micron Filter Storage Temperature and Conditions: 4 °C |
| 1x Gold Buffer | In House | Not Applicable | 10X Gold Buffer diluted with PCR Grade H2O Storage Temperature and Conditions: minus 20 °C |
| 25mM dNTPs | New England BioLabs | N0446S | Deoxynucleotide Solution Set Storage Temperature and Conditions: minus 20 °C |
| 5mL Tubes | Thermo Fisher | 3391276 | Argos Technologies Microcentrifuge Tubes – 5mL Storage Temperature and Conditions: Room temperature |
| 96 Well Plate | Bio-Rad | HSP9601 | Hard-Shell 96-Well PCR Plates, Low Profile, Thin Wall, Skirted, White / Clear Storage Temperature and Conditions: Room temperature |
| Aluminum Foil | Office Depot | 3489072 | Reynolds Wrap Stanard Aluminum Foil Roll, 12" x 75', Silver Storage Temperature and Conditions: Room temperature |
| AmpliTaq Gold Kit – Polymerase and Buffer | Thermo Fisher | 4311806 | AmpliTaq Gold DNA Polymerase with Gold Buffer and MgCl2 (MgCl2 in this kit is not used), 10X Gold Buffer, 2.5U AmpliTaq Gold Polymerase Storage Temperature and Conditions: minus 20 °C |
| Betaine | Thermo Fisher | AAJ77507AB | Betaine, 5M Solution, Molecular Biology Grade, Ultrapure, 10mL Storage Temperature and Conditions: minus 20 °C |
| Big Tube Rack | Thermo Fisher | 344817 | Fisherbrand 4-Way Tube Rack Storage Temperature and Conditions: Room temperature |
| CFX Maestro Software | Bio-Rad | 12004110 | Software for real-time PCR plate setup, data collection, statistics, and graphiing of results Storage Temperature and Conditions: Room temperature |
| CFX96 Optical Reaction Module for Real-Time PCR Systems with Starter Package | Bio-Rad | 1845096 | 96-well optical module for real-time PCR Storage Temperature and Conditions: Room temperature |
| DTT | Fisher Scientific | AAJ1539706 | Dithiothreitol, >99.5+ Molecular Biology Grade, 5 g Storage Temperature and Conditions: minus 20 °C |
| ELIMINase | Fisher Scientific | 04-355-32 | ELIMINase Laboratory Decontaminant Storage Temperature and Conditions: Room temperature |
| HEPA Filter | USA Scientific | Replacement Filters | High-Efficiency Particulate Air Filter for AirClean Workstations Storage Temperature and Conditions: Room temperature |
| Kimwipes | Thermo Fisher | 06666A | Kimberly-Clark Professional Kimtech Science Kimwipes Delicate Task Wipers, 1-Ply Storage Temperature and Conditions: Room temperature |
| Loading Trough | Thermo Fisher | 14387069 | Thermo Scientific Matrix Reagent Reservoirs Storage Temperature and Conditions: Room temperature |
| Microsoft Excel | Microsoft | Not Applicable | Microsoft 365 package, Excel software application Storage Temperature and Conditions: Room temperature |
| Mini Centrifuge | Genesee Scientific | 31-500B | Poseidon 31-500B Mini Centrifuge, Blue Lid Storage Temperature and Conditions: Room temperature |
| PCR Grade H2O | Thermo Fisher | AM9937 | Nuclease-Free Water (not DEPC-Treated) Storage Temperature and Conditions: Room temperature |
| PCR Hood | USA Scientific | 4263-2588 | Nucleic Acid Workstation with HEPA Filtration, AirClean Systems Combination PCR Workstation Storage Temperature and Conditions: Room temperature |
| PCR Strips | Thermo Fisher | AB0776 | Low Profile Tubes and Flat Caps, Strips of 8 Storage Temperature and Conditions: Room temperature |
| PCR Tube Rack | Thermo Fisher | 344820 | Fisherbrand 96-Well PCR Tube Rack Storage Temperature and Conditions: Room temperature |
| Pipette Tips (Multichannel) | Ranin | 17005860 | Pipette Tips SR LTS 20µL F 960A/5, 20µL Maximum Storage Temperature and Conditions: Room temperature |
| Pipette Tips (Single Channel) | USA Scientific | 1181-3850 | 10µL Graduated TipOne RPT Filter Tips Storage Temperature and Conditions: Room temperature |
| Pipette Tips (Single Channel) | USA Scientific | 1180-1850 | 20µL Beveled TipOne RPT Filter Tips Storage Temperature and Conditions: Room temperature |
| Pipette Tips (Single Channel) | USA Scientific | 1111-0880 | 200µL Natural TipOne Pipette Tips in Racks Storage Temperature and Conditions: Room temperature |
| Pipette Tips (Single Channel) | USA Scientific | 1111-2890 | 1000µL Natural Graduated TipOne Pipette Tips in Racks Storage Temperature and Conditions: Room temperature |
| Pipettors (Multichannel) | Ranin | 17013802 | Pipet-Lite Multi Pipette L8-10XLS, 0.5 to 10µL Storage Temperature and Conditions: Room temperature |
| Pipettors (Multichannel) | Ranin | 17013803 | Pipet-Lite Multi Pipette L8-20LS+, 2 to 20µL Storage Temperature and Conditions: Room temperature |
| Pipettors (Single Channel) | Thermo Fisher | F144802G | Gilson Pipetman Classic Pipets, 1 to 10µL Storage Temperature and Conditions: Room temperature |
| Pipettors (Single Channel) | Thermo Fisher | F123600 | Gilson Pipetman Classic Pipets, 2 to 20µL Storage Temperature and Conditions: Room temperature |
| Pipettors (Single Channel) | Thermo Fisher | F123601 | Gilson Pipetman Classic Pipets, 20 to 200µL Storage Temperature and Conditions: Room temperature |
| Pipettors (Single Channel) | Thermo Fisher | F123602 | Gilson Pipetman Classic Pipets, 200 to 1000µL Storage Temperature and Conditions: Room temperature |
| Plate Sealing Film | Bio-Rad | MSB1001 | Microseal “B” PCR Plate Sealing Film, Adhesive, Optical Storage Temperature and Conditions: Room temperature |
| Plate Spinner | Thermo Fisher | 14-100-141 | Fisherbrand Mini Plate Spinner Centrifuge, 230 V Storage Temperature and Conditions: Room temperature |
| Pre-Hood Filter | USA Scientific | 4235-3724 | Prefilter for AirClean Systems Workstations Storage Temperature and Conditions: Room temperature |
| R Software | The R Project for Statistical Computing | Not Applicable | R version 4.2.2 Storage Temperature and Conditions: Room temperature |
| Scale | Thermo Fisher | 01-922-329 | OHAUS 30430060 PR Series Analytical Balance, 62g Capacity Storage Temperature and Conditions: Room temperature |
| Scissors | Office Depot | 458612 | Office Depot Brand Scissors, 8”, Straight, Black, Pack of 2 Storage Temperature and Conditions: Room temperature |
| Sharpies | Sharpie | 2151734 | Brush Twin Permanent Markers, Black Storage Temperature and Conditions: Room temperature |
| Single Copy Gene Forward Primer | Integrated DNA Technologies | Custom | See separate table Storage Temperature and Conditions: minus 20 °C when rehydrated |
| Single Copy Gene Reverse Primer | Integrated DNA Technologies | Custom | See separate table Storage Temperature and Conditions: minus 20 °C when rehydrated |
| Small Tube Rack | Thermo Fisher | 21-402-17 | Thermo Fisher 8601 Reversible Microtube Racks with Lid Storage Temperature and Conditions: Room temperature |
| Sodium Acetate | Thermo Fisher | J63560.EQE | 3M NaOAc pH 5.2 Storage Temperature and Conditions: Room temperature |
| Stainless Steel Spatula | Thermo Fisher | 3990240 | Bel-Art SP Scienceware Stainless-Steel Sampling Spoon and Spatula Storage Temperature and Conditions: Room temperature |
| SYBR Green | Thermo Fisher | S7563 | SYBR Green I Nucleic Acid Gel Stain – 10,000X Concentrate in DMSO Storage Temperature and Conditions: minus 20 °C when rehydrated |
| Syringe Filters | Fisher Scientific | 09-927-55A | GD/X 25 mm Sterile Syringe Filter, cellulose acetate filtration medium, 0.2 μm Storage Temperature and Conditions: Room temperature |
| Syringes | Thermo Fisher | 148232A | BD Luer-Lok Disposable Syringes without Needles, 10mL Storage Temperature and Conditions: Room temperature |
| TE Buffer | Fisher Scientific | BP2474100 | TE Buffer, Tris-EDTA, 1X Solution, pH 7.6, Molecular Biology, Fisher BioReagents Storage Temperature and Conditions: Room temperature |
| Telomere Forward Primer | Integrated DNA Technologies | Custom | See separate table Storage Temperature and Conditions: minus 20 °C when rehydrated |
| Telomere Reverse Primer | Integrated DNA Technologies | Custom | See separate table Storage Temperature and Conditions: minus 20 °C when rehydrated |
| UV Light | USA Scientific | 4288-2540 | UV Light Bulb for Workstations Storage Temperature and Conditions: Room temperature |
| Vortex | Thermo Fisher | 14-955-151 | Fisherbrand Mini Vortex Mixer, 115 V, 50/60 Hz Storage Temperature and Conditions: Room temperature |
| Weigh Boat | Thermo Fisher | 01-549-752 | Fisherbrand Sterile Hexagonal Weighing Boat, 10mL Storage Temperature and Conditions: Room temperature |
References
- Hemann, M., Strong, M., Hao, L., Greider, C. The shortest telomere, not average telomere length, is critical for cell viability and chromosome stability. Cell. 107 (1), 67-77 (2001).
- Xu, L., Li, S., Stohr, B. A. The role of telomere biology in cancer. Ann Rev Pathol: Mech Dis. 8, 49-78 (2013).
- Lindrose, A., Drury, S. Minimum reporting recommendations for pcr-based telomere length measurement. Telomere Research Network. , (2020).
- Verhulst, S., et al. Commentary: The reliability of telomere length measurements. Int J Epidemiol. 44 (5), 1683-1686 (2015).
- Aubert, G., Hills, M., Lansdorp, P. M. Telomere length measurement-caveats and a critical assessment of the available technologies and tools. Mutat Res. 730 (1-2), 59-67 (2012).
- Mundstock, E., et al. Effect of obesity on telomere length: Systematic review and meta-analysis. Obesity. 23 (11), 2165-2174 (2015).
- Haycock, P. C., et al. Leucocyte telomere length and risk of cardiovascular disease: Systematic review and meta-analysis. BMJ. 349, 4227(2014).
- Astuti, Y., Wardhana, A., Watkins, J., Wulaningsih, W. Cigarette smoking and telomere length: A systematic review of 84 studies and meta-analysis. Environ Res. 158, 480-489 (2017).
- Ridout, K. K., Ridout, S. J., Price, L. H., Sen, S., Tyrka, A. R. Depression and telomere length: A meta-analysis. J Affect Disord. 191, 237-247 (2016).
- Wang, Q., Zhan, Y., Pedersen, N. L., Fang, F., Hägg, S. Telomere length and all-cause mortality: A meta-analysis. Ageing Res Rev. 48, 11-20 (2018).
- Hu, R., Hua, X. G., Jiang, Q. C. Associations of telomere length in risk and recurrence of prostate cancer: A meta-analysis. Andrologia. 51 (7), e13304(2019).
- Schneider, C. V., et al. Association of telomere length with risk of disease and mortality. JAMA Inter Med. 182 (3), 291-300 (2022).
- Deng, Y., et al. Telomere length and the risk of cardiovascular diseases: A mendelian randomization study. Front Cardiovasc Med. 9, 1012615(2022).
- D'mello, M. J., et al. Association between shortened leukocyte telomere length and cardiometabolic outcomes: Systematic review and meta-analysis. Circulation: Cardiovasc Gene. 8 (1), 82-90 (2015).
- Wilbourn, R. V., et al. The relationship between telomere length and mortality risk in non-model vertebrate systems: A meta-analysis. Philos Trans R Soc Lond B Biol Sci. 373 (1741), 20160447(2018).
- Gardner, M., et al. Gender and telomere length: Systematic review and meta-analysis. Exp Gerontol. 51, 15-27 (2014).
- Lai, T. -P., Wright, W. E., Shay, J. W. Comparison of telomere length measurement methods. Philos Trans R Soc Lond B Biol Sci. 373 (1741), 20160451(2018).
- Cawthon, R. Telomere measurement by quatitative pcr. Nuc Acid Res. 30 (10), e47-e53 (2002).
- Cawthon, R. M. Telomere length measurement by a novel monochrome multiplex quantitative pcr method. Nuc Acid Res. 37 (3), e21-e21 (2009).
- Lindrose, A. R., et al. Method comparison studies of telomere length measurement using qpcr approaches: A critical appraisal of the literature. PLoS One. 16 (1), e0245582(2021).
- Lin, J., et al. Effects of DNA extraction, DNA integrity, and laboratory on the precision of qpcr-based telomere length measurement - a multi-lab impartial study. bioRxiv. , (2022).
- Wilfinger, W. W., Mackey, K., Chomczynski, P. Effect of ph and ionic strength on the spectrophotometric assessment of nucleic acid purity. Biotechniques. 22 (3), 474-481 (1997).
- Boesenberg-Smith, K. A., Pessarakli, M. M., Wolk, D. M. Assessment of DNA yield and purity: An overlooked detail of pcr troubleshooting. Clin Microbiol Newsletter. 34 (1), 1-6 (2012).
- Harley, C. B., Futcher, A. B., Greider, C. W. Telomeres shorten during ageing of human fibroblasts. Nature. 345 (6274), 458-460 (1990).
- Kimura, M., et al. Measurement of telomere length by the southern blot analysis of terminal restriction fragment lengths. Nat Protoc. 5 (9), 1596-1607 (2010).
- Ye, Q., et al. Telomere length and chronological age across the human lifespan: A systematic review and meta-analysis of 414 study samples including 743,019 individuals. Ageing Res Rev. 90, 102031(2023).
- Axelrad, M. D., Budagov, T., Atzmon, G. Telomere length and telomerase activity; a yin and yang of cell senescence. J Vis Exp. (75), e50246(2013).
- Liu, M., et al. Immune-mediated inflammatory diseases and leukocyte telomere length: A mendelian randomization study. Front Genetics. 14, 1129247(2023).
- Van Ockenburg, S., et al. Stressful life events and leukocyte telomere attrition in adulthood: A prospective population-based cohort study. Psychol Med. 45 (14), 2975-2984 (2015).
- Zong, Z. Q., et al. Ambient air pollution exposure and telomere length: A systematic review and meta-analysis. Public Health. 215, 42-55 (2023).
- Tang, L., Li, D., Wang, J., Su, B., Tian, Y. Ambient air pollution, genetic risk and telomere length in uk biobank. J Expo Sci Environ Epidemiol. , (2023).
- Aubert, G., Hills, M., Lansdorp, P. Telomere length measurement-caveats and a critical assessment of the available technologies and tools. Mutat Res. 730 (1), 59-67 (2012).
- Lin, J., et al. Systematic and cell type-specific telomere length changes in subsets of lymphocytes. J Immunol Res. 2016, 5371050(2016).
- Needham, B. L., et al. Socioeconomic status, health behavior, and leukocyte telomere length in the national health and nutrition examination survey, 1999-2002. Soc Sci Med. 85, 1-8 (2013).
- Verhulst, S. Improving comparability between qpcr-based telomere studies. Mol Ecol Res. 20 (1), 11-13 (2020).
- Dagnall, C. L., et al. Effect of pre-analytic variables on the reproducibility of qpcr relative telomere length measurement. PloS one. 12 (9), e0184098(2017).
- Lin, J., Smith, D. L., Esteves, K., Drury, S. Telomere length measurement by qpcr-summary of critical factors and recommendations for assay design. Psychoneuroendocrinology. 99, 271-278 (2019).
- Wolf, S. E., et al. Cross-tissue comparison of telomere length and quality metrics of DNA among individuals aged 8 to 70 years. PLOS One. 19 (2), e0290918(2024).
- RoDer, B., FruHwirth, K., Vogl, C., Wagner, M., Rossmanith, P. Impact of long-term storage on stability of standard DNA for nucleic acid-based methods. J Clin Microbiol. 48 (11), 4260-4262 (2010).
- Dagnall, C., et al. Effect of pre-analytic variables on the reproducibility of qpcr relative telomere length measurement. PLoS One. 12 (9), e0184098(2017).
- Shao, W., Khin, S., Kopp, W. C. Characterization of effect of repeated freeze and thaw cycles on stability of genomic DNA using pulsed field gel electrophoresis. Biopreserv Biobank. 10 (1), 4-11 (2012).
- Institute for Statistics and Mathematics of WU. The Comprehensive R Archive Network. , Available from: https://cran.r-project.org/ (2024).
- Nakagawa, S., Schielzeth, H. Repeatability for Gaussian and non-Gaussian data: a practical guide for biologists. Biol Rev. 85 (4), 935-956 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved