Method Article
מונוכרום מולטיפלקס כמותי PCR מדידת אורך טלומרים
* These authors contributed equally
In This Article
Summary
כאן אנו מציגים פרוטוקול למדידת אורך הטלומרים היחסי (TL) באמצעות בדיקת תגובת שרשרת פולימראז כמותית מונוכרום (MMqPCR). בדיקת MMqPCR היא שיטה חוזרת, יעילה וחסכונית למדידת TL מדנ"א אנושי במחקרים מבוססי אוכלוסייה.
Abstract
טלומרים הם מבנים ריבונוקלאו פרוטאינים בקצה כל הכרומוזומים האיקריוטים המגנים על הדנ"א מפני נזק ושומרים על יציבות הכרומוזומים. אורך הטלומרים (TL) נקשר לחשיפות שונות, תהליכים ביולוגיים ותוצאי בריאות. מאמר זה מתאר את פרוטוקול בדיקת תגובת שרשרת פולימראז כמותי מונוכרום (MMqPCR) שנערך באופן שגרתי במעבדה שלנו למדידת TL ממוצע יחסי מדנ"א אנושי. ישנן מספר שיטות שונות למדידת TL מבוססות PCR, אך הפרוטוקול הספציפי לשיטת MMqPCR המוצג בפרסום זה ניתן לחזרה, יעיל, חסכוני ומתאים למחקרים מבוססי אוכלוסייה. פרוטוקול מפורט זה מתאר את כל המידע הדרוש לחוקרים כדי לבסס בדיקה זו במעבדה שלהם. בנוסף, פרוטוקול זה מספק צעדים ספציפיים להגדלת יכולת השחזור של מדידת TL על ידי בדיקה זו, המוגדרת על ידי מקדם המתאם התוך-מעמדי (ICC) על פני מדידות חוזרות ונשנות של אותה דגימה. בית הדין הפלילי הבינלאומי הוא גורם קריטי בהערכת הכוח הצפוי לאוכלוסיית מחקר ספציפית; ככזה, דיווח על ICCs ספציפיים לעוקבה עבור כל בדיקת TL הוא צעד הכרחי כדי לשפר את הקשיחות הכוללת של מחקרים מבוססי אוכלוסייה של TL. תוצאות לדוגמה המשתמשות בדגימות DNA שחולצו מתאי דם חד-גרעיניים היקפיים מדגימות את ההיתכנות של הפקת נתוני TL הניתנים לחזרה באמצעות פרוטוקול MMqPCR זה.
Introduction
טלומרים הם קומפלקסים מגנים הנמצאים בקצה כל הכרומוזומים האיקריוטיים, המורכבים מרצפי דנ"א שמורים מאוד, חוזרים על עצמם וחלבונים הקשורים אליהם. הטלומר מגן על שלמות הדנ"א ושומר על יציבות הכרומוזומים. התקצרות הדרגתית של הטלומרים מתרחשת בתאים מתחלקים כתוצאה מסינתזה חלקית של גדיל מפגר, נזק לדנ"א וגורמים אחרים 1,2. עדויות מוגברות התומכות באורך הטלומרים (TL) כסמן ביולוגי של הזדקנות ומחלות הקשורות לגיל לאורך תוחלת החיים האנושית לוו בעלייה בסוגי מבחני מדידת TL המשמשים להערכת התפקיד של TL במחקרים על חשיפה אנושית, מחלות ובריאות 3,4,5. מטא-אנליזות דיווחו על קשרים של TL עם תמותה כוללת, חשיפות סביבתיות ותוצאי בריאות, כולל סרטן, מחלות לב וכלי דם וסוכרת 6,7,8,9,10,11,12,13 . מטא-אסוציאציות אלה נובעות ממחקרים המשתמשים באחת מלמעלה משני תריסר מתודולוגיות מדידה שונות של TL, כאשר נקודות החוזק של אסוציאציות נוטות להשתנות בין מתודולוגיות שונות 14,15,16. בחירת שיטת מדידת TL אופטימלית למחקר היא צעד מכריע להבטחת תוצאות מדויקות, שכן לכל שיטה יתרונות וחסרונות משלה 5,17.
בשל העלות הנמוכה יחסית של ריאגנטים, תפנית מהירה בבדיקה, מדרגיות ודרישת DNA ראשונית נמוכה יותר, טכניקות מדידת TL מבוססות PCR משמשות לעתים קרובות באופן מועדף בעת ביצוע מחקרים עם אוכלוסיות מדגם גדולות, מחקרים עם גישה מוגבלת לדגימות עם ריכוזי DNA גבוהים, או מחקרים המתעדפים תפוקה גבוהה. השיטה הראשונה המבוססת על PCR למדידת TL, תגובת שרשרת פולימראז כמותית סינגלפלקס (qPCR) שפותחה במקור על ידי ריצ'רד קותון, משתמשת ביחס בין אותות הפלואורסצנטיות של הטלומרים (T) והגברה של גן עותק יחיד (S), הפועלים על לוחות PCR נפרדים18. בגישה זו, פריימרים המשלימים את רצפי הדנ"א הטלומרים החוזרים (T) משמשים להגברת תכולת הדנ"א הטלומרי הכולל בדגימה ומכומתים על ידי זיהוי כתב הפלואורסצנטי SYBR ירוק. באופן דומה, פריימרים המשלימים אזור אינטרגני של גן עותק יחיד (S) שמור משמשים לכימות מספר העתק הגנום. שתי הערכות אלה מכומתות ביחס לעקומת תקן DNA גנומית המשמשת בכל הבדיקות בפרויקט לבקרת השונות מלוח לצלחת. חלוקת הדנ"א הטלומרי הכולל (T) במספר העתק גנום יחיד (S) מייצרת את יחס T/S, מדידה יחסית חסרת יחידה המייצגת תוכן טלומרי ממוצע לתא עבור דגימת DNA בודדת18,19. לפיכך, יחס T/S אינו מדידה ספציפית של אורך פונקציונלי; עם זאת, בהתאם לנורמות הספרותיות, אנו משתמשים במונח TL ממוצע למדגם לאורך פרוטוקול זה.
שיטה זו התקדמה בשנת 2009 כאשר ריצ'רד קות'ון תיאר את בדיקת המולטיפלקס qPCR (MMqPCR) במונוכרום כגישה להפחתת השונות ביחס T/S ביחס לשיטת הסינגלפלקס qPCR המקורית19. לבדיקת MMqPCR יש את היתרונות של בדיקת qPCR עם יתרון נוסף של מדידת אותות T ו- S באותה תגובה היטב באמצעות פלואורופור דיווח אחד, ובכך להקטין את השגיאה ביחס ל- qPCR singleplex וכתוצאה מכך דיוק ושחזור גבוהים יותר19. יתר על כן, שיטת מולטיפלקס זו עשויה להוזיל עלויות ולשפר את התפוקה מכיוון שנדרשות מחצית ממספר התגובות בהשוואה לבדיקת סינגפלקס19.
בהתחשב ביתרונות של מדידת MMqPCR TL, שיטה זו מתאימה היטב למחקרים מבוססי אוכלוסייה של קשרי TL עם חשיפות, תוצאות בריאותיות ותהליכים ביולוגיים. עם זאת, ייזום השיטה יכול להיות מאתגר. כדי להתמודד עם אתגרים אלה, אנו מתארים, בפירוט, את פרוטוקול מדידת MMqPCR TL המשמש במעבדה שלנו, תוך הדגשת שלבי מפתח שיושמו כדי להגביר את דיוק הבדיקה, להפחית את הסיכון לזיהום ולשפר את יכולת החזרתיות.
יתר על כן, פרוטוקול זה מתאר שלבים לניקוי נתונים ולחישוב מקדם המתאם התוך-מעמדי (ICC), מדד סטטיסטי חשוב של יכולת השחזור של מדידות TL2. עם התוצאות המייצגות שלנו, אנו מדגימים את היכולת ליצור ICCs גבוהים באמצעות פרוטוקול זה. בנוסף, אנו מזהים בקרת איכות (QC) ושלבי פתרון בעיות הצפויים להפחית את השונות במדידות TL ולהגדיל את ה- ICC המתקבל. בשל יכולת החזרתיות הגבוהה של שיטה זו, יעילות ועלות-תועלת, מדידת MMqPCR TL אידיאלית למחקר TL אפידמיולוגי. איור 1 מספק סקירה חזותית של שיטת MMqPCR כמתואר בפרוטוקול זה.
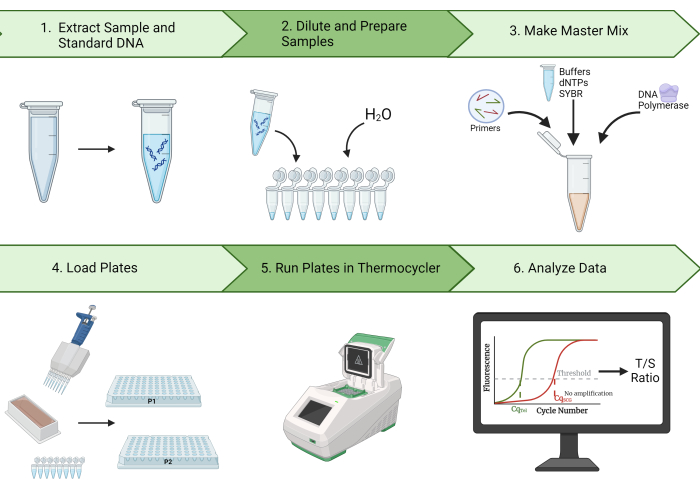
איור 1: סקירה כללית של השיטה. סקירה רחבה של שיטת תגובת שרשרת פולימראז כמותי מונוכרום מולטיפלקס למדידת אורך טלומרים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Protocol
מחקר זה בוצע בהתאם להנחיות המוסדיים. פרוטוקול זה מתאר את בדיקת MMqPCR שבוצעה בעומק מדידה של טריפליקטים כפולים, כלומר, מדידות משולשות של כל דגימה החוזרת על עצמה על פני לוחות כפולים, המיושמות באמצעות שני thermocyclers בו זמנית כדי לשפר את התפוקה. השימוש בלוחות כפולים הוא שיקול ראשון במעלה שנעשה ביישום פרוטוקול זה כדי להשיג יכולת שחזור גבוהה כפי שצוין על ידי ICCs גבוהים. למרות שניתן להשתמש בפחות משכפלים, ההשפעה על ICC, ולאחר מכן על הכוח וגודל הדגימה הדרוש, צריכה להישקל בזהירות ולהימדד עם כל קבוצה ועוקבה על ידי כל מעבדה20,21. אם רק תרמוסייקל אחד זמין, אנו ממליצים לשמור על עומק המדידה (כלומר, טריפליקטים כפולים), ולהריץ 2 לוחות ברצף.
1. הכנת מלאי ותנאי אחסון
- עבור כל החומרים והציוד המשמשים לפרוטוקול זה, ראה טבלת חומרים. בנוסף, עבור ריאגנטים ספציפיים של תערובת האב וכמויות המשמשות לבדיקת MMqPCR, ראה טבלה 1. אם מריצים שני לוחות ברצף, חצי מנפח האב מערבב תוך שמירה על ריכוז, מה שמבטיח שאותם אליציטוטים מגיבים ישמשו על פני לוחות רציפים של אותו מבחן.
הערה: יש להכין מראש את כל ריאגנטים מלאי ולהפשיר לחלוטין ריאגנטים לפני השימוש. - Aliquot ולאחסן 1x Tris-EDTA, pH 7.6 (TE) בצינורות 5 מ"ל בנפחים 3 מ"ל בטמפרטורת החדר עד שנתיים.
- Aliquot ולאחסן 5 M בטאין בצינורות 5 מ"ל בנפחים של 1,280 μL ב -20 ° C למשך עד שנה אחת.
- Aliquot ולאחסן SYBR ירוק בנפחים 3 μL בצינורות רצועת PCR בודדים ב -20 ° C למשך עד שנתיים, מכוסה בנייר כסף וחשוף מינימלי לאור.
- יש לאחסן DNA פולימראז בצינורות מקוריים בטמפרטורה של -20°C למשך עד שנה.
- Aliquot ולאחסן 10x חיץ פולימראז בצינורות 1.5 מ"ל בנפחים 660 μL ב -20 ° C עד 1 שנה.
- עבור דילול מאגר 1x של חיץ פולימראז 10x, הוסף 9.9 μL של חיץ 10x ל 89.1 μL של PCR כיתה H2O בצינורות 0.5 מ"ל; יש לאחסן בטמפרטורה של -20°C למשך עד שנה.
- Aliquot ולאחסן 1 M MgCl2 צינורות 0.5 מ"ל בנפחים 70 μL ב 4 ° C הרחק מהאור עד 1 שנה.
- אחסנו את הפריימרים הקדמיים וההפוכים של הטלומרים (T) וההעתקה הבודדת (S) של הגן אוליגונוקלאוטיד בטמפרטורת החדר, הרחק מהאור. ארבעת רצפי הפריימר הספציפיים של אוליגונוקלאוטידים מוצגים בטבלה 2.
הערה: גן העותק היחיד בפרוטוקול זה הוא אלבומין; אם בוחרים גן עותק יחיד אחר, ייתכן שיהיה צורך להתאים את ריכוזי הפריימר כדי להבטיח יעילות PCR מקובלת.- בנייה מחדש של פריימר: מערבול כל צינור פריימר ליופילי למשך 10 שניות ולאחר מכן מקם צינורות בצנטריפוגה קטנה למשך 5 שניות כדי להבטיח שהגלולה הליופילית נמצאת בתחתית הצינור לפני הוספת חיץ TE 1x.
- בדוק כל צינור פריימר בודד עבור ריכוז nM ([nM]= אלפא) ולהחזיר לחות לכל צינור פריימר על ידי הוספת 1x TE שווה ל 10x מערך אלפא ב μL (למשל, אם ריכוז nM על הצינור קורא 24.6 ננומטר, ואז להוסיף 246 μL של 1x TE לצינור פריימר) כדי ליצור תמיסה של 100 מיקרומטר של כל פריימר.
- פריימרים לטלומרים קדימה ואחורה של Aliquot בנפרד בנפחים של 16 μL ופריימרים אלבומין קדימה ואחורה בנפרד בנפחים של 11 μL. לאחסן את כל ארבעת הסוגים של aliquots פריימר ב -20 ° C עד 6 חודשים.
- תערובת dNTP: מערבולת 4-8 צינורות מכל אחד מארבעת סוגי dNTPS של תמיסות מלאי של 25 מילימטר (כלומר, 16-32 צינורות בסך הכל) למשך 10 שניות ולאחר מכן סיבוב מהיר למטה בטמפרטורת החדר באמצעות מיני צנטריפוגה. הניחו את הצינורות בפיזור אחיד במיקומי הצינור בצנטריפוגה הקטנה, ולאחר מכן סגרו את המכסה כדי לאפשר למכונה להגיע למהירות מלאה, תוך סיבוב של כ-5 שניות.
- בצינור של 5 מ"ל, הוסף 200-250 μL מכל צינור, וודא שחלקים שווים מכל אחד מארבעת סוגי dNTP מתווספים, ומערבלים את תערובת dNTP.
- Aliquot 210 μL של תערובת בצינורות 0.5 מ"ל ולאחסן ב -20 °C עד 1 שנה.
- יש לאחסן את המלאי DTT בטמפרטורה של -20°C ואת המלאי ב-3 M נתרן אצטט בטמפרטורת החדר.
- פתרון DTT: יש למדוד 0.1545 גרם DTT בסירת משקל זפת על משקל באמצעות מרית מפלדת אל-חלד.
זהירות: Dithiothreitol (DTT) הוא מגיב מסוכן. DTT מזיק בבליעה, גורם לגירוי בעור ועלול לגרום לנזק חמור לעיניים. אנשים צריכים ללבוש כפפות מגן, הגנה על העיניים והגנה על הפנים בעת טיפול DTT. בנוסף, יש להימנע מנשימת אדי DTT, לעבוד במכסה מנוע PCR בעת טיפול ב-DTT ולהימנע מחשיפה ממושכת או חוזרת. - הפוך 10 מ"ל של 0.01 M נתרן אצטט על ידי הוספת 33.33 μL של 3 M נתרן אצטט ו 9,967 μL של PCR כיתה H2O בצינור 15 מ"ל מערבולת היטב. הוסף DTT נמדד לתוך צינור 15 מ"ל של 0.01 M נתרן אצטט. העבירו כ-100 מיקרוליטר של תמיסת נתרן אצטט באורך 0.01 מטר לסירת השקילה כדי לאסוף את שאריות ה-DTT. פיפטה 100 μL בחזרה לתוך צינור 15 מ"ל. ברגע שכל ה-DTT נמצא בתמיסה, מערבלים את הצינור עד שהוא מתמוסס במלואו.
- יוצקים את תכולת צינור 15 מ"ל לתוך שוקת טעינה, שואפים את התמיסה כולה לתוך מזרק פלסטיק 10 מ"ל מקצה אחד של שוקת הטעינה. חבר מסנן מזרק תאית אצטט סטרילי 0.2 מיקרומטר 25 מ"מ לקצה המזרק המלא, אפשר להרוות באופן מלא למשך דקה אחת, וטפטף באיטיות את התמיסה לתוך צינור חדש של 15 מ"ל על ידי דחיפה קלה של בוכנה המזרק כלפי מטה, ומבטיח כי התמיסה כולה מטפטפת דרך המסנן לתוך הצינור החדש 15 מ"ל.
- תמיסת Aliquot DTT בנפחים של 200 μL לתוך צינורות 0.5 מ"ל ולאחסן ב -20 ° C למשך עד 6 שבועות.
- פתרון DTT: יש למדוד 0.1545 גרם DTT בסירת משקל זפת על משקל באמצעות מרית מפלדת אל-חלד.
טבלה 1: נפחים סופיים וריכוזים של ריאגנטים. נפחים וריכוזים של ריאגנטים באליציטוטים בודדים, תערובת אב, ובבארות PCR. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: רצפי פריימר של טלומרים ועותק יחיד של גן אוליגונוקלאוטיד (oligonucleotide primer). רשימה של רצפי הפריימר של גן הטלומרים והאלבומין המשמשים במתודולוגיה. אנא לחץ כאן כדי להוריד טבלה זו.
2. מיצוי DNA גנומי והכנת דגימות
- מיצוי דגימות אנליטיות: ביצוע מיצוי DNA גנומי לדגימות בהתאם להנחיות היצרן באמצעות ערכות או שיטות מבוססות במעבדה.
- בדוק את איכות דגימת ה- DNA באמצעות ספקטרופוטומטר ו- DNA דו-גדילי (dsDNA) באמצעות פלואורומטר. אין לנתח דגימות עם יחס ממוצע בלתי קביל של 260/280 ו- 260/230 או ריכוז של dsDNA מתחת לזיהוי (<0.20 ng/μL) עבור TL22,23. בנוסף, אם ריכוז dsDNA גבוה מכדי להפיק קריאה באמצעות פלואורומטר (>1000 ננוגרם/μL), דללו את הדגימה וחזרו על הבדיקה.
הערה: עבור התוצאות המוצגות כאן, הערכים המקובלים לטוהר חומצות גרעין היו יחס 260/280 בין 1.6 ל -2.0 ויחס 260/230 בין 2.0 ל -2.2.
- בדוק את איכות דגימת ה- DNA באמצעות ספקטרופוטומטר ו- DNA דו-גדילי (dsDNA) באמצעות פלואורומטר. אין לנתח דגימות עם יחס ממוצע בלתי קביל של 260/280 ו- 260/230 או ריכוז של dsDNA מתחת לזיהוי (<0.20 ng/μL) עבור TL22,23. בנוסף, אם ריכוז dsDNA גבוה מכדי להפיק קריאה באמצעות פלואורומטר (>1000 ננוגרם/μL), דללו את הדגימה וחזרו על הבדיקה.
- מיצוי דגימות בקרה: ביצוע מיצוי DNA גנומי על דגימת ביקורת שמקורה באותו חומר ביולוגי כמו דגימות הנושא הנבדקות עבור פרויקט נתון. ודא לחלץ DNA בקרה מספיק עבור כל הלוחות הצפויים לרוץ עבור כל הקבוצה, כך תקן DNA יחיד מנוצל עבור כל הבדיקות.
- בדוק את איכות דגימת ה- DNA הבקרה על ידי ספקטרופוטומטר ופלואורומטר. דגימת הבקרה צריכה להיות בעלת יחס ממוצע מקובל של 260/280 ו-260/230 וריכוזים ניתנים לזיהוי של dsDNA 22,23.
- Aliquot שולט בדנ"א בריכוז של 2 ng/μL בכמויות של 150 μL בצינורות 0.5 מ"ל המסומנים עם סוג הדגימה והתאריך. לאחסן aliquots DNA שליטה ב -20 ° C עד 5 שנים. השתמש בדגימת DNA בקרה אחת עבור כל הלוחות של כל הדגימות מאותה קבוצה או פרויקט מחקר. הכינו את ה-aliquots האלה מראש.
- הכנת דגימות אנליטיות: עבור דגימות בעלות ריכוז התחלתי של >5 ng/μL, צור אליציטוטים דילול באמצעות גורם דילול מספר שלם, הוספת הכמות המתאימה של דגימת DNA שחולצה (קובץ משלים 1 MMqPCR להגדיר גיליון, עמודה F) ו PCR כיתה H2O (קובץ משלים 1 MMqPCR להגדיר גיליון, עמודה G) כדי לדלל את הריכוז להיות בין 2.5 - 5.0 ng / μL (קובץ משלים 1 גיליון הגדרת MMqPCR, עמודה K). אין לדלל דגימות עם ריכוז <5 ng/μL, עם זאת, aliquot מספיק נפח כדי להעריך את הדגימה 3x באמצעות פרוטוקול זה.
הערה: יש לבצע אליציטוטים של דילול במהלך הכנת הדגימה, כך שניתן יהיה להוסיף 15 ננוגרם של DNA לצינור רצועת ה-PCR המתאים של כל דגימה. אליציטוטי הדגימה מאפשרים לטכנאים להימנע ממחזורי הקפאה-הפשרה מיותרים מלהשפיע על שלמות הדנ"א של דגימת המלאי אם הדגימה אינה עומדת בקריטריוני האיכות ויש צורך להריץ אותה מחדש. תבנית MMqPCR לדוגמה שנמצאת בקובץ המשלים 1 יכולה לסייע בזיהוי גורם הדילול הנכון ואמצעי האחסון להכנת אליציטוטים לדילול (קובץ משלים 1, גיליון הגדרת MMqPCR, עמודות E-I).- מלא רצועות PCR בדגימות A1-8 ברצועת PCR A, בדגימות B1-8 ברצועת PCR B ובדגימות C1-8 ברצועת PRC C, כמפורט בגיליון הגדרת MMqPCR של הקובץ המשלים 1 ומופיע בטבלה 3 עם כמויות דגימה בדילול מתאים (קובץ משלים 1 MMqPCR Set Up Sheet, עמודה L) וכמויות PCR H2O (קובץ משלים 1 גיליון הגדרת MMqPCR, עמודה M) עבור כמות כוללת של 15 ng של DNA לכל צינור PCR ונפח כולל של 75 μL. הניחו אותו בצד.
הערה: דגימות ברצועות PCR ניתן לאחסן במשך הלילה ב 4 ° C כדי להיות מצופה למחרת.
- מלא רצועות PCR בדגימות A1-8 ברצועת PCR A, בדגימות B1-8 ברצועת PCR B ובדגימות C1-8 ברצועת PRC C, כמפורט בגיליון הגדרת MMqPCR של הקובץ המשלים 1 ומופיע בטבלה 3 עם כמויות דגימה בדילול מתאים (קובץ משלים 1 MMqPCR Set Up Sheet, עמודה L) וכמויות PCR H2O (קובץ משלים 1 גיליון הגדרת MMqPCR, עמודה M) עבור כמות כוללת של 15 ng של DNA לכל צינור PCR ונפח כולל של 75 μL. הניחו אותו בצד.
- הכנת עקומה סטנדרטית: הפשרת אליקוט DNA בקרה, מערבולת למשך 30 שניות, צנטריפוגה למשך 5 שניות, ושאפו את מלוא הנפח (150 מיקרוליטר) לתוך הצינור הראשון ברצועת צינור PCR העקומה הסטנדרטית (SC).
- פיפטה 70 μL של PCR כיתה H2O לתוך השני עד השמיני צינורות של רצועת SC PCR. יש להשהות מחדש ביסודיות את הדנ"א של הבקרה בצינור הראשון לפני שאיפת 70 μL והכנסתו לצינור ה-PCR השני. המתן 30 שניות, ולאחר מכן השהה מחדש ביסודיות את התמיסה בצינור ה- PCR השני לפני שתשאף 70 μL ותחלק אותה לצינור ה- PCR השלישי. חזור על פעולה זו עבור צינורות שלוש עד שבע כדי ליצור דילול סדרתי פי 2 של שבעה תקנים. הצינור הסופי צריך להכיל רק PCR כיתה H2O לתפקד כפקד שאינו תבנית (NTC). הניחו את רצועת SC PCR בצד.
טבלה 3: ארגון דגימות ותקן בקרה בצלחת. מיקום כל הדגימות והתקנים על צלחת PCR של 96 בארות. אנא לחץ כאן כדי להוריד טבלה זו.
3. הכנת תערובת מאסטר MMqPCR
- אסוף את אליציטוטי מגיב תערובת האב המפורטים בטבלה 1, למעט DNA פולימראז, ואפשר להם להגיע לטמפרטורת החדר בתוך מכסה המנוע PCR. הוסף 1 μL של aliquot ירוק SYBR ל- aliquot חיץ 1x.
הערה: כמות מדויקת זו נדרשת כדי לייצר את הריכוז הנכון של SYBR בשל מגבלות דיוק פיפטה במהלך הבדיקה, כך שגם אם רק צלחת אחת מופעלת בכל פעם, כמות זו צריכה להישאר ללא שינוי. - מערבול כל aliquots עבור 10 s, צנטריפוגה עבור 5 s, ולאחר מכן להוסיף את הכמויות הבאות של ריאגנטים לצינור 5 מ"ל המחזיק את 5 M betaine (עכשיו צינור תערובת הראשי): 1,235.2 μL של PCR כיתה H2O, 640 μL של מאגר 10x, 204.8 μL של dNTPs, 192 μL של DTT, 64 μL של MgCl2, 48 μL של SYBR Green / 1x buffer (משלב 3.1), 14.4 μL של שני פריימרים לטלומרים ו-9.6 μL של שני פריימרים אלבומין, כמפורט בטבלה 1.
- קח DNA פולימראז מתוך -20 ° C אחסון, מערבולת עבור 10 שניות, צנטריפוגה עבור 5 שניות, ולאחר מכן לאט להוסיף 128 μL לתערובת הראשי; העבר מיד DNA פולימראז בחזרה לאחסון -20 °C.
- מערבול את צינור תערובת מאסטר 5 מ"ל במשך 30 שניות.
4. הכנת צלחת 96 באר
- הניחו שתי צלחות 96 בארות, שוקת העמסה וקצוות פיפטה רב ערוצית בתוך מכסה מנוע PCR. תייגו כל לוחית עם מספר לוחית (1 או 2). סובב את לוח אחד (לוח P1) 180° כך שמספרי העמודות יהיו הפוכים. השאירו את צלחת שתיים (P2) מול הטכנאי.
- יוצקים את התוכן של צינור תערובת מאסטר 5 מ"ל לתוך שוקת הטעינה. השתמש בקצה פיפטה כדי לאסוף ולהוציא כל תמיסה שנותרה בצינור.
- העמיסו את הטיפים על הפיפטה הרב-ערוצית, ודחפו בבסיס כל קצה פיפטה כדי להבטיח אטימה הדוקה. בדוק כי הטיפים אין כל מסנן בתוך אזור הפלט שבו תערובת האב יהיה לשאוף; אם יש חתיכת מסנן, ואז להחליף את הקצה.
- השתמשו בפיפטינג הפוך כדי למלא את הצלחות בתערובת האב הצמיגית, לסובב את שוקת ההעמסה ואז ללחוץ על בוכנה פיפטה מעבר לתחנה הראשונה, תוך שאיפה של יותר מ-15 מיקרוליטר לתוך קצות הפיפטה, וודאו שהקצוות מתמלאים באותו זמן באותו נפח. כשמוציאים את תערובת המאסטר לעמודה, לוחצים על הבוכנה לתחנה הראשונה, ומשאירים את תערובת המאסטר הנוספת בקצות פיפטה. משאירים את הבוכנה מדוכאת, שקועים את הקצוות בחזרה לתוך שוקת ההעמסה ומשחררים את הבוכנה כדי למלא את הקצוות בעוד 15 μL. השתמשו באותם טיפים כדי למלא את שתי הצלחות.
- מלא לוחות על-ידי סילוק תערובת האב לכל העמודות האי-זוגיות או לכל העמודות האי-זוגיות תחילה, לסירוגין בין לוחות (כלומר, אם הטכנאי בוחר להתחיל במספרי עמודות אי-זוגיים, עמודה 1 ב- P2 תמולא תחילה, ואחריה עמודה 11 ב- P1, ולאחר מכן עמודה 3 ב- P2 וכן הלאה). לאחר שהטכנאי מילא את כל הבארות של הסדרה (אי-זוגיות או זוגיות) שעובדות משמאל לימין, בצע את הסדרות האחרות (זוגיות או אי-זוגיות) של עמודות באותה צורה. ראו איור 2 לתרשים של התהליך הזה.
הערה: אופן זה של מילוי לוחות פועל כדי לשלוט באפקטים של מיקום על פני הלוחות.
- מלא לוחות על-ידי סילוק תערובת האב לכל העמודות האי-זוגיות או לכל העמודות האי-זוגיות תחילה, לסירוגין בין לוחות (כלומר, אם הטכנאי בוחר להתחיל במספרי עמודות אי-זוגיים, עמודה 1 ב- P2 תמולא תחילה, ואחריה עמודה 11 ב- P1, ולאחר מכן עמודה 3 ב- P2 וכן הלאה). לאחר שהטכנאי מילא את כל הבארות של הסדרה (אי-זוגיות או זוגיות) שעובדות משמאל לימין, בצע את הסדרות האחרות (זוגיות או אי-זוגיות) של עמודות באותה צורה. ראו איור 2 לתרשים של התהליך הזה.
- מערבלים את ארבעת פסי ה-PCR הסגורים המכילים את הדגימות ואת העקומה הסטנדרטית, ואז מסובבים כל אחד מהם במיני צנטריפוגה במשך 5 שניות.
- סדרו את רצועות ה-PCR במדף צינור ה-PCR לפי סדר הנחתן על הצלחת. עבור P1 3 העמודות הראשונות הן דוגמאות (רצועת PCR A), עמודות 4-6 הן הסטנדרטיות (רצועת PCR S), עמודות 7-9 הן דוגמאות (רצועת PCR B) ועמודות 10-12 הן דוגמאות (רצועת PCR C; ראו איור 3 וטבלה 3). מכיוון ש-P2 מתמלא בזמן סיבוב של 180 מעלות ביחס לטכנאי, העמודות יהיו הפוכות.
- סובב את שני הלוחות ב-180° כך שמספרי העמודות יתהפכו ביחס לטכנאי עבור כל צלחת (כלומר, אם הטכנאי עמד מול התווית עבור P2 בעבר, כעת הוא יעמוד מול התווית עבור P1 בקצה הצלחת).
- הגדר את הפיפטה הרב-ערוצית ל- 10 μL וטען את קצות הפיפטה על הפיפטה הרב-ערוצית כמתואר בשלב 4.3.
- השתמש בפיפט הרב-ערוצי כדי להשעות מחדש את התמיסות, ולאחר מכן בצע פיפטינג הפוך כמתואר בשלב 4.4 כדי לשאוף ולחלק 10 μL של הדגימות והתמיסות הסטנדרטיות, החל ברצועת ה- PCR A.
- מלא את 3 העמודות הראשונות של כל צלחת באמצעות רצועת PCR A על ידי החלפת העמודות לסירוגין באופן דומה למיקום תערובת המאסטר בצלחת (כלומר, זוגי או אי-זוגי).
- מלא את שלוש העמודות הבאות באמצעות רצועת PCR העקומה הסטנדרטית. עבור רצועה זו, השהה מחדש את צינור הדילול הסטנדרטיהשביעי (השני עד האחרון), באמצעות פיפטה של 200 μL שנקבעה ל~90 μL, ביסודיות לפני שתשהה מחדש את הרצועה כולה באמצעות פיפטה רב ערוצית.
הערה: הנפח הגדול יותר וריכוז הדנ"א הקטן יותר בצינור זה גורמים לעתים קרובות למדידות מגוונות על פני בארות צלחת ה- PCR עקב ערבוב לקוי. שימוש בנפח גדול יותר כדי לערבב צינור זה הופך את תמיסת הדנ"א להומוגנית טוב יותר. - מלא את שלוש העמודות הבאות ברצועת PCR B ואת שלוש האחרונות ברצועת PCR C. החלף קצות פיפטה בין כל רצועת PCR, מלא את כל 96 הבארות בשתי הצלחות בדגימות המתאימות ובתקן הבקרה כמתואר באיור 3.
- לאחר מילוי הצלחות, טפחו בעדינות על הצלחת שעל ראש הספסל כדי להבטיח שנוזלים בצידי הבארות יזרום למטה למטה, ולאחר מכן כסו את ראשי הצלחת באמצעות סרטי איטום. השתמש בקצות האצבעות כדי ללחוץ כלפי מטה על כל קצוות הסרט כדי להבטיח אטימה הדוקה.
- מערבבים את הצלחות על ידי ערבול על מכסה המנוע במשך 30 שניות, ואז מניחים את הצלחות האטומות לתוך ספינר הצלחת למשך 2 דקות כאשר פתחי הבאר פונים למרכז.
- מניחים את הצלחות בתרמוסייקלר, עם מספרי העמודות של הלוחות בסדר קריא. השתמש ברקמה נקייה כדי לנקות את החלק העליון של כל צלחת לפני סגירת החלק העליון thermocycler.
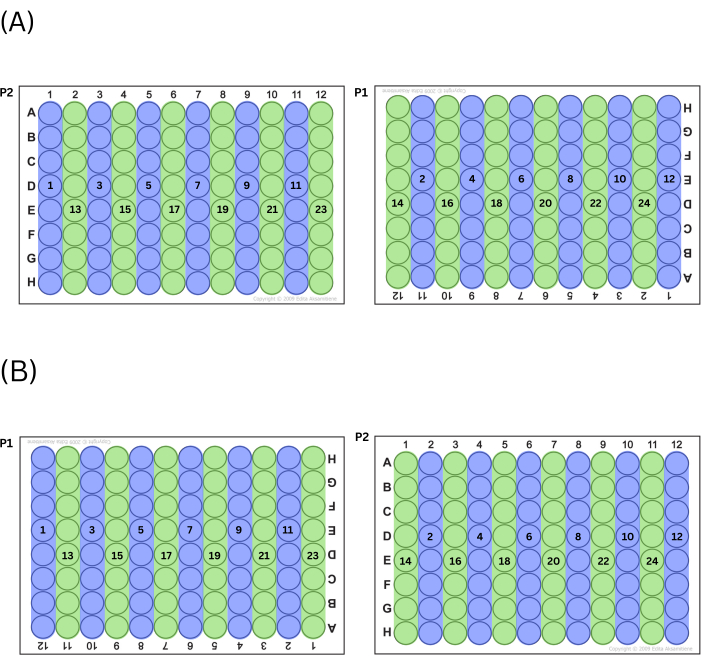
איור 2: תהליך מילוי צלחות. (א) אם בוחרים למלא תחילה טורים אי-זוגיים, זהו סדר מילוי הבארות. (ב) אם בוחרים למלא תחילה עמודים זוגיים, זהו סדר מילוי הבארות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
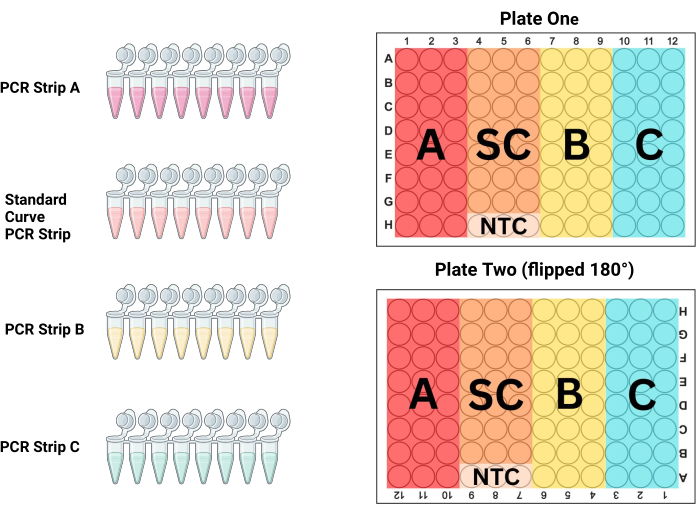
איור 3: פריסת לוחות. יש להשתמש ברצועת PCR A, ברצועה B, ברצועה C וברצועת העקומה הסטנדרטית (SC) כדי למלא שלוש עמודות בכל לוח כדי לייצר טריפליקטים כפולים של כל דגימה ודילול סטנדרטי. דיאגרמה זו מראה אילו מהעמודות יש למלא בכל רצועה. לוחית שתיים מתהפכת ב-180° (שימו לב שכותרות העמודות והשורות הפוכות) לפני הטעינה, אך הלוח ממולא באופן זהה ללוח הראשון, ובכך מבטל שגיאות פיפטינג פוטנציאליות ועדיין שולט באפקטי המיקום על פני הלוחות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
5. תרמוצילקינג MMqPCR
- בזמן שהלוחות מסתובבים בשלב 4.8.1, הפעל את המחשב ואת thermocyclers. פתח את תוכנת thermocycler. פרוטוקול זה מתאר את השימוש בתוכנת CFX Maestro.
- צור את פרוטוקול TL thermocycling בהתאם לפרוטוקול MMqPCR thermocyclingprotocol 19 (איור 4).
- הוסף שלב דגירה כדי להפעיל את ה- DNA פולימראז ב- 95 ° C למשך 15 דקות.
- כדי למנוע קשירת פריימר-דימר, הפעל שני מחזורים של 94 ° C במשך 15 שניות, 49 ° C במשך דקה אחת, ולאחר מכן 3 מחזורים של 94 ° C במשך 15 שניות, 59 ° C במשך 15 שניות.
- להגברה של הטלומרים, הוסיפו 27 מחזורים של 85°C למשך 15 שניות, 74°C למשך 30 שניות, ולאחר מכן רכשו אותות.
- להגברת אלבומין, הוסף 31 מחזורים של 94 ° C עבור 15 שניות, 84 ° C עבור 30 שניות, ולאחר מכן רכישת אותות.
- כלול עקומת התכה מ- 59 ° C ל- 95 ° C במרווחים של 5 שניות עבור כל מעלה עולה בפרוטוקול המחזור התרמי.
- לחץ על התחל הפעלה עבור שני thermocyclers. כשתתבקש, ספק כותרת עבור קבצי הניתוח.
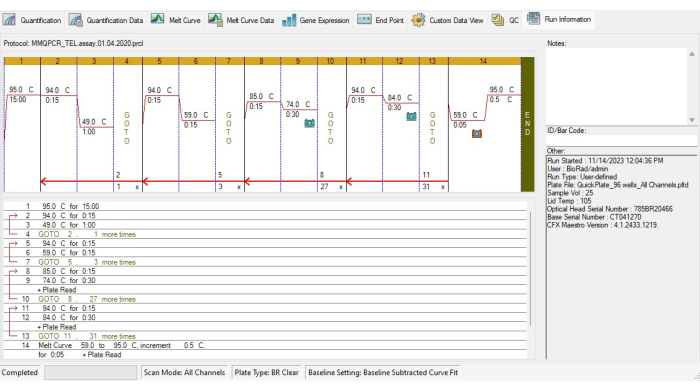
איור 4: פרופיל Thermocycling של בדיקת MMqPCR. פרוטוקול MMqPCR שנוצר בתוכנה בהתאם לפרוטוקול thermocycling המקורי19. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
6. ניתוח נתוני MMqPCR
- לאחר השלמת התרמו-מחזור, נתח את הנתונים באופן הבא כדי להפיק ערכי TL עבור הדגימות שעובדו.
- בתוכנה, בחר את הגדרת צלחת תכונה. בתפריט הנפתח, לחץ על View/Edit Plate.
- סמן את כל הבארות ולחץ על בחר פלואורופורים, ולאחר מכן סמן את התיבה שכותרתה SYBR ובטל את הסימון של כל התיבות האחרות. לחץ על אישור.
- כאשר כל הבארות עדיין מסומנות, לצד המילה Load, סמן את התיבה לצד SYBR. עכשיו כל הבארות צריך להיות כתוב SYBR עליהם.
- לאחר מכן, סמן את שלוש בארות NTC בחלק העליון או התחתון של הדילול הטורי של הבקרה הסטנדרטית ובחר NTC מתפריט סוג הדגימה מימין. שלוש הבארות צריכות כעת להיות צהובות ולהיקרא NTC. איור 5A מראה אילו בארות יש לבחור עבור P1 ואיור 5B מראה אילו בארות יש לבחור עבור P2.
הערה: P2 יהיה הפוך מ- P1, כך שה- NTC יהיה בחלק התחתון של עמודות 4-6 עבור P1 ובחלק העליון של עמודות 7-9 עבור P2. - סמן את 21 הבארות של הדילול הטורי של הבקרה הסטנדרטית ובחר רגיל מתפריט סוג הדגימה. הבארות האלה צריכות להיות ירוקות. כאשר בארות אלה עדיין מסומנות, לחץ על Technical Replicate. בחר 3 מתפריט Replicate Size ולאחר מכן בחר אופקי > החל. בארות אלה צריכות להיות מסומנות בקבוצות של שלוש מ-Std-1 עד Std-7.
- כאשר התקן עדיין מסומן, גלול מטה ובחר סדרת דילול. בשדה גורם דילול, הזן 2 ולאחר מכן הקלד את ריכוז התחלת הדילול והכיווניות בהתאם למספר הצלחת כמתואר בשלבים הבאים.
- עבור לוח P1, הזן 2.00E-03 בשדה הריכוז ההתחלתי, סמן את התיבה עבור הפחתת ולאחר מכן בחר החל. הערכים ב-21 הבארות צריכים להיות כתובים בערכי הריכוז בכל באר הנעים בין 2.00E-03 ל-3.13E-05 מלמעלה למטה.
- עבור לוח P2, הזן 3.13E-5 בשדה הריכוז ההתחלתי, סמן את התיבה עבור הגדל ולאחר מכן בחר החל. הערכים ב-21 הבארות צריכים להיות כתובים בערכי הריכוז בכל באר בטווח שבין 3.13E-05 ל-2.00E-03 מלמעלה למטה.
- עבור הדגימות, סמן את העמודות עבור רצועת PCR A (1-3 עבור P1 ו- P2), בחר לא ידוע מתפריט סוג הדגימה ולאחר מכן בחר שכפול טכני. בחר 3 מתפריט Replicate Size ולאחר מכן בחר Horizontal > Apply. הבארות עבור עמודות אלה צריכות להיות כחולות ומסומנות בשורה בקבוצות של 3 מ- Unk-1 עד Unk-8.
- חזור על שלב 6.3 עבור עמודות עבור רצועת PCR B (עמודות 7-9 עבור P1 ו- 4-6 עבור P2). הם צריכים להיות מסומנים Unk-9 עד Unk-16.
- חזור על שלב 6.3 עבור עמודות עבור רצועת PCR C (עמודות 10-12 עבור P1 ו- P2). הם צריכים להיות מסומנים Unk-17 עד Unk-24. לאחר השלמת שלבים 6.2-6.3.2, חלונות הגדרת הלוחות אמורים להיות דומים לאיור 5A,B.
- בחר אישור בפינה השמאלית התחתונה של חלון עורך הלוחות. לחץ על כן כדי להחיל שינויים כשתתבקש.
- עבור QC ברמת הבדיקה, ודא שעקומות בכרטיסיית הכימות מתאימות (למשל, ללא עקומות הגברה הפוכות) הן לשלב 9 והן לשלב 12 של פרופיל התרמו-מחזור, המתאימים לאמפליקונים של הטלומרים והאלבומין בהתאמה. ניתן לגשת לעקומות דרך התפריט הנפתח בצד הימני האמצעי של חלון התוכנה. איור 6A,B מציג עקומות מתאימות.
- ודא שיעילות ה-PCR המדווחת הן בשלב 9 והן בשלב 12 היא בין 90% ל-110% ושתי יעילות אלה אינן שונות זו מזו ביותר מ-10% (כלומר, 92.4% לשלב 9 ו-98% לשלב 12 אינן מתאימות, אך 92.4% לשלב 9 ו-108% לשלב 12 אינן מתאימות). בנוסף, ודא שעקומת R2 הסטנדרטית היא >0.995. אם P1 או P2 אינם עומדים בקריטריונים אלה, יש להפעיל מחדש את הלוחות.
- עבור P1, בחר שלב 9 וסמן את 21 הבארות המתאימות לעקומה הסטנדרטית כפי שניתן לראות באיור 6A,B. העתק את ערכי Cq בפינה השמאלית התחתונה של חלון התוכנה. פתח את תבנית גליון הנתונים של הטלומרים הזמינה כקובץ משלים 1, והדבק ערכים אלה בגיליון 1 הרגיל, עמודה B. בחר שלב 12 ולאחר מכן העתק ערכי Cq אלה. הדבק ערכים אלה בגיליון 1 הרגיל, עמודה I.
- זהה את ערך השיפוע בשלב 9 והקלד אותו בתא C4 בגיליון 1 הרגיל. זהה את ערך השיפוע בשלב 12 והקלד אותו בתא J4 בגיליון 1 הרגיל.
הערה: המערכת מחשבת את אחוזי היעילות של הפריימרים באמצעות שיפועי העקומה הסטנדרטית שזוהו בשלב 6.6.1. ניתן לחשב את אחוז היעילות באופן ידני באמצעות הנוסחה הבאה: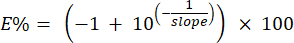
- ודא שמקדם השונות (CV) עבור כל דילול משולש סטנדרטי קטן מ-0.1. אם הוא גדול או שווה ל-0.1, יש להוציא עד שלוש בארות בודדות בסך הכל מכל ריכוזי דגימות הבקרה הכלולות בעקומת הדילול הטורית הסטנדרטית בת 7 הנקודות על הצלחת. רק באר אחת צריכה להיות מחוץ לכל קבוצה משולשת.
הערה: אי הכללת נקודות סטנדרטיות מהניתוח בתוכנה תשנה את השיפוע, R, יירוט y והיעילות המדווחים עבור שני הפריימרים. לכן, לאחר כל באר סטנדרטית מוסרת מן הניתוח, שלבים 6.5.1-6.6.1 חייב לחזור על עצמו. - חזור על שלבים 6.6.1 - 6.6.2 עבור קובץ הניתוח P2 והגיליון הסטנדרטי המתאים 2.
- רק כאשר גיליונות סטנדרטיים 1 וסטנדרטיים 2 מלאים עם קורות חיים מקובלים, לאסוף נתונים לדוגמה בודדים מקבצי הניתוח. ודא שהתאמות QC מדווחות בעמודת גיליון P1 v P2 L, לדוגמה, כמה בארות לא נכללו בקובץ הניתוח P1.
- זהה את ערך השיפוע בשלב 9 והקלד אותו בתא C4 בגיליון 1 הרגיל. זהה את ערך השיפוע בשלב 12 והקלד אותו בתא J4 בגיליון 1 הרגיל.
- ודא שרק 72 בארות הדגימה בקובץ הניתוח P1 מסומנות בכחול בכרטיסייה Quantification כפי שניתן לראות ב איור 7A,ב. בחר שלב 9. העתק את ערכי Cq ו- SQ בפינה השמאלית התחתונה של חלון התוכנה. הדבק ערכים אלה בגיליון P1 לדוגמה, החל מתא D3. בחר שלב 12 לאחר מכן העתק ערכי Cq ו- SQ אלה והדבק בגיליון P1 לדוגמה, החל בתא F3.
- חזור על שלב זה עבור הדגימות בקובץ הניתוח P2 ובגיליון P2 המתאים של הדגימות. יחסי טלומרים לעותק בודד (T/S) (עמודה H) מחושבים באופן אוטומטי, אך ניתן לחשב אותם ידנית באמצעות הנוסחה הבאה:
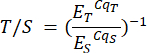
כאשר ET/S היא היעילות של הגברה מעריכית עבור תגובות המכוונות לטלומרים או לגן עותק יחיד בהתאמה, ו- CqT/S הוא המחזור שבו שכפול נתון המכוון לתוכן טלומרי או הגן בעל עותק יחיד מגיע לסף הקריטי של כימות פלואורסצנטי. יחסי T/S ממוצעים (עמודה I) מחושבים על פני שש מדידות לדגימה.
הערה: מספרי זיהוי הדגימה ב-CFX אינם תואמים לאותה דגימה ביולוגית על פני שני הלוחות. תבנית גליון הנתונים של הטלומרים מסבירה הבדל זה ותיישר את המשולשים הכפולים המתאימים. - ב-CFX Maestro, בדקו שערכי Cq עבור כל הדגימות האנליטיות נמצאים בין ערך ה-Cq הנמוך ביותר לערך הגבוה ביותר של העקומה הסטנדרטית, כפי שניתן לראות באיור 7B. אם דגימה נמצאת מחוץ לטווח כפי שניתן לראות באיור 7A, יהיה צורך להריץ אותה מחדש לאחר התאמת הריכוז. דגימה עם ערך Cq נמוך מהתקן בריכוז הגבוה ביותר חייבת להיות מדוללת בפקטור המשוער למספר מחזורי ההגברה שהיא מחוץ לטווח, ומדגם עם ערך Cq גבוה מהתקן בריכוז הנמוך ביותר יצטרך להיות מרוכז בפקטור המשוער למספר מחזורי ההגברה מעבר לסף.
הערה: שונות רחבה בריכוז הדגימות האנליטיות מציגה רמה פוטנציאלית נוספת של שונות ויש לעשות זאת בזהירות. - יש לוודא שהריכוז ההתחלתי ב-NTC היה פחות מ-5% מכמות הדנ"א הממוצעת הקיימת בבארות הדגימה. ניתן לבדוק זאת על ידי הצגת אחוז זיהום המים בדגימות P1 ובדגימות P2 של MMqPCR. אם NTC מצביע על זיהום, הפעל מחדש את הלוחות.
הערה: בשל הרגישות של בדיקת MMqPCR, זיהום קל ובלתי נשלט עלול לגרום מדי פעם לבארות NTC להתעצם. עם זאת, הגברה זו צריכה להיות מינורית ולהתרחש מספר מחזורים לאחר הגברה של גן עותק יחיד בשלב 12 של פרוטוקול thermocycling. - עבור QC ברמת המדגם, סקור סטיות תקן (SD) (עמודה J) וקורות חיים (עמודה K) בדוגמאות P1 ובדגימות P2 Sheets. ודא שיחסי T/S משולשים בין קורות החיים של הלוח התוך-לוחית במדגם נמוכים מ-0.10 (10%). כדי לתקן קורות חיים תוך-לוחית גדולים מ- 0.1, ניתן לא לכלול יחס T/S אחד מקבוצה של טריפליקטים.
הערה: ניתן לא לכלול רק שכפול אחד בסך הכל בשש המדימות לדגימה, כלומר, לא ניתן לשלול העתק עבור אותה דגימה הן ב- P1 והן ב- P2. - בדוק שקורות החיים של המדגם הבודד בגיליון P1 v P2, עמודה G, נמוכים מ- 0.05 (5%). כדי לתקן קורות חיים גדולים מ- 0.05, בצע אי הכללה של יחס T/S אחד משש המדידות לדגימה בשני הלוחות. אין לכלול דגימות לאחר בדיקה חזותית על פני טריפליקטים תוך לוחית וכל שש המדידות לפי הצורך.
הערה: רק דוגמאות העומדות בקריטריוני QC אלה, קורות חיים תוך לוחית < 10% וקורות חיים interplate < 5%, עשויות להיכלל בתוצאות TL הסופיות. אחרת, יש להוציא את הדגימה מגיליונות הנתונים P1 v P2 ו- ICC עבור הפעלה זו, ויש להעריך מחדש את הדגימה בבדיקת MMqPCR שנייה. - עבור QC ברמת הצלחת, בדוק שהשונות הממוצעת בין כל הדגימות בכל לוחית, הממוקמת בתחתית דגימות P1 וגיליונות P2, קטנה מ- 0.05 (5%). לקבלת QC נוסף ברמת הצלחת, בדוק שהשונות הכוללת בין לוחות בגיליון P1 v P2, תא G29, קטנה מ- 0.06 (6%). ודא שדגימות שלא עברו QC יוסרו מחישוב קורות החיים הבין-לוחית בתא G30.
הערה: בעת עבודה עם קבוצות מדגם קשורות (לדוגמה, בני משפחה, נקודות זמן שונות וכו'), כל הדגימות בקבוצה צריכות להיות מופעלות על אותה לוחית. לכן, אם מדגם אחד של הקבוצה אינו עומד בקריטריוני QC, יש להפעיל מחדש את כל הדגימות בקבוצה. - בקובץ נתונים כולל נפרד של עוקבה או ניסוי, רשום נתוני TL סופיים עבור כל מדגם שעבר QC (גיליון P1 v P2, עמודה I), חישובי ICC עבור כל מדגם שעבר QC (גיליון נתוני ICC, עמודות E-K) ובדיקה סופית הפעל נתוני QC מגיליון P1 v P2 (עמודות J-L)
- חזור על שלב זה עבור הדגימות בקובץ הניתוח P2 ובגיליון P2 המתאים של הדגימות. יחסי טלומרים לעותק בודד (T/S) (עמודה H) מחושבים באופן אוטומטי, אך ניתן לחשב אותם ידנית באמצעות הנוסחה הבאה:
- השתמש בקובץ משלים 2 שנוצר על-ידי רשת המחקר של טלומר (TRN) כדי לחשב את ה-ICC עבור הפרויקט20.
- לבסוף, כדי לשפר את יכולת ההשוואה בין מחקרי TL, המר את נתוני TL הסופיים עבור כל מדגם בקובץ הנתונים הכולל הנפרד של הקבוצה או הניסוי לציוני Z באמצעות המשוואה הבאה שבה יחס T/S הממוצע עבור כל הדגימות בקבוצה מופחת מיחס T/S של מדגם בודד ולאחר מכן מחולק על ידי SD על פני כל הדגימות בעוקבה.
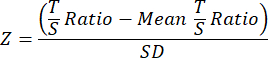
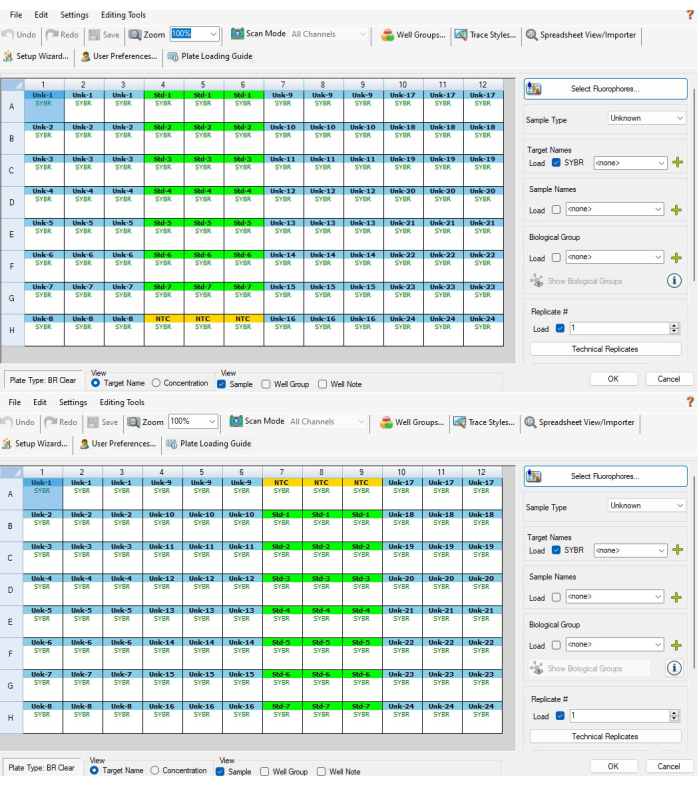
איור 5: הגדרת לוחות מבוססת תוכנה. (A) הגדרת צלחת מבוססת תוכנה עבור לוח P1 לאחר השלמת שלבים 6.2-6.4. (B) הגדרת צלחת מבוססת תוכנה עבור לוח P2 לאחר השלמת שלבים 6.2-6.4. מזהים לדוגמה ומזהים סטנדרטיים אינם מיושרים בין שני לוחות CFX בגלל האופן שבו התוכנה מקצה מזהים לדוגמה בהתבסס על מיקום טוב (כלומר, מדגם CFX 1 ב- P1 הוא מדגם CFX 24 ב- P2). תבנית האקסל המסופקת בקובץ משלים 1 מתייחסת לכך, ומבטיחה שמדידות בין-לוחיות המבוצעות על אותה דגימה ביולוגית מיושרות כראוי זו לזו אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
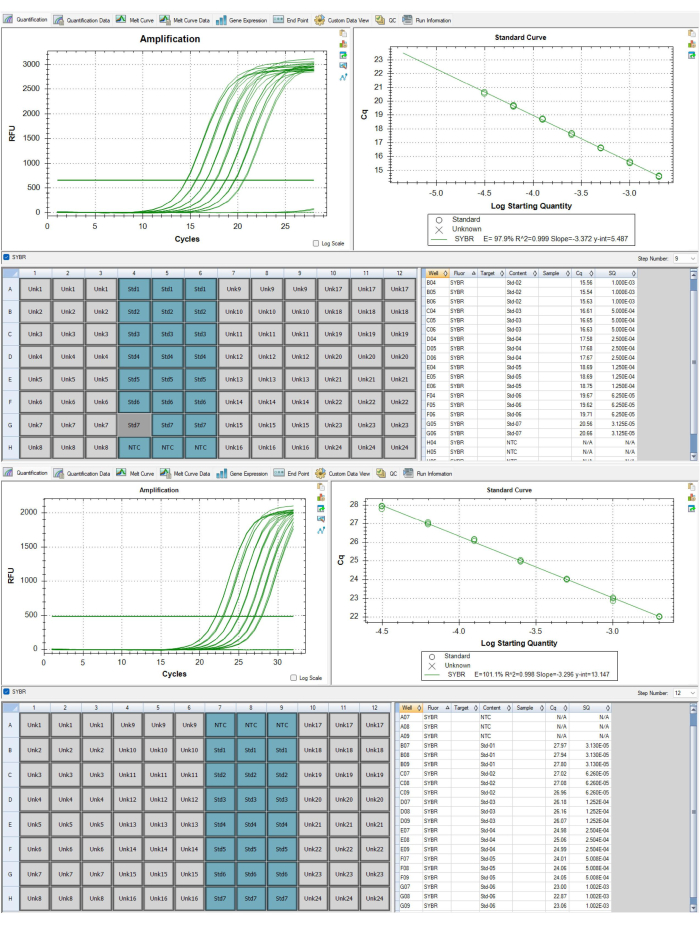
איור 6: עקומות סטנדרטיות עבוראמפליקונים מסוג t elomere ואלבומין. (A) עקומה סטנדרטית זו היא מאפליקון הטלומרים P1 של מערך הנתונים של התוצאות המייצגות. תקן אחד הוסר מכיוון שלא עמד בקריטריונים של בקרת איכות. (B) עקומה סטנדרטית זו היא מאפליקון אלבומין P2 של מערך הנתונים של התוצאות המייצגות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
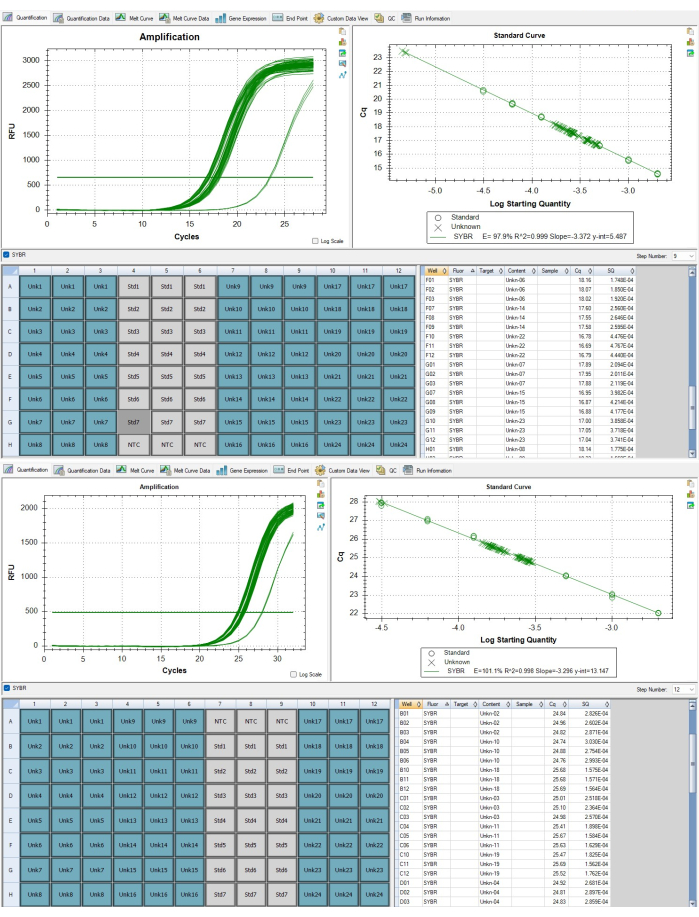
איור 7: אמפליקונים של גן טלומרים ועותק יחיד. (A) הגברה של טלומרים ו-(B) הגברה של גן אלבומין של דגימות שדווחו בתוצאות מייצגות המוצגות בתוכנה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
7. דיווח נתוני MMqPCR
- בעת דיווח על תוצאות המחקר באמצעות נתוני TL שנוצרו מ- MMqPCR, ודא דיווח על הפריטים המתוארים בהנחיות הדיווח המינימלי של TRN. הנחיות אלה ניתן למצוא באתר האינטרנט של TRN (https://trn.tulane.edu/resources/reporting-guidelines/) ותבנית לדיווח על מידע זה מסופקת בקובץ משלים 3. צטט פרוטוקול זה והנחיות ומשאבים אחרים של TRN במידת הצורך.
תוצאות
התוצאות המוצגות בטבלה 4 ובטבלה 5 מציעות דוגמה למדידות TL חוזרות מאוד המתקבלות על ידי ביצוע הפרוטוקול. לצורך תוצאות אלה, DNA הופק מ-24 דגימות תאי דם חד-גרעיניים היקפיים (PBMC) באמצעות ערכה מסחרית בהתאם להנחיות היצרנים. 24 דגימות אלה נערכו על פני שתי צלחות בנות 96 בארות. כל דגימות הדנ"א נבדקו לאיכות באמצעות ספקטרופוטומטר ופלואורומטר, תוך שימוש ביחס ממוצע של 260/280, יחס ממוצע של 260/230 וריכוז dsDNA כדי לקבוע זכאות לבדיקה וגורם דילול הדגימה (טבלה 6). טבלה 6 מדגישה גם את החשיבות של כימות ריכוז dsDNA, שיכול להיות שונה מריכוז DNA שנמדד באמצעות ספקטרופוטומטר. שונות זו היא תוצאה של גישות שונות לכימות. באופן ספציפי, הספקטרופוטומטר גוזר ריכוז DNA המבוסס על ספיגה של 280 ננומטר והוא רגיש לתנודות עקב מזהמים (למשל, חלבון, מלח וכו ') המשפיעים על קריאות הספיגה. לעומת זאת, ריכוזי dsDNA הנמדדים באמצעות פלואורומטר נקבעים על ידי פלואורסצנטיות של צבע שנקשר באופן ספציפי ל- dsDNA, וככזה, מניחים שהוא השתקפות מדויקת יותר של תוכן ה- DNA. דגימות הדנ"א חוו עד שלושה מחזורי הקפאה-הפשרה לפני ניתוח MMqPCR TL. דנ"א הבקרה נוצר ממיצוי DNA מאוגד של PBMCs מאדם אחד, אשר שימש ליצירת דילול סדרתי של שבע נקודות מ-2 ng/μL ל-0.0313 ng/μL של DNA. עקומות התקן הבלתי תלויות שנוצרו עבור PCR שלב 9 (אמפליקון טלומרים) ושלב 12 (אמפליקון גן עותק יחיד, אלבומין בפרוטוקול זה) מוצגות באיור 6A,B. הבדיקות הופעלו על מערכת זיהוי PCR מסחרית בזמן אמת שיצרה עקומת התכה שמראה את תוצרי האמפליקון הבודדים המיוצרים בטמפרטורות נפרדות כפי שניתן לראות באיור 8.
טבלה 4: נתוני פלט ממדידת MMqPCR לקבלת תוצאות מייצגות מיטביות. יחסי T/S ממוצעים, SDs, קורות חיים ו-TL עם ציון Z עבור 24 דגימות. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 5: פלט נתונים באורך טלומרים. נתונים גולמיים מבדיקת MMqPCR מנותחים בתוכנה ולאחר מכן מתווספים לתבנית הגיליון האלקטרוני המצורפת כקובץ משלים 1 לניתוח נוסף ו- QC. גיליון פלט זה של תבנית TL מציג סיכום של הנתונים, ומציג מזהי מדגם, ממוצע TLs, SDs וקורות חיים עבור כל מדגם בשני הלוחות. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 6: מדדי איכות DNA ספקטרופוטומטר ופלואורומטר לקבלת תוצאות דגימה. נתוני QC מניתוח ספקטרופוטומטר כפול ומדידת פלואורומטר סינגולרי של dsDNA וכל זיהום לדגימה. אנא לחץ כאן כדי להוריד טבלה זו.
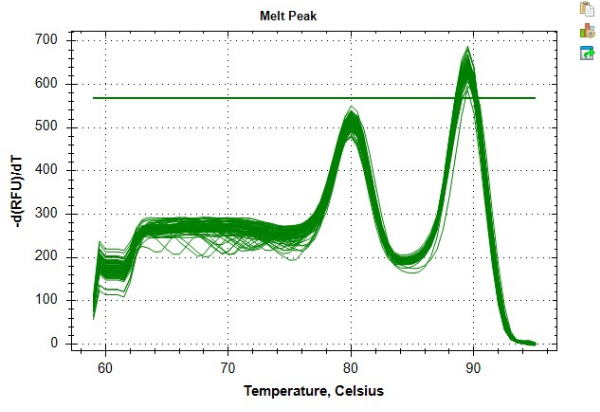
איור 8: עקומת התכה לדוגמה. עקומת התכה עבור נתונים לדוגמה כפי שנוצרו בתוכנה. השיא המוקדם יותר ~ 80 ° C מייצג את אמפליקון הטלומרים והשיא המשני ב ~ 89 ° C מייצג את אמפליקון אלבומין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
עבור פרויקט זה, יעילות הטלומרים הממוצעת הייתה 98.6% עם טווח של 90.7 עד 102.1 ויעילות האלבומין הממוצעת הייתה 102.3% עם טווח של 93.6 עד 108.2 בכל הריצות. היה ממוצע של 0.97 עותקים משוכפלים שהוסרו מהעקומות הסטנדרטיות, מה שעומד בקריטריוני QC של פרוטוקול זה. קורות החיים הבין-לוחית הממוצעים היו 1.83% עם SD של 0.00616 וקורות החיים התוך-לוחית הממוצעים היו 3.78% עם SD של 0.00658. ממוצע ה-TL עבור מדגמים מייצגים אלה מוצג בטבלה 4 ובטבלה 5. ה-TL הממוצע היה 1.37 עם SD של 0.24 וטווח של 0.84 עד 2.32. יחס T/S, SD, CV ו-TL עם ציון Z לכל מדגם מפורטים בטבלה 4. מכיוון שפלט יחס T/S של בדיקת MMqPCR הוא מדידה יחסית של TL, היחסים הפכו לציון Z זה כדי לאפשר השוואה צולבת. ICC עבור פרויקט זה חושב באמצעות סקריפט R כמתואר בהנחיות TRN הנמצאות בקובץ משלים 2, תוך התחשבות באפקטים של אצווה והפעלה20. על מנת לחשב את ה-ICC בתוך הפרויקט, הרצנו מחדש 10% מהדגימות החולפות, והקפדנו לאכלס את לוחות ICC בדגימה אחת לפחות מכל צלחת של הקבוצה. ICC הפרויקט הכולל של 0.801 [CI: 0.703, 0.86] מציין את יכולת השחזור הגבוהה של תוצאות TL.
לא כל התוצאות יהיו אופטימליות. התוצאות באיור 9 ובטבלה 7 מראות תוצאות תת-אופטימליות מבדיקת MMqPCR. איור 9 מציג עקומה סטנדרטית עם יעילות טלומרים מתחת ל-90%, שהיא מתחת לתקני QC, מה שמחייב חזרה על כל הצלחת. בעיות עם יעילות פריימר נובעות בדרך כלל מבעיה עם ריאגנטים, ולכן חשוב לעקוב אחר התאריכים שבהם ריאגנטים הם aliquoted ומתי הם פג כצעד ראשון בקביעה איזה מגיב אחראי על יעילות נמוכה. ריאגנטים שפג תוקפם צריכים להיות מוחלפים לפני הפעלת הצלחת שוב. טבלה 7 מציגה לוח שעבר את קריטריוני QC הראשוניים ברמת הדגימה, אך יש לו רמה גבוהה של שונות בין הלוחות, מה שמוביל לכשל QC ברמת הצלחת. השונות בין הצלחות נובעת בדרך כלל מטעויות בטכניקות הפיפטינג ומילוי הצלחות. במקרה זה, על הטכנאי להעריך את כל הבעיות שהתרחשו במהלך הגדרת הצלחת ולוודא שהפיפטות מכוילות אותן.
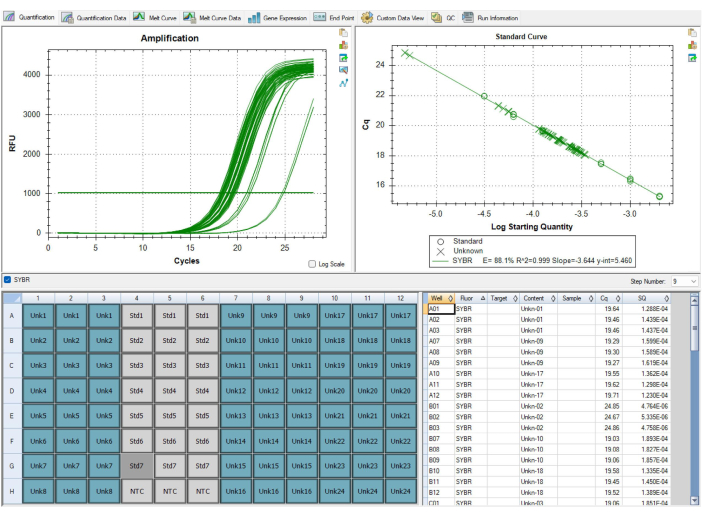
איור 9: תוצאות תת-אופטימליות. עקומה סטנדרטית זו המוצגת בתוכנה לא עברה QC, שכן יעילות ההגברה של פריימר הטלומרים הייתה פחות מ -90%. התמונה לקוחה מ-P1, אך ל-P2 הייתה יעילות נמוכה דומה. לא ניתן היה להשתמש בנתונים מריצה זו והיה צורך להפעיל שוב את כל הדגימות לאחר החלפת מגיב הסיבתי שפג תוקפו. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 7: תוצאות תת-אופטימליות. הטבלה מציגה את תבנית נתוני הטלומרים עבור ריצה שבה רבות מהדגימות לא עמדו בתקני QC. דוגמאות שהיה צורך להריץ מחדש נקבעו על סמך ערכי CV ואז שם המדגם שונה לגופן אדום לזיהוי קל. אנא לחץ כאן כדי להוריד טבלה זו.
קובץ משלים 1: תבנית גיליון אלקטרוני של נתוני Telomere. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 2: חישוב ICC. פרוטוקול זה נוצר על ידי רשת המחקר של טלומר (TRN). קובץ זה שונה מ-20. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 3: הנחיות דיווח TRN. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
השיטה הנפוצה ביותר למדידת TL במחקרים מבוססי אוכלוסייה גדולים יותר, לפני 2002, הייתה ניתוח הכתם הדרומי של אורכי שברי הגבלה טרמינליים (TRF)24,25. TRF, למרות שהוא מספק דיוק ויכולת שחזור מעולים במעבדות מיוחדות, מוגבל בתחולתו בשל כמות ואיכות הדנ"א הנדרש והתפוקה המוגבלת, ובכך מספק את הרקע לניצול מוגבר של מבחני TL מבוססי qPCR, ולאחר מכן מבחן MMqPCR. שיטת MMqPCR TL מספקת מדידת TL הניתנת לחזרה בעת הגדרה, אופטימיזציה ותחזוקה תוך תשומת לב קפדנית לכל קריטריוני QC. החישוב והדיווח של ICC הספציפי עבור כל קבוצה שנותחה נדרשים כדי להבטיח את אמינות הבדיקה. בעוד שהיא כפופה לאיכות ה- DNA ולמומחיות טכנית, שיטת MMqPCR מתאימה היטב למחקרים מבוססי אוכלוסייה גדולים החוקרים TL מכיוון שהיא דורשת כמויות קטנות של DNA, אמינה יותר מ- PCR יחיד, והיא יעילה יותר בעלויות מגיב וזמן טכנאי מאשר שיטות אחרות. היכולת ליצור ICCs גבוהים מספקת נתונים נוספים התומכים בשימוש ב- MMqPCR למחקרים מבוססי אוכלוסייה גדולים של TL. מדידת MMqPCR TL יכולה להיות מיושמת במגוון רחב של מחקרים המבקשים להגדיר את תפקידו של TL כסמן ביולוגי של תמותה מכל הסיבות, הזדקנות, מתח לכל החיים, חשיפות סביבתיות ותוצאי בריאות גופנית כגון מחלות לב וכלי דם וסרטן 4,7,8,10,11,12,13,26,27,28, 29,30,31.
מגבלה אחת של שיטת MMqPCR היא שהיא מדווחת על TL כיחס T/S, אומדן יחסי של אורך המשתנה בהתאם לבחירת גן עותק יחיד, הרכב תערובת אב ופרמטרים של מחזור PCR32. יחס T/S הוא חסר יחידה. לפיכך, ללא שילוב עם מתודולוגיות מדידה אחרות של TL, שיטה זו אינה מסוגלת לדווח על אומדנים בערכי זוגות בסיסים 18,33,34. כתוצאה מכך, יש להפוך את יחס T/S לציון Z כדי להיות רלוונטי בין מחקרים35. יש לנקוט משנה זהירות כאשר עושים זאת במעבדות, שיטות ובדיקות. יתר על כן, שיטה זו, כמו עם בדיקות הכלאה מבוססות ג'ל, יכול לכלול כימות של טלומרים interstitial. עם זאת, רצפים אלה מהווים חלק קטן מאוד מתכולת הדנ"א הכוללת של הטלומרים בכל גנום. בנוסף, רצפים טלומריים אינטרסטיציאליים נוטים יותר להכיל רצפי זוגות בסיסים שאינם תואמים אשר חורגים מחזרות הטלומרים הקנוניות, מה שמקטין את הסבירות לקשירה והגברה של פריימר. בנוסף, בעוד שהכמות המינימלית של DNA הדרושה לבדיקת MMqPCR היא יתרון, חשוב לציין כי מדידות מבוססות qPCR של TL מושפעות מגורמים פרה-אנליטיים המשפיעים על איכות ושלמות ה- DNA, כולל תנאי אחסון דגימות, מתודולוגיית מיצוי DNA ורקמות ביולוגיות36,37. הוכח כי בקרה אנליטית עבור גורמים אלה יכולה לשפר את התוקף החיצוני של מדידות TL שנוצרו באמצעות qPCR38. אף על פי כן, ההשפעה של הבדלים באיכות הדנ"א על TL הנוצרת על ידי בדיקת MMqPCR באופן ספציפי צריכה להיות מוערכת באופן שיטתי, מכיוון שלא קיימת הדרכה עדכנית מבוססת נתונים לקביעה אם דגימה היא באיכות מספקת כדי ליצור הערכה מדויקת של TL באמצעות גישה זו. למרות מגבלות אלה, היישומים של בדיקה זו למחקרים על תוצאות בריאותיות ברמת האוכלוסייה הם ניכרים.
בעת שימוש בבדיקת MMqPCR, נדרשת הערכה מתמדת של דיוק ותפוקה. כפי שתוכנן כעת, טכנאים מריצים טריפליקטים של דגימות בו זמנית על לוחות כפולים באמצעות שני thermocyclers. בהיעדר תרמוסייזרים מרובים, אנו ממליצים לשמור מדידות כפולות-משולשות ולוחות הפעלה ברצף לקבלת דיוק משופר גם במחיר של תפוקה מופחתת. כל החלטה לתעדף תפוקה על פני דיוק, למשל על ידי שימוש במדידות משולשות בודדות, צריכה להיות מלווה בבדיקה יסודית והערכה של ה- ICCs המתקבלים לפני שתמשיך בניתוח של דגימות אנליטיות. בעת קבלת החלטות לגבי תפוקה ודיוק, יש לקחת בחשבון את גודל הדגימה ואת איכות ה- DNA של הדגימה. גודל דגימה קטן יותר או דגימות דנ"א באיכות ירודה מחייבים מתן עדיפות לדיוק גבוה יותר23. יש לכך חשיבות גדולה עוד יותר בעבודה עם דגימות מקבוצות קשורות (למשל, בני משפחה, נבדקים עם נקודות זמן מרובות). במקרים אלה, תכנון זהיר, למשל הקצאת דגימות קשורות לאותה צלחת לפני תחילת הניסוי, הוא אחת הדרכים למנוע אובדן כוח סטטיסטי באמצעות קבוצה לא מכוונת על ידי בלבול לוחות.
לצורך בדיקה זו נעשה שימוש בספקטרופוטומטר להערכת איכות דגימת ה-DNA: דגימות בטווח של 1.6-2.0 עבור יחסים של 260/280 ו-2.0-2.2 עבור יחסים של 260/230 נחשבו מקובלות. הערכת איכות זו וההערכה המדויקת של DNA דו-גדילי באמצעות פלואורומטר הם שלבים קריטיים בפרוטוקול זה לקבלת נתוני TL הניתנים לחזרה. מדדים אחרים, תיאוריים יותר, של שלמות הדנ"א, כגון גודל המקטע ו / או מדדי סיכום של איכות ה- DNA שנקבעו באמצעות ג'ל אגרוז (למשל, מספר שלמות DNA) עשויים לשמש גם בקביעת איכות הדגימה38. כמו כן, אנו ממליצים כי דילול הדגימות יתרחש רק בזמן הכנת הדגימה להפעלת בדיקת MMqPCR. זה מבטיח כי aliquots DNA לעבור כמות מינימלית של מניפולציה לאחר מיצוי ככל האפשר, הפחתת השונות בטיפול לפני המבחן. אם יש צורך להעביר דגימות DNA, יש לשלוח אותן על קרח יבש בריכוז הגבוה ביותר האפשרי כדי למתן את ההתפרקות המתרחשת בדגימות DNA בריכוזים נמוכים יותר39,40. בשל השפלת הדנ"א המתרחשת במחזורי הקפאה-הפשרה, יש למזער את מספר הפשרות ההקפאה למלאי הדנ"א41. יש ליצור Aliquots של DNA הבקרה המאוגמת לפני הפעלת הקוהורט וליצור aliquots של דגימות DNA אנליטיות בודדות לפני הפעלת הבדיקה.
מדדי מפתח של ביצועי בדיקה ו- QC כוללים אות NTC, קורות חיים interplate ו- intraplate ועקומה סטנדרטית R2. אי עמידה בקריטריוני QC ניתן למתן במספר דרכים. שינוי מלאי PCR דרגה H2O באופן קבוע וציטוט של תת-מלאי PCR דרגה H2O עבור כל זוג לוחות לרוץ ימזערו את מקורות הזיהום, כמו גם הגברת NTC. צעדים נוספים להפחתת זיהום כוללים: הגדרת מכסה מנוע PCR ספציפי המוקדש לבדיקת MMqPCR בלבד; ניגוב מכסה המנוע והציוד של ה-PCR באמצעות תמיסת טיהור DNA; הקרנת החדר באור אולטרה סגול; ותרגול טכניקה סטרילית כאשר במכסה המנוע PCR. כדי לשפר את יכולת החזרה של הבדיקה ולהקטין את קורות החיים, מומלץ לבצע מערבולות דגימות, דילולים ורצועות PCR במרץ בשלבי המערבולת המתאימים להן ולהשהות מחדש ביסודיות בעת ביצוע דגימות DNA. עקומת R2 סטנדרטית מתחת לסף (<0.995) מיוחסת ככל הנראה לשגיאות צנרת במהלך טעינת לוחות. כדי להימנע מכך, שימו לב היטב לצנרת מדויקת וכיילו פיפטים מדי שנה, ערבבו במרץ רצועות PCR סטנדרטיות לפני הטעינה, וארגנו בזהירות חומרים מתכלים כדי לקדם זרימת עבודה יעילה. אם נצפה שימוש בשתי מכונות וצלחת אחת כדי להפיק קורות חיים גבוהים יותר באופן עקבי, יש לטפל במכונה כדרך פוטנציאלית להקל על הבעיה. לוחות QC מהיצרן צריכים להיות מופעלים על הצלחות באופן קבוע כדי להעריך את הביצועים של thermocycler.
אם הבעיות נמשכות גם לאחר יישום השלבים המומלצים לעיל, ניתן להשתמש בשלבים הבאים כדי לפתור את בעיות הפרוטוקול. שמירה על תיעוד של מתי כל הריאגנטים היו aliquoted וכל תאריכי התפוגה הרלוונטיים יכול לעזור לייעל את תהליך פתרון הבעיות כאשר קשיים מתעוררים באופן בלתי נמנע. חלק חשוב בכל תהליך פתרון בעיות הוא להתאים רק מגיב אחד בכל פעם כדי לקבוע את הגורם הספציפי לכך שצלחות לא עוברות את קריטריוני ה- QC, החל מגיב הזול ביותר המדובר. לדוגמה, אם גם לטלומרים וגם לגן עותק יחיד יש יעילות נמוכה, ריאגנטים משותפים כגון DTT, dNTPs, או SYBR aliquot הם הסיבה סביר יותר מאשר פריימרים ספציפיים לאמפליקון. במחיר הרשום, aliquots חדש צריך להיבדק בסדר של DTT, ולאחר מכן dNTPs, ולאחר מכן, אם הבעיה עדיין נמשכת, חדש SYBR aliquots. לעומת זאת, אם רק לאחד האמפליקונים (טלומרים או גן העתק יחיד) יש יעילות נמוכה, הגורם לקושי הוא סביר יותר לאחד הפריימרים. פענוח פסגות עקומת ההיתוך המוצגות באיור 8 יכול לשמש כמקור מידע מרכזי לפתרון בעיות. ניתן להשתמש בהדמיה של שתי פסגות עקומת ההתכה כדי לזהות בעיות פוטנציאליות במדגם מסוים, שכן מדגם בעיה בודד יבלוט מהמגמה הכללית של פסגות המוצגות על ידי תקנים או דגימות אנליטיות נותרות. עקומת ההתכה יכולה לשמש גם לאבחון בעיות בפריימר מסוים אם הפסגות של אמפליקון נתון הן באופן שיטתי פחות חדות מאחרות.
כתב יד זה מפרט כיצד להגדיר בהצלחה את בדיקת MMqPCR למדידת TL עם ישימות רחבה למחקר בריאות הציבור ומציג המלצות מרכזיות עבור QC ופתרון בעיות במטרה להגביר את הנגישות והאמינות של שיטה יעילה וחסכונית זו.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים רוצים להודות לוועדה המייעצת של רשת המחקר של טלומר ולמכון הלאומי להזדקנות / המכון הלאומי למדעי בריאות הסביבה (U24 AG066528 ו-U24 AG066528-S1) שאפשרו עבודה זו.
Materials
| Name | Company | Catalog Number | Comments |
| 0.5mL Tubes | USA Scientific | 1605-0099 | Seal-Rite 0.5mL Microcentrifuge Tubes, Sterile Storage Temperature and Conditions: Room temperature |
| 1.5mL Tubes | USA Scientific | 1615-5599 | Seal-Rite 1.5mL Microcentrifuge Tubes, Sterile Storage Temperature and Conditions: Room temperature |
| 100mM DTT | In House | Not Applicable | Made with stock DTT, diluted sodium acetate, and PCR Grade H2O Storage Temperature and Conditions: minus 20 °C |
| 15mL Tubes | Thermo Fisher | 14-959-53A | Corning 352196 Falcon 15mL Conical Centrifuge Tubes Storage Temperature and Conditions: Room temperature |
| 1M MgCl2 | Thermo Fisher | 50152107 | Biotang Inc 1M MgCl2 1M Magnesium Chloride Solution, Prepared in 18.2 Megohms Water and Filtered through 0.22 Micron Filter Storage Temperature and Conditions: 4 °C |
| 1x Gold Buffer | In House | Not Applicable | 10X Gold Buffer diluted with PCR Grade H2O Storage Temperature and Conditions: minus 20 °C |
| 25mM dNTPs | New England BioLabs | N0446S | Deoxynucleotide Solution Set Storage Temperature and Conditions: minus 20 °C |
| 5mL Tubes | Thermo Fisher | 3391276 | Argos Technologies Microcentrifuge Tubes – 5mL Storage Temperature and Conditions: Room temperature |
| 96 Well Plate | Bio-Rad | HSP9601 | Hard-Shell 96-Well PCR Plates, Low Profile, Thin Wall, Skirted, White / Clear Storage Temperature and Conditions: Room temperature |
| Aluminum Foil | Office Depot | 3489072 | Reynolds Wrap Stanard Aluminum Foil Roll, 12" x 75', Silver Storage Temperature and Conditions: Room temperature |
| AmpliTaq Gold Kit – Polymerase and Buffer | Thermo Fisher | 4311806 | AmpliTaq Gold DNA Polymerase with Gold Buffer and MgCl2 (MgCl2 in this kit is not used), 10X Gold Buffer, 2.5U AmpliTaq Gold Polymerase Storage Temperature and Conditions: minus 20 °C |
| Betaine | Thermo Fisher | AAJ77507AB | Betaine, 5M Solution, Molecular Biology Grade, Ultrapure, 10mL Storage Temperature and Conditions: minus 20 °C |
| Big Tube Rack | Thermo Fisher | 344817 | Fisherbrand 4-Way Tube Rack Storage Temperature and Conditions: Room temperature |
| CFX Maestro Software | Bio-Rad | 12004110 | Software for real-time PCR plate setup, data collection, statistics, and graphiing of results Storage Temperature and Conditions: Room temperature |
| CFX96 Optical Reaction Module for Real-Time PCR Systems with Starter Package | Bio-Rad | 1845096 | 96-well optical module for real-time PCR Storage Temperature and Conditions: Room temperature |
| DTT | Fisher Scientific | AAJ1539706 | Dithiothreitol, >99.5+ Molecular Biology Grade, 5 g Storage Temperature and Conditions: minus 20 °C |
| ELIMINase | Fisher Scientific | 04-355-32 | ELIMINase Laboratory Decontaminant Storage Temperature and Conditions: Room temperature |
| HEPA Filter | USA Scientific | Replacement Filters | High-Efficiency Particulate Air Filter for AirClean Workstations Storage Temperature and Conditions: Room temperature |
| Kimwipes | Thermo Fisher | 06666A | Kimberly-Clark Professional Kimtech Science Kimwipes Delicate Task Wipers, 1-Ply Storage Temperature and Conditions: Room temperature |
| Loading Trough | Thermo Fisher | 14387069 | Thermo Scientific Matrix Reagent Reservoirs Storage Temperature and Conditions: Room temperature |
| Microsoft Excel | Microsoft | Not Applicable | Microsoft 365 package, Excel software application Storage Temperature and Conditions: Room temperature |
| Mini Centrifuge | Genesee Scientific | 31-500B | Poseidon 31-500B Mini Centrifuge, Blue Lid Storage Temperature and Conditions: Room temperature |
| PCR Grade H2O | Thermo Fisher | AM9937 | Nuclease-Free Water (not DEPC-Treated) Storage Temperature and Conditions: Room temperature |
| PCR Hood | USA Scientific | 4263-2588 | Nucleic Acid Workstation with HEPA Filtration, AirClean Systems Combination PCR Workstation Storage Temperature and Conditions: Room temperature |
| PCR Strips | Thermo Fisher | AB0776 | Low Profile Tubes and Flat Caps, Strips of 8 Storage Temperature and Conditions: Room temperature |
| PCR Tube Rack | Thermo Fisher | 344820 | Fisherbrand 96-Well PCR Tube Rack Storage Temperature and Conditions: Room temperature |
| Pipette Tips (Multichannel) | Ranin | 17005860 | Pipette Tips SR LTS 20µL F 960A/5, 20µL Maximum Storage Temperature and Conditions: Room temperature |
| Pipette Tips (Single Channel) | USA Scientific | 1181-3850 | 10µL Graduated TipOne RPT Filter Tips Storage Temperature and Conditions: Room temperature |
| Pipette Tips (Single Channel) | USA Scientific | 1180-1850 | 20µL Beveled TipOne RPT Filter Tips Storage Temperature and Conditions: Room temperature |
| Pipette Tips (Single Channel) | USA Scientific | 1111-0880 | 200µL Natural TipOne Pipette Tips in Racks Storage Temperature and Conditions: Room temperature |
| Pipette Tips (Single Channel) | USA Scientific | 1111-2890 | 1000µL Natural Graduated TipOne Pipette Tips in Racks Storage Temperature and Conditions: Room temperature |
| Pipettors (Multichannel) | Ranin | 17013802 | Pipet-Lite Multi Pipette L8-10XLS, 0.5 to 10µL Storage Temperature and Conditions: Room temperature |
| Pipettors (Multichannel) | Ranin | 17013803 | Pipet-Lite Multi Pipette L8-20LS+, 2 to 20µL Storage Temperature and Conditions: Room temperature |
| Pipettors (Single Channel) | Thermo Fisher | F144802G | Gilson Pipetman Classic Pipets, 1 to 10µL Storage Temperature and Conditions: Room temperature |
| Pipettors (Single Channel) | Thermo Fisher | F123600 | Gilson Pipetman Classic Pipets, 2 to 20µL Storage Temperature and Conditions: Room temperature |
| Pipettors (Single Channel) | Thermo Fisher | F123601 | Gilson Pipetman Classic Pipets, 20 to 200µL Storage Temperature and Conditions: Room temperature |
| Pipettors (Single Channel) | Thermo Fisher | F123602 | Gilson Pipetman Classic Pipets, 200 to 1000µL Storage Temperature and Conditions: Room temperature |
| Plate Sealing Film | Bio-Rad | MSB1001 | Microseal “B” PCR Plate Sealing Film, Adhesive, Optical Storage Temperature and Conditions: Room temperature |
| Plate Spinner | Thermo Fisher | 14-100-141 | Fisherbrand Mini Plate Spinner Centrifuge, 230 V Storage Temperature and Conditions: Room temperature |
| Pre-Hood Filter | USA Scientific | 4235-3724 | Prefilter for AirClean Systems Workstations Storage Temperature and Conditions: Room temperature |
| R Software | The R Project for Statistical Computing | Not Applicable | R version 4.2.2 Storage Temperature and Conditions: Room temperature |
| Scale | Thermo Fisher | 01-922-329 | OHAUS 30430060 PR Series Analytical Balance, 62g Capacity Storage Temperature and Conditions: Room temperature |
| Scissors | Office Depot | 458612 | Office Depot Brand Scissors, 8”, Straight, Black, Pack of 2 Storage Temperature and Conditions: Room temperature |
| Sharpies | Sharpie | 2151734 | Brush Twin Permanent Markers, Black Storage Temperature and Conditions: Room temperature |
| Single Copy Gene Forward Primer | Integrated DNA Technologies | Custom | See separate table Storage Temperature and Conditions: minus 20 °C when rehydrated |
| Single Copy Gene Reverse Primer | Integrated DNA Technologies | Custom | See separate table Storage Temperature and Conditions: minus 20 °C when rehydrated |
| Small Tube Rack | Thermo Fisher | 21-402-17 | Thermo Fisher 8601 Reversible Microtube Racks with Lid Storage Temperature and Conditions: Room temperature |
| Sodium Acetate | Thermo Fisher | J63560.EQE | 3M NaOAc pH 5.2 Storage Temperature and Conditions: Room temperature |
| Stainless Steel Spatula | Thermo Fisher | 3990240 | Bel-Art SP Scienceware Stainless-Steel Sampling Spoon and Spatula Storage Temperature and Conditions: Room temperature |
| SYBR Green | Thermo Fisher | S7563 | SYBR Green I Nucleic Acid Gel Stain – 10,000X Concentrate in DMSO Storage Temperature and Conditions: minus 20 °C when rehydrated |
| Syringe Filters | Fisher Scientific | 09-927-55A | GD/X 25 mm Sterile Syringe Filter, cellulose acetate filtration medium, 0.2 μm Storage Temperature and Conditions: Room temperature |
| Syringes | Thermo Fisher | 148232A | BD Luer-Lok Disposable Syringes without Needles, 10mL Storage Temperature and Conditions: Room temperature |
| TE Buffer | Fisher Scientific | BP2474100 | TE Buffer, Tris-EDTA, 1X Solution, pH 7.6, Molecular Biology, Fisher BioReagents Storage Temperature and Conditions: Room temperature |
| Telomere Forward Primer | Integrated DNA Technologies | Custom | See separate table Storage Temperature and Conditions: minus 20 °C when rehydrated |
| Telomere Reverse Primer | Integrated DNA Technologies | Custom | See separate table Storage Temperature and Conditions: minus 20 °C when rehydrated |
| UV Light | USA Scientific | 4288-2540 | UV Light Bulb for Workstations Storage Temperature and Conditions: Room temperature |
| Vortex | Thermo Fisher | 14-955-151 | Fisherbrand Mini Vortex Mixer, 115 V, 50/60 Hz Storage Temperature and Conditions: Room temperature |
| Weigh Boat | Thermo Fisher | 01-549-752 | Fisherbrand Sterile Hexagonal Weighing Boat, 10mL Storage Temperature and Conditions: Room temperature |
References
- Hemann, M., Strong, M., Hao, L., Greider, C. The shortest telomere, not average telomere length, is critical for cell viability and chromosome stability. Cell. 107 (1), 67-77 (2001).
- Xu, L., Li, S., Stohr, B. A. The role of telomere biology in cancer. Ann Rev Pathol: Mech Dis. 8, 49-78 (2013).
- Lindrose, A., Drury, S. Minimum reporting recommendations for pcr-based telomere length measurement. Telomere Research Network. , (2020).
- Verhulst, S., et al. Commentary: The reliability of telomere length measurements. Int J Epidemiol. 44 (5), 1683-1686 (2015).
- Aubert, G., Hills, M., Lansdorp, P. M. Telomere length measurement-caveats and a critical assessment of the available technologies and tools. Mutat Res. 730 (1-2), 59-67 (2012).
- Mundstock, E., et al. Effect of obesity on telomere length: Systematic review and meta-analysis. Obesity. 23 (11), 2165-2174 (2015).
- Haycock, P. C., et al. Leucocyte telomere length and risk of cardiovascular disease: Systematic review and meta-analysis. BMJ. 349, 4227(2014).
- Astuti, Y., Wardhana, A., Watkins, J., Wulaningsih, W. Cigarette smoking and telomere length: A systematic review of 84 studies and meta-analysis. Environ Res. 158, 480-489 (2017).
- Ridout, K. K., Ridout, S. J., Price, L. H., Sen, S., Tyrka, A. R. Depression and telomere length: A meta-analysis. J Affect Disord. 191, 237-247 (2016).
- Wang, Q., Zhan, Y., Pedersen, N. L., Fang, F., Hägg, S. Telomere length and all-cause mortality: A meta-analysis. Ageing Res Rev. 48, 11-20 (2018).
- Hu, R., Hua, X. G., Jiang, Q. C. Associations of telomere length in risk and recurrence of prostate cancer: A meta-analysis. Andrologia. 51 (7), e13304(2019).
- Schneider, C. V., et al. Association of telomere length with risk of disease and mortality. JAMA Inter Med. 182 (3), 291-300 (2022).
- Deng, Y., et al. Telomere length and the risk of cardiovascular diseases: A mendelian randomization study. Front Cardiovasc Med. 9, 1012615(2022).
- D'mello, M. J., et al. Association between shortened leukocyte telomere length and cardiometabolic outcomes: Systematic review and meta-analysis. Circulation: Cardiovasc Gene. 8 (1), 82-90 (2015).
- Wilbourn, R. V., et al. The relationship between telomere length and mortality risk in non-model vertebrate systems: A meta-analysis. Philos Trans R Soc Lond B Biol Sci. 373 (1741), 20160447(2018).
- Gardner, M., et al. Gender and telomere length: Systematic review and meta-analysis. Exp Gerontol. 51, 15-27 (2014).
- Lai, T. -P., Wright, W. E., Shay, J. W. Comparison of telomere length measurement methods. Philos Trans R Soc Lond B Biol Sci. 373 (1741), 20160451(2018).
- Cawthon, R. Telomere measurement by quatitative pcr. Nuc Acid Res. 30 (10), e47-e53 (2002).
- Cawthon, R. M. Telomere length measurement by a novel monochrome multiplex quantitative pcr method. Nuc Acid Res. 37 (3), e21-e21 (2009).
- Lindrose, A. R., et al. Method comparison studies of telomere length measurement using qpcr approaches: A critical appraisal of the literature. PLoS One. 16 (1), e0245582(2021).
- Lin, J., et al. Effects of DNA extraction, DNA integrity, and laboratory on the precision of qpcr-based telomere length measurement - a multi-lab impartial study. bioRxiv. , (2022).
- Wilfinger, W. W., Mackey, K., Chomczynski, P. Effect of ph and ionic strength on the spectrophotometric assessment of nucleic acid purity. Biotechniques. 22 (3), 474-481 (1997).
- Boesenberg-Smith, K. A., Pessarakli, M. M., Wolk, D. M. Assessment of DNA yield and purity: An overlooked detail of pcr troubleshooting. Clin Microbiol Newsletter. 34 (1), 1-6 (2012).
- Harley, C. B., Futcher, A. B., Greider, C. W. Telomeres shorten during ageing of human fibroblasts. Nature. 345 (6274), 458-460 (1990).
- Kimura, M., et al. Measurement of telomere length by the southern blot analysis of terminal restriction fragment lengths. Nat Protoc. 5 (9), 1596-1607 (2010).
- Ye, Q., et al. Telomere length and chronological age across the human lifespan: A systematic review and meta-analysis of 414 study samples including 743,019 individuals. Ageing Res Rev. 90, 102031(2023).
- Axelrad, M. D., Budagov, T., Atzmon, G. Telomere length and telomerase activity; a yin and yang of cell senescence. J Vis Exp. (75), e50246(2013).
- Liu, M., et al. Immune-mediated inflammatory diseases and leukocyte telomere length: A mendelian randomization study. Front Genetics. 14, 1129247(2023).
- Van Ockenburg, S., et al. Stressful life events and leukocyte telomere attrition in adulthood: A prospective population-based cohort study. Psychol Med. 45 (14), 2975-2984 (2015).
- Zong, Z. Q., et al. Ambient air pollution exposure and telomere length: A systematic review and meta-analysis. Public Health. 215, 42-55 (2023).
- Tang, L., Li, D., Wang, J., Su, B., Tian, Y. Ambient air pollution, genetic risk and telomere length in uk biobank. J Expo Sci Environ Epidemiol. , (2023).
- Aubert, G., Hills, M., Lansdorp, P. Telomere length measurement-caveats and a critical assessment of the available technologies and tools. Mutat Res. 730 (1), 59-67 (2012).
- Lin, J., et al. Systematic and cell type-specific telomere length changes in subsets of lymphocytes. J Immunol Res. 2016, 5371050(2016).
- Needham, B. L., et al. Socioeconomic status, health behavior, and leukocyte telomere length in the national health and nutrition examination survey, 1999-2002. Soc Sci Med. 85, 1-8 (2013).
- Verhulst, S. Improving comparability between qpcr-based telomere studies. Mol Ecol Res. 20 (1), 11-13 (2020).
- Dagnall, C. L., et al. Effect of pre-analytic variables on the reproducibility of qpcr relative telomere length measurement. PloS one. 12 (9), e0184098(2017).
- Lin, J., Smith, D. L., Esteves, K., Drury, S. Telomere length measurement by qpcr-summary of critical factors and recommendations for assay design. Psychoneuroendocrinology. 99, 271-278 (2019).
- Wolf, S. E., et al. Cross-tissue comparison of telomere length and quality metrics of DNA among individuals aged 8 to 70 years. PLOS One. 19 (2), e0290918(2024).
- RoDer, B., FruHwirth, K., Vogl, C., Wagner, M., Rossmanith, P. Impact of long-term storage on stability of standard DNA for nucleic acid-based methods. J Clin Microbiol. 48 (11), 4260-4262 (2010).
- Dagnall, C., et al. Effect of pre-analytic variables on the reproducibility of qpcr relative telomere length measurement. PLoS One. 12 (9), e0184098(2017).
- Shao, W., Khin, S., Kopp, W. C. Characterization of effect of repeated freeze and thaw cycles on stability of genomic DNA using pulsed field gel electrophoresis. Biopreserv Biobank. 10 (1), 4-11 (2012).
- Institute for Statistics and Mathematics of WU. The Comprehensive R Archive Network. , Available from: https://cran.r-project.org/ (2024).
- Nakagawa, S., Schielzeth, H. Repeatability for Gaussian and non-Gaussian data: a practical guide for biologists. Biol Rev. 85 (4), 935-956 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved