Method Article
Монохромное мультиплексное количественное измерение длины теломер ПЦР
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы представляем протокол измерения относительной длины теломер (TL) с использованием монохромного мультиплексного количественного анализа полимеразной цепной реакции (MMqPCR). Анализ MMqPCR является воспроизводимым, эффективным и экономичным методом измерения TL из ДНК человека в популяционных исследованиях.
Аннотация
Теломеры — это рибонуклеопротеиновые структуры в конце всех эукариотических хромосом, которые защищают ДНК от повреждений и сохраняют стабильность хромосом. Длина теломер (TL) связана с различными воздействиями, биологическими процессами и последствиями для здоровья. В данной статье описывается протокол монохромного мультиплексного количественного полимеразного цепного реакции (MMqPCR), который обычно проводится в нашей лаборатории для измерения относительного среднего TL из ДНК человека. Существует несколько различных методов измерения ТЛ на основе ПЦР, но конкретный протокол для метода MMqPCR, представленный в этой публикации, является повторяемым, эффективным, экономически эффективным и подходит для популяционных исследований. В этом подробном протоколе изложена вся информация, необходимая исследователям для проведения этого анализа в своей лаборатории. Кроме того, этот протокол предусматривает конкретные шаги по повышению воспроизводимости измерения TL с помощью этого анализа, определяемого внутриклассовым коэффициентом корреляции (ICC) при повторных измерениях одного и того же образца. ICC является критическим фактором при оценке ожидаемой мощности для конкретной исследуемой популяции; таким образом, предоставление ИКХ, специфичных для когорты, для любого анализа ТЛ является необходимым шагом для повышения общей строгости популяционных исследований ТЛ. Примеры результатов с использованием образцов ДНК, извлеченных из мононуклеарных клеток периферической крови, демонстрируют возможность получения высоковоспроизводимых данных TL с использованием этого протокола MMqPCR.
Введение
Теломеры представляют собой защитные комплексы, обнаруженные в конце всех эукариотических хромосом, состоящие из высококонсервативных, повторяющихся последовательностей ДНК и связанных с ними белков. Теломера защищает целостность ДНК, сохраняя стабильность хромосом. Прогрессирующее укорочение теломер происходит в делящихся клетках в результате неполного синтеза ДНК с отстающей цепью, повреждения ДНК и других факторов 1,2. Увеличение количества доказательств в пользу длины теломер (ТЛ) в качестве биомаркера старения и возрастных заболеваний на протяжении всей жизни человека сопровождалось увеличением числа типов анализов измерения ТЛ, используемых для оценки роли ТЛ в исследованиях воздействия на человека, болезней и здоровья 3,4,5. Метаанализы показали связь ТЛ с общей смертностью, воздействием окружающей среды и последствиями для здоровья, включая рак, сердечно-сосудистые заболевания и диабет 6,7,8,9,10,11,12,13 . Эти метаассоциации вытекают из исследований с использованием одной из более чем двух десятков различных методологий измерения TL, где сила ассоциаций, как правило, варьируется между различными методологиями. Выбор оптимального метода измерения TL для научного исследования является важным шагом для обеспечения точных результатов, поскольку каждый метод имеет свои преимущества и недостатки 5,17.
Из-за относительно низкой стоимости реагентов, быстрого выполнения анализа, масштабируемости и более низкой потребности в исходной ДНК методы измерения TL на основе ПЦР часто предпочтительно используются при проведении исследований с большими выборочными популяциями, исследованиях с ограниченным доступом к образцам с высокой концентрацией ДНК или исследованиях с приоритетом высокой производительности. Первый метод измерения TL на основе ПЦР, одноплексная количественная полимеразная цепная реакция (кПЦР), первоначально разработанный Ричардом Коутоном, использует соотношение флуоресцентных сигналов амплификации теломер (T) и гена (S) с одной копией, выполняемых на отдельных ПЦР-планшетах18. В этом подходе праймеры, комплементарные повторяющимся последовательностям теломерной ДНК (Т), используются для амплификации общего содержания теломерной ДНК в образце и количественно определяются путем детектирования флуоресцентного репортера SYBR green. Аналогичным образом, праймеры, комплементарные межгенному участку консервативного гена с одной копией (S), используются для количественной оценки числа копий генома. Эти две оценки количественно оцениваются относительно стандартной кривой геномной ДНК, используемой во всех анализах в проекте по контролю вариаций от пластины к пластине. Деление общего теломерного ДНК (Т) на число копий одного генома (S) дает отношение Т/С, безразмерное, относительное измерение, представляющее среднее содержание теломера на клетку для отдельного образца ДНК 18,19. Таким образом, отношение T/S не является специфическим измерением функциональной длины; однако, в соответствии с литературными нормами, мы используем термин «среднее TL на выборку» во всем этом протоколе.
Этот метод был усовершенствован в 2009 году, когда Ричард Коутон описал монохромный мультиплексный анализ количественной ПЦР (MMqPCR) как подход к потенциальному снижению вариабельности отношения Т/С по сравнению с оригинальным методом одиночной количественной ПЦР19. Анализ MMqPCR обладает преимуществами анализа qPCR с дополнительным преимуществом, заключающимся в измерении сигналов T и S в одной и той же реакционной лунке с использованием одного отчетного флуорофора, тем самым уменьшая ошибку по сравнению с одноплексной кПЦР и приводя к более высокой точности ивоспроизводимости19. Кроме того, этот мультиплексный метод потенциально снижает затраты и повышает производительность, поскольку требуется вдвое меньше реакций по сравнению с одноплексным анализом19.
Учитывая преимущества измерения TL методом MMqPCR, этот метод хорошо подходит для популяционных исследований ассоциаций TL с воздействием, последствиями для здоровья и биологическими процессами. Тем не менее, запуск метода может быть сложной задачей. Чтобы решить эти проблемы, мы подробно описываем протокол измерения MMqPCR TL, используемый в нашей лаборатории, выделяя ключевые шаги, предпринятые для повышения точности анализа, снижения риска загрязнения и улучшения повторяемости.
Кроме того, в этом протоколе описываются шаги по очистке данных и расчету внутриклассового коэффициента корреляции (ICC), важного статистического показателя воспроизводимости измерений TL2. С помощью наших репрезентативных результатов мы демонстрируем возможность генерации высоких ICC с использованием этого протокола. Кроме того, мы определяем меры контроля качества (QC) и устранения неполадок, которые, как ожидается, уменьшат вариацию в измерениях TL и увеличат результирующий ICC. Благодаря высокой повторяемости, эффективности и экономичности этого метода, измерение TL методом MMqPCR идеально подходит для эпидемиологических исследований TL. На рисунке 1 представлен визуальный обзор метода MMqPCR, описанного в этом протоколе.
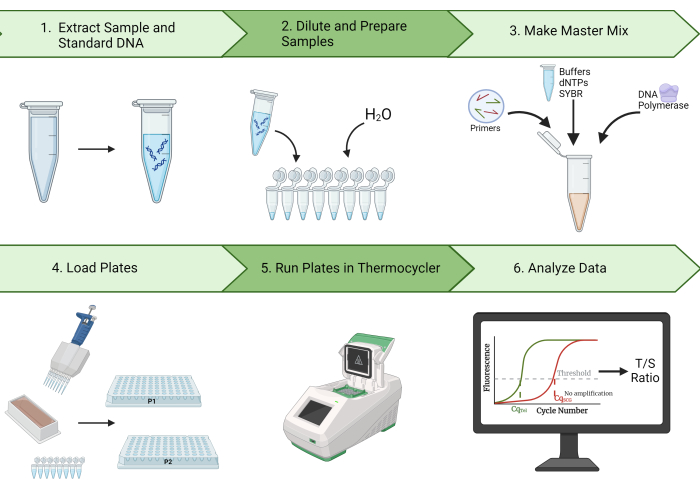
Рисунок 1: Обзор метода. Широкий обзор метода монохромной мультиплексной количественной полимеразной цепной реакции для измерения длины теломер. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
протокол
Данное исследование проводилось в соответствии с институциональными рекомендациями. Этот протокол описывает анализ MMqPCR, проведенный на глубине измерения дубликатов трипликатов, т.е. тройные измерения каждого образца, повторяющиеся на дубликатных планшетах, реализованные с использованием двух термоамплификаторов одновременно для повышения производительности. Использование дубликатов номерных знаков является основным соображением, учитываемым при реализации данного протокола для достижения высокой воспроизводимости, о чем свидетельствуют высокие ICC. Несмотря на то, что можно использовать меньшее количество повторов, влияние на ICC и, следовательно, на мощность и необходимый размер выборки необходимо тщательно учитывать и измерять с каждой когортой вкаждой лаборатории. Если доступен только один амплификатор, мы рекомендуем сохранить глубину измерения (т. е. дублировать тройки) и запустить 2 пластины последовательно.
1. Заготовка и условия хранения
- Для получения информации обо всех материалах и оборудовании, используемых для этого протокола, см. Таблицу материалов. Кроме того, конкретные реагенты и количества, использованные для анализа MMqPCR, см. в таблице 1. При последовательном использовании двух планшетов следует уменьшить объем основной смеси в два раза меньше, сохраняя при этом концентрацию, гарантируя, что одни и те же аликвоты реагентов будут использоваться на последовательных планшетах одного и того же анализа.
ПРИМЕЧАНИЕ: Все стандартные реактивы должны быть подготовлены заранее, а аликвотированные реагенты должны быть полностью разморожены перед использованием. - Аликвоту и хранить 1x Tris-EDTA, pH 7,6 (TE) в пробирках по 5 мл в объемах 3 мл при комнатной температуре до 2 лет.
- Аликвотировать и хранить 5 М бетаина в пробирках по 5 мл объемом 1 280 мкл при температуре -20 °C до 1 года.
- Аликвотировать и хранить SYBR Green в объемах 3 мкл в отдельных ПЦР-стрип-пробирках при температуре -20 °C до 2 лет, накрыв фольгой и минимально подвергаясь воздействию света.
- Хранить ДНК-полимеразу в оригинальных пробирках при температуре -20 °C до 1 года.
- Аликвотировать и хранить 10-кратный полимеразный буфер в пробирках объемом 1,5 мл объемом 660 мкл при -20 °C до 1 года.
- Для 1х буферных разведений 10-кратного полимеразного буфера добавьте 9,9 мкл 10-кратного буфера к 89,1 мкл ПЦР класса H2O в пробирках объемом 0,5 мл; хранить при температуре -20 °C до 1 года.
- Аликвотировать и хранить 1 М MgCl2 в пробирках по 0,5 мл объемом 70 мкл при температуре 4 °C на расстоянии от света до 1 года.
- Храните прямые и обратные теломеры (Т) и одиночные (S) копии гена олигонуклеотидных лиофилизированных праймеров при комнатной температуре вдали от света. Четыре специфические последовательности олигонуклеотидных праймеров представлены в таблице 2.
ПРИМЕЧАНИЕ: Единственной копией гена в этом протоколе является альбумин; При выборе другого гена с одной копией, возможно, потребуется скорректировать концентрацию праймера для обеспечения приемлемой эффективности ПЦР.- Восстановление праймера: Сделайте каждую пробирку лиофилизированной праймерной в течение 10 с, а затем поместите пробирки в мини-центрифугу на 5 с, чтобы убедиться, что лиофилизированная гранула находится на дне пробирки, прежде чем добавить 1x TE буфер.
- Проверьте каждую отдельную пробирку праймера на концентрацию нМ ([нМ] = альфа) и регидратируйте каждую пробирку праймера, добавив 1x TE, равный 10x альфа-значению в мкл (например, если концентрация нМ на пробирке составляет 24,6 нМ, добавьте 246 мкл 1x TE в праймерную пробирку), чтобы получить 100 мкМ раствор каждого праймера.
- Прямые и обратные теломерные праймеры выделяют отдельно в объеме 16 мкл и прямые и обратные праймеры альбумина отдельно в объеме 11 мкл. Хранить все четыре вида аликвот праймера при температуре -20 °C до 6 месяцев.
- Смесь dNTP: Вихревые 4-8 пробирок каждого из четырех типов dNTPS по 25 мМ исходных растворов (т.е. всего 16-32 пробирки) в течение 10 с с последующим быстрым отжимом при комнатной температуре с помощью мини-центрифуги. Поместите пробирки равномерным распределением по пробиркам в мини-центрифуге, а затем закройте крышку, чтобы позволить машине набрать полную скорость, вращаясь около 5 с.
- В пробирку объемом 5 мл добавьте по 200-250 мкл из каждой пробирки, убедившись, что добавлены равные части каждого из четырех типов dNTP, и сделайте смесь dNTP вихревой.
- Аликвоту 210 мкл смеси в пробирки по 0,5 мл и хранить при -20 °С до 1 года.
- Хранить на складе DTT при -20 °C и на складе 3 М ацетата натрия при комнатной температуре.
- Решение DTT: отмерьте 0,1545 г DTT в тарированной весовой лодке на весах с помощью шпателя из нержавеющей стали.
ВНИМАНИЕ: Дитиотреитол (ДТТ) является опасным реагентом. СОИДН вреден при проглатывании, вызывает раздражение кожи и может привести к серьезному повреждению глаз. При работе с DTT следует носить защитные перчатки, средства защиты глаз и лица. Кроме того, следует избегать вдыхания паров ДТТ, работать в ПЦР-колпаке при работе с ДТТ и избегать длительного или повторного воздействия. - Приготовьте 10 мл 0,01 М ацетата натрия, добавив 33,33 мкл 3 М ацетата натрия и 9 967 мкл ПЦР класса H2O в пробирку объемом 15 мл и вихревую лунку. Добавьте измеренный DTT в пробирку объемом 15 мл с 0,01 М ацетата натрия. Перелейте примерно 100 мкл 0,01 М раствора ацетата натрия в весовую лодку для сбора остатков DTT. Наберите пипетку объемом 100 мкл обратно в пробирку объемом 15 мкл. Как только весь DTT окажется в растворе, переведите трубку в вихрь до полного растворения.
- Вылейте содержимое пробирки объемом 15 мл в загрузочный желоб, отасуньте весь раствор в пластиковый шприц объемом 10 мл с одного конца загрузочного желоба. Приложите стерильный шприцевой фильтр из ацетата целлюлозы 0,2 мкм на 25 мм к концу заполненного шприца, дайте полностью пропитаться в течение 1 минуты и медленно капните раствор в новую пробирку объемом 15 мл, слегка надавливая на поршень шприца вниз, следя за тем, чтобы весь раствор капал через фильтр в новую пробирку объемом 15 мл.
- Аликвот DTT раствор в объемах 200 мкл в пробирках объемом 0,5 мл и хранить при -20 °C до 6 недель.
- Решение DTT: отмерьте 0,1545 г DTT в тарированной весовой лодке на весах с помощью шпателя из нержавеющей стали.
Таблица 1: Конечные объемы и концентрации реагентов. Объемы и концентрации реагентов в отдельных аликвотах, мастер-смеси, а также в ПЦР-лунках. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Теломеры и последовательности олигонуклеотидных праймеров гена с одной копией. Список последовательностей праймеров генов теломер и альбумина с одной копией, используемых в методике. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
2. Экстракция геномной ДНК и подготовка образцов
- Экстракция аналитических образцов: Проведите экстракцию геномной ДНК для образцов в соответствии с рекомендациями производителя с использованием наборов или установленных методов в лаборатории.
- Проверьте качество образца ДНК с помощью спектрофотометра и двухцепочечной ДНК (дцДНК) с помощью флуориметра. Образцы с неприемлемыми средними соотношениями 260/280 и 260/230 или концентрацией дцДНК ниже обнаруженной (<0,20 нг/мкл) не следует анализировать на TL22,23. Кроме того, если концентрация дцДНК слишком высока для получения показаний с помощью флуориметра (>1000 нг/мкл), разбавьте образец и повторите анализ.
Примечание: Для представленных здесь результатов приемлемыми значениями чистоты нуклеиновых кислот были соотношение 260/280 от 1,6 до 2,0 и соотношение 260/230 от 2,0 до 2,2.
- Проверьте качество образца ДНК с помощью спектрофотометра и двухцепочечной ДНК (дцДНК) с помощью флуориметра. Образцы с неприемлемыми средними соотношениями 260/280 и 260/230 или концентрацией дцДНК ниже обнаруженной (<0,20 нг/мкл) не следует анализировать на TL22,23. Кроме того, если концентрация дцДНК слишком высока для получения показаний с помощью флуориметра (>1000 нг/мкл), разбавьте образец и повторите анализ.
- Экстракция контрольных образцов: Проведение экстракции геномной ДНК контрольного образца, полученного из того же биологического материала, что и испытуемые образцы, анализируемые для данного проекта. Убедитесь, что вы извлекли достаточное количество контрольной ДНК для всех планшетов, которые должны быть запущены для всей когорты, чтобы для всех анализов использовался единый стандарт ДНК.
- Проверьте качество контрольного образца ДНК с помощью спектрофотометра и флуориметра. Контрольный образец должен иметь приемлемые средние соотношения 260/280 и 260/230 и определяемые концентрации дцДНК22,23.
- Аликвота контрольной ДНК в концентрации 2 нг/мкл в 150 мкл в количествах 0,5 мл в пробирках маркируется типом образца и датой. Храните контрольные аликвоты ДНК при температуре -20 °C до 5 лет. Используйте один контрольный образец ДНК для всех пластин всех образцов из одной когорты или исследовательского проекта. Подготовьте эти аликвоты заранее.
- Подготовка аналитических образцов: Для образцов с начальной концентрацией >5 нг/мкл создайте аликвоты разведения, используя целочисленный коэффициент разбавления, добавив соответствующее количество экстрагированного образца ДНК (Дополнительный файл 1 MMqPCR Setup Up Sheet, колонка F) и ПЦР класса H2O (Дополнительный файл 1 MMqPCR Setup Up Sheet, колонка G) для разбавления концентрации до уровня от 2,5 до 5,0 нг/μл (дополнительный файл 1 Лист настройки MMqPCR, столбец K). Не следует разбавлять образцы концентрацией <5 нг/мкл, однако аликвота достаточна объема, чтобы провести 3-кратное исследование образца по этому протоколу.
ПРИМЕЧАНИЕ: Во время подготовки образца необходимо производить аликвоты разведения, чтобы можно было добавить 15 нг ДНК в соответствующую пробирку для ПЦР-полоски каждого образца. Аликвоты образцов позволяют техническим специалистам избежать влияния ненужных циклов замораживания-размораживания на целостность ДНК исходного образца, если образец не соответствует критериям качества и его необходимо повторить. Образец шаблона MMqPCR, приведенный в дополнительном файле 1, может помочь определить правильный коэффициент разведения и объемы для приготовления аликвот разведения (дополнительный файл 1, лист настройки MMqPCR, столбцы E-I).- Заполните ПЦР-полоски образцами A1-8 в ПЦР-полоске A, образцами B1-8 в ПЦР-полоске B и образцами C1-8 в PRC-полоске C, как указано в дополнительном файле 1 MMqPCR Setup Up Sheet и перечисленными в таблице 3 , соответствующим образом разбавленными количествами образцов (дополнительный файл 1 MMqPCR Setup Up Sheet, колонка L) и ПЦР-сортом H2O (дополнительный файл 1 MMqPCR Set Up Sheet, колонка M) для общего количества 15 нг ДНК на ПЦР-пробирку и общего объема 75 мкл. Отложите его в сторону.
ПРИМЕЧАНИЕ: Образцы в ПЦР-полосках можно хранить в течение ночи при температуре 4 °C, чтобы на следующий день их можно было покрыть.
- Заполните ПЦР-полоски образцами A1-8 в ПЦР-полоске A, образцами B1-8 в ПЦР-полоске B и образцами C1-8 в PRC-полоске C, как указано в дополнительном файле 1 MMqPCR Setup Up Sheet и перечисленными в таблице 3 , соответствующим образом разбавленными количествами образцов (дополнительный файл 1 MMqPCR Setup Up Sheet, колонка L) и ПЦР-сортом H2O (дополнительный файл 1 MMqPCR Set Up Sheet, колонка M) для общего количества 15 нг ДНК на ПЦР-пробирку и общего объема 75 мкл. Отложите его в сторону.
- Приготовление стандартной кривой: Разморозьте контрольную аликвоту ДНК, вихрь в течение 30 с, центрифугу в течение 5 с и аспирируйте полный объем (150 мкл) в первую пробирку стандартной кривой (SC) ПЦР-полоски.
- Пипетка 70 мкл ПЦР класса H2O в вторую-восьмую пробирки ПЦР-полоски SC. Тщательно ресуспендируйте контрольную ДНК в первой пробирке перед аспирацией 70 мкл и дозированием ее во вторую ПЦР-пробирку. Подождите 30 с, затем тщательно суспендируйте раствор во второй ПЦР-пробирке перед аспирацией 70 мкл и дозированием его в третью ПЦР-пробирку. Повторите это для трубок с третьей по седьмую, чтобы получить 2-кратное последовательное разведение семи стандартов. Конечная пробирка должна содержать только ПЦР-класс H, 2O, чтобы функционировать в качестве нешаблонного контроля (NTC). Отложите полоску SC PCR в сторону.
Таблица 3: Организация проб и контрольный стандарт в планшете. Расположение всех образцов и стандартов на 96-луночном ПЦР-планшете. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
3. Приготовление мастер-смеси MMqPCR
- Соберите аликвоты реагентов мастер-микса, перечисленные в таблице 1, за исключением ДНК-полимеразы, и дайте им дойти до комнатной температуры внутри ПЦР-колпака. Добавьте 1 мкл аликвоты SYBR Green в 1x буферную аликвоту.
ПРИМЕЧАНИЕ: Именно это количество необходимо для получения правильной концентрации SYBR из-за ограничений точности пипетки во время анализа, поэтому даже если одновременно выполняется только одна пластина, это количество должно оставаться неизменным. - Переварите все аликвоты в течение 10 с, центрифугируйте в течение 5 с, затем добавьте следующие количества реагентов в пробирку объемом 5 мл, содержащую 5 М бетаин (теперь это основная пробирка для смешивания): 1 235,2 мкл ПЦР класса H2O, 640 мкл 10-кратного буфера, 204,8 мкл dNTP, 192 мкл DTT, 64 мкл MgCl2, 48 мкл буфера SYBR Green / 1x (начиная со стадии 3.1), 14,4 мкл обоих теломерных праймеров и 9,6 мкл обоих праймеров альбумина, как указано в таблице 1.
- Достаньте ДНК-полимеразу из хранилища при температуре -20 °C, сделайте вихрь в течение 10 с, центрифугируйте в течение 5 с, затем медленно добавьте 128 μL в исходную смесь; немедленно переместить ДНК-полимеразу обратно в хранилище при температуре -20 °C.
- Закрутите трубку мастер-микса объемом 5 мл в течение 30 с.
4. Подготовка 96-луночного планшета
- Поместите два 96-луночных планшета, загрузочный желоб и многоканальные наконечники для дозатора в колпак для ПЦР. Пометьте каждую табличку номером пластины (1 или 2). Поверните первую пластину (пластину P1) на 180° так, чтобы номера столбцов были перевернуты. Оставьте вторую пластину (P2) обращенной к технику.
- Вылейте содержимое пробирки master mix объемом 5 мл в загрузочный желоб. Используйте наконечник для дозатора для сбора и дозирования любого раствора, оставшегося в пробирке.
- Загрузите наконечники в многоканальный пипетку, надавливая на основание каждого наконечника пипетки, чтобы обеспечить плотное прилегание. Убедитесь, что наконечники не имеют фильтра в области вывода, где будет отсасываться мастер-микс; Если есть кусочек фильтра, то замените наконечник.
- Используйте обратное пипетирование для заполнения планшетов вязкой основной смесью, закрутите загрузочный желоб, затем нажмите на поршень пипетки после первой остановки, отсасывая более 15 μл в наконечники пипетки, убедившись, что наконечники заполняются одновременно с одинаковым объемом. При вытеснении основной смеси в колонку нажмите на поршень до первой остановки, оставив дополнительную основную смесь в наконечниках пипетки. Оставив поршень нажатым, погрузите наконечники обратно в загрузочный желоб и отпустите поршень, чтобы заполнить наконечники еще 15 μл. Используйте те же наконечники для заполнения обеих пластин.
- Заполните пластины, сначала вытеснив мастер-микс во все четные или все нечетные столбцы, чередуя пластины (т. е. если техник решит начать с нечетных номеров столбцов, сначала будет заполнен столбец 1 на P2, затем столбец 11 на P1, затем столбец 3 на P2 и т. д.). После того, как техник заполнил все лунки ряда (четные или нечетные), работая слева направо, выполните другие ряды (четные или нечетные) колонн таким же образом. Диаграмма этого процесса приведена на рисунке 2 .
ПРИМЕЧАНИЕ: Этот способ заполнения пластин позволяет контролировать эффекты положения на пластинах.
- Заполните пластины, сначала вытеснив мастер-микс во все четные или все нечетные столбцы, чередуя пластины (т. е. если техник решит начать с нечетных номеров столбцов, сначала будет заполнен столбец 1 на P2, затем столбец 11 на P1, затем столбец 3 на P2 и т. д.). После того, как техник заполнил все лунки ряда (четные или нечетные), работая слева направо, выполните другие ряды (четные или нечетные) колонн таким же образом. Диаграмма этого процесса приведена на рисунке 2 .
- Сделайте вихревыми четыре закрытые полоски ПЦР, содержащие образцы и стандартную кривую, затем вращайте каждую в мини-центрифуге в течение 5 с.
- Выстройте полоски ПЦР в штативе для ПЦР-пробирок в порядке их размещения на планшете. Для Р1 первые 3 колонки являются образцами (ПЦР-стрип А), столбцы 4-6 являются стандартными (ПЦР-стрип S), столбцы 7-9 являются образцами (ПЦР-стрип В), а столбцы 10-12 являются образцами (ПЦР-стрип С; см. рис. 3 и табл. 3). Поскольку P2 заполняется при повороте на 180° по отношению к технику, столбцы будут противоположными.
- Поверните обе пластины на 180° так, чтобы номера столбцов были перевернуты относительно техника для каждой пластины (т. е. если раньше техник стоял лицом к этикетке для P2, то теперь он будет обращен к этикетке для P1 по краю пластины).
- Установите многоканальный дозатор на 10 мкл и загрузите наконечники пипетки в многоканальный пипетку, как описано в шаге 4.3.
- Используйте многоканальную пипетку для ресуспендирования растворов, затем выполните обратное пипетирование, как описано в шаге 4.4, для аспирации и дозирования 10 мкл образцов и стандартных растворов, начиная с ПЦР-полоски А.
- Заполните первые 3 столбца каждой пластины с помощью полоски А методом ПЦР, чередуя столбцы таким же образом, как мастер-микс был помещен в тарелку (т.е. четным или нечетным).
- Заполните следующие три столбца с помощью стандартной кривой ПЦР-полоски. Для этой полоски тщательно суспензируйте7-ю стандартную пробирку для разбавления (предпоследней) с помощью пипетки объемом 200 μл, установленной на ~90 μл, перед тем как снова суспендировать всю полоску с помощью многоканальной пипетки.
ПРИМЕЧАНИЕ: Больший объем и меньшая концентрация ДНК в этой пробирке часто приводят к различным измерениям в лунках ПЦР-планшетов из-за плохого перемешивания. Использование большего объема для смешивания этой пробирки лучше гомогенизирует раствор ДНК. - Заполните следующие три столбца полоской для ПЦР B, а последние три — полоской для ПЦР C. Замените наконечники для пипетки между каждой полоской для ПЦР, заполнив все 96 лунок на обеих пластинах соответствующими образцами и контрольным стандартом, как показано на рисунке 3.
- После того, как пластины будут заполнены, осторожно постучите по пластине на столе, чтобы жидкость по бокам лунок стекала на дно, а затем накройте верхушки пластин герметизирующими пленками. Кончиками пальцев надавите на все края пленки, чтобы обеспечить плотное прилегание.
- Перемешайте тарелки, вращая на крышке капота в течение 30 секунд, затем поместите запечатанные тарелки в спиннер для тарелок на 2 минуты так, чтобы отверстия лунок были обращены к центру.
- Поместите пластины в термоамплификатор, с указанием номеров столбцов пластин в разборчивом порядке. Используйте чистую салфетку для очистки верхней части каждой пластины, прежде чем закрывать верхнюю часть термоамплификатора.
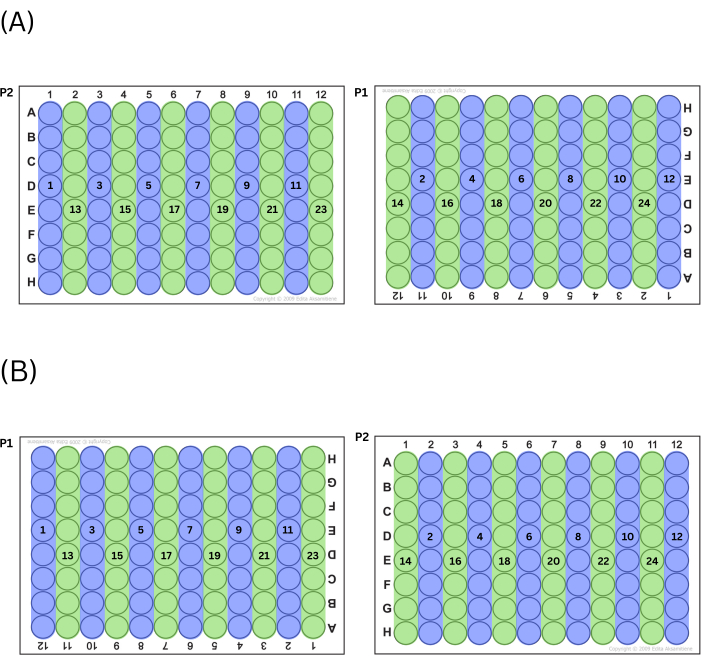
Рисунок 2: Процесс наполнения тарелок. (A) Если выбрано заполнение нечетных столбцов первыми, то именно в таком порядке заполняются скважины. (B) Если выбрано заполнение четных столбцов первыми, то именно в таком порядке заполняются скважины. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
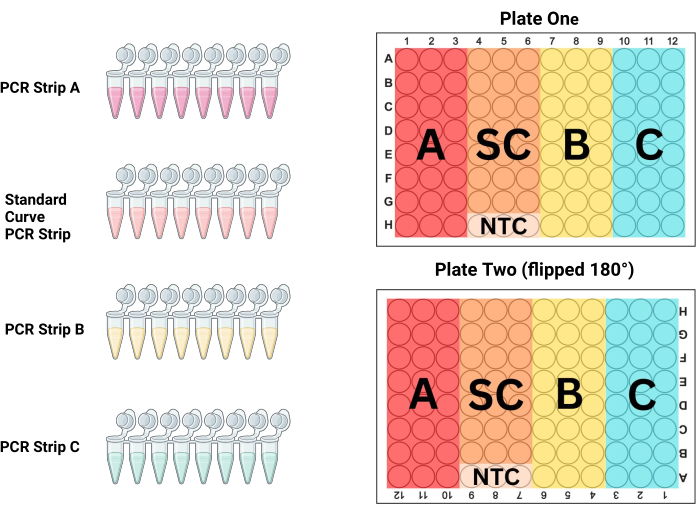
Рисунок 3: Схема расположения пластин. ПЦР-полоска А, полоска В, полоска С и стандартная кривая (SC) полоски должны использоваться для заполнения трех столбцов на каждой пластине для получения дубликатов тройки каждого образца и стандартного разведения. На этой схеме показано, какие из столбцов должны быть заполнены каждой полосой. Вторая пластина переворачивается на 180° (обратите внимание, что заголовки столбцов и строк перевернуты) перед загрузкой, но пластина заполняется так же, как и первая, что исключает потенциальные ошибки пипетирования и при этом контролирует влияние положения на пластины. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
5. Термоцилирование MMqPCR
- Пока пластины вращаются на шаге 4.8.1, включите компьютер и термоамплификаторы. Откройте программное обеспечение термоамплификатора. Этот протокол описывает использование программного обеспечения CFX Maestro.
- Создание протокола термоциклирования TL в соответствии с протоколом термоциклирования MMqPCR19 (рис. 4).
- Добавьте этап инкубации для активации ДНК-полимеразы при 95 °C в течение 15 минут.
- Чтобы избежать связывания праймера с димером, выполните два цикла при температуре 94 °C в течение 15 с, при 49 °C в течение 1 мин, затем 3 цикла при 94 °C в течение 15 с, при температуре 59 °C в течение 15 с.
- Для амплификации теломер добавьте 27 циклов по 85 °C в течение 15 с, 74 °C в течение 30 с, затем захват сигнала.
- Для амплификации альбумина добавьте 31 цикл при температуре 94 °C в течение 15 с, 84 °C в течение 30 с, затем регистрируйте сигнал.
- Включите кривую плавления от 59 °C до 95 °C с интервалом 5 с для каждого возрастающего градуса в протокол термоциклирования.
- Нажмите кнопку «Запустить запуск» для обоих амплификаторов. При появлении запроса укажите название файлов анализа.
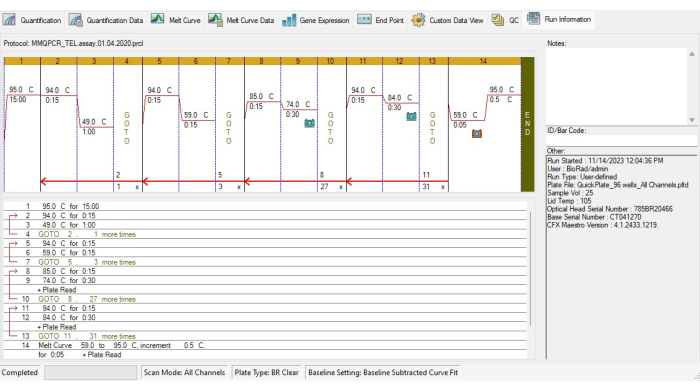
Рисунок 4: Профиль термоциклирования анализа MMqPCR. Протокол MMqPCR создан в программном обеспечении в соответствии с оригинальным протоколом термоциклирования19. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
6. Анализ данных MMqPCR
- После завершения термоциклирования проанализируйте данные следующим образом, чтобы получить значения TL для обработанных образцов.
- В программном обеспечении выберите функцию «Настройка пластины ». В выпадающем меню нажмите кнопку Просмотр/редактирование пластины.
- Выделите все лунки и нажмите Select Fluorophores, затем установите флажок с надписью SYBR и снимите все остальные флажки. Нажмите OK.
- Пока все скважины еще выделены, рядом со словом Нагрузка поставьте галочку напротив SYBR. Теперь на всех лунках должно быть написано SYBR.
- Затем выделите три лунки NTC в верхней или нижней части стандартного контрольного серийного разведения и выберите NTC в меню типа образца справа. Теперь три колодца должны быть желтыми и называться NTC. На рисунке 5А показано, какие скважины следует выбрать для P1, а на рисунке 5B показано, какие скважины следует выбрать для P2.
ПРИМЕЧАНИЕ: P2 будет инвертирован относительно P1, поэтому NTC будет находиться в нижней части столбцов 4-6 для P1 и в верхней части столбцов 7-9 для P2. - Выделите 21 лунку стандартного контрольного серийного разведения и выберите Стандартный в меню типа пробы. Эти колодцы должны быть зелеными. Пока эти скважины все еще подсвечиваются, нажмите кнопку Техническая репликация. Выберите 3 в меню «Тиражировать размер», затем выберите «Горизонтально» > «Применить». Эти лунки должны быть промаркированы наборами по три от Std-1 до Std-7.
- Пока стандарт все еще выделен, прокрутите вниз и выберите «Серия разбавления». В поле «Коэффициент разбавления» введите 2, затем введите начальную концентрацию и направленность разбавления в соответствии с номером пластины, как описано в следующих шагах.
- Для пластины P1 введите 2.00E-03 в поле начальной концентрации и установите флажок Убывающее , затем выберите Применить. Значения в 21 скважине должны иметь значения концентрации, записанные в каждой скважине в диапазоне от 2,00E-03 до 3,13E-05 сверху вниз.
- Для пластины P2 введите 3.13E-5 в поле начальной концентрации и установите флажок « Увеличение », затем выберите «Применить». Значения в 21 скважине должны иметь значения концентрации, записанные в каждой скважине в диапазоне от 3,13E-05 до 2,00E-03 сверху вниз.
- Для образцов выделите столбцы для ПЦР-полоски A (1–3 для P1 и P2), выберите «Неизвестно » в меню типа образца, затем выберите «Техническая репликация». Выберите 3 в меню «Повторить размер », затем выберите «Горизонтально» > «Применить». Лунки для этих столбцов должны быть синего цвета и помечены по строкам в наборах по 3 от Unk-1 до Unk-8.
- Повторите шаг 6.3 для колонок для ПЦР-стрип В (столбцы 7-9 для Р1 и 4-6 для Р2). Они должны иметь маркировку от Unk-9 до Unk-16.
- Повторите шаг 6.3 для колонок для ПЦР-стрип С (столбцы 10-12 для Р1 и Р2). Они должны иметь маркировку от Unk-17 до Unk-24. После выполнения шагов 6.2-6.3.2 окна настройки пластин должны выглядеть как на рисунке 5A, B.
- Нажмите OK в правом нижнем углу окна редактора пластин. Нажмите «Да», чтобы применить изменения при появлении запроса.
- Для контроля качества на уровне анализа убедитесь, что кривые на вкладке количественного определения являются подходящими (например, без инвертированных кривых амплификации) как для Шага 9, так и для Шага 12 профиля термоциклирования, которые соответствуют теломерным и альбуминовым ампликонам соответственно. Доступ к кривым осуществляется с помощью выпадающего меню в средней правой части окна программного обеспечения. На рисунках 6A,B показаны соответствующие кривые.
- Убедитесь, что эффективность ПЦР, указанная на Этапе 9 и Шаге 12, составляет от 90% до 110%, и эти два показателя эффективности не отличаются друг от друга более чем на 10% (т.е. 92,4% для Этапа 9 и 98% для Шага 12 подходят, но 92,4% для Шага 9 и 108% для Шага 12 не подходят). Кроме того, убедитесь, что стандартная кривая R2 равна >0,995. Если P1 или P2 не соответствуют этим критериям, пластины должны быть пропущены повторно.
- Для P1 выберите шаг 9 и выделите 21 лунку, соответствующую стандартной кривой, как показано на рисунке 6A, B. Скопируйте значения Cq в правом нижнем углу окна программы. Откройте шаблон таблицы данных теломер, доступный в качестве дополнительного файла 1, и вставьте эти значения в стандартный лист 1, столбец B. Выберите шаг 12 , затем скопируйте эти значения Cq. Вставьте эти значения в стандартный 1 лист, столбец I.
- Определите значение уклона на шаге 9 и введите его в ячейку C4 на стандартном листе 1. Определите значение наклона на шаге 12 и введите его в ячейку J4 на стандартном листе 1.
ПРИМЕЧАНИЕ: Система рассчитывает процент эффективности грунтовок с использованием наклонов стандартной кривой, определенных в шаге 6.6.1. Процент эффективности можно рассчитать вручную по следующей формуле: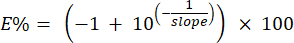
- Убедитесь, что коэффициент вариации (CV) для каждого стандартного тройного разбавления был меньше 0,1. Если значение больше или равно 0,1, исключите в общей сложности до трех отдельных лунок из всех концентраций контрольных проб, включенных в 7-точечную стандартную кривую серийного разубоживания на планшете. Из любого тройного набора должна быть исключена только одна скважина.
ПРИМЕЧАНИЕ: Исключение стандартных точек из анализа в программном обеспечении приведет к изменению заявленного наклона, R, y-точки пересечения и эффективности для обоих грунтов. Таким образом, после того, как любая стандартная скважина будет выведена из анализа, шаги 6.5.1-6.6.1 должны быть повторены. - Повторите шаги 6.6.1 - 6.6.2 для файла анализа P2 и соответствующего листа стандарта 2.
- Только после того, как листы стандарта 1 и стандарта 2 заполнены приемлемыми резюме, соберите данные отдельных образцов из файлов анализа. Убедитесь, что корректировки контроля качества отображаются в столбце L листа P1 v P2, например, сколько скважин было исключено в файле анализа P1.
- Определите значение уклона на шаге 9 и введите его в ячейку C4 на стандартном листе 1. Определите значение наклона на шаге 12 и введите его в ячейку J4 на стандартном листе 1.
- Убедитесь, что только 72 лунки для отбора проб в файле анализа P1 выделены синим цветом на вкладке «Количественная оценка», как показано на рисунке Рисунок 7А,В. Выбирать Шаг 9. Скопируйте значения Cq и SQ в правом нижнем углу окна программы. Вставьте эти значения в образцы листа P1, начиная с ячейки D3. Выбирать Шаг 12 затем скопируйте эти значения Cq и SQ и вставьте в образцы лист P1, начиная с ячейки F3.
- Повторите этот шаг для образцов в файле анализа P2 и соответствующих образцах на листе P2. Отношение теломер к единичным экземплярам (T/S) (столбец H) рассчитывается автоматически, но может быть рассчитано вручную по следующей формуле:
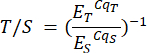
Где ET/S — эффективность экспоненциальной амплификации для реакций, нацеленных на теломеры или ген одной копии соответственно, а CqT/S — цикл, в котором данная реплика, нацеленная на теломерное содержимое, или ген с одной копией достигает критического порога количественного определения флуоресценции. Средние отношения T/S (столбец I) рассчитываются по шести измерениям для каждого образца.
ПРИМЕЧАНИЕ: Идентификационные номера образцов в CFX не соответствуют одному и тому же биологическому образцу на двух планшетах. Шаблон таблицы данных теломер учитывает эту разницу и выравнивает соответствующие повторяющиеся тройки. - В CFX Maestro убедитесь, что значения Cq для всех аналитических образцов находятся между самым низким и самым высоким значением Cq стандартной кривой, как показано на рисунке 7B. Если проба находится за пределами диапазона, как показано на рисунке 7A, ее необходимо повторно прогнать после корректировки концентрации. Проба со значением Cq ниже наивысшего стандарта концентрации должна быть разбавлена на коэффициент, приближенный к числу циклов амплификации, за пределы которого она выходит, а проба со значением Cq выше самого низкого стандарта концентрации должна быть сконцентрирована на коэффициент, приближенный к числу циклов амплификации за пределами порогового значения.
ПРИМЕЧАНИЕ: Значительные колебания концентрации аналитических образцов вносят дополнительный потенциальный уровень вариаций, и к этому следует относиться с осторожностью. - Убедитесь, что начальная концентрация в NTC составляла менее 5% от среднего количества ДНК, присутствующей в лунках образца. Это можно проверить, просмотрев % загрязнения воды на образцах P1 и образцах P2 листов MMqPCR. Если NTC указывает на загрязнение, то повторно запустите пластины.
ПРИМЕЧАНИЕ: Из-за чувствительности анализа MMqPCR, незначительное неконтролируемое загрязнение может иногда вызывать амплификацию лунок NTC. Однако эта амплификация должна быть незначительной и происходить через несколько циклов после амплификации одной копии гена на этапе 12 протокола термоциклирования. - Для контроля качества на уровне выборки просмотрите стандартные отклонения (SD) (столбец J) и CV (столбец K) в образцах P1 и образцах P2 листах. Убедитесь, что внутрипланшетные CV в образце с тройным отношением T/S составляют менее 0,10 (10%). Для коррекции любых внутрипластинчатых CV больше 0,1 может быть исключено одно отношение T/S из набора трипликатов.
ПРИМЕЧАНИЕ: Может быть исключена только одна общая репликация по шести измерениям на образце, т.е. репликация для одного и того же образца не может быть исключена одновременно для P1 и P2. - Убедитесь, что количество МВ отдельных образцов между пластинами в листе Р1 и Р2, колонка G, меньше 0,05 (5%). Чтобы скорректировать CV больше 0,05, выполните исключение одного отношения T/S из шести измерений на образце на обеих пластинах. Исключите образцы после визуального осмотра во внутрипланшетных тройках и всех шести измерений по мере необходимости.
ПРИМЕЧАНИЕ: В окончательные результаты ТЛ могут быть включены только образцы, удовлетворяющие этим критериям контроля качества, внутрипланшетный CV < 10% и внутрипланшетный CV < 5%. В противном случае образец должен быть исключен из спецификаций P1 v P2 и ICC для этого прогона, а образец должен быть повторно оценен с помощью второго анализа MMqPCR. - Для контроля качества на уровне пластин убедитесь, что среднее внутрипланшетное отклонение по всем образцам на каждой пластине, расположенной в нижней части образцов P1 и образцов P2 листов, составляет менее 0,05 (5%). Для дополнительного контроля качества на уровне пластин убедитесь, что общее изменение межпластинчатого слоя в P1 по сравнению с P2, ячейка G29, составляет менее 0,06 (6%). Убедитесь, что образцы, не прошедшие контроль качества, исключены из расчета межпластинчатого CV в ячейке G30.
ПРИМЕЧАНИЕ: При работе со связанными группами образцов (например, членами семьи, разными временными точками и т. д.) все образцы в группе должны быть выполнены на одной пластине. Таким образом, если одна выборка из группы не удовлетворяет критериям контроля качества, все выборки в группе должны быть пропущены повторно. - В отдельном файле данных общей когорты или эксперимента запишите окончательные данные TL для каждого образца, прошедшего контроль качества (P1 v P2 Sheet, столбец I), расчеты ICC для каждого образца, прошедшего контроль качества (ICC Data Sheet, столбцы E-K), и окончательные данные прогона анализа из P1 v P2 Sheet (столбцы J-L)
- Повторите этот шаг для образцов в файле анализа P2 и соответствующих образцах на листе P2. Отношение теломер к единичным экземплярам (T/S) (столбец H) рассчитывается автоматически, но может быть рассчитано вручную по следующей формуле:
- Используйте Дополнительный файл 2, созданный Исследовательской сетью теломер (TRN), для расчета ICC для проекта20.
- Наконец, чтобы улучшить сопоставимость между исследованиями TL, преобразуйте окончательные данные TL для каждой выборки в отдельной общей когорте или файле данных эксперимента в Z-оценки, используя следующее уравнение, в котором среднее отношение T/S для всех выборок в когорте вычитается из отношения T/S отдельной выборки, а затем делится на SD по всем выборкам в когорте.
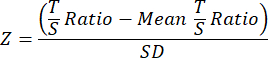
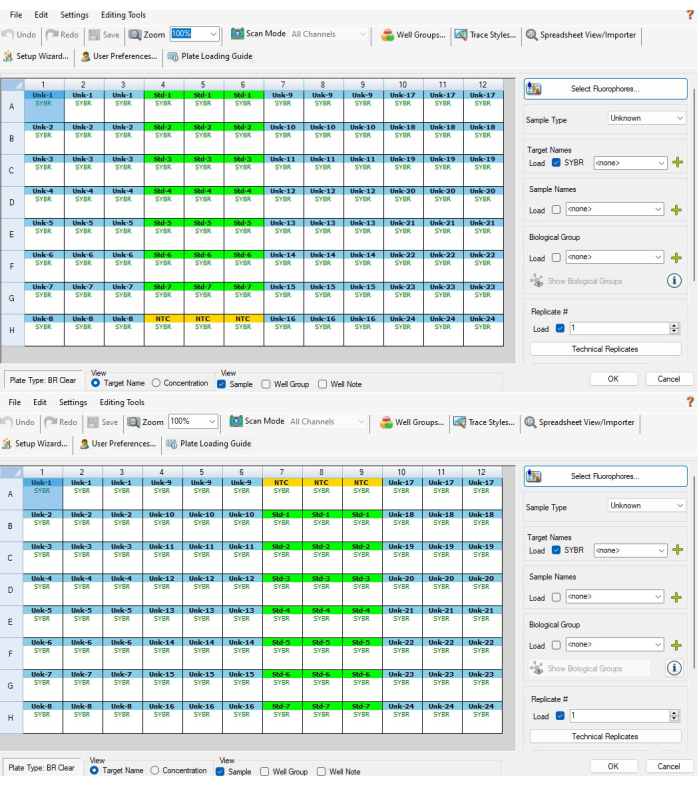
Рисунок 5: Настройка пластин на основе программного обеспечения. (A) Настройка пластины на основе программного обеспечения для пластины P1 после выполнения шагов 6.2-6.4. (B) Настройка пластины на основе программного обеспечения для пластины P2 после выполнения шагов 6.2-6.4. Идентификаторы образцов и стандартных образцов не выровнены между двумя пластинами CFX из-за того, как программное обеспечение присваивает идентификаторы образцов в зависимости от положения скважины (т. е. образец CFX 1 на P1 — это образец CFX 24 на P2). Шаблон Excel, представленный в Дополнительном файле 1, учитывает это, гарантируя, что межпланшетные измерения, выполненные на одном и том же биологическом образце, правильно выровнены друг с другом Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
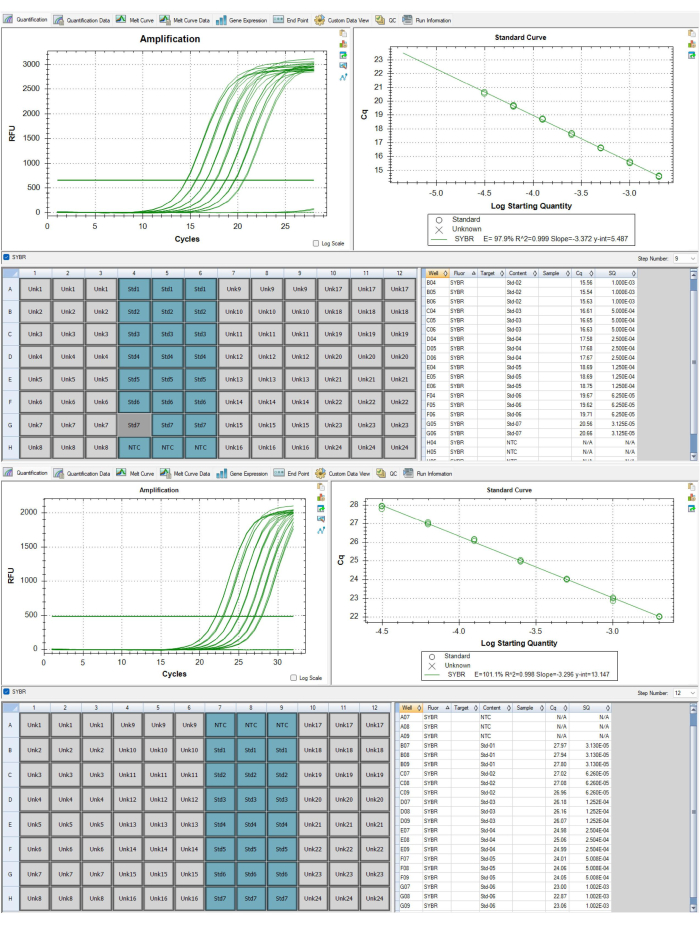
Рисунок 6: Стандартные кривые дляампликонов таломеров и альбуминов. (A) Эта стандартная кривая получена из ампликона теломер P1 репрезентативного набора данных результатов. Один стандарт был удален из-за того, что он не соответствовал критериям контроля качества. (B) Эта стандартная кривая взята из ампликона альбумина P2 репрезентативного набора данных результатов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
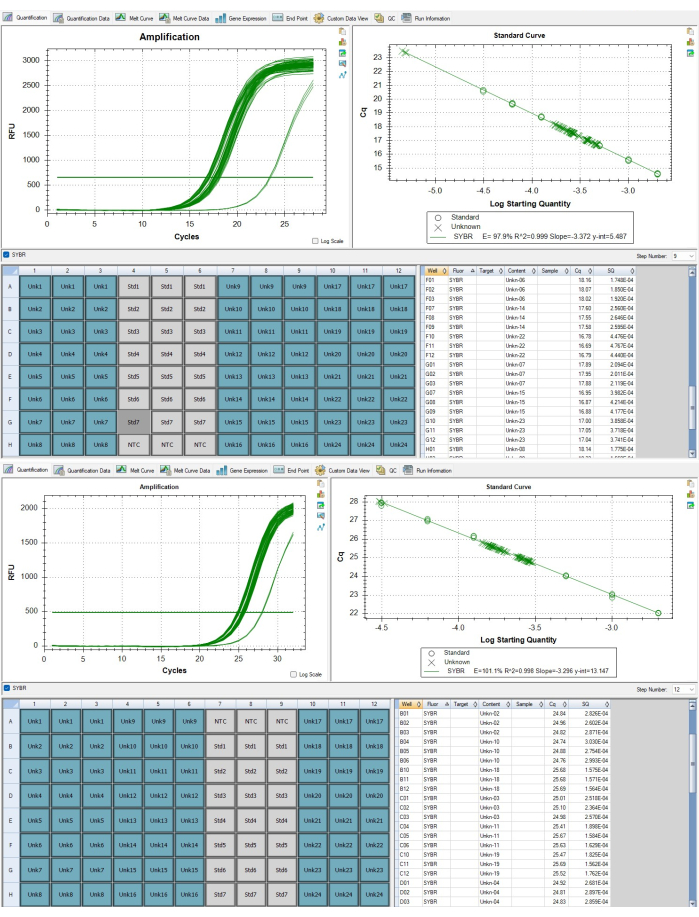
Рисунок 7: Теломеры и ампликоны генов с одной копией. (A) амплификация теломер и (B) амплификация гена альбумина образцов представлены в репрезентативных результатах, отображаемых в программном обеспечении. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
7. Отчетность по данным MMqPCR
- При представлении результатов исследований с использованием данных TL, полученных с помощью MMqPCR, убедитесь, что отчеты описаны в Руководстве по минимальной отчетности TRN. Эти рекомендации можно найти на веб-сайте TRN (https://trn.tulane.edu/resources/reporting-guidelines/), а шаблон для представления этой информации представлен в Дополнительном файле 3. При необходимости ссылайтесь на этот протокол и другие рекомендации и ресурсы TRN.
Результаты
Результаты, представленные в таблицах 4 и 5, представляют собой пример высоковоспроизводимых измерений TL, полученных в соответствии с протоколом. Для получения этих результатов ДНК была выделена из 24 образцов мононуклеарных клеток периферической крови (PBMC) с использованием коммерческого набора в соответствии с рекомендациями производителей. Эти 24 образца были пропущены через два 96-луночных планшета. Все образцы ДНК были проверены на качество с помощью спектрофотометра и флуориметра с использованием среднего соотношения 260/280, среднего соотношения 260/230 и концентрации дцДНК для определения пригодности анализа и коэффициента разбавления образца (Таблица 6). В таблице 6 также подчеркивается важность количественного определения концентрации дцДНК, которая может отличаться от концентрации ДНК, измеренной с помощью спектрофотометра. Эта изменчивость является результатом различных подходов к количественной оценке. В частности, спектрофотометр рассчитывает концентрацию ДНК на основе поглощения на длине волны 280 нм и подвержен колебаниям из-за загрязнений (например, белка, соли и т. д.), влияющих на показатели поглощения. Напротив, концентрации дцДНК, измеренные с помощью флуориметра, определяются флуоресценцией красителя, который специфически связывается с дцДНК и, как таковой, считается более точным отражением содержания ДНК. Образцы ДНК подвергались до трех циклов замораживания-размораживания перед MMqPCR TL-анализом. Контрольная ДНК была создана путем объединенной экстракции ДНК PBMC от одного индивидуума, которая была использована для создания семиточечного серийного разведения от 2 нг/мкл до 0,0313 нг/мкл ДНК. Независимые стандартные кривые, созданные для ПЦР Step 9 (теломерный ампликон) и Step 12 (одиночная копия гена amplicon, альбумин в этом протоколе), представлены на рисунке 6A,B. Анализы проводились с помощью коммерческой системы обнаружения ПЦР в реальном времени, которая генерировала кривую расплава, показывающую, что отдельные продукты ампликона производятся при различных температурах, как показано на рисунке 8.
Таблица 4: Выходные данные измерения MMqPCR для получения оптимальных репрезентативных результатов. Средние отношения T/S, SD, CV и Z-score TL для 24 образцов. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 5: Вывод данных о длине теломер. Исходные данные анализа MMqPCR анализируются в программном обеспечении, а затем добавляются в шаблон электронной таблицы, прикрепленный в качестве дополнительного файла 1, для дальнейшего анализа и контроля качества. На этом выходном листе шаблона TL представлена сводка данных с отображением идентификаторов образцов, средних TL, SD и CV для каждого образца на обеих пластинах. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 6: Метрики качества ДНК спектрофотометра и флуориметра для результатов проб. Данные контроля качества, полученные с помощью дублирующего спектрофотометрического анализа и сингулярного флуориметрического измерения дцДНК и любых загрязнений в образце. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
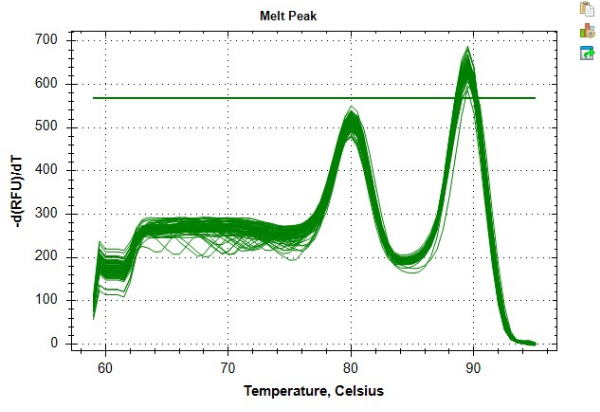
Рисунок 8: Пример кривой плавления. Кривая расплавления для данных образца, сгенерированных в программном обеспечении. Более ранний пик ~80 °C представляет ампликон теломер, а вторичный пик при ~89 °C представляет ампликон альбумина. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Для этого проекта средняя эффективность теломер составила 98,6% с диапазоном от 90,7 до 102,1, а средняя эффективность альбумина составила 102,3% с диапазоном от 93,6 до 108,2 по всем прогонам. Из стандартных кривых было удалено в среднем 0,97 повторения, что соответствует критериям контроля качества данного протокола. Средний межпластиночный CV составил 1,83% при SD 0,00616, а средний внутрипластиночный CV составил 3,78% при SD 0,00658. Средние TL для этих репрезентативных выборок представлены в таблицах 4 и 5. Среднее значение TL составило 1,37 при стандартном отклонении 0,24 и диапазоне от 0,84 до 2,32. Отношение T/S, SD, CV и Z-оценка TL на образец приведены в таблице 4. Поскольку отношение T/S анализа MMqPCR является относительным измерением TL, отношения были преобразованы в этот Z-показатель для обеспечения перекрестного сравнения исследований. ICC для данного проекта рассчитывали с использованием скрипта R, как описано в руководящих принципах TRN, приведенных в дополнительном файле 2, с учетом эффектов пакета и прогона20. Чтобы рассчитать внутрипроектный ICC, мы повторно прогнали 10% проходящих выборок, убедившись, что пластины ICC заполнены как минимум одной выборкой из каждой пластины когорты. Общий ICC проекта 0,801 [CI: 0,703, 0,86] указывает на высокую воспроизводимость результатов TL.
Не все результаты будут оптимальными. Результаты, представленные на рисунке 9 и в таблице 7, показывают неоптимальные результаты анализа MMqPCR. На рисунке 9 показана стандартная кривая с эффективностью теломер ниже 90%, что ниже стандартов контроля качества, что требует повторения всей пластины. Проблемы с эффективностью праймеров обычно связаны с проблемами с реагентами, поэтому важно отслеживать даты аликвотирования реагентов и срок их годности в качестве первого шага в определении того, какой реагент отвечает за низкую эффективность. Реагенты с истекшим сроком годности должны быть заменены перед повторным запуском пластины. В таблице 7 показана пластина, которая удовлетворяет первоначальным критериям контроля качества на уровне выборки, но имеет высокий уровень вариабельности между пластинами, что приводит к нарушению контроля качества на уровне пластин. Различия между планшетами обычно связаны с ошибками в пипетировании и технике заполнения планшетов. В этом случае технический специалист должен оценить любые проблемы, возникшие во время настройки планшета, и убедиться, что пипетки откалиброваны.
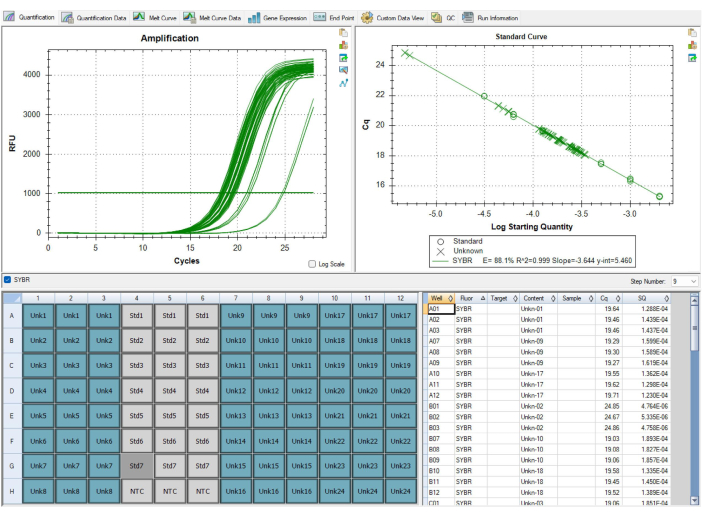
Рисунок 9: Неоптимальные результаты. Эта стандартная кривая, отображаемая в программном обеспечении, не прошла контроль качества, так как эффективность амплификации для теломерного праймера составляла менее 90%. Изображение получено из P1, но у P2 была такая же низкая эффективность. Данные этого прогона не могли быть использованы, и все образцы необходимо было запускать заново после замены причинного реагента, срок годности которого истек. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Таблица 7: Неоптимальные результаты. В таблице показан шаблон данных теломер для прогона, в котором многие образцы не соответствовали стандартам контроля качества. Образцы, которые необходимо было повторить, определялись на основе значений CV, а затем название образца было изменено на красный шрифт для облегчения идентификации. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительный файл 1: Шаблон таблицы данных теломер. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2: Расчет ICC. Этот протокол был создан Исследовательской сетью теломер (TRN). Этот файл был изменен по сравнению с20. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 3: Руководящие принципы отчетности по РНН. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
До 2002 года в более крупных популяционных исследованиях наиболее часто использовавшимся методом измерения TL был Саузерн-блоттинг длин терминальных рестрикционных фрагментов (TRF)24,25. TRF, несмотря на то, что он обеспечивает превосходную точность и воспроизводимость в специализированных лабораториях, ограничен в применимости из-за количества и качества требуемой ДНК и ограниченной пропускной способности, что создает предпосылки для более широкого использования анализов TL на основе количественной ПЦР, а затем и анализа MMqPCR. Метод MMqPCR TL обеспечивает воспроизводимое измерение TL при настройке, оптимизации и обслуживании с тщательным вниманием к каждому критерию контроля качества. Расчет и отчетность по конкретному ICC для каждой анализируемой когорты необходимы для обеспечения надежности анализа. Несмотря на то, что метод MMqPCR зависит от качества ДНК и технических знаний, он хорошо подходит для крупных популяционных исследований, изучающих TL, поскольку он требует небольшого количества ДНК, более надежен, чем одиночная ПЦР, и более эффективен с точки зрения затрат на реагенты и времени технического специалиста, чем другие методы. Возможность получения высоких ICC предоставляет дополнительные данные в поддержку использования MMqPCR для крупных популяционных исследований TL. Измерение ТЛ ММкПЦР может быть применено к широкому спектру исследований, направленных на определение роли ТЛ в качестве биомаркера смертности от всех причин, старения, стресса в течение жизни, воздействия окружающей среды и последствий для физического здоровья, таких как сердечно-сосудистые заболевания и рак 4,7,8,10,11,12,13,26,27,28, 29,30,31.
Одним из ограничений метода MMqPCR является то, что он сообщает TL в виде отношения T/S, относительной оценки длины, которая варьируется в зависимости от выбора гена с одной копией, состава мастер-миксаи параметров циклирования ПЦР. Соотношение T/S не имеет единиц измерения. Таким образом, без комбинации с другими методологиями измерения TL этот метод не позволяет получать оценки в значениях пар оснований 18,33,34. В результате, отношение T/S должно быть преобразовано в Z-оценку, чтобы иметь релевантностьдля всех исследований. Следует проявлять значительную осторожность при проведении таких операций в разных лабораториях, методах и анализах. Кроме того, этот метод, как и в случае с анализами гибридизации на основе геля, может включать количественное определение интерстициальных теломер. Однако эти последовательности составляют очень небольшую долю общего содержания теломер ДНК на геном. Кроме того, интерстициальные теломерные последовательности с большей вероятностью содержат несовпадающие последовательности пар оснований, которые отклоняются от канонических теломерных повторов, снижая вероятность связывания и амплификации праймеров. Кроме того, несмотря на то, что минимальное количество ДНК, необходимое для анализа MMqPCR, является преимуществом, важно отметить, что на измерения TL на основе количественной ПЦР влияют преаналитические факторы, влияющие на качество и целостность ДНК, включая условия хранения образца, методологию экстракции ДНК и биологическую ткань36,37. Было показано, что аналитический контроль этих факторов может повысить внешнюю валидность измерений TL, полученных с помощью qPCR38. Тем не менее, влияние различий в качестве ДНК на ТЛ, полученное с помощью анализа MMqPCR, нуждается в систематической оценке, поскольку в настоящее время не существует основанных на данных рекомендаций по определению того, является ли образец достаточно качественным для получения точной оценки ТЛ с использованием этого подхода. Несмотря на эти ограничения, применение этого анализа в исследованиях исходов для здоровья на уровне популяции является значительным.
При использовании анализа MMqPCR необходимо постоянно оценивать точность и производительность. В соответствии с текущим проектом, техники одновременно запускают тройные пробы на дубликатах пластин с помощью двух амплификаторов. При отсутствии нескольких амплификаторов мы рекомендуем сохранять повторяющиеся и тройные измерения и последовательные рабочие пластины для повышения точности даже за счет снижения производительности. Любое решение о приоритете производительности над точностью, например, с использованием одиночных тройных измерений, должно сопровождаться тщательным тестированием и оценкой полученных ICC, прежде чем приступать к анализу аналитических образцов. При принятии решения о пропускной способности и точности необходимо учитывать размер образца и качество образца ДНК. Меньший размер выборки или некачественные образцы ДНК требуют приоритета более высокой точности. Это имеет еще большее значение при работе с образцами из родственных групп (например, члены семьи, субъекты с несколькими временными точками). В таких случаях тщательное планирование, например, присвоение связанных образцов одной и той же пластине до начала эксперимента, является одним из способов предотвращения потери статистической мощности из-за непреднамеренного смешивания групп по пластинам.
Для этого анализа использовали спектрофотометр для оценки качества образцов ДНК: приемлемыми были признаны образцы в диапазоне 1,6-2,0 для соотношений 260/280 и 2,0-2,2 для соотношений 260/230. Эта оценка качества и точная оценка двухцепочечной ДНК с помощью флуориметра являются критически важными этапами в этом протоколе для получения воспроизводимых данных TL. Другие, более описательные измерения целостности ДНК, такие как размер фрагмента и/или суммарные измерения качества ДНК, определенные с помощью агарозного геля (например, число целостности ДНК), также могут быть использованы для определения качества образца38. Мы также рекомендуем, чтобы разведение образцов происходило только во время подготовки образца для проведения анализа MMqPCR. Это гарантирует, что аликвоты ДНК подвергаются минимальному количеству манипуляций после экстракции, насколько это возможно, уменьшая вариабельность при обработке перед анализом. В случае необходимости транспортировки образцов ДНК их следует перевозить на сухом льду в максимально возможной концентрации, чтобы смягчить деградацию, происходящую в образцах ДНК при более низких концентрациях39,40. В связи с деградацией ДНК, происходящей при циклах замораживания-оттаивания, количество замораживаний-оттаиваний для запаса ДНК должно быть сведено к минимуму41. Аликвоты объединенной контрольной ДНК должны быть созданы до запуска когорты, а аликвоты отдельных аналитических образцов ДНК должны быть созданы до проведения анализа.
Ключевые показатели эффективности анализа и контроля качества включают сигнал NTC, межпластинчатые и внутрипланшетные CV, а также стандартную кривую R2. Несоответствие критериям контроля качества можно смягчить несколькими способами. Регулярная смена запасов ПЦР класса H2O и аликвотирование субзапасов ПЦР класса H2O для каждой пары прогонов планшетов сведут к минимуму источники загрязнения, а также амплификацию NTC. Дополнительные шаги по снижению загрязнения включают следующее: назначение специального ПЦР-колпака, предназначенного только для анализа MMqPCR; протирание ПЦР-капюшона и оборудования раствором для обеззараживания ДНК; облучение помещения ультрафиолетом; и отработка стерильной техники в ПЦР-капюшоне. Для повышения повторяемости анализа и снижения сердечно-сосудистых заболеваний рекомендуется энергично проводить вихревые образцы, разведения и ПЦР-полоски на соответствующих вихревых стадиях и тщательно ресуспендировать при пипетировании образцов ДНК. Кривая R2 ниже порогового значения (<0,995), скорее всего, связана с ошибками пипетирования при загрузке планшетов. Чтобы избежать этого, уделяйте пристальное внимание точному пипетированию и ежегодной калибровке пипеток, энергично перемешивайте стандартные ПЦР-полоски перед загрузкой и тщательно организуйте поставки, чтобы способствовать эффективному рабочему процессу. Если при использовании двух машин и одной пластины наблюдаются стабильно более высокие CV, машину следует обслуживать в качестве потенциального способа решения проблемы. Пластины контроля качества от производителя должны регулярно запускаться на пластинах для оценки производительности термоамплификатора.
Если проблемы не исчезают даже после выполнения описанных выше шагов, для устранения неполадок протокола можно использовать следующие шаги. Учет того, когда все реагенты были аликвотированы, и любых соответствующих сроков годности может помочь оптимизировать процесс устранения неполадок при неизбежном возникновении трудностей. Важной частью любого процесса поиска и устранения неисправностей является корректировка только одного реагента за раз, чтобы определить конкретную причину несоответствия пластин критериям контроля качества, начиная с самого дешевого реагента, о котором идет речь. Например, если и теломера, и ген с одной копией имеют низкую эффективность, общие реагенты, такие как DTT, dNTP или аликвота SYBR, являются более вероятной причиной, чем ампликон-специфичные праймеры. По указанной цене новые аликвоты должны быть протестированы в порядке DTT, затем dNTP и, наконец, если проблема все еще не устранена, новые аликвоты SYBR. И наоборот, если только один из ампликонов (теломера или ген с одной копией) имеет низкую эффективность, то причиной затруднения, скорее всего, является один из праймеров. Интерпретация пиков кривой расплава, представленная на рисунке 8, может служить источником ключевой информации для поиска и устранения неисправностей. Визуализация двух пиков кривой расплавления может быть использована для выявления потенциальных проблем с конкретным образцом, поскольку отдельный образец проблемы будет выделяться из общего тренда пиков, демонстрируемого стандартами или оставшимися аналитическими образцами. Кривая расплава также может быть использована для диагностики проблем с конкретным грунтовкой, если пики для данного ампликона систематически менее острые, чем для другого.
В этой рукописи подробно описывается, как успешно настроить анализ MMqPCR для измерения TL с широкой применимостью к исследованиям в области общественного здравоохранения, а также представлены ключевые рекомендации по контролю качества и устранению неполадок с целью повышения доступности и надежности этого эффективного и экономичного метода.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы выразить признательность Консультативному комитету исследовательской сети теломер и финансированию Национального института по проблемам старения / Национального института наук об окружающей среде (U24 AG066528 и U24 AG066528-S1), которые сделали эту работу возможной.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.5mL Tubes | USA Scientific | 1605-0099 | Seal-Rite 0.5mL Microcentrifuge Tubes, Sterile Storage Temperature and Conditions: Room temperature |
| 1.5mL Tubes | USA Scientific | 1615-5599 | Seal-Rite 1.5mL Microcentrifuge Tubes, Sterile Storage Temperature and Conditions: Room temperature |
| 100mM DTT | In House | Not Applicable | Made with stock DTT, diluted sodium acetate, and PCR Grade H2O Storage Temperature and Conditions: minus 20 °C |
| 15mL Tubes | Thermo Fisher | 14-959-53A | Corning 352196 Falcon 15mL Conical Centrifuge Tubes Storage Temperature and Conditions: Room temperature |
| 1M MgCl2 | Thermo Fisher | 50152107 | Biotang Inc 1M MgCl2 1M Magnesium Chloride Solution, Prepared in 18.2 Megohms Water and Filtered through 0.22 Micron Filter Storage Temperature and Conditions: 4 °C |
| 1x Gold Buffer | In House | Not Applicable | 10X Gold Buffer diluted with PCR Grade H2O Storage Temperature and Conditions: minus 20 °C |
| 25mM dNTPs | New England BioLabs | N0446S | Deoxynucleotide Solution Set Storage Temperature and Conditions: minus 20 °C |
| 5mL Tubes | Thermo Fisher | 3391276 | Argos Technologies Microcentrifuge Tubes – 5mL Storage Temperature and Conditions: Room temperature |
| 96 Well Plate | Bio-Rad | HSP9601 | Hard-Shell 96-Well PCR Plates, Low Profile, Thin Wall, Skirted, White / Clear Storage Temperature and Conditions: Room temperature |
| Aluminum Foil | Office Depot | 3489072 | Reynolds Wrap Stanard Aluminum Foil Roll, 12" x 75', Silver Storage Temperature and Conditions: Room temperature |
| AmpliTaq Gold Kit – Polymerase and Buffer | Thermo Fisher | 4311806 | AmpliTaq Gold DNA Polymerase with Gold Buffer and MgCl2 (MgCl2 in this kit is not used), 10X Gold Buffer, 2.5U AmpliTaq Gold Polymerase Storage Temperature and Conditions: minus 20 °C |
| Betaine | Thermo Fisher | AAJ77507AB | Betaine, 5M Solution, Molecular Biology Grade, Ultrapure, 10mL Storage Temperature and Conditions: minus 20 °C |
| Big Tube Rack | Thermo Fisher | 344817 | Fisherbrand 4-Way Tube Rack Storage Temperature and Conditions: Room temperature |
| CFX Maestro Software | Bio-Rad | 12004110 | Software for real-time PCR plate setup, data collection, statistics, and graphiing of results Storage Temperature and Conditions: Room temperature |
| CFX96 Optical Reaction Module for Real-Time PCR Systems with Starter Package | Bio-Rad | 1845096 | 96-well optical module for real-time PCR Storage Temperature and Conditions: Room temperature |
| DTT | Fisher Scientific | AAJ1539706 | Dithiothreitol, >99.5+ Molecular Biology Grade, 5 g Storage Temperature and Conditions: minus 20 °C |
| ELIMINase | Fisher Scientific | 04-355-32 | ELIMINase Laboratory Decontaminant Storage Temperature and Conditions: Room temperature |
| HEPA Filter | USA Scientific | Replacement Filters | High-Efficiency Particulate Air Filter for AirClean Workstations Storage Temperature and Conditions: Room temperature |
| Kimwipes | Thermo Fisher | 06666A | Kimberly-Clark Professional Kimtech Science Kimwipes Delicate Task Wipers, 1-Ply Storage Temperature and Conditions: Room temperature |
| Loading Trough | Thermo Fisher | 14387069 | Thermo Scientific Matrix Reagent Reservoirs Storage Temperature and Conditions: Room temperature |
| Microsoft Excel | Microsoft | Not Applicable | Microsoft 365 package, Excel software application Storage Temperature and Conditions: Room temperature |
| Mini Centrifuge | Genesee Scientific | 31-500B | Poseidon 31-500B Mini Centrifuge, Blue Lid Storage Temperature and Conditions: Room temperature |
| PCR Grade H2O | Thermo Fisher | AM9937 | Nuclease-Free Water (not DEPC-Treated) Storage Temperature and Conditions: Room temperature |
| PCR Hood | USA Scientific | 4263-2588 | Nucleic Acid Workstation with HEPA Filtration, AirClean Systems Combination PCR Workstation Storage Temperature and Conditions: Room temperature |
| PCR Strips | Thermo Fisher | AB0776 | Low Profile Tubes and Flat Caps, Strips of 8 Storage Temperature and Conditions: Room temperature |
| PCR Tube Rack | Thermo Fisher | 344820 | Fisherbrand 96-Well PCR Tube Rack Storage Temperature and Conditions: Room temperature |
| Pipette Tips (Multichannel) | Ranin | 17005860 | Pipette Tips SR LTS 20µL F 960A/5, 20µL Maximum Storage Temperature and Conditions: Room temperature |
| Pipette Tips (Single Channel) | USA Scientific | 1181-3850 | 10µL Graduated TipOne RPT Filter Tips Storage Temperature and Conditions: Room temperature |
| Pipette Tips (Single Channel) | USA Scientific | 1180-1850 | 20µL Beveled TipOne RPT Filter Tips Storage Temperature and Conditions: Room temperature |
| Pipette Tips (Single Channel) | USA Scientific | 1111-0880 | 200µL Natural TipOne Pipette Tips in Racks Storage Temperature and Conditions: Room temperature |
| Pipette Tips (Single Channel) | USA Scientific | 1111-2890 | 1000µL Natural Graduated TipOne Pipette Tips in Racks Storage Temperature and Conditions: Room temperature |
| Pipettors (Multichannel) | Ranin | 17013802 | Pipet-Lite Multi Pipette L8-10XLS, 0.5 to 10µL Storage Temperature and Conditions: Room temperature |
| Pipettors (Multichannel) | Ranin | 17013803 | Pipet-Lite Multi Pipette L8-20LS+, 2 to 20µL Storage Temperature and Conditions: Room temperature |
| Pipettors (Single Channel) | Thermo Fisher | F144802G | Gilson Pipetman Classic Pipets, 1 to 10µL Storage Temperature and Conditions: Room temperature |
| Pipettors (Single Channel) | Thermo Fisher | F123600 | Gilson Pipetman Classic Pipets, 2 to 20µL Storage Temperature and Conditions: Room temperature |
| Pipettors (Single Channel) | Thermo Fisher | F123601 | Gilson Pipetman Classic Pipets, 20 to 200µL Storage Temperature and Conditions: Room temperature |
| Pipettors (Single Channel) | Thermo Fisher | F123602 | Gilson Pipetman Classic Pipets, 200 to 1000µL Storage Temperature and Conditions: Room temperature |
| Plate Sealing Film | Bio-Rad | MSB1001 | Microseal “B” PCR Plate Sealing Film, Adhesive, Optical Storage Temperature and Conditions: Room temperature |
| Plate Spinner | Thermo Fisher | 14-100-141 | Fisherbrand Mini Plate Spinner Centrifuge, 230 V Storage Temperature and Conditions: Room temperature |
| Pre-Hood Filter | USA Scientific | 4235-3724 | Prefilter for AirClean Systems Workstations Storage Temperature and Conditions: Room temperature |
| R Software | The R Project for Statistical Computing | Not Applicable | R version 4.2.2 Storage Temperature and Conditions: Room temperature |
| Scale | Thermo Fisher | 01-922-329 | OHAUS 30430060 PR Series Analytical Balance, 62g Capacity Storage Temperature and Conditions: Room temperature |
| Scissors | Office Depot | 458612 | Office Depot Brand Scissors, 8”, Straight, Black, Pack of 2 Storage Temperature and Conditions: Room temperature |
| Sharpies | Sharpie | 2151734 | Brush Twin Permanent Markers, Black Storage Temperature and Conditions: Room temperature |
| Single Copy Gene Forward Primer | Integrated DNA Technologies | Custom | See separate table Storage Temperature and Conditions: minus 20 °C when rehydrated |
| Single Copy Gene Reverse Primer | Integrated DNA Technologies | Custom | See separate table Storage Temperature and Conditions: minus 20 °C when rehydrated |
| Small Tube Rack | Thermo Fisher | 21-402-17 | Thermo Fisher 8601 Reversible Microtube Racks with Lid Storage Temperature and Conditions: Room temperature |
| Sodium Acetate | Thermo Fisher | J63560.EQE | 3M NaOAc pH 5.2 Storage Temperature and Conditions: Room temperature |
| Stainless Steel Spatula | Thermo Fisher | 3990240 | Bel-Art SP Scienceware Stainless-Steel Sampling Spoon and Spatula Storage Temperature and Conditions: Room temperature |
| SYBR Green | Thermo Fisher | S7563 | SYBR Green I Nucleic Acid Gel Stain – 10,000X Concentrate in DMSO Storage Temperature and Conditions: minus 20 °C when rehydrated |
| Syringe Filters | Fisher Scientific | 09-927-55A | GD/X 25 mm Sterile Syringe Filter, cellulose acetate filtration medium, 0.2 μm Storage Temperature and Conditions: Room temperature |
| Syringes | Thermo Fisher | 148232A | BD Luer-Lok Disposable Syringes without Needles, 10mL Storage Temperature and Conditions: Room temperature |
| TE Buffer | Fisher Scientific | BP2474100 | TE Buffer, Tris-EDTA, 1X Solution, pH 7.6, Molecular Biology, Fisher BioReagents Storage Temperature and Conditions: Room temperature |
| Telomere Forward Primer | Integrated DNA Technologies | Custom | See separate table Storage Temperature and Conditions: minus 20 °C when rehydrated |
| Telomere Reverse Primer | Integrated DNA Technologies | Custom | See separate table Storage Temperature and Conditions: minus 20 °C when rehydrated |
| UV Light | USA Scientific | 4288-2540 | UV Light Bulb for Workstations Storage Temperature and Conditions: Room temperature |
| Vortex | Thermo Fisher | 14-955-151 | Fisherbrand Mini Vortex Mixer, 115 V, 50/60 Hz Storage Temperature and Conditions: Room temperature |
| Weigh Boat | Thermo Fisher | 01-549-752 | Fisherbrand Sterile Hexagonal Weighing Boat, 10mL Storage Temperature and Conditions: Room temperature |
Ссылки
- Hemann, M., Strong, M., Hao, L., Greider, C. The shortest telomere, not average telomere length, is critical for cell viability and chromosome stability. Cell. 107 (1), 67-77 (2001).
- Xu, L., Li, S., Stohr, B. A. The role of telomere biology in cancer. Ann Rev Pathol: Mech Dis. 8, 49-78 (2013).
- Lindrose, A., Drury, S. Minimum reporting recommendations for pcr-based telomere length measurement. Telomere Research Network. , (2020).
- Verhulst, S., et al. Commentary: The reliability of telomere length measurements. Int J Epidemiol. 44 (5), 1683-1686 (2015).
- Aubert, G., Hills, M., Lansdorp, P. M. Telomere length measurement-caveats and a critical assessment of the available technologies and tools. Mutat Res. 730 (1-2), 59-67 (2012).
- Mundstock, E., et al. Effect of obesity on telomere length: Systematic review and meta-analysis. Obesity. 23 (11), 2165-2174 (2015).
- Haycock, P. C., et al. Leucocyte telomere length and risk of cardiovascular disease: Systematic review and meta-analysis. BMJ. 349, 4227(2014).
- Astuti, Y., Wardhana, A., Watkins, J., Wulaningsih, W. Cigarette smoking and telomere length: A systematic review of 84 studies and meta-analysis. Environ Res. 158, 480-489 (2017).
- Ridout, K. K., Ridout, S. J., Price, L. H., Sen, S., Tyrka, A. R. Depression and telomere length: A meta-analysis. J Affect Disord. 191, 237-247 (2016).
- Wang, Q., Zhan, Y., Pedersen, N. L., Fang, F., Hägg, S. Telomere length and all-cause mortality: A meta-analysis. Ageing Res Rev. 48, 11-20 (2018).
- Hu, R., Hua, X. G., Jiang, Q. C. Associations of telomere length in risk and recurrence of prostate cancer: A meta-analysis. Andrologia. 51 (7), e13304(2019).
- Schneider, C. V., et al. Association of telomere length with risk of disease and mortality. JAMA Inter Med. 182 (3), 291-300 (2022).
- Deng, Y., et al. Telomere length and the risk of cardiovascular diseases: A mendelian randomization study. Front Cardiovasc Med. 9, 1012615(2022).
- D'mello, M. J., et al. Association between shortened leukocyte telomere length and cardiometabolic outcomes: Systematic review and meta-analysis. Circulation: Cardiovasc Gene. 8 (1), 82-90 (2015).
- Wilbourn, R. V., et al. The relationship between telomere length and mortality risk in non-model vertebrate systems: A meta-analysis. Philos Trans R Soc Lond B Biol Sci. 373 (1741), 20160447(2018).
- Gardner, M., et al. Gender and telomere length: Systematic review and meta-analysis. Exp Gerontol. 51, 15-27 (2014).
- Lai, T. -P., Wright, W. E., Shay, J. W. Comparison of telomere length measurement methods. Philos Trans R Soc Lond B Biol Sci. 373 (1741), 20160451(2018).
- Cawthon, R. Telomere measurement by quatitative pcr. Nuc Acid Res. 30 (10), e47-e53 (2002).
- Cawthon, R. M. Telomere length measurement by a novel monochrome multiplex quantitative pcr method. Nuc Acid Res. 37 (3), e21-e21 (2009).
- Lindrose, A. R., et al. Method comparison studies of telomere length measurement using qpcr approaches: A critical appraisal of the literature. PLoS One. 16 (1), e0245582(2021).
- Lin, J., et al. Effects of DNA extraction, DNA integrity, and laboratory on the precision of qpcr-based telomere length measurement - a multi-lab impartial study. bioRxiv. , (2022).
- Wilfinger, W. W., Mackey, K., Chomczynski, P. Effect of ph and ionic strength on the spectrophotometric assessment of nucleic acid purity. Biotechniques. 22 (3), 474-481 (1997).
- Boesenberg-Smith, K. A., Pessarakli, M. M., Wolk, D. M. Assessment of DNA yield and purity: An overlooked detail of pcr troubleshooting. Clin Microbiol Newsletter. 34 (1), 1-6 (2012).
- Harley, C. B., Futcher, A. B., Greider, C. W. Telomeres shorten during ageing of human fibroblasts. Nature. 345 (6274), 458-460 (1990).
- Kimura, M., et al. Measurement of telomere length by the southern blot analysis of terminal restriction fragment lengths. Nat Protoc. 5 (9), 1596-1607 (2010).
- Ye, Q., et al. Telomere length and chronological age across the human lifespan: A systematic review and meta-analysis of 414 study samples including 743,019 individuals. Ageing Res Rev. 90, 102031(2023).
- Axelrad, M. D., Budagov, T., Atzmon, G. Telomere length and telomerase activity; a yin and yang of cell senescence. J Vis Exp. (75), e50246(2013).
- Liu, M., et al. Immune-mediated inflammatory diseases and leukocyte telomere length: A mendelian randomization study. Front Genetics. 14, 1129247(2023).
- Van Ockenburg, S., et al. Stressful life events and leukocyte telomere attrition in adulthood: A prospective population-based cohort study. Psychol Med. 45 (14), 2975-2984 (2015).
- Zong, Z. Q., et al. Ambient air pollution exposure and telomere length: A systematic review and meta-analysis. Public Health. 215, 42-55 (2023).
- Tang, L., Li, D., Wang, J., Su, B., Tian, Y. Ambient air pollution, genetic risk and telomere length in uk biobank. J Expo Sci Environ Epidemiol. , (2023).
- Aubert, G., Hills, M., Lansdorp, P. Telomere length measurement-caveats and a critical assessment of the available technologies and tools. Mutat Res. 730 (1), 59-67 (2012).
- Lin, J., et al. Systematic and cell type-specific telomere length changes in subsets of lymphocytes. J Immunol Res. 2016, 5371050(2016).
- Needham, B. L., et al. Socioeconomic status, health behavior, and leukocyte telomere length in the national health and nutrition examination survey, 1999-2002. Soc Sci Med. 85, 1-8 (2013).
- Verhulst, S. Improving comparability between qpcr-based telomere studies. Mol Ecol Res. 20 (1), 11-13 (2020).
- Dagnall, C. L., et al. Effect of pre-analytic variables on the reproducibility of qpcr relative telomere length measurement. PloS one. 12 (9), e0184098(2017).
- Lin, J., Smith, D. L., Esteves, K., Drury, S. Telomere length measurement by qpcr-summary of critical factors and recommendations for assay design. Psychoneuroendocrinology. 99, 271-278 (2019).
- Wolf, S. E., et al. Cross-tissue comparison of telomere length and quality metrics of DNA among individuals aged 8 to 70 years. PLOS One. 19 (2), e0290918(2024).
- RoDer, B., FruHwirth, K., Vogl, C., Wagner, M., Rossmanith, P. Impact of long-term storage on stability of standard DNA for nucleic acid-based methods. J Clin Microbiol. 48 (11), 4260-4262 (2010).
- Dagnall, C., et al. Effect of pre-analytic variables on the reproducibility of qpcr relative telomere length measurement. PLoS One. 12 (9), e0184098(2017).
- Shao, W., Khin, S., Kopp, W. C. Characterization of effect of repeated freeze and thaw cycles on stability of genomic DNA using pulsed field gel electrophoresis. Biopreserv Biobank. 10 (1), 4-11 (2012).
- Institute for Statistics and Mathematics of WU. The Comprehensive R Archive Network. , Available from: https://cran.r-project.org/ (2024).
- Nakagawa, S., Schielzeth, H. Repeatability for Gaussian and non-Gaussian data: a practical guide for biologists. Biol Rev. 85 (4), 935-956 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены