Method Article
单色多重定量 PCR 端粒长度测量
* 这些作者具有相同的贡献
摘要
在这里,我们提出了一种使用单色多重定量聚合酶链反应 (MMqPCR) 测定法测量相对端粒长度 (TL) 的方案。MMqPCR 检测是一种可重复、高效且具有成本效益的方法,用于在基于人群的研究中测量人类 DNA 中的 TL。
摘要
端粒是位于所有真核染色体末端的核糖核蛋白结构,可保护 DNA 免受损伤并保持染色体稳定性。端粒长度 (TL) 与各种暴露、生物过程和健康结果有关。本文介绍了我们实验室常规进行的单色多重定量聚合酶链反应 (MMqPCR) 测定方案,用于测量人类 DNA 的相对平均 TL。有几种不同的基于 PCR 的 TL 测量方法,但本出版物中介绍的 MMqPCR 方法的特定方案是可重复的、高效的、具有成本效益的,并且适用于基于人群的研究。该详细方案概述了研究人员在其实验室中建立该检测所需的所有信息。此外,该协议提供了通过该测定提高 TL 测量可重复性的具体步骤,该测定由同一样品重复测量的类内相关系数 (ICC) 定义。ICC 是评估特定研究人群的预期功效的关键因素;因此,报告任何 TL 检测的队列特异性 ICC 是提高基于人群的 TL 研究整体严谨性的必要步骤。利用从外周血单核细胞中提取的 DNA 样品的示例结果证明了使用该 MMqPCR 方案生成高度可重复的 TL 数据的可行性。
引言
端粒是在所有真核染色体末端发现的保护复合物,由高度保守、重复的 DNA 序列和相关蛋白质组成。端粒保护 DNA 的完整性,保持染色体的稳定性。由于滞后链 DNA 合成不完全、DNA 损伤和其他因素,端粒在分裂细胞中发生进行性缩短 1,2。越来越多的证据支持端粒长度 (TL) 作为人类一生中衰老和年龄相关疾病的生物标志物,同时用于评估 TL 在人类暴露、疾病和健康研究中的作用的 TL 测量测定类型的增加 3,4,5。荟萃分析报告了 TL 与总死亡率、环境暴露和健康结果(包括癌症、心血管疾病和糖尿病)的关联 6,7,8,9,10,11,12,13 .这些元关联源自利用二十多种不同 TL 测量方法之一的研究,其中关联强度在不同方法之间往往有所不同 14,15,16。为研究选择最佳的 TL 测量方法是确保准确结果的关键步骤,因为每种方法都有自己的优点和缺点 5,17。
由于试剂成本相对较低、分析周转时间短、可扩展性好且初始 DNA 要求较低,因此在进行大量样品的研究、难以获得高 DNA 浓度样品的研究或优先考虑高通量的研究时,通常优先使用基于 PCR 的 TL 测量技术。第一种基于 PCR 的 TL 测量方法,即最初由 Richard Cawthon 开发的单重定量聚合酶链反应 (qPCR),利用端粒 (T) 和单拷贝基因 (S) 扩增的荧光信号的比率,在单独的 PCR 板上运行18。在这种方法中,使用与重复端粒 DNA 序列 (T) 互补的引物来扩增样品中的端粒 DNA 总含量,并通过检测荧光报告基因 SYBR green 进行定量。同样,与保守的单拷贝 (S) 基因的基因间区域互补的引物用于量化基因组拷贝数。这两个估计值是相对于项目中所有检测中使用的基因组 DNA 标准曲线进行量化的,以控制板间差异。将总端粒 DNA (T) 除以单个基因组拷贝数 (S) 可得出 T/S 比值,这是一种无单位的相对测量值,代表单个 DNA 样品每个细胞的平均端粒含量18,19。因此,T/S 比不是功能长度的特定测量;然而,与文献规范一致,我们在整个协议中使用术语每个样本的平均 TL。
该方法在 2009 年得到推进,当时 Richard Cawthon 将单色多重 qPCR (MMqPCR) 检测描述为一种可能降低相对于原始单重 qPCR 方法的 T/S 比率变异性的方法19。MMqPCR 检测具有 qPCR 检测的优势,并且具有使用一个报告荧光基团测量同一反应孔内的 T 和 S 信号的额外优势,从而减少相对于单重 qPCR 的误差,从而获得更高的精度和重现性19。此外,这种多重方法可能会降低成本并提高通量,因为与单重检测相比,所需的反应次数减少了一半 19。
鉴于 MMqPCR TL 测量的优势,该方法非常适合 TL 与暴露、健康结果和生物过程关联的基于人群的研究。但是,启动该方法可能具有挑战性。为了应对这些挑战,我们详细描述了我们实验室使用的 MMqPCR TL 测量方案,重点介绍了为提高检测精度、降低污染风险和增强可重复性而实施的关键步骤。
此外,该协议概述了清理数据和计算组内相关系数 (ICC) 的步骤,ICC 是 TL 测量可重复性的重要统计指标2。通过我们的代表性结果,我们证明了使用该协议产生高 ICC 的能力。此外,我们还确定了质量控制 (QC) 和故障排除步骤,以期减少 TL 测量值的变化并增加最终的 ICC。由于该方法具有高重复性、效率和成本效益,MMqPCR TL 测量是流行病学 TL 研究的理想选择。 图 1 提供了本协议中描述的 MMqPCR 方法的直观概述。
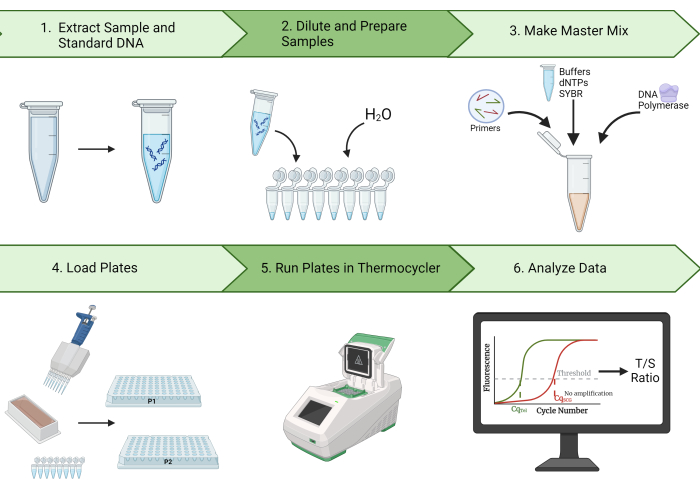
图 1:方法概述。 用于测量端粒长度的单色多重定量聚合酶链反应方法的广泛概述。 请单击此处查看此图的较大版本。
研究方案
这项研究是按照机构指南进行的。该方案描述了在一式三份的测量深度进行的 MMqPCR 测定,即在一式两份板上重复对每个样品进行一式三份测量,同时使用两台热循环仪实施以提高通量。使用重复板是实施该方案的首要考虑因素,以实现高 ICC 所表明的高重现性。尽管可以使用更少的重复,但需要仔细考虑对 ICC 的影响,以及随后的功效和所需的样本量,并由每个实验室对每个队列进行测量20,21。如果只有一台热循环仪可用,我们建议保持测量深度(即一式三份),并按顺序运行 2 个板。
1. 备料和储存条件
- 有关用于本协议的所有材料和设备,请参阅 材料表。此外,有关用于 MMqPCR 检测的特定预混液试剂和用量,请参见 表 1。如果按顺序运行两个板,则在保持浓度的同时将预混液体积减半,确保在同一测定的连续板中使用相同的试剂等分试样。
注:所有储备试剂应提前准备,等分的试剂应在使用前完全解冻。 - 将 1x Tris-EDTA,pH 7.6 (TE) 分装并储存在 5 mL 试管中,体积为 3 mL,室温下保存长达 2 年。
- 将 5 M 甜菜碱分装并储存在 5 mL 试管中,体积为 1,280 μL,在 -20 °C 下保存长达 1 年。
- 将 SYBR Green 分装并储存在 -20 °C 的单个 PCR 联管中,保存时间长达 2 年,用箔纸覆盖,尽量减少光照。
- 将 DNA 聚合酶在 -20 °C 的原始试管中储存长达 1 年。
- 将 10x 聚合酶缓冲液分装并储存在 1.5 mL 试管中,体积为 660 μL,在 -20 °C 下保存长达 1 年。
- 如需 10x 聚合酶缓冲液的 1x 缓冲液稀释液,在 0.5 mL 试管中加入 9.9 μL 10x 缓冲液到 89.1 μL PCR 级 H2O 中;在 -20 °C 下储存长达 1 年。
- 将 1 M MgCl2 分装并储存在 0.5 mL 试管中,体积为 70 μL,在 4 °C 避光条件下保存长达 1 年。
- 将正向和反向端粒 (T) 和单个 (S) 拷贝基因寡核苷酸冻干引物在室温下避光储存。 表 2 中列出了四种特异性寡核苷酸引物序列。
注意:该方案中的单拷贝基因是白蛋白;如果选择不同的单拷贝基因,则可能需要调整引物浓度以确保可接受的 PCR 效率。- 引物重构:涡旋每个冻干引物管 10 秒,然后将试管放入迷你离心机中 5 秒,以确保冻干沉淀在试管底部,然后再加入 1x TE 缓冲液。
- 检查每个引物管的 nM 浓度 ([nM] = α),并通过添加 1x TE 等于 10x α 值(以 μL 为单位)来再水化每个引物管(例如,如果管上的 nM 浓度读数为 24.6 nM,则向引物管中加入 246 μL 的 1x TE)以制备每种引物的 100 μM 溶液。
- 分别以 16 μL 体积分装正向和反向端粒引物,以 11 μL 体积分装正向和反向白蛋白引物。将所有四种类型的引物等分试样在 -20 °C 下储存长达 6 个月。
- dNTP 混合物:涡旋四种 dNTPS 类型的 25 mM 储备溶液中的每一种 4-8 管(即总共 16-32 管)10 秒,然后使用微型离心机在室温下快速旋转。将试管均匀分布在微型离心机的试管位置,然后盖上盖子,让机器达到全速,旋转约 5 秒。
- 在 5 mL 试管中,从每支试管中加入 200-250 μL,确保添加四种 dNTP 类型中的每一种均等量,然后涡旋 dNTP 混合物。
- 将 210 μL 混合物分装在 0.5 mL 试管中,并在 -20 °C 下储存长达 1 年。
- 将库存 DTT 储存在 -20 °C 并在室温下储存 3 M 乙酸钠。
- DTT 解决方案:使用不锈钢刮刀在秤上测量去皮重船中的 0.1545 g DTT。
注意:二硫苏糖醇 (DTT) 是一种有害试剂。吞咽 DTT 有害,会引起皮肤刺激,并可能导致严重的眼睛损伤。个人在处理 DTT 时应佩戴防护手套、护目镜和面部防护装置。此外,个人应避免吸入 DTT 蒸气,在处理 DTT 时在 PCR 罩中工作,并避免长时间或反复接触。 - 在 15 mL 试管中加入 33.33 μL 3 M 乙酸钠和 9,967 μL PCR 级 H2O,制备 10 mL 0.01 M 乙酸钠,并涡旋孔。将测得的 DTT 加入 15 mL 的 0.01 M 乙酸钠管中。将大约 100 μL 的 0.01 M 乙酸钠溶液转移到称量舟中,以收集残留的 DTT。将 100 μL 移回 15 mL 试管中。一旦所有 DTT 都进入溶液中,涡旋试管直至其完全溶解。
- 将 15 mL 试管的内容物倒入上样槽中,从上样槽的一端将整个溶液吸出到 10 mL 塑料注射器中。将无菌 0.2 μm 醋酸纤维素针头过滤器连接到装满的注射器末端 25 mm,完全饱和 1 分钟,然后轻轻向下推注射器柱塞,将溶液缓慢滴入新的 15 mL 管中,确保整个溶液通过过滤器滴入新的 15 mL 管中。
- 将 200 μL 体积的 DTT 溶液分装到 0.5 mL 试管中,并在 -20 °C 下储存长达 6 周。
- DTT 解决方案:使用不锈钢刮刀在秤上测量去皮重船中的 0.1545 g DTT。
表 1:试剂的最终体积和浓度。 单个等分试样、预混液和 PCR 孔中试剂的体积和浓度。 请点击此处下载此表格。
表 2:端粒和单拷贝基因寡核苷酸引物序列。 该方法中使用的端粒和白蛋白单拷贝基因引物序列列表。 请点击此处下载此表格。
2. 基因组 DNA 提取和样品制备
- 分析样品的提取:根据制造商的指南,使用试剂盒或实验室内的既定方法对样品进行基因组 DNA 提取。
- 使用分光光度计检查 DNA 样品质量,并使用荧光计检查双链 DNA (dsDNA)。对于平均 260/280 和 260/230 比率不可接受或 dsDNA 浓度低于检测 (<0.20 ng/μL) 的样品,不应分析 TL22,23。此外,如果 dsDNA 浓度太高而无法使用荧光计 (>1000 ng/μL) 生成读数,请稀释样品,然后重复检测。
注:对于此处提供的结果,可接受的核酸纯度值为 1.6 至 2.0 之间的 260/280 比率和 2.0 至 2.2 之间的 260/230 比率。
- 使用分光光度计检查 DNA 样品质量,并使用荧光计检查双链 DNA (dsDNA)。对于平均 260/280 和 260/230 比率不可接受或 dsDNA 浓度低于检测 (<0.20 ng/μL) 的样品,不应分析 TL22,23。此外,如果 dsDNA 浓度太高而无法使用荧光计 (>1000 ng/μL) 生成读数,请稀释样品,然后重复检测。
- 对照样品的提取:对对照样品进行基因组 DNA 提取,该样品来源于与给定项目分析的主题样品相同的生物材料。确保为整个队列预期运行的所有板提取足够的对照 DNA,以便所有检测都使用单一 DNA 标准品。
- 通过分光光度计和荧光计检查对照 DNA 样品质量。对照样品应具有可接受的平均 260/280 和 260/230 比率以及可检测的 dsDNA 浓度22,23。
- 将浓度为 2 ng/μL 的对照 DNA 分装在 150 μL 量的 0.5 mL 试管中,并标明样品类型和日期。将对照 DNA 等分试样在 -20 °C 下储存长达 5 年。对来自同一队列或研究项目的所有样品的所有板使用一个对照 DNA 样品。提前准备这些储备等分试样。
- 分析样品的制备:对于起始浓度为 >5 ng/μL 的样品,使用整数稀释因子制备稀释等分试样,加入适量提取的 DNA 样品(补充文件 1 MMqPCR 设置表,F 列)和 PCR 级 H2O(补充文件 1 MMqPCR 设置表,G 列),将浓度稀释至 2.5 - 5.0 ng/μL 之间(补充文件 1 MMqPCR 设置表,K 列)。请勿稀释浓度为 <5 ng/μL 的样品,但应分装足够的体积以使用此方案对样品进行 3 次检测。
注:样品制备过程中必须进行等分稀释,以便将 15 ng DNA 添加到每个样品的相应 PCR 联管中。样品等分试样使技术人员能够在样品未通过质量标准并需要重新运行时避免不必要的冻融循环影响样品储备液 DNA 的完整性。 补充文件 1 中的样本 MMqPCR 模板可以帮助确定正确的稀释因子和体积,以制备稀释等分试样(补充文件 1,MMqPCR 设置表,E-I 列)。- 按照 补充文件 1 MMqPCR 设置表中列出的详细信息,并在 表 3 中列出适当稀释的样品量(补充文件 1 MMqPCR 设置表,列在 L 列)和 PCR 级 H2O 量(补充文件 1 MMqPCR 设置表,M 柱),每个 PCR 管的 DNA 总量为 15 ng,总体积为 75 μL。将其放在一边。
注:PCR 条中的样品可以在 4 °C 下储存过夜,以便在第二天接种。
- 按照 补充文件 1 MMqPCR 设置表中列出的详细信息,并在 表 3 中列出适当稀释的样品量(补充文件 1 MMqPCR 设置表,列在 L 列)和 PCR 级 H2O 量(补充文件 1 MMqPCR 设置表,M 柱),每个 PCR 管的 DNA 总量为 15 ng,总体积为 75 μL。将其放在一边。
- 标准曲线的制备:解冻对照 DNA 等分试样,涡旋 30 秒,离心 5 秒,然后将全体积 (150 μL) 吸出到标准曲线 (SC) PCR 试管联管中的第一管中。
- 将 70 μL PCR 级 H2O 移液管移液到 SC PCR 试纸条的第 2 管至第 8 管中。在吸出 70 μL 并将其分配到第二个 PCR 管中之前,将对照 DNA 彻底重悬于第一管中。等待 30 秒,然后将溶液彻底重悬于第二个 PCR 管中,然后吸出 70 μL 并将其分配到第三个 PCR 管中。对试管 3 至 7 重复此操作,以产生 7 个标准品的 2 倍连续稀释液。最终试管应仅含有 PCR 级 H2O 以用作非模板对照 (NTC)。将 SC PCR 条放在一边。
表 3:样品板和对照标准品的组织。 所有样品和标准品在 96 孔 PCR 板上的位置。 请点击此处下载此表格。
3. MMqPCR 预混液制备
- 收集 表 1 中列出的预混试剂等分试样(DNA 聚合酶除外),并让它们在 PCR 罩内达到室温。将 1 μL SYBR Green 等分试样添加到 1x 缓冲液等分试样中。
注意:由于分析过程中移液器准确性的限制,需要这个确切的量来产生正确浓度的 SYBR,因此即使一次只运行一个板,该量也应保持不变。 - 将所有等分试样涡旋 10 秒,离心 5 秒,然后将以下量的试剂添加到装有 5 M 甜菜碱的 5 mL 试管(现为预混管)中:1,235.2 μL PCR 级 H2O、640 μL 10x 缓冲液、204.8 μL dNTP、192 μL DTT、 64 μL MgCl2、48 μL SYBR Green / 1x 缓冲液(来自步骤 3.1)、14.4 μL 两种端粒引物和 9.6 μL 两种白蛋白引物,如 表 1 所示。
- 从 -20 °C 储存中取出 DNA 聚合酶,涡旋 10 秒,离心 5 秒,然后缓慢加入 128 μL 到预混液中;立即将 DNA 聚合酶移回 -20 °C 储存。
- 涡旋 5 mL 预混管 30 秒。
4. 96 孔板的制备
- 将两个 96 孔板、加载槽和多通道移液器吸头放入 PCR 罩内。用板号(1 或 2)标记每个板。将板 1(P1 板)旋转 180°,使柱数倒置。让板二 (P2) 面向技术人员。
- 将 5 mL 预混液管的内容物倒入上样槽中。使用移液器吸头收集和分配试管中残留的任何溶液。
- 将吸头加载到多通道移液器上,推动每个移液器吸头的底部以确保紧密密封。检查吸头在将吸出预混液的输出区域内是否没有任何过滤器;如果有一块过滤器,则更换尖端。
- 使用反向移液将粘性预混液填充板中,旋转加载槽,然后按下移液器柱塞通过第一个挡块,将大于 15 μL 的吸液量吸入移液器吸头,确保吸头同时以相同的体积填充。将预混液排入色谱柱时,将柱塞压至第一个止动点,将多余的预混液留在移液器吸头中。压下柱塞,将吸头浸回上样槽中,然后松开柱塞,再填充 15 μL 吸头。使用相同的吸头填充两个板。
- 先将预混液排出到所有偶数列或所有奇数列中,然后在板之间交替填充(即,如果技术人员选择从奇数列编号开始,则首先填充 P2 上的第 1 列,然后是 P1 上的第 11 列,然后是 P2 上的第 3 列,依此类推)。在技术人员从左到右填充了该系列的所有井(奇数或偶数)后,以相同的方式填充其他系列(偶数或奇数)的列。有关此过程的图表,请参见 图 2 。
注意:这种板填充方式的作用是控制跨板的位置效应。
- 先将预混液排出到所有偶数列或所有奇数列中,然后在板之间交替填充(即,如果技术人员选择从奇数列编号开始,则首先填充 P2 上的第 1 列,然后是 P1 上的第 11 列,然后是 P2 上的第 3 列,依此类推)。在技术人员从左到右填充了该系列的所有井(奇数或偶数)后,以相同的方式填充其他系列(偶数或奇数)的列。有关此过程的图表,请参见 图 2 。
- 涡旋包含样品和标准曲线的四个封闭 PCR 条,然后在微型离心机中旋转每个 5 秒。
- 按照它们在板上的放置顺序将 PCR 试纸条在 PCR 管架上对齐。对于 P1,前 3 列是样品(PCR 联排 A),第 4-6 列是标准品(PCR 联排 S),第 7-9 列是样品(PCR 联排 B),第 10-12 列是样品(PCR 联排 C;参见 图 3 和 表 3)。由于 P2 是在相对于技术人员旋转 180° 时填充的,因此柱子将是相反的。
- 将两个板旋转 180°,使柱数相对于每个板的技术人员翻转(即,如果技术人员之前面对 P2 的标签,现在他们将在板边缘面对 P1 的标签)。
- 将多通道移液器设置为 10 μL,并按照步骤 4.3 中的说明将移液器吸头加载到多通道移液器上。
- 使用多通道移液器重悬溶液,然后按照步骤 4.4 中的说明执行反向移液,从 PCR 联排 A 开始吸出并分配 10 μL 样品和标准溶液。
- 使用 PCR 联排管 A 填充每个板的前 3 列,以与将预混液放入板中类似的方式(即偶数或奇数)交替排列各列。
- 使用标准曲线 PCR 条填充接下来的三列。对于该试纸条,使用设置为 ~90 μL 的 200 μL 移液器彻底重悬第 7 个标准稀释管(倒数第二个),然后使用多通道移液器重悬整个试纸条。
注:由于混合不良,该管中较大体积和较小的 DNA 浓度经常导致 PCR 板孔的测量值不同。使用更大体积混合该试管可以更好地使 DNA 溶液均质化。 - 用 PCR 试纸条 B 填充接下来的三列,用 PCR 试纸条 C 填充最后三列。更换每个 PCR 试纸条之间的移液器吸头,用相应的样品和对照标准品填充两个板上的所有 96 孔,如图 3 所示。
- 填充板后,轻轻敲击工作台上的板,确保孔侧面的液体流到底部,然后使用密封膜覆盖板顶部。用指尖按压薄膜的所有边缘,以确保紧密密封。
- 通过在罩顶上旋转 30 秒来混合板,然后将密封板放入板旋转器中 2 分钟,孔口朝向中心。
- 将板放入热循环仪中,板的列数按清晰的顺序排列。在关闭热循环仪顶部之前,使用干净的纸巾清洁每个板的顶部。
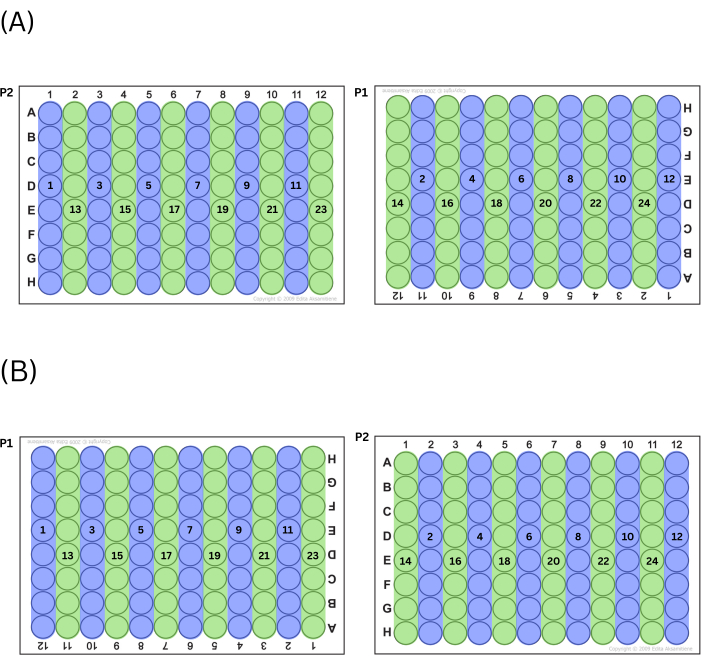
图 2:填充板的过程。 (A) 如果选择先填充奇数列,则这是填充孔的顺序。(B) 如果选择先填充偶数列,则这是填充孔的顺序。 请单击此处查看此图的较大版本。
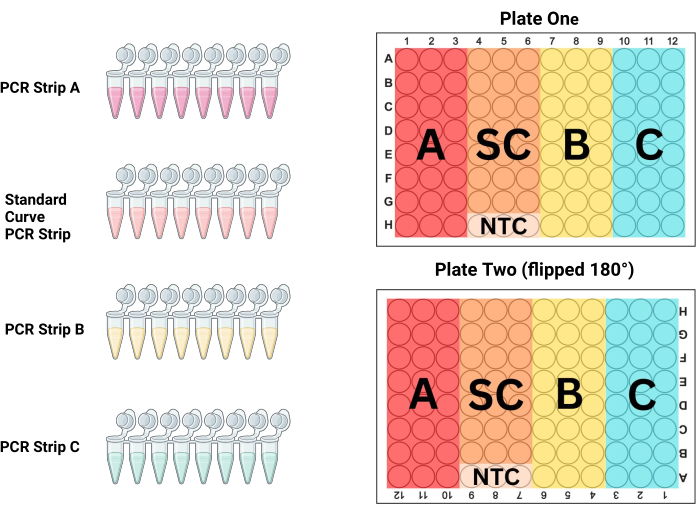
图 3:板布局。 PCR 联管 A、联排 B、联排 C 和标准曲线 (SC) 联排都应用于填充每个板上的三列,以产生每个样品和标准品稀释的一式三份。此图显示了每个条带应填充哪些列。上样前,第二板翻转 180°(请注意,列和行标题是倒置的),但板的填充方式与第一板相同,从而消除了潜在的移液错误,同时仍能控制跨板的位置效应。 请单击此处查看此图的较大版本。
5. MMqPCR 热循环
- 在步骤 4.8.1 中旋转板时,打开计算机和热循环仪。打开热循环仪软件。该协议描述了 CFX Maestro 软件的使用。
- 根据 MMqPCR 热循环方案19 创建 TL 热循环方案(图 4)。
- 添加孵育步骤,在 95 °C 下激活 DNA 聚合酶 15 分钟。
- 为避免引物 - 二聚体结合,运行 94 °C 15 秒、49 °C 1 分钟的两个循环,然后运行 94 °C 15 秒、59 °C 15 秒的 3 个循环。
- 对于端粒扩增,添加 27 个 85 °C 循环 15 秒,74 °C 30 秒,然后进行信号采集。
- 对于白蛋白扩增,添加 31 个 94 °C 循环 15 秒,84 °C 30 秒,然后进行信号采集。
- 在热循环方案中,包括从 59 °C 到 95 °C 的熔解曲线,间隔 5 秒,每个增加度。
- 单击两个热循环仪的 Start Run 。出现提示时,提供分析文件的标题。
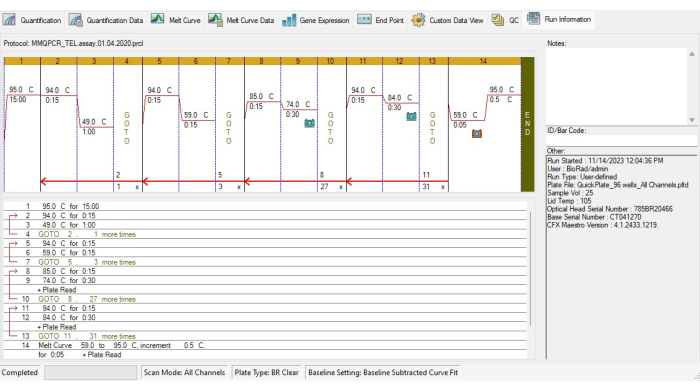
图 4:MMqPCR 检测的热循环曲线。 根据原始热循环方案19 在软件中创建的 MMqPCR 方案。 请单击此处查看此图的较大版本。
6. MMqPCR 数据分析
- 热循环完成后,按以下方式分析数据,以产生已处理样品的 TL 值。
- 在软件中,选择 Plate Setup(微孔板设置 )功能。在下拉菜单中,单击 View/Edit Plate。
- 突出显示所有孔并单击 Select Fluorophores(选择荧光团),然后选中标记为 SYBR 的框并取消选中所有其他框。单击 OK。
- 当所有孔仍突出显示时,在 Load(加载)字样旁边,选中 SYBR 旁边的框。现在所有井都应该写上 SYBR。
- 接下来,突出显示标准对照连续稀释液顶部或底部的三个 NTC 孔,然后从右侧的样品类型菜单中选择 NTC 。这三个井现在应该是黄色的,称为 NTC。 图 5A 显示了应该为 P1 选择哪些孔, 图 5B 显示了应该为 P2 选择哪些孔。
注意:P2 将从 P1 反转,因此 NTC 将位于 P1 的第 4-6 列底部,P2 将位于第 7-9 列的顶部。 - 突出显示标准对照系列稀释液的 21 个孔,然后从样品类型菜单中选择 Standard( 标准 )。这些井应该是绿色的。当这些孔仍然高亮显示时,单击 Technical Replicate (技术复制)。从 Replicate Size 菜单中选择 3 ,然后选择 Horizontal > Apply 。这些孔应从 Std-1 到 Std-7 以三个为一组进行标记。
- 当标准品仍高亮显示时,向下滚动并选择 Dilution Series (稀释系列)。在 Dilution Factor(稀释因子)字段中,输入 2,然后根据板号键入稀释起始浓度和方向性,如以下步骤所述。
- 对于 P1 板,在起始浓度字段中输入 2.00E-03,选中 Reducing 复选框,然后选择 Apply。21 个孔中的值应在每个孔中写入浓度值,范围从上到下从 2.00E-03 到 3.13E-05。
- 对于 P2 板,在起始浓度字段中输入 3.13E-5,选中 Increasing 复选框,然后选择 Apply。21 个孔中的值应在每个孔中写入浓度值,范围从上到下从 3.13E-05 到 2.00E-03。
- 对于样品,突出显示 PCR 试纸条 A 的列(P1 和 P2 为 1-3),从样品类型菜单中选择“未知”,然后选择“技术重复”。从 Replicate Size 菜单中选择 3,然后选择 Horizontal > Apply。这些列的孔应为蓝色,并以从 Unk-1 到 Unk-8 的 3 个为一组逐行标记。
- 对 PCR 试纸条 B 的色谱柱(P1 的第 7-9 列和 P2 的第 4-6 列)重复步骤 6.3。它们应该被标记为 Unk-9 到 Unk-16。
- 对 PCR 条 C 的色谱柱(P1 和 P2 的色谱柱 10-12)重复步骤 6.3。它们应该被标记为 Unk-17 到 Unk-24。完成步骤 6.2-6.3.2 后,板设置窗口应类似于 图 5A、B。
- 选择板编辑器窗口右下角的 OK 。单击 “是 ”以在出现提示时应用更改。
- 对于检测水平 QC,确保定量选项卡中的曲线适用于热循环曲线的第 9 步和第 12 步(例如,无倒置的扩增曲线),分别对应于端粒和白蛋白扩增子。曲线可通过软件窗口右中侧的下拉菜单访问。 图 6A、B 显示了适当的曲线。
- 确保步骤 9 和步骤 12 报告的 PCR 效率在 90% 和 110% 之间,并且这两个效率之间的差异不超过 10%(即,步骤 9 为 92.4%,步骤 12 为 98% 是合适的,但步骤 9 为 92.4% 和步骤 12 为 108% 是不合适的)。此外,确保标准 R2 曲线为 >0.995。如果 P1 或 P2 不符合这些标准,则需要重新运行板。
- 对于 P1,选择 步骤 9 并突出显示与标准曲线对应的 21 个孔,如图 6A、B 所示。复制软件窗口右下角的 Cq 值。打开作为 补充文件 1 提供的端粒数据表模板,然后将这些值粘贴到标准 1 工作表的 B 列中。选择 步骤 12 ,然后复制这些 Cq 值。将这些值粘贴到标准 1 页的第 I 列中。
- 确定步骤 9 中的斜率值,并将其键入标准 1 工作表的单元格 C4 中。确定步骤 12 中的斜率值,并将其键入标准 1 工作表的单元格 J4 中。
注:系统使用步骤 6.6.1 中确定的标准曲线的斜率计算引物的效率百分比。可以使用以下公式手动计算效率百分比: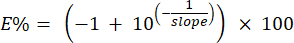
- 确保每个标准稀释液一式三份的变异系数 (CV) 小于 0.1。如果大于或等于 0.1,则从板上 7 点标准连续稀释曲线中包含的所有浓度的对照样品中排除最多三个单独的孔。任何一式三份组中只应排除一个孔。
注:从软件分析中排除标准点将改变两种引物报告的斜率、R、y 截距和效率。因此,从分析中删除任何标准孔后,必须重复步骤 6.5.1-6.6.1。 - 对 P2 分析文件和相应的标准 2 图纸重复步骤 6.6.1 - 6.6.2。
- 只有当标准 1 和标准 2 图纸都带有可接受的 CV 时,才从分析文件中收集单个样品数据。确保在 P1 v P2 表 L 列中报告 QC 调整,例如,P1 分析文件中排除了多少孔。
- 确定步骤 9 中的斜率值,并将其键入标准 1 工作表的单元格 C4 中。确定步骤 12 中的斜率值,并将其键入标准 1 工作表的单元格 J4 中。
- 确保 P1 分析文件中只有 72 个样品孔在“定量”选项卡中以蓝色突出显示,如下所示 图 7A,B.选择 步骤 9.复制软件窗口右下角的 Cq 和 SQ 值。将这些值粘贴到样本 P1 工作表中,从单元格 D3 开始。选择 步骤 12 然后复制这些 Cq 和 SQ 值,并粘贴到样本 P1 工作表中,从单元格 F3 开始。
- 对 P2 分析文件和相应样品 P2 表中的样品重复此步骤。端粒与单个拷贝 (T/S) 的比率(列 H)是自动计算的,但可以使用以下公式手动计算:
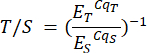
其中 ET/S 分别是靶向端粒或单拷贝基因的反应的指数扩增效率,CqT/S 是靶向端粒含量的给定复制或单拷贝基因达到荧光定量临界阈值的周期。平均 T/S 比值(列 I)通过每个样品的 6 次测量计算。
注意:CFX 中的样品 ID 号与两个板中的相同生物样品不对应。端粒数据表模板考虑了这种差异,并将对齐适当的一式三份。 - 在 CFX Maestro 中,检查所有分析样品的 Cq 值是否介于标准曲线的最低和最高 Cq 值之间,如图 7B 所示。如果样品超出 图 7A 所示的范围,则需要在浓度调整后重新运行。Cq 值低于最高浓度标准品的样品必须稀释大约于超出范围的扩增循环数,而 Cq 值高于最低浓度标准品的样品需要浓缩接近超出阈值的扩增循环数的倍数。
注:分析样品浓度的较大差异会带来额外的潜在变异水平,应谨慎使用。 - 确保 NTC 中的起始浓度小于样品孔中 DNA 平均量的 5%。这可以通过查看 MMqPCR 的样品 P1 和样品 P2 纸上的水污染百分比来检查。如果 NTC 指示污染,则重新运行板。
注:由于 MMqPCR 检测的灵敏度,轻微的不可控污染可能偶尔会导致 NTC 孔扩增。然而,这种扩增应该是轻微的,并且在热循环方案的步骤 12 中单拷贝基因扩增后发生几个周期。 - 对于样品级 QC,请查看样品 P1 和样品 P2 表中的标准偏差 (SD)(列 J)和 CV(列 K)。确保样品一式三份 T/S 比率的板内 CV 小于 0.10 (10%)。为了校正任何大于 0.1 的板内 CV,可以排除一组一式三份中的一个 T/S 比值。
注:每个样品的 6 次测量中只能排除一个总仿行,即不能在 P1 和 P2 上排除同一样品的仿行。 - 检查 P1 v P2 片材 G 列中的单个样品板间 CV 是否小于 0.05 (5%)。要校正任何大于 0.05 的 CV,请从两个板的每个样品的六次测量中排除一个 T/S 比率。目视检查后,对板内一式三份进行目视检查,并根据需要排除所有六次测量。
注:只有通过这些 QC 标准(板内 CV < 10%)和板间 CV < 5% 的样品才能包含在最终 TL 结果中。否则,应将样品排除在本次运行的 P1 v P2 和 ICC 数据表中,并在第二次 MMqPCR 检测中重新评估样品。 - 对于板级 QC,检查位于样品 P1 和样品 P2 折叠底部的每个板上所有样品的平均板内变化是否小于 0.05 (5%)。对于其他板级 QC,检查 P1 v P2 片(单元格 G29)中的总体板间变化是否小于 0.06 (6%)。确保从单元格 G30 的板间 CV 计算中删除未通过 QC 的样品。
注:当使用相关样品组(例如,家庭成员、不同时间点等)时,一个组中的所有样品都需要在同一板上运行。因此,如果该组的一个样品未通过 QC 标准,则必须重新运行该组中的所有样品。 - 在单独的整体队列或实验数据文件中,记录通过 QC 的每个样品的最终 TL 数据(P1 v P2 表,列 I)、每个通过 QC 的样品的 ICC 计算(ICC 数据表,E-K 列)以及 P1 v P2 表的最终分析运行 QC 数据(列 J-L)
- 对 P2 分析文件和相应样品 P2 表中的样品重复此步骤。端粒与单个拷贝 (T/S) 的比率(列 H)是自动计算的,但可以使用以下公式手动计算:
- 使用端粒研究网络 (TRN) 创建的 补充文件 2 计算项目20 的 ICC。
- 最后,为了提高 TL 研究之间的可比性,使用以下等式将单独的整体队列或实验数据文件中每个样本的最终 TL 数据转换为 Z 分数,其中队列中所有样本的平均 T/S 比率从单个样本 T/S 比率中减去,然后除以队列中所有样本的 SD。
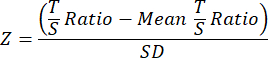
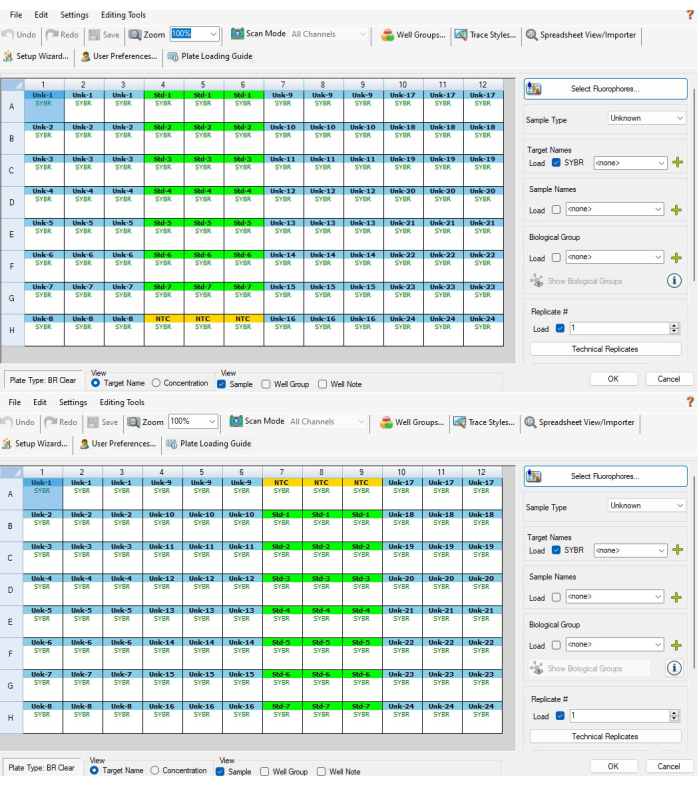
图 5:基于软件的微孔板设置。 (A) 完成步骤 6.2-6.4 后,对 P1 板进行基于软件的板设置。(B) 完成步骤 6.2-6.4 后,P2 板的基于软件的板设置。由于软件根据孔位置分配样品 ID 的方式(即 P1 上的 CFX 样品 1 是 P2 上的 CFX 样品 24),因此样品和标准 ID 在两个 CFX 板之间未对齐。补充文件 1 中提供的 excel 模板对此进行了解释,确保在相同生物样品上进行的板间测量彼此正确对齐请单击此处查看此图的较大版本。
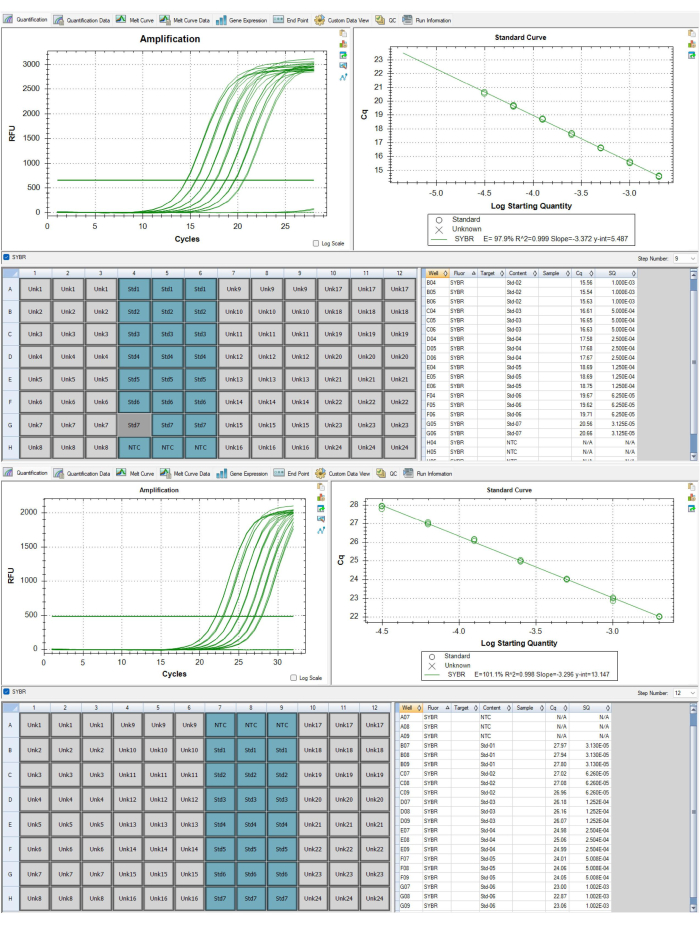
图 6:telomere 和白蛋白扩增子的标准曲线。(A) 该标准曲线来自代表性结果数据集的 P1 端粒扩增子。一个标准品因不符合 QC 标准而被删除。(B) 该标准曲线来自代表性结果数据集的 P2 白蛋白扩增子。 请单击此处查看此图的较大版本。
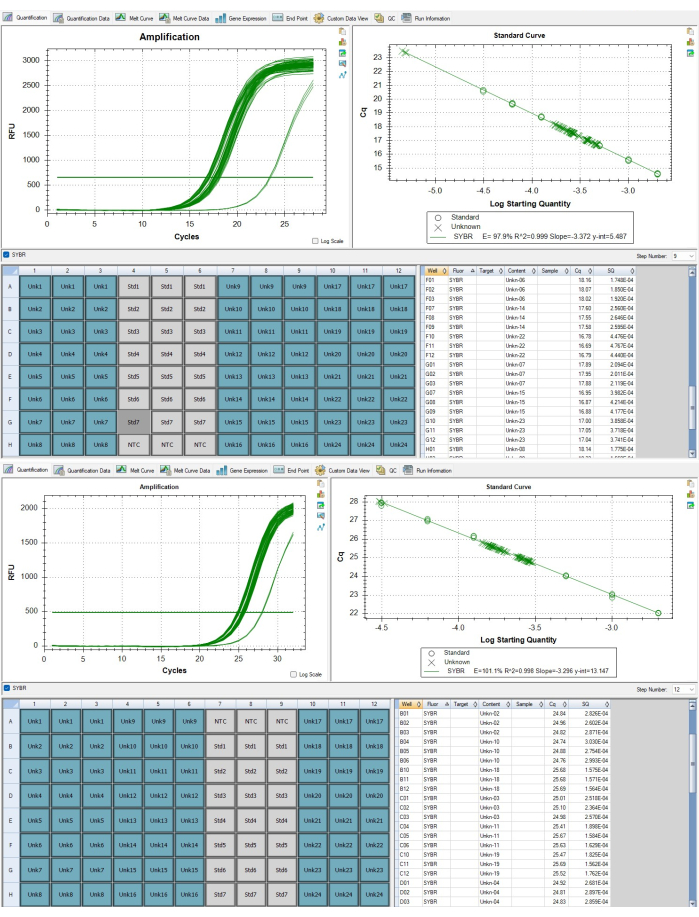
图 7:端粒和单拷贝基因扩增子。 (A) 软件中显示的代表性结果中报告的样品的端粒扩增和 (B) 白蛋白基因扩增。 请单击此处查看此图的较大版本。
7. MMqPCR 数据报告
- 当使用从 MMqPCR 创建的 TL 数据报告研究结果时,请确保报告 TRN 最低报告指南中描述的项目。这些指南可以在 TRN 网站 (https://trn.tulane.edu/resources/reporting-guidelines/) 上找到,补充文件 3 中提供了报告此信息的模板。在适当的情况下引用此协议和其他 TRN 指南和资源。
结果
表 4 和表 5 中提供的结果提供了遵循协议获得的高度可重复的 TL 测量的示例。对于这些结果,根据制造商指南,使用商业试剂盒从 24 个外周血单核细胞 (PBMC) 样品中提取 DNA。这 24 个样品在两个 96 孔板上运行。使用平均 260/280 比值、平均 260/230 比值和 dsDNA 浓度,通过分光光度计和荧光计检查所有 DNA 样品的质量,以确定检测合格性和样品稀释因子(表 6)。表 6 还强调了定量 dsDNA 浓度的重要性,这与使用分光光度计测量的 DNA 浓度可能不同。这种可变性是不同量化方法的结果。具体来说,分光光度计根据 280 nm 处的吸收度得出 DNA 浓度,并且容易受到污染物(例如蛋白质、盐等)影响吸光度读数的波动的影响。相比之下,使用荧光计测量的 dsDNA 浓度是由与 dsDNA 特异性结合的染料的荧光确定的,因此被认为更准确地反映了 DNA 含量。DNA 样品在 MMqPCR TL 分析之前经历了多达三个冻融循环。对照 DNA 是从单个个体的 PBMC 混合 DNA 提取中提取而成,用于制备从 2 ng/μL 至 0.0313 ng/μL DNA 的七点连续稀释液。为 PCR 步骤 9(端粒扩增子)和步骤 12(本方案中的单拷贝基因扩增子、白蛋白)创建的独立标准曲线如图 6A、B 所示。这些分析在市售实时荧光定量 PCR 检测系统上运行,该系统生成了一条熔解曲线,显示了在不同温度下产生的单个扩增子产物,如图 8 所示。
表 4:输出 MMqPCR 测量数据以获得最佳代表性结果。 24 个样品的平均 T/S 比值、SD 、CV 和 Z 评分 TL。 请点击此处下载此表格。
表 5:端粒长度数据输出。 在软件中分析来自 MMqPCR 分析的原始数据,然后添加到作为 补充文件 1 附带的电子表格模板中,以进行进一步分析和 QC。此 TL 模板输出表提供了数据摘要,显示了两个板中每个样品的样品 ID、平均 TL、SD 和 CV。 请点击此处下载此表格。
表 6:样品结果的分光光度计和荧光计 DNA 质量指标。 来自重复分光光度计分析和单个荧光计测量 dsDNA 和每个样品中任何污染物的 QC 数据。 请点击此处下载此表格。
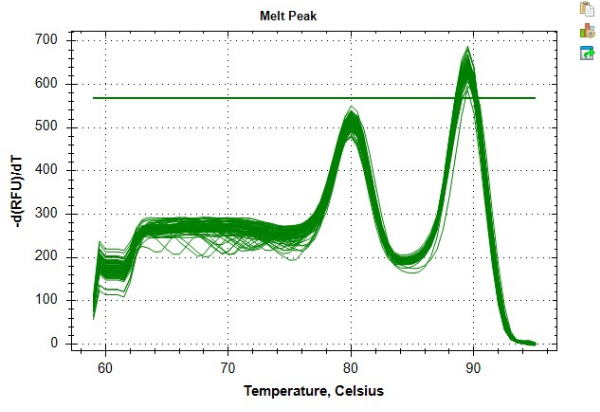
图 8:熔融曲线示例。 软件中生成的样品数据的熔解曲线。较早的峰 ~80 °C 代表端粒扩增子,~89 °C 的次级峰代表白蛋白扩增子。 请单击此处查看此图的较大版本。
对于该项目,平均端粒效率为 98.6%,范围为 90.7 至 102.1,平均白蛋白效率为 102.3%,范围为 93.6 至 108.2。从标准曲线中平均去除了 0.97 个重复,符合本方案的 QC 标准。平均板间 CV 为 1.83%,SD 为 0.00616,平均板内 CV 为 3.78%,SD 为 0.00658。这些代表性样本的平均 TL 如 表 4 和表 5 所示。 平均 TL 为 1.37,SD 为 0.24,范围为 0.84 至 2.32。 表 4 列出了每个样品的 T/S 比、SD、CV 和 Z 评分 TL。由于 MMqPCR 测定的 T/S 比率输出是 TL 的相对测量值,因此将比率转换为该 Z 分数以允许交叉研究比较。该项目的 ICC 是使用 R 脚本计算的,如 补充文件 2 中的 TRN 指南所述,考虑了批处理和运行效应20。为了计算项目内 ICC,我们重新运行了 10% 的通过样品,确保使用队列每个板中至少一个样品填充 ICC 板。总体项目 ICC 为 0.801 [CI: 0.703, 0.86] 表明 TL 结果的高重现性。
并非所有结果都是最佳的。 图 9 和 表 7 中的结果显示了 MMqPCR 检测的次优结果。 图 9 显示了端粒效率低于 90% 的标准曲线,低于 QC 标准,需要重复整个板。引物效率问题通常是由于试剂问题引起的,因此跟踪试剂的等分日期和过期时间非常重要,这是确定哪种试剂导致效率低下的第一步。过期的试剂应在再次运行板之前更换。 表 7 显示了通过初始样品级 QC 标准的板,但板之间的差异性很大,导致板级 QC 失败。板之间的差异通常是由于移液和板填充技术的错误。在这种情况下,技术人员应评估孔板设置过程中出现的任何问题,并确保移液器已校准。
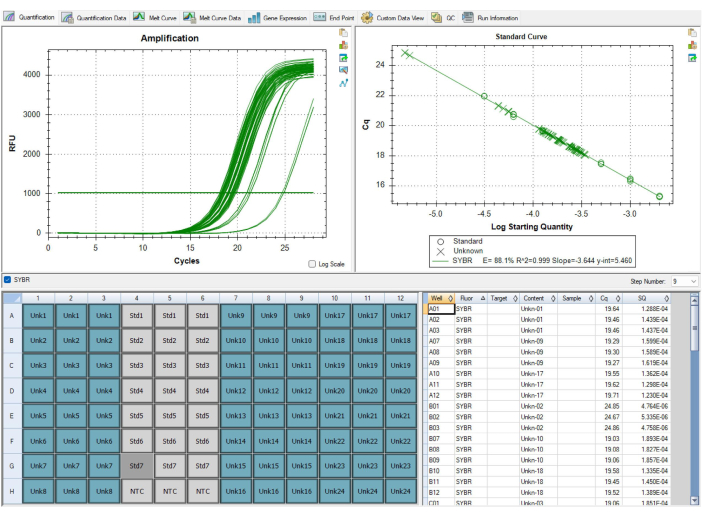
图 9:次优结果。 软件中显示的标准曲线未能通过 QC,因为端粒引物的扩增效率低于 90%。该图像来自 P1,但 P2 的效率同样较低。此次运行的数据无法使用,所有样品在更换过期的致病试剂后都需要再次运行。 请单击此处查看此图的较大版本。
表 7:次优结果。 该表显示了许多样品不符合 QC 标准的运行的端粒数据模板。根据 CV 值确定需要重新运行的样品,然后将样品名称更改为红色字体以便于识别。 请点击此处下载此表格。
补充文件 1: 端粒数据电子表格模板。 请点击此处下载此文件。
补充文件 2: ICC 计算。该协议由 Telomere Research Network (TRN) 创建。此文件已从20 修改。 请点击此处下载此文件。
补充文件 3: TRN 报告指南。 请点击此处下载此文件。
讨论
在 2002 年之前,在更大规模的基于人群的研究中,最常用的 TL 测量方法是末端限制性片段长度 (TRF) 的 Southern 印迹分析24,25。尽管 TRF 在专业实验室中提供了出色的精度和重现性,但由于所需 DNA 的数量和质量以及通量有限,其适用性受到限制,因此为基于 qPCR 的 TL 检测以及随后的 MMqPCR 检测的利用增加提供了背景。MMqPCR TL 方法在设置、优化和维护时提供可重复的 TL 测量,并仔细注意每个 QC 标准。需要计算和报告分析的每个队列的特定 ICC,以确保检测的可靠性。虽然受 DNA 质量和技术专长的影响,但 MMqPCR 方法非常适合研究 TL 的大规模人群研究,因为它需要少量 DNA,比单重 PCR 更可靠,并且比其他方法在试剂成本和技术人员时间方面更有效。生成高 ICC 的能力提供了额外的数据,以支持将 MMqPCR 用于基于人群的大型 TL 研究。MMqPCR TL 测量可应用于广泛的研究,旨在定义 TL 作为全因死亡率、衰老、终生压力、环境暴露和身体健康结果(如心血管疾病和癌症)的生物标志物的作用 4,7,8,10,11,12,13,26,27,28, 29,30,31.
MMqPCR 方法的一个局限性是它将 TL 报告为 T/S 比值,这是长度的相对估计值,根据单拷贝基因的选择、预混液组成和 PCR 循环参数而变化32。T/S 比率是无单位的。因此,如果不与其他 TL 测量方法相结合,该方法无法报告碱基对值 18,33,34 的估计值。因此,必须将 T/S 比转换为 Z 分数才能在研究中具有相关性35。在实验室、方法和检测中执行此操作时,应格外小心。此外,与基于凝胶的杂交测定一样,该方法可以包括间质端粒的定量。然而,这些序列在每个基因组的总端粒 DNA 含量中只占非常小的比例。此外,间隙端粒序列更有可能包含错配的碱基对序列,这些序列偏离了经典端粒重复序列,从而降低了引物结合和扩增的可能性。此外,虽然 MMqPCR 检测所需的 DNA 量最少是有利的,但需要注意的是,基于 qPCR 的 TL 测量受影响 DNA 质量和完整性的分析前因素的影响,包括样品储存条件、DNA 提取方法和生物组织36,37。已经表明,这些因素的分析控制可以提高使用 qPCR38 生成的 TL 测量的外部有效性。即便如此,还需要系统地评估 MMqPCR 检测产生的 DNA 质量差异对 TL 的影响,因为目前没有数据指导来确定样品是否具有足够的质量来使用这种方法生成准确的 TL 估计。尽管存在这些限制,但该测定法在人群水平健康结果研究中的应用是相当大的。
使用 MMqPCR 检测时,需要持续评估精度和通量。按照目前的设计,技术人员使用两台热循环仪在两份板上同时运行一式三份样品。在没有多台热循环仪的情况下,我们建议保留一式三份的测量并按顺序运行板,以提高精度,即使以降低通量为代价。任何优先考虑通量而不是精度的决定,例如采用一式三份测量,在继续分析分析样品之前,都应同时对所得 ICC 进行全面测试和评估。在做出有关通量和精度的决策时,必须考虑样品量和样品 DNA 的质量。较小的样本量或质量较差的 DNA 样本需要优先考虑更高的精度23。当使用来自相关组(例如,家庭成员、具有多个时间点的受试者)的样本时,这一点更为重要。在这些情况下,仔细规划,例如在开始实验之前将相关样品分配到同一板,是防止因无意的逐板分组混杂而损失统计功效的一种方法。
对于该测定,使用分光光度计评估 DNA 样品质量:260/280 比率在 1.6-2.0 和 260/230 比率范围内 2.0-2.2 的样品被认为是可以接受的。这种质量评估和通过荧光计对双链 DNA 的准确评估是该方案中获得可重复 TL 数据的关键步骤。其他更具描述性的 DNA 完整性测量方法,例如片段大小和/或通过琼脂糖凝胶测定的 DNA 质量汇总测量(例如 DNA 完整性值)也可用于确定样品质量38。我们还建议仅在运行 MMqPCR 检测的样品制备时进行样品稀释。这确保了 DNA 等分试样在提取后经过尽可能少的操作,从而减少了分析前处理的可变性。如果需要运输 DNA 样品,则应将其以尽可能高的浓度装在干冰上运输,以减轻较低浓度 DNA 样品中发生的降解39,40。由于冻融循环会发生 DNA 降解,因此应尽量减少冻融 DNA 储备的次数41。在运行队列之前,应创建混合对照 DNA 的等分试样,并在运行分析之前创建单个分析 DNA 样品的等分试样。
分析性能和 QC 的关键指标包括 NTC 信号、板间和板内 CV 以及标准曲线 R2。未能满足 QC 标准可以通过多种方式减轻。定期更换 PCR 级 H2O 储备液,并为每对板运行分装 PCR 级 H2O 储备液,将最大限度地减少污染源和 NTC 扩增。减少污染的其他步骤包括:指定一个专门用于 MMqPCR 检测的特定 PCR 罩;用 DNA 去污溶液擦拭 PCR 通风橱和设备;用紫外线照射房间;并在 PCR 罩中练习无菌技术。为了提高检测的可重复性并降低 CV,建议在移取 DNA 样品时,在各自的涡旋步骤中用力涡旋样品、稀释液和 PCR 条,并彻底重悬。低于阈值标准 R2 曲线 (<0.995) 很可能是由于孔板加载过程中的移液误差。为避免这种情况,请特别注意精确移液并每年校准移液,上样前充分混合标准 PCR 条,并仔细组织耗材以促进高效的工作流程。如果使用两台机器和一个板观察到输出始终更高的 CV,则应对机器进行维修,作为改善问题的潜在方法。制造商提供的 QC 板应定期在板上运行,以评估热循环仪的性能。
如果在应用上述建议的步骤后问题仍然存在,则可以使用以下步骤对协议进行故障排除。记录所有试剂的等分时间和任何相关的有效期,有助于在不可避免地出现困难时简化故障排除过程。任何故障排除过程的一个重要部分是一次只调整一种试剂,以确定板未通过 QC 标准的具体原因,从最便宜的试剂开始。例如,如果端粒和单拷贝基因的效率都较低,则共享试剂(如 DTT、dNTP 或 SYBR 等分试样)比扩增子特异性引物更可能是原因。按照标价,应按照 DTT 的顺序测试新的等分试样,然后是 dNTP,最后,如果问题仍然存在,则测试新的 SYBR 等分试样。相反,如果只有一个扩增子(端粒或单拷贝基因)效率低,则困难的原因更可能是引物之一。 图 8 中所示熔解曲线峰的解释可以作为故障排除的关键信息来源。两个熔解曲线峰的可视化可用于识别特定样品的潜在问题,因为单个问题样品将从标准品或其余分析样品表现出的峰的一般趋势中脱颖而出。如果给定扩增子的峰系统性地不如另一个峰尖锐,则熔解曲线也可用于诊断特定引物的问题。
本手稿详细介绍了如何成功设置用于测量 TL 的 MMqPCR 检测方法,该检测试剂盒具有广泛的公共卫生研究适用性,并介绍了 QC 和故障排除的关键建议,目的是提高这种高效且具有成本效益的方法的可及性和可靠性。
披露声明
作者没有什么可披露的。
致谢
作者要感谢端粒研究网络咨询委员会和美国国家老龄化研究所/国家环境健康科学研究所的资助(U24 AG066528 和 U24 AG066528-S1),他们使这项工作成为可能。
材料
| Name | Company | Catalog Number | Comments |
| 0.5mL Tubes | USA Scientific | 1605-0099 | Seal-Rite 0.5mL Microcentrifuge Tubes, Sterile Storage Temperature and Conditions: Room temperature |
| 1.5mL Tubes | USA Scientific | 1615-5599 | Seal-Rite 1.5mL Microcentrifuge Tubes, Sterile Storage Temperature and Conditions: Room temperature |
| 100mM DTT | In House | Not Applicable | Made with stock DTT, diluted sodium acetate, and PCR Grade H2O Storage Temperature and Conditions: minus 20 °C |
| 15mL Tubes | Thermo Fisher | 14-959-53A | Corning 352196 Falcon 15mL Conical Centrifuge Tubes Storage Temperature and Conditions: Room temperature |
| 1M MgCl2 | Thermo Fisher | 50152107 | Biotang Inc 1M MgCl2 1M Magnesium Chloride Solution, Prepared in 18.2 Megohms Water and Filtered through 0.22 Micron Filter Storage Temperature and Conditions: 4 °C |
| 1x Gold Buffer | In House | Not Applicable | 10X Gold Buffer diluted with PCR Grade H2O Storage Temperature and Conditions: minus 20 °C |
| 25mM dNTPs | New England BioLabs | N0446S | Deoxynucleotide Solution Set Storage Temperature and Conditions: minus 20 °C |
| 5mL Tubes | Thermo Fisher | 3391276 | Argos Technologies Microcentrifuge Tubes – 5mL Storage Temperature and Conditions: Room temperature |
| 96 Well Plate | Bio-Rad | HSP9601 | Hard-Shell 96-Well PCR Plates, Low Profile, Thin Wall, Skirted, White / Clear Storage Temperature and Conditions: Room temperature |
| Aluminum Foil | Office Depot | 3489072 | Reynolds Wrap Stanard Aluminum Foil Roll, 12" x 75', Silver Storage Temperature and Conditions: Room temperature |
| AmpliTaq Gold Kit – Polymerase and Buffer | Thermo Fisher | 4311806 | AmpliTaq Gold DNA Polymerase with Gold Buffer and MgCl2 (MgCl2 in this kit is not used), 10X Gold Buffer, 2.5U AmpliTaq Gold Polymerase Storage Temperature and Conditions: minus 20 °C |
| Betaine | Thermo Fisher | AAJ77507AB | Betaine, 5M Solution, Molecular Biology Grade, Ultrapure, 10mL Storage Temperature and Conditions: minus 20 °C |
| Big Tube Rack | Thermo Fisher | 344817 | Fisherbrand 4-Way Tube Rack Storage Temperature and Conditions: Room temperature |
| CFX Maestro Software | Bio-Rad | 12004110 | Software for real-time PCR plate setup, data collection, statistics, and graphiing of results Storage Temperature and Conditions: Room temperature |
| CFX96 Optical Reaction Module for Real-Time PCR Systems with Starter Package | Bio-Rad | 1845096 | 96-well optical module for real-time PCR Storage Temperature and Conditions: Room temperature |
| DTT | Fisher Scientific | AAJ1539706 | Dithiothreitol, >99.5+ Molecular Biology Grade, 5 g Storage Temperature and Conditions: minus 20 °C |
| ELIMINase | Fisher Scientific | 04-355-32 | ELIMINase Laboratory Decontaminant Storage Temperature and Conditions: Room temperature |
| HEPA Filter | USA Scientific | Replacement Filters | High-Efficiency Particulate Air Filter for AirClean Workstations Storage Temperature and Conditions: Room temperature |
| Kimwipes | Thermo Fisher | 06666A | Kimberly-Clark Professional Kimtech Science Kimwipes Delicate Task Wipers, 1-Ply Storage Temperature and Conditions: Room temperature |
| Loading Trough | Thermo Fisher | 14387069 | Thermo Scientific Matrix Reagent Reservoirs Storage Temperature and Conditions: Room temperature |
| Microsoft Excel | Microsoft | Not Applicable | Microsoft 365 package, Excel software application Storage Temperature and Conditions: Room temperature |
| Mini Centrifuge | Genesee Scientific | 31-500B | Poseidon 31-500B Mini Centrifuge, Blue Lid Storage Temperature and Conditions: Room temperature |
| PCR Grade H2O | Thermo Fisher | AM9937 | Nuclease-Free Water (not DEPC-Treated) Storage Temperature and Conditions: Room temperature |
| PCR Hood | USA Scientific | 4263-2588 | Nucleic Acid Workstation with HEPA Filtration, AirClean Systems Combination PCR Workstation Storage Temperature and Conditions: Room temperature |
| PCR Strips | Thermo Fisher | AB0776 | Low Profile Tubes and Flat Caps, Strips of 8 Storage Temperature and Conditions: Room temperature |
| PCR Tube Rack | Thermo Fisher | 344820 | Fisherbrand 96-Well PCR Tube Rack Storage Temperature and Conditions: Room temperature |
| Pipette Tips (Multichannel) | Ranin | 17005860 | Pipette Tips SR LTS 20µL F 960A/5, 20µL Maximum Storage Temperature and Conditions: Room temperature |
| Pipette Tips (Single Channel) | USA Scientific | 1181-3850 | 10µL Graduated TipOne RPT Filter Tips Storage Temperature and Conditions: Room temperature |
| Pipette Tips (Single Channel) | USA Scientific | 1180-1850 | 20µL Beveled TipOne RPT Filter Tips Storage Temperature and Conditions: Room temperature |
| Pipette Tips (Single Channel) | USA Scientific | 1111-0880 | 200µL Natural TipOne Pipette Tips in Racks Storage Temperature and Conditions: Room temperature |
| Pipette Tips (Single Channel) | USA Scientific | 1111-2890 | 1000µL Natural Graduated TipOne Pipette Tips in Racks Storage Temperature and Conditions: Room temperature |
| Pipettors (Multichannel) | Ranin | 17013802 | Pipet-Lite Multi Pipette L8-10XLS, 0.5 to 10µL Storage Temperature and Conditions: Room temperature |
| Pipettors (Multichannel) | Ranin | 17013803 | Pipet-Lite Multi Pipette L8-20LS+, 2 to 20µL Storage Temperature and Conditions: Room temperature |
| Pipettors (Single Channel) | Thermo Fisher | F144802G | Gilson Pipetman Classic Pipets, 1 to 10µL Storage Temperature and Conditions: Room temperature |
| Pipettors (Single Channel) | Thermo Fisher | F123600 | Gilson Pipetman Classic Pipets, 2 to 20µL Storage Temperature and Conditions: Room temperature |
| Pipettors (Single Channel) | Thermo Fisher | F123601 | Gilson Pipetman Classic Pipets, 20 to 200µL Storage Temperature and Conditions: Room temperature |
| Pipettors (Single Channel) | Thermo Fisher | F123602 | Gilson Pipetman Classic Pipets, 200 to 1000µL Storage Temperature and Conditions: Room temperature |
| Plate Sealing Film | Bio-Rad | MSB1001 | Microseal “B” PCR Plate Sealing Film, Adhesive, Optical Storage Temperature and Conditions: Room temperature |
| Plate Spinner | Thermo Fisher | 14-100-141 | Fisherbrand Mini Plate Spinner Centrifuge, 230 V Storage Temperature and Conditions: Room temperature |
| Pre-Hood Filter | USA Scientific | 4235-3724 | Prefilter for AirClean Systems Workstations Storage Temperature and Conditions: Room temperature |
| R Software | The R Project for Statistical Computing | Not Applicable | R version 4.2.2 Storage Temperature and Conditions: Room temperature |
| Scale | Thermo Fisher | 01-922-329 | OHAUS 30430060 PR Series Analytical Balance, 62g Capacity Storage Temperature and Conditions: Room temperature |
| Scissors | Office Depot | 458612 | Office Depot Brand Scissors, 8”, Straight, Black, Pack of 2 Storage Temperature and Conditions: Room temperature |
| Sharpies | Sharpie | 2151734 | Brush Twin Permanent Markers, Black Storage Temperature and Conditions: Room temperature |
| Single Copy Gene Forward Primer | Integrated DNA Technologies | Custom | See separate table Storage Temperature and Conditions: minus 20 °C when rehydrated |
| Single Copy Gene Reverse Primer | Integrated DNA Technologies | Custom | See separate table Storage Temperature and Conditions: minus 20 °C when rehydrated |
| Small Tube Rack | Thermo Fisher | 21-402-17 | Thermo Fisher 8601 Reversible Microtube Racks with Lid Storage Temperature and Conditions: Room temperature |
| Sodium Acetate | Thermo Fisher | J63560.EQE | 3M NaOAc pH 5.2 Storage Temperature and Conditions: Room temperature |
| Stainless Steel Spatula | Thermo Fisher | 3990240 | Bel-Art SP Scienceware Stainless-Steel Sampling Spoon and Spatula Storage Temperature and Conditions: Room temperature |
| SYBR Green | Thermo Fisher | S7563 | SYBR Green I Nucleic Acid Gel Stain – 10,000X Concentrate in DMSO Storage Temperature and Conditions: minus 20 °C when rehydrated |
| Syringe Filters | Fisher Scientific | 09-927-55A | GD/X 25 mm Sterile Syringe Filter, cellulose acetate filtration medium, 0.2 μm Storage Temperature and Conditions: Room temperature |
| Syringes | Thermo Fisher | 148232A | BD Luer-Lok Disposable Syringes without Needles, 10mL Storage Temperature and Conditions: Room temperature |
| TE Buffer | Fisher Scientific | BP2474100 | TE Buffer, Tris-EDTA, 1X Solution, pH 7.6, Molecular Biology, Fisher BioReagents Storage Temperature and Conditions: Room temperature |
| Telomere Forward Primer | Integrated DNA Technologies | Custom | See separate table Storage Temperature and Conditions: minus 20 °C when rehydrated |
| Telomere Reverse Primer | Integrated DNA Technologies | Custom | See separate table Storage Temperature and Conditions: minus 20 °C when rehydrated |
| UV Light | USA Scientific | 4288-2540 | UV Light Bulb for Workstations Storage Temperature and Conditions: Room temperature |
| Vortex | Thermo Fisher | 14-955-151 | Fisherbrand Mini Vortex Mixer, 115 V, 50/60 Hz Storage Temperature and Conditions: Room temperature |
| Weigh Boat | Thermo Fisher | 01-549-752 | Fisherbrand Sterile Hexagonal Weighing Boat, 10mL Storage Temperature and Conditions: Room temperature |
参考文献
- Hemann, M., Strong, M., Hao, L., Greider, C. The shortest telomere, not average telomere length, is critical for cell viability and chromosome stability. Cell. 107 (1), 67-77 (2001).
- Xu, L., Li, S., Stohr, B. A. The role of telomere biology in cancer. Ann Rev Pathol: Mech Dis. 8, 49-78 (2013).
- Lindrose, A., Drury, S. Minimum reporting recommendations for pcr-based telomere length measurement. Telomere Research Network. , (2020).
- Verhulst, S., et al. Commentary: The reliability of telomere length measurements. Int J Epidemiol. 44 (5), 1683-1686 (2015).
- Aubert, G., Hills, M., Lansdorp, P. M. Telomere length measurement-caveats and a critical assessment of the available technologies and tools. Mutat Res. 730 (1-2), 59-67 (2012).
- Mundstock, E., et al. Effect of obesity on telomere length: Systematic review and meta-analysis. Obesity. 23 (11), 2165-2174 (2015).
- Haycock, P. C., et al. Leucocyte telomere length and risk of cardiovascular disease: Systematic review and meta-analysis. BMJ. 349, 4227(2014).
- Astuti, Y., Wardhana, A., Watkins, J., Wulaningsih, W. Cigarette smoking and telomere length: A systematic review of 84 studies and meta-analysis. Environ Res. 158, 480-489 (2017).
- Ridout, K. K., Ridout, S. J., Price, L. H., Sen, S., Tyrka, A. R. Depression and telomere length: A meta-analysis. J Affect Disord. 191, 237-247 (2016).
- Wang, Q., Zhan, Y., Pedersen, N. L., Fang, F., Hägg, S. Telomere length and all-cause mortality: A meta-analysis. Ageing Res Rev. 48, 11-20 (2018).
- Hu, R., Hua, X. G., Jiang, Q. C. Associations of telomere length in risk and recurrence of prostate cancer: A meta-analysis. Andrologia. 51 (7), e13304(2019).
- Schneider, C. V., et al. Association of telomere length with risk of disease and mortality. JAMA Inter Med. 182 (3), 291-300 (2022).
- Deng, Y., et al. Telomere length and the risk of cardiovascular diseases: A mendelian randomization study. Front Cardiovasc Med. 9, 1012615(2022).
- D'mello, M. J., et al. Association between shortened leukocyte telomere length and cardiometabolic outcomes: Systematic review and meta-analysis. Circulation: Cardiovasc Gene. 8 (1), 82-90 (2015).
- Wilbourn, R. V., et al. The relationship between telomere length and mortality risk in non-model vertebrate systems: A meta-analysis. Philos Trans R Soc Lond B Biol Sci. 373 (1741), 20160447(2018).
- Gardner, M., et al. Gender and telomere length: Systematic review and meta-analysis. Exp Gerontol. 51, 15-27 (2014).
- Lai, T. -P., Wright, W. E., Shay, J. W. Comparison of telomere length measurement methods. Philos Trans R Soc Lond B Biol Sci. 373 (1741), 20160451(2018).
- Cawthon, R. Telomere measurement by quatitative pcr. Nuc Acid Res. 30 (10), e47-e53 (2002).
- Cawthon, R. M. Telomere length measurement by a novel monochrome multiplex quantitative pcr method. Nuc Acid Res. 37 (3), e21-e21 (2009).
- Lindrose, A. R., et al. Method comparison studies of telomere length measurement using qpcr approaches: A critical appraisal of the literature. PLoS One. 16 (1), e0245582(2021).
- Lin, J., et al. Effects of DNA extraction, DNA integrity, and laboratory on the precision of qpcr-based telomere length measurement - a multi-lab impartial study. bioRxiv. , (2022).
- Wilfinger, W. W., Mackey, K., Chomczynski, P. Effect of ph and ionic strength on the spectrophotometric assessment of nucleic acid purity. Biotechniques. 22 (3), 474-481 (1997).
- Boesenberg-Smith, K. A., Pessarakli, M. M., Wolk, D. M. Assessment of DNA yield and purity: An overlooked detail of pcr troubleshooting. Clin Microbiol Newsletter. 34 (1), 1-6 (2012).
- Harley, C. B., Futcher, A. B., Greider, C. W. Telomeres shorten during ageing of human fibroblasts. Nature. 345 (6274), 458-460 (1990).
- Kimura, M., et al. Measurement of telomere length by the southern blot analysis of terminal restriction fragment lengths. Nat Protoc. 5 (9), 1596-1607 (2010).
- Ye, Q., et al. Telomere length and chronological age across the human lifespan: A systematic review and meta-analysis of 414 study samples including 743,019 individuals. Ageing Res Rev. 90, 102031(2023).
- Axelrad, M. D., Budagov, T., Atzmon, G. Telomere length and telomerase activity; a yin and yang of cell senescence. J Vis Exp. (75), e50246(2013).
- Liu, M., et al. Immune-mediated inflammatory diseases and leukocyte telomere length: A mendelian randomization study. Front Genetics. 14, 1129247(2023).
- Van Ockenburg, S., et al. Stressful life events and leukocyte telomere attrition in adulthood: A prospective population-based cohort study. Psychol Med. 45 (14), 2975-2984 (2015).
- Zong, Z. Q., et al. Ambient air pollution exposure and telomere length: A systematic review and meta-analysis. Public Health. 215, 42-55 (2023).
- Tang, L., Li, D., Wang, J., Su, B., Tian, Y. Ambient air pollution, genetic risk and telomere length in uk biobank. J Expo Sci Environ Epidemiol. , (2023).
- Aubert, G., Hills, M., Lansdorp, P. Telomere length measurement-caveats and a critical assessment of the available technologies and tools. Mutat Res. 730 (1), 59-67 (2012).
- Lin, J., et al. Systematic and cell type-specific telomere length changes in subsets of lymphocytes. J Immunol Res. 2016, 5371050(2016).
- Needham, B. L., et al. Socioeconomic status, health behavior, and leukocyte telomere length in the national health and nutrition examination survey, 1999-2002. Soc Sci Med. 85, 1-8 (2013).
- Verhulst, S. Improving comparability between qpcr-based telomere studies. Mol Ecol Res. 20 (1), 11-13 (2020).
- Dagnall, C. L., et al. Effect of pre-analytic variables on the reproducibility of qpcr relative telomere length measurement. PloS one. 12 (9), e0184098(2017).
- Lin, J., Smith, D. L., Esteves, K., Drury, S. Telomere length measurement by qpcr-summary of critical factors and recommendations for assay design. Psychoneuroendocrinology. 99, 271-278 (2019).
- Wolf, S. E., et al. Cross-tissue comparison of telomere length and quality metrics of DNA among individuals aged 8 to 70 years. PLOS One. 19 (2), e0290918(2024).
- RoDer, B., FruHwirth, K., Vogl, C., Wagner, M., Rossmanith, P. Impact of long-term storage on stability of standard DNA for nucleic acid-based methods. J Clin Microbiol. 48 (11), 4260-4262 (2010).
- Dagnall, C., et al. Effect of pre-analytic variables on the reproducibility of qpcr relative telomere length measurement. PLoS One. 12 (9), e0184098(2017).
- Shao, W., Khin, S., Kopp, W. C. Characterization of effect of repeated freeze and thaw cycles on stability of genomic DNA using pulsed field gel electrophoresis. Biopreserv Biobank. 10 (1), 4-11 (2012).
- Institute for Statistics and Mathematics of WU. The Comprehensive R Archive Network. , Available from: https://cran.r-project.org/ (2024).
- Nakagawa, S., Schielzeth, H. Repeatability for Gaussian and non-Gaussian data: a practical guide for biologists. Biol Rev. 85 (4), 935-956 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。