A subscription to JoVE is required to view this content. Sign in or start your free trial.
Research Article
تحسين نتائج الطلاب من خلال تجربة بحثية جامعية قائمة على دورة الاستنساخ الجزيئي القابلة للتكيف
* These authors contributed equally
In This Article
Summary
تم استخدام وحدة الاستنساخ الجزيئي لتجميع جيبسون القابلة للتكيف في تنسيق تجربة البحث الجامعي المستندة إلى الدورة التدريبية (CURE) لطلاب دورة مختبر البيولوجيا الجزيئية. أظهر تقييم نتائج تعلم الطلاب تحسنا في الفهم والثقة في الاستنساخ الجزيئي بعد الانتهاء من CURE ، وتم استنساخ البلازميدات الجديدة لأبحاث التخليق الحيوي للمنتجات الطبيعية.
Abstract
يتطلب التقدم المستمر لتقنيات البيولوجيا الجزيئية تحسين مناهج البيولوجيا الجزيئية بانتظام لإعداد الطلاب بشكل فعال لدخول القوى العاملة بكفاءات حديثة. على وجه الخصوص ، أدى ظهور Gibson Assembly ، وهي تقنية استنساخ جزيئي قابلة للتخصيص وقابلة للتكيف بدرجة كبيرة ، إلى تطوير مشهد الاستنساخ الجزيئي في العديد من بيئات البحث. وهكذا ، أنشأنا وحدة استنساخ Gibson Assembly للنشر في دورة مختبرية للبيولوجيا الجزيئية في جامعة ولاية كاليفورنيا للفنون التطبيقية ، سان لويس أوبيسبو وقمنا بتقييم نتائج تعلم الطلاب من الوحدة. على مدى ثلاث تكرارات من الدورة ، شارك الطلاب في مشروع مستقل قائم على التجربة تضمن استنساخ ثلاث مكتبات بلازميد فريدة لدعم المشاريع البحثية في التخليق الحيوي للمنتجات الطبيعية. تم إعطاء الطلاب استبيانات قبل وبعد تقييم فهمهم للاستنساخ الجزيئي وثقتهم في مصطلحات وتقنيات البيولوجيا الجزيئية. أظهرت ردود الطلاب زيادة كبيرة في كل من تعلم مفاهيم الاستنساخ الجزيئي والثقة المبلغ عنها ذاتيا بمصطلحات وتقنيات الاستنساخ الجزيئي. يمكن تعميم إطار عمل الوحدة هذا لتعليم Gibson Assembly لتطبيقات مختلفة ، مما يوفر للمعلمين مجموعة أدوات لتعليم تقنية استنساخ قابلة للتكيف وناشئة أثناء تطوير مشاريعهم البحثية.
Introduction
يعد تدريب الطلاب الجامعيين على مفاهيم البيولوجيا الجزيئية الأساسية والتقنيات المختبرية أمرا بالغ الأهمية لتطورهم العلمي والمهني لأن هذه المنهجيات شائعة في مختلف البيئات البحثية ، بما في ذلك الأوساط الأكاديمية والصناعة. على هذا النحو ، يطلب من الطلاب في علم الأحياء (تركيز البيولوجيا الجزيئية والخلوية) وتخصصات الكيمياء الحيوية في جامعة ولاية كاليفورنيا للفنون التطبيقية ، سان لويس أوبيسبو (كال بولي) أخذ دورة مختبرية في البيولوجيا الجزيئية من القسم العلوي لتعلم هذه الموضوعات وتطبيقها (CHEM / BIO 475). تم تطوير منهج أساسي لهذه الدورة مسبقا حيث يقوم الطلاب بإجراء استنساخ قائم على التوبويزوميراز (TOPO) لتجميع بلازميد يحتوي على الأكتين يتم تحضيره من قالب الحمض النووي التكميلي للخميرة (cDNA)1. يصمم الطلاب تجارب بناء على أسئلة تحاكي فرضيات البحث الحقيقية ، مما يزيد من معرفتهم بالممارسات المختبرية والتعلم القائم على الاستفسار. يتطلب التقدم المستمر في مجال البيولوجيا الجزيئية أن تتكيف المناهج المناهج المقابلة لإعداد الطلاب ذوي الكفاءات الحديثة للقوى العاملة. على وجه الخصوص ، أصبح استخدام جمعية جيبسون أكثر انتشارا في المجتمع العلمي. في حين تم إنشاء الطريقة في الأصل لتصنيع الكروموسومات الاصطناعية2 ، فقد أشار أكثر من 5,000 منشور في وقت هذا التقرير إلى عمل Gibson et al. الأصلي. يعد Gibson Assembly فريدا من نوعه مقارنة بمنهجيات الاستنساخ التقليدية: فهو قابل للتخصيص بدرجة كبيرة ويمكنه بسهولة ربط أجزاء DNA خطية متعددة دون الحاجة إلى مواقع تقييد لإنتاج التقاطعات. وهكذا ، رأينا الفرصة لتجديد منهج CHEM / BIO 475 لدمج تقنيات الاستنساخ الجزيئي الحديثة وتحسين نموذج الدورة التدريبية القائم على الاستفسار.
لقد ثبت أن خبرات أبحاث الطلاب تساهم في زيادة الفهم المفاهيمي وتنمية المهارات والمثابرة في العلوم3 ، ومع ذلك لا تتاح الفرصة لجميع الطلاب الجامعيين للمشاركة مباشرة في مختبر البحث. لمواجهة التحدي المتمثل في قدرة الطلاب المحدودة في مختبرات البحوث ، تم تطوير الخبرات البحثية الجامعية القائمة على الدورات (CUREs) وتوظيفها لزيادة إمكانية الوصول إلى العلوم من خلال البحث الأصيل في الفصل الدراسي. وفي حين أن هذه البحوث البحثية تختلف في تنفيذها، فقد تم وضع ممارسات مشتركة تعالج المبادئ الخمسة للبحث العلمي. في CURE المصمم جيدا ، سيقوم الطلاب 1) باستخدام الممارسات العلمية ، 2) التعاون في مشروع بحثي ، 3) محاولة إجراء اكتشافات جديدة ، 4) المساهمة في العمل ذي الصلة خارج الفصل الدراسي ، و 5) إعادة تقييم ومراجعة الفرضيات والأساليب في حالة الفشل التجريبي4. على غرار الخبرات البحثية التقليدية للطلاب في المختبر ، ثبت أن CUREs تعزز ثقة الطلاب في العلوم والمهارات العلمية وملكية المشروع والمثابرة في العلوم والتكنولوجيا والهندسة والرياضيات (STEM)5. في حين تم الإبلاغ عن CUREs التي تنطوي على الاستنساخ الجزيئي سابقا6،7،8،9،10،11،12،13 ، فإننا لسنا على علم بأي شيء يؤكد على قدرة Gibson Assembly على التكيف لإنشاء مكتبة من البلازميدات البحثية الأصلية.
هنا ، نبلغ عن توسيع منهج CHEM / BIO 475 الحالي القائم على الاستفسار في جامعة ولاية كاليفورنيا للفنون التطبيقية ، سان لويس أوبيسبو مع تحسينين رئيسيين: الخبرة العملية باستخدام Gibson Assembly ومشاركة الطلاب في CURE ، والتي قدمت تركيبات البلازميد الأصلية للمشاريع البحثية الممولة من المؤسسة الوطنية للعلوم (NSF-1708919 و NSF-2300890). على مدار ثلاثة تطبيقات لهذا المنهج ، ساهم الطلاب في مشروعين بحثيين متميزين يركزان على التخليق الحيوي للمنتجات الطبيعية للجزيئات النشطة بيولوجيا التي تنتجها Actinomycetota. غالبا ما تحتوي المنتجات الطبيعية على دوائر ذات أنشطة مضادة للمضادات الحيوية و / أو الفطريات و / أو مضادة للسرطان ، مما يعطي هذه الجزيئات الصغيرة أهمية في جهود اكتشاف الأدوية وإمكانية الأهمية السريرية14. يتطلب هذا البحث إنشاء مكتبات بلازميد لتمكين التحقيق في كل من الوظيفة والإمكانات الهندسية لإنزيمات التخليق الحيوي البكتيرية. في هذا CURE ، صمم الطلاب وأجروا تجارب Gibson Assembly لاستنساخ مكتبات البلازميد الفريدة ذات الصلة بهذه المشاريع البحثية (الشكل 1). بالإضافة إلى ذلك ، فإن تنسيق وتصميم الوحدة مميز لأنه سهل التكيف لتوليد أي بلازميدات ذات أهمية لمشاريع بحثية أخرى.
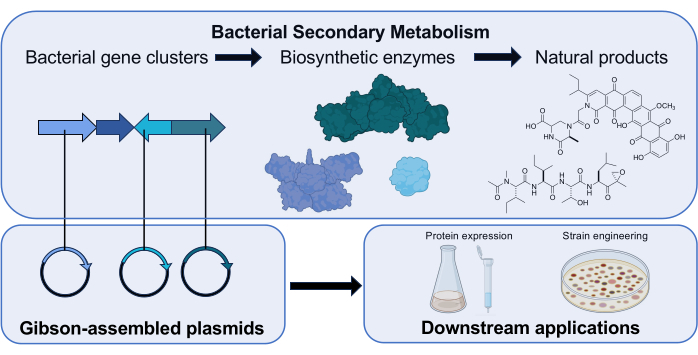
الشكل 1: نظرة عامة على دور جمعية جيبسون في مختبر الأبحاث لدينا. تنتج Actinomycetota منتجات طبيعية جزيئية صغيرة ذات أنشطة حيوية ذات صلة سريريا باستخدام مجموعات الجينات التي تشفر إنزيمات التخليق الحيوي. في بحثنا ، يتم تجميع البلازميدات التي تحتوي على جين التخليق الحيوي عبر Gibson Assembly لإجراء تحقيقات نهائية لوظيفة الإنزيم المشفر. أيقونات العلوم من Biorender.com. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
نظرة عامة على المختبر
مختبر البيولوجيا الجزيئية هو مقرر دراسي من الدرجة الأولى مطلوبة لتخصصات الكيمياء الحيوية وتخصصات علم الأحياء بتركيز البيولوجيا الجزيئية والخلوية. نرحب بالطلاب الآخرين الذين يستوفون المتطلبات الأساسية لأخذ الدورة كمادة اختيارية للقسم العلوي. الدورة مدرجة بشكل مشترك بين قسم الكيمياء والكيمياء الحيوية وقسم الأحياء في كال بولي. يتناوب أعضاء هيئة التدريس من كلا القسمين على تدريس الدورة في كل فصل دراسي (ربعان علم الأحياء ، ربع الكيمياء والكيمياء الحيوية).
يجتمع الفصل في المختبر مرتين كل أسبوع لمدة 170 دقيقة ومرة واحدة في الأسبوع لمحاضرة مدتها 50 دقيقة. تحتوي أقسام المختبر على 16 طالبا كحد أقصى ويتم تقديم 2-3 أقسام معملية كل ثلاثة أشهر. تستمر الدورة لمدة 10 أسابيع ، ويتم إجراء الاختبار النهائي خلال الاجتماع الأخير في الأسبوع 10. يقضي وقت المحاضرة في مناقشة النظرية الكامنة وراء العديد من التقنيات التجريبية التي يتم إجراؤها في المختبر ، بالإضافة إلى الموضوعات الحالية في البيولوجيا الجزيئية التي لا يتم تغطيتها في المختبر. يشمل المنهج الأساسي للمختبر عملية استنساخ جين الأكتين من الخميرة1 ، والتي تستغرق حوالي 7 أسابيع (13-14 اجتماعا معمليا). تشمل التقنيات الماصة الدقيقة ، وعزل الحمض النووي الريبي للخميرة ، وتضخيم جين الخميرة باستخدام تفاعل البوليميراز المتسلسل للنسخ العكسي (RT-PCR) ، واستنساخ TOPO ، والفحص الأزرق والأبيض ، وعزل البلازميد والتحقق من الإدخال عن طريق ملخص التقييد و PCR ، في تحليل السيليكو للنسخ المستنسخة ، وتحليل تسلسل الحمض النووي. يخضع المنهج الدراسي لآخر 3 أسابيع من الدورة لتقدير المعلم ولكنه يتضمن الطلاب الذين يكملون "مشروعا مستقلا" بنتائج غير محددة.
نظرة عامة على التجربة
أحد محاور مجموعتنا البحثية هو مسارات التخليق الحيوي في Actinomycetota. عند تصميم المشروع المستقل ، تصورنا أن يقوم الطلاب بإنشاء البلازميدات من خلال Gibson Assembly لاستخدامها في مشاريعنا البحثية التي تبحث في التخليق الحيوي للمنتجات الطبيعية. في حين أن تكرارات وحدة الدورة التدريبية التي تم تقييمها هنا كانت خاصة بالبلازميدات التي تسمح بالتلاعب بمسارات التخليق الحيوي ، فإن سير عمل Gibson Assembly قابل للتكيف بشكل كبير مع مشاريع الاستنساخ الجزيئي الأخرى (الشكل 2). تم تقسيم سير العمل إلى ثلاث تجارب مختلفة (A و B و C) تم إكمالها على مدار فترتين من المحاضرات وست فترات معملية (إجمالي 3 أسابيع) (انظر الملف التكميلي 1 والملف التكميلي 2). سبقت التجارب أوراق عمل لدعم إعداد الطلاب وتقييم فهم الطلاب (الملف التكميلي 3 ، الملف التكميلي 4 ، والملف التكميلي 5). يتم تقديم سير العمل بتنسيق مرن لاحتياجات المدرس واهتماماته.

الشكل 2: سير عمل وحدة تجميع جيبسون. اليوم 1 واليوم 4 عبارة عن فترات محاضرات يكمل فيها الطلاب تحليل تسلسل السيليكو والتصميم التجريبي. الأيام 2-3 و 5-8 هي اجتماعات معملية حيث يتم إجراء خطوات استنساخ البلازميدات الجديدة عبر Gibson Assembly ، تليها العزل والفحص. يتم تجميع المخطط الانسيابي التصويري حسب التجارب الثلاث التي يقوم بها الطلاب (A و B و C). يمكن العثور على توجيهات وبروتوكولات أكثر تفصيلا في أدلة المعلم والطالب المقدمة كملف تكميلي 1 وملف تكميلي 2، على التوالي. أيقونات العلوم من Biorender.com. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
تم تجريب وحدة المشروع المستقل لجمعية جيبسون لأول مرة في ربع ربيع عام 2019 في CHEM / BIO 475. في عامي 2020 و 2021 ، تم تدريس الدورة عبر الإنترنت بسبب جائحة SARS-CoV-2. عندما استؤنف التدريس الشخصي في ربيع عامي 2022 و 2023 ، تمت دعوة الطلاب داخل الدورة للمشاركة في دراسة لتقييم نتائج التعلم لمشروع Gibson Assembly المستقل حيث سيتم استنساخ البلازميدات الأصلية ذات الصلة بالبحث. في عام 2019 ، أنشأ الطلاب مكتبة من البلازميدات تتكون من أشرطة جينية من جينوم Micromonospora echinospora ATCC 15837 التي تم استنساخها في pKC1132 (الشكل 3). يتم استخدام مكتبة البلازميد هذه في مختبر الأبحاث الخاص بنا لتعطيل الجينات ذات الأهمية في مجموعة جينات التخليق الحيوي المفترضة للمنتج الطبيعي TLN-0522015. لاستكمال دراسات تعطيل الجينات لدينا ، قام الطلاب في عام 2022 باستنساخ مكتبة صغيرة من الجينات من مجموعة الجينات المفترضة TLN-05220 إلى pUC19 (Figure 3). استخدمت مجموعتنا البحثية هذه البلازميدات لاستنساخ الجينات الفرعية في نواقل التعبير ، بما في ذلك pET28b ، للإفراط في التعبير عن البروتين وتنقيته. ساهم الطلاب في مجموعة 2023 في العمل الجاري في مشروع هندسة التخليق الحيوي على epoxomicin synthetase16. في فرق مكونة من 3-4 ، استنساخ الطلاب مجالات هندسية من تخليق الببتيد غير الريبوزومي17 وحدة في نواقل تعبير البروتين المختلفة لتحسين الإفراط في التعبير عن هذه الإنزيمات وتنقيتها في مختبر الأبحاث الخاص بنا (الشكل 3). تم تضمين التكرار في خطة الاستنساخ لكل مجموعة. على سبيل المثال ، احتوت مجموعة 2019 على 44 طالبا ، وتم تخصيص 15 بلازميد للفصل ، للاستنساخ. وهكذا تمت محاولة استنساخ كل بلازميد مرتين أو ثلاث مرات.
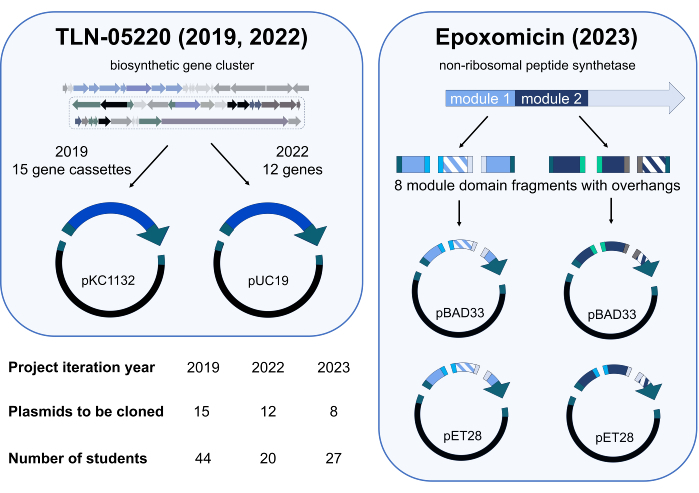
الشكل 3: ملخص البلازميدات المستنسخة والطلاب المشاركين خلال تكرارات المشاريع المستقلة 2019 و 2022 و 2023. تم نشر مشروع Gibson Assembly ثلاث مرات. في كل عرض ، استنسخ الطلاب المشاركون مكتبة مختلفة من البلازميدات لاستخدامها في المشاريع البحثية التي تستكشف مسارات التخليق الحيوي. دعمت المشاريع في عامي 2019 و 2022 عملنا المستمر على المنتج الطبيعي TLN-0522015 مع جزأين (كاسيت جيني واحد أو جين وناقل تفاعلات Gibson Assembly. تضمن مشروع 2023 مبادلة المجال داخل الوحدتين 1 و 2 من إنزيم مركب الببتيد غير الريبوزومي (NRPS) الذي يشارك في التخليق الحيوي للإيبوكسوميسين16. تمثل الشظايا المفرغة اثنين من الطفرات المختلفة للمجال الذي تم تبديله، وتمثل الألوان الصلبة المجالات التي لم يتم تبديلها. في المجموع ، تم إنشاء ثمانية أجزاء جينية مختلفة (أربعة للوحدة 1 وأربعة للوحدة 2) مع أجزاء متدلية متوافقة مع Gibson Assembly. لكل وحدة ، تم تجميع مجموعتين مختلفتين من ثلاثة أجزاء جينية مع واحد من اثنين من المتجهين المختلفين (pBAD33 و pET28 ، أربعة أجزاء إجمالية لكل تجميع) ، من أجل إمكانية توليد ثمانية بلازميدات NRPS هندسية. أيقونات العلوم من Biorender.com. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
نظرة عامة على التقييم
قبل أسبوع واحد على الأقل من بدء مشروع Gibson Assembly المستقل ، تمت دعوة الطلاب في مجموعات 2022 و 2023 للمشاركة في تحقيق نتائج التعلم ، المصمم بشكل مشابه لدراسة أجريت في دراسة استقصائية لدورة مختبر الكيمياء الحيوية في Cal Poly18. أكمل الطلاب المشاركون استبيانا مسبقا متعدد الخيارات في اجتماع المختبر قبل بدء المشروع المستقل واستبيان لاحق متعدد الخيارات خلال اجتماع المختبر النهائي (أي بعد الانتهاء من وحدة تجميع جيبسون). تألفت الاستبيانات السابقة واللاحقة من 28 سؤالا متطابقا مع سؤالين إضافيين في مرحلة ما بعد الاستبيان (إجمالي 30 سؤالا). تمت كتابة عشرة أسئلة حول المحتوى لتقييم معرفة الطلاب بالإنزيمات والآليات المشاركة في الاستنساخ الجزيئي (على سبيل المثال ، تفاعل البوليميراز المتسلسل [PCR] ، وتجميع جيبسون ، والتحول ، والفحص الأزرق والأبيض). طلبت الأسئلة السبعة التالية من الطلاب التقييم الذاتي لمعرفتهم بمصطلحات الاستنساخ الجزيئي (على سبيل المثال ، بوليميراز الحمض النووي ، نوكلياز خارجي ، ليغاز). سمحت الأسئلة العشرة التالية للطلاب بالتقييم الذاتي لقدرتهم على أداء تقنيات الاستنساخ الجزيئي (على سبيل المثال ، تحليل تسلسل الحمض النووي ، وتفاعلات هضم التقييد ، والرحلان الكهربائي لهلام الاغاروز). أبلغ الطلاب أيضا عما إذا كانوا سيكونون مرتاحين لممارسة مهنة في البيولوجيا الجزيئية بناء على معرفتهم بتقنيات الاستنساخ الجزيئي. تم تضمين سؤالين إضافيين في الاستبيان اللاحق للطلاب لتقييم التزامهم بالتعلم في الدورة التدريبية وما إذا كانت الدورة تجربة تعليمية قيمة (الملف التكميلي 6 والملف التكميلي 7). تم دمج جميع البيانات من إجابات الطلاب قبل وبعد الاستبيان لعامي 2022 و 2023 للتحليل وهي متوفرة في الجدول التكميلي S1.
Protocol
تمت مراجعة الدراسات التي شملت مشاركين من البشر والموافقة عليها من قبل أشخاص في مجلس المراجعة المؤسسية البحثية في كال بولي (2022-113-CP (IRB)). قدم المشاركون موافقتهم الخطية المستنيرة على المشاركة في هذه الدراسة.
يوضح البروتوكول التالي إعداد المعلم (الخطوات 1.1-1.3) ، وإجراءات الطلاب لوحدة تعليمية من ثلاث تجارب تتضمن تفاعل البوليميراز المتسلسل للحصول على أجزاء خطية (الخطوات 2.1-2.7) ، وتجميع جيبسون ، وتحويلها ، واختيارها (الخطوات 3.1-3.5) ، وعزل البلازميد وفحصه (الخطوات 4.1-4.4) ، وتقييم نتائج التعلم (5.1-5.2). يصف إعداد المدرب مثالا تمثيليا واحدا لتصميم التمهيدي وإعداد خريطة البلازميد المرغوبة في السيليكو. جميع أقسام البروتوكول قابلة للتكيف مع البلازميدات الأخرى المرغوبة. تنقسم كل تجربة طلابية إلى اجتماعين معمليين لمدة 3 ساعات.
1. إعداد المدرب
- تصميم التمهيدي لتجميع جيبسون باستخدام معالج تجميع مقاعد البدلاء
- حدد مصدر قالب الحمض النووي لإدراج (إدخالات) الجينات، مثل الحمض النووي الجيني والبلازميد والحمض النووي الاصطناعي.
ملاحظه: بالنسبة للجينات التي سيتم تضخيمها من قوالب الحمض النووي الجينومية المعقدة ، ينصح أولا بتحديد مواقع ربط فريدة للبادئات داخل قالب الحمض النووي الجيني الخاصة بالجين (الجينات) ذات الأهمية ، باستخدام أداة البحث عن المحاذاة المحلية الأساسية للمركز الوطني لمعلومات التكنولوجيا الحيوية (NCBI) 21 ، كما هو مفصل في الملف التكميلي 1. بالنسبة للقوالب البسيطة مثل البلازميدات أو الحمض النووي الاصطناعي ، انتقل إلى الخطوة التالية. - استرجع تسلسل الحمض النووي لإدراج (إدخالات) الجينات والمتجه (على سبيل المثال ، انظر تسلسل جيني هيدروكسيلاز البولي كيتيد وتسلسل pUC19 المقدم كملفات GenBank في الملف التكميلي 8). قم باستيراد تسلسل (تسلسلات) الإدراج المطلوب وتسلسل المتجه المطلوب إلى Benchling ، كل منها كملف تسلسل DNA جديد. افتح كل تسلسل مستورد ليتم تضمينه في تفاعل Gibson Assembly.
ملاحظه: يمكن للمرء استيراد ملفات تسلسل الحمض النووي بعدة تنسيقات ، بما في ذلك GenBank و FASTA. يمكن للمرء أيضا استيراد تسلسل مباشرة من قاعدة بيانات برقم انضمام أو لصق تسلسل نيوكليوتيدات منسوخ من ملف أو عارض آخر. - في الجزء السفلي من الشاشة ، حدد موقع أداة معالج التجميع . انقر فوق معالج التجميع، ثم حدد إنشاء تجميع جديد. من الخيارات المتوفرة ، حدد Gibson وانقر فوق ابدأ لبدء التجميع.
- في نافذة تسلسل المتجه ، حدد جميع القواعد المراد تضمينها في التجميع من العمود الفقري المتجه. ابدأ التحديد في موضع النيوكليوتيدات في نهاية 3 'من إدراج الجين (على سبيل المثال ، الموضع 657 من pUC19) ، وحدد جميع النيوكليوتيدات المتبقية المراد تضمينها (على سبيل المثال ، من خلال الموضع 656 لتضمين تسلسل pUC19 بالكامل). بمجرد تحديده، انقر فوق علامة التبويب العمود الفقري في أسفل الشاشة | تعيين جزء.
ملاحظه: قم بالتبديل بين طرق عرض خريطة التسلسل والبلازميد للمتجه لتحديد جميع القواعد المطلوبة لقالب دائري. بدلا من ذلك ، إذا كنت تخطط لإعداد جزء الناقل عبر ملخص التقييد (بدلا من تفاعل البوليميراز المتسلسل (PCR) لتجميع جيبسون ، فقم بخطية تسلسل العمود الفقري باستخدام موقع قطع إنزيم التقييد (على سبيل المثال ، XbaI). للقيام بذلك ، انقر فوق موقع القطع ، واضغط مع الاستمرار على Shift ، وانقر فوق موقع القطع مرة أخرى. ثم انقر فوق تعيين جزء لتعيين العمود الفقري. اعلم أنه لن يتم إنشاء بادئات خاصة بالمتجهات بواسطة Benchling إذا كان العمود الفقري خطيا بإنزيم تقييد في معالج التجميع. - في نافذة تسلسل الإدراج ، حدد جميع قواعد الإدراج المراد تضمينها في التجميع. بمجرد التحديد، انقر فوق علامة التبويب إدراج في أسفل الشاشة | تعيين جزء.
- في حالة إدراج الجينات المتعددة ، انقر فوق الزر + على الجانب الأيمن من معالج التجميع. في نافذة تسلسل الإدراج ، حدد جميع قواعد الإدراج المراد تضمينها في التجميع. بمجرد التحديد، انقر فوق علامة التبويب إدراج في أسفل الشاشة | تعيين جزء.
- بمجرد تعيين جميع الأجزاء، أعد تسمية التجميع إلى اسم البلازميد المطلوب وانقر فوق تجميع على يسار معالج التجميع. حدد موقع المجلد المطلوب لكل من مجلد التسلسل والمجلد التمهيدي. انقر فوق إنشاء لتجميع تسلسل البلازميد المؤتلف.
- افتح البلازميد المجمع وانقر فوق محفوظات التجميع لعرض خريطة البلازميد الأساسية ونظرة عامة على التسلسلات التي اشتقت منها. تأكد من أن مواضع النيوكليوتيدات لكل جزء تتطابق مع التصميم المطلوب.
- في علامة التبويب معلمات التجميع ، اعرض أسماء البادئات المصممة للتجميع. لاحظ أنه سيكون هناك نوعان أوليان مصممان لكل إدراج (أمامي وخلفي) ، وسيتم اشتقاق أسماء التمهيدي من عناوين ملفات تسلسل الحمض النووي. تأكد أيضا من أن درجات حرارة ذوبان التمهيدي ودرجات حرارة التلدين المقترحة متوافقة في هذه النافذة (انظر الملف التكميلي 8 ، البادئات التمثيلية).
- إذا لم تكن درجات حرارة ذوبان التمهيدي أو درجات حرارة التلدين مثالية ، فقم بضبط تسلسلات التمهيدي يدويا (على سبيل المثال ، إزالة النيوكليوتيدات لتقليل درجة حرارة الانصهار) داخل ملفات تسلسل التمهيدي. بدلا من ذلك ، انقر فوق إعادة فتح وضبط إعدادات التمهيدي بالنقر فوق إعدادات الإنزيم / التمهيدي بجوار الزر تجميع في معالج التجميع. ثم كرر خطوة التجميع وأعد فحص التسلسلات التمهيدية.
- إذا كان سيتم استنساخ مكتبة من البلازميدات بالعديد من الجينات المختلفة المستنسخة في نفس العمود الفقري للناقل ،
- استخدم نفس زوج التمهيدي للمتجه في كل حالة. للقيام بذلك ، قم بإزالة جميع النيوكليوتيدات يدويا من البادئات المتجهة التي من شأنها تثبيت الأجزاء المتدلية الخاصة بالإدخال. سيتم العثور على هذه النيوكليوتيدات في نهاية 5 ' من التمهيدي. بعد الإزالة ، تأكد من توافق درجات حرارة ذوبان التمهيدي ودرجات حرارة التلدين (انظر الملف التكميلي 8 ، البادئات التمثيلية).
- تأكد من أن جميع أزواج التمهيدي المدخلة لها درجات حرارة انصهار ودرجات حرارة صلب متشابهة جدا.
ملاحظه: سيقلل هذا من الحاجة إلى تحسين درجة حرارة التلدين لكل زوج ويسمح بتدوير جميع تفاعلات تفاعل البوليميراز المتسلسل للطلاب في نفس الوقت باستخدام نفس برنامج التدوير الحراري.
- بمجرد اكتمال تصميم التمهيدي للبلازميدات المطلوبة، انقر فوق Finishize في معالج التجميع. اطلب الاشعال من شركة تخليق الحمض النووي واسترجع عينات من قوالب الحمض النووي للإدراج (النواقل) والمتجه.
- اختبر كلا من أزواج التمهيدي الخاصة بالإدخال والناقلات للحصول على درجات حرارة التلدين المثلى باستخدام تجربة PCR المتدرجة مع قوالب الحمض النووي. اختبر درجات حرارة التلدين الموصى بها من قبل Benchling ± 3 درجات مئوية في البداية.
- بمجرد تحديد درجات حرارة التلدين ، قم بإنشاء حصصات من المحاليل التمهيدية وقوالب الحمض النووي والكواشف اللازمة لتفاعلات تفاعل البوليميراز المتسلسل للطلاب.
- حدد مصدر قالب الحمض النووي لإدراج (إدخالات) الجينات، مثل الحمض النووي الجيني والبلازميد والحمض النووي الاصطناعي.
- قبل التجارب ، قم بتوفير أوراق عمل للطلاب لدعم الإعداد وتقييم الفهم (الملف التكميلي 4 ، التكميلي 5 ، والتكميلي 6).
- جمع البيانات حول مخرجات التعلم
ملاحظه: إذا كنت مهتما بجمع بيانات نتائج التعلم من وحدة Gibson Assembly ونشر النتائج ، فاحصل على الموافقة على البحث مع البشر وفقا لسياسات المؤسسة.- قم بدعوة الطلاب للمشاركة في تحقيق نتائج التعلم قبل أسبوع واحد على الأقل من بدء مشروع Gibson Assembly المستقل.
- اطلب من الطلاب المشاركين إكمال الاستبيان المسبق متعدد الخيارات (الملف التكميلي 6) اجتماع المختبر قبل بدء المشروع المستقل.
2. تجربة الطالب أ: تفاعل البوليميراز المتسلسل للحصول على شظايا خطية
- احصل على البادئات وقوالب حلول الحمض النووي ل تفاعل البوليميراز المتسلسل من المدرب.
- تفاعلات الماصة 25 ميكرولتر بما في ذلك بوليميراز الحمض النووي MasterMix ، وقالب الحمض النووي ، والبادئات الأمامية والعكسية ، والماء الخالي من النوكلياز وفقا للتعليمات الواردة في دليل الطالب (انظر الملف التكميلي 2).
- قم بتدوير التفاعل في جهاز تدوير حراري وفقا لدليل الطالب في الملف التكميلي 2. تأكد من أن درجة حرارة التلدين للتفاعل مناسبة للبادئات ، وأن وقت التمديد مناسب لطول المضخم المطلوب. راجع الملف التكميلي 2 والملف التكميلي 3 للحصول على إرشادات مفصلة.
- تخزين تفاعلات تفاعل البوليميراز المتسلسل عند 4 درجات مئوية أو -20 درجة مئوية حتى فترة المختبر التالية.
- قم بتحليل 5 ميكرولتر من كل تفاعل عن طريق الرحلان الكهربائي لهلام الاغاروز. أثناء تشغيل الجل ، أضف 1 ميكرولتر من إنزيم تقييد DpnI إلى كل تفاعل يستخدم الحمض النووي البلازميد كقالب. احتضان هذا الخليط لمدة ساعة واحدة عند 37 درجة مئوية.
ملاحظه: سيؤدي DpnI إلى تدهور أي قالب DNA بلازميد دائري متبقي ، مما يقلل من احتمالية الحصول على إيجابيات خاطئة في خطوة التحول. - قم بتصوير الجل للتأكد من نجاح تفاعل البوليميراز المتسلسل وتم تحقيق التضخيم الصحيح. قم بتنقية أي تفاعلات تفاعل البوليميراز المتسلسل الناجحة باستخدام مجموعة تنقية تفاعل البوليميراز المتسلسل المتوفرة تجاريا. قم بقياس تركيز (نانوغرام / ميكرولتر) لمنتج تفاعل البوليميراز المتسلسل المنقى باستخدام مقياس الطيف الضوئي الصغير الحجم لاستخدامه في حسابات تجميع جيبسون اللاحقة.
- قبل اجتماع الفصل التالي ، صمم وصفة رد الفعل لجمعية جيبسون (انظر الملف التكميلي 2 والملف التكميلي 4).
3. تجربة الطالب ب: تجميع جيبسون وتحويلها واختيارها
- ماصة تفاعل جمعية جيبسون وفقا للوصفة المصممة. احتضان التفاعل عند 50 درجة مئوية لمدة 15 دقيقة. أثناء احتضان التفاعلات ، استعد للتحول عن طريق إذابة خلايا الإشريكية القولونية المختصة كيميائيا على الجليد.
- قم بتحويل 2 ميكرولتر من مجموعة جيبسون إلى خلايا مختصة كيميائيا عن طريق الصدمة الحرارية. ماصة 100 ميكرولتر من الخلايا المحولة على لوحين اختيار وتنتشر بخرز معقم. قم بإعداد 10-4 و 10-5 و 10-6 تخفيفات للخلايا المتبقية على أجار Luria-Bertani (LB). لوحة 100 ميكرولتر من كل تخفيف تسلسلي على LB (بدون اختيار) وتنتشر بخرز معقم.
ملاحظه: تسمح هذه الخطوة بحساب كفاءة التحويل. - احتضن الأطباق طوال الليل عند 37 درجة مئوية ، قم بتخزين الأطباق في درجة حرارة 4 درجات مئوية حتى فترة الفصل التالية.
- عد المستعمرات على جميع اللوحات واحسب كفاءة التحويل كما هو موضح في الملف التكميلي 2. أعد وضع صفيحة انتقائية واحدة بأربع مستعمرات من أي من الألواح الانتقائية واحتضان هذه اللوحة عند 37 درجة مئوية بين عشية وضحاها.
ملاحظه: هذا بمثابة ثقافة احتياطية للنسخ المستنسخة الإيجابية. - باستخدام علامة ، حدد أربع مستعمرات مميزة على لوحة التحديد وقم بوضع دائرة عليها وتسميتها بالأحرف الأولى من اسم الطالب ورقم (على سبيل المثال ، ABC1). استرجع صفيحة LB-agar جديدة تحتوي على مضاد حيوي للاختيار ، واستخدم علامة لتقسيم اللوحة إلى أرباع (أي أرباع) ، ثم استخدم ~ 1/2 من كل مستعمرة لإعادة الخط على الربع المسمى على التوالي والآخر 1/2 لتلقيح ثقافة LB سائلة سعة 5 مل لكل من المستعمرات الأربع المختارة. تأكد من تسمية الأنابيب بهوية المستعمرة المعنية (على سبيل المثال ، ABC1) وإضافة التركيز الصحيح للمضادات الحيوية للاختيار. احتضان المزارع السائلة في حاضنة اهتزاز عند 37 درجة مئوية بين عشية وضحاها ولوحة أجار في حاضنة ثابتة عند 37 درجة مئوية ؛ قم بتخزين المزارع والأطباق السائلة عند 4 درجات مئوية حتى فترة الفصل التالية.
4. تجربة الطالب ج: عزل البلازميد وفحصه
- اعزل الحمض النووي للبلازميد من المزارع السائلة من التجربة ب باستخدام مجموعة أدوات التحضير المصغرة. قياس تركيز البلازميد المعزول (بالنانوغرام / ميكرولتر).
- صمم ملخص تقييد أو شاشة PCR لتحليل البلازميدات المعزولة (انظر التعليمات التفصيلية في الملف التكميلي 2 والإبلاغ عن التوقعات في الملف التكميلي 5).
- الماصة التقييد تهضم التفاعلات أو التفاعلات وفقا للوصفات المصممة وتحتضن في درجات الحرارة والفترات المصممة مسبقا.
- تحليل النتائج عن طريق الرحلان الكهربائي لهلام الاغاروز.
5. التقييم
- اطلب من الطلاب المشاركين إكمال الاستبيان اللاحق متعدد الخيارات (الملف التكميلي 7) اجتماع المختبر بعد اكتمال وحدة تجميع جيبسون.
- اجمع جميع البيانات من إجابات ما قبل الاستبيان وبعده للتحليل.
- افحص الدلالة الإحصائية للزيادة في متوسط درجة كل سؤال محتوى فردي بين الاستبيانات باستخدام اختبارات t المزدوجة ثنائية الذيل وحجم تأثير كوهين د.
- تقييم زيادة ثقة الطالب لكل فصل دراسي وتقنية على حدة لتحديد مدى التغيير وأهميته الإحصائية.
- تحديد تأثير خلفية الطلاب والعوامل الأكاديمية على تعلم الطلاب باستخدام اكتساب التعلم الطبيعي (NLG) واختبارات t غير المزاوجة.
- تقييم اتجاهات الطلاب تجاه تجربة المشروع ومهن البيولوجيا الجزيئية من خلال تقييم متوسط الدرجات.
النتائج
نجاح الطالب في الاستنساخ
في كل تكرار لوحدة Gibson Assembly (2019 و 2022 و 2023) ، طلب من الطلاب إعداد تقرير يلخص النتائج التي توصلوا إليها. في عام 2019 ، أفاد 36 من أصل 44 طالبا (81.8٪) أنهم نجحوا في استنساخ البلازميدات الخاصة بهم بناء على نتائج الشاشة التي صمموها للتجربة C. أبلغ ما م?...
Discussion
هنا ، نقترح مشروع مختبر للفصول الدراسية الجامعية قابل للتعديل يعلم الطلاب الاستنساخ الجزيئي من خلال Gibson Assembly في بيئة بحثية قائمة على الدورة التدريبية. في المجموع ، تم استنساخ 28 بلازميدات جديدة من قبل الطلاب الجامعيين في بيئة الفصل الدراسي. تراوح النجاح الفردي الذي أبلغ ...
Disclosures
ويعلن أصحاب البلاغ أنه ليس لديهم مصالح مالية متنافسة أو أي تضارب في المصالح أخرى.
Acknowledgements
يعرب المؤلفون عن امتنانهم لأندريا لوبشر للدعم الفني ، ومايكل بلاك وساندي كليمنت وجافين أوزا للمناقشات المفيدة حول تنفيذ مختبر التدريس وتقييم نتائج التعلم. يقدر المؤلفون بتقدير جميع الطلاب الذين شاركوا في دراسة نتائج التعلم في مجموعات 2019 و 2022 و 2023 ، بالإضافة إلى طلاب البحث ناثان كون وأيوشي أديتوار الذين ساعدوا في إعداد الكاشف لتنفيذ مختبر التدريس. يقر المؤلفون أيضا بالدعم التمويلي من صندوق ويليام وليندا فروست ، ومنحة شيفرون للبحوث التطبيقية للتكنولوجيا الحيوية التابعة لمركز التطبيقات في التكنولوجيا الحيوية ، والمؤسسة الوطنية للعلوم (NSF-1708919 و NSF-2300890).
Materials
| Name | Company | Catalog Number | Comments |
| Deoxyribonucleotide triphosphate (dNTPs, 10 mM) | Fisher Scientific | FERR0191 | Homemade' MasterMix component |
| Dithiothreitol (DTT) | Fisher Scientific | FERR0861 | Homemade' MasterMix component |
| DpnI | New England Biolabs | R0176S | 1000 units |
| Fisherbrand Isotemp Microbiological Incubator | Fisher Scientific | 15-103-0513 | |
| FisherBrand Isotemp Water Bath | Fisher Scientific | S28124 | |
| GelRed Nucleic Acid Gel Stain | Biotium | NC9594719 | 10,000X |
| GeneJET Gel Extraction and DNA Cleanup Micro Kit | Thermo Scientific | FERK0831 | 100 Preps |
| GeneRuler 1 kb DNA ladder | Fisher Scientific | FERSM0314 | 100 applications |
| LB Broth, Miller | Fisher BioReagents | BP9723-500 | 500 g |
| Magnesium chloride hexahydrate | Fisher Scientific | BP214-500 | Homemade' MasterMix component |
| Mastercycler nexus X2 Gradient Thermocycler | Eppendorf | 6337000027 | |
| Microfuge 16 Centrifuge | Beckman Coulter | A46474 | |
| Micromonospora echinospora bacteria | American Type Culture Collection | ATCC 15837 | |
| Microwave Oven | General Electric | 2440640 | |
| Molecular Biology Grade Agarose | Fisher BioReagents | BP160-100 | 100 g |
| Nanodrop One Microvolume Spectrophotometer | Thermo Scientific | 13-400-518 | |
| NEB 5-alpha Competent E. coli | New England Biolabs | C2987H | 20 x 0.05 mL |
| NEBuilder HiFi DNA Assembly Master Mix | New England Biolabs | E2621S | 10 reactions |
| New Brunswick Innova 40 Benchtop Orbital Shaker | New Brunswick | M1299-0090 | |
| Nuclease Free Water | Fisher BioReagents | BP248450 | 50 mL |
| PEG-8000 | Fisher Scientific | BP233-100 | Homemade' MasterMix component |
| Phusion DNA Polymerase | New England Biolabs | M0530 | Homemade' MasterMix component |
| Portable Balance | Ohaus | SKX123 | |
| pUC19 vector | New England Biolabs | N3041S | |
| Q5 High-Fidelity 2x Master Mix | New England Biolabs | M0492S | 100 reactions |
| T5 Exonuclease | Epicentre | T5E4111K | Homemade' MasterMix component |
| Taq DNA Ligase | New England Biolabs | M0208 | Homemade' MasterMix component |
| Tris-HCl | Fisher Scientific | AAA1137918 | Homemade' MasterMix component |
| TriTrack DNA Gel Loading Dye (6x) | Thermo Scientific | FERR1161 | 5 x 1 mL |
| Zyppy Plasmid Miniprep Kit | Zymo Research | D4019 | 100 Preps |
| β-Nicotinamide adenine dinucleotide (NAD+) | New England Biolabs | B9007S | Homemade' MasterMix component |
References
- Black, M. W., Tuan, A., Jonasson, E. Cloning yeast actin cDNA leads to an investigative approach for the molecular biology laboratory. Biochem Mol Biol Educ. 36 (3), 217-224 (2008).
- Gibson, D. G., Young, L., Chuang, R. -. Y., Venter, J. C., Hutchison, C. A., Smith, H. O. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nat Methods. 6 (5), 343-345 (2009).
- Bell, J. K., et al. CUREs in biochemistry—where we are and where we should go. Biochem Mol Biol Educ. 45 (1), 7-12 (2017).
- Auchincloss, L. C., et al. Assessment of course-based undergraduate research experiences: A meeting report. CBE Life Sci Educ. 13 (1), 29-40 (2014).
- Buchanan, A. J., Fisher, G. R. Current status and implementation of science practices in Course-based Undergraduate Research Experiences (CUREs): A systematic literature review. CBE Life Sci Educ. 21 (4), ar83 (2022).
- Verity, N., Ulm, B., Pham, K., Evangelista, B., Borgon, R. Demonstrating core molecular biology principles using GST-GFP in a semester-long laboratory course. Biochem Mol Biol Educ. 50 (1), 55-64 (2022).
- Li, G., et al. CUR(E)ating a new approach to study fungal effectors and enhance undergraduate education through authentic research. Biochem Mol Biol Educ. 52 (1), 6-14 (2024).
- Roecklein-Canfield, J. A., Lopilato, J. Tagging and purifying proteins to teach molecular biology and advanced biochemistry. Biochem Mol Biol Educ. 32 (6), 373-377 (2004).
- Li, C., et al. Directed evolution of glyphosate oxidase and a chemiluminescence system for glyphosate detection: A comprehensive practical laboratory experiment on biotechnology. Biochem Mol Biol Educ. 51 (3), 302-311 (2023).
- Wang, J. T. H., Schembri, M. A., Ramakrishna, M., Sagulenko, E., Fuerst, J. A. Immersing undergraduate students in the research experience: A practical laboratory module on molecular cloning of microbial genes. Biochem Mol Biol Educ. 40 (1), 37-45 (2012).
- Dean, D. M., Wilder, J. A. The “Frankenplasmid” lab: An investigative exercise for teaching recombinant DNA methods. Biochem Mol Biol Educ. 39 (5), 376-383 (2011).
- Bornhorst, J. A., Deibel, M. A., Mulnix, A. B. Gene amplification by PCR and subcloning into a GFP-fusion plasmid expression vector as a molecular biology laboratory course. Biochem Mol Biol Educ. 32 (3), 173-182 (2004).
- Roberts, L. A., Shell, S. S. A research program-linked, course-based undergraduate research experience that allows undergraduates to participate in current research on mycobacterial gene regulation. Front Microbiol. 13, 1025250 (2023).
- Jose, P. A., Maharshi, A., Jha, B. Actinobacteria in natural products research: Progress and prospects. Microbiol Res. 246, 126708 (2021).
- Banskota, A. H., et al. TLN-05220, TLN-05223, new Echinosporamicin-type antibiotics, and proposed revision of the structure of bravomicins. J Antibiot. 62 (10), 565-570 (2009).
- Schorn, M., et al. Genetic basis for the biosynthesis of the pharmaceutically important class of epoxyketone proteasome inhibitors. ACS Chem Biol. 9 (1), 301-309 (2014).
- Smith, H. G., Beech, M. J., Lewandowski, J. R., Challis, G. L., Jenner, M. Docking domain-mediated subunit interactions in natural product megasynth(et)ases. J Ind Microbiol Biotechnol. 48 (3-4), kuab018 (2021).
- Williams, L. C., et al. The genetic code kit: An open-source cell-free platform for biochemical and biotechnology education. Front Bioeng Biotechnol. 8, 941 (2020).
- Bloodhart, B., Balgopal, M. M., Casper, A. M. A., Sample McMeeking, L. B., Fischer, E. V. Outperforming yet undervalued: Undergraduate women in STEM. PLoS One. 15 (6), e0234685 (2020).
- Farrar, V. S., Aguayo, B. -. Y. C., Caporale, N. Gendered performance gaps in an upper-division biology course: Academic, demographic, environmental, and affective factors. CBE Life Sci Educ. 22 (4), ar55 (2023).
- Camacho, C., et al. BLAST+: Architecture and applications. BMC Bioinf. 10 (1), 421 (2009).
- . Optimization Tips for NEBuilder® HiFi DNA Assembly and NEB® Gibson Assembly Available from: https://www.neb.com/en-us/tools-and-resources/usage-guidelines/optimization-tips-for-nebuilder-hifi-dna-assembly-and-neb-gibson-assembly (2024)
- . Instruction Manual: Gibson Assembly® Master Mix / Gibson Assembly® Cloning Kit Available from: https://www.neb.com/-/media/nebus/files/manuals/manuale2611.pdf?rev=9db62577a41b4cfda071e21864a6763e (2021)
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved