A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحسين النتائج في استئصال الفص الصدغي الأمامي - دليل على استئصال القشرة الكمثرية الصدغية
In This Article
Summary
هنا ، نوضح نهجا للتوجيه الجراحي العصبي أثناء الجراحة في استئصال الفص الصدغي الأمامي ، مع تسليط الضوء على وجه التحديد على استخدام التصوير الشبكي والأقنعة التشريحية للمساعدة في الاستئصال الآمن للجزء الصدغي من القشرة الكمثرية - وهي منطقة ينظر إليها بشكل متزايد على أنها هدف جراحي حاسم في صرع الفص الصدغي المتوسط المقاوم للأدوية.
Abstract
يعد استئصال الفص الصدغي الأمامي (ATLR) خيارا علاجيا مفيدا لصرع الفص الصدغي المتوسط المقاوم للأدوية (DRmTLE). تشير الأدلة المتزايدة إلى أن القشرة الكمثرية تلعب دورا مهما في توليد وانتشار النوبات في DRmTLE - وأن استئصال الجزء الزمني من القشرة الكمثرية يرتبط بمعدلات محسنة بشكل كبير من حرية النوبات.
هنا ، نقدم استئصال الجزء الزمني من القشرة الكمثرية في ATLR ، باستخدام خوارزميات الtract الاحتمالية عالية الدقة قبل الجراحة والأقنعة التشريحية المدمجة للهياكل ذات الأهمية في الملاحة العصبية أثناء الجراحة وشاشة العرض المجهرية (HUD).
قدم جميع المرضى الذين يخضعون لتقييم شامل قبل الجراحة وفحوصات DRmTLE موافقة خطية مستنيرة لتسجيل فيديو أثناء الجراحة للإجراء. تم تحديد المرضى من قبل فريق خبير متعدد التخصصات من أطباء الصرع وجراحي الأعصاب وعلماء النفس العصبي والأطباء النفسيين العصبيين وأخصائيي الفيزيولوجيا الكهربية في مركز كبير لجراحة الصرع. تضمن خط أنابيب التصوير قبل الجراحة تحديد الهياكل الحرجة. وشمل ذلك القشرة الكمثرية الصدغية ، والتصوير الاحتمالي عالي الدقة للمسالك الأساسية المعرضة للخطر (على سبيل المثال ، الإشعاع البصري والحزمة الجبهية القذالية السفلية). تم تسجيلها بشكل مشترك في فحص الملاحة العصبية الحجمي قبل الجراحة وتحميلها على نظام الملاحة العصبية أثناء الجراحة.
يتم تقديم إجراء خطوة بخطوة ل ATLR ، بما في ذلك استئصال الجزء الزمني من القشرة الكمثرية. يجمع البروتوكول بين التصوير بالرنين المغناطيسي الهيكلي والمنتشر المتقدم والمساعدات البصرية أثناء الجراحة لدمج الأقنعة التشريحية لهياكل المادة الرمادية الحرجة ومسارات المادة البيضاء في سير العمل الجراحي في غرفة العمليات.
Introduction
استئصال الفص الصدغي الأمامي (ATLR) هو العلاج الأكثر فعالية لصرع الفص الصدغي المتوسط المقاوم للأدوية (DRmTLE) 1،2 ، مع معدلات تحرر من النوبات بنسبة 50٪ -70٪ ومراضة منخفضة نسبيا3،4،5. كما ثبت أن الإجراء يحسن نوعية الحياة6،7،8 ، ومعدلات التوظيف5 ، والرفاهية النفسيةوالاجتماعية 9.
يتضمن ATLR المتعارف عليه ، الموصوف بواسطة Spencer et al.10 ، استئصال القطب الصدغي ، و uncus ، واللوزة الدماغية ، والحصين ، والتلفيف شبه الحصين ، والتلفيف المغزلي. مسارات المادة البيضاء الحرجة المشاركة في الرؤية (الإشعاع البصري ، على وجه الخصوص ، حلقة ماير11،12) واللغة (على سبيل المثال ، الحزمة الأمامية القذاليةالسفلية 13 والحزمة المقوسة14،15) معرضة لخطر الإصابة عند الوصول إلى القرن الصدغي للبطين الجانبي. يحدد البروتوكول التالي نهجا لتجنب مسارات المادة البيضاء هذه باستخدام التصوير التولي الاحتمالي عالي الدقة قبل الجراحة والأقنعة التشريحية المنصهرة للهياكل ذات الأهمية في الملاحة العصبية أثناء الجراحة والعرض المجهري للرأس (HUD).
الفهم التقليدي للمجال هو أن استئصال الحصين الأقصى مفيد لزيادة معدلات الحرية من النوبات بعد الجراحة. ومع ذلك ، تظهر التحليلات الحديثة لحالات ما بعد ATLR أن استئصال الجزء الزمني من القشرة الكمثرية في ATLR يزيد بشكل كبير من فرصة التحرر من النوبات. كما أظهروا أنه لا يوجد ارتباط بين استئصال الحصين الخلفي وحرية النوبات16،17. وفقا لذلك ، تم اقتراح تحديث تقنية سبنسر عن طريق الحد من استئصال الحصين إلى 55٪ الأمامي من الحصين ، في ATLRs في نصف الكرة المهيمن على اللغة ، للحفاظ على وظيفة الذاكرة16،18.
في حين كان هناك اهتمام متزايد باستخدام العلاجات الجديدة طفيفة التوغل ، وخاصة العلاج الحراري الخلالي الخلالي بالليزر (LITT) ، يظل الاستئصال الجراحي هو معيار الرعاية للصرع البؤري المقاوم للأدوية1 ، وقد ثبت أن فعالية LITT تنتج نسبة أقل من نتائج نوبات إنجل 1 (58٪ -59٪)1،19 مقارنة ب ATLR (60٪ -70٪)3 ، 4،5،20 ، وهكذا لا تزال منطقة تتطلب مزيدا من التحقيق21.
هناك مجموعة متزايدة من الأدلة التي تدعم الفرضية القائلة بأن القشرة الكمثرية (الشكل 1) هي منطقة حرجة في انتشار و / أو تكوين الصرع للنوبات لدى البالغين16،17،22،23،24 والأطفال25 المصابين بصرع الفص الصدغي المتوسط. القشرة الكمثرية عبارة عن شريط من القشرة المخية ثلاثية الطبقات (على غرار ترتيب قشرة الحصين) ملفوفة حول التلم الداخلي الوسطي للجذع الصدغي26،27 ، وبالتالي تشكل التقاء الفص الصدغي والجبهي. لذلك ، يمكن اعتباره بسهولة على أنه يتكون من انقسامات أمامية وزمنية ، موصوفة بالتفصيل في الأدبيات22،25،28،29،30.
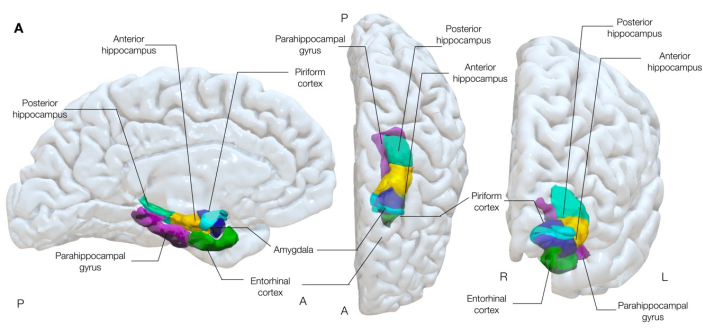
الشكل 1: عرض شبه شفاف ثلاثي الأبعاد للهياكل الزمنية المتوسطة للدماغ. يوضح هذا الشكل الارتباطات التشريحية للقشرة الكمثرية (السماوية) بتشريح الفص الصدغي الوسطي المحيط. المناظر الإنسية اليسرى ، والوسطى العليا ، والأمامية اليمنى. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
القشرة الكمثرية هي سوبر ميزيال للوزة الدماغية وقد تورطت منذ فترة طويلة في الدراسات التي أجريت على لتكون عقدة مشتركة في الشبكات التي تنشر إفرازات الصرع31-33 ، وتولد نوبات بعد التحفيز الكهربائي بسهولة أكبر من الهياكل المتوسطة المجاورة ، بما في ذلك اللوزة والحصين34. موقعه ، مع وصلات واسعة بالقشرة الداخلية ، الحوفي ، المدارية الجبهية ، والانعزالية ، وكذلك إلى المهاد ، والبصلة الشمية ، واللوزة ، والحصين ، يفسح المجال أيضا لدور كمسار انتشار رئيسي لإفرازات الصرع في الصرعالبؤري 30.
تدعم دراسات EEG-fMRI والتصوير المقطعي بالإصدار البوزيتروني (PET) دورا مهما للقشرة الكمثرية في DRmTLE ، مما يدل على التنشيط الداخلي ، ويرتبط ارتباط مستقبلات حمض أمينوبوتيريك γ من النوع A (GABAA) في القشرة الكمثرية بزيادة نشاط النوبات35،36،37.
أظهرت دراستان حديثتان مهمتان للتصوير في DRmTLE أن حرية النوبات بعد الجراحة ترتبط بمدى أكبر من استئصال القشرة الكمثري. أظهر جالوفيتش وآخرون في مجموعة كبيرة بأثر رجعي أن إزالة نصف القشرة الكمثرية على الأقل حسنت احتمالات أن تصبح خالية من النوبات بمعامل 16 (95٪ CI ، 5-47 ؛ ص < 0.001)17. كما ثبت أن أحجام الاستئصال للهياكل الزمنية الوسطى الأخرى لم تكن مرتبطة بحرية النوبات ، وهي نتيجة تم تكرارها ودعمها من خلال تحليلات الفوكسل الحكيمة التي أجراها Sone et al. ، الذين أظهروا أن استئصال القشرة الكمثرية فقط في TLE الأيسر كان مرتبطا بحرية النوبات16 (الشكل 2).
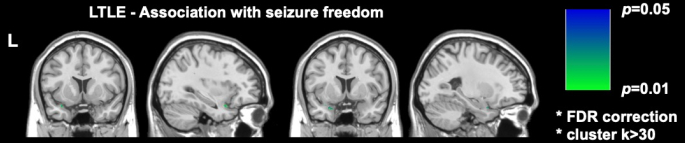
الشكل 2: ارتباط Voxel الحكيم بحرية النوبات بعد الجراحة في TLE. المنطقة الوحيدة المرتبطة ارتباطا وثيقا بحرية النوبات هي الجزء الزمني من القشرة الكمثرية ، ص = 0.01 (أخضر في شرائح التصوير بالرنين المغناطيسي المرجحة بالإكليل والسهمي T1). مقتبس من Sone et al.16 بإذن. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
أظهر Borger et al. أيضا في مجموعة كبيرة بأثر رجعي أن نسبة القشرة الكمثرية الصدغية المقطوعة فقط هي المرتبطة بمعدلات تحسين معدلات حرية النوبات في كل من السنةالأولى 3 وفي المتابعة الأطول (متوسط 3.75 سنوات)23. وأكدوا كذلك أن الحجم المقطوع من الحصين واللوزة الدماغية لا يتنبأ بحرية النوبات.
كما تم إثبات أهمية فصل القشرة الكمثرية عن شبكة الصرع الشاذة في mTLE في LITT ، حيث أظهر Hwang et al. في متابعة مدتها 6 أشهر أن النسبة المئوية لاستئصال قشرة الكمثري كانت مرتبطة بنتائج ILAE من الفئة1 38 (OR 1.051 ، 95٪ CI 1.001-1.117 ، p = 0.045) ، ولكن هذا كان اتجاها لم يكن ذا دلالة إحصائية في 1 سنة5. يبدو أن هذا يدعم البيانات الناشئة المتعلقة ب LITT ، والتي تشير إلى أن هناك تحسنا إيجابيا ، ولكن ربما أقل ديمومة ، في نتائج النوبات ، مما أدى إلى استخدام LITT بشكل شائع كإجراء "المرحلة الأولى" ، مع تقديم الجراحة الاستئصالية لأولئك الذين لا يحقق LITT حرية النوبات فيهم.
لذلك ، هناك أدلة قوية على أن استئصال الجزء الصدغي من القشرة الكمثرية كهدف رئيسي في تحقيق حرية النوبات في صرع الفص الصدغي المتوسط المقاوم للأدوية. ومع ذلك ، كما أوضحت المجموعة بأثر رجعي من جالوفيتش وآخرون ، فإن هذا الشريط من القشرة المخية الداخلية في مكان يصعب استهدافه جراحيا عند إجراء ATLR ، مما يعني أنه إذا لم يتم استهدافه بشكل مباشر ، فلن تتم إزالته دائما بنجاح. نوضح في هذه الدراسة كيفية استهداف واستئصال الجزء الصدغي من القشرة الكمثرية بأمان كجزء من دراسة جراحية مستقبلية مستمرة ، لتقييم تأثيره على تحسين معدلات التحرر من النوبات بعد الجراحة39.
ينصب تركيز البروتوكول التالي على الجوانب الفنية لاكتساب الصورة ومعالجتها ، والنهج الجراحي ، وكيف نضمن استئصال الجزء الزمني من القشرة الكمثرية في ATLR ، مع دمج التصوير الاحتمالي عالي الدقة قبل الجراحة والأقنعة التشريحية المدمجة للهياكل ذات الأهمية في الملاحة العصبية أثناء الجراحة والعرض الرأسي المجهري (HUD). يستخدم البروتوكول أيضا منصة برمجيات تخطيط محددة40 ، والتي تسمح بعرض ثلاثي الأبعاد وتكامل التصوير متعدد الوسائط للمراجعة والتخطيط الجراحي ، ونظام ملاحة عصبية يسمح بالتكامل مع المجهر الجراحي (التفاصيل مفصلة في جدول المواد).
Protocol
هذه الأساليب والبروتوكولات هي جزء من تجربة جراحية مستقبلية مستمرة تمت الموافقة عليها من قبل هيئة البحوث الصحية في 10/09/2020 ، مرجع لجنة أخلاقيات البحث (REC) لندن: 20 / LO / 0966. تم تسجيل البروتوكول مستقبليا: ISRCTN72646265 ، في 25/09/2020 ، متاح على الإنترنت39 ، وتم تقديمه في مؤتمروطني 41.
يتم تطبيق البروتوكول التالي على جميع المرضى الذين يخضعون ل ATLR ل DRmTLE في المرضى الذين تتراوح أعمارهم بين 18 و 70 عاما (الفئة العمرية للمرضى الذين خضعوا لعملية جراحية لهذا المؤشر في مركز جراحة الصرع البالغين المتخصص) ، وكلهم يخضعون لعملية جراحية من قبل نفس الجراحين (AWM ، AM). قدم جميع المشاركين موافقة مستنيرة قبل إدراجهم في الدراسة. خضع جميع المشاركين لتقييم شامل قبل الجراحة وفحوصات بتوجيه من فريق الخبير متعدد التخصصات للصرع الجراحي في مركز جراحة الصرع الشامل التابع للمؤلفين ، والذي يتألف من جراحي الأعصاب وأطباء الأعصاب والصرع وعلماء النفس العصبي والأطباء النفسيين وأخصائيي الأشعة العصبية وغيرهم من أعضاء خدمات علاجات الصرع المتخصصة. قبل الجراحة ، كان لدى الجميع تصوير بالرنين المغناطيسي الحجمي T1 و T2 و FLAIR كما هو موضح في البروتوكول أدناه ، بالإضافة إلى الدم القياسي قبل الجراحة ومراجعة من قبل فريق التخدير العصبي ، مما يضمن أنهم آمنون للمضي قدما في الجراحة تحت التخدير العام. وترد التفاصيل التجارية للكواشف والمعدات المستخدمة في هذه الدراسة في جدول المواد.
1. الحصول على التصوير ومعالجته
ملاحظة: يتم الحصول على فحوصات التصوير بالرنين المغناطيسي (MRI) عالية الدقة قبل الجراحة ، لمدة 3 أشهر ، و 1 سنة بعد الجراحة بشكل روتيني في الأشخاص الذين يخضعون لجراحة الصرع في مركزنا. تم الحصول على بيانات التصوير بالرنين المغناطيسي بين مارس 2020 ومارس 2024 على نفس ماسح التصوير بالرنين المغناطيسي من أجل الاتساق. تم وصف الحصول على الصور المعيارية والعديد من مكونات المعالجة سابقا في الأدبيات وتمت الإشارة إليها بشكل مناسب في البروتوكول الملخص أدناه:
- الحصول على تسلسلات التصوير بالرنين المغناطيسي التالية:
- تسلسل قياسي متساوي القياس ثلاثي الأبعاد (1 مم) T1 مع انعكاس استرداد التدرج الفاسد السريع (IR-FSPGR) صدى [وقت الصدى (TE) 3.1 مللي ثانية ، وقت التكرار (TR) = 7.4 مللي ثانية ، وقت الانعكاس = 400 مللي ثانية ، مجال الرؤية (FOV) = 224 × 256 × 256 مم ، المصفوفة = 224 × 256 × 256 ، حجم الفوكسل = 1.00 × 1.00 × 1.00 مم = 1.00 مم3 ، عامل تسريع التصوير المتوازي = 2] و ؛
- تسلسل سريع للانتعايش السريع للصدى المزدوج الدوران بسرعة كثافة البروتون / T2 يستخدم لقياس الاسترخاء T242 (TE = 30/119 مللي ثانية ، TR = 7600 مللي ثانية ، مجال الرؤية = 220 × 220 مم ، مصفوفة = 512 × 512 ، سمك الشريحة = 4 مم ، حجم فوكسل = 0.43 × 0.43 × 4.00 مم = 0.74 مم3 ، عامل SENSE = 2).
- استخدم التسلسل المرجح T1 أعلاه كمدخل لخوارزمية تدفقات المعلومات الجيوديسية (GIF v3) لتقسيم الدماغ إلى 162 منطقة تشريحية باستخدام NiftyWeb43.
- قم بإنتاج أقنعة تشريحية للهياكل ذات الأهمية باستخدام أجزاء GIF (التلفيف المجاور للحصين ، التلفيف المغزلي ، وإنشاء معلومات توصيف الحصين ، وتقسيم الحصين إلى الأمامي 55٪ والخلف 45٪ باستخدام Hipposeg44) ، وتراكبها في برنامج التخطيط على التصوير الحجمي قبل الجراحة للمريض (كما في الخطوة 1.1).
- قم بإجراء تجزئة تلقائية لقشرة الكمثري وتقسيم القشرة الكمثرية إلى مكونات أمامية وزمنية من تقنيات قياس الحجم الموضحة في العمل السابق من مختبرنا17،45،46. بمجرد إنشاؤها ، قم بتراكب هذه الأقنعة على تصوير المريض قبل الجراحة.
- احصل على صور التصوير بالرنين المغناطيسي للانتشار التالية:
- استحواذ متعدد الأغلفة على الدقة القياسية (دقة متناحية، 11 و8 و32 و64 اتجاها متدرجا عند القيم b 0 و300 و700 و2500 ثانية/مم 2) و؛
- اقتناء متعدد الأصداف عالي الدقة (دقة متناحية: 1.6 مم ، 101 اتجاها ، 14 b0 ، b-values: 300 و 700 و 2500 s / mm2).
- تصحيح بيانات الانتشار المكتسبة باستخدام MRtrix3 (https://mrtrix.org)47 من أجل:
- الضوضاء باستخدام "dwidenoise" في MRtrix348.
- انجراف الإشارة49.
- رنين جيبس باستخدام "mrdegibs" في MRtrix350.
- التشويه باستخدام تدرج ترميز الطور العكسي باستخدام خوارزمية FSL TOPUP (https://fsl.fmrib.ox.ac.uk/fsl51).
- تيارات الدوامة والتحف الحركية باستخدام خوارزمية دوامة FSL (https://fsl.fmrib.ox.ac.uk/fsl) 52 ، وتدوير المتجهات b53.
- حقل التحيز باستخدام خوارزمية ANTs (https://mrtrix.org47،54).
- استخدم إزالة الالتواء الكروي المقيد متعدد الأصداف والأنسجة (CSD) 55 لتقدير وظائف الاستجابة للمادة البيضاء والرمادية والسائل النخاعي (CSF).
- قم بإجراء التصوير الآلي المستهدف تشريحيا لإعادة بناء حزم الألياف ذات الأهمية12،56،57: الإشعاع البصري ، والحزمة الأمامية القذالية السفلية (IFOF ؛ الحالات السائدة في اللغة) ، والحزمة الطولية الوسطى (MLF ؛ الحالات غير المهيمنة اللغوية). اتبع الخطوات أدناه.
- استخرج نقاط الإنهاء القشرية لكل حزمة ألياف وقم بتجميعها في عائد استثمار البذور والإنهاء.
- قم بإنشاء مناطق قشرية استبعاد وعائد استثمار باستخدام مناطق قشرية غير منتهية.
- قم بإجراء التصوير الشبكي المقيدتشريحيا 58 عبر خوارزمية تتبع الألياف الاحتمالية iFOD259 باستخدام تجزئة السطح والحجم الهجين في MRtrix347 باختيار 5,000 خط انسيابي كحد أقصى من 300 مليون بذرة.
- قم بإجراء التصوير في الخطوة 1.8.3 مرتين لكل حزمة ألياف ، وتبديل عائد الاستثمار للبذور والإنهاء.
- قم بتحويل حزم الألياف الناتجة إلى خرائط احتمالية ، عتبة بقيمة 0.01 - استخدمها كمعايير استبعاد إضافية لإزالة خطوط الانسيابية الزائفة.
- راجع حزم الألياف الناتجة (الموسعة بمقدار 2 مم) والأقنعة التشريحية في برنامج التخطيط للتأكد من دقتها تشريحيا (يتم تنفيذ هذه الخطوة بواسطة اثنين من جراحي الأعصاب في وحدتنا).
- قم بتسجيل أقنعة المادة الرمادية التشريحية الناتجة والمادة البيضاء مكانيا إلى صورة التصوير بالرنين المغناطيسي المرجعية T1 في الخطوة 1.1 وتحميلها على نظام الملاحة أثناء الجراحة في غرفة عمليات التصوير بالرنين المغناطيسي أثناء الجراحة (iMRI).
- الحصول على صور التصوير بالرنين المغناطيسي الحجمي المرجح T1 و T2 و T2-FLAIR مباشرة قبل الجراحة (< 24 ساعة) مع إخلاصات الجلد على فروة رأس المريض. شارك في تسجيل هذه الصور لبعضها البعض ، والصورة المرجعية والأقنعة الموزونة T1 الموضحة أعلاه ، والموضحة في الشكل 3.
- تسجيل المريض على نظام الملاحة العصبية باستخدام ليزر مطابق للسطح ومؤشر ذكي.
- التحقق من دقة التسجيل المشترك للصورة والمريض مع اثنين من جراحي الأعصاب للصرع قبل بدء الحالة للتأكد من الدقة.
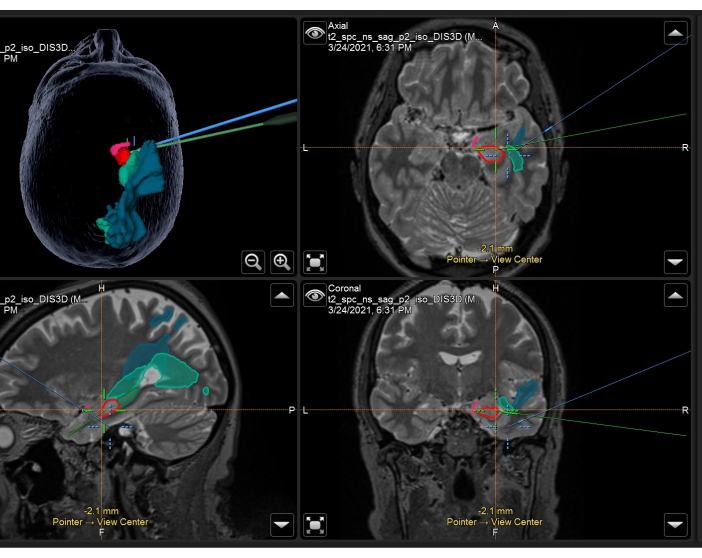
الشكل 3: لقطة شاشة لنظام الملاحة العصبية توضح التصوير بالرنين المغناطيسي الحجمي T2 المرجح مع أقنعة تشريحية متراكبة ومسالك تستخدم أثناء الجراحة في ATLR الأيمن. اللوحة العلوية اليسرى: إعادة بناء ثلاثية الأبعاد لرأس المريض ، موضحة الأقنعة التشريحية. أعلى اليمين: محوري ، أسفل اليسار: سهمي ، وأسفل اليمين: تظهر المناظر الإكليلية أيضا أقنعة تشريحية متراكبة في فحص التصوير بالرنين المغناطيسي الحجمي المرجح T2. الأقنعة التشريحية المعروضة: الجزء الزمني من القشرة الكمثرية (وردي) ، الأمامي 55٪ من الحصين (أحمر) ، الخلفي 45٪ من الحصين (أخضر داكن ، يظهر فقط على الصورة السهمية) ، الإشعاع البصري (منتصف الأخضر) ، الحزمة الطولية الوسطى (الأزرق). الشعيرات المتصالبة الزرقاء هي الموضع المتكامل لتركيز المجهر ، والخط المتقاطع الأخضر هو موضع مؤشر الملاحة العصبية المستخدم في المجال الجراحي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. التقنية الجراحية
ملاحظة: تلخص الخطوات أدناه الممارسة في مركز المؤلفين ولا يقصد بها أن تكون عرضا للنهج الجراحي الوحيد ل ATLR ، بل دليلا على كيفية توحيد المؤلفين لنهج هذا الإجراء لتوفير استئصال موثوق به وقابل للتكرار ، بما في ذلك استئصال القشرة الكمثرية الصدغية.
- تحديد المواقع والنهج
- بعد الفحوصات القياسية قبل الجراحة وتدابير السلامة ، ضع المريض مستلقا ، وارفع الكتف المماثل بلفة ، وأدر الرأس إلى الجانب المقابل.
- ثني الرأس بشكل جانبي للتأكد من أن السماوة هي أعلى نقطة في المجال الجراحي ، وقم بإصلاحها في المسامير (جهاز تثبيت الجمجمة المكون من 3 نقاط - انظر الأمثلة ، بما في ذلك تلك المتوافقة مع مسارح [iMRI] أثناء الجراحة في جدول المواد).
ملاحظة: يعد تحديد المواقع أمرا بالغ الأهمية للسماح بالوصول الكافي إلى هياكل الفص الصدغي المتوسط والخلفي ، وخاصة الانثناء الجانبي ، لضمان أن السمعة هي أعلى نقطة في المجال الجراحي. - تسلل إلى مخدر موضعي لمواقع الدبوس وشق الجلد.
- تسجيل مساحة المريض في نظام الملاحة العصبية باستخدام مزيج من الائتمانات الجلدية وتتبع السطح (خاص بالعلامة التجارية لنظام الملاحة العصبية المستخدمة). تأكد من دقة التسجيل مقابل المعالم العظمية / التشريحية الأخرى الملموسة أو المرئية.
- ضع علامة على خط الشعر وجذر الزيغوما (الذي تم تحديده عن طريق الجس اليدوي). تحديد ووضع علامة على مسار الشق السيلفي باستخدام الملاحة العصبية ، وشق الجلد الأمامي الصدغي المنحني المخطط له.
- قم بإزالة الشعر على طول شق الجلد المخطط له باستخدام مقصات الشعر الكهربائية.
- قم بإجراء شق جبهي الصدغي من 1 سم أمام الزنمة ، مع التقويس بطريقة علامة استفهام ، لمنع إصابة الفرع الجبهي الصدغي للعصب الوجهي. تحديد الشريان الصدغي السطحي والحفاظ عليه إن أمكن. يظهر وضع شق الجلد ووضع علامات عليه في الشكل 4.
- قم بتغطية حواف الجرح وتثبيتها بمسحات الخشاء المنقوعة بمضادات الميكروبات ومشابك راني.
- شق العضلة الصدغية ورفعها إما في السديلة الجلدية العضلية أو بين اللفافة / تحت اللفافة (منع إصابة الفرع الجبهي الصدغي للعصب الوجهي).
- لف سديلة الجلد بشاش مبلل بمحلول مضاد للميكروبات وسحبه للأمام (تجنب استخدام أدوات تثبيت المعادن إذا كنت في مسارح التصوير بالرنين المغناطيسي).
- قم بإنشاء فتحتين لدغ في الجمجمة باستخدام مثقاب ثقب: الأول فوق جذر الزيجوما مباشرة لزيادة التعرض السفلي ، والثاني الجبهي السفلي لتسهيل تصور شق سيلفيان.
- قم بإجراء بضع القحف الجبهي الصدغي القياسي60،61،62 ، مما يؤدي إلى تعريض التلفيف الصدغي العلوي والأوسط على ارتفاع 1 سم فوق الشق السيلفي.
- حفر بعيدا الهوامش الأمامية والسفلية من حج القحف للسماح بسهولة الوصول إلى أرضية الحفرة الصدغية الوسطى وكذلك القطب الصدغي الأمامي. إذا تمت مصادفة خلايا الهواء الخشائية ، فقم بإغلاقها بشمع العظام وغراء الفيبرين عند مواجهتها وفي نهاية الإجراء قبل إغلاق الطبقات السطحية على العظام.
ملاحظة: من المهم التأكد من أن حج القحف يسمح بالوصول إلى أرضية الحفرة القحفية الوسطى ، حيث سيكون هذا هو النهج المنهج للقرن الصدغي للبطين الجانبي عبر التلم الجانبي. من المهم أيضا إغلاق أي خلايا هوائية خشاء تمت مواجهتها تماما لمنع تسرب السائل الدماغي النخاعي بعد الجراحة والأعراض الناتجة والالتهابات المحتملة. - افتح الجافية بطريقة على شكل حرف U مع انعكاس القاعدة للأمام وممتدة بطريقة نجمية. اربط الجافية بعيدا عن مجال العمليات بالخيوط (مثل الحرير 3-0).
- حرر السائل الدماغي النخاعي من أرضية الحفرة القحفية الوسطى والجانب الأمامي للحفرة القحفية الوسطى.
ملاحظة: تعد خطوة تحرير السائل الدماغي النخاعي مهمة للسماح بمساحة عمل كافية للوصول جراحيا إلى أرضية الحفرة القحفية الوسطى والتلم الجانبي من الأسفل دون تراجع وإجهاد الفص الصدغي القاعدي.
- إزالة القشرة المخية الحديثة الجانبية
- تخثر pia من الدوران الصدغي الأوسط والسفلي (MTG و ITG ، على التوالي) في خط عمودي على قاعدة الجمجمة وبما يتماشى مع الإسقاط الأمامي للقرن الصدغي للبطين الجانبي (مؤكد في نظام الملاحة العصبية). تصميم المدى الأمامي الخلفي لهذا الخط على أساس كل حالة على حدة اعتمادا على الأدلة قبل الجراحة لتورط القشرة القشرية الحديثة الجانبية في بداية / انتشار النوبات.
ملاحظة: يجب أن يأخذ المدى الأمامي الخلفي لاستئصال القشرة الحديثة الجانبي في الاعتبار الأدلة السابقة للجراحة (أو عدم وجودها) لتورطها في انتشار النوبات ، وهذا مصمم خصيصا للمريض الفردي. - استخدم نهجا عبر القشرة في ITG لفضح أرضية الحفرة القحفية الوسطى وتحديد التلم الجانبي ، وهو جانبي للتلفيف المجاور للحصين والإنسي إلى التلفيف المغزلي.
- تخثر pia من التلفيف الصدغي العلوي (STG) الأمامي للشق القشري الحديثة الجانبي أعلاه, بالتوازي مع اتجاه الشق سيلفيان. هذا عمودي على الخط الموصوف في الخطوة 2.16 ، ويمتد إلى الأمام إلى القطب الصدغي.
- قم بتطوير المستوى بين STG وشق سيلفيان باستخدام تقنيات التشريح تحت السطح ، وحماية فروع الشريان الدماغي الأوسط ، وحمل هذا التشريح إلى الجزء الأفقي من شق سيلفيان إلى مستوى التلم المحدد السفلي للإنسولة.
ملاحظة: يجب توخي الحذر للحفاظ على سلامة PIA من STG المتاخمة لشق Sylvian أثناء إجراء التشريح تحت الشفة في الخطوة 2.2.4 ، حيث أن هذا يحمي فروع الشريان الدماغي الأوسط في الشق ، بالإضافة إلى الهياكل الأخرى مثل العصب الحركي للعين والشريان المتصل الخلفي (الخطوة 2.2.14) والجهاز البصري (الخطوة 2.3) في وقت لاحق من العملية. - دمج المجهر مع نظام الملاحة العصبية.
- تأكد من دقة تراكبات الكائن للأقنعة التشريحية الموضحة في القسم 1 وتصورها على مجهر HUD.
- قم بإمالة خط الاستئصال الخلفي من الأمام بشكل متفوق لتقليل استئصال STG ، وتمديده تدريجيا من خلال MTG و ITG ، من خلال التلفيف المغزلي إلى التلم الجانبي.
- تحقق من علاقة هامش الاستئصال الخلفي بنظام الملاحة العصبية مع قناع الإشعاع البصري (OR) المرئي.
- تصور المدى الأمامي الأقصى لقناع غرفة العمليات على المجهر وتأكد من أنه خلف هامش الاستئصال على مجهر HUD لضمان عدم حدوث أي ضرر لغرفة العمليات ، مما قد يؤدي إلى عجز في المجال البصري بعد الجراحة ، كما هو موضح في الشكل 5.
ملاحظة: الخطوة 2.2.9 هي خطوة حاسمة لمنع عجز المجال البصري بعد الجراحة بسبب تلف حلقة ماير للإشعاع البصري. إذا كان هناك الكثير من التحول في الدماغ ورغب الجراح في تقليل مخاطر تلف الإشعاع البصري ، أو إذا كانت الإسقاطات الموجودة على HUD في المجهر لا تعمل بشكل صحيح ، يقترح المؤلفون استخدام مؤشر الملاحة العصبية لتوجيه النهج إلى الطرف الأمامي للقرن الصدغي للبطين الجانبي ، لأن هذا يقلل من خطر إصابة غرفة العمليات - اتبع التلم الجانبي بشكل متفوق حتى يتم مواجهة القرن الصدغي (تأكد من ذلك على نظام الملاحة العصبية) ، كما هو موضح في الشكل 6. يمكن التعرف على جدار القرن الصدغي عن طريق البطانة البطانية ذات اللون الأزرق.
ملاحظة: في الأفراد الذين لا يكون علم الأمراض لديهم هو تصلب الحصين ، ورأس الحصين ضخم ، قد يكون من الصعب العثور على البطين. في هذه الحالات ، يتمثل خيار استكشاف الأخطاء وإصلاحها في استخدام مؤشر التنقل العصبي على قاعدة الحفرة الصدغية الإنسية حيث لا يوجد تحول للعثور على مكان إسقاط طرف البطين. من المفيد عادة البحث عن هذا على مستوى إكليلي. إذا تعذر العثور على البطين ، نقترح أولا إزالة العمود ثم العثور على البطين باستخدام الشفاط بالموجات فوق الصوتية. - قسم leptomeninges الصدغي القاعدي الجانبي إلى التعرض للقرن الصدغي.
- افتح البطين من الأمام لفضح رأس الحصين (كما هو موضح في الشكل 6).
- قم بتمديد هامش الاستئصال الخلفي للانضمام إلى الانفصال عن البطين وهذا يسمح بفصل الكتلة القشرية الحديثة.
- قم بتعبئة القطب الصدغي باتباع خط التشريح على هامش الحافة التحتية. احرص على عدم إجراء الفصل على حافة الخيمة لتجنب إصابات الهياكل المتوسطة ، بما في ذلك العصب الحركي للعين والشريان المتصل الخلفي.
ملاحظة: لتقليل مخاطر إتلاف الهياكل في الصهريج ، اتبع شكل حافة الخيمة دون تجاوز حافة الخيمة. سيبقى uncus في مكانه ويمكن أخذه كعينة منفصلة.
- تخثر pia من الدوران الصدغي الأوسط والسفلي (MTG و ITG ، على التوالي) في خط عمودي على قاعدة الجمجمة وبما يتماشى مع الإسقاط الأمامي للقرن الصدغي للبطين الجانبي (مؤكد في نظام الملاحة العصبية). تصميم المدى الأمامي الخلفي لهذا الخط على أساس كل حالة على حدة اعتمادا على الأدلة قبل الجراحة لتورط القشرة القشرية الحديثة الجانبية في بداية / انتشار النوبات.
- الاستئصال الصدغي المتوسط، بما في ذلك القشرة الكمثرية الصدغية
- قم بمسح أنسجة uncus مع تشريح واستخدام الشفاط بالموجات فوق الصوتية بشكل متوسط حتى يظهر العصب الحركي للعين والشريان المتصل الخلفي. توقف مدى الاستئصال الخلفي عند تصور pes (المدى الأكثر ميزيالية لرأس الحصين).
- قم بإجراء استئصال اللوزة باستخدام الشفاط بالموجات فوق الصوتية ، والتي تقتصر بشكل كبير على pia من التلم البطاني ، وحتى يتم تصور الجهاز البصري ، وبشكل mesially بواسطة مستوى pial للصهاريج القاعدية.
ملاحظة: احرص على الحفاظ على الجذع الصدغي وعدم الدخول إلى الفص الجبهي عند تنفيذ الخطوة 2.3.2. في بعض الأحيان ، بسبب تحول الدماغ ، قد يبالغ التنقل العصبي في تقدير مدى الاستئصال ميزيلا. في هذا الصدد ، فإن الاستئصال آمن للاستمرار حتى يتم تصور الجهاز البصري من خلال PIA ، وهذا يمثل الحدود المتوسطة للاستئصال. تم وصف هذا أيضا في Usui et al.63يوصف الهامش الظهري للوزة الدماغية بشكل شائع بأنه تقريبي من خلال خط وهمي يربط النقطة المشيمية بتشعب الشريان الدماغي الأوسط القريب64. - تأكد من استئصال الجزء الزمني من القشرة الكمثرية عن طريق إزالة أي أنسجة متبقية عن طريق التشريح تحت الشفة التي تتقدم بشكل أدنى من الجانب الصدغي للشق السيلفي حتى يتم تصور وريد التلم الدائري السفلي للإنسولا. هذا هامش استئصال مشابه لتلك التي وصفها Usui et al. عند استئصال آفات اللوزة63.
ملاحظة: إذا كان من الصعب إزالة القشرة الكمثرية (في الخطوة 2.3.1) أو قشرة الكمثري (في بعض الأحيان ، يمكن أن تكون ملتصقة جدا بالأم pia) ، يقترح المؤلفون استخدام تشريح Rhoton بدلا من الشفاط بالموجات فوق الصوتية لتقليل إصابة الأم pia. - تأكد من استئصال الجزء الزمني من القشرة الكمثرية باستخدام القناع التشريحي الموصوف في الخطوة 1.4 المتراكب على مجهر HUD ، كما هو موضح في الشكل 7.
- استئصال الحصين
- ضع الخطوط العريضة (أو القطن العريض المماثل) لسحب الضفيرة المشيمية (والشريان المشيمي الأمامي) بشكل ميزي لتسهيل تصور الحصين الفيمبري.
- افصل الحصين الفيمبريا عن مرفقه العنكبوتية ، مما يكشف التلم الحصين الذي يحمل الممر الوعائي الشرياني لقرن عمون.
- افصل الحصين عن ذيله (إما قصر هذا الاستئصال على 55٪ الأمامي من الحصين في استئصال نصف الكرة المهيمن في محاولة لتقليل عجز الذاكرة اللفظية كما هو موضح في16 ، أو تمتد إلى الخلف مثل مستوى تكتوم الدماغ الأوسط في استئصال نصف الكرة الأرضية غير اللغية).
- افصل رأس الحصين عن الحصين. تخثر الممر الشرياني الحصين حسب الحاجة.
- إزالة الحصين المنفصل في كتلة.
- إجراء تشريح تحت السطح للتلفيف المجاور للحصين وتحت الكتلة ، والتأكد من الإرقاء في التجويف الجراحي الناتج. قم بإزالة الحصين pes ، وتصور وحماية جذع الدماغ.
ملاحظة: يجب توخي الحذر عند تنفيذ الخطوة 2.4.7 ، حيث لا توجد حدود واقية بين pes وجذع الدماغ عند هذا المستوى.
- التصوير أثناء الجراحة والإغلاق
- قم بإزالة جميع العناصر المعدنية من المجال الجراحي ، وقم بتغطية الجرح ، وقم بإجراء فحص التصوير بالرنين المغناطيسي أثناء الجراحة ، بما في ذلك عادة تسلسلات T1 و T2 و FLAIR و DWI الحجمية.
- راجع التصوير أثناء الجراحة مع استشاري الأشعة العصبية جنبا إلى جنب مع اثنين من جراحي الأعصاب الاستشاريين في الصرع ، للتأكد من أن الكمية المطلوبة من هياكل الفص الصدغي المتوسط (بما في ذلك الجزء الزمني من القشرة الكمثرية ، بالإضافة إلى الكميات المتغيرة من الحصين كما هو موضح أعلاه في الخطوة 2.36) قد تم استئصالها بنجاح. راجع أيضا تصوير DWI للتأكد من عدم حدوث مناطق من نقص التروية أثناء الإجراء.
- بمجرد تأكيد ما سبق ، قم بنقل المريض مرة أخرى إلى طاولة العمليات ، وتأكد من الإرقاء في التجويف الجراحي عند ضغط الدم الطبيعي للمريض.
- أغلق الجرح بطريقة قياسية ، واستبدل السديلة العظمية ، وقم بتثبيته بألواح ومسامير عند 3 نقاط ، وإغلاق قياسي لطبقات العضلات واللفافة والجلد بالخيوط ، مع ترك تصريف الجرح الجراحي في مكانه لمدة 24 ساعة.
ملاحظة: تكون رعاية ما بعد الجراحة في مركز المؤلفين ، عادة في وحدة الاعتماد العالي لجراحة الأعصاب لمدة 24 ساعة الأولى ، تليها تنحي إلى جناح أخصائي جراحة الأعصاب عندما تشعر وحدة الاعتماد العالي أن ذلك مناسب. تتم مراقبة المرضى لملاحظاتهم العصبية ، ولديهم دم بعد الجراحة بما في ذلك اليوريا والكهارل ، وتعداد الدم الكامل والتفاضل ، وعادة ما يتم إخراجهم بعد حوالي 72 ساعة من الجراحة. ثم تتم متابعتهم كمرضى خارجيين في 4-6 أسابيع ، وفي 3-4 أشهر و 1 سنة بعد الجراحة كحد أدنى مع التصوير الفاصل الزمني.
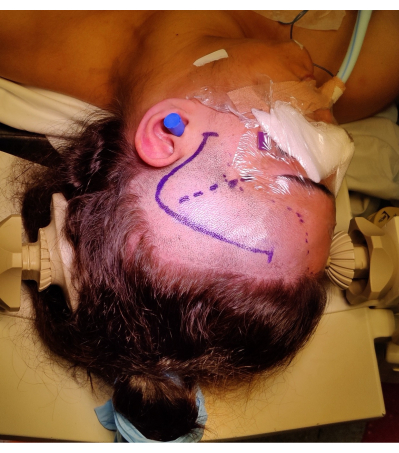
الشكل 4: صورة لوضع المريض في ATLR الأيمن ، مما يدل على وضع علامة على "علامة الاستفهام" شق الجلد الجبهي الصدغي الأيمن ، وخط الشعر ، والشق السيلفي. لم يتم تصوير لفة الكتف الأيسر تحت الكتف الأيسر للمريض للسماح بزاوية وضع الرأس دون وضع ضغط لا داعي له على رقبة المريض ، وعدم إعاقة العودة الوريدية. تم التقاط الصور وإدراجها بموافقة المريض. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
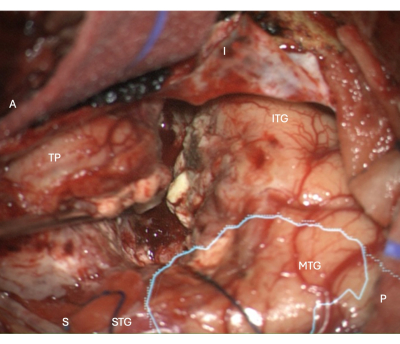
الشكل 5: صورة أثناء الجراحة من المجهر توضح هامش استئصال القشرة المخية الحديثة الجانبي في ATLR الأيمن ، مع القناع التشريحي المتراكب للإشعاع البصري (السماوي) - مما يدل على أن هامش الاستئصال هو الأمامي لغرفة العمليات. توضح الملصقات اتجاه العرض المنطوقي: A = أمامي ، P = خلفي ، I = أدنى ، S = متفوق ، STG = تلفيف الصدغي العلوي ، MTG = التلفيف الصدغي الأوسط ، ITG = التلفيف الصدغي السفلي ، TP = القطب الصدغي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
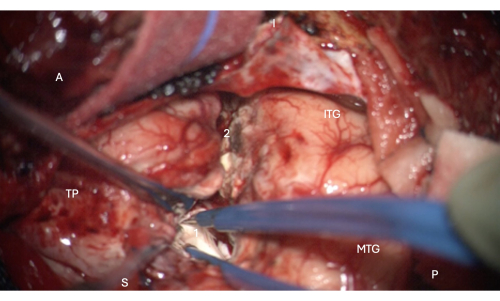
الشكل 6: صورة أثناء الجراحة من المجهر توضح الدخول إلى الجزء الأمامي من القرن الصدغي للبطين الجانبي ، تظهر رأس الحصين بداخله (أبيض باهت ، 1). التسميات: A = الأمامي ، P = الخلفي ، I = السفلي ، S = متفوق ، MTG = التلفيف الصدغي الأوسط ، ITG = التلفيف الصدغي السفلي ، 2 = هامش استئصال القشرة القشرية الحديثة الجانبي ، بعد التلم الجانبي بشكل متفوق في العمق للعثور على القرن الصدغي للبطين الجانبي ، TP = القطب الصدغي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
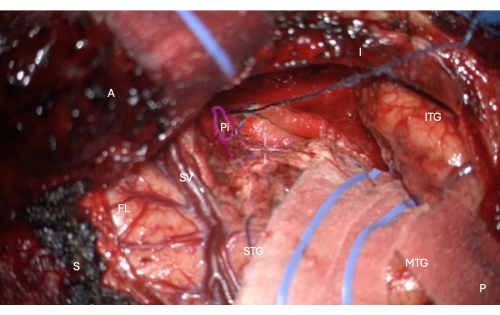
الشكل 7: صورة أثناء الجراحة من المجهر توضح تراكب HUD للقناع التشريحي للجزء الزمني من القشرة الكمثرية (المخطط الوردي ، المسمى Pi). يوضح هذا الشكل الاستئصال الكامل - لا يوجد نسيج دماغي متبقي ، فقط حدود اللوحة للتلم بباطن الأنف إلى الاستئصال ، محمية في هذه الصورة مع الفطيرة الطولية العلوية في الصورة ، فوق التقاطع الأبيض المركزي لمجهر HUD. التسميات: A = الأمامي ، P = الخلفي ، I = السفلي ، S = متفوق ، STG = التلفيف الصدغي العلوي ، MTG = التلفيف الصدغي الأوسط ، ITG = التلفيف الصدغي السفلي ، FL = الفص الجبهي ، SV = الأوردة السيلفية (التي تغطي شق سيلفيان) ، Pi = الجزء الزمني من القشرة الكمثرية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
تم تطبيق هذا البروتوكول والتقنيات الجراحية ضمن دراسة مستمرة ، للاستجواب في آثار استئصال القشرة الكمثرية الصدغية وتأثيرها على حرية النوبات بعد ATLR ل DRmTLE. الهدف من هذه الدراسة هو تحديد ما إذا كانت حرية النوبات بعد إزالة القشرة الكمثرية الصدغية تعمل بالفعل على تحسين حرية ا?...
Discussion
يوفر هذا البروتوكول استئصالا موثوقا ومستهدفا للجزء الزمني من القشرة الكمثرية - يفترض أنه هيكل حاسم في تكوين الصرع وانتشار شبكة صرع الفص الصدغي المتوسط16،17،24،25،30.
تم ...
Disclosures
يتلقى المؤلفان ديبيان داسغوبتا وجون إس دنكان تمويلا من برنامج Wellcome Trust للابتكار (218380 / Z / 19 / Z). يتم دعم Lawrence P. Binding من قبل Epilepsy Research UK (رقم المنحة P1904). يتم تمويل المؤلفين المذكورين أعلاه و Sjoerd B. Vos جزئيا من قبل المعهد الوطني للبحوث الصحية ، ومستشفى كلية لندن ، ومركز أبحاث الطب الحيوي (NIHR BRC UCLH / UCL High Impact Initiative BW.mn.BRC10269). ويعلن المؤلفون أن البحث أجري في غياب أي علاقات تجارية أو مالية يمكن تفسيرها على أنها تضارب محتمل في المصالح. نؤكد أننا قرأنا موقف المجلة من القضايا التي ينطوي عليها النشر الأخلاقي ونؤكد أن هذا التقرير يتفق مع تلك الإرشادات.
Acknowledgements
تم دعم هذا العمل من قبل Epilepsy Research UK (رقم المنحة P1904) وبرنامج Wellcome Trust للابتكار (218380 / Z / 19 / Z). تم تمويل هذا العمل جزئيا من قبل المعهد الوطني للبحوث الصحية ، ومستشفى كلية لندن الجامعية ، ومركز أبحاث الطب الحيوي (NIHR BRC UCLH / UCL مبادرة التأثير العالي BW.mn.BRC10269). يقر المؤلفون بالمرافق والمساعدة العلمية والفنية للمرفق الوطني للتصوير ، وهي قدرة على البنية التحتية للبحوث التعاونية الوطنية (NCRIS) ، في مركز الفحص المجهري والتوصيف والتحليل ، جامعة أستراليا الغربية. تم تمويل هذا البحث كليا أو جزئيا من قبل Wellcome Trust [WT 218380]. لغرض الوصول المفتوح ، قام المؤلف بتطبيق ترخيص حقوق الطبع والنشر العام CC BY على أي نسخة مخطوطة مقبولة من قبل المؤلف تنشأ عن هذا التقديم.
Materials
| Name | Company | Catalog Number | Comments |
| Brainlab Neuronavigation System | Brianlab, Westchester, IL | https://www.brainlab.com/surgery-products/overview-neurosurgery-products/cranial-navigation/ | Intraoperative neuronavigation system |
| EpiNav Planning Software | N/A | N/A | Clinical Decision Support Tool, for research use, developed in academia at King's College London and University College London |
| Mayfield clamp | Integra | A1059 | Any 3 pin head immobilisation device can be used |
| Microsurgical instruments | As per local neurosurgical unit | ||
| MRI Scanner | GE, Milwaukee, WI, USA | 3T MRI GE MR750 | Any alternative 3T MRI scanner can be used |
| MRTrix3 | N/A | Reference 47 in the manuscript | MRtrix3 provides a set of tools to perform various advanced diffusion MRI analyses, including constrained spherical deconvolution (CSD), probabilistic tractography, track-density imaging, and apparent fibre density |
| NORAS coil | NORAS MRI Products | https://www.noras.de/en/mri-produkte/lucy-or-head-holder-8-ch-coil/#infos | Any MRI-safe head immobilisation device can be used |
| Perforator drill | Stryker | https://neurosurgical.stryker.com/products/elite/ | Any alternative neurosurgical perforator drill driver and bit can be used |
| Sutures - Vicryl Plus 2/- | Ethicon | ETVCP684H | Any alternative suture that the surgeon prefers can be used |
| Titanium bone plates and screws | As per local neurosurgical unit | ||
| Ultrasonic Aspirator | Integra | https://products.integralife.com/cusa-tissue-ablation/category/cusa-tissue-ablation | Any alternative that the surgeon prefers can be used |
References
- Marathe, K., et al. ablative and radiosurgical interventions for drug-resistant mesial temporal lobe epilepsy: A systematic review and meta-analysis of outcomes. Front Neurol. 12, 777845 (2021).
- Choi, H., et al. Epilepsy surgery for pharmacoresistant temporal lobe epilepsy: A decision analysis. JAMA. 300, 2497 (2008).
- Foldvary, N., et al. Seizure outcome after temporal lobectomy for temporal lobe epilepsy: A Kaplan-Meier survival analysis. Neurology. 54, 630-634 (2000).
- Spencer, S. S., et al. Predicting long-term seizure outcome after resective epilepsy surgery: The multicenter study. Neurology. 65, 912-918 (2005).
- Sperling, M. R., O'Connor, M. J., Saykin, A. J., Plummer, C. Temporal lobectomy for refractory epilepsy. JAMA. 276, 470-475 (1996).
- Wiebe, S. Effectiveness and safety of epilepsy surgery: What is the evidence. CNS Spectr. 9, 120-132 (2004).
- Gilliam, F., et al. Patient-oriented outcome assessment after temporal lobectomy for refractory epilepsy. Neurology. 53, 687-694 (1999).
- Markand, O. N., Salanova, V., Whelihan, E., Emsley, C. L. Health-related quality of life outcome in medically refractory epilepsy treated with anterior temporal lobectomy. Epilepsia. 41, 749-759 (2000).
- Jones, J. E., Berven, N. L., Ramirez, L., Woodard, A., Hermann, B. P. Long-term psychosocial outcomes of anterior temporal lobectomy. Epilepsia. 43, 896-903 (2002).
- Spencer, D. D., Spencer, S. S., Mattson, R. H., Williamson, P. D., Novelly, R. A. Access to the posterior medial temporal lobe structures in the surgical treatment of temporal lobe epilepsy. Neurosurgery. 15, 667-671 (1984).
- Vakharia, V. N., et al. Intraoperative overlay of optic radiation tractography during anteromesial temporal resection: A prospective validation study. J Neurosurg. 1, 1-10 (2021).
- Winston, G. P., et al. Preventing visual field deficits from neurosurgery. Neurology. 83, 604-611 (2014).
- Almairac, F., Herbet, G., Moritz-Gasser, S., de Champfleur, N. M., Duffau, H. The left inferior fronto-occipital fasciculus subserves language semantics: A multilevel lesion study. Brain Struct Funct. 220, 1983-1995 (2015).
- Binding, L. P., Dasgupta, D., Giampiccolo, D., Duncan, J. S., Vos, S. B. Structure and function of language networks in temporal lobe epilepsy. Epilepsia. 63, 1025-1040 (2022).
- Giampiccolo, D., Duffau, H. Controversy over the temporal cortical terminations of the left arcuate fasciculus: A reappraisal. Brain. 145, 1242-1256 (2022).
- Sone, D., et al. Optimal surgical extent for memory and seizure outcome in temporal lobe epilepsy. Ann Neurol. 91, 131-144 (2022).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690-700 (2019).
- Dasgupta, D., et al. Hippocampal resection in temporal lobe epilepsy: Do we need to resect the tail. Epilepsy Res. 190, 107086 (2023).
- Wu, C., et al. Effects of surgical targeting in laser interstitial thermal therapy for mesial temporal lobe epilepsy: A multicenter study of 234 patients. Epilepsia. 60, 1171-1183 (2019).
- Wiebe, S. A randomized, controlled trial of surgery for temporal-lobe epilepsy. N Engl J Med. 345 (5), 311-318 (2001).
- Brotis, A. G., et al. A meta-analysis on potential modifiers of LITT efficacy for mesial temporal lobe epilepsy: Seizure-freedom seems to fade with time. Clin Neurol Neurosurg. 205, 106644 (2021).
- Borger, V., et al. Resection of piriform cortex predicts seizure freedom in temporal lobe epilepsy. Ann Clin Transl Neurol. 8, 177-189 (2020).
- Borger, V., et al. Temporal lobe epilepsy surgery: Piriform cortex resection impacts seizure control in the long-term. Ann Clin Transl Neurol. 9 (8), 1206-1211 (2022).
- Hwang, B. Y., et al. Piriform cortex ablation volume is associated with seizure outcome in mesial temporal lobe epilepsy. Neurosurgery. 91, 414-421 (2022).
- Piper, R. J., et al. Extent of piriform cortex resection in children with temporal lobe epilepsy. Ann Clin Transl Neurol. 10, 1613-1622 (2023).
- Allison, A. C. The secondary olfactory areas in the human brain. J Anat. 88, 481-488 (1954).
- Ribas, G. C. The cerebral sulci and gyri. Neurosurg Focus. 28, E2 (2010).
- Young, J. C., Vaughan, D. N., Paolini, A. G., Jackson, G. D. Electrical stimulation of the piriform cortex for the treatment of epilepsy: A review of the supporting evidence. Epilepsy Behav. 88, 152-161 (2018).
- Mai, J. K., Majtanik, M., Paxinos, G. . Atlas of the Human Brain. , (2016).
- Vaughan, D. N., Jackson, G. D. The piriform cortex and human focal epilepsy. Front Neurol. 5, 259 (2014).
- Gale, K. Progression and generalization of seizure discharge: Anatomical and neurochemical substrates. Epilepsia. 29, S15-S34 (1988).
- Löscher, W., Ebert, U. The role of the piriform cortex in kindling. Prog Neurobiol. 50, 427-481 (1996).
- Piredda, S., Gale, K. A crucial epileptogenic site in the deep prepiriform cortex. Nature. 317, 623-625 (1985).
- McIntyre, D. C., Gilby, K. L. Mapping seizure pathways in the temporal lobe. Epilepsia. 49, 23-30 (2008).
- Fahoum, F., Lopes, R., Pittau, F., Dubeau, F., Gotman, J. Widespread epileptic networks in focal epilepsies: EEG-fMRI study. Epilepsia. 53, 1618-1627 (2012).
- Flanagan, D., Badawy, R. A. B., Jackson, G. D. EEG-fMRI in focal epilepsy: Local activation and regional networks. Clin Neurophysiol. 125, 21-31 (2014).
- Laufs, H., et al. Converging PET and fMRI evidence for a common area involved in human focal epilepsies. Neurology. 77, 904-910 (2011).
- Wieser, H. G., et al. Proposal for a new classification of outcome with respect to epileptic seizures following epilepsy surgery. Epilepsia. 42, 282-286 (2001).
- Dasgupta, D., Duncan, J. S. Optimizing epilepsy surgery. ISRCTN Registry. BMC. , (2020).
- Sparks, R., et al. Automated multiple trajectory planning algorithm for the placement of stereo-electroencephalography (SEEG) electrodes in epilepsy treatment. Int J CARS. 12, 123-136 (2017).
- Dasgupta, D. . Improving outcomes in anteromesial temporal lobe resections - A prospective surgical trial integrating multimodal imaging & novel hi-res tractography. , (2022).
- Winston, G. P., et al. Automated T2 relaxometry of the hippocampus for temporal lobe epilepsy. Epilepsia. 58, 1645-1652 (2017).
- Cardoso, M. J., et al. Geodesic information flows: Spatially-variant graphs and their application to segmentation and fusion. IEEE Trans Med Imaging. 34, 1976-1988 (2015).
- Winston, G. P., et al. Automated hippocampal segmentation in patients with epilepsy: Available free online. Epilepsia. 54, 2166-2173 (2013).
- Iqbal, S., et al. Volumetric analysis of the piriform cortex in temporal lobe epilepsy. Epilepsy Res. 185, 106971 (2022).
- Leon-Rojas, J. E., et al. Resection of the piriform cortex for temporal lobe epilepsy: a novel approach on imaging segmentation and surgical application. Br J Neurosurg. 1, 1-6 (2021).
- Tournier, J. -. D., et al. MRtrix3: A fast, flexible and open software framework for medical image processing and visualization. Neuroimage. 202, 116137 (2019).
- Cordero-Grande, L., Christiaens, D., Hutter, J., Price, A. N., Hajnal, J. V. Complex diffusion-weighted image estimation via matrix recovery under general noise models. Neuroimage. 200, 391-404 (2019).
- Vos, S. B., et al. The importance of correcting for signal drift in diffusion MRI. Magn Reson Med. 77, 285-299 (2017).
- Kellner, E., Dhital, B., Kiselev, V. G., Reisert, M. Gibbs-ringing artifact removal based on local subvoxel-shifts. Magn Reson Med. 76, 1574-1581 (2016).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. Neuroimage. 23, S208-S219 (2004).
- Andersson, J. L. R., Sotiropoulos, S. N. An integrated approach to correction for off-resonance effects and subject movement in diffusion MR imaging. Neuroimage. 125, 1063-1078 (2016).
- Leemans, A., Jones, D. K. The B-matrix must be rotated when correcting for subject motion in DTI data. Magn Reson Med. 61, 1336-1349 (2009).
- Tustison, N. J., et al. N4ITK: Improved N3 Bias Correction. IEEE Trans Med Imaging. 29, 1310-1320 (2010).
- Dhollander, T., Raffelt, D., Connelly, A. Unsupervised 3-tissue response function estimation from single-shell or multi-shell diffusion MR data without a co-registered T1 image. ISMRM Workshop on Breaking the Barriers of Diffusion MRI. 5, (2016).
- Binding, L. P., et al. Contribution of white matter fiber bundle damage to language change after surgery for temporal lobe epilepsy. Neurology. 100, e1621-e1633 (2023).
- Giampiccolo, D., et al. Thalamostriatal disconnection underpins long-term seizure freedom in frontal lobe epilepsy surgery. Brain. 146, 2377-2388 (2023).
- Smith, R. E., Tournier, J. -. D., Calamante, F., Connelly, A. Anatomically-constrained tractography: Improved diffusion MRI streamlines tractography through effective use of anatomical information. Neuroimage. 62, 1924-1938 (2012).
- Tournier, J. D., Calamante, F., Connelly, A. Improved probabilistic streamlines tractography by 2nd order integration over fibre orientation distributions. Proc 18th Annu Meet ISMRM. 1670, (2010).
- Yasargil, M. G., Fox, J. L. The microsurgical approach to intracranial aneurysms. Surg Neurol. 3, 7-14 (1975).
- Yasargil, M. G., et al. Microsurgical pterional approach to aneurysms of the basilar bifurcation. Surg. Neurol. 6, 83-91 (1976).
- Rao, D., Le, R. T., Fiester, P., Patel, J., Rahmathulla, G. An illustrative review of common modern craniotomies. J Clin Imaging Sci. 10, 81 (2020).
- Usui, N., Kondo, A., Nitta, N., Tottori, T., Inoue, Y. Surgical resection of amygdala and uncus. Neurol Med Chir (Tokyo). 58, 377-383 (2018).
- Vivas, A. C., Reintjes, S., Shimony, N., Vale, F. L. Surgery of the amygdala and uncus: A case series of glioneuronal tumors. Acta Neurochir. (Wien). 162, 795-801 (2020).
- Al-Otaibi, F., Baeesa, S. S., Parrent, A. G., Girvin, J. P., Steven, D. Surgical techniques for the treatment of temporal lobe epilepsy. Epilepsy Res Treat. 2012, 1-13 (2012).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved