Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Amélioration des résultats des résections du lobe temporal antéro-sial - Une démonstration de la résection du cortex temporal piriforme
Dans cet article
Résumé
Ici, nous démontrons une approche du guidage neurochirurgical peropératoire dans les résections du lobe temporal antéro-sémaillaire, en mettant spécifiquement en évidence l’utilisation de la tractographie et des masques anatomiques pour aider à la résection sûre de la partie temporale du cortex piriforme - une zone de plus en plus considérée comme une cible chirurgicale cruciale dans l’épilepsie mésiale du lobe temporal résistante aux médicaments.
Résumé
La résection du lobe temporal antéro-sial (ATLR) est une option de traitement utile pour l’épilepsie du lobe temporal mésial résistante aux médicaments (DRmTLE). De plus en plus de preuves suggèrent que le cortex piriforme joue un rôle crucial dans la génération et la propagation des crises dans le DRmTLE - et que la résection de la partie temporale du cortex piriforme est associée à des taux significativement améliorés d’absence de crise.
Ici, nous présentons la résection de la portion temporale du cortex piriforme dans l’ATLR, à l’aide d’algorithmes de tractographie probabiliste préopératoire à haute résolution et de masques anatomiques fusionnés des structures d’intérêt dans la neuronavigation peropératoire et l’affichage tête haute (HUD) du microscope.
Tous les patients subissant une évaluation préopératoire complète et des investigations pour DRmTLE ont fourni un consentement écrit éclairé pour enregistrer une vidéo peropératoire de la procédure. Les patients ont été identifiés par une équipe multidisciplinaire d’épileptologues, de neurochirurgiens spécialisés dans l’épilepsie, de neuropsychologues, de neuropsychiatres et d’électrophysiologistes dans un grand centre de chirurgie de l’épilepsie. Le pipeline d’imagerie préopératoire comprenait la délimitation des structures critiques. Cela comprenait le cortex piriforme temporal et la tractographie probabiliste à haute résolution pour les voies essentielles à risque (par exemple, le rayonnement optique et le faisceau fronto-occipital inférieur). Ceux-ci ont été co-enregistrés dans le balayage volumétrique de neuronavigation préopératoire et téléchargés dans le système de neuronavigation peropératoire.
Voici une procédure étape par étape de l’ATLR, y compris la résection de la partie temporale du cortex piriforme. Le protocole combine une imagerie IRM structurelle et de diffusion avancée et des aides visuelles peropératoires pour intégrer des masques anatomiques de structures critiques de matière grise et de faisceaux de substance blanche dans le flux de travail chirurgical en salle d’opération.
Introduction
La résection du lobe temporal antéro-zéral (ATLR) est le traitement le plus efficace de l’épilepsie du lobe temporal mésial résistante aux médicaments (DRmTLE)1,2, avec des taux d’absence de crises de 50 % à 70 % et une morbidité relativement faible 3,4,5. Il a également été démontré que la procédure améliore la qualité de vie 6,7,8, les taux d’emploi5 et le bien-être psychosocial9.
L’ATLR canonique, décrite par Spencer et al.10, implique une résection du pôle temporal, de l’uncus, de l’amygdale, de l’hippocampe, du gyrus parahippocampique et du gyrus fusiforme. Les voies critiques de la substance blanche impliquées dans la vision (le rayonnement optique, en particulier, l’anse de Meyer11,12) et le langage (par exemple, le faisceau fronto-occipital inférieur13 et le faisceau arqué14,15) risquent d’être blessées lors de l’accès à la corne temporale du ventricule latéral. Le protocole suivant décrit une approche pour éviter ces faisceaux de substance blanche à l’aide d’une tractographie probabiliste préopératoire à haute résolution et de masques anatomiques fusionnés des structures d’intérêt dans la neuronavigation peropératoire et l’affichage tête haute microscopique (HUD).
La compréhension traditionnelle du domaine est que la résection maximale de l’hippocampe est bénéfique pour maximiser les taux de liberté de crise postopératoire. Cependant, des analyses récentes par voxels de cas post-ATLR démontrent que la résection de la partie temporale du cortex piriforme dans l’ATLR augmente considérablement les chances d’absence de crise. Ils ont également montré qu’il n’y avait pas d’association entre la résection postérieure de l’hippocampe et l’absence de crises16,17. En conséquence, il a été proposé de mettre à jour la technique de Spencer en limitant la résection de l’hippocampe à la partie antérieure de 55 % de l’hippocampe, dans les ATLR de l’hémisphère dominant du langage, afin de préserver la fonction de mémoire16,18.
Bien qu’il y ait eu un intérêt croissant pour l’utilisation de nouvelles thérapies mini-invasives, en particulier la thérapie thermique interstitielle au laser (LITT), la résection chirurgicale reste la norme de soins pour l’épilepsie focale résistante aux médicaments1, et il a été démontré que l’efficacité de la LITT produit une proportion plus faible de résultats convulsifs d’Engel 1 (58 %-59 %)1,19 par rapport à l’ATLR (60 %-70 %)3, 4,5,20, et c’est donc encore un domaine nécessitant une enquête plus approfondie21.
Il existe de plus en plus de preuves à l’appui de l’hypothèse selon laquelle le cortex piriforme (Figure 1) est une région critique dans la propagation et/ou l’épileptogenèse des crises chez les adultes 16,17,22,23,24 et les enfants25 atteints d’épilepsie mésiale du lobe temporal. Le cortex piriforme est un ruban d’allocortex à trois couches (similaire à l’arrangement du cortex hippocampique) qui est drapé autour du sillon entorhinal mésial au tronc temporal26,27, et forme donc la confluence des lobes temporal et frontal. Il peut donc être facilement considéré comme constitué de divisions frontales et temporelles, décrites en détail dans la littérature 22,25,28,29,30.
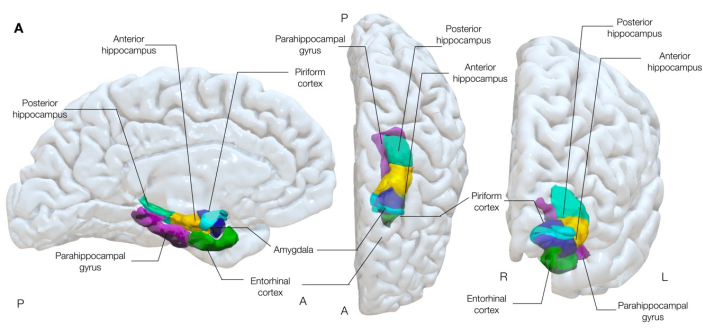
Figure 1 : Rendu tridimensionnel semi-transparent des structures temporales mésiales du cerveau. Cette figure démontre les associations anatomiques du cortex piriforme (cyan) avec l’anatomie du lobe temporal mésial environnant. Vue médiale gauche, vue supérieure du centre et vue antérieure droite. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Le cortex piriforme est supéro-mésial à l’amygdale et a longtemps été impliqué dans les études animales comme un nœud commun dans les réseaux qui diffusent des décharges épileptogènes31-33, et génère des crises suite à une stimulation électrique plus facilement que les structures mésiales voisines, y compris l’amygdale et l’hippocampe34. Sa position, avec des connexions étendues aux cortex entorhinal, limbique, orbitofrontal et insulaire, ainsi qu’au thalamus, au bulbe olfactif, à l’amygdale et à l’hippocampe, se prête également à un rôle de voie de propagation clé des décharges épileptogènes dans l’épilepsie focale30.
Les études EEG-IRMf et la tomographie par émission de positons (TEP) confirment en outre un rôle important du cortex piriforme dans la DRmTLE, montrant une activation interictale, et une réduction de la liaison du récepteur de l’acide γ-aminobutyrique de type A (GABAA) dans le cortex piriforme est associée à une augmentation de l’activité convulsive 35,36,37.
Deux études d’imagerie récentes significatives dans DRmTLE ont montré que l’absence de crise postopératoire est associée à une plus grande étendue de résection du cortex piriforme ; Galovic et al. ont démontré dans une vaste cohorte rétrospective que l’ablation d’au moins la moitié du cortex piriforme améliorait les chances de ne plus avoir de crises d’un facteur de 16 (IC à 95 %, 5-47 ; p < 0,001)17. Il a également été démontré que les volumes de résection d’autres structures temporales mésiales n’étaient pas associés à l’absence de crises, une découverte reproduite et soutenue par les analyses par voxels effectuées par Sone et al., qui ont montré que seule la résection du cortex piriforme dans le TLE gauche était associée à l’absence de crises16 (Figure 2).
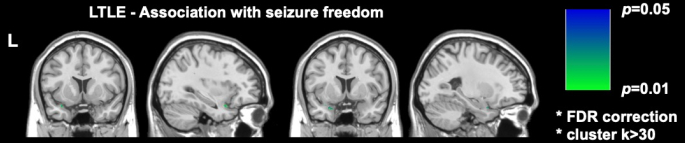
Figure 2 : Association par voxel avec l’absence de crise postopératoire dans le TLE gauche. La seule zone significativement corrélée à l’absence de crise est la partie temporale du cortex piriforme, p = 0,01 (vert dans les coupes IRM coronales et sagittales pondérées en T1). Adapté de Sone et al.16 avec autorisation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Borger et al. ont également démontré dans une vaste cohorte rétrospective que seule la proportion de cortex piriforme temporal réséqué est associée à une amélioration des taux d’absence de crises à la fois à 1 an3 et à un suivi plus long (moyenne de 3,75 ans)23. Ils ont en outre corroboré que le volume réséqué de l’hippocampe et de l’amygdale ne prédisait pas l’absence de crise.
L’importance de la déconnexion du cortex piriforme du réseau épileptogène aberrant dans le mTLE a également été démontrée dans le LITT, Hwang et al. montrant lors d’un suivi de 6 mois que le pourcentage d’ablation du cortex piriforme était associé aux résultats de classe 1 de l’ILAE38 (OR 1,051, IC à 95 % 1,001-1,117, p = 0,045), mais qu’il s’agissait d’une tendance qui n’était pas significative à 1 an5. Cela semble corroborer les données émergentes concernant le LITT, selon lesquelles il y a une amélioration positive, mais potentiellement moins permanente, des résultats des crises, ce qui a conduit à ce que la LITT soit couramment utilisée comme une procédure de « première étape », la chirurgie réséctive étant proposée à ceux chez qui l’absence de crise n’est pas obtenue par le LITT.
Il existe donc des preuves solides que la résection de la partie temporale du cortex piriforme est une cible clé pour atteindre l’absence de crise dans l’épilepsie du lobe temporal mésial résistante aux médicaments. Cependant, comme l’a démontré la cohorte rétrospective de Galovic et al., ce ruban du cortex entorhinal se trouve dans un endroit difficile à cibler chirurgicalement lors de la réalisation d’un ATLR, ce qui signifie que s’il n’est pas directement ciblé, il n’est pas toujours retiré avec succès. Dans cette étude, nous montrons comment cibler et réséquer en toute sécurité la partie temporale du cortex piriforme dans le cadre d’une étude chirurgicale prospective en cours, afin d’évaluer son impact sur l’amélioration des taux de liberté des crises postopératoires39.
Le protocole suivant se concentre sur les aspects techniques de l’acquisition et du traitement des images, l’approche chirurgicale et la façon dont nous assurons la résection de la partie temporale du cortex piriforme dans l’ATLR, tout en intégrant la tractographie probabiliste préopératoire à haute résolution et les masques anatomiques fusionnés des structures d’intérêt dans la neuronavigation peropératoire et l’affichage tête haute (HUD) du microscope. Le protocole utilise également une plate-forme logicielle de planification spécifique40, qui permet la visualisation en 3 dimensions et l’intégration de l’imagerie multimodale pour l’examen et la planification chirurgicaux, et un système de neuronavigation qui permet l’intégration avec le microscope opératoire (les spécificités sont détaillées dans la table des matériaux).
Protocole
Ces méthodes et protocoles font partie d’un essai chirurgical prospectif en cours qui a été approuvé par la Health Research Authority le 10/09/2020, Research Ethics Committee (REC) London reference : 20/LO/0966. Le protocole a fait l’objet d’un enregistrement prospectif : ISRCTN72646265, le 25/09/2020, est disponible en ligne39, et a été présenté lors d’une conférence nationale41.
Le protocole suivant est appliqué à tous les patients subissant une ATLR pour DRmTLE chez les patients âgés de 18 à 70 ans (la tranche d’âge des patients opérés pour cette indication dans notre centre spécialisé en chirurgie de l’épilepsie chez l’adulte), tous opérés par les mêmes chirurgiens (AWM, AM). Tous les participants ont fourni un consentement éclairé avant d’être inclus dans l’étude. Tous les participants ont fait l’objet d’une évaluation préopératoire approfondie et d’investigations dirigées par l’équipe multidisciplinaire experte en épilepsie chirurgicale du centre de chirurgie de l’épilepsie complet des auteurs, composée de neurochirurgiens, de neurologues épileptiques, de neuropsychologues, de psychiatres, de neuroradiologues et d’autres membres des services spécialisés dans les thérapies de l’épilepsie. Avant l’opération, tous avaient des IRM volumétriques T1, T2 et FLAIR à jour, comme indiqué dans le protocole ci-dessous, ainsi que du sang préopératoire standard et un examen par l’équipe de neuroanesthésie, garantissant qu’ils pouvaient passer en toute sécurité à la chirurgie sous anesthésie générale. Les détails commerciaux des réactifs et de l’équipement utilisés dans cette étude sont fournis dans la table des matériaux.
1. Acquisition et traitement de l’imagerie
REMARQUE : Des examens d’imagerie par résonance magnétique (IRM) préopératoires à haute résolution, de 3 mois et de 1 an sont couramment acquis chez les personnes subissant une chirurgie de l’épilepsie dans notre centre. Les données d’IRM ont été acquises entre mars 2020 et mars 2024 sur le même scanner d’IRM par souci de cohérence. L’acquisition d’images normalisée et de nombreux composants de traitement ont déjà été décrits dans la littérature et sont référencés de manière appropriée dans le protocole résumé ci-dessous :
- Acquérir les séquences IRM suivantes :
- Une séquence isométrique 3D standard (1 mm) pondérée T1 avec écho IR-FSPGR (inversion-récupération, rappel rapide de gradient gâté) [temps d’écho (TE) 3,1 ms, temps de répétition (TR) = 7,4 ms, temps d’inversion = 400 ms, champ de vision (FOV) = 224 × 256 × 256 mm, matrice = 224 × 256 × 256, taille de voxel = 1,00 × 1,00 × 1,00 mm = 1,00 mm3, facteur d’accélération de l’imagerie parallèle = 2] et ;
- Une séquence coronale à double écho à récupération rapide de spin rapide densité de protons/T2 utilisée pour la relaxométrie T242 (TE = 30/119 ms, TR = 7600 ms, FOV = 220 × 220 mm, matrice = 512 × 512, épaisseur de la tranche = 4 mm, taille du voxel = 0,43 × 0,43 × 4,00 mm = 0,74 mm3, facteur SENSE = 2).
- Utilisez la séquence pondérée T1 ci-dessus comme entrée dans l’algorithme de flux d’informations géodésiques (GIF v3) pour diviser le cerveau en 162 régions anatomiques à l’aide de NiftyWeb43.
- Produisez des masques anatomiques des structures d’intérêt à l’aide des parcellations GIF (gyrus parahippocampique, gyrus fusiforme, créez des informations de profilage de l’hippocampe et segmentez l’hippocampe en 55 % antérieur et 45 % postérieur à l’aide d’Hipposeg44), superposez-les dans le logiciel de planification sur l’imagerie préopératoire volumétrique du patient (comme à l’étape 1.1).
- Effectuez une segmentation automatisée du cortex piriforme et divisez le cortex piriforme en composantes frontales et temporelles à partir des techniques de volumétrie expliquées dans les travaux précédents de notre laboratoire 17,45,46. Une fois générés, superposez ces masques sur l’imagerie préopératoire du patient.
- Acquérir les images IRM de diffusion suivantes :
- Une acquisition multicouche à résolution standard (résolution isotrope de 2 mm, 11, 8, 32 et 64 directions de gradient aux valeurs b 0, 300, 700, 2500 s/mm2) et ;
- Une acquisition multi-couches haute résolution (résolution isotrope de 1,6 mm, 101 directions, 14 b0, valeurs b : 300, 700 et 2500 s/mm2).
- Corrigez les données de diffusion acquises à l’aide de MRtrix3 (https://mrtrix.org)47 pour :
- Bruit à l’aide de « dwidenoise » dans MRtrix348.
- Dérive du signal49.
- Sonnerie de Gibbs à l’aide de « mrdegibs » dans MRtrix350.
- Distorsion à l’aide d’un gradient de codage de phase inverse avec l’algorithme FSL TOPUP (https://fsl.fmrib.ox.ac.uk/fsl51).
- Courants de Foucault et artefacts de mouvement à l’aide de l’algorithme de Foucault (https://fsl.fmrib.ox.ac.uk/fsl)52, en faisant pivoter les vecteurs b53.
- Champ de biais à l’aide de l’algorithme ANTs (https://mrtrix.org47,54).
- Utilisez la déconvolution sphérique contrainte (CSD)55 pour estimer les fonctions de réponse de la matière blanche et grise, et du liquide céphalo-rachidien (LCR).
- Effectuer une tractographie automatisée anatomiquement ciblée pour reconstruire les faisceaux de fibres d’intérêt 12,56,57 : le rayonnement optique, le faisceau fronto-occipital inférieur (IFOF ; cas dominants en langage) et le faisceau longitudinal moyen (MLF ; cas non dominants en langue). Suivez les étapes ci-dessous.
- Extrayez les points de terminaison corticaux de chaque faisceau de fibres et regroupez-les en retour sur investissement de graine et de terminaison.
- Créez des régions corticales d’exclusion et un retour sur investissement à l’aide de régions corticales non terminales.
- Effectuez une tractographie anatomiquement contrainte58 via l’algorithme probabiliste de suivi des fibres iFOD259 à l’aide de la segmentation hybride de surface et de volume dans MRtrix347 , en sélectionnant un maximum de 5 000 lignes de courant à partir de 300 millions de graines.
- Effectuez la tractographie à l’étape 1.8.3 deux fois pour chaque faisceau de fibres, en changeant le retour sur investissement de l’amorce et de la terminaison.
- Convertissez les faisceaux de fibres résultants en cartes probabilistes, seuillées à une valeur de 0,01 - utilisez-les comme critère d’exclusion supplémentaire pour supprimer les lignes de courant parasites.
- Examinez les faisceaux de fibres résultants (dilatés de 2 mm) et les masques anatomiques dans le logiciel de planification pour vous assurer qu’ils sont anatomiquement précis (cette étape est effectuée par deux neurochirurgiens épileptiques de notre unité).
- Enregistrez spatialement les masques anatomiques de matière grise et de substance blanche résultants sur l’image IRM de référence pondérée T1 à l’étape 1.1 et chargez-les sur le système de navigation peropératoire dans la salle d’opération d’IRM peropératoire (IRMi).
- Acquérir des images IRM volumétriques pondérées T1, T2 et T2-FLAIR immédiatement avant l’intervention chirurgicale (< 24 h) avec des repères cutanés sur le cuir chevelu du patient. Co-enregistrez ces images les unes par rapport aux autres, ainsi qu’à l’image de référence pondérée T1 et aux masques décrits ci-dessus, et illustrés à la figure 3.
- Enregistrez le patient sur le système de neuronavigation à l’aide d’un laser d’adaptation de surface et d’un pointeur intelligent.
- Vérifiez l’exactitude de l’enregistrement de l’image et du patient avec deux neurochirurgiens épileptiques avant le début du cas pour assurer l’exactitude.
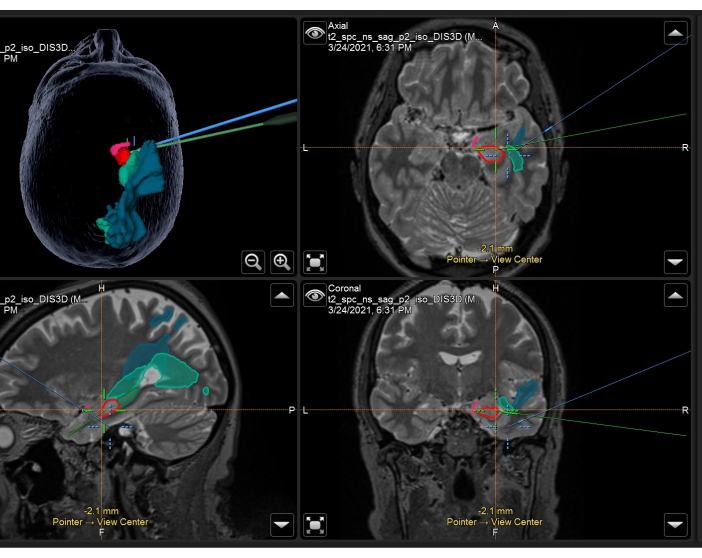
Figure 3 : Capture d’écran du système de neuronavigation démontrant l’IRM volumétrique pondérée en T2 avec des masques anatomiques superposés et des voies utilisées en peropératoire dans un ATLR droit. Panneau en haut à gauche : reconstruction en 3 dimensions de la tête du patient, démonstration de masques anatomiques. En haut à droite : axial, en bas à gauche : sagittal, et en bas à droite : vues coronales montrant également des masques anatomiques superposés sur l’IRM volumétrique pondérée en T2. Masques anatomiques affichés : partie temporale du cortex piriforme (rose), 55 % antérieur de l’hippocampe (rouge), postérieur 45 % de l’hippocampe (vert foncé, visible uniquement sur l’image sagittale), rayonnement optique (vert moyen), faisceau longitudinal moyen (bleu). Le réticule bleu est la position intégrée du foyer du microscope, et le réticule vert est la position du pointeur de neuronavigation utilisé dans le domaine chirurgical. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Technique chirurgicale
REMARQUE : Les étapes ci-dessous résument la pratique dans le centre des auteurs et n’ont pas pour but d’être une exposition de la seule approche chirurgicale d’un ATLR, mais plutôt une démonstration de la façon dont les auteurs ont normalisé l’approche de cette procédure pour fournir des résections fiables et reproductibles, y compris la résection du cortex temporal piriforme.
- Positionnement et approche
- Après les contrôles préopératoires standard et les mesures de sécurité, positionnez le patient en décubitus dorsal, élevez l’épaule ipsilatérale avec un rouleau et tournez la tête vers le côté controlatéral.
- Fléchissez la tête latéralement pour vous assurer que l’éminence malaire est le point le plus élevé du champ opératoire, et fixez-les (dispositif de fixation du crâne en 3 points - voir exemples, y compris ceux compatibles avec les salles peropératoires [IRMi] dans la table des matériaux).
REMARQUE : Le positionnement est crucial pour permettre un accès adéquat aux structures du lobe temporal mésial et postérieur, en particulier la flexion latérale, afin de garantir que l’éminence malaire est le point le plus élevé du champ opératoire. - Infiltrer l’anesthésique local dans les sites d’épingle et l’incision cutanée.
- Enregistrez l’espace patient dans le système de neuronavigation à l’aide d’une combinaison de repères cutanés et de suivi de surface (spécifique à la marque du système de neuronavigation utilisé). Confirmez l’exactitude de l’enregistrement par rapport aux repères osseux ou autres repères anatomiques palpables ou visibles.
- Marquez la racine des cheveux et la racine du zygoma (identifiée par palpation manuelle). Identifiez et marquez le tracé de la fissure de Sylvian à l’aide de la neuronavigation et de l’incision cutanée frontotemporale curviligne en forme de « point d’interrogation ».
- Retirez les poils le long de l’incision cutanée prévue à l’aide d’une tondeuse à cheveux électrique.
- Effectuez une incision frontotemporale de 1 cm en avant du tragus, en s’incurvant en forme de point d’interrogation, pour éviter de lésionner la branche frontotemporale du nerf facial. Identifier et préserver l’artère temporale superficielle si possible. Le positionnement et le marquage de l’incision cutanée sont illustrés à la figure 4.
- Couvrez et fixez les bords de la plaie à l’aide d’écouvillons mastoïdiens imbibés d’antimicrobiens et de pinces Raney.
- Inciser le muscle temporal et l’élever soit dans un lambeau myocutané, soit interfascial/sous-fascial (empêchant les lésions de la branche frontotemporale du nerf facial).
- Enveloppez le lambeau cutané dans une gaze imbibée d’une solution antimicrobienne et rétractez-le vers l’avant (en évitant d’utiliser des instruments de fixation métalliques si vous êtes dans les salles d’IRMi).
- Créez 2 trous de bavure dans le crâne à l’aide d’une perceuse perforatrice : le premier juste au-dessus de la racine du zygoma pour maximiser l’exposition inférieure, le second frontal inférieur pour faciliter la visualisation de la fissure de Sylvian.
- Effectuer une craniotomie frontotemporale standard 60,61,62, exposant le gyrus temporal supérieur et moyen à 1 cm au-dessus de la fissure de Sylv.
- Percez les marges antérieure et inférieure de la craniotomie pour permettre un accès facile au plancher de la fosse temporale moyenne ainsi qu’au pôle temporal antérieur. Si des cellules d’air mastoïdiennes sont rencontrées, scellez-les avec de la cire d’os et de la colle de fibrine à la fois lorsqu’elles sont rencontrées et à la fin de la procédure avant de fermer les couches superficielles à l’os.
REMARQUE : Il est important de s’assurer que la craniotomie permet d’accéder au plancher de la fosse crânienne moyenne, car ce sera l’approche de la corne temporale du ventricule latéral via le sillon collatéral. Il est également important de bien sceller toutes les cellules aériennes mastoïdiennes rencontrées pour prévenir une fuite postopératoire du LCR et les symptômes et infections potentielles qui en résultent. - Ouvrez la dure-mère en forme de U avec la base réfléchie vers l’avant et prolongée de manière étoilée. Attelez la dure-mère loin du champ opératoire avec des sutures (comme la soie 3-0).
- Libérez le LCR du plancher de la fosse crânienne moyenne et de la face antérieure de la fosse crânienne moyenne.
REMARQUE : L’étape de libération du LCR est importante pour laisser suffisamment d’espace de travail pour accéder chirurgicalement au plancher de la fosse crânienne moyenne et au sillon collatéral par le bas sans rétraction ni tension sur le lobe temporal basal.
- Ablation néocorticale latérale
- Coaguler la pie, du gyri temporal moyen et inférieur (MTG et ITG, respectivement) sur une ligne perpendiculaire à la base du crâne et en ligne avec la projection antérieure de la corne temporale du ventricule latéral (confirmée par le système de neuronavigation). Adapter l’étendue antéro-postérieure de cette ligne au cas par cas en fonction des signes préchirurgicaux d’implication néocorticale latérale dans l’apparition/propagation des crises.
REMARQUE : L’étendue antéro-postérieure de la résection néocorticale latérale doit tenir compte de la preuve préopératoire (ou de l’absence de preuve) de son implication dans la propagation de la crise, et cela est adapté à chaque patient. - Utiliser une approche transcorticale dans l’ITG pour exposer le plancher de la fosse crânienne moyenne et identifier le sillon collatéral, qui est latéral au gyrus parahippocampique et médial au gyrus fusiforme.
- Coaguler la pie du gyrus temporal supérieur (STG) antérieure à l’incision néocorticale latérale ci-dessus, parallèlement à la direction de la fissure de Sylv. Celle-ci est perpendiculaire à la ligne décrite à l’étape 2.16 et s’étend antérieurement au pôle temporal.
- Développer le plan entre STG et la fissure de Sylvian en utilisant des techniques de dissection sous-piale, protégeant les branches de l’artère cérébrale moyenne, et porter cette dissection vers la partie horizontale de la fissure de Sylvian jusqu’au niveau du sillon limite inférieur de l’insula.
REMARQUE : Des précautions doivent être prises pour maintenir l’intégrité de la pie, de la STG bordant la fissure de Sylvian lors de la dissection sous-piale à l’étape 2.2.4, car elle protège les branches de l’artère cérébrale moyenne dans la fissure, ainsi que d’autres structures telles que le nerf oculomoteur et l’artère communicante postérieure (étape 2.2.14) et le tractus optique (étape 2.3) plus tard dans l’opération. - Intégrez le microscope au système de neuronavigation.
- Confirmez l’exactitude des superpositions d’objets des masques anatomiques décrits dans la section 1 et visualisez-les sur le HUD du microscope.
- Inclinez la ligne de résection postérieure vers l’avant vers le haut pour minimiser la résection de STG, et étendez-la progressivement à travers le MTG et l’ITG, à travers le gyrus fusiforme jusqu’au sillon collatéral.
- Vérifiez la relation entre la marge de résection postérieure et le système de neuronavigation avec le masque de rayonnement optique (OR) visualisé.
- Visualisez l’extension antérieure maximale du masque de salle d’opération sur le microscope et assurez-vous qu’elle est postérieure à la marge de résection sur le HUD du microscope pour éviter tout dommage à la salle d’opération, ce qui entraînerait un déficit du champ visuel postopératoire, comme le montre la figure 5.
REMARQUE : L’étape 2.2.9 est une étape critique pour prévenir un déficit du champ visuel postopératoire dû à des dommages à l’anse de Meyer du rayonnement optique. S’il y a beaucoup de décalage cérébral et que le chirurgien souhaite minimiser davantage le risque d’endommagement du rayonnement optique, ou si les projections sur le HUD du microscope ne fonctionnent pas correctement, les auteurs suggèrent d’utiliser le pointeur de neuronavigation pour diriger l’approche vers l’extrémité la plus antérieure de la corne temporale du ventricule latéral, car cela minimise le risque de blessure au bloc opératoire. - Suivez le sillon collatéral vers le haut jusqu’à ce que la corne temporale soit rencontrée (confirmez-le sur le système de neuronavigation), comme le montre la figure 6. La paroi de la corne temporale peut être identifiée par un épendyme teinté de bleu.
REMARQUE : Chez les personnes chez qui la pathologie n’est pas la sclérose de l’hippocampe et la tête de l’hippocampe est volumineuse, le ventricule peut être difficile à trouver. Dans ces cas, une option de dépannage consiste à utiliser le pointeur de neuronavigation à la base de la fosse temporale médiale où il n’y a pas de décalage pour trouver où l’extrémité du ventricule est projetée. Il est normalement utile de rechercher cela sur un plan coronal. Si le ventricule est introuvable, nous vous suggérons de retirer d’abord le pôle, puis de trouver le ventricule avec l’aspirateur à ultrasons. - Divisez les leptoméninges temporales basales latéralement à l’exposition de la corne temporale.
- Ouvrez le ventricule vers l’avant pour exposer la tête de l’hippocampe (comme le montre la figure 6).
- Étendre la marge de résection postérieure pour joindre la déconnexion au ventricule et cela permet la déconnexion du bloc néocortical.
- Mobiliser le pôle temporal en suivant la ligne de dissection sur le bord du bord tentoriel. Veillez à ne pas effectuer la déconnexion sur le bord du tentorium pour éviter de blesser les structures mésiales, y compris le nerf oculomoteur et l’artère communicante postérieure.
REMARQUE : Pour réduire le risque d’endommager les structures de la citerne cruralis, suivez la forme du bord du tentorium sans passer par-dessus le bord de la tente. L’uncus restera en place et pourra être pris comme un spécimen séparé.
- Coaguler la pie, du gyri temporal moyen et inférieur (MTG et ITG, respectivement) sur une ligne perpendiculaire à la base du crâne et en ligne avec la projection antérieure de la corne temporale du ventricule latéral (confirmée par le système de neuronavigation). Adapter l’étendue antéro-postérieure de cette ligne au cas par cas en fonction des signes préchirurgicaux d’implication néocorticale latérale dans l’apparition/propagation des crises.
- Résection temporale mésiale, y compris le cortex temporal piriforme
- Dégagez le tissu de l’uncus avec dissection et utilisation de l’aspirateur à ultrasons jusqu’à ce que le nerf oculomoteur et l’artère communicante postérieure soient visibles. Arrêtez l’étendue de la résection postérieure lorsque le pes (l’extension la plus mésiale de la tête de l’hippocampe) est visualisé.
- Effectuez la résection de l’amygdale avec l’aspirateur à ultrasons, limité par la pointe du sillon endorhinal, et jusqu’à ce que le tractus optique soit visualisé, et mésialement par le plan pial des citernes basales.
REMARQUE : Prenez soin de préserver le tronc temporal et de ne pas pénétrer dans le lobe frontal lors de l’exécution de l’étape 2.3.2. Parfois, en raison d’un décalage cérébral, la neuronavigation peut surestimer l’étendue de la résection mésialement ; À cet égard, la résection peut se poursuivre en toute sécurité jusqu’à ce que le tractus optique soit visualisé à travers la PIA, ce qui représente la limite mésiale de la résection. Ceci est également décrit dans Usui et al.63Le bord dorsal de l’amygdale est généralement décrit comme approximé par une ligne imaginaire reliant le point choroïdien à la bifurcation de l’artère cérébrale moyenne proximale64. - Assurez-vous que la partie temporale du cortex piriforme est réséquée en enlevant tout tissu résiduel par dissection sous-piale, progressant vers le bas à partir du côté temporal de la fissure de Sylvian jusqu’à ce que la veine du sillon circulaire inférieur de l’insula soit visualisée. Il s’agit d’une marge de résection similaire à celle décrite par Usui et al. lors de la résection de lésions amygdaliennes-uncales63.
REMARQUE : Si l’uncus (à l’étape 2.3.1) ou le cortex piriforme sont difficiles à enlever (parfois, ils peuvent être très adhérents à la pie-mère), les auteurs suggèrent l’utilisation d’un dissecteur de Rhoton plutôt que d’un aspirateur à ultrasons pour minimiser les lésions à la pie-mère. - Confirmez la résection de la partie temporale du cortex piriforme à l’aide du masque anatomique décrit à l’étape 1.4 superposé sur le HUD du microscope, comme le montre la figure 7.
- Résection de l’hippocampe
- Placez des linaines (ou des cotonoïdes larges similaires) pour rétracter le plexus choroïde (et l’artère choroïdienne antérieure) mésialement afin de faciliter la visualisation de l’hippocampe fimbria.
- Déconnectez le fimbria hippocampi de son attache arachnoïdienne, exposant le sillon de l’hippocampe qui porte l’arcade vasculaire artérielle de la corne d’Ammon.
- Déconnecter l’hippocampe de sa queue (soit en limitant cette résection aux 55 % antérieurs de l’hippocampe dans les résections de l’hémisphère dominant du langage dans le but de minimiser les déficits de mémoire verbale décrits aupoint 16, soit en s’étendant aussi postérieurement que le niveau du tectum du mésencéphale dans les résections de l’hémisphère dominant non du langage).
- Déconnectez la tête de l’hippocampe du pes hippocampi. Coagulez l’arcade artérielle de l’hippocampe au besoin.
- Retirez l’hippocampe déconnecté en bloc.
- Effectuez une dissection sous-piale du gyrus parahippocampique et du subiculum, et assurez-vous de l’hémostase dans la cavité chirurgicale résultante. Retirez le pes hippocampi, visualisant et protégeant le tronc cérébral.
REMARQUE : Des précautions doivent être prises lors de l’exécution de l’étape 2.4.7, car il n’y a pas de limite piale protectrice entre le pes et le tronc cérébral à ce niveau.
- Imagerie peropératoire et fermeture
- Retirez tous les objets métalliques du champ opératoire, couvrez la plaie et effectuez une IRM peropératoire, comprenant généralement des séquences volumétriques T1, T2, FLAIR et DWI.
- Passez en revue l’imagerie peropératoire avec un neuroradiologue consultant et deux neurochirurgiens consultants en épilepsie, pour vous assurer que la quantité souhaitée de structures du lobe temporal mésial (y compris la partie temporale du cortex piriforme, ainsi que les quantités variables d’hippocampe comme indiqué ci-dessus à l’étape 2.36) a été réséquée avec succès. Examinez également l’imagerie DWI pour vous assurer qu’aucune zone d’ischémie n’a été causée pendant la procédure.
- Une fois ce qui précède confirmé, transférez le patient sur la table d’opération et confirmez l’hémostase dans la cavité chirurgicale à la normotension pour le patient.
- Fermez la plaie de manière standard, en remplaçant le lambeau osseux, en le fixant avec des plaques et des vis en 3 points, et une fermeture standard des couches musculaires, fasciales et cutanées avec des sutures, en laissant un drain chirurgical de la plaie en place pendant 24 heures.
REMARQUE : Les soins postopératoires se font dans le centre de l’auteur, généralement dans l’unité neurochirurgicale de haute dépendance pendant les 24 premières heures, suivis d’une descente dans un service de neurochirurgie spécialisée lorsque l’unité de haute dépendance le juge approprié. Les patients sont surveillés pour leurs observations neurologiques, ont du sang postopératoire, y compris de l’urée et des électrolytes, une formule sanguine complète et des différentiels, et sont généralement libérés environ 72 heures après l’opération. Ils sont ensuite suivis en ambulatoire dans 4 à 6 semaines, et à 3-4 mois et 1 an postopératoire au minimum avec imagerie d’intervalle.
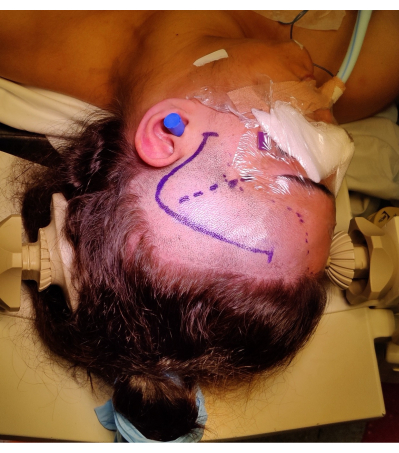
Figure 4 : Image du positionnement du patient pour un ATLR droit, montrant le marquage du « point d’interrogation » de l’incision cutanée frontotemporale droite, de la racine des cheveux et de la fissure de Sylvian. Le roulement de l’épaule gauche sous l’épaule gauche du patient n’est pas illustré pour permettre l’angle de positionnement de la tête sans exercer de pression excessive sur le cou du patient et sans entraver le retour veineux. Des images ont été capturées et incluses avec le consentement du patient. Veuillez cliquer ici pour voir une version agrandie de cette figure.
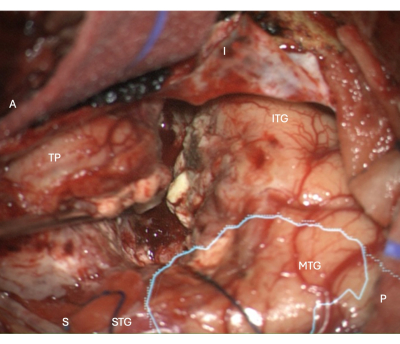
Figure 5 : Image peropératoire du microscope montrant la marge de résection néocorticale latérale dans un ATLR droit, avec le masque anatomique superposé du rayonnement optique (cyan) - montrant que la marge de résection est antérieure à la salle d’opération. Les étiquettes démontrent l’orientation de la vue opératoire : A = antérieur, P = postérieur, I = inférieur, S = supérieur, STG = gyrus temporal supérieur, MTG = gyrus temporal moyen, ITG = gyrus temporal inférieur, TP = pôle temporal. Veuillez cliquer ici pour voir une version agrandie de cette figure.
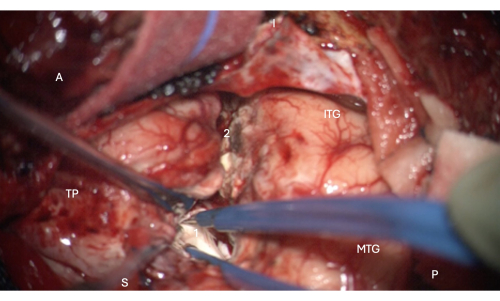
Figure 6 : Image peropératoire du microscope montrant l’entrée dans la partie antérieure de la corne temporale du ventricule latéral, montrant la tête de l’hippocampe à l’intérieur de celle-ci (blanc pâle, 1). Marquages : A = antérieur, P = postérieur, I = inférieur, S = supérieur, MTG = gyrus temporal moyen, ITG = gyrus temporal inférieur, 2 = marge de résection néocorticale latérale, suivant le sillon collatéral vers le haut à la profondeur pour trouver la corne temporale du ventricule latéral, TP = pôle temporal. Veuillez cliquer ici pour voir une version agrandie de cette figure.
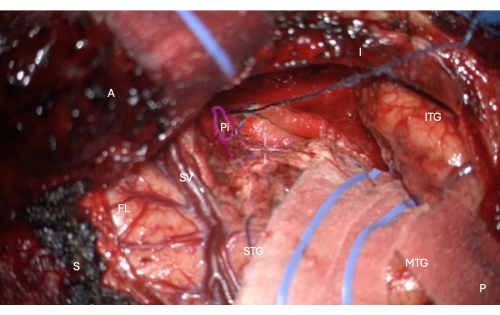
Figure 7 : Image peropératoire du microscope montrant la superposition HUD du masque anatomique de la partie temporale du cortex piriforme (contour rose, étiqueté Pi). Cette figure montre une résection complète - il n’y a pas de tissu cérébral restant, seulement la limite piale du sillon endorhinal mésiale à la résection, protégée dans cette image par la galette longitudinale sus-jacente dans l’image, juste au-dessus du réticule blanc central du HUD du microscope. Étiquettes : A = antérieur, P = postérieur, I = inférieur, S = supérieur, STG = gyrus temporal supérieur, MTG = gyrus temporal moyen, ITG = gyrus temporal inférieur, FL = lobe frontal, SV = veines sylviennes (recouvrant la fissure sylvienne), Pi = partie temporale du cortex piriforme. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Ce protocole et les techniques chirurgicales ont été appliqués dans le cadre d’une étude en cours, interrogeant les effets de la résection du cortex piriforme temporal et son impact sur l’absence de crise après ATLR pour DRmTLE. Le but de cette étude est de déterminer de manière prospective si l’absence de crises après l’ablation du cortex piriforme temporal améliore effectivement l’absence de crises dans la DRmTLE, comme le suggère le nombre croissant de données r...
Discussion
Ce protocole fournit une résection fiable et ciblée de la partie temporale du cortex piriforme - considérée comme une structure cruciale dans l’épileptogénèse et la propagation du réseau d’épilepsie du lobe temporal mésial 16,17,24,25,30.
Les composants de la technique ATLR standard qu...
Déclarations de divulgation
Les auteurs Debayan Dasgupta et John S. Duncan reçoivent un financement du programme d’innovation Wellcome Trust (218380/Z/19/Z). Lawrence P. Binding est soutenu par Epilepsy Research UK (numéro de subvention P1904). Les auteurs susmentionnés et Sjoerd B. Vos sont en partie financés par le National Institute for Health Research University College London Hospitals Biomedical Research Centre (NIHR BRC UCLH/UCL High Impact Initiative BW.mn.BRC10269). Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel. Nous confirmons que nous avons lu la position de la Revue sur les questions liées à la publication éthique et affirmons que ce rapport est conforme à ces directives.
Remerciements
Ce travail a été soutenu par Epilepsy Research UK (numéro de subvention P1904) et le Wellcome Trust Innovation Program (218380/Z/19/Z). Ce travail a été en partie financé par le National Institute for Health Research University College London Hospitals Biomedical Research Centre (NIHR BRC UCLH/UCL High Impact Initiative BW.mn.BRC10269). Les auteurs remercient les installations et l’assistance scientifique et technique du National Imaging Facility, une capacité de la National Collaborative Research Infrastructure Strategy (NCRIS), du Center for Microscopy, Characterization, and Analysis, de l’Université d’Australie-Occidentale. Cette recherche a été financée en tout ou en partie par le Wellcome Trust [WT 218380]. Aux fins de l’Open Access, l’auteur a appliqué une licence publique de droit d’auteur CC BY à toute version du manuscrit accepté par l’auteur découlant de cette soumission.
matériels
| Name | Company | Catalog Number | Comments |
| Brainlab Neuronavigation System | Brianlab, Westchester, IL | https://www.brainlab.com/surgery-products/overview-neurosurgery-products/cranial-navigation/ | Intraoperative neuronavigation system |
| EpiNav Planning Software | N/A | N/A | Clinical Decision Support Tool, for research use, developed in academia at King's College London and University College London |
| Mayfield clamp | Integra | A1059 | Any 3 pin head immobilisation device can be used |
| Microsurgical instruments | As per local neurosurgical unit | ||
| MRI Scanner | GE, Milwaukee, WI, USA | 3T MRI GE MR750 | Any alternative 3T MRI scanner can be used |
| MRTrix3 | N/A | Reference 47 in the manuscript | MRtrix3 provides a set of tools to perform various advanced diffusion MRI analyses, including constrained spherical deconvolution (CSD), probabilistic tractography, track-density imaging, and apparent fibre density |
| NORAS coil | NORAS MRI Products | https://www.noras.de/en/mri-produkte/lucy-or-head-holder-8-ch-coil/#infos | Any MRI-safe head immobilisation device can be used |
| Perforator drill | Stryker | https://neurosurgical.stryker.com/products/elite/ | Any alternative neurosurgical perforator drill driver and bit can be used |
| Sutures - Vicryl Plus 2/- | Ethicon | ETVCP684H | Any alternative suture that the surgeon prefers can be used |
| Titanium bone plates and screws | As per local neurosurgical unit | ||
| Ultrasonic Aspirator | Integra | https://products.integralife.com/cusa-tissue-ablation/category/cusa-tissue-ablation | Any alternative that the surgeon prefers can be used |
Références
- Marathe, K., et al. ablative and radiosurgical interventions for drug-resistant mesial temporal lobe epilepsy: A systematic review and meta-analysis of outcomes. Front Neurol. 12, 777845 (2021).
- Choi, H., et al. Epilepsy surgery for pharmacoresistant temporal lobe epilepsy: A decision analysis. JAMA. 300, 2497 (2008).
- Foldvary, N., et al. Seizure outcome after temporal lobectomy for temporal lobe epilepsy: A Kaplan-Meier survival analysis. Neurology. 54, 630-634 (2000).
- Spencer, S. S., et al. Predicting long-term seizure outcome after resective epilepsy surgery: The multicenter study. Neurology. 65, 912-918 (2005).
- Sperling, M. R., O'Connor, M. J., Saykin, A. J., Plummer, C. Temporal lobectomy for refractory epilepsy. JAMA. 276, 470-475 (1996).
- Wiebe, S. Effectiveness and safety of epilepsy surgery: What is the evidence. CNS Spectr. 9, 120-132 (2004).
- Gilliam, F., et al. Patient-oriented outcome assessment after temporal lobectomy for refractory epilepsy. Neurology. 53, 687-694 (1999).
- Markand, O. N., Salanova, V., Whelihan, E., Emsley, C. L. Health-related quality of life outcome in medically refractory epilepsy treated with anterior temporal lobectomy. Epilepsia. 41, 749-759 (2000).
- Jones, J. E., Berven, N. L., Ramirez, L., Woodard, A., Hermann, B. P. Long-term psychosocial outcomes of anterior temporal lobectomy. Epilepsia. 43, 896-903 (2002).
- Spencer, D. D., Spencer, S. S., Mattson, R. H., Williamson, P. D., Novelly, R. A. Access to the posterior medial temporal lobe structures in the surgical treatment of temporal lobe epilepsy. Neurosurgery. 15, 667-671 (1984).
- Vakharia, V. N., et al. Intraoperative overlay of optic radiation tractography during anteromesial temporal resection: A prospective validation study. J Neurosurg. 1, 1-10 (2021).
- Winston, G. P., et al. Preventing visual field deficits from neurosurgery. Neurology. 83, 604-611 (2014).
- Almairac, F., Herbet, G., Moritz-Gasser, S., de Champfleur, N. M., Duffau, H. The left inferior fronto-occipital fasciculus subserves language semantics: A multilevel lesion study. Brain Struct Funct. 220, 1983-1995 (2015).
- Binding, L. P., Dasgupta, D., Giampiccolo, D., Duncan, J. S., Vos, S. B. Structure and function of language networks in temporal lobe epilepsy. Epilepsia. 63, 1025-1040 (2022).
- Giampiccolo, D., Duffau, H. Controversy over the temporal cortical terminations of the left arcuate fasciculus: A reappraisal. Brain. 145, 1242-1256 (2022).
- Sone, D., et al. Optimal surgical extent for memory and seizure outcome in temporal lobe epilepsy. Ann Neurol. 91, 131-144 (2022).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690-700 (2019).
- Dasgupta, D., et al. Hippocampal resection in temporal lobe epilepsy: Do we need to resect the tail. Epilepsy Res. 190, 107086 (2023).
- Wu, C., et al. Effects of surgical targeting in laser interstitial thermal therapy for mesial temporal lobe epilepsy: A multicenter study of 234 patients. Epilepsia. 60, 1171-1183 (2019).
- Wiebe, S. A randomized, controlled trial of surgery for temporal-lobe epilepsy. N Engl J Med. 345 (5), 311-318 (2001).
- Brotis, A. G., et al. A meta-analysis on potential modifiers of LITT efficacy for mesial temporal lobe epilepsy: Seizure-freedom seems to fade with time. Clin Neurol Neurosurg. 205, 106644 (2021).
- Borger, V., et al. Resection of piriform cortex predicts seizure freedom in temporal lobe epilepsy. Ann Clin Transl Neurol. 8, 177-189 (2020).
- Borger, V., et al. Temporal lobe epilepsy surgery: Piriform cortex resection impacts seizure control in the long-term. Ann Clin Transl Neurol. 9 (8), 1206-1211 (2022).
- Hwang, B. Y., et al. Piriform cortex ablation volume is associated with seizure outcome in mesial temporal lobe epilepsy. Neurosurgery. 91, 414-421 (2022).
- Piper, R. J., et al. Extent of piriform cortex resection in children with temporal lobe epilepsy. Ann Clin Transl Neurol. 10, 1613-1622 (2023).
- Allison, A. C. The secondary olfactory areas in the human brain. J Anat. 88, 481-488 (1954).
- Ribas, G. C. The cerebral sulci and gyri. Neurosurg Focus. 28, E2 (2010).
- Young, J. C., Vaughan, D. N., Paolini, A. G., Jackson, G. D. Electrical stimulation of the piriform cortex for the treatment of epilepsy: A review of the supporting evidence. Epilepsy Behav. 88, 152-161 (2018).
- Mai, J. K., Majtanik, M., Paxinos, G. . Atlas of the Human Brain. , (2016).
- Vaughan, D. N., Jackson, G. D. The piriform cortex and human focal epilepsy. Front Neurol. 5, 259 (2014).
- Gale, K. Progression and generalization of seizure discharge: Anatomical and neurochemical substrates. Epilepsia. 29, S15-S34 (1988).
- Löscher, W., Ebert, U. The role of the piriform cortex in kindling. Prog Neurobiol. 50, 427-481 (1996).
- Piredda, S., Gale, K. A crucial epileptogenic site in the deep prepiriform cortex. Nature. 317, 623-625 (1985).
- McIntyre, D. C., Gilby, K. L. Mapping seizure pathways in the temporal lobe. Epilepsia. 49, 23-30 (2008).
- Fahoum, F., Lopes, R., Pittau, F., Dubeau, F., Gotman, J. Widespread epileptic networks in focal epilepsies: EEG-fMRI study. Epilepsia. 53, 1618-1627 (2012).
- Flanagan, D., Badawy, R. A. B., Jackson, G. D. EEG-fMRI in focal epilepsy: Local activation and regional networks. Clin Neurophysiol. 125, 21-31 (2014).
- Laufs, H., et al. Converging PET and fMRI evidence for a common area involved in human focal epilepsies. Neurology. 77, 904-910 (2011).
- Wieser, H. G., et al. Proposal for a new classification of outcome with respect to epileptic seizures following epilepsy surgery. Epilepsia. 42, 282-286 (2001).
- Dasgupta, D., Duncan, J. S. Optimizing epilepsy surgery. ISRCTN Registry. BMC. , (2020).
- Sparks, R., et al. Automated multiple trajectory planning algorithm for the placement of stereo-electroencephalography (SEEG) electrodes in epilepsy treatment. Int J CARS. 12, 123-136 (2017).
- Dasgupta, D. . Improving outcomes in anteromesial temporal lobe resections - A prospective surgical trial integrating multimodal imaging & novel hi-res tractography. , (2022).
- Winston, G. P., et al. Automated T2 relaxometry of the hippocampus for temporal lobe epilepsy. Epilepsia. 58, 1645-1652 (2017).
- Cardoso, M. J., et al. Geodesic information flows: Spatially-variant graphs and their application to segmentation and fusion. IEEE Trans Med Imaging. 34, 1976-1988 (2015).
- Winston, G. P., et al. Automated hippocampal segmentation in patients with epilepsy: Available free online. Epilepsia. 54, 2166-2173 (2013).
- Iqbal, S., et al. Volumetric analysis of the piriform cortex in temporal lobe epilepsy. Epilepsy Res. 185, 106971 (2022).
- Leon-Rojas, J. E., et al. Resection of the piriform cortex for temporal lobe epilepsy: a novel approach on imaging segmentation and surgical application. Br J Neurosurg. 1, 1-6 (2021).
- Tournier, J. -. D., et al. MRtrix3: A fast, flexible and open software framework for medical image processing and visualization. Neuroimage. 202, 116137 (2019).
- Cordero-Grande, L., Christiaens, D., Hutter, J., Price, A. N., Hajnal, J. V. Complex diffusion-weighted image estimation via matrix recovery under general noise models. Neuroimage. 200, 391-404 (2019).
- Vos, S. B., et al. The importance of correcting for signal drift in diffusion MRI. Magn Reson Med. 77, 285-299 (2017).
- Kellner, E., Dhital, B., Kiselev, V. G., Reisert, M. Gibbs-ringing artifact removal based on local subvoxel-shifts. Magn Reson Med. 76, 1574-1581 (2016).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. Neuroimage. 23, S208-S219 (2004).
- Andersson, J. L. R., Sotiropoulos, S. N. An integrated approach to correction for off-resonance effects and subject movement in diffusion MR imaging. Neuroimage. 125, 1063-1078 (2016).
- Leemans, A., Jones, D. K. The B-matrix must be rotated when correcting for subject motion in DTI data. Magn Reson Med. 61, 1336-1349 (2009).
- Tustison, N. J., et al. N4ITK: Improved N3 Bias Correction. IEEE Trans Med Imaging. 29, 1310-1320 (2010).
- Dhollander, T., Raffelt, D., Connelly, A. Unsupervised 3-tissue response function estimation from single-shell or multi-shell diffusion MR data without a co-registered T1 image. ISMRM Workshop on Breaking the Barriers of Diffusion MRI. 5, (2016).
- Binding, L. P., et al. Contribution of white matter fiber bundle damage to language change after surgery for temporal lobe epilepsy. Neurology. 100, e1621-e1633 (2023).
- Giampiccolo, D., et al. Thalamostriatal disconnection underpins long-term seizure freedom in frontal lobe epilepsy surgery. Brain. 146, 2377-2388 (2023).
- Smith, R. E., Tournier, J. -. D., Calamante, F., Connelly, A. Anatomically-constrained tractography: Improved diffusion MRI streamlines tractography through effective use of anatomical information. Neuroimage. 62, 1924-1938 (2012).
- Tournier, J. D., Calamante, F., Connelly, A. Improved probabilistic streamlines tractography by 2nd order integration over fibre orientation distributions. Proc 18th Annu Meet ISMRM. 1670, (2010).
- Yasargil, M. G., Fox, J. L. The microsurgical approach to intracranial aneurysms. Surg Neurol. 3, 7-14 (1975).
- Yasargil, M. G., et al. Microsurgical pterional approach to aneurysms of the basilar bifurcation. Surg. Neurol. 6, 83-91 (1976).
- Rao, D., Le, R. T., Fiester, P., Patel, J., Rahmathulla, G. An illustrative review of common modern craniotomies. J Clin Imaging Sci. 10, 81 (2020).
- Usui, N., Kondo, A., Nitta, N., Tottori, T., Inoue, Y. Surgical resection of amygdala and uncus. Neurol Med Chir (Tokyo). 58, 377-383 (2018).
- Vivas, A. C., Reintjes, S., Shimony, N., Vale, F. L. Surgery of the amygdala and uncus: A case series of glioneuronal tumors. Acta Neurochir. (Wien). 162, 795-801 (2020).
- Al-Otaibi, F., Baeesa, S. S., Parrent, A. G., Girvin, J. P., Steven, D. Surgical techniques for the treatment of temporal lobe epilepsy. Epilepsy Res Treat. 2012, 1-13 (2012).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon