このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
前哀扈側頭葉切除術における転帰の改善 - 側頭梨状皮質の切除のデモンストレーション
要約
ここでは、術前側頭葉切除術における術中脳神経外科指導へのアプローチを示し、特にトラクトグラフィーと解剖学的マスクの使用を強調します 梨状皮質の側頭部分の安全な切除を支援するためのマスク - 薬剤耐性近心側頭葉てんかんの重要な外科的標的としてますます見なされている領域。
要約
前弯性側頭葉切除術 (ATLR) は、薬剤耐性近心側頭葉てんかん (DRmTLE) の有用な治療オプションです。梨状皮質がDRmTLEの発作の発生と伝播に重要な役割を果たしていること、および梨状皮質の側頭部分の切除が発作の自由化率の有意な改善と関連していることを示唆する証拠が増えています。
ここでは、高解像度の術前確率的トラクトグラフィー アルゴリズムと、目的の構造の融合解剖学的マスクを使用して、ATLR の梨状皮質の側頭部分の切除を、術中のニューロナビゲーションと顕微鏡ヘッドアップ ディスプレイ (HUD) に示します。
DRmTLEの包括的な術前評価と調査を受けているすべての患者は、手順の術中ビデオを録画するための情報に基づいた書面による同意を提供しました。患者は、大規模なてんかん手術センターのてんかん専門医、てんかん脳神経外科医、神経心理学者、神経精神科医、および電気生理学者からなる学際的な専門家チームによって特定されました。術前のイメージングパイプラインには、重要な構造の描写が含まれていました。これには、側頭梨状皮質、およびリスクのある必須路(視放射線や下前頭後頭束など)の高解像度確率トラクトグラフィーが含まれていました。これらは、術前の体積ニューロナビゲーション スキャンに同時登録され、術中ニューロナビゲーション システムにアップロードされました。
ここで紹介するのは、梨状皮質の側頭部分の切除を含む、ATLRの段階的な手順です。このプロトコルは、高度な構造および拡散MRイメージングと術中視覚補助を組み合わせて、重要な灰白質構造と白質路の解剖学的マスクを手術室の手術ワークフローに統合します。
概要
前弯性側頭葉切除術 (ATLR) は、薬剤耐性近心側頭葉てんかん (DRmTLE) 1,2 の最も効果的な治療法であり、発作の解放率は 50% から 70% で、罹患率は比較的低い 3,4,5。この手順は、生活の質6,7,8、就職率5、および心理社会的幸福9を改善することも示されています。
Spencerらによって記述された標準的なATLR10は、側頭極、海馬鉤、扁桃体、海馬、海馬傍回、および紡錘状回の切除を含む。視覚(視放射線、特にマイヤーループ11,12)および言語(例えば、下前頭後頭束13および弓状束14,15)に関与する重要な白質経路は、側脳室の側頭角にアクセスするときに損傷するリスクがあります。次のプロトコルでは、高解像度の術前確率的トラクトグラフィーと、目的の構造の融合解剖学的マスクを使用して、これらの白質路を回避するアプローチを概説しています 術中ニューロナビゲーションと顕微鏡ヘッドアップディスプレイ(HUD)。
この分野の伝統的な理解は、最大の海馬切除が術後の発作の自由率を最大化するために有益であるということです。しかし、ATLR後の症例に関する最近のボクセルワイズ解析では、ATLRにおける梨状皮質の側頭部分の切除が発作の自由の可能性を大幅に増加させることが示されています。彼らはまた、後部海馬切除と発作の自由との間に関連性がないことを示しました16,17。したがって、言語優位の半球ATLRでは、海馬切除を海馬の前方55%に限定することにより、記憶機能を保持するためにスペンサーの技術を更新することが提案されています16,18。
新しい低侵襲療法、特にレーザー間質性温熱療法(LITT)の使用への関心が高まっている一方で、外科的切除は依然として薬剤耐性焦点てんかんの標準治療であり1、LITTの有効性は、ATLR(60%-70%)と比較して、エンゲル1発作の結果に占める割合が低いことが示されています(58%-59%)1,19、4,5,20、そして、まださらなる調査が必要な領域である21。
梨状皮質 (図 1) が、成人16、17、22、23、24 および近心側頭葉てんかんの子供25 の発作の伝播および/またはてんかん発生の重要な領域であるという仮説を支持する証拠が増えています。梨状皮質は、側頭幹26,27の近心嗅内溝の周りに覆われている3層のアロコルテックス(海馬皮質の配置に類似)のリボンであり、したがって側頭葉と前頭葉の合流点を形成します。したがって、それは、文献22,25,28,29,30に詳細に説明されている前頭部と時間部からなると容易に考えることができます。
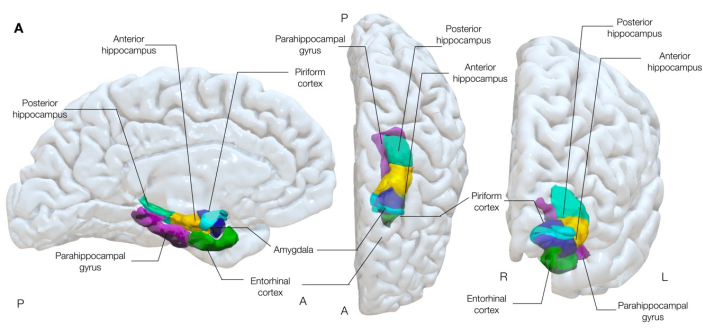
図1:脳の近心時間構造の半透明3次元レンダリング。 この図は、梨状皮質 (シアン) と周囲の近心側頭葉の解剖学的構造との解剖学的関連を示しています。左内側、中央上、右前方のビュー。 この図の拡大版を表示するには、ここをクリックしてください。
梨状皮質は扁桃体に対して超近心的であり、てんかん原性分泌物31-33を広めるネットワークの一般的な結節であると動物実験で長い間関与されてきました。また、電気刺激後に発作を引き起こすのは、扁桃体や海馬を含む隣接する近心構造よりも容易に起こります34.その位置は、嗅内皮質、辺縁皮質、眼窩前頭皮質、島皮質、視床、嗅球、扁桃体、海馬に広く接続されており、限局性てんかんにおけるてんかん原性分泌物の主要な伝播経路としての役割にも役立ちます30。
EEG-fMRIおよび陽電子放出断層撮影法(PET)研究は、DRmTLEにおける梨状皮質の重要な役割をさらに支持し、発作間欠性活性化を示し、梨状皮質におけるγ-アミノ酪酸A型(GABAA)受容体結合の減少は発作活性の増加と関連している35,36,37。
DRmTLEにおける最近の2つの重要な画像研究は、術後発作の自由が梨状皮質のより大きな切除と関連していることを示しています。Galovicらは、大規模なレトロスペクティブコホートで、梨状皮質の少なくとも半分を切除すると、発作がなくなる確率が16倍向上したことを示しました(95%CI、5-47; p < 0.001)17.また、他の近心側頭構造の切除容積は発作の自由と関連していないことが示され、この発見は、左TLEの梨状皮質切除のみが発作の自由と関連していることを示したSoneらによって行われたボクセルワイズ分析によって再現され、支持されました16 (図2)。
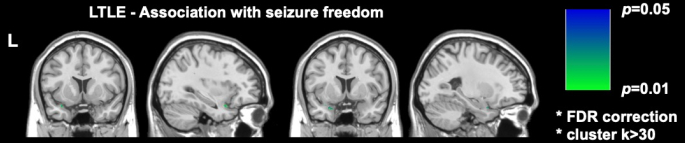
図2:左TLEにおける術後発作の自由性とのボクセルごとの関連。 発作の自由と有意に相関する唯一の領域は、梨状皮質の側頭部分、 p = 0.01 (冠状および矢状 T1 強調 MRI スライスでは緑色) です。Sone et al.16 から許可を得て引用。 この図の拡大版を表示するには、ここをクリックしてください。
また、大規模なレトロスペクティブ・コホートにおいて、切除された側頭梨状皮質の割合のみが、1年3 時と長期の追跡期間(平均3.75年)の両方で発作の自由度の改善と関連していることを実証した23。彼らはさらに、海馬と扁桃体の切除された体積が発作の自由を予測しなかったことを裏付けました。
mTLEにおける梨状皮質が異常なてんかん誘発性ネットワークから切り離されることの重要性は、LITTでも実証されており、Hwangらは、6カ月の追跡調査で、梨状皮質アブレーションの割合がILAEクラス1の転帰と関連していたことを示しました38 (OR 1.051、95%CI 1.001-1.117、 p = 0.045)が、これは1年目には有意ではなかった傾向でした5.これは、LITTに関する新たなデータ、つまり、発作の結果に肯定的ではあるが、永続的ではない可能性のある改善があり、その結果、LITTは「第一段階」の手順として一般的に使用され、LITTによって発作が解消されない人々に切除手術が提供されるようになったことを裏付けているようです。
したがって、梨状皮質の側頭部分の切除が、薬剤耐性近心側頭葉てんかんの発作の自由を達成するための主要な標的であるという強力な証拠があります。しかし、Galovic et al. のレトロスペクティブ コホートが示したように、この嗅内皮質のリボンは、ATLR を実行するときに外科的に標的とするのが難しい場所にあるため、直接標的にしないと、常にうまく除去できるとは限りません。この研究では、進行中の前向き手術研究の一環として、梨状皮質の側頭部分を安全に標的にして切除する方法を示し、術後の発作自由率の改善への影響を評価します39。
次のプロトコルの焦点は、画像の取得と処理、外科的アプローチ、およびATLRの梨状皮質の側頭部分の切除を確実にする方法の技術的側面にあり、高解像度の術前確率的トラクトグラフィーと目的の構造の融合解剖学的マスクを術中のニューロナビゲーションと顕微鏡ヘッドアップディスプレイ(HUD)に統合します。このプロトコルはまた、外科的レビューおよび計画のためのマルチモーダルイメージングの3次元表示および統合を可能にする特定の計画ソフトウェアプラットフォーム40、および手術用顕微鏡との統合を可能にするニューロナビゲーションシステムを使用する(詳細は 材料の表に詳述されている)。
プロトコル
これらの方法とプロトコルは、2020 年 9 月 10 日に Health Research Authority によって承認された進行中の前向き外科試験の一部です、研究倫理委員会 (REC) ロンドン参照: 20/LO/0966。このプロトコルは前向きに登録されました:ISRCTN72646265、2020年9月25日に、オンラインで利用可能であり39、全国会議41で発表されました。
次のプロトコルは、18 歳から 70 歳の患者 (当院の専門の成人てんかん手術センターでこの適応症のために手術を受けた患者の年齢層) で DRmTLE の ATLR を受けるすべての患者に適用され、すべて同じ外科医 (AWM、AM) によって手術されます。すべての参加者は、研究に含める前にインフォームドコンセントを提供しました。すべての参加者は、脳神経外科医、てんかん神経科医、神経心理学者、精神科医、神経放射線科医、および専門のてんかん治療サービスの他のメンバーで構成される著者の総合てんかん手術センターの専門外科てんかん学際チームによって指示された徹底的な術前評価と調査を受けました。手術前に、全員が以下のプロトコルに概説されている最新の容積測定T1、T2、およびFLAIR MRIを受け、標準的な術前血液と神経麻酔チームによるレビューを受け、全身麻酔下で安全に手術に進むことができました。この研究で使用された試薬と機器の商業的な詳細は、 資料表に記載されています。
1. 画像取得・処理
注:高解像度の手術前、3か月、および1年間の術後磁気共鳴画像法(MRI)スキャンは、当センターでてんかん手術を受けている人々に定期的に取得されています。MRIデータは、一貫性を保つために、2020年3月から2024年3月にかけて同じMRIスキャナーで取得されました。標準化された画像取得と多くの処理コンポーネントは、以前に文献で説明されており、以下に要約するプロトコルで適切に参照されています。
- 次の MRI シーケンスを取得します。
- 標準的な 3D アイソメトリック (1 mm) T1 強調シーケンスと反転回復高速スポイルド グラジエント リコール (IR-FSPGR) エコー [エコー時間 (TE) 3.1 ms、繰り返し時間 (TR) = 7.4 ms、反転時間 = 400 ms、視野 (FOV) = 224 × 256 × 256 mm、マトリックス = 224 × 256 × 256、ボクセル サイズ = 1.00 × 1.00 × 1.00 mm = 1.00 mm3、並列イメージング加速係数 = 2] および
- T2 リラクソメトリー42 (TE = 30/119 ms、TR = 7600 ms、FOV = 220 × 220 mm、マトリックス = 512 × 512、スライス厚さ = 4 mm、ボクセル サイズ = 0.43 × 0.43 × 4.00 mm = 0.74 mm3、SENSE factor = 2) に使用されるコロナル デュアルエコー高速回復高速スピン エコー プロトン密度/T2 強調シーケンス)。
- 上記の T1 で重み付けされたシーケンスを測地線情報フロー (GIF v3) アルゴリズムへの入力として使用し、NiftyWeb43 を使用して脳を 162 の解剖学的領域に分割します。
- GIF パーセルレーション (海馬傍回、紡錘状回、海馬プロファイリング情報の作成、Hipposeg44 を使用して海馬を前方 55% と後方 45% にセグメント化) を使用して、関心のある構造の解剖学的マスクを作成し、これらを患者の術前体積イメージング (ステップ 1.1 など) の計画ソフトウェアにオーバーレイします。
- 自動化された梨状皮質のセグメンテーションを実行し、ラボ 17,45,46 の以前の研究で説明したボリューム測定技術から、梨状皮質を前頭と側頭のコンポーネントに分割します。生成されたら、これらのマスクを患者の術前画像に重ね合わせます。
- 次の拡散MRI画像を取得します。
- 標準分解能のマルチシェル取得(2 mm等方性分解能、b値0、300、700、2500 s / mm2での11、8、32、および64の勾配方向)および;
- 高分解能マルチシェル取得(1.6 mm等方性分解能、101方向、14 b0、b値:300、700、2500 s/mm2)。
- MRtrix3 (https://mrtrix.org)47を使用して取得した拡散データを次のように補正します。
- MRtrix348 で "dwidenoise" を使用したノイズ。
- 信号ドリフト49.
- MRtrix350 で "mrdegibs" を使用したギブスリンギング。
- FSL TOPUPアルゴリズムによる逆位相符号化勾配を使用した歪み(https://fsl.fmrib.ox.ac.uk/fsl51)。
- FSLの渦アルゴリズム(https://fsl.fmrib.ox.ac.uk/fsl)52を使用して渦電流と移動アーチファクト、bベクトル53を回転させる。
- ANTsアルゴリズムを使用したバイアスフィールド(https://mrtrix.org 47,54)。
- マルチシェル、マルチティッシュの制約付き球状デコンボリューション(CSD)55 を使用して、白質と灰白質、および脳脊髄液(CSF)の応答関数を推定します。
- 解剖学的にターゲットを絞った自動トラクトグラフィーを実行して、視神経放射、下前頭後頭束(IFOF;言語優性の場合)、および中縦長束(MLF;言語非優性の場合)の線維束を再構築します12,56,57。以下の手順に従ってください。
- 各繊維束の皮質終末点を抽出し、それらをシードROIと終結ROIにグループ化します。
- 非終結皮質領域を使用して、除外皮質領域とROIを作成します。
- MRtrix347のハイブリッド表面および体積セグメンテーションを使用して、確率的繊維追跡アルゴリズムiFOD259を介して解剖学的に制約されたトラクトグラフィー58を実行し、3億の種子から最大5,000の流線を選択する。
- ステップ 1.8.3 のトラクトグラフィをファイバー バンドルごとに 2 回実行し、シード ROI とターミネーション ROI を切り替えます。
- 結果として得られるファイバーバンドルを、0.01 の値でしきい値が設定された確率マップに変換します - これらを追加の除外基準として使用して、偽のストリームラインを削除します。
- 作成された繊維束(2 mm拡張)と解剖学的マスクをプランニングソフトウェアで確認し、解剖学的に正確であることを確認します(この手順は、ユニット内の2人のてんかん神経外科医によって実行されます)。
- 得られた解剖学的灰白質と白質トラクトマスクをステップ1.1の参照T1強調MR画像に空間的に登録し、術中MRI(iMRI)手術室の術中ナビゲーションシステムにロードします。
- 手術の直前 (< 24 時間) に、患者の頭皮に皮膚基準を設定した T1、T2、および T2-FLAIR 加重体積 MRI 画像を取得します。これらの画像を相互に共レジストレーションし、上記のT1重み付け参照画像とマスクをコレジストレーションし、 図3に示します。
- ニューロナビゲーションシステムに患者を「登録」するには、表面マッチングレーザーとスマートポインターを使用します。
- 症例を開始する前に、画像の同時登録と患者と 2 人のてんかん神経外科医の精度を確認して、精度を確保します。
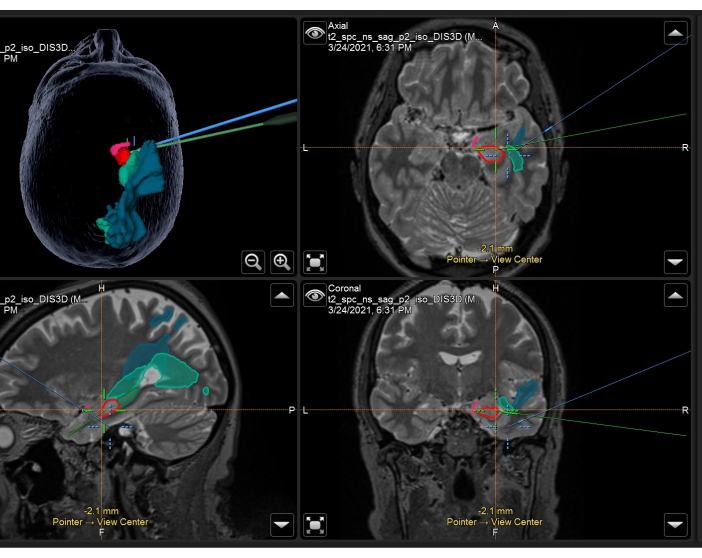
図3:右ATLRで術中に使用される解剖学的マスクとトラクトを重ね合わせた容積T2強調MRIを示すニューロナビゲーションシステムのスクリーンショット。 左上のパネル:解剖学的マスクを実演する患者の頭部の3次元再構成。右上:軸方向、左下:矢状、右下:T2強調体積MRIスキャンで解剖学的マスクを重ねて示した冠状図。表示される解剖学的マスク:梨状皮質の側頭部分(ピンク)、海馬の前部55%(赤)、海馬の後部45%(濃い緑、矢状画像でのみ見られる)、視放射線(中緑)、中央縦束(青)。青い十字線は顕微鏡の焦点の統合位置であり、緑の十字線は手術野内で使用されるニューロナビゲーションポインターの位置です。 この図の拡大版を表示するには、ここをクリックしてください。
2.手術手技
注:以下の手順は、著者のセンターでの実践を要約したものであり、ATLRへの唯一の外科的アプローチの説明を意図したものではなく、著者がこの手順へのアプローチをどのように標準化したかを示すことを目的としています。
- ポジショニングとアプローチ
- 標準的な術前チェックと安全対策に従って、患者を仰臥位に置き、ロールで同側の肩を持ち上げ、頭を反対側に向けます。
- 頭を横に曲げて、頬骨の隆起が術野の最高点になるようにし、ピンに固定します(3点頭蓋骨固定装置- 材料表の術中[iMRI]シアターと互換性のあるものを含む例を参照してください)。
注:ポジショニングは、近心および後方の側頭葉構造、特に横方向の屈曲への適切なアクセスを可能にするために重要であり、頬骨の隆起が手術野の最高点であることを保証します。 - 局所麻酔薬をピンサイトと皮膚切開部に浸潤させます。
- スキンフィデューシャルとサーフェストラッキング(利用するニューロナビゲーションシステムのブランドに固有)の組み合わせを使用して、患者スペースをニューロナビゲーションシステムに登録します。触知可能または目に見える骨/その他の解剖学的ランドマークに対する登録精度を確認します。
- 頬骨の生え際と根元に印を付けます(手動触診で識別されます)。ニューロナビゲーションを使用してシルビウス亀裂の経過を特定し、マークし、計画された曲線の前頭側頭「疑問符」皮膚切開を行います。
- 電動バリカンを使用して、計画された皮膚切開部に沿って髪を取り除きます。
- 顔面神経の前頭側頭枝の損傷を防ぐために、耳珠の前方 1 cm 前からクエスチョンマークのように湾曲する前頭側頭切開を行います。可能であれば、表在性側頭動脈を特定して保存します。皮膚切開の位置とマーキングを 図4に示します。
- 抗菌剤を染み込ませた乳様突起スワブとRaneyクリップで傷口を覆って固定します。
- 側頭筋を切開し、筋皮弁または筋膜間/筋膜下皮弁のいずれかでそれを持ち上げます(顔面神経の前頭側頭枝の損傷を防ぎます)。
- 抗菌剤溶液を染み込ませたガーゼで皮膚弁を包み、前方に引っ込めます(iMRIシアターでは金属製の固定器具の使用は避けてください)。
- 穿孔器ドリルで頭蓋骨に2つのバリ穴を作ります:1つ目は頬骨の根元のすぐ上に下側の露出を最大化し、2つ目はシルビウス亀裂の視覚化を容易にするための下前頭部です。
- 標準的な前頭側頭開頭術 60,61,62 を実行し、シルビウス亀裂の 1 cm 上に上側頭回と中側頭回を露出させます。
- 開頭術の前方縁と下縁をドリルで取り除き、中側頭窩床と前方の側頭極に簡単にアクセスできるようにします。乳様突起空気細胞に遭遇した場合は、骨の表面層を閉じる前に、骨ワックスとフィブリン接着剤でこれらを密封します。
注:開頭術が中頭蓋窩の床にアクセスできるようにすることが重要です。これは、側副溝を介した側頭脳室の側頭角へのアプローチとなるためです。また、術後のCSF漏れやその結果生じる症状、潜在的な感染を防ぐために、遭遇した乳様突起空気細胞を完全に密閉することも重要です。 - 硬膜をU字型に開き、基部を前方に反射させて星状に伸ばします。縫合糸(3-0シルクなど)で硬膜を手術野から離します。
- 中頭蓋窩床および中頭蓋窩の前面からCSFを放出します。
注: CSF リリースステップは、基底側頭葉に後退や負担をかけることなく、下から中頭蓋窩床と側副溝に外科的にアクセスするための十分な作業スペースを確保するために重要です。
- 外側新皮質除去
- 中側頭回と下側頭回(それぞれMTGとITG)の軟膜を、頭蓋底に垂直で、側脳室の側頭角の前方突起に沿って凝固させます(ニューロナビゲーションシステムで確認)。この線の前後の範囲は、発作の発症/伝播における外側新皮質の関与の術前の証拠に応じて、ケースバイケースで調整します。
注: 外側新皮質切除術の前後範囲は、発作伝播への関与の術前証拠 (またはその欠如) を考慮に入れるべきであり、これは個々の患者に合わせて調整されます。 - ITG で経皮的アプローチを採用して、中頭蓋窩床を露出させ、海馬傍回の外側と紡錘状回の内側にある側副溝を特定します。
- 上側頭回(STG)の軟膜を、シルビアン亀裂の方向に平行に、上記の外側新皮質切開の前方で凝固させます。これは、ステップ 2.16 で説明した線に垂直で、側頭極に対して前方に延びています。
- 中大脳動脈の枝を保護し、椎下解剖技術を使用して STG 裂とシルビウス裂の間の平面を発達させ、この解剖をシルビアン裂の水平部分まで下降させ、島皮質の下限溝のレベルまで運びます。
注:ステップ2.2.4で椎下解剖を行う際には、シルビアン裂に接するSTGのピアの完全性を維持するように注意する必要があります。これは、亀裂の中大脳動脈の枝を保護するだけでなく、眼球運動神経や後部連通動脈(ステップ2.2.14)、視路(ステップ2.3)などの他の構造も保護します手術の後半で。 - 顕微鏡をニューロナビゲーションシステムと統合します。
- セクション1で説明した解剖学的マスクのオブジェクトオーバーレイの精度を確認し、これらを顕微鏡のHUDで視覚化します。
- STGの切除を最小限に抑えるために、後部切除線を前方に上方に傾け、MTGとITGを介して紡錘状回を通って側副溝まで徐々に延長します。
- 視放射線 (OR) マスクを視覚化した状態で、ニューロナビゲーション システムに対する後部切除断端との関係を確認します。
- 図 5 に示すように、顕微鏡で OR マスクの最大前方範囲を視覚化し、顕微鏡の HUD で切除縁の後方にあることを確認して、手術後に視野欠損を引き起こす OR に損傷を与えないようにします。
注: ステップ 2.2.9 は、視放射線のマイヤーループの損傷による術後の視野欠損を防ぐための重要なステップです。脳のずれが大きく、外科医が視神経放射線の損傷リスクをさらに最小限に抑えたい場合、または顕微鏡のHUDの投影が正しく機能していない場合は、ニューロナビゲーションポインターを使用して、側脳室の側頭角の最前端にアプローチを向けることを提案しています。 これにより、ORの怪我のリスクが最小限に抑えられます。 - 側副溝を上方に追って、側頭角に遭遇するまで待ちます(これをニューロナビゲーションシステムで確認します)(図 6に示すように)。側頭角の壁は、青みがかった上衣で識別できます。
注:病理が海馬硬化症ではなく、海馬の頭部がかさばる個人では、心室を見つけるのが難しい場合があります。このような場合、トラブルシューティングの選択肢は、心室の先端が突出している場所を見つけるためにシフトがない内側側頭窩の基部にあるニューロナビゲーションポインターを使用することです。通常、これを冠状面で探すと便利です。心室が見つからない場合は、最初にポールを取り外してから、超音波吸引器で心室を見つけることをお勧めします。 - 基底側頭軟髄膜を側頭角露出の外側に分割します。
- 心室を前方に開いて、海馬の頭を露出させます( 図6に示すように)。
- 後部切除縁を伸ばして、切断を心室に結合すると、新皮質ブロックの切断が可能になります。
- テントリアルエッジの縁にある解剖線に沿って側頭極を動員します。眼球運動神経や後部連絡動脈などの近心構造への損傷を避けるために、テントの縁を越えて切断を行わないように注意してください。
注: 槽の 構造物を損傷するリスクを減らすために、テントの端を越えずにテントの端の形状に従ってください。海馬鉤は所定の位置に留まり、別の標本として採取できます。
- 中側頭回と下側頭回(それぞれMTGとITG)の軟膜を、頭蓋底に垂直で、側脳室の側頭角の前方突起に沿って凝固させます(ニューロナビゲーションシステムで確認)。この線の前後の範囲は、発作の発症/伝播における外側新皮質の関与の術前の証拠に応じて、ケースバイケースで調整します。
- 側頭梨状皮質を含む近心側頭切除術
- 眼球運動神経と後部連通動脈が見えるまで、超音波吸引器を解剖して使用することで、海馬鉤の組織をきれいにします。後部切除の範囲を停止します pes (海馬頭部の最も近心的な範囲) が視覚化されます。
- 超音波吸引器を使用して扁桃体の切除を行い、鼻腔内溝の孔によって、視路が視覚化されるまで、そして基底槽の胆孔面によって中心的に制限されます。
注:手順2.3.2を実行するときは、側頭ステムを保持し、前頭葉に入らないように注意してください。時々、脳のシフトのために、ニューロナビゲーションは中間的に切除の程度を過大評価することがあります。この点で、視路が視認路を通して視覚化されるまで、切除は安全に継続でき、これは切除の近心境界を表します。これは、Usui et al.63でも説明されており、扁桃体の背側縁は、一般に、脈絡膜点と近位中大脳動脈分岐部64を結ぶ架空の線によって近似されていると説明されています。 - 梨状皮質の側頭部分が切除されるようにします シルビアン亀裂の側頭側から島島の下円形溝の静脈が視覚化されるまで、下進行する椎下解剖 によって 残留組織を除去します。これは、扁桃体-下顎病変63を切除する際にUsuiらによって記載されたものと同様の切除断端である。
注:海馬鉤(ステップ2.3.1)または梨状皮質が除去が難しい場合(場合によっては、軟膜に非常に付着する可能性があります)、著者らは、超音波吸引器ではなくロートンディセクターを使用して、軟膜への損傷を最小限に抑えることを提案しています。 - 図 7 に示すように、ステップ 1.4 で説明した解剖学的マスクを顕微鏡の HUD に重ねて使用して、梨状皮質の側頭部分の切除を確認します。
- 海馬切除術
- 糸状突起(および前脈絡膜動脈)を近心的に引っ込めるためにlinteens(または同様の広い綿状体)を配置して、海馬の線維の視覚化を容易にします。
- くも膜付着部から糸状海馬を切り離し、アンモンの角動脈血管アーケードを運ぶ海馬溝を露出させます。
- 海馬をその尾から切り離します(16で概説されているように、言語記憶の欠損を最小限に抑えるために、言語優性半球切除術でこの切除を海馬の前方55%に限定するか、非言語優性半球切除術で中脳の蓋のレベルと同じくらい後方に拡張します)。
- 海馬の頭を 海馬から切り離します。必要に応じて海馬動脈アーケードを凝固させます。.
- 切断された海馬 を一括して取り外します。
- 海馬傍回と海馬下回の解剖を行い、結果として生じる手術腔の止血を確保します。 海馬を取り除き、脳幹を視覚化して保護します。
注:手順2.4.7を実行するときは、 このレベルではPES と脳幹の間に保護的なピアル境界がないため、注意が必要です。
- 術中イメージングとクロージャー
- 術野からすべての金属片を取り除き、傷口を覆い、通常は容積測定T1、T2、FLAIR、およびDWIシーケンスを含む術中MRIスキャンを実行します。
- コンサルタント神経放射線科医と 2 人のてんかんコンサルタント脳神経外科医で術中イメージングをレビューし、必要な量の近心側頭葉構造 (梨状皮質の側頭部分、およびステップ 2.36 で上記で概説した海馬の変動量を含む) が正常に切除されたことを確認します。また、DWIイメージングを見直して、処置中に虚血の領域が引き起こされていないことを確認します。
- 上記が確認されたら、患者を手術台に戻し、患者の正常張力での手術腔内の止血を確認します。
- 標準的な方法で創傷を閉じ、骨フラップを交換し、これをプレートとネジで3点に固定し、筋肉、筋膜、および皮膚層を縫合糸で標準的に閉鎖し、外科的創傷ドレーンを24時間所定の位置に残します。
注:術後ケアは著者のセンターで行われ、通常は最初の24時間は脳神経外科の高依存病棟で行われ、その後、高依存病棟が適切であると感じた場合は脳神経外科専門病棟にステップダウンします。患者は神経学的観察のために監視され、尿素と電解質を含む術後血液、全血球数と差があり、通常は術後約 72 時間で退院します。その後、4〜6週間で外来患者としてフォローアップされ、術後3〜4か月と1年で最低でもインターバルイメージングでフォローアップされます。
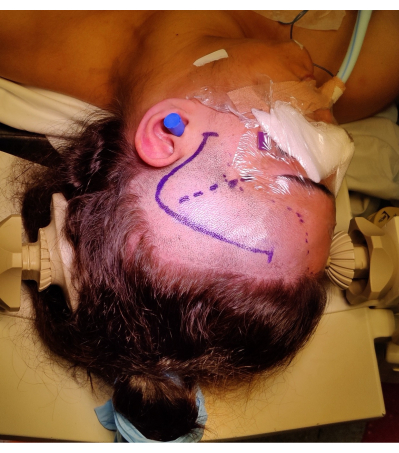
図4:右ATLRに対する患者の位置決めの画像で、「疑問符」である右前頭側頭皮膚切開、生え際、およびシルビウス裂のマーキングを示しています。 写真に写っていないのは、患者の首に過度の負担をかけず、静脈還流を妨げずに頭の位置の角度を可能にするために、患者の左肩の下に左肩ロールです。画像は撮影され、患者の同意を得て含まれました。 この図の拡大版を表示するには、ここをクリックしてください。
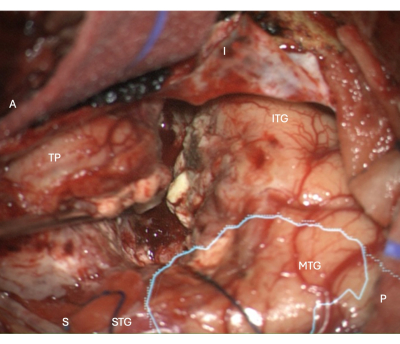
図 5: 右 ATLR の外側新皮質切除断端を示す顕微鏡からの術中画像、光学放射線 (シアン) の解剖学的マスクを重ね合わせたもの - 切除断端が手術室の前方にあることを示しています。 ラベルは、手術ビューの向きを示しています:A =前方、P =後方、I =下位、S =上、STG =上側頭回、MTG =中側頭回、ITG =下側頭回、TP =時間極。 この図の拡大版を表示するには、ここをクリックしてください。
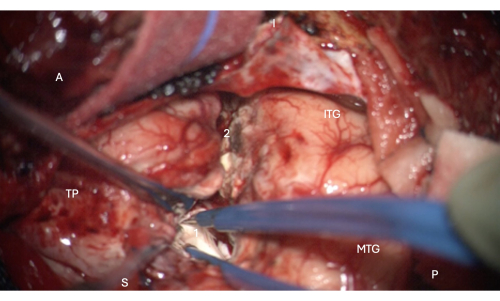
図6:側脳室の側頭角の前部への侵入を示す顕微鏡からの術中画像で、その中に海馬の頭部が写っています(淡い白、1)。 ラベル:A =前部、P =後部、I =下部、S =上部、MTG =中側頭回、ITG =下側頭回、2 =側頭新皮質切除縁、側副溝を上方にたどって側頭角の側頭角を見つける、TP =側頭極。 この図の拡大版を表示するには、ここをクリックしてください。
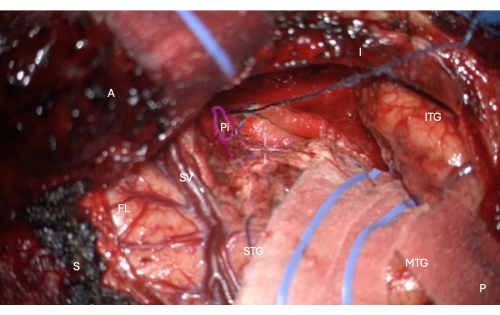
図7:梨状皮質の側頭部分の解剖学的マスクのHUDオーバーレイを示す顕微鏡からの術中画像(ピンクの輪郭、Piとラベル付け)。 この図は完全な切除を示しています - 脳組織は残っておらず、切除の近心にある鼻腔内溝の小孔境界のみが、この画像では顕微鏡HUDの中央の白い十字線のすぐ上にある画像内の縦方向のパティで保護されています。ラベル:A =前部、P =後部、I =下部、S =上部、STG =上側頭回、MTG =中側頭回、ITG =下側頭回、FL =前頭葉、SV =シルビウス静脈(シルビウス亀裂を覆う)、Pi =梨状皮質の側頭部分。 この図の拡大版を表示するには、ここをクリックしてください。
結果
このプロトコルと外科的技術は、進行中の研究内で適用されており、側頭梨状皮質切除の影響と、DRmTLE の ATLR 後の発作自由への影響を調査しています。この研究の目的は、側頭梨状皮質の除去後の発作自由度が実際に DRmTLE の発作自由度を向上させるかどうかを前向きに判断することです。
現在までに、ATLRを受けている36人の連続した患者で説?...
ディスカッション
このプロトコルは、梨状皮質の側頭部分の信頼性の高い標的切除を提供します - 近心側頭葉てんかんネットワーク16、17、24、25、30のてんかん発生と伝播における重要な構造であると仮定されています。
私たちのセンターで?...
開示事項
著者のデバヤン・ダスグプタとジョン・S・ダンカンは、ウェルカム・トラスト・イノベーション・プログラム(218380/Z/19/Z)から資金提供を受けています。Lawrence P. Bindingは、Epilepsy Research UK(助成金番号P1904)の支援を受けています。前述の著者とSjoerd B. Vosは、国立衛生研究所、ユニバーシティカレッジ、ロンドン病院、生物医学研究センター(NIHR、BRC、UCLH/UCL、ハイインパクトイニシアチブ、BW.mn.BRC10269)から一部資金提供を受けています。著者らは、この研究は、潜在的な利益相反と解釈される可能性のある商業的または金銭的関係がない状態で実施されたと宣言します。私たちは、倫理的な出版に関連する問題に関するジャーナルの立場を読んだことを確認し、このレポートがそれらのガイドラインと一致していることを確認します。
謝辞
この研究は、Epilepsy Research UK(助成金番号P1904)およびWellcome Trust Innovation Program(218380/Z/19/Z)の支援を受けました。この研究は、国立衛生研究所、ユニバーシティカレッジ、ロンドン病院、生物医学研究センター(NIHR、BRC、UCLH/UCL、ハイインパクトイニシアチブ、BW.mn.BRC10269)から一部資金提供を受けました。著者らは、西オーストラリア大学顕微鏡・特性評価・分析センター(Center for Microscopy, Characterization, and Analysis)のNational Collaborative Research Infrastructure Strategy(NCRIS)機能であるNational Imaging Facilityの施設と科学的・技術的支援を認めるものである。この研究は、ウェルカム・トラスト[WT 218380]によって全体的または部分的に資金提供されました。オープンアクセスの目的で、著者は、この提出から生じる著者受理原稿バージョンにCC BY公開著作権ライセンスを適用しています。
資料
| Name | Company | Catalog Number | Comments |
| Brainlab Neuronavigation System | Brianlab, Westchester, IL | https://www.brainlab.com/surgery-products/overview-neurosurgery-products/cranial-navigation/ | Intraoperative neuronavigation system |
| EpiNav Planning Software | N/A | N/A | Clinical Decision Support Tool, for research use, developed in academia at King's College London and University College London |
| Mayfield clamp | Integra | A1059 | Any 3 pin head immobilisation device can be used |
| Microsurgical instruments | As per local neurosurgical unit | ||
| MRI Scanner | GE, Milwaukee, WI, USA | 3T MRI GE MR750 | Any alternative 3T MRI scanner can be used |
| MRTrix3 | N/A | Reference 47 in the manuscript | MRtrix3 provides a set of tools to perform various advanced diffusion MRI analyses, including constrained spherical deconvolution (CSD), probabilistic tractography, track-density imaging, and apparent fibre density |
| NORAS coil | NORAS MRI Products | https://www.noras.de/en/mri-produkte/lucy-or-head-holder-8-ch-coil/#infos | Any MRI-safe head immobilisation device can be used |
| Perforator drill | Stryker | https://neurosurgical.stryker.com/products/elite/ | Any alternative neurosurgical perforator drill driver and bit can be used |
| Sutures - Vicryl Plus 2/- | Ethicon | ETVCP684H | Any alternative suture that the surgeon prefers can be used |
| Titanium bone plates and screws | As per local neurosurgical unit | ||
| Ultrasonic Aspirator | Integra | https://products.integralife.com/cusa-tissue-ablation/category/cusa-tissue-ablation | Any alternative that the surgeon prefers can be used |
参考文献
- Marathe, K., et al. ablative and radiosurgical interventions for drug-resistant mesial temporal lobe epilepsy: A systematic review and meta-analysis of outcomes. Front Neurol. 12, 777845 (2021).
- Choi, H., et al. Epilepsy surgery for pharmacoresistant temporal lobe epilepsy: A decision analysis. JAMA. 300, 2497 (2008).
- Foldvary, N., et al. Seizure outcome after temporal lobectomy for temporal lobe epilepsy: A Kaplan-Meier survival analysis. Neurology. 54, 630-634 (2000).
- Spencer, S. S., et al. Predicting long-term seizure outcome after resective epilepsy surgery: The multicenter study. Neurology. 65, 912-918 (2005).
- Sperling, M. R., O'Connor, M. J., Saykin, A. J., Plummer, C. Temporal lobectomy for refractory epilepsy. JAMA. 276, 470-475 (1996).
- Wiebe, S. Effectiveness and safety of epilepsy surgery: What is the evidence. CNS Spectr. 9, 120-132 (2004).
- Gilliam, F., et al. Patient-oriented outcome assessment after temporal lobectomy for refractory epilepsy. Neurology. 53, 687-694 (1999).
- Markand, O. N., Salanova, V., Whelihan, E., Emsley, C. L. Health-related quality of life outcome in medically refractory epilepsy treated with anterior temporal lobectomy. Epilepsia. 41, 749-759 (2000).
- Jones, J. E., Berven, N. L., Ramirez, L., Woodard, A., Hermann, B. P. Long-term psychosocial outcomes of anterior temporal lobectomy. Epilepsia. 43, 896-903 (2002).
- Spencer, D. D., Spencer, S. S., Mattson, R. H., Williamson, P. D., Novelly, R. A. Access to the posterior medial temporal lobe structures in the surgical treatment of temporal lobe epilepsy. Neurosurgery. 15, 667-671 (1984).
- Vakharia, V. N., et al. Intraoperative overlay of optic radiation tractography during anteromesial temporal resection: A prospective validation study. J Neurosurg. 1, 1-10 (2021).
- Winston, G. P., et al. Preventing visual field deficits from neurosurgery. Neurology. 83, 604-611 (2014).
- Almairac, F., Herbet, G., Moritz-Gasser, S., de Champfleur, N. M., Duffau, H. The left inferior fronto-occipital fasciculus subserves language semantics: A multilevel lesion study. Brain Struct Funct. 220, 1983-1995 (2015).
- Binding, L. P., Dasgupta, D., Giampiccolo, D., Duncan, J. S., Vos, S. B. Structure and function of language networks in temporal lobe epilepsy. Epilepsia. 63, 1025-1040 (2022).
- Giampiccolo, D., Duffau, H. Controversy over the temporal cortical terminations of the left arcuate fasciculus: A reappraisal. Brain. 145, 1242-1256 (2022).
- Sone, D., et al. Optimal surgical extent for memory and seizure outcome in temporal lobe epilepsy. Ann Neurol. 91, 131-144 (2022).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690-700 (2019).
- Dasgupta, D., et al. Hippocampal resection in temporal lobe epilepsy: Do we need to resect the tail. Epilepsy Res. 190, 107086 (2023).
- Wu, C., et al. Effects of surgical targeting in laser interstitial thermal therapy for mesial temporal lobe epilepsy: A multicenter study of 234 patients. Epilepsia. 60, 1171-1183 (2019).
- Wiebe, S. A randomized, controlled trial of surgery for temporal-lobe epilepsy. N Engl J Med. 345 (5), 311-318 (2001).
- Brotis, A. G., et al. A meta-analysis on potential modifiers of LITT efficacy for mesial temporal lobe epilepsy: Seizure-freedom seems to fade with time. Clin Neurol Neurosurg. 205, 106644 (2021).
- Borger, V., et al. Resection of piriform cortex predicts seizure freedom in temporal lobe epilepsy. Ann Clin Transl Neurol. 8, 177-189 (2020).
- Borger, V., et al. Temporal lobe epilepsy surgery: Piriform cortex resection impacts seizure control in the long-term. Ann Clin Transl Neurol. 9 (8), 1206-1211 (2022).
- Hwang, B. Y., et al. Piriform cortex ablation volume is associated with seizure outcome in mesial temporal lobe epilepsy. Neurosurgery. 91, 414-421 (2022).
- Piper, R. J., et al. Extent of piriform cortex resection in children with temporal lobe epilepsy. Ann Clin Transl Neurol. 10, 1613-1622 (2023).
- Allison, A. C. The secondary olfactory areas in the human brain. J Anat. 88, 481-488 (1954).
- Ribas, G. C. The cerebral sulci and gyri. Neurosurg Focus. 28, E2 (2010).
- Young, J. C., Vaughan, D. N., Paolini, A. G., Jackson, G. D. Electrical stimulation of the piriform cortex for the treatment of epilepsy: A review of the supporting evidence. Epilepsy Behav. 88, 152-161 (2018).
- Mai, J. K., Majtanik, M., Paxinos, G. . Atlas of the Human Brain. , (2016).
- Vaughan, D. N., Jackson, G. D. The piriform cortex and human focal epilepsy. Front Neurol. 5, 259 (2014).
- Gale, K. Progression and generalization of seizure discharge: Anatomical and neurochemical substrates. Epilepsia. 29, S15-S34 (1988).
- Löscher, W., Ebert, U. The role of the piriform cortex in kindling. Prog Neurobiol. 50, 427-481 (1996).
- Piredda, S., Gale, K. A crucial epileptogenic site in the deep prepiriform cortex. Nature. 317, 623-625 (1985).
- McIntyre, D. C., Gilby, K. L. Mapping seizure pathways in the temporal lobe. Epilepsia. 49, 23-30 (2008).
- Fahoum, F., Lopes, R., Pittau, F., Dubeau, F., Gotman, J. Widespread epileptic networks in focal epilepsies: EEG-fMRI study. Epilepsia. 53, 1618-1627 (2012).
- Flanagan, D., Badawy, R. A. B., Jackson, G. D. EEG-fMRI in focal epilepsy: Local activation and regional networks. Clin Neurophysiol. 125, 21-31 (2014).
- Laufs, H., et al. Converging PET and fMRI evidence for a common area involved in human focal epilepsies. Neurology. 77, 904-910 (2011).
- Wieser, H. G., et al. Proposal for a new classification of outcome with respect to epileptic seizures following epilepsy surgery. Epilepsia. 42, 282-286 (2001).
- Dasgupta, D., Duncan, J. S. Optimizing epilepsy surgery. ISRCTN Registry. BMC. , (2020).
- Sparks, R., et al. Automated multiple trajectory planning algorithm for the placement of stereo-electroencephalography (SEEG) electrodes in epilepsy treatment. Int J CARS. 12, 123-136 (2017).
- Dasgupta, D. . Improving outcomes in anteromesial temporal lobe resections - A prospective surgical trial integrating multimodal imaging & novel hi-res tractography. , (2022).
- Winston, G. P., et al. Automated T2 relaxometry of the hippocampus for temporal lobe epilepsy. Epilepsia. 58, 1645-1652 (2017).
- Cardoso, M. J., et al. Geodesic information flows: Spatially-variant graphs and their application to segmentation and fusion. IEEE Trans Med Imaging. 34, 1976-1988 (2015).
- Winston, G. P., et al. Automated hippocampal segmentation in patients with epilepsy: Available free online. Epilepsia. 54, 2166-2173 (2013).
- Iqbal, S., et al. Volumetric analysis of the piriform cortex in temporal lobe epilepsy. Epilepsy Res. 185, 106971 (2022).
- Leon-Rojas, J. E., et al. Resection of the piriform cortex for temporal lobe epilepsy: a novel approach on imaging segmentation and surgical application. Br J Neurosurg. 1, 1-6 (2021).
- Tournier, J. -. D., et al. MRtrix3: A fast, flexible and open software framework for medical image processing and visualization. Neuroimage. 202, 116137 (2019).
- Cordero-Grande, L., Christiaens, D., Hutter, J., Price, A. N., Hajnal, J. V. Complex diffusion-weighted image estimation via matrix recovery under general noise models. Neuroimage. 200, 391-404 (2019).
- Vos, S. B., et al. The importance of correcting for signal drift in diffusion MRI. Magn Reson Med. 77, 285-299 (2017).
- Kellner, E., Dhital, B., Kiselev, V. G., Reisert, M. Gibbs-ringing artifact removal based on local subvoxel-shifts. Magn Reson Med. 76, 1574-1581 (2016).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. Neuroimage. 23, S208-S219 (2004).
- Andersson, J. L. R., Sotiropoulos, S. N. An integrated approach to correction for off-resonance effects and subject movement in diffusion MR imaging. Neuroimage. 125, 1063-1078 (2016).
- Leemans, A., Jones, D. K. The B-matrix must be rotated when correcting for subject motion in DTI data. Magn Reson Med. 61, 1336-1349 (2009).
- Tustison, N. J., et al. N4ITK: Improved N3 Bias Correction. IEEE Trans Med Imaging. 29, 1310-1320 (2010).
- Dhollander, T., Raffelt, D., Connelly, A. Unsupervised 3-tissue response function estimation from single-shell or multi-shell diffusion MR data without a co-registered T1 image. ISMRM Workshop on Breaking the Barriers of Diffusion MRI. 5, (2016).
- Binding, L. P., et al. Contribution of white matter fiber bundle damage to language change after surgery for temporal lobe epilepsy. Neurology. 100, e1621-e1633 (2023).
- Giampiccolo, D., et al. Thalamostriatal disconnection underpins long-term seizure freedom in frontal lobe epilepsy surgery. Brain. 146, 2377-2388 (2023).
- Smith, R. E., Tournier, J. -. D., Calamante, F., Connelly, A. Anatomically-constrained tractography: Improved diffusion MRI streamlines tractography through effective use of anatomical information. Neuroimage. 62, 1924-1938 (2012).
- Tournier, J. D., Calamante, F., Connelly, A. Improved probabilistic streamlines tractography by 2nd order integration over fibre orientation distributions. Proc 18th Annu Meet ISMRM. 1670, (2010).
- Yasargil, M. G., Fox, J. L. The microsurgical approach to intracranial aneurysms. Surg Neurol. 3, 7-14 (1975).
- Yasargil, M. G., et al. Microsurgical pterional approach to aneurysms of the basilar bifurcation. Surg. Neurol. 6, 83-91 (1976).
- Rao, D., Le, R. T., Fiester, P., Patel, J., Rahmathulla, G. An illustrative review of common modern craniotomies. J Clin Imaging Sci. 10, 81 (2020).
- Usui, N., Kondo, A., Nitta, N., Tottori, T., Inoue, Y. Surgical resection of amygdala and uncus. Neurol Med Chir (Tokyo). 58, 377-383 (2018).
- Vivas, A. C., Reintjes, S., Shimony, N., Vale, F. L. Surgery of the amygdala and uncus: A case series of glioneuronal tumors. Acta Neurochir. (Wien). 162, 795-801 (2020).
- Al-Otaibi, F., Baeesa, S. S., Parrent, A. G., Girvin, J. P., Steven, D. Surgical techniques for the treatment of temporal lobe epilepsy. Epilepsy Res Treat. 2012, 1-13 (2012).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved