需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
改善前颞叶切除术的预后 - 切除颞梨状皮层的演示
摘要
在这里,我们展示了一种在前颞叶切除术中进行术中神经外科引导的方法,特别强调了使用牵引成像和解剖面罩来帮助安全切除梨状皮层的颞部——该区域越来越被视为耐药性内侧颞叶癫痫的关键手术目标。
摘要
前颞叶切除术 (ATLR) 是耐药性内侧颞叶癫痫 (DRmTLE) 的有效治疗选择。越来越多的证据表明,梨状皮层在 DRmTLE 中癫痫发作的产生和传播中起着至关重要的作用 - 并且梨状皮层颞部的切除与癫痫发作自由率的显着提高有关。
在这里,我们介绍了 ATLR 中梨状皮层颞部的切除,使用高分辨率术前概率束成像算法,并将感兴趣结构的解剖掩码融合到术中神经导航和显微镜平视显示器 (HUD) 中。
所有接受 DRmTLE 综合术前评估和调查的患者均提供了知情的书面同意,以录制手术的术中视频。患者由癫痫病学家、癫痫神经外科医生、神经心理学家、神经精神病学家和电生理学家组成的多学科专家团队在一家大型癫痫手术中心进行鉴定。术前成像流程包括关键结构的描绘。这包括颞梨状皮层,以及对处于风险中的重要束(例如,光辐射和额枕下束)的高分辨率概率束造影。这些被共同配准到术前体积神经导航扫描中,并上传到术中神经导航系统。
这里介绍的是 ATLR 的分步程序,包括梨状皮层颞部的切除。该方案结合了先进的结构和弥散 MR 成像以及术中视觉辅助工具,将关键灰质结构和白质束的解剖掩码整合到手术室的手术工作流程中。
引言
前颞叶切除术 (ATLR) 是治疗耐药性内侧颞叶癫痫 (DRmTLE) 的最有效方法1,2,癫痫发作自由率为 50%-70%,发病率相对较低 3,4,5。该程序还被证明可以改善生活质量 6,7,8、就业率5 和社会心理健康9。
Spencer 等人 10 描述的经典 ATLR 涉及颞极、钩状、杏仁核、海马体、海马旁回和梭形回的切除。涉及视觉(视辐射,特别是迈耶环11,12)和语言(例如,额枕下束13 和弓状束14,15)的关键白质通路在进入侧脑室的颞角时有受伤的风险。以下协议概述了一种使用高分辨率术前概率束成像和将感兴趣结构的解剖掩码融合到术中神经导航和显微平视显示器 (HUD) 中来避免这些白质束的方法。
该领域的传统理解是,最大海马切除术有利于最大限度地提高术后癫痫发作自由率。然而,最近对 ATLR 后病例的体素分析表明,ATLR 中梨状皮层颞部的切除大大增加了癫痫发作自由的机会。他们还表明,海马后切除术与无癫痫发作之间没有关联16,17。因此,有人提议更新斯宾塞的技术,将海马切除限制在海马体的前 55%,在语言占主导地位的半球 ATLR 中,以保持记忆功能16,18。
虽然人们对使用新型微创疗法,特别是激光间质热疗 (LITT) 越来越感兴趣,但手术切除仍然是耐药局灶性癫痫的标准治疗1,并且 LITT 的疗效已被证明产生较低比例的 Engel 1 癫痫发作结果(58%-59%)1,19与 ATLR (60%-70%) 相比3,4,5,20,因此仍然是一个需要进一步调查的领域21。
越来越多的证据支持梨状皮层(图 1)是成人16、17、22、23、24 和儿童25 内侧颞叶癫痫癫痫发作传播和/或癫痫发生的关键区域。梨状皮层是一条由三层分配状的带状物(类似于海马皮层的排列),覆盖在颞干近端的内嗅沟周围 26,27,因此形成颞叶和额叶的汇合处。因此,它可以很容易地被认为是由额部和时间部组成,在文献 22,25,28,29,30 中有详细描述。
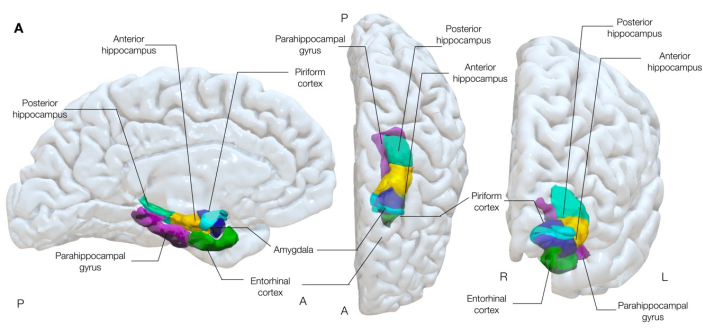
图 1:大脑近中颞结构的半透明 3 维渲染。 该图展示了梨状皮层(青色)与周围近中颞叶解剖结构的解剖学关联。左内侧、中央上视图和右前视图。 请单击此处查看此图的较大版本。
梨状皮层位于杏仁核近中上,长期以来在动物研究中一直被认为是传播致癫痫放电的网络中的共同节点31-33,并且比邻近的近中结构(包括杏仁核和海马体)更容易在电刺激后产生癫痫发作34.它的位置与内嗅、边缘、眶额叶和岛叶皮层以及丘脑、嗅球、杏仁核和海马体有着广泛的联系,也使其在局灶性癫痫中充当致癫痫放电的关键传播途径30。
EEG-fMRI 和正电子发射断层扫描 (PET) 研究进一步支持梨状皮层在 DRmTLE 中的重要作用,显示发作间期激活,梨状皮层中 γ-氨基丁酸 A 型 (GABAA) 受体结合减少与癫痫发作活动增加有关 35,36,37。
DRmTLE 中最近的两项重要影像学研究表明,术后无癫痫发作与梨状皮层更大程度的切除有关;Galovic 等人在一个大型回顾性队列中证明,切除至少一半的梨状皮层可将无癫痫发作的几率提高 16 倍(95% CI,5-47; p < 0.001)17。研究还证明,其他近中颞结构的切除体积与无癫痫发作无关,这一发现被 Sone 等人进行的体素分析复制和支持,他们表明只有左侧 TLE 中的梨状皮层切除与无癫痫发作相关16 (图2)。
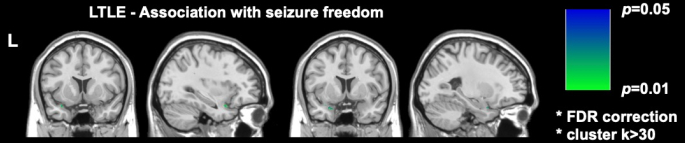
图 2:体素与左侧 TLE 术后无癫痫发作的关联。 唯一与无癫痫发作显著相关的区域是梨状皮层的颞部, p = 0.01(冠状位和矢状位 T1 加权 MRI 切片为绿色)。经许可改编自 Sone et al.16 。 请单击此处查看此图的较大版本。
Borger 等人还在一个大型回顾性队列中证明,在第 1 年3 和更长时间的随访(平均 3.75 年)中,只有切除的颞梨状皮层的比例与癫痫发作清除率的提高相关 23。他们进一步证实,海马体和杏仁核切除的体积并不能预测癫痫发作的自由度。
梨状皮层与 mTLE 异常致痫网络断开连接的重要性也在 LITT 中得到证明,Hwang 等人在 6 个月的随访中表明,梨状皮层消融百分比与 ILAE 1 类结果相关38 (OR 1.051,95% CI 1.001-1.117,p = 0.045),但这是一个在 1 年时不显著的趋势5 .这似乎支持有关 LITT 的新数据,即癫痫发作结果有积极但可能不太持久的改善,这导致 LITT 通常用作“第一阶段”手术,为那些通过 LITT 无法实现无癫痫发作的人提供切除手术。
因此,有强有力的证据表明,切除梨状皮层的颞部是耐药性内侧颞叶癫痫实现无癫痫发作的关键目标。然而,正如 Galovic 等人的回顾性队列所证明的那样,在进行 ATLR 时,这条内嗅皮层带位于难以手术靶向的位置,这意味着如果它没有直接靶向,它并不总是能成功去除。作为正在进行的前瞻性手术研究的一部分,我们在这项研究中展示了如何安全地靶向和切除梨状皮层的颞部,以评估其对提高术后癫痫发作自由率的影响39。
以下协议的重点是图像采集和处理的技术方面、手术方法以及我们如何确保在 ATLR 中切除梨状皮层的颞部,同时将高分辨率术前概率束造影和感兴趣结构的融合解剖掩码集成到术中神经导航和显微镜平视显示器 (HUD)。该协议还使用特定的计划软件平台40,该平台允许 3 维查看和集成多模式成像以进行手术审查和计划,以及允许与手术显微镜集成的神经导航系统(具体细节详见 材料表)。
Access restricted. Please log in or start a trial to view this content.
研究方案
这些方法和方案是正在进行的前瞻性外科试验的一部分,该试验于 2020 年 9 月 10 日获得卫生研究局批准,研究伦理委员会 (REC) 伦敦参考:20/LO/0966。该协议已前瞻性注册:ISRCTN72646265,于 2020 年 9 月 25 日在线提供39,并已在全国会议上提出41。
以下方案适用于 18-70 岁患者(在我们的专业成人癫痫手术中心为此适应症进行手术的患者年龄组)的所有接受 ATLR 治疗 DRmTLE 的患者,所有患者均由同一位外科医生(AWM、AM)进行手术。所有参与者在纳入研究前都提供了知情同意书。所有参与者都接受了由作者综合癫痫手术中心的外科癫痫专家多学科团队指导的全面术前评估和调查,该团队由神经外科医生、癫痫神经学家、神经心理学家、精神病学家、神经放射学家和癫痫专业治疗服务的其他成员组成。手术前,所有人都进行了最新的体积 T1、T2 和 FLAIR MRI,如下方案所述,以及标准的术前血液和神经麻醉团队的审查,确保他们在全身麻醉下可以安全地进行手术。材料 表中提供了本研究中使用的试剂和设备的商业细节。
1. 成像采集和处理
注意:在我们中心接受癫痫手术的人中,通常会进行高分辨率的术前、术后 3 个月和 1 年的磁共振成像 (MRI) 扫描。为了保持一致性,MRI 数据是在 2020 年 3 月至 2024 年 3 月期间在同一台 MRI 扫描仪上采集的。标准化图像采集和许多处理组件已在文献中进行了先前的描述,并在下面总结的协议中进行了适当引用:
- 获取以下 MRI 序列:
- 标准 3D 等距 (1 mm) T1 加权序列,具有反转恢复快速破坏梯度调用(IR-FSPGR)回波[回波时间(TE)3.1 ms,重复时间(TR)= 7.4 ms,反转时间= 400 ms,视场(FOV)= 224 × 256 × 256 mm,矩阵 = 224 × 256 × 256,体素大小 = 1.00 × 1.00 × 1.00 mm = 1.00 mm3,平行成像加速因子 = 2]和;
- 用于 T2 弛豫测量42 的冠状动脉双回波快速恢复快速自旋回波质子密度/T2 加权序列(TE = 30/119 ms,TR = 7600 ms,FOV = 220 × 220 mm,基质 = 512 × 512,切片厚度 = 4 mm,体素大小 = 0.43 × 0.43 × 4.00 mm = 0.74 mm3,SENSE 因子 = 2)。
- 使用上述 T1 加权序列作为测地线信息流 (GIF v3) 算法的输入,使用 NiftyWeb43 将大脑分成 162 个解剖区域。
- 使用 GIF 包裹(海马旁回、梭状回、创建海马分析信息,并使用 Hipposeg44 将海马分割为前 55% 和后 45%)生成感兴趣结构的解剖掩码,在计划软件中将这些叠加在患者的体积术前成像上(如步骤 1.1 所示)。
- 执行自动梨状皮层分割,并将梨状皮层分成额叶和颞叶成分,这些成分来自我们实验室之前工作中解释的体积测量技术 17,45,46。生成后,将这些面罩叠加在患者的术前成像上。
- 获取以下弥散 MRI 图像:
- 标准分辨率多壳采集(2 mm 各向同性分辨率,11、8、32 和 64 个梯度方向,b 值为 0、300、700、2500 s/mm2)和;
- 高分辨率多壳采集(1.6 mm 各向同性分辨率,101 个方向,14 b0,b 值:300、700 和 2500 s/mm2)。
- 使用 MRtrix3 (https://mrtrix.org)47 校正采集的扩散数据:
- 在 MRtrix3 中使用 “dwidenoise” 的噪声48.
- 信号漂移49.
- 在 MRtrix3 中使用 “mrdegibs” 的 Gibbs 振铃50.
- 使用反相编码梯度和 FSL TOPUP 算法 (https://fsl.fmrib.ox.ac.uk/fsl51) 进行失真。
- 使用 FSL 的涡流算法 (https://fsl.fmrib.ox.ac.uk/fsl)52 的涡流和运动伪影,旋转 b 向量53。
- 使用 ANT 算法的偏置场 (https://mrtrix.org47,54)。
- 使用多壳、多组织约束球形反卷积 (CSD)55 来估计白质和灰质以及脑脊液 (CSF) 的响应函数。
- 进行解剖学靶向自动束造影以重建感兴趣的纤维束 12,56,57:视辐射、额枕下束 (IFOF;语言优势病例)和中纵束 (MLF;语言非优势病例)。请按照以下步骤作。
- 提取每个纤维束的皮质终端点,并将它们分为种子和终端 ROI。
- 使用非终止皮质区域创建排除皮质区域和 ROI。
- 通过概率纤维跟踪算法 iFOD259 在 MRtrix347 中使用混合表面和体积分割进行解剖学约束的束成像58,从 3 亿颗种子中选择最多 5,000 个流线。
- 对每个纤维束执行步骤 1.8.3 中的束描记两次,切换种子和终止 ROI。
- 将生成的光纤束转换为概率图,阈值为 0.01 - 将这些用作额外的排除标准以消除虚假流线。
- 在计划软件中查看生成的纤维束(扩张 2 毫米)和解剖面罩,以确保它们在解剖学上是准确的(此步骤由我们单位的两名癫痫神经外科医生执行)。
- 在步骤 1.1 中将生成的解剖灰质和白质束掩码空间配准到参考 T1 加权 MR 图像,并加载到术中 MRI (iMRI) 手术室的术中导航系统。
- 手术前(< 24 小时)立即获取 T1、T2 和 T2-FLAIR 加权体积 MRI 图像,并在患者头皮上提供皮肤基准。将这些图像相互共配准,以及上述 T1 加权参考图像和掩码,如图 3 所示。
- 使用表面匹配激光和智能指针在神经导航系统上注册“患者。
- 在病例开始之前,验证图像共同配准和患者与两名癫痫神经外科医生的准确性,以确保准确性。
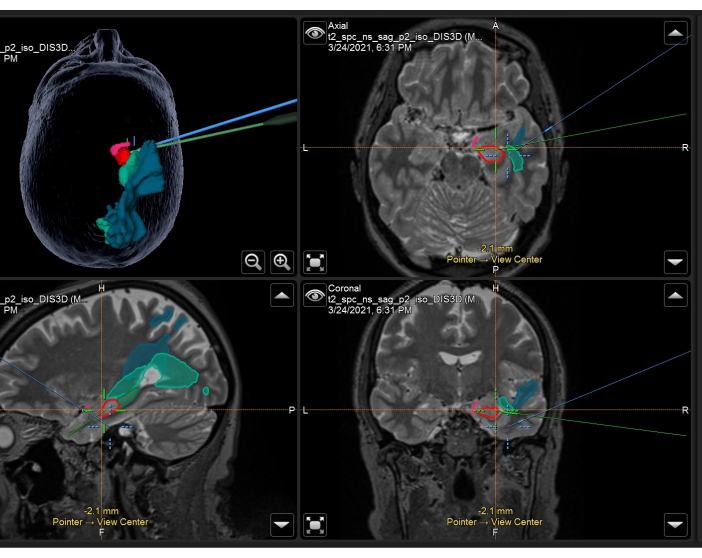
图 3:神经导航系统的屏幕截图,展示了右侧 ATLR 术中使用的带有叠加解剖面罩和束的体积 T2 加权 MRI。 左上面板:患者头部的 3 维重建,展示了解剖学面罩。右上:轴向,左下:矢状面,右下:冠状位视图也显示 T2 加权体积 MRI 扫描上叠加的解剖掩码。显示的解剖掩码:梨状皮层的颞部(粉红色)、海马体的前部 55%(红色)、海马体后部 45%(深绿色,仅在矢状面上可见)、光辐射(中绿色)、中纵束(蓝色)。蓝色十字准线是显微镜焦点的集成位置,绿色十字准线是手术区域内使用的神经导航指针的位置。 请单击此处查看此图的较大版本。
2. 手术技术
注意:以下步骤总结了作者中心的实践,并非旨在阐述 ATLR 的唯一手术方法,而是展示作者如何标准化该程序的方法以提供可靠和可重复的切除,包括颞梨状皮层的切除。
- 定位和方法
- 按照标准的术前检查和安全措施,将患者仰卧位,滚动抬高同侧肩部,并将头部转向对侧。
- 横向弯曲头部以确保颧骨隆起是手术区域的最高点,并固定在销钉中(3 点颅骨固定装置 - 参见示例,包括与材料 表中的术中 [iMRI] 剧院兼容的那些)。
注意:定位对于允许充分进入近中和后颞叶结构至关重要,尤其是侧屈,以确保颧骨隆起是手术区域的最高点。 - 将局部麻醉剂浸润到针刺部位和皮肤切口。
- 使用皮肤基准和表面跟踪的组合(特定于所使用的神经导航系统品牌)将患者空间注册到神经导航系统。根据可触及或可见的骨/其他解剖标志确认配准准确性。
- 标记发际线和颧骨根部(通过手动触诊识别)。使用神经导航识别和标记 Sylvian 裂的路线,以及计划的曲线额颞叶“问号”皮肤切口。
- 使用电动理发器沿计划的皮肤切口去除毛发。
- 从耳屏前 1 cm 处做一个额颞切口,以问号的方式弯曲,以防止损伤面神经的额颞支。如果可能,识别并保留颞浅动脉。皮肤切口的定位和标记如图 4 所示。
- 用浸有抗菌剂的乳突拭子和 Raney 夹覆盖并固定伤口边缘。
- 切开颞肌并将其抬高到肌皮瓣或筋膜间/筋膜下皮瓣中(防止损伤面神经的额颞支)。
- 用浸有抗菌溶液的纱布包裹皮瓣并向前缩回(如果在 iMRI 手术室中,请避免使用金属固定器械)。
- 用穿支钻在颅骨上挖 2 个钻孔:第一个就在颧骨根部上方,以最大限度地暴露下部,第二个在额下部,以促进外侧裂的可视化。
- 进行标准的额颞开颅手术 60,61,62,暴露出外侧裂上方 1 cm 的颞上回和中回。
- 钻掉开颅手术的前缘和下缘,以便轻松进入颞中窝底以及前颞极。如果遇到乳突气室,请在遇到它们时和手术结束时用骨蜡和纤维蛋白胶密封这些气室,然后再闭合骨骼浅表的层。
注意:重要的是要确保开颅手术允许进入颅中窝的底部,因为这将是通过侧支沟进入侧脑室颞角的途径。彻底密封任何遇到的乳突气室以防止术后脑脊液泄漏和由此产生的症状和潜在感染也很重要。 - 以 U 形方式打开硬脑膜,底部向前反射并以星形方式延伸。用缝合线(如 3-0 丝绸)将硬脑膜从手术区域拴开。
- 从颅中窝底部和颅中窝前部释放 CSF。
注意:CSF 释放步骤对于允许足够的工作空间从下方通过手术进入颅中窝底和侧支沟很重要,而不会对基底颞叶造成回缩和压力。
- 外侧新皮质切除
- 将颞下回(分别为 MTG 和 ITG)的软脑膜凝固在垂直于颅底的一条线上,并与侧脑室颞角的前突一致(在神经导航系统上确认)。根据外侧新皮质参与癫痫发作/传播的术前证据,根据具体情况调整这条线的前后范围。
注意:外侧新皮质切除术的前后范围应考虑其参与癫痫发作传播的术前证据(或缺乏证据),这是为个体患者量身定制的。 - 在 ITG 中采用经皮层入路暴露颅中窝底部并识别侧支沟,该侧支沟位于海马旁回外侧和梭状回内侧。
- 凝固上述外侧新皮质切口前方的颞上回 (STG) 的软脑膜,平行于 Sylvian 裂的方向。这垂直于步骤 2.16 中描述的线,并向前延伸到颞极。
- 使用软膜下解剖技术在 STG 和 Sylvian 裂之间形成平面,保护大脑中动脉的分支,并将该解剖向下带到 Sylvian 裂的水平部分,直至岛叶下限制沟的水平。
注意:在步骤 2.2.4 中进行软脑膜下解剖时,应注意保持与外侧裂接壤的 STG 软脑膜的完整性,因为这可以保护裂隙中大脑中动脉的分支,以及其他结构,例如动眼神经和后交通动脉(步骤 2.2.14)和视束(步骤 2.3)在手术后期。 - 将显微镜与神经导航系统集成。
- 确认第 1 节中描述的解剖掩模的物体叠加的准确性,并在显微镜 HUD 上可视化这些。
- 将后切除术线向前向上倾斜以尽量减少 STG 的切除,并将其逐渐通过 MTG 和 ITG 延伸,通过梭形回到达侧支沟。
- 检查后切除边缘与神经导航系统的关系,并可视化光辐射 (OR) 面罩。
- 在显微镜上观察 OR 面罩的最大前部,并确保它位于显微镜 HUD 上切除边缘的后方,以确保不会损坏 OR,这会导致术后视野缺损,如图 5 所示。
注意:步骤 2.2.9 是防止由于光辐射 Meyer 环损伤而导致术后视野缺损的关键步骤。如果大脑转移很多,外科医生希望进一步降低对视辐射造成损伤的风险,或者如果显微镜 HUD 上的投影无法正常工作,作者建议使用神经导航指针将方法对准侧脑室颞角的最前尖端, 因为这可以最大限度地降低手术室损伤的风险。 - 向上跟踪侧支沟,直到遇到颞角(在神经导航系统上确认这一点),如图 6 所示。颞角壁可以通过蓝色的室管膜来识别。
注意:在病理不是海马硬化且海马头体积庞大的个体中,很难找到心室。在这些情况下,故障排除选项是使用内侧颞窝底部没有移动的神经导航指针来查找心室尖端突出的位置。在冠状平面上寻找这个通常会有所帮助。如果找不到心室,我们建议先取下杆子,然后用超声波吸引器找到心室。 - 将颞角暴露外侧的基底颞软脑膜分开。
- 向前打开心室以露出海马头(如图 6 所示)。
- 延长后切缘以加入与心室的断开,这允许新皮质阻滞断开。
- 沿着小幕边缘边缘的解剖线动员颞极。注意不要在幕边缘进行断线作,以免损伤近中结构,包括动眼神经和后交通动脉。
注意:为了降低损坏水箱中结构的风险 , 请遵循帐篷边缘的形状,不要越过帐篷的边缘。钩子将保留在原位,可以作为单独的标本采集。
- 将颞下回(分别为 MTG 和 ITG)的软脑膜凝固在垂直于颅底的一条线上,并与侧脑室颞角的前突一致(在神经导航系统上确认)。根据外侧新皮质参与癫痫发作/传播的术前证据,根据具体情况调整这条线的前后范围。
- 近中颞叶切除术,包括颞梨状皮层
- 通过解剖清理 uncus 组织,并在近中使用超声抽吸器,直到可以看到动眼神经和后交通动脉。当看到 pes (海马头的最近中范围) 时,停止后切除术的范围。
- 用超声抽吸器切除杏仁核,在上部受鼻内沟软脑膜的限制,直到看到视束,并在近中受基底池软脑膜平面的限制。
注意:在执行步骤 2.3.2 时,请注意保留颞叶,不要进入额叶。有时,由于大脑转移,神经导航可能会高估近中切除的范围;在这方面,切除可以安全地继续进行,直到通过 PIA 看到视束,这代表了切除的近中边界。这在 Usui 等人 63中也有描述,杏仁核的背缘通常被描述为由连接脉络膜点和大脑中动脉近端分叉的假想线近似64。 - 通过软脑膜下解剖去除任何残留组织,确保梨状皮层的颞部被切除,从 Sylvian 裂的颞侧向下进展,直到可以看到岛叶下环沟的静脉。这与 Usui 等人在切除杏仁核-钩状病变时描述的切缘相似63。
注意:如果 uncus(在步骤 2.3.1 中)或梨状皮层难以去除(有时,它们可能非常粘附在 pia mater上),作者建议使用 Rhoton 解剖器而不是超声抽吸器,以尽量减少对软脑膜的伤害。 - 使用步骤 1.4 中描述的覆盖在显微镜 HUD 上的解剖掩码确认梨状皮层颞部的切除,如图 7 所示。
- 海马切除术
- 放置 linteens(或类似的宽棉状体)以向近中回缩脉络丛(和脉络膜前动脉),以方便观察海马菌毛。
- 断开菌毛海马体与其蛛网膜附件的连接,露出携带 Ammon 角动脉血管拱廊的海马沟。
- 断开海马体与其尾部的连接(在语言优势半球切除术中将切除限制在海马体的前 55%,以尽量减少16 中概述的语言记忆缺陷,或在非语言优势半球切除术中向后延伸至中脑顶盖的水平)。
- 断开海马头与 海马足的连接。根据需要凝固海马动脉弓。
- 整体移除断开连接的海马体。
- 对海马旁回和皮下进行软膜下解剖,并确保所得手术腔中的止血。切除 海马足,观察和保护脑干。
注意:执行步骤 2.4.7 时应小心,因为在此水平上 pes 和脑干之间没有保护性软脑膜边界。
- 术中影像学检查和闭合
- 从手术区域中取出所有金属物品,覆盖伤口,并进行术中 MRI 扫描,通常包括体积 T1、T2、FLAIR 和 DWI 序列。
- 与一名神经放射学顾问医生和两名癫痫神经外科医生顾问一起审查术中成像,以确保成功切除所需数量的近中颞叶结构(包括梨状皮层的颞部,以及上述步骤 2.36 中概述的海马体的可变数量)。还要检查 DWI 成像,以确保在手术过程中没有引起缺血区域。
- 确认上述情况后,将患者转移回手术台,确认患者血压正常时手术腔内止血。
- 以标准方式闭合伤口,更换骨瓣,在 3 个点用板和螺钉固定,并用缝合线标准闭合肌肉、筋膜和皮肤层,将手术伤口引流管留在原位 24 小时。
注意:术后护理在作者中心进行,通常在神经外科高依赖病房前 24 小时进行,然后在高依赖病房认为合适时降级到神经外科专科病房。监测患者的神经系统观察结果,术后血液(包括尿素和电解质)、全血细胞计数和分类计数,通常在术后约 72 小时出院。然后在 4-6 周内作为门诊患者进行随访,并在术后至少 3-4 个月和 1 年进行间歇成像随访。
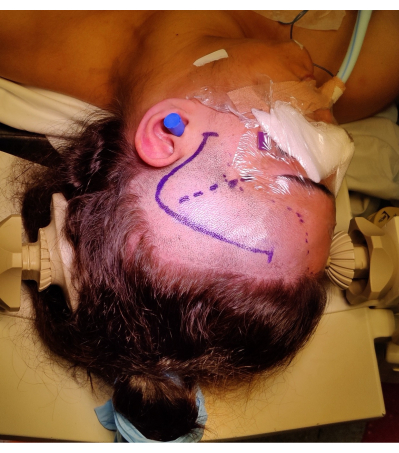
图 4:患者右侧 ATLR 的定位图像,展示了“问号”右侧额颞叶皮肤切口、发际线和外侧裂的标记。 图中未图为患者左肩下方的左肩滚动,以允许头部定位的角度,而不会对患者的颈部造成过度的压力,也不会阻碍静脉回流。在患者同意的情况下捕获并包含图像。 请单击此处查看此图的较大版本。
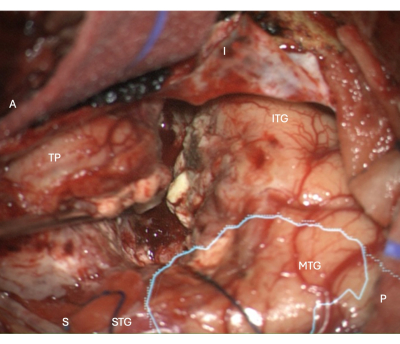
图 5:显微镜的术中图像显示右侧 ATLR 的外侧新皮质切除边缘,光辐射的解剖掩码覆盖(青色)- 显示切除边缘位于 OR 前方。 标签显示手术视图的方向:A = 前,P = 后,I = 下,S = 上,STG = 颞上回,MTG = 颞中回,ITG = 颞下回,TP = 颞极。 请单击此处查看此图的较大版本。
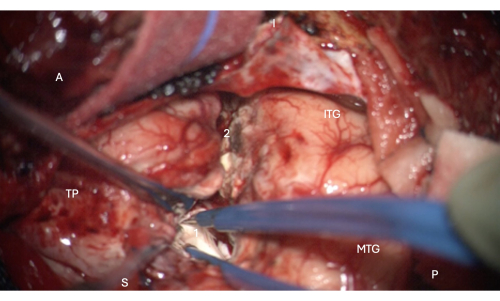
图 6:显微镜的术中图像显示进入侧脑室颞角的前部,显示其中的海马头(淡白色,1)。 标签: A = 前,P = 后,I = 下,S = 上,MTG = 颞中回,ITG = 颞下回,2 = 外侧新皮质切除边缘,在深度上沿侧支沟找到侧脑室的颞角,TP = 颞极。 请单击此处查看此图的较大版本。
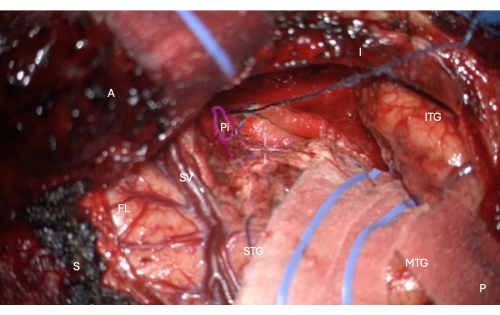
图 7:来自显微镜的术中图像显示了梨状皮层颞部解剖面具的 HUD 叠加(粉红色轮廓,标记为 Pi)。 该图显示了完全切除 - 没有剩余的脑组织,只有位于切除近端的鼻内沟的软脑膜边界,在此图像中受到保护,图像中覆盖的纵向馅饼位于显微镜 HUD 的中央白色十字准线上方。标签:A = 前,P = 后,I = 下,S = 上,STG = 颞上回,MTG = 颞中回,ITG = 颞下回,FL = 额叶,SV = 外侧静脉(覆盖外侧裂),Pi = 梨状皮层的颞部。 请单击此处查看此图的较大版本。
Access restricted. Please log in or start a trial to view this content.
结果
该方案和手术技术已应用于一项正在进行的研究中,询问颞梨状皮层切除术的影响及其对 DRmTLE ATLR 后无癫痫发作的影响。本研究的目的是前瞻性地确定去除颞梨状皮层后的无癫痫发作是否确实提高了 DRmTLE 的无癫痫发作,正如文献中越来越多的回顾性数据所表明的那样。
迄今为止,我们已经在连续 36 名接受 ATLR 的患者中采用了所描述的方案,所有这...
Access restricted. Please log in or start a trial to view this content.
讨论
该方案提供了梨状皮层颞部的可靠、有针对性的切除 - 被认为是近中颞叶癫痫网络 16,17,24,25,30 的癫痫发生和传播的关键结构。
我们在我们中心执行的标准 ATLR 技术的组件改编自 Spencer 等人10,并且之前在我们?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者 Debayan Dasgupta 和 John S. Duncan 获得了 Wellcome Trust 创新计划 (218380/Z/19/Z) 的资助。Lawrence P. Binding 得到了英国癫痫研究中心(资助号 P1904)的支持。上述作者和 Sjoerd B. Vos 部分由国家卫生研究所、伦敦大学学院医院生物医学研究中心 (NIHR BRC、UCLH/UCL 高影响力倡议 BW.mn.BRC10269) 资助。作者声明,该研究是在没有任何可能被解释为潜在利益冲突的商业或财务关系的情况下进行的。我们确认,我们已经阅读了本刊对道德出版所涉及的问题的立场,并确认本报告符合这些指导方针。
致谢
这项工作得到了英国癫痫研究中心(资助号 P1904)和 Wellcome Trust 创新计划 (218380/Z/19/Z) 的支持。这项工作部分由国家卫生研究所伦敦大学学院医院生物医学研究中心 (NIHR BRC UCLH/UCL HIGH IMPACT INITIATIVE BW.MN.BRC10269) 资助。作者感谢西澳大利亚大学显微镜、表征和分析中心的国家成像设施(国家协作研究基础设施战略 (NCRIS) 能力)的设施和科学技术援助。这项研究全部或部分由 Wellcome Trust [WT 218380] 资助。出于开放获取的目的,作者已将 CC BY 公共版权许可应用于因本提交内容而产生的任何作者接受的手稿版本。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Brainlab Neuronavigation System | Brianlab, Westchester, IL | https://www.brainlab.com/surgery-products/overview-neurosurgery-products/cranial-navigation/ | Intraoperative neuronavigation system |
| EpiNav Planning Software | N/A | N/A | Clinical Decision Support Tool, for research use, developed in academia at King's College London and University College London |
| Mayfield clamp | Integra | A1059 | Any 3 pin head immobilisation device can be used |
| Microsurgical instruments | As per local neurosurgical unit | ||
| MRI Scanner | GE, Milwaukee, WI, USA | 3T MRI GE MR750 | Any alternative 3T MRI scanner can be used |
| MRTrix3 | N/A | Reference 47 in the manuscript | MRtrix3 provides a set of tools to perform various advanced diffusion MRI analyses, including constrained spherical deconvolution (CSD), probabilistic tractography, track-density imaging, and apparent fibre density |
| NORAS coil | NORAS MRI Products | https://www.noras.de/en/mri-produkte/lucy-or-head-holder-8-ch-coil/#infos | Any MRI-safe head immobilisation device can be used |
| Perforator drill | Stryker | https://neurosurgical.stryker.com/products/elite/ | Any alternative neurosurgical perforator drill driver and bit can be used |
| Sutures - Vicryl Plus 2/- | Ethicon | ETVCP684H | Any alternative suture that the surgeon prefers can be used |
| Titanium bone plates and screws | As per local neurosurgical unit | ||
| Ultrasonic Aspirator | Integra | https://products.integralife.com/cusa-tissue-ablation/category/cusa-tissue-ablation | Any alternative that the surgeon prefers can be used |
参考文献
- Marathe, K., et al. ablative and radiosurgical interventions for drug-resistant mesial temporal lobe epilepsy: A systematic review and meta-analysis of outcomes. Front Neurol. 12, 777845(2021).
- Choi, H., et al. Epilepsy surgery for pharmacoresistant temporal lobe epilepsy: A decision analysis. JAMA. 300, 2497(2008).
- Foldvary, N., et al. Seizure outcome after temporal lobectomy for temporal lobe epilepsy: A Kaplan-Meier survival analysis. Neurology. 54, 630-634 (2000).
- Spencer, S. S., et al. Predicting long-term seizure outcome after resective epilepsy surgery: The multicenter study. Neurology. 65, 912-918 (2005).
- Sperling, M. R., O'Connor, M. J., Saykin, A. J., Plummer, C. Temporal lobectomy for refractory epilepsy. JAMA. 276, 470-475 (1996).
- Wiebe, S. Effectiveness and safety of epilepsy surgery: What is the evidence. CNS Spectr. 9, 120-132 (2004).
- Gilliam, F., et al. Patient-oriented outcome assessment after temporal lobectomy for refractory epilepsy. Neurology. 53, 687-694 (1999).
- Markand, O. N., Salanova, V., Whelihan, E., Emsley, C. L. Health-related quality of life outcome in medically refractory epilepsy treated with anterior temporal lobectomy. Epilepsia. 41, 749-759 (2000).
- Jones, J. E., Berven, N. L., Ramirez, L., Woodard, A., Hermann, B. P. Long-term psychosocial outcomes of anterior temporal lobectomy. Epilepsia. 43, 896-903 (2002).
- Spencer, D. D., Spencer, S. S., Mattson, R. H., Williamson, P. D., Novelly, R. A. Access to the posterior medial temporal lobe structures in the surgical treatment of temporal lobe epilepsy. Neurosurgery. 15, 667-671 (1984).
- Vakharia, V. N., et al. Intraoperative overlay of optic radiation tractography during anteromesial temporal resection: A prospective validation study. J Neurosurg. 1, 1-10 (2021).
- Winston, G. P., et al. Preventing visual field deficits from neurosurgery. Neurology. 83, 604-611 (2014).
- Almairac, F., Herbet, G., Moritz-Gasser, S., de Champfleur, N. M., Duffau, H. The left inferior fronto-occipital fasciculus subserves language semantics: A multilevel lesion study. Brain Struct Funct. 220, 1983-1995 (2015).
- Binding, L. P., Dasgupta, D., Giampiccolo, D., Duncan, J. S., Vos, S. B. Structure and function of language networks in temporal lobe epilepsy. Epilepsia. 63, 1025-1040 (2022).
- Giampiccolo, D., Duffau, H. Controversy over the temporal cortical terminations of the left arcuate fasciculus: A reappraisal. Brain. 145, 1242-1256 (2022).
- Sone, D., et al. Optimal surgical extent for memory and seizure outcome in temporal lobe epilepsy. Ann Neurol. 91, 131-144 (2022).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690-700 (2019).
- Dasgupta, D., et al. Hippocampal resection in temporal lobe epilepsy: Do we need to resect the tail. Epilepsy Res. 190, 107086(2023).
- Wu, C., et al. Effects of surgical targeting in laser interstitial thermal therapy for mesial temporal lobe epilepsy: A multicenter study of 234 patients. Epilepsia. 60, 1171-1183 (2019).
- Wiebe, S. A randomized, controlled trial of surgery for temporal-lobe epilepsy. N Engl J Med. 345 (5), 311-318 (2001).
- Brotis, A. G., et al. A meta-analysis on potential modifiers of LITT efficacy for mesial temporal lobe epilepsy: Seizure-freedom seems to fade with time. Clin Neurol Neurosurg. 205, 106644(2021).
- Borger, V., et al. Resection of piriform cortex predicts seizure freedom in temporal lobe epilepsy. Ann Clin Transl Neurol. 8, 177-189 (2020).
- Borger, V., et al. Temporal lobe epilepsy surgery: Piriform cortex resection impacts seizure control in the long-term. Ann Clin Transl Neurol. 9 (8), 1206-1211 (2022).
- Hwang, B. Y., et al. Piriform cortex ablation volume is associated with seizure outcome in mesial temporal lobe epilepsy. Neurosurgery. 91, 414-421 (2022).
- Piper, R. J., et al. Extent of piriform cortex resection in children with temporal lobe epilepsy. Ann Clin Transl Neurol. 10, 1613-1622 (2023).
- Allison, A. C. The secondary olfactory areas in the human brain. J Anat. 88, 481-488 (1954).
- Ribas, G. C. The cerebral sulci and gyri. Neurosurg Focus. 28, E2(2010).
- Young, J. C., Vaughan, D. N., Paolini, A. G., Jackson, G. D. Electrical stimulation of the piriform cortex for the treatment of epilepsy: A review of the supporting evidence. Epilepsy Behav. 88, 152-161 (2018).
- Mai, J. K., Majtanik, M., Paxinos, G. Atlas of the Human Brain. , Academic Press. Amsterdam Heidelberg. (2016).
- Vaughan, D. N., Jackson, G. D. The piriform cortex and human focal epilepsy. Front Neurol. 5, 259(2014).
- Gale, K. Progression and generalization of seizure discharge: Anatomical and neurochemical substrates. Epilepsia. 29, S15-S34 (1988).
- Löscher, W., Ebert, U. The role of the piriform cortex in kindling. Prog Neurobiol. 50, 427-481 (1996).
- Piredda, S., Gale, K. A crucial epileptogenic site in the deep prepiriform cortex. Nature. 317, 623-625 (1985).
- McIntyre, D. C., Gilby, K. L. Mapping seizure pathways in the temporal lobe. Epilepsia. 49, 23-30 (2008).
- Fahoum, F., Lopes, R., Pittau, F., Dubeau, F., Gotman, J. Widespread epileptic networks in focal epilepsies: EEG-fMRI study. Epilepsia. 53, 1618-1627 (2012).
- Flanagan, D., Badawy, R. A. B., Jackson, G. D. EEG-fMRI in focal epilepsy: Local activation and regional networks. Clin Neurophysiol. 125, 21-31 (2014).
- Laufs, H., et al. Converging PET and fMRI evidence for a common area involved in human focal epilepsies. Neurology. 77, 904-910 (2011).
- Wieser, H. G., et al. Proposal for a new classification of outcome with respect to epileptic seizures following epilepsy surgery. Epilepsia. 42, 282-286 (2001).
- Dasgupta, D., Duncan, J. S. Optimizing epilepsy surgery. ISRCTN Registry. BMC. , Springer Nature. (2020).
- Sparks, R., et al. Automated multiple trajectory planning algorithm for the placement of stereo-electroencephalography (SEEG) electrodes in epilepsy treatment. Int J CARS. 12, 123-136 (2017).
- Dasgupta, D. Improving outcomes in anteromesial temporal lobe resections - A prospective surgical trial integrating multimodal imaging & novel hi-res tractography. , (2022).
- Winston, G. P., et al. Automated T2 relaxometry of the hippocampus for temporal lobe epilepsy. Epilepsia. 58, 1645-1652 (2017).
- Cardoso, M. J., et al. Geodesic information flows: Spatially-variant graphs and their application to segmentation and fusion. IEEE Trans Med Imaging. 34, 1976-1988 (2015).
- Winston, G. P., et al. Automated hippocampal segmentation in patients with epilepsy: Available free online. Epilepsia. 54, 2166-2173 (2013).
- Iqbal, S., et al. Volumetric analysis of the piriform cortex in temporal lobe epilepsy. Epilepsy Res. 185, 106971(2022).
- Leon-Rojas, J. E., et al. Resection of the piriform cortex for temporal lobe epilepsy: a novel approach on imaging segmentation and surgical application. Br J Neurosurg. 1, 1-6 (2021).
- Tournier, J. -D., et al. MRtrix3: A fast, flexible and open software framework for medical image processing and visualization. Neuroimage. 202, 116137(2019).
- Cordero-Grande, L., Christiaens, D., Hutter, J., Price, A. N., Hajnal, J. V. Complex diffusion-weighted image estimation via matrix recovery under general noise models. Neuroimage. 200, 391-404 (2019).
- Vos, S. B., et al. The importance of correcting for signal drift in diffusion MRI. Magn Reson Med. 77, 285-299 (2017).
- Kellner, E., Dhital, B., Kiselev, V. G., Reisert, M. Gibbs-ringing artifact removal based on local subvoxel-shifts. Magn Reson Med. 76, 1574-1581 (2016).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. Neuroimage. 23, S208-S219 (2004).
- Andersson, J. L. R., Sotiropoulos, S. N. An integrated approach to correction for off-resonance effects and subject movement in diffusion MR imaging. Neuroimage. 125, 1063-1078 (2016).
- Leemans, A., Jones, D. K. The B-matrix must be rotated when correcting for subject motion in DTI data. Magn Reson Med. 61, 1336-1349 (2009).
- Tustison, N. J., et al. N4ITK: Improved N3 Bias Correction. IEEE Trans Med Imaging. 29, 1310-1320 (2010).
- Dhollander, T., Raffelt, D., Connelly, A. Unsupervised 3-tissue response function estimation from single-shell or multi-shell diffusion MR data without a co-registered T1 image. ISMRM Workshop on Breaking the Barriers of Diffusion MRI. 5, (2016).
- Binding, L. P., et al. Contribution of white matter fiber bundle damage to language change after surgery for temporal lobe epilepsy. Neurology. 100, e1621-e1633 (2023).
- Giampiccolo, D., et al. Thalamostriatal disconnection underpins long-term seizure freedom in frontal lobe epilepsy surgery. Brain. 146, 2377-2388 (2023).
- Smith, R. E., Tournier, J. -D., Calamante, F., Connelly, A. Anatomically-constrained tractography: Improved diffusion MRI streamlines tractography through effective use of anatomical information. Neuroimage. 62, 1924-1938 (2012).
- Tournier, J. D., Calamante, F., Connelly, A. Improved probabilistic streamlines tractography by 2nd order integration over fibre orientation distributions. Proc 18th Annu Meet ISMRM. 1670, (2010).
- Yasargil, M. G., Fox, J. L. The microsurgical approach to intracranial aneurysms. Surg Neurol. 3, 7-14 (1975).
- Yasargil, M. G., et al. Microsurgical pterional approach to aneurysms of the basilar bifurcation. Surg. Neurol. 6, 83-91 (1976).
- Rao, D., Le, R. T., Fiester, P., Patel, J., Rahmathulla, G. An illustrative review of common modern craniotomies. J Clin Imaging Sci. 10, 81(2020).
- Usui, N., Kondo, A., Nitta, N., Tottori, T., Inoue, Y. Surgical resection of amygdala and uncus. Neurol Med Chir (Tokyo). 58, 377-383 (2018).
- Vivas, A. C., Reintjes, S., Shimony, N., Vale, F. L. Surgery of the amygdala and uncus: A case series of glioneuronal tumors. Acta Neurochir. (Wien). 162, 795-801 (2020).
- Al-Otaibi, F., Baeesa, S. S., Parrent, A. G., Girvin, J. P., Steven, D. Surgical techniques for the treatment of temporal lobe epilepsy. Epilepsy Res Treat. 2012, 1-13 (2012).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690(2019).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。