Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Anteromesiyal Temporal Lob Rezeksiyonlarında Sonuçların İyileştirilmesi - Temporal Piriform Korteksin Rezeke Edilmesinin Bir Gösterimi
Bu Makalede
Özet
Burada, anteromesiyal temporal lob rezeksiyonlarında intraoperatif nöroşirürji rehberliğine bir yaklaşım gösteriyoruz, özellikle piriform korteksin temporal kısmının güvenli rezeksiyonuna yardımcı olmak için traktografi ve anatomik maskelerin kullanımını vurguluyoruz - ilaca dirençli mesial temporal lob epilepsisinde giderek daha önemli bir cerrahi hedef olarak kabul edilen bir alan.
Özet
Anteromesiyal temporal lob rezeksiyonu (ATLR), ilaca dirençli mesial temporal lob epilepsisi (DRmTLE) için yararlı bir tedavi seçeneğidir. Artan kanıtlar, piriform korteksin DRmTLE'de nöbetlerin oluşumunda ve yayılmasında çok önemli bir rol oynadığını ve piriform korteksin temporal kısmının rezeksiyonunun, önemli ölçüde iyileştirilmiş nöbet özgürlüğü oranları ile ilişkili olduğunu göstermektedir.
Burada, yüksek çözünürlüklü preoperatif olasılıklı traktografi algoritmaları ve ilgilenilen yapıların anatomik maskelerini intraoperatif nöronavigasyon ve mikroskop baş üstü ekranına (HUD) kaynaştırarak ATLR'de piriform korteksin temporal kısmının rezeksiyonunu sunuyoruz.
DRmTLE için kapsamlı preoperatif değerlendirme ve incelemeler yapılan tüm hastalar, prosedürün intraoperatif bir videosunu kaydetmek için bilgilendirilmiş, yazılı onay verdiler. Hastalar, büyük bir epilepsi cerrahisi merkezinde epileptologlar, epilepsi beyin cerrahları, nöropsikologlar, nöropsikiyatristler ve elektrofizyologlardan oluşan uzman bir multidisipliner ekip tarafından tanımlandı. Ameliyat öncesi görüntüleme boru hattı, kritik yapıların tanımlanmasını içeriyordu. Bu, temporal piriform korteksi ve risk altındaki temel yollar için yüksek çözünürlüklü olasılıklı traktografiyi içeriyordu (ör., optik radyasyon ve inferior fronto-oksipital fasikül). Bunlar preoperatif volümetrik nöronavigasyon taramasına kaydedildi ve intraoperatif nöronavigasyon sistemine yüklendi.
Burada, piriform korteksin temporal kısmının rezeksiyonu da dahil olmak üzere, ATLR'nin adım adım bir prosedürü sunulmaktadır. Protokol, kritik gri madde yapılarının ve beyaz madde yollarının anatomik maskelerini ameliyathanedeki cerrahi iş akışına entegre etmek için Gelişmiş yapısal ve difüzyon MR görüntüleme ve intraoperatif görsel yardımcıları birleştirir.
Giriş
Anteromesiyal temporal lob rezeksiyonu (ATLR), ilaca dirençli mezial temporal lob epilepsisi (DRmTLE)1,2 için en etkili tedavi olup, %50-%70 nöbet serbestisi oranları ve nispeten düşük morbiditeile 3,4,5. Prosedürün ayrıca yaşam kalitesini 6,7,8, istihdam oranlarını5 ve psikososyal refahı9 iyileştirdiği gösterilmiştir.
Spencer ve ark.10 tarafından tanımlanan kanonik ATLR, temporal kutbun, uncus, amigdala, hipokampus, parahipokampal girus ve fusiform girusun rezeksiyonunu içerir. Görme (optik radyasyon, özellikle Meyer döngüsü11,12) ve dil (örneğin, inferior fronto-oksipital fasikül13 ve kavisli fasikül14,15) ile ilgili kritik beyaz cevher yolları, lateral ventrikülün temporal boynuzuna erişirken yaralanma riski altındadır. Aşağıdaki protokol, yüksek çözünürlüklü preoperatif olasılıklı traktografi ve ilgilenilen yapıların intraoperatif nöronavigasyon ve mikroskobik baş üstü ekranına (HUD) kaynaşmış anatomik maskeler kullanarak bu beyaz cevher yollarından kaçınmaya yönelik bir yaklaşımı özetlemektedir.
Alanın geleneksel anlayışı, maksimal hipokampal rezeksiyonun postoperatif nöbet özgürlüğü oranlarını en üst düzeye çıkarmak için faydalı olduğu yönündedir. Bununla birlikte, ATLR sonrası vakaların son voksel analizleri, ATLR'deki piriform korteksin temporal kısmının rezeksiyonunun nöbet özgürlüğü şansını büyük ölçüde artırdığını göstermektedir. Ayrıca posterior hipokampal rezeksiyon ile nöbet özgürlüğü arasında bir ilişki olmadığını göstermişlerdir16,17. Buna göre, hafıza fonksiyonunu korumak için dil baskın hemisfer ATLR'lerde hipokampal rezeksiyonu hipokampusun ön %55'i ile sınırlayarak Spencer tekniğinin güncellenmesi önerilmiştir16,18.
Yeni minimal invaziv tedavilerin, özellikle lazer interstisyel termal tedavinin (LITT) kullanımına artan bir ilgi olmasına rağmen, cerrahi rezeksiyon ilaca dirençli fokal epilepsi 1 için standart bakım olmaya devam etmektedir ve LITT'nin etkinliğinin, ATLR'ye(%60-%70) kıyasla Engel 1 nöbet sonuçlarının daha düşük bir oranını (%58-%59)1,19 ürettiği gösterilmiştir3, 4,5,20 ve bu nedenle hala daha fazla araştırma gerektiren bir alandır21.
Piriform korteksin (Şekil 1) 16,17,22,23,24 ve25 yaşındaki çocuklarda mezial temporal lob epilepsisi olan hastalarda nöbetlerin yayılmasında ve/veya epileptogenezinde kritik bir bölge olduğu hipotezini destekleyen artan sayıda kanıt bulunmaktadır. Piriform korteks, temporal gövdeye26,27 entorinal sulkus mesialinin etrafına sarılan ve bu nedenle temporal ve frontal lobların birleştiği yeri oluşturan üç katmanlı allokorteksin (hipokampal korteksin düzenlenmesine benzer) bir şerididir. Bu nedenle, literatürde ayrıntılı olarak açıklanan cephesel ve zamansal bölünmelerden oluştuğudüşünülebilir 22,25,28,29,30.
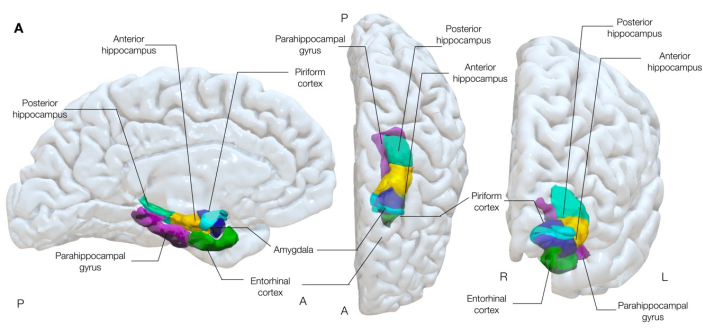
Şekil 1: Beynin mesial temporal yapılarının yarı saydam 3 boyutlu görüntüsü. Bu şekil, piriform korteksin (camgöbeği) çevredeki mesial temporal lob anatomisi ile anatomik ilişkilerini göstermektedir. Sol medial, merkez üst ve sağ ön görünümler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Piriform korteks, amigdalaya süpero-mesiyaldir ve uzun süredir hayvan çalışmalarında, epileptojenik deşarjları31-33 yayan ağlarda ortak bir düğüm olarak kabul edilmiştir ve elektriksel stimülasyonu takiben amigdala ve hipokampus da dahil olmak üzere komşu mezial yapılardan daha kolay nöbetler oluşturur34. Entorhinal, limbik, orbitofrontal ve insular kortekslerin yanı sıra talamus, koku soğancığı, amigdala ve hipokampus ile geniş bağlantıları olan konumu, fokal epilepside epileptojenik deşarjların önemli bir yayılma yolu olarak da rol oynar30.
EEG-fMRI ve pozitron emisyon tomografisi (PET) çalışmaları, DRmTLE'de piriform korteksin önemli bir rolünü daha da desteklemektedir, interiktal aktivasyonu gösterir ve piriform kortekste azalmış γ-Aminobütirik asit tip A (GABAA) reseptör bağlanması, artmış nöbet aktivitesi ile ilişkilidir 35,36,37.
DRmTLE'de yakın zamanda yapılan iki önemli görüntüleme çalışması, postoperatif nöbet özgürlüğünün piriform korteksin daha büyük ölçüde rezeksiyonu ile ilişkili olduğunu göstermiştir; Galovic ve ark. geniş bir retrospektif kohortta piriform korteksin en az yarısının çıkarılmasının nöbetsiz kalma olasılığını 16 kat artırdığını göstermiştir (%95 CI, 5-47; P < 0.001)17. Ayrıca, diğer mezial temporal yapıların rezeksiyon hacimlerinin nöbet özgürlüğü ile ilişkili olmadığı gösterildi, bu bulgu Sone ve arkadaşları tarafından yapılan voksel bilge analizlerle tekrarlandı ve desteklendi, bu da sol TLE'de sadece piriform korteks rezeksiyonunun nöbet özgürlüğü ile ilişkili olduğunu gösterdi16 (Şekil 2).
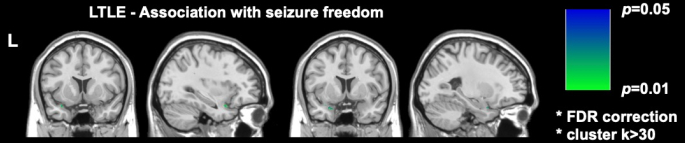
Şekil 2: Sol TLE'de postoperatif nöbet özgürlüğü ile voksel açısından ilişki. Nöbet özgürlüğü ile anlamlı olarak ilişkili olan tek alan, piriform korteksin temporal kısmıdır, p = 0.01 (koronal ve sagital T1 ağırlıklı MRG dilimlerinde yeşil). Sone ve ark.16'dan izin alınarak uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Borger ve ark. ayrıca geniş bir retrospektif kohortta sadece rezeke edilen temporal piriform korteks oranının hem 1 yıl3'te hem de daha uzun takipte (ortalama 3.75 yıl) nöbet serbestliği oranlarında iyileşme ile ilişkili olduğunu göstermiştir23. Ayrıca, hipokampus ve amigdala'nın rezeke edilen hacminin nöbet özgürlüğünü öngörmediğini doğruladılar.
mTLE'de piriform korteksin anormal epileptojenik ağdan bağlantısının kesilmesinin önemi LITT'de de gösterilmiştir, Hwang ve ark. 6 aylık takipte yüzde piriform korteks ablasyonunun ILAE sınıf 1 sonuçları38 (OR 1.051,% 95 CI 1.001-1.117, p = 0.045) ile ilişkili olduğunu göstermiştir, ancak bunun 1 yılda anlamlı olmayan bir eğilim olduğunu5. Bu, LITT ile ilgili ortaya çıkan verileri, nöbet sonuçlarında pozitif, ancak potansiyel olarak daha az kalıcı bir iyileşme olduğunu ve bu da LITT'nin yaygın olarak "birinci aşama" bir prosedür olarak kullanılmasına yol açtığını ve nöbet özgürlüğünün elde edilemediği kişilere rezektif cerrahi sunulduğunu desteklemektedir.
Bu nedenle, piriform korteksin temporal kısmının rezeksiyonunun, ilaca dirençli mesial temporal lob epilepsisinde nöbet özgürlüğünün sağlanmasında anahtar bir hedef olduğuna dair güçlü kanıtlar vardır. Bununla birlikte, Galovic ve ark.'nın retrospektif kohortunda gösterildiği gibi, bu entorinal korteks şeridi, bir ATLR gerçekleştirirken cerrahi olarak hedeflenmesi zor bir konumdadır, yani doğrudan hedeflenmezse, her zaman başarılı bir şekilde çıkarılmaz. Bu çalışmada, devam eden prospektif bir cerrahi çalışmanın parçası olarak piriform korteksin temporal kısmının nasıl güvenli bir şekilde hedefleneceğini ve rezeke edileceğini, ameliyat sonrası nöbet serbestlik oranlarını iyileştirme üzerindeki etkisini değerlendirmek için gösteriyoruz39.
Aşağıdaki protokolün odak noktası, görüntü elde etme ve işlemenin teknik yönleri, cerrahi yaklaşım ve ATLR'de piriform korteksin temporal kısmının rezeksiyonunu nasıl sağladığımız, aynı zamanda yüksek çözünürlüklü preoperatif olasılıklı traktografi ve ilgilenilen yapıların kaynaşmış anatomik maskelerini intraoperatif nöronavigasyon ve mikroskop baş üstü ekranına (HUD) entegre etmektir. Protokol ayrıca, cerrahi inceleme ve planlama için multimodal görüntülemenin 3 boyutlu görüntülenmesine ve entegrasyonuna izin veren özel bir planlama yazılımı platformu40 ve operatif mikroskop ile entegrasyona izin veren bir nöronavigasyon sistemi kullanır (ayrıntılar Malzeme Tablosunda ayrıntılı olarak açıklanmıştır).
Access restricted. Please log in or start a trial to view this content.
Protokol
Bu yöntemler ve protokoller, Sağlık Araştırma Kurumu tarafından 10/09/2020 tarihinde onaylanan devam eden prospektif bir cerrahi çalışmanın parçasıdır, Araştırma Etik Kurulu (REC) Londra referansı: 20/LO/0966. Protokol ileriye dönük olarak tescil edildi: ISRCTN72646265, 25/09/2020 tarihinde çevrimiçi olarak mevcuttur39 ve ulusal bir konferanstasunulmuştur 41.
Aşağıdaki protokol, 18-70 yaş arası hastalarda (uzman erişkin epilepsi cerrahisi merkezimizde bu endikasyon için ameliyat edilen hastaların yaş grubu) DRmTLE için ATLR uygulanan tüm hastalara uygulanır ve hepsi aynı cerrahlar tarafından ameliyat edilir (AWM,). Tüm katılımcılar çalışmaya dahil edilmeden önce bilgilendirilmiş onam verdiler. Tüm katılımcılara, beyin cerrahları, epilepsi nörologları, nöropsikologlar, psikiyatristler, nöroradyologlar ve uzman epilepsi tedavileri hizmetlerinin diğer üyelerinden oluşan yazarların kapsamlı epilepsi cerrahisi merkezinde uzman cerrahi epilepsi multidisipliner ekibi tarafından yönetilen kapsamlı bir preoperatif değerlendirme ve araştırma yapıldı. Ameliyattan önce, hepsinde aşağıdaki protokolde belirtildiği gibi güncel hacimsel T1, T2 ve FLAIR MRG'lerin yanı sıra standart preoperatif kan ve nöro anestezi ekibi tarafından yapılan bir inceleme vardı ve genel anestezi altında cerrahiye devam etmek için güvenli olduklarından emin olundu. Bu çalışmada kullanılan reaktiflerin ve ekipmanların ticari detayları Malzeme Tablosunda verilmiştir.
1. Görüntüleme alımı ve işlenmesi
NOT: Merkezimizde epilepsi cerrahisi geçiren kişilerde yüksek çözünürlüklü cerrahi öncesi, 3 aylık ve 1 yıllık cerrahi sonrası manyetik rezonans görüntüleme (MRG) taramaları rutin olarak yapılmaktadır. MRG verileri, tutarlılık için Mart 2020 ile Mart 2024 arasında aynı MRG tarayıcısında elde edildi. Standartlaştırılmış görüntü alımı ve işleme bileşenlerinin çoğu literatürde daha önce tanımlanmıştır ve aşağıda özetlenen protokolde uygun şekilde atıfta bulunulmuştur:
- Aşağıdaki MRI dizilerini edinin:
- Standart bir 3D izometrik (1 mm) T1 ağırlıklı dizi, ters çevirme-kurtarma hızlı bozulmuş gradyan geri çağrıldı (IR-FSPGR) yankı [yankı süresi (TE) 3.1 ms, tekrarlama süresi (TR) = 7.4 ms, ters çevirme süresi = 400 ms, görüş alanı (FOV) = 224 × 256 × 256 mm, matris = 224 × 256 × 256, voksel boyutu = 1.00 × 1.00 × 1.00 mm = 1.00 mm3, paralel görüntüleme hızlanma faktörü = 2] ve;
- T2 relaksometre42 için kullanılan bir koronal çift eko hızlı iyileşme hızlı spin yankı proton yoğunluğu/T2 ağırlıklı dizi (TE = 30/119 ms, TR = 7600 ms, FOV = 220 × 220 mm, matris = 512 × 512, dilim kalınlığı = 4 mm, voksel boyutu = 0.43 × 0.43 × 4.00 mm = 0.74 mm3, SENSE faktörü = 2).
- NiftyWeb43 kullanarak beyni 162 anatomik bölgeye ayırmak için jeodezik bilgi akışları (GIF v3) algoritmasına girdi olarak yukarıdaki T1 ağırlıklı diziyi kullanın.
- GIF parselasyonlarını (parahipokampal girus, fusiform girus) kullanarak ilgilenilen yapıların anatomik maskelerini üretin, hipokampal profil oluşturma bilgileri oluşturun ve Hipposeg44 kullanarak hipokampusu ön %55 ve arka %45 olarak segmentlere ayırın, bunları hastanın hacimsel preoperatif görüntülemesi üzerindeki planlama yazılımına yerleştirin (adım 1.1'de olduğu gibi).
- Otomatik piriform korteks segmentasyonu gerçekleştirin ve piriform korteksi, laboratuvarımız 17,45,46'daki önceki çalışmalarda açıklanan hacimsel tekniklerden frontal ve temporal bileşenlere ayırın. Oluşturulduktan sonra, bu maskeleri hastanın ameliyat öncesi görüntülemesinin üzerine yerleştirin.
- Aşağıdaki Difüzyon MRI görüntülerini edinin:
- Standart çözünürlüklü çok kabuklu edinim (2 mm izotropik çözünürlük, 0, 300, 700, 2500 s/mm2 b değerlerinde 11, 8, 32 ve 64 gradyan yönü) ve;
- Yüksek çözünürlüklü çok kabuklu çekim (1,6 mm izotropik çözünürlük, 101 yön, 14 b0, b değerleri: 300, 700 ve 2500 s/mm2).
- Elde edilen difüzyon verilerini MRtrix3 (https://mrtrix.org)47 kullanarak düzeltin:
- MRtrix348'de "dwidenoise" kullanan gürültü.
- Sinyal kayması49.
- MRtrix350'de "mrdegibs" kullanarak Gibbs zil sesi.
- FSL TOPUP algoritması ile ters faz kodlama gradyanı kullanılarak bozulma (https://fsl.fmrib.ox.ac.uk/fsl51).
- FSL'nin girdap algoritması (https://fsl.fmrib.ox.ac.uk/fsl)52 kullanılarak girdap akımları ve hareket artefaktları, b vektörlerini53 döndürerek.
- ANTs algoritması kullanılarak yanlılık alanı (https://mrtrix.org47,54).
- Beyaz ve gri madde ve beyin omurilik sıvısı (BOS) için yanıt fonksiyonlarını tahmin etmek için çok kabuklu, çok dokulu Kısıtlı Küresel Dekonvolüsyon (CSD)55 kullanın.
- İlgilenilen lif demetlerini yeniden yapılandırmak için Anatomik Olarak Hedeflenmiş Otomatik Traktografi gerçekleştirin 12,56,57: optik radyasyon, inferior fronto-oksipital fasikül (IFOF; dil baskın vakalar) ve orta longitudinal fasikül (MLF; dil baskın olmayan vakalar). Aşağıdaki adımları takip et.
- Her lif demeti için kortikal sonlandırma noktalarını çıkarın ve bunları tohum ve sonlandırma ROI'si olarak gruplandırın.
- Sonlandırılmayan kortikal bölgeleri kullanarak dışlama kortikal bölgeleri ve ROI oluşturun.
- MRtrix347'de hibrit yüzey ve hacim segmentasyonu kullanarak olasılıksal lif izleme algoritması iFOD259 aracılığıyla anatomik olarak kısıtlı traktografi58 gerçekleştirin ve 300 milyon tohumdan maksimum 5.000 akış çizgisi seçin.
- Adım 1.8.3'teki traktografiyi her bir fiber demeti için iki kez gerçekleştirin, tohumu ve sonlandırma ROI'sini değiştirin.
- Elde edilen fiber demetlerini 0,01 değerinde eşiklenmiş olasılıksal haritalara dönüştürün - bunları sahte akış çizgilerini kaldırmak için ek bir dışlama kriteri olarak kullanın.
- Elde edilen lif demetlerini (2 mm genaşlanmış) ve anatomik maskeleri anatomik olarak doğru olduklarından emin olmak için planlama yazılımında gözden geçirin (bu adım ünitemizdeki iki epilepsi beyin cerrahı tarafından gerçekleştirilir).
- Elde edilen anatomik gri cevher ve beyaz cevher yolu maskelerini adım 1.1'deki referans T1 ağırlıklı MR görüntüsüne uzamsal olarak kaydedin ve intraoperatif MRI (iMRI) ameliyathanesindeki intraoperatif navigasyon sistemine yükleyin.
- Ameliyattan hemen önce (< 24 saat) hastanın kafa derisindeki cilt referansları ile T1, T2 ve T2-FLAIR ağırlıklı hacimsel MRI görüntüleri elde edin. Bu görüntüleri birbirine ve yukarıda açıklanan ve Şekil 3'te gösterilen T1 ağırlıklı referans görüntüsüne ve maskelere birlikte kaydedin.
- Hastayı yüzey eşleşen bir lazer ve akıllı işaretçi ile nöro-navigasyon sistemine kaydedin.
- Doğruluğu sağlamak için vaka başlamadan önce görüntü ortak kaydının ve hastanın doğruluğunu iki epilepsi beyin cerrahı ile doğrulayın.
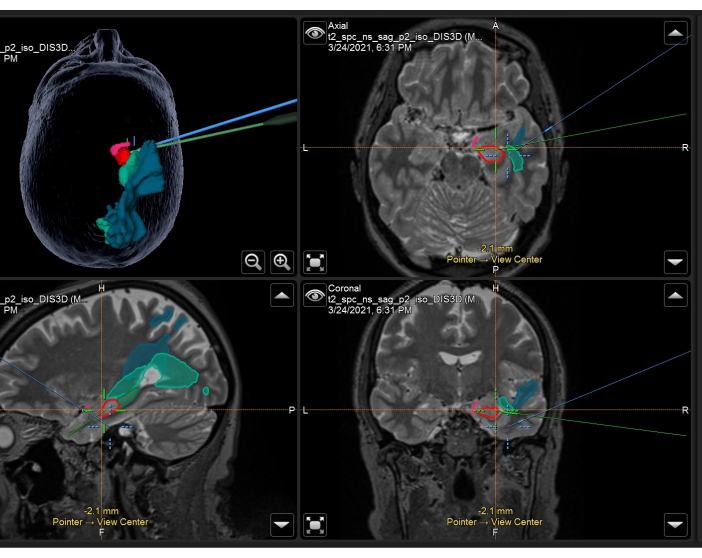
Şekil 3: Sağ ATLR'de intraoperatif olarak kullanılan anatomik maskeler ve traktlar ile birlikte volumetrik T2 ağırlıklı MRG'yi gösteren nöronavigasyon sisteminin ekran görüntüsü. Sol üst panel: Anatomik maskeleri gösteren, hastanın kafasının 3 boyutlu rekonstrüksiyonu. Sağ üst: eksenel, Sol alt: sagital ve sağ alt: T2 ağırlıklı hacimsel MRI taramasında üst üste bindirilmiş anatomik maskeleri de gösteren koronal görünümler. Görüntülenen anatomik maskeler: piriform korteksin temporal kısmı (pembe), hipokampusun ön %55'i (kırmızı), hipokampusun posterior %45'i (koyu yeşil, sadece sagital görüntüde görülür), optik radyasyon (orta yeşil), orta longitudinal fasikül (mavi). Mavi artı işareti, mikroskobun odağının entegre konumudur ve yeşil artı işareti, cerrahi alanda kullanılan nöronavigasyon işaretçisinin konumudur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Cerrahi teknik
NOT: Aşağıdaki adımlar, yazarların merkezindeki uygulamayı özetlemektedir ve bir ATLR'ye yönelik tek cerrahi yaklaşımın bir açıklaması olması amaçlanmamıştır, daha ziyade yazarların temporal piriform korteksin rezeksiyonu da dahil olmak üzere güvenilir ve tekrarlanabilir rezeksiyonlar sağlamak için bu prosedüre yaklaşımı nasıl standartlaştırdıklarının bir gösterimi olarak tasarlanmıştır.
- Konumlandırma ve yaklaşım
- Standart ameliyat öncesi kontroller ve güvenlik önlemlerini takiben, hastayı sırtüstü yatırın, ipsilateral omzunu bir rulo ile kaldırın ve başı karşı tarafa çevirin.
- Malar eminensinin cerrahi alanın en yüksek noktası olduğundan emin olmak için başı yanal olarak esnetin ve pimlere sabitleyin (3 noktalı kafatası sabitleme cihazı - Malzeme Tablosundaki intraoperatif [iMRI] tiyatrolarla uyumlu olanlar da dahil olmak üzere örneklere bakın).
NOT: Konumlandırma, malar eminensinin cerrahi alanın en yüksek noktası olmasını sağlamak için mesial ve posterior temporal lob yapılarına, özellikle lateral fleksiyona yeterli erişim sağlamak için çok önemlidir. - İğne bölgelerine ve cilt kesisine lokal anestezik sızın.
- Cilt referansları ve yüzey izlemenin bir kombinasyonunu kullanarak (kullanılan nöronavigasyon sisteminin markasına özgü) hasta alanını nöronavigasyon sistemine kaydedin. Elle tutulur veya görünür kemikli / diğer anatomik işaretlere karşı kayıt doğruluğunu onaylayın.
- Zigoma'nın saç çizgisini ve kökünü işaretleyin (manuel palpasyon ile tanımlanır). Nöronavigasyonu ve planlanan eğrisel frontotemporal 'soru işareti' cilt insizyonunu kullanarak Sylvian fissürünün seyrini tanımlayın ve işaretleyin.
- Elektrikli saç kesme makineleri kullanarak planlanan cilt kesisi boyunca tüyleri alın.
- Fasiyal sinirin frontotemporal dalının yaralanmasını önlemek için tragusa 1 cm önden soru işareti şeklinde kıvrılarak frontotemporal bir kesi yapın. Mümkünse yüzeysel temporal arteri tanımlayın ve koruyun. Deri kesisinin konumlandırılması ve işaretlenmesi Şekil 4'te gösterilmiştir.
- Yara kenarlarını antimikrobiyal ıslatılmış mastoid swablar ve Raney klipsleri ile örtün ve sabitleyin.
- Temporalis kasını kesin ve miyokutanöz veya interfasyal/subfasiyal flepte yükseltin (fasiyal sinirin frontotemporal dalının yaralanmasını önleyin).
- Cilt flebini antimikrobiyal solüsyona batırılmış gazlı bezle sarın ve öne doğru geri çekin (iMRI tiyatrolarında ise metal sabitleme aletleri kullanmaktan kaçının).
- Bir perforatör matkapla kafatasında 2 çapak deliği oluşturun: ilki, alt maruziyeti en üst düzeye çıkarmak için zigoma kökünün hemen üzerinde, ikincisi Sylvian fissürünün görselleştirilmesini kolaylaştırmak için alt frontal.
- Standart bir frontotemporal kraniotomi60,61,62 gerçekleştirin ve üst ve orta temporal girusu Sylvian fissürünün 1 cm yukarısında açığa çıkarın.
- Orta temporal fossa tabanına ve anterior olarak temporal direğe kolay erişim sağlamak için kraniotominin ön ve alt kenarlarını delin. Mastoid hava hücreleri ile karşılaşılırsa, bunları hem karşılaştıklarında hem de işlem sonunda kemiğe yüzeysel tabakaları kapatmadan önce kemik mumu ve fibrin yapıştırıcı ile kapatın.
NOT: Kraniotominin orta kraniyal fossanın tabanına erişime izin vermesini sağlamak önemlidir, çünkü bu, kollateral sulkus yoluyla lateral ventrikülün temporal boynuzuna yaklaşım olacaktır. Ameliyat sonrası BOS sızıntısını ve bunun sonucunda ortaya çıkan semptomları ve potansiyel enfeksiyonları önlemek için karşılaşılan mastoid hava hücrelerini iyice kapatmak da önemlidir. - Dura'yı U şeklinde açın, taban öne doğru yansıtılmış ve yıldız şeklinde uzatılmıştır. Dura'yı dikişlerle (3-0 ipek gibi) ameliyat alanından uzaklaştırın.
- BOS'u orta kraniyal fossa tabanından ve orta kraniyal fossanın ön yönünden serbest bırakın.
NOT: BOS serbest bırakma adımı, bazal temporal lob üzerinde geri çekilme ve zorlanma olmaksızın orta kraniyal fossa tabanına ve kollateral sulkusa aşağıdan cerrahi olarak erişmek için yeterli çalışma alanına izin vermek için önemlidir.
- Lateral neokortikal kaldırma
- Orta ve inferior temporal girusun piasını (sırasıyla MTG ve ITG) kafatası tabanına dik bir çizgide ve lateral ventrikülün temporal boynuzunun ön çıkıntısı ile aynı hizada (nöronavigasyon sisteminde onaylanmıştır) pıhtılaştırın. Bu çizginin ön-arka kapsamını, nöbet başlangıcında / yayılımında lateral neokortikal tutulumun cerrahi öncesi kanıtlarına bağlı olarak vaka bazında uyarlayın.
NOT: Lateral neokortikal rezeksiyonun ön-arka kapsamı, nöbet yayılımına katılımının preoperatif kanıtlarını (veya bunların eksikliğini) dikkate almalıdır ve bu, bireysel hasta için uyarlanmıştır. - Orta kraniyal fossa tabanını ortaya çıkarmak ve parahipokampal girusa lateral ve fusiform girusa medial olan kollateral sulkusu tanımlamak için ITG'de transkortikal bir yaklaşım kullanın.
- Superior temporal gyrusun (STG) pia'sını, Sylvian fissürünün yönüne paralel olarak, yukarıdaki lateral neokortikal insizyona pıhtılaştırın. Bu, adım 2.16'da açıklanan çizgiye diktir ve temporal kutba öne doğru uzanır.
- Orta serebral arterin dallarını koruyarak subpial diseksiyon tekniklerini kullanarak STG ve Sylvian fissür arasındaki düzlemi geliştirin ve bu diseksiyonu Sylvian fissürünün yatay kısmına, insulanın inferior limitan sulkus seviyesine kadar taşıyın.
NOT: Adım 2.2.4'te subpial diseksiyon yapılırken Sylvian fissürünü sınırlayan STG'nin piasının bütünlüğünün korunmasına özen gösterilmelidir, çünkü bu, fissürdeki orta serebral arterin dallarını ve ayrıca okülomotor sinir ve posterior komünikan arter (adım 2.2.14) ve optik trakt (adım 2.3) gibi diğer yapıları operasyonun ilerleyen aşamalarında korur. - Mikroskobu nöronavigasyon sistemi ile entegre edin.
- Bölüm 1'de açıklanan anatomik maskelerin nesne kaplamalarının doğruluğunu onaylayın ve bunları mikroskop HUD'sinde görselleştirin.
- STG'nin rezeksiyonunu en aza indirmek için posterior rezeksiyon hattını anterior olarak süperior olarak eğin ve MTG ve ITG boyunca fusiform girus yoluyla kollateral sulkusa doğru aşamalı olarak uzatın.
- Optik radyasyon (OR) maskesi görselleştirilirken posterior rezeksiyon sınırının nöronavigasyon sistemi ile ilişkisini kontrol edin.
- Ameliyathane maskesinin maksimum ön kapsamını mikroskopta görselleştirin ve Şekil 5'te gösterildiği gibi ameliyathaneye ameliyat sonrası görme alanı açığına neden olacak şekilde ameliyathaneye zarar vermemek için mikroskop HUD'deki rezeksiyon sınırının arkasında olduğundan emin olun.
NOT: Adım 2.2.9, Meyer'in optik radyasyon döngüsündeki hasara bağlı ameliyat sonrası görme alanı açığını önlemek için kritik bir adımdır. Çok fazla beyin kayması varsa ve cerrah optik radyasyona zarar verme riskini daha da en aza indirmek istiyorsa veya mikroskobun HUD'sindeki projeksiyonlar doğru çalışmıyorsa, yazarlar yaklaşımı hedeflemek için nöronavigasyon işaretçisinin kullanılmasını önermektedir. lateral ventrikülün temporal boynuzunun en ön ucuna, çünkü bu, ameliyathane yaralanma riskini en aza indirir. - Şekil 6'da gösterildiği gibi, temporal korna ile karşılaşılana kadar kollateral sulkusu superior şekilde takip edin (bunu nöronavigasyon sisteminde onaylayın). Temporal boynuzun duvarı mavi tonlu ependima ile tanımlanabilir.
NOT: Patolojinin hipokampal skleroz olmadığı ve hipokampal başın hantal olduğu kişilerde ventrikülün bulunması zor olabilir. Bu durumlarda, bir sorun giderme seçeneği, ventrikül ucunun nereye çıktığını bulmak için herhangi bir kaymanın olmadığı medial temporal fossanın tabanındaki nöronavigasyon işaretçisini kullanmaktır. Normalde bunu koronal bir düzlemde aramak yararlıdır. Ventrikül bulunamazsa, önce direği çıkarmanızı ve ardından ultrasonik aspiratör ile ventrikülü bulmanızı öneririz. - Temporal boynuz maruziyetine lateral bazal temporal leptomeningleri bölün.
- Hipokampal başı ortaya çıkarmak için ventrikülü öne doğru açın ( Şekil 6'da gösterildiği gibi).
- Ventrikül bağlantısının kesilmesini birleştirmek için posterior rezeksiyon marjını uzatın ve bu neokortikal bloğun bağlantısının kesilmesine izin verir.
- Tentorial kenarın kenarındaki diseksiyon çizgisini takip ederek temporal kutbu harekete geçirin. Okülomotor sinir ve posterior komünikan arter dahil olmak üzere mesial yapıların yaralanmasını önlemek için bağlantı kesme işlemini tentoriumun kenarı üzerinden yapmamaya dikkat edin.
NOT: Cisterna cruralis'teki yapılara zarar verme riskini azaltmak için, çadırın kenarını aşmadan tentoriumun kenarının şeklini takip edin. Uncus yerinde kalacaktır ve ayrı bir örnek olarak alınabilir.
- Orta ve inferior temporal girusun piasını (sırasıyla MTG ve ITG) kafatası tabanına dik bir çizgide ve lateral ventrikülün temporal boynuzunun ön çıkıntısı ile aynı hizada (nöronavigasyon sisteminde onaylanmıştır) pıhtılaştırın. Bu çizginin ön-arka kapsamını, nöbet başlangıcında / yayılımında lateral neokortikal tutulumun cerrahi öncesi kanıtlarına bağlı olarak vaka bazında uyarlayın.
- Temporal piriform korteks dahil olmak üzere mezial temporal rezeksiyon
- Okülomotor sinir ve posterior komünikan arter görünene kadar diseksiyon ve ultrasonik aspiratörün mesial kullanımı ile uncus dokusunu temizleyin. Pes (hipokampal başın en mesiyal kapsamı) görüntülendiğinde posterior rezeksiyonun kapsamını durdurun.
- Amigdala rezeksiyonunu, endorhinal sulkusun pia'sı tarafından üst kısımda ve optik kanal görüntülenene kadar ve mesial olarak bazal sarnıçların piyal düzlemi ile sınırlı olan ultrasonik aspiratör ile gerçekleştirin.
NOT: Adım 2.3.2'yi gerçekleştirirken temporal gövdeyi korumaya ve frontal loba girmemeye dikkat edin. Bazen, beyin kayması nedeniyle, nöronavigasyon rezeksiyonun derecesini mezial olarak abartabilir; Bu bağlamda, optik yol PIA aracılığıyla görüntülenene kadar rezeksiyonun devam etmesi güvenlidir ve bu, rezeksiyonun mezial sınırını temsil eder. Bu aynı zamanda Usui ve ark.63'tede tanımlanmıştır: Amigdalanın dorsal kenarı, genellikle koroidal noktayı proksimal orta serebral arter bifurkasyonuna bağlayan hayali bir çizgi ile yaklaşık olarak tanımlanır64. - Piriform korteksin temporal kısmının, insula'nın inferior dairesel sulkusunun damarı görüntülenene kadar Sylvian fissürünün temporal tarafından aşağı doğru ilerleyen subpial diseksiyon yoluyla herhangi bir kalıntı dokuyu çıkararak rezeke edildiğinden emin olun. Bu, Usui ve ark. amigdalar-unkal lezyonları rezeke ederken tarif edilene benzer bir rezeksiyon sınırıdır63.
NOT: Uncus (adım 2.3.1'de) veya piriform korteksin çıkarılması zorsa (bazen pia materyaline çok yapışık olabilirler), yazarlar pia materyalinin yaralanmasını en aza indirmek için ultrasonik aspiratör yerine bir Rhoton disektörünün kullanılmasını önermektedir. - Şekil 7'de gösterildiği gibi, mikroskop HUD üzerine yerleştirilmiş adım 1.4'te açıklanan anatomik maskeyi kullanarak piriform korteksin temporal kısmının rezeksiyonunu onaylayın.
- Hipokampal rezeksiyon
- Fimbria hippocampus'u görselleştirmeyi kolaylaştırmak için koroid pleksusu (ve ön koroidal arteri) mesiyal olarak geri çekmek için linteenleri (veya benzer geniş pamukluları) yerleştirin.
- Fimbria hippocampi'yi araknoid bağlantısından ayırın ve Ammon'un boynuz arteriyel vasküler pasajını taşıyan hipokampal sulkusu açığa çıkarın.
- Hipokampusu kuyruğundan ayırın (16'da belirtildiği gibi sözel hafıza eksikliklerini en aza indirmek amacıyla dil baskın hemisfer rezeksiyonlarında bu rezeksiyonu hipokampusun ön %55'i ile sınırlayın veya dil baskın olmayan hemisfer rezeksiyonlarında orta beynin tektum seviyesi kadar arkaya doğru uzatın).
- Hipokampal kafayı pes hipokampisinden ayırın. Hipokampal arteriyel arcade'yi gerektiği gibi pıhtılaştırın.
- Bağlantısı kesilmiş hipokampusu blok halinde çıkarın.
- Parahipokampal girus ve subikulumun subpial diseksiyonunu yapın ve ortaya çıkan cerrahi boşlukta hemostaz sağlayın. Beyin sapını görselleştirerek ve koruyarak pes hipokampisini çıkarın.
NOT: Adım 2.4.7'yi gerçekleştirirken dikkatli olunmalıdır, çünkü bu seviyede pes ile beyin sapı arasında koruyucu bir piyal sınır yoktur.
- İntraoperatif görüntüleme ve kapatma
- Tüm metal öğeleri cerrahi alandan çıkarın, yarayı örtün ve tipik olarak hacimsel T1, T2, FLAIR ve DWI dizileri dahil olmak üzere intraoperatif bir MRI taraması yapın.
- İstenilen miktarda mezial temporal lob yapılarının (piriform korteksin temporal kısmı ve yukarıda adım 2.36'da belirtildiği gibi değişken hipokampus miktarları dahil) başarılı bir şekilde rezeke edildiğinden emin olmak için iki epilepsi danışmanı beyin cerrahı ile birlikte bir danışman nöroradyolog ile intraoperatif görüntülemeyi gözden geçirin. Ayrıca, işlem sırasında herhangi bir iskemi alanına neden olmadığından emin olmak için DWI görüntülemeyi gözden geçirin.
- Yukarıdakiler onaylandıktan sonra, hastayı ameliyat masasına geri aktarın ve hasta için normotension'da cerrahi boşlukta hemostazı doğrulayın.
- Yarayı standart bir şekilde kapatın, kemik flebini değiştirin, bunu 3 noktadan plakalar ve vidalarla sabitleyin ve kas, fasya ve cilt katmanlarını dikişlerle standart bir şekilde kapatın ve 24 saat boyunca cerrahi yara drenini yerinde bırakın.
NOT: Ameliyat sonrası bakım, yazarların merkezinde, tipik olarak ilk 24 saat boyunca nöroşirürji yüksek bağımlılık ünitesindedir, ardından yüksek bağımlılık ünitesi bunun uygun olduğunu düşündüğünde bir beyin cerrahisi uzmanı koğuşuna adım atılır. Hastalar nörolojik gözlemleri için izlenir, üre ve elektrolitler dahil olmak üzere postoperatif kan, tam kan sayımı ve diferansiyelleri vardır ve tipik olarak ameliyattan yaklaşık 72 saat sonra taburcu edilirler. Daha sonra 4-6 hafta ayaktan takip edilirler ve ameliyat sonrası en az 3-4 ay ve 1 yıl sonra aralıklı görüntüleme ile takip edilirler.
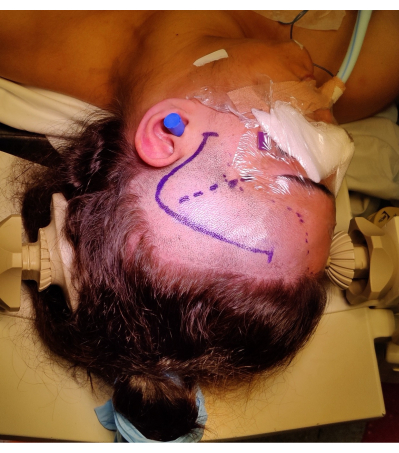
Şekil 4: Hastanın sağ frontotemporal cilt insizyonu, saç çizgisi ve Sylvian fissürü 'soru işareti' işaretini gösteren sağ ATLR için pozisyonunun görüntüsü. Resimde olmayan, hastanın boynuna aşırı yük bindirmeden ve venöz dönüşü engellemeden başın pozisyon açısına izin vermek için hastanın sol omzunun altındaki sol omuz rulosudur. Görüntüler çekildi ve hastanın rızası ile dahil edildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
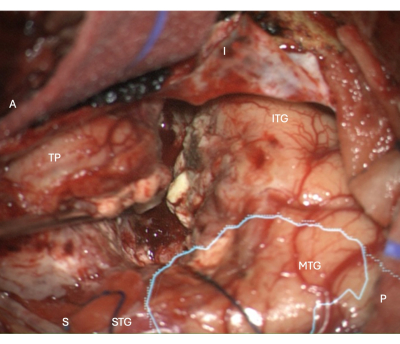
Şekil 5: Sağ ATLR'de lateral neokortikal rezeksiyon sınırını gösteren mikroskoptan alınan intraoperatif görüntü, optik radyasyonun üst üste bindirilmiş anatomik maskesi (camgöbeği) - rezeksiyon sınırının ameliyathanenin önünde olduğunu gösterir. Etiketler, operatif görünümün yönünü gösterir: A = ön, P = arka, I = aşağı, S = üstün, STG = üstün temporal girus, MTG = orta temporal girus, ITG = alt temporal girus, TP = Temporal Kutup. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
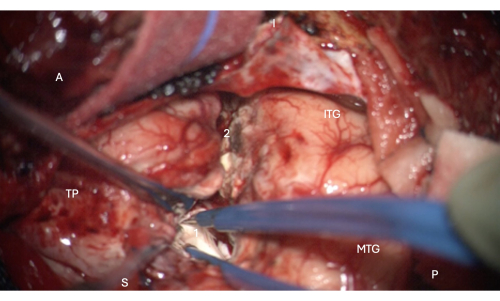
Şekil 6: Lateral ventrikülün temporal boynuzunun ön kısmına girişi gösteren mikroskoptan alınan intraoperatif görüntü ve içindeki hipokampal başı gösteren görüntü (soluk beyaz, 1). Etiketler: A = ön, P = arka, I= aşağı, S = üstün, MTG = orta temporal girus, ITG = alt temporal girus, 2 = lateral neokortikal rezeksiyon sınırı, lateral ventrikülün temporal boynuzunu bulmak için derinlikte kollateral sulkusu üstün olarak takip etmek, TP = Temporal Kutup. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
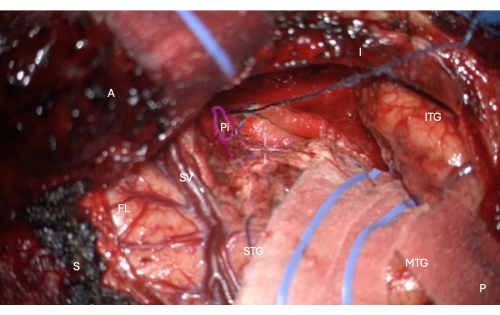
Şekil 7: Piriform korteksin temporal kısmının anatomik maskesinin HUD kaplamasını gösteren mikroskoptan alınan intraoperatif görüntü (pembe anahat, Pi olarak etiketlenmiş). Bu şekil tam rezeksiyonu göstermektedir - kalan beyin dokusu yoktur, sadece endorhinal sulkusun rezeksiyona mesial pial sınırı, bu görüntüde görüntüdeki uzunlamasına köfte ile korunmaktadır, mikroskop HUD'nin merkezi beyaz artı işaretinin hemen üzerinde. Etiketler: A = ön, P = arka, I = aşağı, S = üstün, STG = Üst temporal girus, MTG = orta temporal girus, ITG = alt temporal girus, FL = frontal lob, SV = Sylvian damarları (Sylvian fissürünün üstünde), Pi = piriform korteksin temporal kısmı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Bu protokol ve cerrahi teknikler, temporal piriform korteks rezeksiyonunun etkilerini ve DRmTLE için ATLR'yi takiben nöbet özgürlüğü üzerindeki etkisini sorgulayan devam eden bir çalışma kapsamında uygulanmıştır. Bu çalışmanın amacı, literatürde giderek artan retrospektif verilerin önerdiği gibi, temporal piriform korteksin çıkarılmasından sonra nöbet serbestliğinin DRmTLE'de nöbet özgürlüğünü gerçekten iyileştirip iyileştirmediğini prospektif olar...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu protokol, piriform korteksin temporal kısmının güvenilir, hedefli bir rezeksiyonunu sağlar - mezial temporal lob epilepsi ağının epileptogenezinde ve yayılmasında çok önemli bir yapı olduğu varsayılmaktadır 16,17,24,25,30.
Merkezimizde gerçekleştirdiğimiz standart ATLR tekniği...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar Debayan Dasgupta ve John S. Duncan, Wellcome Trust İnovasyon Programı'ndan (218380/Z/19/Z) fon alıyor. Lawrence P. Binding, Epilepsy Research UK tarafından desteklenmektedir (hibe numarası P1904). Yukarıda bahsedilen yazarlar ve Sjoerd B. Vos, kısmen Ulusal Sağlık Araştırmaları Enstitüsü, University College London Hastaneleri Biyomedikal Araştırma Merkezi (NIHR, BRC, UCLH/UCL High Impact Initiative, BW.mn.BRC10269) tarafından finanse edilmektedir. Yazarlar, araştırmanın potansiyel bir çıkar çatışması olarak yorumlanabilecek herhangi bir ticari veya finansal ilişkinin yokluğunda yapıldığını beyan ederler. Derginin etik yayıncılıkla ilgili konulardaki tutumunu okuduğumuzu ve bu raporun bu yönergelerle tutarlı olduğunu teyit ediyoruz.
Teşekkürler
Bu çalışma Epilepsy Research UK (hibe numarası P1904) ve Wellcome Trust İnovasyon Programı (218380/Z/19/Z) tarafından desteklenmiştir. Bu çalışma kısmen Ulusal Sağlık Araştırmaları Enstitüsü, University College London Hastaneleri, Biyomedikal Araştırma Merkezi (NIHR, BRC, UCLH/UCL High Impact Initiative, BW.mn.BRC10269) tarafından finanse edilmiştir. Yazarlar, Batı Avustralya Üniversitesi Mikroskopi, Karakterizasyon ve Analiz Merkezi'nde bir Ulusal İşbirliğine Dayalı Araştırma Altyapısı Stratejisi (NCRIS) yeteneği olan Ulusal Görüntüleme Tesisi'nin olanaklarını ve bilimsel ve teknik yardımını kabul etmektedir. Bu araştırma tamamen veya kısmen Wellcome Trust [WT 218380] tarafından finanse edilmiştir. Açık Erişim amacıyla, yazar, bu gönderimden kaynaklanan herhangi bir Yazar Tarafından Kabul Edilen El Yazması sürümüne bir CC BY kamu telif hakkı lisansı uygulamıştır.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Brainlab Neuronavigation System | Brianlab, Westchester, IL | https://www.brainlab.com/surgery-products/overview-neurosurgery-products/cranial-navigation/ | Intraoperative neuronavigation system |
| EpiNav Planning Software | N/A | N/A | Clinical Decision Support Tool, for research use, developed in academia at King's College London and University College London |
| Mayfield clamp | Integra | A1059 | Any 3 pin head immobilisation device can be used |
| Microsurgical instruments | As per local neurosurgical unit | ||
| MRI Scanner | GE, Milwaukee, WI, USA | 3T MRI GE MR750 | Any alternative 3T MRI scanner can be used |
| MRTrix3 | N/A | Reference 47 in the manuscript | MRtrix3 provides a set of tools to perform various advanced diffusion MRI analyses, including constrained spherical deconvolution (CSD), probabilistic tractography, track-density imaging, and apparent fibre density |
| NORAS coil | NORAS MRI Products | https://www.noras.de/en/mri-produkte/lucy-or-head-holder-8-ch-coil/#infos | Any MRI-safe head immobilisation device can be used |
| Perforator drill | Stryker | https://neurosurgical.stryker.com/products/elite/ | Any alternative neurosurgical perforator drill driver and bit can be used |
| Sutures - Vicryl Plus 2/- | Ethicon | ETVCP684H | Any alternative suture that the surgeon prefers can be used |
| Titanium bone plates and screws | As per local neurosurgical unit | ||
| Ultrasonic Aspirator | Integra | https://products.integralife.com/cusa-tissue-ablation/category/cusa-tissue-ablation | Any alternative that the surgeon prefers can be used |
Referanslar
- Marathe, K., et al. ablative and radiosurgical interventions for drug-resistant mesial temporal lobe epilepsy: A systematic review and meta-analysis of outcomes. Front Neurol. 12, 777845(2021).
- Choi, H., et al. Epilepsy surgery for pharmacoresistant temporal lobe epilepsy: A decision analysis. JAMA. 300, 2497(2008).
- Foldvary, N., et al. Seizure outcome after temporal lobectomy for temporal lobe epilepsy: A Kaplan-Meier survival analysis. Neurology. 54, 630-634 (2000).
- Spencer, S. S., et al. Predicting long-term seizure outcome after resective epilepsy surgery: The multicenter study. Neurology. 65, 912-918 (2005).
- Sperling, M. R., O'Connor, M. J., Saykin, A. J., Plummer, C. Temporal lobectomy for refractory epilepsy. JAMA. 276, 470-475 (1996).
- Wiebe, S. Effectiveness and safety of epilepsy surgery: What is the evidence. CNS Spectr. 9, 120-132 (2004).
- Gilliam, F., et al. Patient-oriented outcome assessment after temporal lobectomy for refractory epilepsy. Neurology. 53, 687-694 (1999).
- Markand, O. N., Salanova, V., Whelihan, E., Emsley, C. L. Health-related quality of life outcome in medically refractory epilepsy treated with anterior temporal lobectomy. Epilepsia. 41, 749-759 (2000).
- Jones, J. E., Berven, N. L., Ramirez, L., Woodard, A., Hermann, B. P. Long-term psychosocial outcomes of anterior temporal lobectomy. Epilepsia. 43, 896-903 (2002).
- Spencer, D. D., Spencer, S. S., Mattson, R. H., Williamson, P. D., Novelly, R. A. Access to the posterior medial temporal lobe structures in the surgical treatment of temporal lobe epilepsy. Neurosurgery. 15, 667-671 (1984).
- Vakharia, V. N., et al. Intraoperative overlay of optic radiation tractography during anteromesial temporal resection: A prospective validation study. J Neurosurg. 1, 1-10 (2021).
- Winston, G. P., et al. Preventing visual field deficits from neurosurgery. Neurology. 83, 604-611 (2014).
- Almairac, F., Herbet, G., Moritz-Gasser, S., de Champfleur, N. M., Duffau, H. The left inferior fronto-occipital fasciculus subserves language semantics: A multilevel lesion study. Brain Struct Funct. 220, 1983-1995 (2015).
- Binding, L. P., Dasgupta, D., Giampiccolo, D., Duncan, J. S., Vos, S. B. Structure and function of language networks in temporal lobe epilepsy. Epilepsia. 63, 1025-1040 (2022).
- Giampiccolo, D., Duffau, H. Controversy over the temporal cortical terminations of the left arcuate fasciculus: A reappraisal. Brain. 145, 1242-1256 (2022).
- Sone, D., et al. Optimal surgical extent for memory and seizure outcome in temporal lobe epilepsy. Ann Neurol. 91, 131-144 (2022).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690-700 (2019).
- Dasgupta, D., et al. Hippocampal resection in temporal lobe epilepsy: Do we need to resect the tail. Epilepsy Res. 190, 107086(2023).
- Wu, C., et al. Effects of surgical targeting in laser interstitial thermal therapy for mesial temporal lobe epilepsy: A multicenter study of 234 patients. Epilepsia. 60, 1171-1183 (2019).
- Wiebe, S. A randomized, controlled trial of surgery for temporal-lobe epilepsy. N Engl J Med. 345 (5), 311-318 (2001).
- Brotis, A. G., et al. A meta-analysis on potential modifiers of LITT efficacy for mesial temporal lobe epilepsy: Seizure-freedom seems to fade with time. Clin Neurol Neurosurg. 205, 106644(2021).
- Borger, V., et al. Resection of piriform cortex predicts seizure freedom in temporal lobe epilepsy. Ann Clin Transl Neurol. 8, 177-189 (2020).
- Borger, V., et al. Temporal lobe epilepsy surgery: Piriform cortex resection impacts seizure control in the long-term. Ann Clin Transl Neurol. 9 (8), 1206-1211 (2022).
- Hwang, B. Y., et al. Piriform cortex ablation volume is associated with seizure outcome in mesial temporal lobe epilepsy. Neurosurgery. 91, 414-421 (2022).
- Piper, R. J., et al. Extent of piriform cortex resection in children with temporal lobe epilepsy. Ann Clin Transl Neurol. 10, 1613-1622 (2023).
- Allison, A. C. The secondary olfactory areas in the human brain. J Anat. 88, 481-488 (1954).
- Ribas, G. C. The cerebral sulci and gyri. Neurosurg Focus. 28, E2(2010).
- Young, J. C., Vaughan, D. N., Paolini, A. G., Jackson, G. D. Electrical stimulation of the piriform cortex for the treatment of epilepsy: A review of the supporting evidence. Epilepsy Behav. 88, 152-161 (2018).
- Mai, J. K., Majtanik, M., Paxinos, G. Atlas of the Human Brain. , Academic Press. Amsterdam Heidelberg. (2016).
- Vaughan, D. N., Jackson, G. D. The piriform cortex and human focal epilepsy. Front Neurol. 5, 259(2014).
- Gale, K. Progression and generalization of seizure discharge: Anatomical and neurochemical substrates. Epilepsia. 29, S15-S34 (1988).
- Löscher, W., Ebert, U. The role of the piriform cortex in kindling. Prog Neurobiol. 50, 427-481 (1996).
- Piredda, S., Gale, K. A crucial epileptogenic site in the deep prepiriform cortex. Nature. 317, 623-625 (1985).
- McIntyre, D. C., Gilby, K. L. Mapping seizure pathways in the temporal lobe. Epilepsia. 49, 23-30 (2008).
- Fahoum, F., Lopes, R., Pittau, F., Dubeau, F., Gotman, J. Widespread epileptic networks in focal epilepsies: EEG-fMRI study. Epilepsia. 53, 1618-1627 (2012).
- Flanagan, D., Badawy, R. A. B., Jackson, G. D. EEG-fMRI in focal epilepsy: Local activation and regional networks. Clin Neurophysiol. 125, 21-31 (2014).
- Laufs, H., et al. Converging PET and fMRI evidence for a common area involved in human focal epilepsies. Neurology. 77, 904-910 (2011).
- Wieser, H. G., et al. Proposal for a new classification of outcome with respect to epileptic seizures following epilepsy surgery. Epilepsia. 42, 282-286 (2001).
- Dasgupta, D., Duncan, J. S. Optimizing epilepsy surgery. ISRCTN Registry. BMC. , Springer Nature. (2020).
- Sparks, R., et al. Automated multiple trajectory planning algorithm for the placement of stereo-electroencephalography (SEEG) electrodes in epilepsy treatment. Int J CARS. 12, 123-136 (2017).
- Dasgupta, D. Improving outcomes in anteromesial temporal lobe resections - A prospective surgical trial integrating multimodal imaging & novel hi-res tractography. , (2022).
- Winston, G. P., et al. Automated T2 relaxometry of the hippocampus for temporal lobe epilepsy. Epilepsia. 58, 1645-1652 (2017).
- Cardoso, M. J., et al. Geodesic information flows: Spatially-variant graphs and their application to segmentation and fusion. IEEE Trans Med Imaging. 34, 1976-1988 (2015).
- Winston, G. P., et al. Automated hippocampal segmentation in patients with epilepsy: Available free online. Epilepsia. 54, 2166-2173 (2013).
- Iqbal, S., et al. Volumetric analysis of the piriform cortex in temporal lobe epilepsy. Epilepsy Res. 185, 106971(2022).
- Leon-Rojas, J. E., et al. Resection of the piriform cortex for temporal lobe epilepsy: a novel approach on imaging segmentation and surgical application. Br J Neurosurg. 1, 1-6 (2021).
- Tournier, J. -D., et al. MRtrix3: A fast, flexible and open software framework for medical image processing and visualization. Neuroimage. 202, 116137(2019).
- Cordero-Grande, L., Christiaens, D., Hutter, J., Price, A. N., Hajnal, J. V. Complex diffusion-weighted image estimation via matrix recovery under general noise models. Neuroimage. 200, 391-404 (2019).
- Vos, S. B., et al. The importance of correcting for signal drift in diffusion MRI. Magn Reson Med. 77, 285-299 (2017).
- Kellner, E., Dhital, B., Kiselev, V. G., Reisert, M. Gibbs-ringing artifact removal based on local subvoxel-shifts. Magn Reson Med. 76, 1574-1581 (2016).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. Neuroimage. 23, S208-S219 (2004).
- Andersson, J. L. R., Sotiropoulos, S. N. An integrated approach to correction for off-resonance effects and subject movement in diffusion MR imaging. Neuroimage. 125, 1063-1078 (2016).
- Leemans, A., Jones, D. K. The B-matrix must be rotated when correcting for subject motion in DTI data. Magn Reson Med. 61, 1336-1349 (2009).
- Tustison, N. J., et al. N4ITK: Improved N3 Bias Correction. IEEE Trans Med Imaging. 29, 1310-1320 (2010).
- Dhollander, T., Raffelt, D., Connelly, A. Unsupervised 3-tissue response function estimation from single-shell or multi-shell diffusion MR data without a co-registered T1 image. ISMRM Workshop on Breaking the Barriers of Diffusion MRI. 5, (2016).
- Binding, L. P., et al. Contribution of white matter fiber bundle damage to language change after surgery for temporal lobe epilepsy. Neurology. 100, e1621-e1633 (2023).
- Giampiccolo, D., et al. Thalamostriatal disconnection underpins long-term seizure freedom in frontal lobe epilepsy surgery. Brain. 146, 2377-2388 (2023).
- Smith, R. E., Tournier, J. -D., Calamante, F., Connelly, A. Anatomically-constrained tractography: Improved diffusion MRI streamlines tractography through effective use of anatomical information. Neuroimage. 62, 1924-1938 (2012).
- Tournier, J. D., Calamante, F., Connelly, A. Improved probabilistic streamlines tractography by 2nd order integration over fibre orientation distributions. Proc 18th Annu Meet ISMRM. 1670, (2010).
- Yasargil, M. G., Fox, J. L. The microsurgical approach to intracranial aneurysms. Surg Neurol. 3, 7-14 (1975).
- Yasargil, M. G., et al. Microsurgical pterional approach to aneurysms of the basilar bifurcation. Surg. Neurol. 6, 83-91 (1976).
- Rao, D., Le, R. T., Fiester, P., Patel, J., Rahmathulla, G. An illustrative review of common modern craniotomies. J Clin Imaging Sci. 10, 81(2020).
- Usui, N., Kondo, A., Nitta, N., Tottori, T., Inoue, Y. Surgical resection of amygdala and uncus. Neurol Med Chir (Tokyo). 58, 377-383 (2018).
- Vivas, A. C., Reintjes, S., Shimony, N., Vale, F. L. Surgery of the amygdala and uncus: A case series of glioneuronal tumors. Acta Neurochir. (Wien). 162, 795-801 (2020).
- Al-Otaibi, F., Baeesa, S. S., Parrent, A. G., Girvin, J. P., Steven, D. Surgical techniques for the treatment of temporal lobe epilepsy. Epilepsy Res Treat. 2012, 1-13 (2012).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690(2019).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır