Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Mejora de los resultados en las resecciones del lóbulo temporal anteromesial: una demostración de la resección de la corteza temporal piriforme
En este artículo
Resumen
Aquí, demostramos un enfoque para la guía neuroquirúrgica intraoperatoria en las resecciones del lóbulo temporal anteromesial, destacando específicamente el uso de la tractografía y las máscaras anatómicas para ayudar a la resección segura de la porción temporal de la corteza piriforme, un área cada vez más considerada como un objetivo quirúrgico crucial en la epilepsia del lóbulo temporal mesial resistente a los medicamentos.
Resumen
La resección del lóbulo temporal anteromesial (ATLR, por sus siglas en inglés) es una opción de tratamiento útil para la epilepsia del lóbulo temporal mesial resistente a los medicamentos (DRmTLE, por sus siglas en inglés). Cada vez hay más pruebas que sugieren que la corteza piriforme desempeña un papel crucial en la generación y propagación de convulsiones en la DRmTLE, y que la resección de la porción temporal de la corteza piriforme se asocia con tasas significativamente mejoradas de ausencia de convulsiones.
Aquí, presentamos la resección de la porción temporal de la corteza piriforme en ATLR, utilizando algoritmos de tractografía probabilística preoperatoria de alta resolución y máscaras anatómicas fusionadas de las estructuras de interés en la neuronavegación intraoperatoria y la visualización frontal del microscopio (HUD).
Todos los pacientes que se sometieron a una evaluación preoperatoria integral y a investigaciones para DRmTLE dieron su consentimiento informado y por escrito para grabar un video intraoperatorio del procedimiento. Los pacientes fueron identificados por un equipo multidisciplinario experto de epileptólogos, neurocirujanos de epilepsia, neuropsicólogos, neuropsiquiatras y electrofisiólogos en un gran centro de cirugía de epilepsia. La línea de imágenes preoperatorias incluyó la delineación de estructuras críticas. Esto incluyó la corteza temporal piriforme y la tractografía probabilística de alta resolución para los tractos esenciales en riesgo (p. ej., radiación óptica y fascículo fronto-occipital inferior). Estos se registraron conjuntamente en la exploración de neuronavegación volumétrica preoperatoria y se cargaron en el sistema de neuronavegación intraoperatoria.
Aquí se presenta un procedimiento paso a paso de ATLR, que incluye la resección de la porción temporal de la corteza piriforme. El protocolo combina imágenes de resonancia magnética estructural y de difusión avanzadas y ayudas visuales intraoperatorias para integrar máscaras anatómicas de estructuras críticas de materia gris y tractos de sustancia blanca en el flujo de trabajo quirúrgico en el quirófano.
Introducción
La resección del lóbulo temporal anteromesial (ATLR) es el tratamiento más eficaz para la epilepsia del lóbulo temporal mesial resistente a fármacos (DRmTLE)1,2, con tasas de ausencia de convulsiones del 50%-70% y una morbilidad relativamente baja 3,4,5. También se ha demostrado que el procedimiento mejora la calidad de vida 6,7,8, las tasas de empleo5 y el bienestar psicosocial9.
La ATLR canónica, descrita por Spencer et al.10, implica la resección del polo temporal, el uncus, la amígdala, el hipocampo, el giro parahipocampal y el giro fusiforme. Las vías críticas de la sustancia blanca implicadas en la visión (la radiación óptica, en particular, el asa de Meyer11,12) y el lenguaje (p. ej., el fascículo fronto-occipital inferior13 y el fascículo arqueado14,15) corren el riesgo de sufrir lesiones al acceder al asta temporal del ventrículo lateral. El siguiente protocolo describe un enfoque para evitar estos tractos de sustancia blanca mediante tractografía probabilística preoperatoria de alta resolución y máscaras anatómicas fusionadas de las estructuras de interés en la neuronavegación intraoperatoria y la visualización microscópica de visualización frontal (HUD).
La comprensión tradicional del campo es que la resección máxima del hipocampo es beneficiosa para maximizar las tasas de ausencia de convulsiones postoperatorias. Sin embargo, los análisis recientes de casos posteriores a la ATLR demuestran que la resección de la porción temporal de la corteza piriforme en la ATLR aumenta en gran medida la posibilidad de ausencia de convulsiones. También demostraron que no hubo asociación entre la resección posterior del hipocampo y la ausencia de convulsiones16,17. En consecuencia, se ha propuesto actualizar la técnica de Spencer limitando la resección del hipocampo al 55% anterior del hipocampo, en los ATLR del hemisferio dominante del lenguaje, para preservar la función de la memoria16,18.
Si bien ha habido un interés creciente en el uso de nuevas terapias mínimamente invasivas, en particular la terapia térmica intersticial con láser (LITT), la resección quirúrgica sigue siendo el estándar de atención para la epilepsia focal resistente a los medicamentos1, y se ha demostrado que la eficacia de la LITT produce una menor proporción de resultados de convulsiones de Engel 1 (58%-59%)1,19 en comparación con ATLR (60%-70%)3, 4,5,20, por lo que sigue siendo un área que requiere más investigación21.
Cada vez hay más evidencias que apoyan la hipótesis de que la corteza piriforme (Figura 1) es una región crítica en la propagación y/o epileptogénesis de las convulsiones en adultos 16,17,22,23,24 y niños25 con epilepsia del lóbulo temporal mesial. La corteza piriforme es una cinta de alocorteza de tres capas (similar a la disposición de la corteza del hipocampo) que se extiende alrededor del surco entorrinal mesial al tallo temporal26,27 y, por lo tanto, forma la confluencia de los lóbulos temporal y frontal. Por lo tanto, se puede considerar fácilmente que consiste en divisiones frontales y temporales, descritas en detalle en la literatura 22,25,28,29,30.
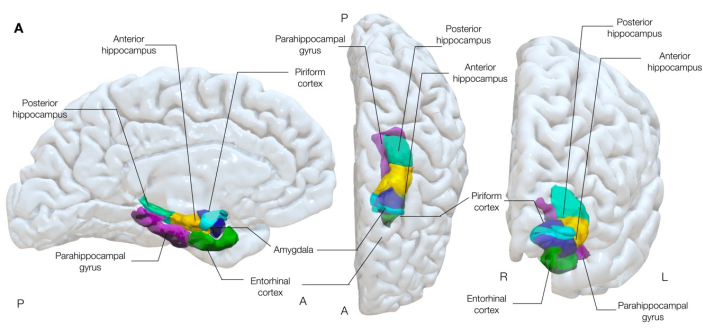
Figura 1: Representación semitransparente en 3 dimensiones de las estructuras temporales mesiales del cerebro. Esta figura muestra las asociaciones anatómicas de la corteza piriforme (cian) con la anatomía del lóbulo temporal mesial circundante. Vistas medial izquierda, centro superior y anterior derecha. Haga clic aquí para ver una versión más grande de esta figura.
La corteza piriforme es supero-mesial de la amígdala y ha sido implicada durante mucho tiempo en estudios animales como un nodo común en redes que diseminan descargas epileptogénicas31-33, y genera convulsiones después de la estimulación eléctrica más fácilmente que las estructuras mesiales vecinas, incluyendo la amígdala y el hipocampo34. Su posición, con amplias conexiones con las cortezas entorrinal, límbica, orbitofrontal e insular, así como con el tálamo, el bulbo olfatorio, la amígdala y el hipocampo, también se presta a un papel como una vía de propagación clave de las descargas epileptógenas en la epilepsia focal30.
Los estudios de EEG-fMRI y tomografía por emisión de positrones (PET) respaldan aún más un papel importante de la corteza piriforme en DRmTLE, mostrando activación interictal, y la reducción de la unión del receptor de ácido γ-aminobutírico tipo A (GABAA) en la corteza piriforme se asocia con una mayor actividad convulsiva 35,36,37.
Dos importantes estudios de imagen recientes en DRmTLE han demostrado que la ausencia de convulsiones postoperatorias se asocia con un mayor grado de resección de la corteza piriforme; Galovic et al. demostraron en una cohorte retrospectiva grande que la extirpación de al menos la mitad de la corteza piriforme mejoró las probabilidades de quedar libre de convulsiones en un factor de 16 (IC 95%, 5-47; p < 0,001)17. También se demostró que los volúmenes de resección de otras estructuras temporales mesiales no se asociaron con la libertad de convulsiones, un hallazgo replicado y respaldado por los análisis de vóxeles realizados por Sone et al., quienes mostraron que solo la resección de la corteza piriforme en el TLE izquierdo se asoció con la ausencia de convulsiones16 (Figura 2).
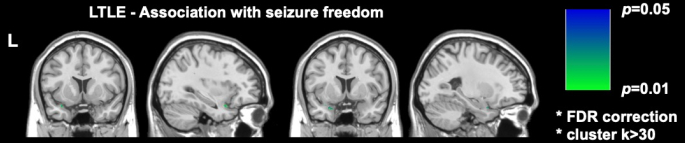
Figura 2: Asociación de vóxeles con la ausencia de convulsiones postoperatorias en la TLE izquierda. La única área significativamente correlacionada con la ausencia de convulsiones es la porción temporal de la corteza piriforme, p = 0,01 (verde en cortes de resonancia magnética coronales y sagitales ponderados en T1). Adaptado de Sone et al.16 con permiso. Haga clic aquí para ver una versión más grande de esta figura.
Borger et al. también demostraron en una gran cohorte retrospectiva que solo la proporción de corteza piriforme temporal resecada se asocia con mejores tasas de ausencia de convulsiones tanto a 1año3 como a un seguimiento más prolongado (media de 3,75 años)23. Además, corroboraron que el volumen resecado del hipocampo y la amígdala no predecía la ausencia de convulsiones.
La importancia de que la corteza piriforme esté desconectada de la red epileptógena aberrante en la mTLE también se ha demostrado en LITT, con Hwang et al. demostrando en el seguimiento de 6 meses que el porcentaje de ablación de la corteza piriforme se asoció con los resultados de la clase 1 de ILAE38 (OR 1,051, IC 95% 1,001-1,117, p = 0,045), pero que esta fue una tendencia que no fue significativa a 1 año5. Esto parece respaldar los datos emergentes con respecto a la LITT, que hay una mejora positiva, pero potencialmente menos permanente, en los resultados de las convulsiones, lo que ha llevado a que la LITT se use comúnmente como un procedimiento de "primera etapa", con cirugía resectiva ofrecida a aquellos en quienes la LITT no logra la ausencia de convulsiones.
Por lo tanto, existe una fuerte evidencia de que la resección de la porción temporal de la corteza piriforme es un objetivo clave para lograr la ausencia de convulsiones en la epilepsia del lóbulo temporal mesial resistente a los medicamentos. Sin embargo, como demostró la cohorte retrospectiva de Galovic et al., esta cinta de corteza entorrinal se encuentra en una ubicación difícil de atacar quirúrgicamente cuando se realiza un ATLR, lo que significa que si no se dirige directamente, no siempre se elimina con éxito. En este estudio mostramos cómo dirigirse y resecar de forma segura la porción temporal de la corteza piriforme como parte de un estudio quirúrgico prospectivo en curso, para evaluar su impacto en la mejora de las tasas de ausencia de convulsiones en el postoperatorio39.
El siguiente protocolo se centra en los aspectos técnicos de la adquisición y el procesamiento de imágenes, el enfoque quirúrgico y cómo aseguramos la resección de la porción temporal de la corteza piriforme en ATLR, al tiempo que integramos la tractografía probabilística preoperatoria de alta resolución y las máscaras anatómicas fusionadas de las estructuras de interés en la neuronavegación intraoperatoria y la visualización frontal del microscopio (HUD). El protocolo también utiliza una plataforma de software de planificación específica40, que permite la visualización tridimensional y la integración de imágenes multimodales para la revisión y planificación quirúrgica, y un sistema de neuronavegación que permite la integración con el microscopio quirúrgico (los detalles se detallan en la Tabla de Materiales).
Protocolo
Estos métodos y protocolos forman parte de un ensayo quirúrgico prospectivo en curso que fue aprobado por la Autoridad de Investigación Sanitaria el 10/09/2020, referencia del Comité de Ética en la Investigación (REC) de Londres: 20/LO/0966. El protocolo se registró prospectivamente: ISRCTN72646265, el 25/09/2020, está disponible en línea39, y ha sido presentado en una conferencia nacional41.
El siguiente protocolo se aplica a todos los pacientes sometidos a ATLR para DRmTLE en pacientes de 18 a 70 años (el grupo de edad de los pacientes operados por esta indicación en nuestro centro especializado en cirugía de epilepsia en adultos), todos operados por los mismos cirujanos (AWM, AM). Todos los participantes dieron su consentimiento informado antes de su inclusión en el estudio. Todos los participantes se sometieron a una evaluación preoperatoria exhaustiva y a investigaciones dirigidas por el equipo multidisciplinario de expertos en epilepsia quirúrgica del centro integral de cirugía de la epilepsia de los autores, compuesto por neurocirujanos, neurólogos de epilepsia, neuropsicólogos, psiquiatras, neurorradiólogos y otros miembros de los servicios especializados en terapias para la epilepsia. Antes de la cirugía, todos se sometieron a resonancias magnéticas volumétricas T1, T2 y FLAIR actualizadas, como se describe en el protocolo a continuación, así como sangre preoperatoria estándar y una revisión por parte del equipo de neuroanestesia, lo que garantizó que eran seguros para proceder a la cirugía bajo anestesia general. Los detalles comerciales de los reactivos y el equipo utilizado en este estudio se proporcionan en la Tabla de Materiales.
1. Adquisición y procesamiento de imágenes
NOTA: Las imágenes de resonancia magnética (RM) prequirúrgicas de alta resolución, a los 3 meses y a los 1 año posquirúrgicos, se adquieren de forma rutinaria en personas que se someten a una cirugía de epilepsia en nuestro centro. Los datos de resonancia magnética se adquirieron entre marzo de 2020 y marzo de 2024 en el mismo escáner de resonancia magnética para mantener la consistencia. La adquisición de imágenes estandarizada y muchos de los componentes de procesamiento se han descrito previamente en la literatura y se hace referencia a ellos de manera adecuada en el protocolo que se resume a continuación:
- Adquiera las siguientes secuencias de resonancia magnética:
- Una secuencia 3D estándar isométrica (1 mm) ponderada T1 con recuperación de inversión con gradiente estropeado rápido recordado (IR-FSPGR) eco [tiempo de eco (TE) 3,1 ms, tiempo de repetición (TR) = 7,4 ms, tiempo de inversión = 400 ms, campo de visión (FOV) = 224 × 256 × 256 mm, matriz = 224 × 256 × 256, tamaño del vóxel = 1,00 × 1,00 × 1,00 mm = 1,00 mm3, factor de aceleración de imágenes paralelas = 2] y;
- Una secuencia coronal de doble eco de recuperación rápida de espín de protón de espín rápido / T2 ponderada utilizada para la relaxometría T242 (TE = 30/119 ms, TR = 7600 ms, FOV = 220 × 220 mm, matriz = 512 × 512, grosor de corte = 4 mm, tamaño de vóxel = 0,43 × 0,43 × 4,00 mm = 0,74 mm3, factor SENSE = 2).
- Utilice la secuencia ponderada T1 anterior como entrada para el algoritmo de flujos de información geodésica (GIF v3) para parcelar el cerebro en 162 regiones anatómicas utilizando NiftyWeb43.
- Producir máscaras anatómicas de las estructuras de interés utilizando las parcelaciones GIF (giro parahipocampal, giro fusiforme, crear información de perfil del hipocampo y segmentar el hipocampo en el 55% anterior y el 45% posterior utilizando Hipposeg44), superponerlas en el software de planificación en las imágenes preoperatorias volumétricas del paciente (como en el paso 1.1).
- Realizar la segmentación automatizada de la corteza piriforme y dividir la corteza piriforme en componentes frontales y temporales a partir de las técnicas de volumetría explicadas en trabajos previos de nuestro laboratorio 17,45,46. Una vez generadas, superponga estas mascarillas en las imágenes preoperatorias del paciente.
- Adquiera las siguientes imágenes de resonancia magnética de difusión:
- Una adquisición de múltiples capas de resolución estándar (resolución isotrópica de 2 mm, direcciones de gradiente de 11, 8, 32 y 64 a valores b 0, 300, 700, 2500 s/mm2) y;
- Una adquisición multicapa de alta resolución (resolución isótropa de 1,6 mm, 101 direcciones, 14 b0, valores b: 300, 700 y 2500 s/mm2).
- Corrija los datos de difusión adquiridos utilizando MRtrix3 (https://mrtrix.org)47 para:
- Ruido usando "dwidenoise" en MRtrix348.
- Deriva de la señal49.
- Timbre de Gibbs usando "mrdegibs" en MRtrix350.
- Distorsión utilizando un gradiente de codificación de fase inversa con el algoritmo FSL TOPUP (https://fsl.fmrib.ox.ac.uk/fsl51).
- Corrientes de Foucault y artefactos de movimiento utilizando el algoritmo de Foucault de FSL (https://fsl.fmrib.ox.ac.uk/fsl)52, rotando los vectores b53.
- Campo de sesgo utilizando el algoritmo ANTs (https://mrtrix.org47,54).
- Utilice la deconvolución esférica restringida (CSD) de múltiples capas y tejidos55 para estimar las funciones de respuesta para la materia blanca y gris, y el líquido cefalorraquídeo (LCR).
- Realizar tractografía automatizada anatómicamente dirigida para reconstruir haces de fibras de interés 12,56,57: la radiación óptica, el fascículo fronto-occipital inferior (IFOF; casos dominantes del lenguaje) y el fascículo longitudinal medio (FML; casos no dominantes del lenguaje). Siga los pasos que se indican a continuación.
- Extraiga los puntos de terminación cortical para cada haz de fibra y agrúpelos en ROI de semilla y terminación.
- Cree regiones corticales de exclusión y ROI utilizando regiones corticales no finalizantes.
- Realice tractografía anatómicamente restringida58 a través del algoritmo probabilístico de seguimiento de fibra iFOD259 utilizando segmentación híbrida de superficie y volumen en MRtrix347 seleccionando un máximo de 5.000 líneas de corriente de 300 millones de semillas.
- Realice la tractografía en el paso 1.8.3 dos veces para cada haz de fibra, cambiando el ROI de semilla y terminación.
- Convierta los haces de fibras resultantes en mapas probabilísticos, con un umbral de un valor de 0,01: utilícelos como criterio de exclusión adicional para eliminar líneas de corriente falsas falsas.
- Revisar los haces de fibras resultantes (dilatados en 2 mm) y las mascarillas anatómicas en el software de planificación para asegurarse de que son anatómicamente precisos (este paso lo realizan dos neurocirujanos de epilepsia de nuestra unidad).
- Registre espacialmente las máscaras anatómicas del tracto de la materia gris y la sustancia blanca resultantes en la imagen de RM ponderada en T1 de referencia en el paso 1.1 y cargándolas en el sistema de navegación intraoperatorio en el quirófano de RM intraoperatoria (iMRI).
- Adquiera imágenes de resonancia magnética volumétrica ponderada T1, T2 y T2-FLAIR inmediatamente antes de la cirugía (< 24 h) con fiduciales de piel en el cuero cabelludo del paciente. Correlacione el registro de estas imágenes entre sí, y con la imagen de referencia ponderada T1 y las máscaras descritas anteriormente, y que se muestran en la Figura 3.
- Registre" al paciente en el sistema de neuronavegación con un láser de adaptación a la superficie y un puntero inteligente.
- Verificar la exactitud del registro conjunto de la imagen y del paciente con dos neurocirujanos de epilepsia antes de que comience el caso para garantizar la precisión.
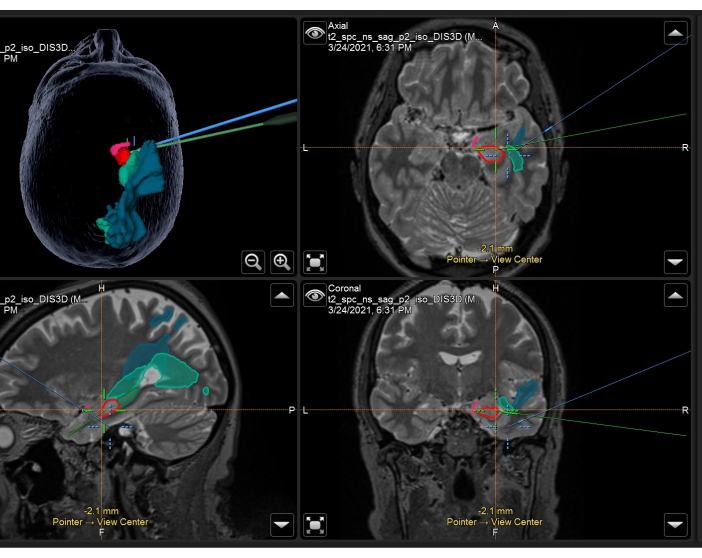
Figura 3: Captura de pantalla del sistema de neuronavegación que muestra la resonancia magnética volumétrica ponderada en T2 con máscaras anatómicas superpuestas y tractos utilizados intraoperatoriamente en un ATLR derecho. Panel superior izquierdo: reconstrucción tridimensional de la cabeza del paciente, mostrando máscaras anatómicas. Arriba a la derecha: axial, abajo a la izquierda: sagital, y abajo a la derecha: vistas coronales que también muestran máscaras anatómicas superpuestas en una resonancia magnética volumétrica ponderada en T2. Máscaras anatómicas mostradas: porción temporal de la corteza piriforme (rosa), 55% anterior del hipocampo (rojo), 45% posterior del hipocampo (verde oscuro, solo se ve en la imagen sagital), radiación óptica (verde medio), fascículo longitudinal medio (azul). El punto de mira azul es la posición integrada del foco del microscopio, y el punto de mira verde es la posición del puntero de neuronavegación que se utiliza dentro del campo quirúrgico. Haga clic aquí para ver una versión más grande de esta figura.
2. Técnica quirúrgica
NOTA: Los pasos a continuación resumen la práctica en el centro de los autores y no pretenden ser una exposición del único enfoque quirúrgico para un ATLR, sino más bien una demostración de cómo los autores han estandarizado el enfoque de este procedimiento para proporcionar resecciones confiables y reproducibles, incluida la resección de la corteza temporal piriforme.
- Posicionamiento y enfoque
- Siguiendo los controles preoperatorios estándar y las medidas de seguridad, coloque al paciente en decúbito supino, eleve el hombro ipsilateral con un giro y gire la cabeza hacia el lado contralateral.
- Flexionar la cabeza lateralmente para asegurarse de que la eminencia malar sea el punto más alto del campo quirúrgico y fijarla con clavos (dispositivo de fijación del cráneo de 3 puntos; ver ejemplos, incluidos los compatibles con los quirófanos intraoperatorios [iMRI] en la Tabla de Materiales).
NOTA: La posición es crucial para permitir un acceso adecuado a las estructuras del lóbulo temporal mesial y posterior, particularmente la flexión lateral, para asegurar que la eminencia malar sea el punto más alto del campo quirúrgico. - Infiltrar anestésico local en los sitios de clavos y la incisión en la piel.
- Registre el espacio del paciente en el sistema de neuronavegación utilizando una combinación de fiduciales de piel y seguimiento de superficie (específico de la marca del sistema de neuronavegación utilizado). Confirme la precisión del registro frente a puntos de referencia óseos/otros puntos de referencia anatómicos palpables o visibles.
- Marque la línea del cabello y la raíz del cigoma (identificada por palpación manual). Identificar y marcar el curso de la fisura de Silvio mediante la neuronavegación y la incisión cutánea curvilínea frontotemporal planificada con "signo de interrogación".
- Retire el vello a lo largo de la incisión cutánea planificada con una cortadora de pelo eléctrica.
- Realizar una incisión frontotemporal desde 1 cm anterior al trago, curvándose en forma de signo de interrogación, para evitar lesiones en la rama frontotemporal del nervio facial. Identifique y preserve la arteria temporal superficial si es posible. La posición y el marcado de la incisión en la piel se muestran en la Figura 4.
- Cubra y asegure los bordes de la herida con hisopos mastoides empapados en antimicrobianos y pinzas Raney.
- Incidir el músculo temporal y elevarlo en un colgajo miocutáneo o interfascial/subfascial (evitando lesiones en la rama frontotemporal del nervio facial).
- Envuelva el colgajo de piel en una gasa empapada en solución antimicrobiana y retírelo hacia delante (evitando el uso de instrumentos metálicos de seguridad si se está en quirófanos de iMRI).
- Cree 2 orificios de rebaba en el cráneo con un taladro perforador: el primero justo encima de la raíz del cigoma para maximizar la exposición inferior, el segundo frontal inferior para facilitar la visualización de la fisura de Silvio.
- Realizar una craneotomía frontotemporal estándar 60,61,62, exponiendo la circunvolución temporal superior y media 1 cm por encima de la fisura de Silvio.
- Perfore los márgenes anterior e inferior de la craneotomía para permitir un fácil acceso al suelo de la fosa temporal media, así como al polo temporal anterior. Si se encuentran células de aire mastoides, séllelas con cera ósea y pegamento de fibrina tanto al encontrarlas como al final del procedimiento antes de cerrar las capas superficiales al hueso.
NOTA: Es importante asegurarse de que la craneotomía permita el acceso al suelo de la fosa craneal media, ya que será el acercamiento al asta temporal del ventrículo lateral a través del surco colateral. También es importante sellar completamente cualquier célula de aire mastoidea que se encuentre para prevenir una fuga de líquido cefalorraquídeo postoperatorio y los síntomas resultantes y posibles infecciones. - Abra la duramadre en forma de U con la base reflejada anteriormente y extendida en forma estrellada. Enganche la duramadre lejos del campo operatorio con suturas (como la seda 3-0).
- Libera líquido cefalorraquídeo del suelo de la fosa craneal media y de la cara anterior de la fosa craneal media.
NOTA: El paso de liberación del LCR es importante para permitir suficiente espacio de trabajo para acceder quirúrgicamente al suelo de la fosa craneal media y al surco colateral desde abajo sin retracción ni tensión en el lóbulo temporal basal.
- Extirpación lateral del neocortical
- Coagular los pia de las circunvoluciones temporales medias e inferiores (MTG e ITG, respectivamente) en línea perpendicular a la base del cráneo y en línea con la proyección anterior del asta temporal del ventrículo lateral (confirmado en el sistema de neuronavegación). Adaptar la extensión antero-posterior de esta línea caso por caso, dependiendo de la evidencia prequirúrgica de la afectación neocortical lateral en el inicio/propagación de las convulsiones.
NOTA: La extensión antero-posterior de la resección neocortical lateral debe tener en cuenta la evidencia preoperatoria (o la falta de ella) de su participación en la propagación de las convulsiones, y esto se adapta a cada paciente individual. - Emplear un abordaje transcortical en el ITG para exponer el suelo de la fosa craneal media e identificar el surco colateral, que es lateral a la circunvolución parahipocampal y medial a la circunvolución fusiforme.
- Coagular la pia de la circunvolución temporal superior (STG) anterior a la incisión neocortical lateral anterior, paralela a la dirección de la fisura de Silvio. Es perpendicular a la línea descrita en el paso 2.16 y se extiende anteriormente hasta el polo temporal.
- Desarrollar el plano entre la STG y la fisura de Silvio utilizando técnicas de disección subpial, protegiendo las ramas de la arteria cerebral media, y llevar esta disección hasta la parte horizontal de la fisura de Silvio hasta el nivel del surco limitante inferior de la ínsula.
NOTA: Se debe tener cuidado de mantener la integridad de la pia de la STG que bordea la fisura de Silvio mientras se realiza la disección subpial en el paso 2.2.4, ya que esto protege las ramas de la arteria cerebral media en la fisura, así como otras estructuras como el nervio oculomotor y la arteria comunicante posterior (paso 2.2.14) y el tracto óptico (paso 2.3) más adelante en la operación. - Integrar el microscopio con el sistema de neuronavegación.
- Confirme la precisión de las superposiciones de objetos de las máscaras anatómicas descritas en la sección 1 y visualícelas en el HUD del microscopio.
- Inclinar la línea de resección posterior anterior hacia arriba para minimizar la resección de STG, y extenderla progresivamente a través de la MTG y la ITG, a través del giro fusiforme hasta el surco colateral.
- Comprobar la relación del margen de resección posterior frente al sistema de neuronavegación con la máscara de radiación óptica (OR) visualizada.
- Visualice la extensión anterior máxima de la máscara de quirófano en el microscopio y asegúrese de que sea posterior al margen de resección en el HUD del microscopio para garantizar que no haya daño en el quirófano, lo que resultaría en un déficit del campo visual postoperatorio, como se demuestra en la Figura 5.
NOTA: El paso 2.2.9 es un paso crítico para prevenir un déficit del campo visual postoperatorio debido al daño del bucle de Meyer de la radiación óptica. Si hay mucho desplazamiento cerebral y el cirujano desea minimizar aún más el riesgo de daño a la radiación óptica, o si las proyecciones en el HUD del microscopio no funcionan correctamente, los autores sugieren usar el puntero de neuronavegación para dirigir el enfoque a la punta más anterior del asta temporal del ventrículo lateral. ya que esto minimiza el riesgo de lesiones en el quirófano. - Siga el surco colateral superiormente hasta que se encuentre con el cuerno temporal (confirme esto en el sistema de neuronavegación), como se muestra en la Figura 6. La pared del cuerno temporal se puede identificar por un ependima teñido de azul.
NOTA: En individuos en los que la patología no es la esclerosis del hipocampo, y la cabeza del hipocampo es voluminosa, el ventrículo puede ser difícil de encontrar. En estos casos, una opción de solución de problemas es usar el puntero de neuronavegación en la base de la fosa temporal medial, donde no hay desplazamiento para encontrar dónde se proyecta la punta del ventrículo. Normalmente es útil buscar esto en un plano coronal. Si no se puede encontrar el ventrículo, sugerimos extraer primero el polo y luego encontrar el ventrículo con el aspirador ultrasónico. - Divida las leptomeninges temporales basales laterales a la exposición del cuerno temporal.
- Abra el ventrículo anteriormente para exponer la cabeza del hipocampo (como se muestra en la Figura 6).
- Extender el margen de resección posterior para unir la desconexión al ventrículo y esto permite la desconexión del bloqueo neocortical.
- Movilizar el polo temporal siguiendo la línea de disección en el margen del borde tentorial. Tenga cuidado de no realizar la desconexión sobre el borde del tentorio para evitar lesiones en las estructuras mesiales, incluido el nervio oculomotor y la arteria comunicante posterior.
NOTA: Para reducir el riesgo de dañar las estructuras en la cisterna cruralis, siga la forma del borde del tentorio sin pasar por encima del borde de la tienda. El uncus permanecerá en su lugar y se puede tomar como un espécimen separado.
- Coagular los pia de las circunvoluciones temporales medias e inferiores (MTG e ITG, respectivamente) en línea perpendicular a la base del cráneo y en línea con la proyección anterior del asta temporal del ventrículo lateral (confirmado en el sistema de neuronavegación). Adaptar la extensión antero-posterior de esta línea caso por caso, dependiendo de la evidencia prequirúrgica de la afectación neocortical lateral en el inicio/propagación de las convulsiones.
- Resección temporal mesial, incluyendo la corteza temporal piriforme
- Limpiar el tejido del uncus con disección y uso del aspirador ultrasónico mesialmente hasta que el nervio oculomotor y la arteria comunicante posterior sean visibles. Detener la extensión de la resección posterior cuando se visualiza el pes (la extensión más mesial de la cabeza del hipocampo).
- Realizar la resección de la amígdala con el aspirador ultrasónico, limitada superiormente por la pia del surco endorinal, y hasta visualizar el tracto óptico, y mesialmente por el plano pial de las cisternas basales.
NOTA: Tenga cuidado de preservar el tallo temporal y no entrar en el lóbulo frontal al realizar el paso 2.3.2. A veces, debido al desplazamiento cerebral, la neuronavegación puede sobrestimar la extensión de la resección mesialmente; En este sentido, es seguro continuar la resección hasta que se visualice el tracto óptico a través de la PIA, y esto representa el límite mesial de la resección. Esto también se describe en Usui et al.63El margen dorsal de la amígdala se describe comúnmente como aproximado por una línea imaginaria que conecta el punto coroideo con la bifurcación proximal de la arteria cerebral media64. - Asegúrese de que la porción temporal de la corteza piriforme se reseca eliminando cualquier tejido residual a través de la disección subpial que progresa inferiormente desde el lado temporal de la fisura de Silvio hasta que se visualiza la vena del surco circular inferior de la ínsula. Se trata de un margen de resección similar al descrito por Usui et al. al resecar lesiones amigdalar-uncales63.
NOTA: Si el uncus (en el paso 2.3.1) o la corteza piriforme son difíciles de extirpar (a veces, pueden ser muy adherentes a la piamadre), los autores sugieren el uso de un disector de Rhoton en lugar del aspirador ultrasónico para minimizar la lesión a la piamadre. - Confirme la resección de la porción temporal de la corteza piriforme utilizando la máscara anatómica descrita en el paso 1.4 superpuesta en el HUD del microscopio, como se muestra en la Figura 7.
- Resección del hipocampo
- Coloque linteens (o algodonoides anchos similares) para retraer el plexo coroideo coroideo (y la arteria coroidea anterior) mesialmente para facilitar la visualización de los hipocampos de fimbria.
- Desconecte la fimbria hippocampi de su unión aracnoidea, exponiendo el surco del hipocampo que lleva la arcada vascular arterial del cuerno de Ammon.
- Desconecte el hipocampo de su cola (ya sea limitando esta resección al 55% anterior del hipocampo en las resecciones del hemisferio dominante del lenguaje en un intento de minimizar los déficits de memoria verbal como se describe en16, o extendiéndose hasta el nivel del tectum del mesencéfalo en las resecciones del hemisferio dominante no lingüístico).
- Desconecte la cabeza del hipocampo del pie hipocampo. Coagular la arcada arterial del hipocampo según sea necesario.
- Retira el hipocampo desconectado en bloque.
- Realizar la disección subpial de la circunvolución parahipocampal y el subículo, y asegurar la hemostasia en la cavidad quirúrgica resultante. Retira el hipocampo del pie, visualizando y protegiendo el tronco encefálico.
NOTA: Se debe tener cuidado al realizar el paso 2.4.7, ya que no hay un límite pial protector entre el pie y el tronco encefálico a este nivel.
- Imágenes intraoperatorias y cierre
- Retire todos los elementos metálicos del campo quirúrgico, cubra la herida y realice una resonancia magnética intraoperatoria, que generalmente incluye secuencias volumétricas T1, T2, FLAIR y DWI.
- Revise las imágenes intraoperatorias con un neurorradiólogo consultor junto con dos neurocirujanos consultores de epilepsia, para asegurarse de que la cantidad deseada de estructuras del lóbulo temporal mesial (incluida la porción temporal de la corteza piriforme, así como las cantidades variables de hipocampo como se describe anteriormente en el paso 2.36) se hayan resecado con éxito. También revise las imágenes de DWI para asegurarse de que no se hayan causado áreas de isquemia durante el procedimiento.
- Una vez confirmado lo anterior, trasladar al paciente de nuevo a la mesa de operaciones, y confirmar la hemostasia en la cavidad quirúrgica a normotensión para el paciente.
- Cierre la herida de manera estándar, reemplazando el colgajo óseo, asegurándolo con placas y tornillos en 3 puntos, y un cierre estándar de las capas de músculo, fascia y piel con suturas, dejando un drenaje quirúrgico de la herida en su lugar durante 24 h.
NOTA: Los cuidados postoperatorios se realizan en el centro de autores, normalmente en la unidad de alta dependencia neuroquirúrgica durante las primeras 24 horas, seguidos de un paso a una sala de especialistas en neurocirugía cuando la unidad de alta dependencia lo considera oportuno. Los pacientes son monitoreados para sus observaciones neurológicas, tienen sangre postoperatoria que incluye urea y electrolitos, hemograma completo y diferenciales, y generalmente son dados de alta aproximadamente 72 horas después de la operación. A continuación, se realiza un seguimiento ambulatorio de 4 a 6 semanas, y a los 3-4 meses y 1 año después de la operación, como mínimo, con imágenes a intervalos.
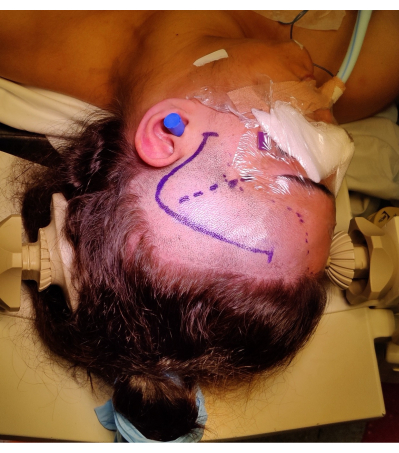
Figura 4: Imagen de la posición del paciente para una ATLR derecha, que muestra la marca del "signo de interrogación" en la incisión cutánea frontotemporal derecha, la línea del cabello y la fisura de Silvio. No se muestra el giro del hombro izquierdo debajo del hombro izquierdo del paciente para permitir el ángulo de la posición de la cabeza sin ejercer una tensión excesiva en el cuello del paciente y sin impedir el retorno venoso. Las imágenes fueron capturadas e incluidas con el consentimiento del paciente. Haga clic aquí para ver una versión más grande de esta figura.
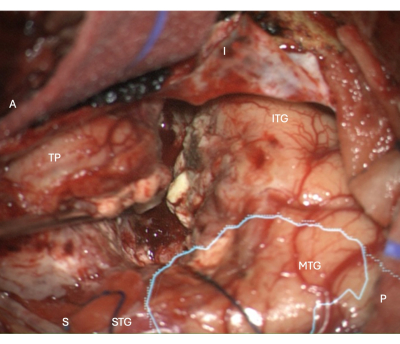
Figura 5: Imagen intraoperatoria del microscopio que muestra el margen de resección neocortical lateral en un ATLR derecho, con la máscara anatómica superpuesta de la radiación óptica (cian), lo que demuestra que el margen de resección es anterior al quirófano. Las etiquetas demuestran la orientación de la vista operatoria: A = anterior, P = posterior, I = inferior, S = superior, STG = circunvolución temporal superior, MTG = circunvolución temporal media, ITG = circunvolución temporal inferior, TP = polo temporal. Haga clic aquí para ver una versión más grande de esta figura.
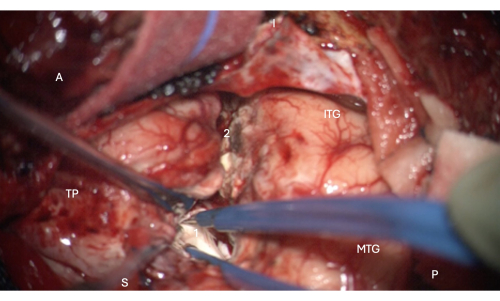
Figura 6: Imagen intraoperatoria del microscopio que muestra la entrada en la porción anterior del asta temporal del ventrículo lateral, mostrando la cabeza del hipocampo dentro del mismo (blanco pálido, 1). Etiquetas: A = anterior, P = posterior, I = inferior, S = superior, MTG = circunvolución temporal media, ITG = circunvolución temporal inferior, 2 = margen de resección neocortical lateral, siguiendo el surco colateral superiormente en la profundidad para encontrar el asta temporal del ventrículo lateral, TP = Polo Temporal. Haga clic aquí para ver una versión más grande de esta figura.
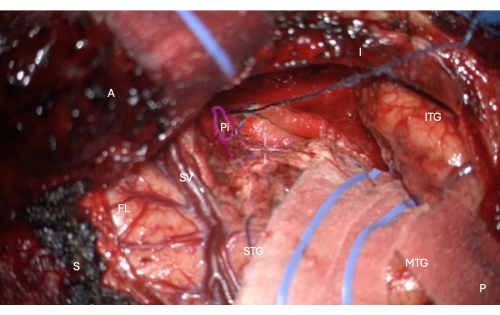
Figura 7: Imagen intraoperatoria del microscopio que demuestra la superposición de HUD de la máscara anatómica de la porción temporal de la corteza piriforme (contorno rosa, etiquetado como Pi). Esta figura muestra la resección completa: no queda tejido cerebral, solo el límite pial del surco endorinal mesial a la resección, protegido en esta imagen con la hamburguesa longitudinal superpuesta en la imagen, justo encima de la cruz blanca central del HUD del microscopio. Etiquetas: A = anterior, P = posterior, I = inferior, S = superior, STG = Circunvolución temporal superior, MTG = circunvolución temporal media, ITG = circunvolución temporal inferior, FL = lóbulo frontal, SV = venas silvianas (suprayacentes a la fisura de Silvio), Pi = porción temporal de la corteza piriforme. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Este protocolo y las técnicas quirúrgicas se han aplicado dentro de un estudio en curso, que investiga los efectos de la resección de la corteza temporal piriforme y su impacto en la ausencia de convulsiones después de la ATLR para DRmTLE. El objetivo de este estudio es determinar prospectivamente si la ausencia de convulsiones después de la extirpación de la corteza temporal piriforme mejora efectivamente la libertad de convulsiones en el DRmTLE, como sugiere el creciente cuerpo d...
Discusión
Este protocolo proporciona una resección confiable y dirigida de la porción temporal de la corteza piriforme, postulada como una estructura crucial en la epileptogénesis y propagación de la red de epilepsia del lóbulo temporal mesial 16,17,24,25,30.
Los componentes de la técnica estándar de A...
Divulgaciones
Los autores Debayan Dasgupta y John S. Duncan reciben fondos del Programa de Innovación de Wellcome Trust (218380/Z/19/Z). Lawrence P. Binding cuenta con el apoyo de Epilepsy Research UK (número de subvención P1904). Los autores antes mencionados y Sjoerd B. Vos están financiados en parte por el Centro de Investigación Biomédica del Instituto Nacional de Investigación en Salud del University College London Hospitals (NIHR BRC UCLH / UCL High Impact Initiative BW.mn.BRC10269). Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses. Confirmamos que hemos leído la posición de la Revista sobre los temas relacionados con la publicación ética y afirmamos que este informe es coherente con esas directrices.
Agradecimientos
Este trabajo fue apoyado por Epilepsy Research UK (subvención número P1904) y el Programa de Innovación de Wellcome Trust (218380/Z/19/Z). Este trabajo fue financiado en parte por el Centro de Investigación Biomédica del Instituto Nacional de Investigación en Salud del University College London Hospitals (NIHR BRC UCLH/UCL High Impact Initiative BW.mn.BRC10269). Los autores agradecen las instalaciones y la asistencia científica y técnica de la National Imaging Facility, una capacidad de la Estrategia Nacional de Infraestructura de Investigación Colaborativa (NCRIS), en el Centro de Microscopía, Caracterización y Análisis de la Universidad de Australia Occidental. Esta investigación fue financiada en su totalidad o en parte por el Wellcome Trust [WT 218380]. A los efectos del acceso abierto, el autor ha aplicado una licencia pública de derechos de autor CC BY a cualquier versión del manuscrito aceptada por el autor que surja de esta presentación.
Materiales
| Name | Company | Catalog Number | Comments |
| Brainlab Neuronavigation System | Brianlab, Westchester, IL | https://www.brainlab.com/surgery-products/overview-neurosurgery-products/cranial-navigation/ | Intraoperative neuronavigation system |
| EpiNav Planning Software | N/A | N/A | Clinical Decision Support Tool, for research use, developed in academia at King's College London and University College London |
| Mayfield clamp | Integra | A1059 | Any 3 pin head immobilisation device can be used |
| Microsurgical instruments | As per local neurosurgical unit | ||
| MRI Scanner | GE, Milwaukee, WI, USA | 3T MRI GE MR750 | Any alternative 3T MRI scanner can be used |
| MRTrix3 | N/A | Reference 47 in the manuscript | MRtrix3 provides a set of tools to perform various advanced diffusion MRI analyses, including constrained spherical deconvolution (CSD), probabilistic tractography, track-density imaging, and apparent fibre density |
| NORAS coil | NORAS MRI Products | https://www.noras.de/en/mri-produkte/lucy-or-head-holder-8-ch-coil/#infos | Any MRI-safe head immobilisation device can be used |
| Perforator drill | Stryker | https://neurosurgical.stryker.com/products/elite/ | Any alternative neurosurgical perforator drill driver and bit can be used |
| Sutures - Vicryl Plus 2/- | Ethicon | ETVCP684H | Any alternative suture that the surgeon prefers can be used |
| Titanium bone plates and screws | As per local neurosurgical unit | ||
| Ultrasonic Aspirator | Integra | https://products.integralife.com/cusa-tissue-ablation/category/cusa-tissue-ablation | Any alternative that the surgeon prefers can be used |
Referencias
- Marathe, K., et al. ablative and radiosurgical interventions for drug-resistant mesial temporal lobe epilepsy: A systematic review and meta-analysis of outcomes. Front Neurol. 12, 777845 (2021).
- Choi, H., et al. Epilepsy surgery for pharmacoresistant temporal lobe epilepsy: A decision analysis. JAMA. 300, 2497 (2008).
- Foldvary, N., et al. Seizure outcome after temporal lobectomy for temporal lobe epilepsy: A Kaplan-Meier survival analysis. Neurology. 54, 630-634 (2000).
- Spencer, S. S., et al. Predicting long-term seizure outcome after resective epilepsy surgery: The multicenter study. Neurology. 65, 912-918 (2005).
- Sperling, M. R., O'Connor, M. J., Saykin, A. J., Plummer, C. Temporal lobectomy for refractory epilepsy. JAMA. 276, 470-475 (1996).
- Wiebe, S. Effectiveness and safety of epilepsy surgery: What is the evidence. CNS Spectr. 9, 120-132 (2004).
- Gilliam, F., et al. Patient-oriented outcome assessment after temporal lobectomy for refractory epilepsy. Neurology. 53, 687-694 (1999).
- Markand, O. N., Salanova, V., Whelihan, E., Emsley, C. L. Health-related quality of life outcome in medically refractory epilepsy treated with anterior temporal lobectomy. Epilepsia. 41, 749-759 (2000).
- Jones, J. E., Berven, N. L., Ramirez, L., Woodard, A., Hermann, B. P. Long-term psychosocial outcomes of anterior temporal lobectomy. Epilepsia. 43, 896-903 (2002).
- Spencer, D. D., Spencer, S. S., Mattson, R. H., Williamson, P. D., Novelly, R. A. Access to the posterior medial temporal lobe structures in the surgical treatment of temporal lobe epilepsy. Neurosurgery. 15, 667-671 (1984).
- Vakharia, V. N., et al. Intraoperative overlay of optic radiation tractography during anteromesial temporal resection: A prospective validation study. J Neurosurg. 1, 1-10 (2021).
- Winston, G. P., et al. Preventing visual field deficits from neurosurgery. Neurology. 83, 604-611 (2014).
- Almairac, F., Herbet, G., Moritz-Gasser, S., de Champfleur, N. M., Duffau, H. The left inferior fronto-occipital fasciculus subserves language semantics: A multilevel lesion study. Brain Struct Funct. 220, 1983-1995 (2015).
- Binding, L. P., Dasgupta, D., Giampiccolo, D., Duncan, J. S., Vos, S. B. Structure and function of language networks in temporal lobe epilepsy. Epilepsia. 63, 1025-1040 (2022).
- Giampiccolo, D., Duffau, H. Controversy over the temporal cortical terminations of the left arcuate fasciculus: A reappraisal. Brain. 145, 1242-1256 (2022).
- Sone, D., et al. Optimal surgical extent for memory and seizure outcome in temporal lobe epilepsy. Ann Neurol. 91, 131-144 (2022).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690-700 (2019).
- Dasgupta, D., et al. Hippocampal resection in temporal lobe epilepsy: Do we need to resect the tail. Epilepsy Res. 190, 107086 (2023).
- Wu, C., et al. Effects of surgical targeting in laser interstitial thermal therapy for mesial temporal lobe epilepsy: A multicenter study of 234 patients. Epilepsia. 60, 1171-1183 (2019).
- Wiebe, S. A randomized, controlled trial of surgery for temporal-lobe epilepsy. N Engl J Med. 345 (5), 311-318 (2001).
- Brotis, A. G., et al. A meta-analysis on potential modifiers of LITT efficacy for mesial temporal lobe epilepsy: Seizure-freedom seems to fade with time. Clin Neurol Neurosurg. 205, 106644 (2021).
- Borger, V., et al. Resection of piriform cortex predicts seizure freedom in temporal lobe epilepsy. Ann Clin Transl Neurol. 8, 177-189 (2020).
- Borger, V., et al. Temporal lobe epilepsy surgery: Piriform cortex resection impacts seizure control in the long-term. Ann Clin Transl Neurol. 9 (8), 1206-1211 (2022).
- Hwang, B. Y., et al. Piriform cortex ablation volume is associated with seizure outcome in mesial temporal lobe epilepsy. Neurosurgery. 91, 414-421 (2022).
- Piper, R. J., et al. Extent of piriform cortex resection in children with temporal lobe epilepsy. Ann Clin Transl Neurol. 10, 1613-1622 (2023).
- Allison, A. C. The secondary olfactory areas in the human brain. J Anat. 88, 481-488 (1954).
- Ribas, G. C. The cerebral sulci and gyri. Neurosurg Focus. 28, E2 (2010).
- Young, J. C., Vaughan, D. N., Paolini, A. G., Jackson, G. D. Electrical stimulation of the piriform cortex for the treatment of epilepsy: A review of the supporting evidence. Epilepsy Behav. 88, 152-161 (2018).
- Mai, J. K., Majtanik, M., Paxinos, G. . Atlas of the Human Brain. , (2016).
- Vaughan, D. N., Jackson, G. D. The piriform cortex and human focal epilepsy. Front Neurol. 5, 259 (2014).
- Gale, K. Progression and generalization of seizure discharge: Anatomical and neurochemical substrates. Epilepsia. 29, S15-S34 (1988).
- Löscher, W., Ebert, U. The role of the piriform cortex in kindling. Prog Neurobiol. 50, 427-481 (1996).
- Piredda, S., Gale, K. A crucial epileptogenic site in the deep prepiriform cortex. Nature. 317, 623-625 (1985).
- McIntyre, D. C., Gilby, K. L. Mapping seizure pathways in the temporal lobe. Epilepsia. 49, 23-30 (2008).
- Fahoum, F., Lopes, R., Pittau, F., Dubeau, F., Gotman, J. Widespread epileptic networks in focal epilepsies: EEG-fMRI study. Epilepsia. 53, 1618-1627 (2012).
- Flanagan, D., Badawy, R. A. B., Jackson, G. D. EEG-fMRI in focal epilepsy: Local activation and regional networks. Clin Neurophysiol. 125, 21-31 (2014).
- Laufs, H., et al. Converging PET and fMRI evidence for a common area involved in human focal epilepsies. Neurology. 77, 904-910 (2011).
- Wieser, H. G., et al. Proposal for a new classification of outcome with respect to epileptic seizures following epilepsy surgery. Epilepsia. 42, 282-286 (2001).
- Dasgupta, D., Duncan, J. S. Optimizing epilepsy surgery. ISRCTN Registry. BMC. , (2020).
- Sparks, R., et al. Automated multiple trajectory planning algorithm for the placement of stereo-electroencephalography (SEEG) electrodes in epilepsy treatment. Int J CARS. 12, 123-136 (2017).
- Dasgupta, D. . Improving outcomes in anteromesial temporal lobe resections - A prospective surgical trial integrating multimodal imaging & novel hi-res tractography. , (2022).
- Winston, G. P., et al. Automated T2 relaxometry of the hippocampus for temporal lobe epilepsy. Epilepsia. 58, 1645-1652 (2017).
- Cardoso, M. J., et al. Geodesic information flows: Spatially-variant graphs and their application to segmentation and fusion. IEEE Trans Med Imaging. 34, 1976-1988 (2015).
- Winston, G. P., et al. Automated hippocampal segmentation in patients with epilepsy: Available free online. Epilepsia. 54, 2166-2173 (2013).
- Iqbal, S., et al. Volumetric analysis of the piriform cortex in temporal lobe epilepsy. Epilepsy Res. 185, 106971 (2022).
- Leon-Rojas, J. E., et al. Resection of the piriform cortex for temporal lobe epilepsy: a novel approach on imaging segmentation and surgical application. Br J Neurosurg. 1, 1-6 (2021).
- Tournier, J. -. D., et al. MRtrix3: A fast, flexible and open software framework for medical image processing and visualization. Neuroimage. 202, 116137 (2019).
- Cordero-Grande, L., Christiaens, D., Hutter, J., Price, A. N., Hajnal, J. V. Complex diffusion-weighted image estimation via matrix recovery under general noise models. Neuroimage. 200, 391-404 (2019).
- Vos, S. B., et al. The importance of correcting for signal drift in diffusion MRI. Magn Reson Med. 77, 285-299 (2017).
- Kellner, E., Dhital, B., Kiselev, V. G., Reisert, M. Gibbs-ringing artifact removal based on local subvoxel-shifts. Magn Reson Med. 76, 1574-1581 (2016).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. Neuroimage. 23, S208-S219 (2004).
- Andersson, J. L. R., Sotiropoulos, S. N. An integrated approach to correction for off-resonance effects and subject movement in diffusion MR imaging. Neuroimage. 125, 1063-1078 (2016).
- Leemans, A., Jones, D. K. The B-matrix must be rotated when correcting for subject motion in DTI data. Magn Reson Med. 61, 1336-1349 (2009).
- Tustison, N. J., et al. N4ITK: Improved N3 Bias Correction. IEEE Trans Med Imaging. 29, 1310-1320 (2010).
- Dhollander, T., Raffelt, D., Connelly, A. Unsupervised 3-tissue response function estimation from single-shell or multi-shell diffusion MR data without a co-registered T1 image. ISMRM Workshop on Breaking the Barriers of Diffusion MRI. 5, (2016).
- Binding, L. P., et al. Contribution of white matter fiber bundle damage to language change after surgery for temporal lobe epilepsy. Neurology. 100, e1621-e1633 (2023).
- Giampiccolo, D., et al. Thalamostriatal disconnection underpins long-term seizure freedom in frontal lobe epilepsy surgery. Brain. 146, 2377-2388 (2023).
- Smith, R. E., Tournier, J. -. D., Calamante, F., Connelly, A. Anatomically-constrained tractography: Improved diffusion MRI streamlines tractography through effective use of anatomical information. Neuroimage. 62, 1924-1938 (2012).
- Tournier, J. D., Calamante, F., Connelly, A. Improved probabilistic streamlines tractography by 2nd order integration over fibre orientation distributions. Proc 18th Annu Meet ISMRM. 1670, (2010).
- Yasargil, M. G., Fox, J. L. The microsurgical approach to intracranial aneurysms. Surg Neurol. 3, 7-14 (1975).
- Yasargil, M. G., et al. Microsurgical pterional approach to aneurysms of the basilar bifurcation. Surg. Neurol. 6, 83-91 (1976).
- Rao, D., Le, R. T., Fiester, P., Patel, J., Rahmathulla, G. An illustrative review of common modern craniotomies. J Clin Imaging Sci. 10, 81 (2020).
- Usui, N., Kondo, A., Nitta, N., Tottori, T., Inoue, Y. Surgical resection of amygdala and uncus. Neurol Med Chir (Tokyo). 58, 377-383 (2018).
- Vivas, A. C., Reintjes, S., Shimony, N., Vale, F. L. Surgery of the amygdala and uncus: A case series of glioneuronal tumors. Acta Neurochir. (Wien). 162, 795-801 (2020).
- Al-Otaibi, F., Baeesa, S. S., Parrent, A. G., Girvin, J. P., Steven, D. Surgical techniques for the treatment of temporal lobe epilepsy. Epilepsy Res Treat. 2012, 1-13 (2012).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados