A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שיפור התוצאות בכריתה של האונה הרקתית האנטרומזיאלית - הדגמה של כריתת קליפת המוח הפירפורמית הטמפורלית
In This Article
Summary
כאן, אנו מדגימים גישה להנחיה נוירוכירורגית תוך ניתוחית בכריתה של האונה הטמפורלית האנטרומזיאלית, תוך הדגשת השימוש בטרקטוגרפיה ובמסכות אנטומיות כדי לסייע בכריתה בטוחה של החלק הטמפורלי של קליפת המוח הפיריפורמית - אזור שנחשב יותר ויותר כמטרה כירורגית חיונית באפילפסיה של האונה הטמפורלית המזיאלית העמידה לתרופות.
Abstract
כריתת אונה טמפורלית אנטרומזיאלית (ATLR) היא אפשרות טיפול שימושית לאפילפסיה של האונה הטמפורלית המזיאלית העמידה לתרופות (DRmTLE). עדויות הולכות וגדלות מצביעות על כך שקליפת המוח הפיריפורמית ממלאת תפקיד מכריע ביצירת והתפשטות ההתקפים ב-DRmTLE - וכי כריתה של החלק הטמפורלי של קליפת המוח הפיריפורמית קשורה לשיפור משמעותי בשיעורי החופש מהתקפים.
כאן, אנו מציגים את הכריתה של החלק הטמפורלי של קליפת המוח הפיריפורמית ב-ATLR, תוך שימוש באלגוריתמים של טרקטוגרפיה הסתברותית טרום ניתוחית ברזולוציה גבוהה ומסכות אנטומיות ממוזגות של המבנים המעניינים לתוך הניווט העצבי התוך-ניתוחי והתצוגה העילית של המיקרוסקופ (HUD).
כל המטופלים שעברו הערכה וחקירות מקיפות לפני הניתוח עבור DRmTLE סיפקו הסכמה מדעת בכתב להקליט סרטון תוך ניתוחי של ההליך. החולים זוהו על ידי צוות רב תחומי מומחה של אפילפטולוגיה, נוירוכירורגים אפילפסיה, נוירופסיכולוגים, נוירופסיכיאטרים ואלקטרופיזיולוגים במרכז גדול לניתוחי אפילפסיה. צינור ההדמיה לפני הניתוח כלל תיחום של מבנים קריטיים. זה כלל את קליפת המוח הפיריפורמית הטמפורלית, וטרקטוגרפיה הסתברותית ברזולוציה גבוהה עבור מסלולים חיוניים בסיכון (למשל, קרינה אופטית ו-fronto-occipital fasciculus נחות). אלה נרשמו במשותף לסריקת הניווט העצבי הנפחי לפני הניתוח והועלו למערכת הניווט העצבי התוך ניתוחית.
מוצג כאן הליך שלב אחר שלב של ATLR, כולל כריתה של החלק הטמפורלי של קליפת המוח הפיריפורמית. הפרוטוקול משלב הדמיית MR מבנית ודיפוזיה מתקדמת ועזרים חזותיים תוך ניתוחיים כדי לשלב מסכות אנטומיות של מבני חומר אפור קריטיים ודרכי חומר לבן בזרימת העבודה הכירורגית בחדר הניתוח.
Introduction
כריתת האונה הרקתית האנטרומזיאלית (ATLR) היא הטיפול היעיל ביותר לאפילפסיה של האונה הרקתית המזיאלית העמידה לתרופות (DRmTLE)1,2, עם שיעורי שחרור מהתקפים של 50%-70% ותחלואה נמוכה יחסית 3,4,5. ההליך הוכח גם כמשפר את איכות החיים 6,7,8, שיעורי התעסוקה5 והרווחה הפסיכו-סוציאלית9.
ה-ATLR הקנוני, המתואר על ידי ספנסר ואחרים.10, כולל כריתה של הקוטב הטמפורלי, אונקוס, אמיגדלה, היפוקמפוס, פיתול פרה-היפוקמפוס ופיתול פיוזיפורמי. מסלולי חומר לבן קריטיים המעורבים בראייה (הקרינה האופטית, בפרט, לולאת מאייר11,12) והשפה (למשל, ה-fronto-occipital fasciculusהתחתון 13 וה-arcuate fasciculus 14,15) נמצאים בסיכון לפציעה בעת גישה לקרן הטמפורלית של החדר הצדדי. הפרוטוקול הבא מתאר גישה להימנעות ממסלולי החומר הלבן הללו באמצעות טרקטוגרפיה הסתברותית טרום ניתוחית ברזולוציה גבוהה ומסכות אנטומיות ממוזגות של המבנים המעניינים לתוך ניווט עצבי תוך ניתוחי ותצוגה עילית מיקרוסקופית (HUD).
ההבנה המסורתית של התחום היא שכריתת היפוקמפוס מקסימלית מועילה כדי למקסם את שיעורי החופש מהתקפים לאחר הניתוח. עם זאת, ניתוחים עדכניים של מקרים שלאחר ATLR מראים כי כריתה של החלק הטמפורלי של קליפת המוח הפיריפורמית ב-ATLR מגדילה מאוד את הסיכוי לחופש התקפים. הם גם הראו כי אין קשר בין כריתה אחורית של ההיפוקמפוס לבין חופש ההתקפים 16,17. בהתאם לכך, הוצע לעדכן את הטכניקה של ספנסר על ידי הגבלת כריתת ההיפוקמפוס ל-55% הקדמיים של ההיפוקמפוס, ב-ATLRs של חצי הכדור הדומיננטי בשפה, כדי לשמר את תפקוד הזיכרון16,18.
בעוד שיש עניין גובר בשימוש בטיפולים זעיר פולשניים חדשניים, במיוחד טיפול תרמי אינטרסטיציאלי בלייזר (LITT), כריתה כירורגית נותרה הסטנדרט לטיפול באפילפסיה מוקדית עמידה לתרופות1, והיעילות של LITT הוכחה כמייצרת שיעור נמוך יותר של תוצאות התקפי אנגל 1 (58%-59%)1,19 בהשוואה ל-ATLR (60%-70%)3, 4,5,20, ולכן הוא עדיין תחום הדורש חקירה נוספת21.
ישנו גוף הולך וגדל של ראיות התומכות בהשערה שקליפת המוח הפיריפורמית (איור 1) היא אזור קריטי בהתפשטות ו/או אפילפטוגנזה של התקפים אצל מבוגרים 16,17,22,23,24 וילדיםבני 25 עם אפילפסיה של האונה הרקתית המזיאלית. קליפת המוח הפיריפורמית היא סרט של אלוקורטקס תלת שכבתי (בדומה לסידור קליפת המוח ההיפוקמפוסית) העטוף סביב החריץ האנטורינלי לגזע הטמפורלי26,27, ולכן יוצר את המפגש של האונות הטמפורליות והקדמיות. לכן ניתן בקלות להתייחס אליו כמורכב מחלוקות חזיתיות וזמניות, המתוארות בפירוט בספרות 22,25,28,29,30.
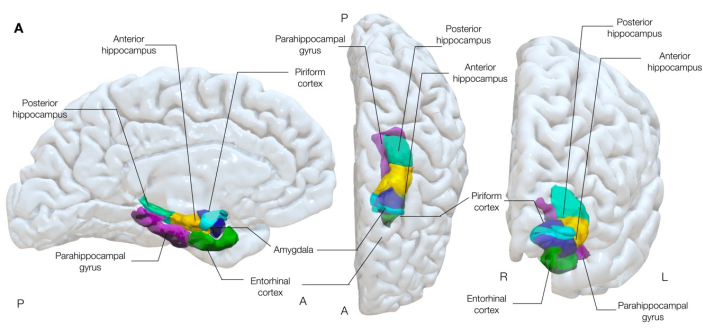
איור 1: עיבוד תלת-ממדי שקוף למחצה של מבנים טמפורליים מזיים של המוח. איור זה מדגים את האסוציאציות האנטומיות של קליפת המוח הפיריפורמית (ציאן) לאנטומיה של האונה הטמפורלית המזיאלית שמסביב. מבט מדיאלי שמאלי, מרכזי עליון וימני קדמי אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
קליפת המוח הפיריפורמית היא סופרו-מזיאלית לאמיגדלה וכבר מזמן מעורבת במחקרים בבעלי חיים כצומת נפוץ ברשתות המפיצות פריקות אפילפטוגניות31-33, ויוצרת התקפים בעקבות גירוי חשמלי ביתר קלות מאשר מבנים מזיאליים שכנים, כולל האמיגדלה וההיפוקמפוס34. מיקומו, עם קשרים נרחבים לקליפת המוח האנטורינלית, הלימבית, האורביטופרונטלית והאינסולרית, כמו גם לתלמוס, פקעת הריח, האמיגדלה וההיפוקמפוס, מתאים גם לתפקיד כמסלול התפשטות מרכזי של הפרשות אפילפטוגניות באפילפסיה מוקדית30.
מחקרי EEG-fMRI וטומוגרפיה של פליטת פוזיטרונים (PET) תומכים עוד יותר בתפקיד חשוב של קליפת המוח הפיריפורמית ב-DRmTLE, המראים הפעלה אינטריקטלית, וקשירת קולטן חומצה γ-אמינובוטירית מסוג A (GABAA) מופחתת בקליפת המוח הפיריפורמית קשורה לפעילות התקפים מוגברת 35,36,37.
שני מחקרי הדמיה משמעותיים שנערכו לאחרונה ב- DRmTLE הראו כי חופש התקפים לאחר הניתוח קשור להיקף גדול יותר של כריתה של קליפת המוח הפיריפורמית; גלוביץ' ועמיתיו הראו בקבוצה רטרוספקטיבית גדולה כי הסרה של לפחות מחצית מקליפת המוח הפירפורמית שיפרה את הסיכויים להיות חופשיים מהתקפים בפקטור של 16 (95% CI, 5-47; עמ' < 0.001)17. כמו כן, הוכח כי נפחי הכריתה של מבנים טמפורליים מזיאלים אחרים לא היו קשורים לחופש ההתקף, ממצא ששוחזר ונתמך על ידי ניתוחי ווקסל שבוצעו על ידי Sone et al., שהראו שרק כריתת קליפת המוח הפיריפורמית ב-TLE השמאלי הייתה קשורה לחופש התקפים16 (איור 2).
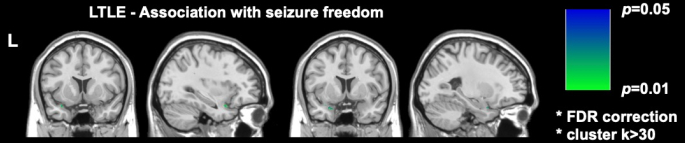
איור 2: קשר מבחינת ווקסל עם חופש התקפים לאחר ניתוח ב-TLE השמאלי. האזור היחיד שנמצא בקורלציה מובהקת עם חופש ההתקפים הוא החלק הזמני של קליפת המוח הפיריפורמית, p = 0.01 (ירוק בפרוסות MRI משוקללות T1 עטרה וסגיטלי). אומץ מ-Sone et al.16 באישור. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Borger et al. הראו גם בקבוצה רטרוספקטיבית גדולה שרק החלק היחסי של קליפת המוח הפיריפורמית הטמפורלית שנכרתה קשור לשיעורים משופרים של חופש מהתקפים הן בשנהו-3 והן במעקב ארוך יותר (ממוצע של 3.75 שנים)23. הם אישרו עוד כי הנפח שנכרת מההיפוקמפוס והאמיגדלה לא ניבא חופש התקפים.
החשיבות של ניתוק קליפת המוח הפיריפורמית מהרשת האפילפטוגנית החריגה ב-mTLE הודגמה גם ב-LITT, כאשר הואנג ועמיתיו הראו במעקב של 6 חודשים כי אחוז האבלציה של קליפת המוח הפיריפורמית היה קשור לתוצאות ILAE Class 138 (OR 1.051, 95% CI 1.001-1.117, p = 0.045), אך זו הייתה מגמה שלא הייתה מובהקת בשנה5. נראה כי זה תומך בנתונים המתפתחים לגבי LITT, שיש שיפור חיובי, אך פוטנציאלי פחות קבוע, בתוצאות ההתקפים, מה שהוביל לשימוש נפוץ ב-LITT כהליך "שלב ראשון", עם ניתוח כריתה המוצע לאלה שאצלם החופש מהתקפים אינו מושג על ידי LITT.
יש, אם כן, ראיות חזקות לכך שכריתה של החלק הטמפורלי של קליפת המוח הפיריפורמית כמטרה מרכזית בהשגת חופש התקפים באפילפסיה של האונה הרקתית המזיאלית העמידה לתרופות. עם זאת, כפי שהקבוצה הרטרוספקטיבית של Gallovic et al. הדגימה, סרט זה של קליפת המוח האנטורינלית נמצא במיקום קשה למטרה כירורגית בעת ביצוע ATLR, כלומר אם הוא לא מכוון ישירות, הוא לא תמיד מוסר בהצלחה. אנו מראים במחקר זה כיצד למקד ולכרות בבטחה את החלק הטמפורלי של קליפת המוח הפיריפורמית כחלק ממחקר כירורגי פרוספקטיבי מתמשך, כדי להעריך את השפעתו על שיפור שיעורי החופש מהתקפים לאחר הניתוח39.
המוקד של הפרוטוקול הבא הוא בהיבטים הטכניים של רכישת ועיבוד התמונה, הגישה הכירורגית וכיצד אנו מבטיחים כריתה של החלק הטמפורלי של קליפת המוח הפיריפורמית ב-ATLR, תוך שילוב טרקטוגרפיה הסתברותית טרום ניתוחית ברזולוציה גבוהה ומסכות אנטומיות מאוחות של המבנים המעניינים לתוך הניווט העצבי התוך-ניתוחי והתצוגה העילית של המיקרוסקופ (HUD). הפרוטוקול משתמש גם בפלטפורמת תוכנת תכנון ספציפית40, המאפשרת צפייה תלת מימדית ואינטגרציה של הדמיה מולטי-מודאלית לסקירה ותכנון כירורגי, ומערכת ניווט עצבי המאפשרת אינטגרציה עם המיקרוסקופ הניתוחי (הפרטים מפורטים בטבלת החומרים).
Protocol
שיטות ופרוטוקולים אלה הם חלק מניסוי כירורגי פרוספקטיבי מתמשך שאושר על ידי הרשות למחקר בריאות ב-10/09/2020, ועדת האתיקה של המחקר (REC) לונדון התייחסות: 20/LO/0966. הפרוטוקול נרשם באופן פרוספקטיבי: ISRCTN72646265, ב-25/09/2020, זמין באינטרנט39, והוצג בכנס ארצי41.
הפרוטוקול הבא מיושם על כל החולים העוברים ATLR עבור DRmTLE בחולים בגילאי 18-70 (קבוצת הגיל של החולים שנותחו להתוויה זו במרכז המומחה שלנו לניתוחי אפילפסיה למבוגרים), כולם מנותחים על ידי אותם מנתחים (AWM, AM). כל המשתתפים סיפקו הסכמה מדעת לפני הכללתם במחקר. כל המשתתפים עברו הערכה וחקירות יסודיות לפני הניתוח בהנחיית הצוות הרב-תחומי המומחה לאפילפסיה כירורגית במרכז המקיף לניתוחי אפילפסיה של המחברים, המורכב מנוירוכירורגים, נוירולוגים אפילפסיה, נוירופסיכולוגים, פסיכיאטרים, נוירורדיולוגים וחברים אחרים בשירותי המומחים לטיפולי אפילפסיה. לפני הניתוח, לכולם היו MRI נפחי T1, T2 ו-FLAIR עדכניים כמתואר בפרוטוקול שלהלן, כמו גם דם סטנדרטי לפני הניתוח וסקירה של צוות ההרדמה הנוירולוגית, כדי להבטיח שהם בטוחים להמשיך לניתוח בהרדמה כללית. הפרטים המסחריים של הריאגנטים והציוד המשמש במחקר זה מסופקים בטבלת החומרים.
1. קליטה ועיבוד הדמיה
הערה: סריקות הדמיית תהודה מגנטית (MRI) ברזולוציה גבוהה לפני הניתוח, 3 חודשים ושנה לאחר הניתוח נרכשות באופן שגרתי אצל אנשים העוברים ניתוח אפילפסיה במרכז שלנו. נתוני MRI נרכשו בין מרץ 2020 למרץ 2024 באותו סורק MRI לצורך עקביות. רכישת התמונה הסטנדרטית ורבים ממרכיבי העיבוד תוארו בעבר בספרות והם מוזכרים כראוי בפרוטוקול המסוכם להלן:
- רכוש את רצפי ה-MRI הבאים:
- רצף משוקלל T1 איזומטרי תלת-ממדי סטנדרטי (1 מ"מ) עם הד שיפוע מקולקל מהיר (IR-FSPGR) [זמן הד (TE) 3.1 אלפיות השנייה, זמן חזרה (TR) = 7.4 אלפיות השנייה, זמן היפוך = 400 אלפיות השנייה, שדה ראייה (FOV) = 224 × 256 × 256 מ"מ, מטריצה = 224 × 256 × 256, גודל ווקסל = 1.00 × 1.00 × 1.00 מ"מ = 1.00 מ"מ3, גורם תאוצה של הדמיה מקבילה = 2] ו;
- רצף משוקלל של הד כפול הד מהיר עם התאוששות מהירה של הד מהיר / T2 משוקלל המשמש עבור רלקסומטריית T242 (TE = 30/119 ms, TR = 7600 ms, FOV = 220 × 220 מ"מ, מטריצה = 512 × 512, עובי פרוסה = 4 מ"מ, גודל ווקסל = 0.43 × 0.43 × 4.00 מ"מ = 0.74 מ"מ3, גורם SENSE = 2).
- השתמש ברצף המשוקלל T1 לעיל כקלט לאלגוריתם זרימת המידע הגיאודזי (GIF v3) כדי לחלק את המוח ל-162 אזורים אנטומיים באמצעות NiftyWeb43.
- לייצר מסכות אנטומיות של המבנים המעניינים באמצעות פרצלציות GIF (פיתול פרה-היפוקמפוס, פיתול פיוזיפורמי, ליצור מידע פרופיל היפוקמפוס, ולפלח את ההיפוקמפוס ל-55% הקדמי והאחורי 45% באמצעות Hipposeg44), לכסות אותן בתוכנת התכנון על הדמיה טרום ניתוחית נפחית של המטופל (כמו בשלב 1.1).
- בצע פילוח אוטומטי של קליפת המוח הפיריפורמית ופצל את קליפת המוח הפיריפורמית לרכיבים קדמיים וטמפורליים מטכניקות הנפח שהוסברו בעבודה קודמת מהמעבדה שלנו 17,45,46. לאחר שנוצרו, שכבו את המסכות הללו על ההדמיה לפני הניתוח של המטופל.
- רכוש את תמונות ה-MRI הבאות של דיפוזיה:
- רכישה מרובת מעטפת ברזולוציה סטנדרטית (רזולוציה איזוטרופית של 2 מ"מ, כיווני שיפוע של 11, 8, 32 ו-64 בערכי b 0, 300, 700, 2500 s/mm2) ו;
- רכישה מרובת מעטפות ברזולוציה גבוהה (רזולוציה איזוטרופית של 1.6 מ"מ, 101 כיוונים, 14 b0, ערכי b: 300, 700 ו-2500 s/mm2).
- תקן את נתוני הדיפוזיה שנרכשו באמצעות MRtrix3 (https://mrtrix.org)47 עבור:
- רעש באמצעות "dwidenoise" ב-MRtrix348.
- סחף אות49.
- גיבס - צלצול באמצעות "mrdegibs" ב- MRtrix350.
- עיוות באמצעות שיפוע קידוד פאזה הפוכה עם אלגוריתם FSL TOPUP (https://fsl.fmrib.ox.ac.uk/fsl51).
- זרמי מערבולת וחפצי תנועה באמצעות אלגוריתם המערבולת של FSL (https://fsl.fmrib.ox.ac.uk/fsl)52, סיבוב וקטורי b53.
- שדה הטיה באמצעות אלגוריתם ANTs (https://mrtrix.org47,54).
- השתמש בדקונבולוציה כדורית מוגבלת מרובת מעטפת ורב-רקמות (CSD)55 כדי להעריך את תפקודי התגובה עבור חומר לבן ואפור, ונוזל מוחי שדרתי (CSF).
- בצע טרקטוגרפיה אוטומטית ממוקדת אנטומית כדי לשחזר חבילות סיבים מעניינות 12,56,57: הקרינה האופטית, Inferior fronto-occipital fasciculus (IFOF; מקרים דומיננטיים בשפה), ו-Fasciculus האורכי האמצעי (MLF; מקרים לא דומיננטיים בשפה). בצע את השלבים הבאים.
- חלץ נקודות סיום קליפת המוח עבור כל צרור סיבים וקבץ אותן להחזר ROI של זרעים וסיום.
- צור אזורים בקליפת המוח והחזר על ההשקעה באמצעות אזורים קליפת המוח שאינם מסיימים.
- בצע טרקטוגרפיה מוגבלת אנטומית58 באמצעות אלגוריתם מעקב הסיבים ההסתברותי iFOD259 באמצעות פילוח משטח ונפח היברידי ב-MRtrix347 תוך בחירת מקסימום של 5,000 קווי זרימה מתוך 300 מיליון זרעים.
- בצע את הטרקטוגרפיה בשלב 1.8.3 פעמיים עבור כל צרור סיבים, והחלף את החזר ה-ROI של הזרע והסיום.
- המר את חבילות הסיבים המתקבלות למפות הסתברותיות, סף בערך של 0.01 - השתמש בהן כקריטריוני אי הכללה נוספים להסרת קווי ייעול מזויפים.
- סקור את צרורות הסיבים המתקבלים (מורחבים ב -2 מ"מ) והמסכות האנטומיות בתוכנת התכנון כדי לוודא שהם מדויקים מבחינה אנטומית (שלב זה מבוצע על ידי שני נוירוכירורגים אפילפסיה ביחידה שלנו).
- רשום מרחבית את מסכות החומר האפור והחומר הלבן האנטומי המתקבלות לתמונת ה-MR המשוקללת T1 בשלב 1.1 ונטען למערכת הניווט התוך-ניתוחית בחדר הניתוח MRI תוך ניתוחי (iMRI).
- רכוש תמונות MRI נפחיות משוקללות T1, T2 ו-T2-FLAIR מיד לפני הניתוח (< 24 שעות) עם סימני עור על קרקפת המטופל. רשמו את התמונות הללו זו לזו, ואת תמונת הייחוס והמסכות המשוקללות T1 שתוארו לעיל, והודגמו באיור 3.
- רשום את המטופל במערכת הניווט העצבי עם לייזר תואם משטח ומצביע חכם.
- ודא את דיוק הרישום המשותף של התמונה והמטופל עם שני נוירוכירורגים אפילפסיה לפני תחילת המקרה כדי להבטיח דיוק.
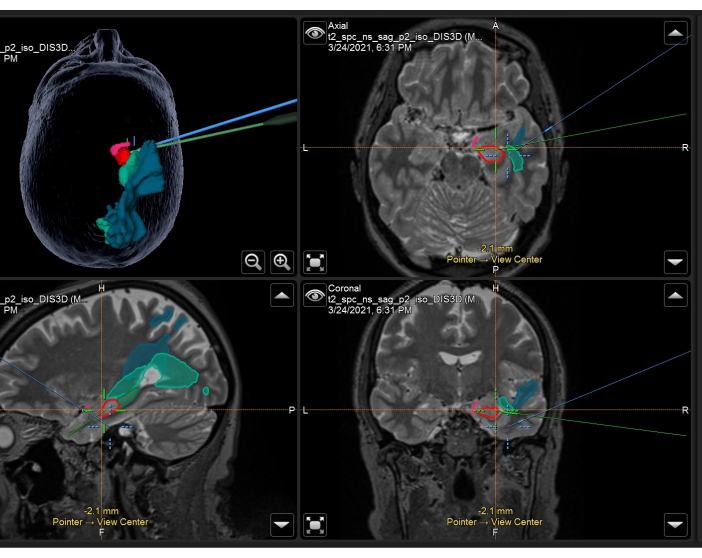
איור 3: צילום מסך של מערכת ניווט עצבי המדגימה את ה-MRI המשוקלל T2 הנפחי עם מסכות אנטומיות ומסכות המשמשות תוך ניתוחי ב-ATLR ימני. פנל שמאלי למעלה: שחזור תלת מימדי של ראש המטופל, הדגמת מסכות אנטומיות. מימין למעלה: צירי, משמאל למטה: סגיטל, ומימין למטה: תצוגות עטרה המציגות גם מסכות אנטומיות שכבות על סריקת MRI נפחית משוקללת T2. מסכות אנטומיות מוצגות: החלק הטמפורלי של קליפת המוח הפיריפורמית (ורוד), קדמי 55% מההיפוקמפוס (אדום), אחורי 45% מההיפוקמפוס (ירוק כהה, נראה רק בתמונה סגיטלית), קרינה אופטית (אמצע ירוק), פאסיקולוס אורכי אמצעי (כחול). הכוונת הכחולה היא המיקום המשולב של מוקד המיקרוסקופ, והכוונת הירוקה היא המיקום של מצביע הניווט העצבי המשמש בתחום הניתוח. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
2. טכניקה כירורגית
הערה: השלבים שלהלן מסכמים את הפרקטיקה במרכז המחברים ואינם מיועדים להוות אקספוזיציה של הגישה הכירורגית היחידה ל-ATLR, אלא הדגמה כיצד המחברים תקנו את הגישה להליך זה כדי לספק כריתות אמינות וניתנות לשחזור, כולל כריתה של קליפת המוח הפיריפורמית הטמפורלית.
- מיקום וגישה
- לאחר בדיקות ואמצעי בטיחות סטנדרטיים לפני הניתוח, מקם את המטופל בשכיבה, הרם את הכתף המקבילה בגלגול וסובב את הראש לצד הנגדי.
- כופפו את הראש לרוחב כדי להבטיח שהבולטות המלרית היא הנקודה הגבוהה ביותר של השדה הכירורגי, וקבעו בפינים (מכשיר לקיבוע גולגולת 3 נקודות - ראה דוגמאות, כולל אלה התואמים לתיאטראות [iMRI] תוך ניתוחיים בטבלת החומרים).
הערה: המיקום חיוני כדי לאפשר גישה נאותה למבני האונה הטמפורלית המרכזית והאחורית, במיוחד הכיפוף הרוחבי, כדי להבטיח שהבולטות המלרית היא הנקודה הגבוהה ביותר של השדה הכירורגי. - הסתנן לחומר הרדמה מקומי כדי להצמיד אתרים וחתך בעור.
- רשום את מרחב המטופל למערכת הניווט העצבי באמצעות שילוב של נאמנות עור ומעקב אחר פני השטח (ספציפי למותג מערכת הניווט העצבי בו נעשה שימוש). אשר את דיוק הרישום מול ציוני דרך גרמיים/אנטומיים אחרים מוחשיים או גלויים.
- סמן את קו השיער ואת שורש הזיגומה (מזוהה על ידי מישוש ידני). לזהות ולסמן את מהלך הסדק הסילביאני באמצעות הניווט העצבי, וחתך העור הפרונטו-טמפורלי המתוכנן בסימן שאלה.
- הסר שיער לאורך חתך העור המתוכנן באמצעות קוצץ שיער חשמלי.
- בצע חתך פרונטו-טמפורלי מ-1 ס"מ לפני הטראגוס, מתעקל בצורה של סימן שאלה, כדי למנוע פגיעה בענף הפרונטו-טמפורלי של עצב הפנים. זהה ושמר את העורק הטמפורלי השטחי במידת האפשר. מיקום וסימון חתך העור מוצגים באיור 4.
- כסו ואבטחו את קצוות הפצע בעזרת ספוגיות מסטואיד ספוגות אנטי מיקרוביאליות וקליפסים של רני.
- חתך את שריר הטמפורליס והרם אותו בדש שריר עורי או בין-פאשיאלי/תת-פאשיאלי (מניעת פגיעה בענף הפרונטו-טמפורלי של עצב הפנים).
- עטפו את דש העור בגזה ספוגה בתמיסה אנטי-מיקרוביאלית ומשכו אותה קדימה (הימנעו משימוש במכשירי אבטחת מתכת אם נמצאים באולמות iMRI).
- צור 2 חורי בור בגולגולת בעזרת מקדחת מחורר: הראשון ממש מעל שורש הזיגומה כדי למקסם את החשיפה הנחותה, השני הקדמי התחתון כדי להקל על הדמיה של הסדק הסילבי.
- בצע קרניוטומיה פרונטו-טמפורלית סטנדרטית 60,61,62, תוך חשיפת הבליטה הטמפורלית העליונה והאמצעית 1 ס"מ מעל הסדק הסילבי.
- קדחו את השוליים הקדמיים והתחתונים של הגולגולת כדי לאפשר גישה נוחה לרצפת הפוסה הטמפורלית האמצעית כמו גם לקוטב הטמפורלי מלפנים. אם נתקלים בתאי אוויר מסטואידים, אטמו אותם בשעוות עצם ודבק פיברין הן במפגש איתם והן בסוף ההליך לפני סגירת שכבות שטחיות לעצם.
הערה: חשוב לוודא שהגולגולת מאפשרת גישה לרצפת הפוסה הגולגולתית האמצעית, מכיוון שזו תהיה הגישה לקרן הטמפורלית של החדר הצדדי דרך החריץ הצדדי. כמו כן, חשוב לאטום היטב את כל תאי האוויר המסטואידים שנתקלו בהם כדי למנוע דליפת CSF לאחר הניתוח וכתוצאה מכך תסמינים וזיהומים פוטנציאליים. - פתח את הדורה בצורה בצורת U כשהבסיס משתקף מלפנים ומורחב בצורה כוכבית. הרחיקו את הדורה משדה הניתוח בעזרת תפרים (כגון 3-0 משי).
- שחרר CSF מרצפת הפוסה הגולגולתית האמצעית ומההיבט הקדמי של פוסה הגולגולת האמצעית.
הערה: שלב שחרור ה-CSF חשוב כדי לאפשר מרחב עבודה מספיק לגישה כירורגית לרצפת הפוסה הגולגולתית האמצעית ולחריץ הצדדי מלמטה ללא נסיגה ועומס על האונה הטמפורלית הבסיסית.
- הסרה ניאו-קורטיקלית לרוחב
- קרישת ה-pia של הגירי הטמפורלי האמצעי והתחתון (MTG ו-ITG, בהתאמה) בקו בניצב לבסיס הגולגולת ובקו עם ההקרנה הקדמית של הקרן הטמפורלית של החדר הצדדי (אושר במערכת ניווט עצבי). התאם את ההיקף הקדמי-אחורי של קו זה על בסיס כל מקרה לגופו בהתאם לראיות הטרום-ניתוחיות למעורבות ניאו-קורטיקלית רוחבית בהופעת/התפשטות ההתקף.
הערה: ההיקף הקדמי-אחורי של הכריתה הניאו-קורטיקלית לרוחב צריך לקחת בחשבון את הראיות הטרום-ניתוחיות (או היעדרן) למעורבותה בהתפשטות ההתקפים, וזה מותאם למטופל הבודד. - השתמש בגישה טרנס-קורטיקלית ב-ITG כדי לחשוף את רצפת הפוסה הגולגולתית האמצעית ולזהות את החריץ הצדדי, שהוא לרוחב הפיתול הפרה-היפוקמפוס והמדיאלי לפיתול הפיוזיפורמי.
- קרש את ה-pia של הפיתול הטמפורלי העליון (STG) הקדמי לחתך הניאו-קורטיקלי הצדדי לעיל, במקביל לכיוון הסדק הסילבי. זה מאונך לקו המתואר בשלב 2.16, ומשתרע מלפנים לקוטב הטמפורלי.
- פתח את המישור בין STG לסדק סילבי באמצעות טכניקות דיסקציה תת-פיאלית, המגן על ענפי עורק המוח האמצעי, ונשא דיסקציה זו למטה לחלק האופקי של הסדק הסילבי עד לרמת החריץ המגביל התחתון של האינסולה.
הערה: יש להקפיד על שמירה על שלמות ה-pia של ה-STG הגובל בסדק הסילבי בעת ביצוע הדיסקציה התת-פיאלית בשלב 2.2.4, מכיוון שהדבר מגן על ענפי עורק המוח האמצעי בסדק, כמו גם על מבנים אחרים כגון העצב האוקולומוטורי והעורק המתקשר האחורי (שלב 2.2.14) ודרכי הראייה (שלב 2.3) בהמשך הניתוח. - שלב את המיקרוסקופ עם מערכת הניווט העצבי.
- אשר את הדיוק של שכבות האובייקט של המסכות האנטומיות המתוארות בסעיף 1 ודמיין אותן במיקרוסקופ HUD.
- הטה את קו הכריתה האחורי קדימה כדי למזער את הכריתה של STG, והאריך אותו בהדרגה דרך ה-MTG וה-ITG, דרך הבליטה הפיוזיפורמית אל החריץ הצדדי.
- בדוק את הקשר בין שולי הכריתה האחורית למערכת הניווט העצבי עם מסכת הקרינה האופטית (OR) המוצגת.
- דמיין את ההיקף הקדמי המקסימלי של מסכת ה-OR במיקרוסקופ וודא שהיא אחורית לשולי הכריתה במיקרוסקופ HUD כדי להבטיח שלא ייגרם נזק ל-OR, מה שיגרום לגירעון בשדה הראייה לאחר הניתוח, כפי שמודגם באיור 5.
הערה: שלב 2.2.9 הוא צעד קריטי למניעת ליקוי בשדה הראייה לאחר הניתוח עקב נזק ללולאת הקרינה האופטית של מאייר. אם יש תזוזה מוחית רבה והמנתח רוצה למזער עוד יותר את הסיכון לנזק לקרינה האופטית, או אם ההקרנות על ה-HUD של המיקרוסקופ אינן פועלות כהלכה, המחברים מציעים להשתמש במצביע הניווט העצבי כדי לכוון את הגישה לקצה הקדמי ביותר של הקרן הרקתית של החדר הצדדי, מכיוון שהדבר ממזער את הסיכון לפציעה ב-OR. - עקוב אחר החריץ הצדדי בצורה מעולה עד שנתקלים בקרן הטמפורלית (אשר זאת במערכת הניווט העצבי), כפי שמוצג באיור 6. ניתן לזהות את דופן הקרן הטמפורלית על ידי אפנדימה בגוון כחול.
הערה: אצל אנשים בהם הפתולוגיה אינה טרשת היפוקמפוס, וראש ההיפוקמפוס מגושם, החדר יכול להיות קשה למצוא. במקרים אלה, אפשרות לפתרון בעיות היא להשתמש במצביע הניווט העצבי בבסיס הפוסה הטמפורלית האמצעית שבה אין תזוזה כדי למצוא היכן קצה החדר מקרין. בדרך כלל מועיל לחפש את זה במישור עטרה. אם לא ניתן למצוא את החדר, אנו מציעים להסיר תחילה את המוט ולאחר מכן למצוא את החדר עם השואב האולטראסוני. - חלקו את הלפטומנינגים הטמפורליים הבסיסיים לרוחב לחשיפה לקרן הטמפורלית.
- פתח את החדר מלפנים כדי לחשוף את ראש ההיפוקמפוס (כפי שמודגם באיור 6).
- הרחב את שולי הכריתה האחורית כדי להצטרף לניתוק לחדר וזה מאפשר ניתוק של הגוש הניאו-קורטיקלי.
- גייס את הקוטב הטמפורלי בעקבות קו החיתוך בשולי הקצה הטנטוריאלי. הקפד לא לבצע את הניתוק מעל קצה הטנטוריום כדי למנוע פגיעות במבנים מזיאליים, כולל העצב האוקולומוטורי והעורק המתקשר האחורי.
הערה: כדי להפחית את הסיכון לפגיעה במבנים בבור המים, עקוב אחר צורת קצה הטנטוריום מבלי לעבור את קצה האוהל. ה-uncus יישאר במקומו וניתן לקחת אותו כדגימה נפרדת.
- קרישת ה-pia של הגירי הטמפורלי האמצעי והתחתון (MTG ו-ITG, בהתאמה) בקו בניצב לבסיס הגולגולת ובקו עם ההקרנה הקדמית של הקרן הטמפורלית של החדר הצדדי (אושר במערכת ניווט עצבי). התאם את ההיקף הקדמי-אחורי של קו זה על בסיס כל מקרה לגופו בהתאם לראיות הטרום-ניתוחיות למעורבות ניאו-קורטיקלית רוחבית בהופעת/התפשטות ההתקף.
- כריתה טמפורלית מזיאלית, כולל קליפת המוח הפיריפורמית הטמפורלית
- נקה את רקמת האונקוס עם דיסקציה ושימוש בשואב האולטראסוני באופן מזאלי עד שהעצב האוקולומוטורי והעורק המתקשר האחורי נראים לעין. עצור את היקף הכריתה האחורית כאשר מדמיינים את ה-pes (ההיקף המזיאלי ביותר של ראש ההיפוקמפוס).
- בצע את כריתת האמיגדלה עם השואב האולטראסוני, מוגבל באופן עליון על ידי הפיה של החריץ האנדרורינלי, ועד לדמיון דרכי הראייה, ובאופן מזאלי על ידי מישור הפיאל של בורות הבסיס.
הערה: הקפד לשמור על הגבעול הטמפורלי ולא להיכנס לאונה הקדמית בעת ביצוע שלב 2.3.2. לעיתים, עקב תזוזה מוחית, הניווט העצבי עשוי להעריך יתר על המידה את היקף הכריתה באופן מזיאלי; בהקשר זה, הכריתה בטוחה להמשיך עד לדרכי הראייה דרך ה-PIA, וזה מייצג את הגבול המזיאלי של הכריתה. זה מתואר גם ב-Usui et al.63השוליים הגביים של האמיגדלה מתוארים בדרך כלל כמשוערים על ידי קו דמיוני המחבר את הנקודה הכורואידית להתפצלות עורק המוח האמצעי הפרוקסימלי64. - ודא שהחלק הטמפורלי של קליפת המוח הפיריפורמית נכרת על ידי הסרת כל רקמה שיורית באמצעות דיסקציה תת-פיאלית המתקדמת בצורה נחותה מהצד הטמפורלי של הסדק הסילבי עד להדמיה של הווריד של החריץ המעגלי התחתון של האינסולה. זהו שולי כריתה דומים לאלה שתוארו על ידי Usui et al. בעת כריתת נגעים אמיגדלריים-לא קליים63.
הערה: אם קשה להסיר את ה-uncus (בשלב 2.3.1) או את קליפת המוח הפיריפורמית (לפעמים, הם יכולים להיות דבוקים מאוד ל-pia mater), המחברים מציעים להשתמש בדיסקטור רוטון ולא בשואב האולטראסוני כדי למזער את הפגיעה בפיה מאטר. - אשר כריתה של החלק הטמפורלי של קליפת המוח הפיריפורמית באמצעות המסכה האנטומית המתוארת בשלב 1.4 המונחת על המיקרוסקופ HUD, כפי שמודגם באיור 7.
- כריתת היפוקמפוס
- הנח לינטינים (או כותנה רחבה דומה) כדי להחזיר את מקלעת הכורואיד (ועורק הכורואיד הקדמי) באופן מזאלי כדי להקל על הדמיית ההיפוקמפוס של פימבריה.
- נתק את ההיפוקמפוס של פימבריה מהחיבור הארכנואיד שלו, וחשוף את החריץ ההיפוקמפוס הנושא את ארקייד כלי הדם העורקי של קרן האמון.
- נתק את ההיפוקמפוס מזנבו (או להגביל את הכריתה הזו ל-55% הקדמיים של ההיפוקמפוס בכריתות חצי כדור דומיננטי בשפה בניסיון למזער ליקויים בזיכרון מילולי כמתוארב-16, או להרחיב לאחור כמו רמת הטקטום של המוח התיכון בכריתות המיספרה דומיננטיות שאינן שפה).
- נתק את ראש ההיפוקמפוס מההיפוקמפוס pes. קרש את ארקייד עורקי ההיפוקמפוס כנדרש.
- הסר את ההיפוקמפוס המנותק בגוש.
- בצע דיסקציה תת-פיאלית של הפיתול הפרה-היפוקמפוס והסוביקולום, וודא המוסטזיס בחלל הניתוח שנוצר. הסר את ההיפוקמפוס pes, הדמיה והגנה על גזע המוח.
הערה: יש לנקוט בזהירות בעת ביצוע שלב 2.4.7, מכיוון שאין גבול פיאל מגן בין ה-pes לגזע המוח ברמה זו.
- הדמיה וסגירה תוך ניתוחית
- הסר את כל הפריטים המתכתיים משדה הניתוח, כסה את הפצע ובצע סריקת MRI תוך ניתוחית, בדרך כלל כולל רצפי T1, T2, FLAIR ו-DWI נפחיים.
- סקור את ההדמיה התוך ניתוחית עם נוירורדיולוג יועץ לצד שני נוירוכירורגים יועצים לאפילפסיה, כדי לוודא שהכמות הרצויה של מבני האונה הטמפורלית המזיאלית (כולל החלק הטמפורלי של קליפת המוח הפיריפורמית, כמו גם הכמויות המשתנות של ההיפוקמפוס כמתואר לעיל בשלב 2.36) נכרתו בהצלחה. סקור גם את הדמיית ה-DWI כדי לוודא שלא נגרמו אזורים של איסכמיה במהלך ההליך.
- לאחר אישור האמור לעיל, העבר את המטופל בחזרה לשולחן הניתוחים, ואשר המוסטזיס בחלל הניתוח בנורמוטנס עבור המטופל.
- סגור את הפצע בצורה סטנדרטית, החלף את דש העצם, אבטח אותו עם צלחות וברגים ב-3 נקודות, וסגירה סטנדרטית של שכבות השריר, הפאשיה והעור עם תפרים, והשאיר ניקוז פצע כירורגי במקומו למשך 24 שעות.
הערה: הטיפול לאחר הניתוח הוא במרכז המחברים, בדרך כלל ביחידה הנוירוכירורגית עם תלות גבוהה במשך 24 השעות הראשונות, ולאחר מכן ירידה למחלקת מומחים נוירוכירורגית כאשר היחידה עם תלות גבוהה מרגישה שזה מתאים. המטופלים נמצאים במעקב אחר התצפיות הנוירולוגיות שלהם, יש להם דם לאחר הניתוח כולל אוריאה ואלקטרוליטים, ספירת דם מלאה ודיפרנציאלים, והם משוחררים בדרך כלל כ-72 שעות לאחר הניתוח. לאחר מכן הם נמצאים במעקב כאשפוז חוץ תוך 4-6 שבועות, ובגיל 3-4 חודשים ושנה לאחר הניתוח כמינימום עם הדמיית מרווחים.
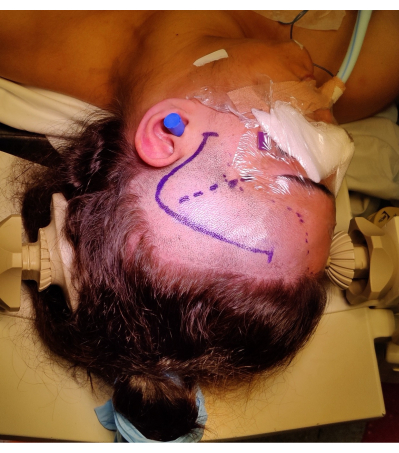
איור 4: תמונה של מיקום המטופל עבור ATLR ימני, המדגימה סימון של 'סימן שאלה' חתך עור פרונטו-טמפורלי ימני, קו שיער וסדק סילבי. לא בתמונה גלגול הכתף השמאלית מתחת לכתף שמאל של המטופל כדי לאפשר את זווית מיקום הראש מבלי להפעיל עומס מיותר על צוואר המטופל, ולא לעכב את חזרת הווריד. התמונות צולמו ונכללו בהסכמת המטופל. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
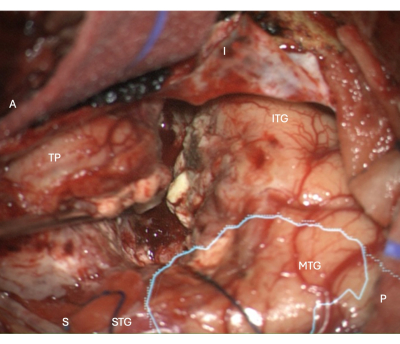
איור 5: תמונה תוך ניתוחית מהמיקרוסקופ המדגימה את שולי הכריתה הניאו-קורטיקלית לרוחב ב-ATLR ימני, עם המסכה האנטומית המונחת של הקרינה האופטית (ציאן) - המדגימה ששולי הכריתה קדמיים ל-OR. תוויות מדגימות את הכיוון של ההשקפה האופרטיבית: A = קדמי, P = אחורי, I = נחות, S = עליון, STG = פיתול טמפורלי עליון, MTG = פיתול טמפורלי אמצעי, ITG = פיתול טמפורלי נחות, TP = קוטב טמפורלי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
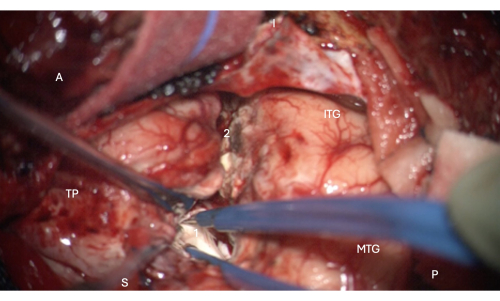
איור 6: תמונה תוך ניתוחית מהמיקרוסקופ המדגימה כניסה לחלק הקדמי של הקרן הרקתית של החדר הצדדי, המראה את ראש ההיפוקמפוס בתוכו (לבן חיוור, 1). תוויות: A = קדמי, P = אחורי, I = נחות, S = עליון, MTG = פיתול טמפורלי אמצעי, ITG = פיתול טמפורלי נחות, 2 = שולי כריתה ניאו-קורטיקלית לרוחב, בעקבות החריץ הצדדי בעומק כדי למצוא את הקרן הטמפורלית של החדר הצדדי, TP = קוטב טמפורלי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
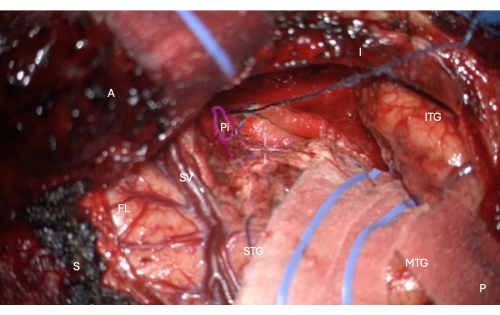
איור 7: תמונה תוך-ניתוחית מהמיקרוסקופ המדגימה שכבת HUD של המסכה האנטומית של החלק הטמפורלי של קליפת המוח הפיריפורמית (מתאר ורוד, מסומן Pi). איור זה מדגים כריתה מלאה - לא נותרה רקמת מוח, רק הגבול הפיאלי של החריץ האנדורינלי המזיאלי לכריתה, מוגן בתמונה זו עם הקציצה האורכית המכסה בתמונה, ממש מעל הכוונת הלבנה המרכזית של המיקרוסקופ HUD. תוויות: A = קדמי, P = אחורי, I = נחות, S = עליון, STG = פיתול טמפורלי עליון, MTG = פיתול טמפורלי אמצעי, ITG = פיתול טמפורלי נחות, FL = אונה קדמית, SV = ורידים סילביאניים (מעל הסדק הסילבי), Pi = חלק טמפורלי של קליפת המוח הפיריפורמית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
תוצאות
פרוטוקול זה והטכניקות הכירורגיות יושמו במחקר מתמשך, החוקר את ההשפעות של כריתת קליפת המוח הפיריפורמית הטמפורלית והשפעתה על חופש ההתקפים בעקבות ATLR עבור DRmTLE. מטרת מחקר זה היא לקבוע באופן פרוספקטיבי האם חופש ההתקפים לאחר הסרת קליפת המוח הפיריפורמית הטמפורלית אכן משפר את ח?...
Discussion
פרוטוקול זה מספק כריתה אמינה וממוקדת של החלק הטמפורלי של קליפת המוח הפיריפורמית - ההנחה היא שהוא מבנה מכריע באפילפטוגנזה ובהתפשטות של רשת האפילפסיה של האונה הטמפורלית המזיאלית 16,17,24,25,30.
Disclosures
המחברים דביאן דסגופטה וג'ון ס. דאנקן מקבלים מימון מתוכנית החדשנות של Wellcome Trust (218380/Z/19/Z). Lawrence P. Binding נתמך על ידי Epilepsy Research UK (מספר מענק P1904). המחברים הנ"ל ו-Sjoerd B. Vos ממומנים בחלקם על ידי המכון הלאומי לחקר הבריאות, המרכז למחקר ביו-רפואי של בתי החולים של אוניברסיטת קולג' לונדון (NIHR, BRC, UCLH/UCL High Impact Initiative, BW.mn.BRC10269). המחברים מצהירים כי המחקר נערך בהיעדר קשרים מסחריים או פיננסיים כלשהם שיכולים להתפרש כניגוד אינטרסים פוטנציאלי. אנו מאשרים כי קראנו את עמדת כתב העת בנושאים הקשורים לפרסום אתי ומאשרים כי דו"ח זה עולה בקנה אחד עם הנחיות אלה.
Acknowledgements
עבודה זו נתמכה על ידי Epilepsy Research UK (מספר מענק P1904) ותוכנית החדשנות של Wellcome Trust (218380/Z/19/Z). עבודה זו מומנה בחלקה על ידי המכון הלאומי לחקר הבריאות, המרכז למחקר ביו-רפואי של בתי החולים בלונדון (NIHR, BRC, UCLH/UCL High Impact Initiative, BW.mn.BRC10269). המחברים מכירים במתקנים ובסיוע המדעי והטכני של מתקן ההדמיה הלאומי, יכולת אסטרטגיית תשתית מחקר שיתופית לאומית (NCRIS), במרכז למיקרוסקופיה, אפיון וניתוח, אוניברסיטת מערב אוסטרליה. מחקר זה מומן במלואו, או בחלקו, על ידי קרן וולקאם [WT 218380]. לצורך גישה פתוחה, המחבר החיל רישיון זכויות יוצרים ציבורי CC BY על כל גרסה של כתב יד המקובל על ידי המחבר הנובעת מהגשה זו.
Materials
| Name | Company | Catalog Number | Comments |
| Brainlab Neuronavigation System | Brianlab, Westchester, IL | https://www.brainlab.com/surgery-products/overview-neurosurgery-products/cranial-navigation/ | Intraoperative neuronavigation system |
| EpiNav Planning Software | N/A | N/A | Clinical Decision Support Tool, for research use, developed in academia at King's College London and University College London |
| Mayfield clamp | Integra | A1059 | Any 3 pin head immobilisation device can be used |
| Microsurgical instruments | As per local neurosurgical unit | ||
| MRI Scanner | GE, Milwaukee, WI, USA | 3T MRI GE MR750 | Any alternative 3T MRI scanner can be used |
| MRTrix3 | N/A | Reference 47 in the manuscript | MRtrix3 provides a set of tools to perform various advanced diffusion MRI analyses, including constrained spherical deconvolution (CSD), probabilistic tractography, track-density imaging, and apparent fibre density |
| NORAS coil | NORAS MRI Products | https://www.noras.de/en/mri-produkte/lucy-or-head-holder-8-ch-coil/#infos | Any MRI-safe head immobilisation device can be used |
| Perforator drill | Stryker | https://neurosurgical.stryker.com/products/elite/ | Any alternative neurosurgical perforator drill driver and bit can be used |
| Sutures - Vicryl Plus 2/- | Ethicon | ETVCP684H | Any alternative suture that the surgeon prefers can be used |
| Titanium bone plates and screws | As per local neurosurgical unit | ||
| Ultrasonic Aspirator | Integra | https://products.integralife.com/cusa-tissue-ablation/category/cusa-tissue-ablation | Any alternative that the surgeon prefers can be used |
References
- Marathe, K., et al. ablative and radiosurgical interventions for drug-resistant mesial temporal lobe epilepsy: A systematic review and meta-analysis of outcomes. Front Neurol. 12, 777845 (2021).
- Choi, H., et al. Epilepsy surgery for pharmacoresistant temporal lobe epilepsy: A decision analysis. JAMA. 300, 2497 (2008).
- Foldvary, N., et al. Seizure outcome after temporal lobectomy for temporal lobe epilepsy: A Kaplan-Meier survival analysis. Neurology. 54, 630-634 (2000).
- Spencer, S. S., et al. Predicting long-term seizure outcome after resective epilepsy surgery: The multicenter study. Neurology. 65, 912-918 (2005).
- Sperling, M. R., O'Connor, M. J., Saykin, A. J., Plummer, C. Temporal lobectomy for refractory epilepsy. JAMA. 276, 470-475 (1996).
- Wiebe, S. Effectiveness and safety of epilepsy surgery: What is the evidence. CNS Spectr. 9, 120-132 (2004).
- Gilliam, F., et al. Patient-oriented outcome assessment after temporal lobectomy for refractory epilepsy. Neurology. 53, 687-694 (1999).
- Markand, O. N., Salanova, V., Whelihan, E., Emsley, C. L. Health-related quality of life outcome in medically refractory epilepsy treated with anterior temporal lobectomy. Epilepsia. 41, 749-759 (2000).
- Jones, J. E., Berven, N. L., Ramirez, L., Woodard, A., Hermann, B. P. Long-term psychosocial outcomes of anterior temporal lobectomy. Epilepsia. 43, 896-903 (2002).
- Spencer, D. D., Spencer, S. S., Mattson, R. H., Williamson, P. D., Novelly, R. A. Access to the posterior medial temporal lobe structures in the surgical treatment of temporal lobe epilepsy. Neurosurgery. 15, 667-671 (1984).
- Vakharia, V. N., et al. Intraoperative overlay of optic radiation tractography during anteromesial temporal resection: A prospective validation study. J Neurosurg. 1, 1-10 (2021).
- Winston, G. P., et al. Preventing visual field deficits from neurosurgery. Neurology. 83, 604-611 (2014).
- Almairac, F., Herbet, G., Moritz-Gasser, S., de Champfleur, N. M., Duffau, H. The left inferior fronto-occipital fasciculus subserves language semantics: A multilevel lesion study. Brain Struct Funct. 220, 1983-1995 (2015).
- Binding, L. P., Dasgupta, D., Giampiccolo, D., Duncan, J. S., Vos, S. B. Structure and function of language networks in temporal lobe epilepsy. Epilepsia. 63, 1025-1040 (2022).
- Giampiccolo, D., Duffau, H. Controversy over the temporal cortical terminations of the left arcuate fasciculus: A reappraisal. Brain. 145, 1242-1256 (2022).
- Sone, D., et al. Optimal surgical extent for memory and seizure outcome in temporal lobe epilepsy. Ann Neurol. 91, 131-144 (2022).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690-700 (2019).
- Dasgupta, D., et al. Hippocampal resection in temporal lobe epilepsy: Do we need to resect the tail. Epilepsy Res. 190, 107086 (2023).
- Wu, C., et al. Effects of surgical targeting in laser interstitial thermal therapy for mesial temporal lobe epilepsy: A multicenter study of 234 patients. Epilepsia. 60, 1171-1183 (2019).
- Wiebe, S. A randomized, controlled trial of surgery for temporal-lobe epilepsy. N Engl J Med. 345 (5), 311-318 (2001).
- Brotis, A. G., et al. A meta-analysis on potential modifiers of LITT efficacy for mesial temporal lobe epilepsy: Seizure-freedom seems to fade with time. Clin Neurol Neurosurg. 205, 106644 (2021).
- Borger, V., et al. Resection of piriform cortex predicts seizure freedom in temporal lobe epilepsy. Ann Clin Transl Neurol. 8, 177-189 (2020).
- Borger, V., et al. Temporal lobe epilepsy surgery: Piriform cortex resection impacts seizure control in the long-term. Ann Clin Transl Neurol. 9 (8), 1206-1211 (2022).
- Hwang, B. Y., et al. Piriform cortex ablation volume is associated with seizure outcome in mesial temporal lobe epilepsy. Neurosurgery. 91, 414-421 (2022).
- Piper, R. J., et al. Extent of piriform cortex resection in children with temporal lobe epilepsy. Ann Clin Transl Neurol. 10, 1613-1622 (2023).
- Allison, A. C. The secondary olfactory areas in the human brain. J Anat. 88, 481-488 (1954).
- Ribas, G. C. The cerebral sulci and gyri. Neurosurg Focus. 28, E2 (2010).
- Young, J. C., Vaughan, D. N., Paolini, A. G., Jackson, G. D. Electrical stimulation of the piriform cortex for the treatment of epilepsy: A review of the supporting evidence. Epilepsy Behav. 88, 152-161 (2018).
- Mai, J. K., Majtanik, M., Paxinos, G. . Atlas of the Human Brain. , (2016).
- Vaughan, D. N., Jackson, G. D. The piriform cortex and human focal epilepsy. Front Neurol. 5, 259 (2014).
- Gale, K. Progression and generalization of seizure discharge: Anatomical and neurochemical substrates. Epilepsia. 29, S15-S34 (1988).
- Löscher, W., Ebert, U. The role of the piriform cortex in kindling. Prog Neurobiol. 50, 427-481 (1996).
- Piredda, S., Gale, K. A crucial epileptogenic site in the deep prepiriform cortex. Nature. 317, 623-625 (1985).
- McIntyre, D. C., Gilby, K. L. Mapping seizure pathways in the temporal lobe. Epilepsia. 49, 23-30 (2008).
- Fahoum, F., Lopes, R., Pittau, F., Dubeau, F., Gotman, J. Widespread epileptic networks in focal epilepsies: EEG-fMRI study. Epilepsia. 53, 1618-1627 (2012).
- Flanagan, D., Badawy, R. A. B., Jackson, G. D. EEG-fMRI in focal epilepsy: Local activation and regional networks. Clin Neurophysiol. 125, 21-31 (2014).
- Laufs, H., et al. Converging PET and fMRI evidence for a common area involved in human focal epilepsies. Neurology. 77, 904-910 (2011).
- Wieser, H. G., et al. Proposal for a new classification of outcome with respect to epileptic seizures following epilepsy surgery. Epilepsia. 42, 282-286 (2001).
- Dasgupta, D., Duncan, J. S. Optimizing epilepsy surgery. ISRCTN Registry. BMC. , (2020).
- Sparks, R., et al. Automated multiple trajectory planning algorithm for the placement of stereo-electroencephalography (SEEG) electrodes in epilepsy treatment. Int J CARS. 12, 123-136 (2017).
- Dasgupta, D. . Improving outcomes in anteromesial temporal lobe resections - A prospective surgical trial integrating multimodal imaging & novel hi-res tractography. , (2022).
- Winston, G. P., et al. Automated T2 relaxometry of the hippocampus for temporal lobe epilepsy. Epilepsia. 58, 1645-1652 (2017).
- Cardoso, M. J., et al. Geodesic information flows: Spatially-variant graphs and their application to segmentation and fusion. IEEE Trans Med Imaging. 34, 1976-1988 (2015).
- Winston, G. P., et al. Automated hippocampal segmentation in patients with epilepsy: Available free online. Epilepsia. 54, 2166-2173 (2013).
- Iqbal, S., et al. Volumetric analysis of the piriform cortex in temporal lobe epilepsy. Epilepsy Res. 185, 106971 (2022).
- Leon-Rojas, J. E., et al. Resection of the piriform cortex for temporal lobe epilepsy: a novel approach on imaging segmentation and surgical application. Br J Neurosurg. 1, 1-6 (2021).
- Tournier, J. -. D., et al. MRtrix3: A fast, flexible and open software framework for medical image processing and visualization. Neuroimage. 202, 116137 (2019).
- Cordero-Grande, L., Christiaens, D., Hutter, J., Price, A. N., Hajnal, J. V. Complex diffusion-weighted image estimation via matrix recovery under general noise models. Neuroimage. 200, 391-404 (2019).
- Vos, S. B., et al. The importance of correcting for signal drift in diffusion MRI. Magn Reson Med. 77, 285-299 (2017).
- Kellner, E., Dhital, B., Kiselev, V. G., Reisert, M. Gibbs-ringing artifact removal based on local subvoxel-shifts. Magn Reson Med. 76, 1574-1581 (2016).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. Neuroimage. 23, S208-S219 (2004).
- Andersson, J. L. R., Sotiropoulos, S. N. An integrated approach to correction for off-resonance effects and subject movement in diffusion MR imaging. Neuroimage. 125, 1063-1078 (2016).
- Leemans, A., Jones, D. K. The B-matrix must be rotated when correcting for subject motion in DTI data. Magn Reson Med. 61, 1336-1349 (2009).
- Tustison, N. J., et al. N4ITK: Improved N3 Bias Correction. IEEE Trans Med Imaging. 29, 1310-1320 (2010).
- Dhollander, T., Raffelt, D., Connelly, A. Unsupervised 3-tissue response function estimation from single-shell or multi-shell diffusion MR data without a co-registered T1 image. ISMRM Workshop on Breaking the Barriers of Diffusion MRI. 5, (2016).
- Binding, L. P., et al. Contribution of white matter fiber bundle damage to language change after surgery for temporal lobe epilepsy. Neurology. 100, e1621-e1633 (2023).
- Giampiccolo, D., et al. Thalamostriatal disconnection underpins long-term seizure freedom in frontal lobe epilepsy surgery. Brain. 146, 2377-2388 (2023).
- Smith, R. E., Tournier, J. -. D., Calamante, F., Connelly, A. Anatomically-constrained tractography: Improved diffusion MRI streamlines tractography through effective use of anatomical information. Neuroimage. 62, 1924-1938 (2012).
- Tournier, J. D., Calamante, F., Connelly, A. Improved probabilistic streamlines tractography by 2nd order integration over fibre orientation distributions. Proc 18th Annu Meet ISMRM. 1670, (2010).
- Yasargil, M. G., Fox, J. L. The microsurgical approach to intracranial aneurysms. Surg Neurol. 3, 7-14 (1975).
- Yasargil, M. G., et al. Microsurgical pterional approach to aneurysms of the basilar bifurcation. Surg. Neurol. 6, 83-91 (1976).
- Rao, D., Le, R. T., Fiester, P., Patel, J., Rahmathulla, G. An illustrative review of common modern craniotomies. J Clin Imaging Sci. 10, 81 (2020).
- Usui, N., Kondo, A., Nitta, N., Tottori, T., Inoue, Y. Surgical resection of amygdala and uncus. Neurol Med Chir (Tokyo). 58, 377-383 (2018).
- Vivas, A. C., Reintjes, S., Shimony, N., Vale, F. L. Surgery of the amygdala and uncus: A case series of glioneuronal tumors. Acta Neurochir. (Wien). 162, 795-801 (2020).
- Al-Otaibi, F., Baeesa, S. S., Parrent, A. G., Girvin, J. P., Steven, D. Surgical techniques for the treatment of temporal lobe epilepsy. Epilepsy Res Treat. 2012, 1-13 (2012).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved