É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Melhorando os resultados nas ressecções do lobo temporal anteromesiano - uma demonstração da ressecção do córtex piriforme temporal
Neste Artigo
Resumo
Aqui, demonstramos uma abordagem para orientação neurocirúrgica intraoperatória em ressecções do lobo temporal anteromesiano, destacando especificamente o uso de tractografia e máscaras anatômicas para auxiliar na ressecção segura da porção temporal do córtex piriforme - uma área cada vez mais considerada como um alvo cirúrgico crucial na epilepsia do lobo temporal mesial resistente a medicamentos.
Resumo
A ressecção do lobo temporal anteromesial (ATLR) é uma opção de tratamento útil para a epilepsia do lobo temporal mesial resistente a medicamentos (DRmTLE). Evidências crescentes sugerem que o córtex piriforme desempenha um papel crucial na geração e propagação de convulsões na DRmTLE - e que a ressecção da porção temporal do córtex piriforme está associada a taxas significativamente melhoradas de liberdade de convulsões.
Aqui, apresentamos a ressecção da porção temporal do córtex piriforme em ATLR, usando algoritmos de tractografia probabilística pré-operatória de alta resolução e máscaras anatômicas fundidas das estruturas de interesse na neuronavegação intraoperatória e no head-up display (HUD) do microscópio.
Todos os pacientes submetidos a avaliação pré-operatória abrangente e investigações para DRmTLE forneceram consentimento informado e por escrito para gravar um vídeo intraoperatório do procedimento. Os pacientes foram identificados por uma equipe multidisciplinar especializada de epileptologistas, neurocirurgiões de epilepsia, neuropsicólogos, neuropsiquiatras e eletrofisiologistas em um grande centro de cirurgia de epilepsia. O pipeline de imagem pré-operatório incluiu o delineamento de estruturas críticas. Isso incluiu o córtex piriforme temporal e tractografia probabilística de alta resolução para tratos essenciais em risco (por exemplo, radiação óptica e fascículo fronto-occipital inferior). Estes foram co-registrados na varredura de neuronavegação volumétrica pré-operatória e carregados no sistema de neuronavegação intraoperatória.
Apresenta-se aqui um procedimento passo a passo da ATLR, incluindo a ressecção da porção temporal do córtex piriforme. O protocolo combina imagens avançadas de ressonância magnética estrutural e de difusão e recursos visuais intraoperatórios para integrar máscaras anatômicas de estruturas críticas de substância cinzenta e tratos de substância branca no fluxo de trabalho cirúrgico na sala de cirurgia.
Introdução
A ressecção do lobo temporal anteromesial (ATLR) é o tratamento mais eficaz para a epilepsia do lobo temporal mesial resistente a medicamentos (DRmTLE)1,2, com taxas de liberdade de convulsões de 50% a 70% e morbidade relativamentebaixa3,4,5. O procedimento também demonstrou melhorar a qualidade de vida 6,7,8, as taxas de emprego5 e o bem-estar psicossocial9.
O ATLR canônico, descrito por Spencer et al.10, envolve a ressecção do polo temporal, uncus, amígdala, hipocampo, giro parahipocampal e giro fusiforme. As vias críticas da substância branca envolvidas na visão (a radiação óptica, em particular, a alça de Meyer 11,12) e na linguagem (por exemplo, o fascículo fronto-occipital inferior13 e o fascículo arqueado14,15) correm risco de lesão ao acessar o corno temporal do ventrículo lateral. O protocolo a seguir descreve uma abordagem para evitar esses tratos de substância branca usando tractografia probabilística pré-operatória de alta resolução e máscaras anatômicas fundidas das estruturas de interesse na neuronavegação intraoperatória e no head-up display microscópico (HUD).
O entendimento tradicional do campo é que a ressecção máxima do hipocampo é benéfica para maximizar as taxas de liberdade de convulsões pós-operatórias. No entanto, análises recentes de casos pós-ATLR demonstram que a ressecção da porção temporal do córtex piriforme em ATLR aumenta muito a chance de ausência de convulsões. Eles também mostraram que não houve associação entre a ressecção posterior do hipocampo e a ausência de convulsões16,17. Assim, foi proposto atualizar a técnica de Spencer, limitando a ressecção do hipocampo aos 55% anteriores do hipocampo, em ATLRs do hemisfério dominante da linguagem, para preservar a função da memória16,18.
Embora tenha havido um interesse crescente no uso de novas terapias minimamente invasivas, particularmente a terapia térmica intersticial a laser (LITT), a ressecção cirúrgica continua sendo o padrão de tratamento para epilepsia focal resistente a medicamentos1, e a eficácia do LITT demonstrou produzir uma proporção menor de resultados de convulsão de Engel 1 (58% -59%)1,19 em comparação com ATLR (60% -70%)3, 4,5,20, e por isso ainda é uma área que requer mais investigação21.
Há um crescente corpo de evidências que apóia a hipótese de que o córtex piriforme (Figura 1) é uma região crítica na propagação e/ou epileptogênese de convulsões em adultos 16,17,22,23,24 e crianças25 com epilepsia do lobo temporal mesial. O córtex piriforme é uma faixa de alocórtex de três camadas (semelhante ao arranjo do córtex hipocampal) que é enrolada ao redor do sulco entorrinal mesial até o tronco temporal26,27 e, portanto, forma a confluência dos lobos temporal e frontal. Pode, portanto, ser facilmente considerada como consistindo de divisões frontais e temporais, descritas em detalhes na literatura 22,25,28,29,30.
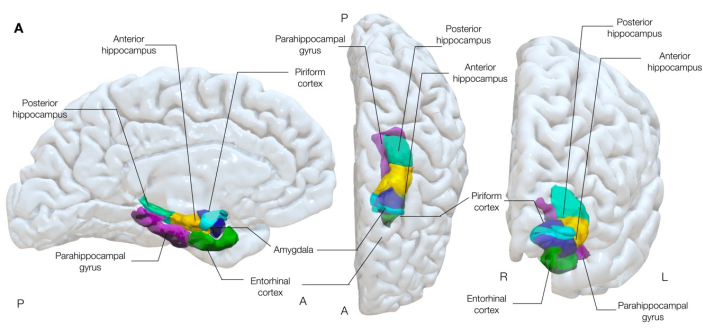
Figura 1: Renderização tridimensional semitransparente de estruturas temporais mesiais do cérebro. Esta figura demonstra as associações anatômicas do córtex piriforme (ciano) com a anatomia do lobo temporal mesial circundante. Vistas medial esquerda, centro-superior e anterior direita. Clique aqui para ver uma versão maior desta figura.
O córtex piriforme é supero-mesial para a amígdala e há muito tempo tem sido implicado em estudos com animais como um nó comum em redes que disseminam descargas epileptogênicas31-33 e gera convulsões após estimulação elétrica mais facilmente do que as estruturas mesiais vizinhas, incluindo a amígdala e o hipocampo34. Sua posição, com extensas conexões com os córtices entorrinal, límbico, orbitofrontal e insular, bem como com o tálamo, bulbo olfatório, amígdala e hipocampo, também se presta a um papel como uma via chave de propagação de descargas epileptogênicas na epilepsia focal30.
Estudos de EEG-fMRI e tomografia por emissão de pósitrons (PET) apóiam ainda mais um papel importante do córtex piriforme na DRmTLE, mostrando ativação interictal, e a redução da ligação ao receptor do ácido γ-aminobutírico tipo A (GABAA) no córtex piriforme está associada ao aumento da atividade convulsiva 35,36,37.
Dois estudos de imagem recentes significativos em DRmTLE mostraram que a ausência de convulsões pós-operatórias está associada a uma maior extensão da ressecção do córtex piriforme; Galovic et al. demonstraram em uma grande coorte retrospectiva que a remoção de pelo menos metade do córtex piriforme melhorou as chances de ficar livre de convulsões por um fator de 16 (IC 95%, 5-47; p < 0,001)17. Também foi demonstrado que os volumes de ressecção de outras estruturas temporais mesiais não estavam associados à ausência de convulsões, um achado replicado e apoiado pelas análises de voxels realizadas por Sone et al., que mostraram que apenas a ressecção do córtex piriforme no ELT esquerdo estava associada à ausência de crises16 (Figura 2).
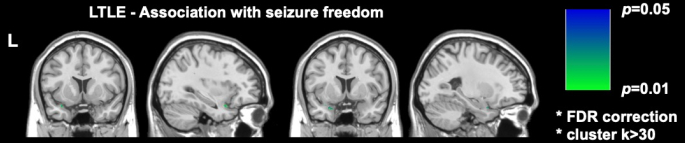
Figura 2: Associação de voxels com ausência de convulsões pós-operatórias no ELT esquerdo. A única área significativamente correlacionada com a ausência de crises é a porção temporal do córtex piriforme, p = 0,01 (verde em cortes coronais e sagitais de ressonância magnética ponderada em T1). Adaptado de Sone et al.16 com permissão. Clique aqui para ver uma versão maior desta figura.
Borger et al. também demonstraram em uma grande coorte retrospectiva que apenas a proporção de córtex piriforme temporal ressecado está associada a melhores taxas de liberdade de convulsões tanto em 1 ano3 quanto em acompanhamento mais longo (média de 3,75 anos)23. Eles corroboraram ainda que o volume ressecado do hipocampo e da amígdala não previa a ausência de convulsões.
A importância de o córtex piriforme ser desconectado da rede epileptogênica aberrante no mTLE também foi demonstrada no LITT, com Hwang et al. mostrando no acompanhamento de 6 meses que a porcentagem de ablação do córtex piriforme estava associada a desfechos de classe 1 de ILAE38 (OR 1,051, IC 95% 1,001-1,117, p = 0,045), mas que essa era uma tendência que não era significativa em 1 ano5. Isso parece apoiar os dados emergentes sobre o LITT, de que há uma melhora positiva, mas potencialmente menos permanente, nos resultados das convulsões, o que levou o LITT a ser usado comumente como um procedimento de "primeiro estágio", com cirurgia ressectiva oferecida àqueles em quem a liberdade de convulsões não é alcançada pelo LITT.
Há, portanto, fortes evidências de que a ressecção da porção temporal do córtex piriforme é um alvo chave para alcançar a liberdade de convulsões na epilepsia do lobo temporal mesial resistente a medicamentos. No entanto, como a coorte retrospectiva de Galovic et al. demonstrou, essa faixa do córtex entorrinal está em um local difícil de atingir cirurgicamente ao realizar um ATLR, o que significa que, se não for diretamente direcionada, nem sempre é removida com sucesso. Mostramos neste estudo como direcionar e ressecar com segurança a porção temporal do córtex piriforme como parte de um estudo cirúrgico prospectivo em andamento, para avaliar seu impacto na melhoria das taxas de liberdade de convulsões no pós-operatório39.
O foco do protocolo a seguir está nos aspectos técnicos da aquisição e processamento da imagem, na abordagem cirúrgica e em como garantimos a ressecção da porção temporal do córtex piriforme no ATLR, integrando tractografia probabilística pré-operatória de alta resolução e máscaras anatômicas fundidas das estruturas de interesse na neuronavegação intraoperatória e no head-up display do microscópio (HUD). O protocolo também utiliza uma plataforma de software de planejamento específica40, que permite a visualização tridimensional e a integração de imagens multimodais para revisão e planejamento cirúrgico, e um sistema de neuronavegação que permite a integração com o microscópio operatório (os detalhes são detalhados na Tabela de Materiais).
Protocolo
Esses métodos e protocolos fazem parte de um estudo cirúrgico prospectivo em andamento que foi aprovado pela Autoridade de Pesquisa em Saúde em 10/09/2020, Comitê de Ética em Pesquisa (REC) Referência de Londres: 20/LO/0966. O protocolo foi registrado prospectivamente: ISRCTN72646265, em 25/09/2020, está disponível online39, e foi apresentado em uma conferência nacional41.
O protocolo a seguir é aplicado a todos os pacientes submetidos a ATLR para DRmTLE em pacientes de 18 a 70 anos (a faixa etária dos pacientes operados para esta indicação em nosso centro especializado em cirurgia de epilepsia em adultos), todos operados pelos mesmos cirurgiões (AWM, AM). Todos os participantes forneceram consentimento informado antes da inclusão no estudo. Todos os participantes foram submetidos a uma avaliação pré-operatória completa e investigações dirigidas pela equipe multidisciplinar especializada em epilepsia cirúrgica no centro abrangente de cirurgia de epilepsia dos autores, composta por neurocirurgiões, neurologistas de epilepsia, neuropsicólogos, psiquiatras, neurorradiologistas e outros membros dos serviços especializados em terapias de epilepsia. Antes da cirurgia, todos tinham ressonâncias magnéticas volumétricas T1, T2 e FLAIR atualizadas, conforme descrito no protocolo abaixo, bem como sangue pré-operatório padrão e uma revisão pela equipe de neuroanestesia, garantindo que eles estivessem seguros para prosseguir para a cirurgia sob anestesia geral. Os detalhes comerciais dos reagentes e do equipamento usado neste estudo são fornecidos na Tabela de Materiais.
1. Aquisição e processamento de imagens
NOTA: Exames de ressonância magnética (RM) pré-cirúrgica de alta resolução, 3 meses e 1 ano pós-cirúrgicos são rotineiramente adquiridos em pessoas submetidas a cirurgia de epilepsia em nosso centro. Os dados de ressonância magnética foram adquiridos entre março de 2020 e março de 2024 no mesmo scanner de ressonância magnética para consistência. A aquisição padronizada de imagens e muitos dos componentes de processamento foram descritos anteriormente na literatura e são referenciados adequadamente no protocolo resumido abaixo:
- Adquira as seguintes sequências de ressonância magnética:
- Uma sequência isométrica 3D padrão (1 mm) ponderada em T1 com eco de recuperação rápida de gradiente de recuperação de inversão (IR-FSPGR) [tempo de eco (TE) 3,1 ms, tempo de repetição (TR) = 7,4 ms, tempo de inversão = 400 ms, campo de visão (FOV) = 224 × 256 × 256 mm, matriz = 224 × 256 × 256, tamanho do voxel = 1,00 × 1,00 × 1,00 mm = 1,00 mm3, fator de aceleração de imagem paralela = 2] e;
- Uma sequência coronal de eco duplo de recuperação rápida de spin echo rápido densidade de prótons/T2 ponderada usada para relaxometria T242 (TE = 30/119 ms, TR = 7600 ms, FOV = 220 × 220 mm, matriz = 512 × 512, espessura do corte = 4 mm, tamanho do voxel = 0,43 × 0,43 × 4,00 mm = 0,74 mm3, fator SENSE = 2).
- Use a sequência ponderada em T1 acima como entrada para o algoritmo de fluxos de informações geodésicas (GIF v3) para dividir o cérebro em 162 regiões anatômicas usando o NiftyWeb43.
- Produza máscaras anatômicas das estruturas de interesse usando as parcelas GIF (giro parahipocampal, giro fusiforme, crie informações de perfil do hipocampo e segmente o hipocampo em 55% anteriores e 45% posteriores usando Hipposeg44), sobreponha-as no software de planejamento na imagem pré-operatória volumétrica do paciente (como na etapa 1.1).
- Realize a segmentação automatizada do córtex piriforme e divida o córtex piriforme em componentes frontais e temporais a partir das técnicas de volumetria explicadas em trabalhos anteriores de nosso laboratório 17,45,46. Uma vez geradas, sobreponha essas máscaras na imagem pré-operatória do paciente.
- Adquira as seguintes imagens de ressonância magnética de difusão:
- Uma aquisição de concha múltipla de resolução padrão (resolução isotrópica de 2 mm, direções de gradiente de 11, 8, 32 e 64 em valores b 0, 300, 700, 2500 s/mm2) e;
- Uma aquisição multi-shell de alta resolução (resolução isotrópica de 1,6 mm, 101 direções, 14 b0, valores b: 300, 700 e 2500 s/mm2).
- Corrija os dados de difusão adquiridos usando MRtrix3 (https://mrtrix.org)47 para:
- Ruído usando "dwidenoise" em MRtrix348.
- Desvio de sinal49.
- Toque de Gibbs usando "mrdegibs" em MRtrix350.
- Distorção usando um gradiente de codificação de fase reversa com o algoritmo FSL TOPUP (https://fsl.fmrib.ox.ac.uk/fsl51).
- Correntes parasitas e artefatos de movimento usando o algoritmo de vórtices de FSL (https://fsl.fmrib.ox.ac.uk/fsl)52, girando os vetores b53.
- Campo de viés usando o algoritmo ANTs (https://mrtrix.org 47,54).
- Use a Deconvolução Esférica Restrita (CSD) de várias conchas e vários tecidos 55 para estimar as funções de resposta para substância branca e cinzenta e líquido cefalorraquidiano (LCR).
- Realizar tractografia automatizada anatomicamente direcionada para reconstruir feixes de fibras de interesse 12,56,57: radiação óptica, fascículo fronto-occipital inferior (IFOF; casos dominantes de linguagem) e fascículo longitudinal médio (MLF; casos não dominantes de linguagem). Siga os passos abaixo.
- Extraia pontos de terminação corticais para cada feixe de fibras e agrupe-os em ROI de semente e terminação.
- Crie regiões corticais de exclusão e ROI usando regiões corticais não terminantes.
- Realize a tractografia anatomicamente restrita58 por meio do algoritmo probabilístico de rastreamento de fibra iFOD259 usando segmentação híbrida de superfície e volume no MRtrix347 , selecionando um máximo de 5.000 linhas de fluxo de 300 milhões de sementes.
- Execute a tractografia na etapa 1.8.3 duas vezes para cada feixe de fibras, alternando o ROI de semente e terminação.
- Converta os feixes de fibras resultantes em mapas probabilísticos, com limite de 0,01 - use-os como um critério de exclusão adicional para remover linhas de fluxo espúrias.
- Revise os feixes de fibras resultantes (dilatados em 2 mm) e máscaras anatômicas no software de planejamento para garantir que sejam anatomicamente precisos (esta etapa é realizada por dois neurocirurgiões de epilepsia em nossa unidade).
- Registre espacialmente as máscaras anatômicas resultantes da substância cinzenta e do trato da substância branca na imagem de RM ponderada em T1 de referência na etapa 1.1 e carregada no sistema de navegação intraoperatória na sala de cirurgia de ressonância magnética intraoperatória (iMRI).
- Adquira imagens de ressonância magnética volumétrica ponderadas em T1, T2 e T2-FLAIR imediatamente antes da cirurgia (< 24 h) com fiduciais cutâneos no couro cabeludo do paciente. Co-registre essas imagens entre si e a imagem de referência ponderada em T1 e as máscaras descritas acima e demonstradas na Figura 3.
- Registre" o paciente no sistema de neuronavegação com um laser de correspondência de superfície e ponteiro inteligente.
- Verifique a precisão do co-registro da imagem e do paciente com dois neurocirurgiões de epilepsia antes do início do caso para garantir a precisão.
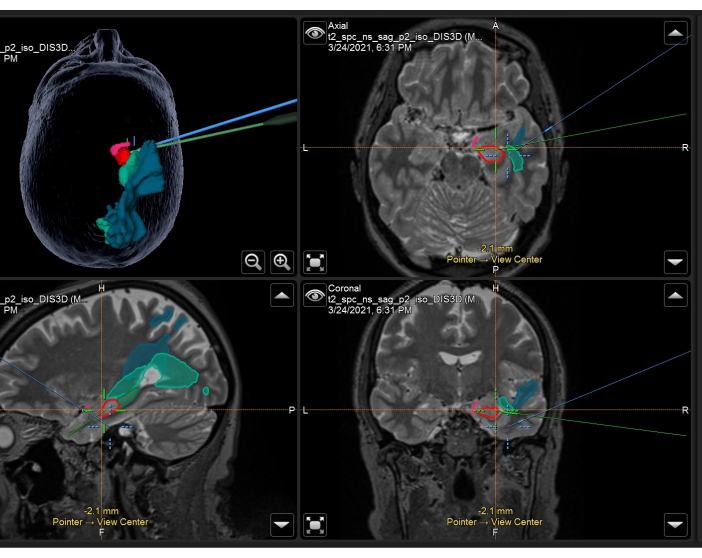
Figura 3: Captura de tela do sistema de neuronavegação demonstrando a ressonância magnética volumétrica ponderada em T2 com máscaras anatômicas sobrepostas e tratos usados no intraoperatório em um ATLR direito. Painel superior esquerdo: reconstrução tridimensional da cabeça do paciente, demonstrando máscaras anatômicas. Superior direito: axial, inferior esquerdo: sagital e inferior direito: vistas coronais também mostrando máscaras anatômicas sobrepostas na ressonância magnética volumétrica ponderada em T2. Máscaras anatômicas exibidas: porção temporal do córtex piriforme (rosa), 55% anterior do hipocampo (vermelho), 45% posterior do hipocampo (verde escuro, visto apenas na imagem sagital), radiação óptica (verde médio), fascículo longitudinal médio (azul). A mira azul é a posição integrada do foco do microscópio, e a mira verde é a posição do ponteiro de neuronavegação que está sendo usado no campo cirúrgico. Clique aqui para ver uma versão maior desta figura.
2. Técnica cirúrgica
NOTA: As etapas abaixo resumem a prática no centro dos autores e não pretendem ser uma exposição da única abordagem cirúrgica para um ATLR, mas sim uma demonstração de como os autores padronizaram a abordagem para este procedimento para fornecer ressecções confiáveis e reprodutíveis, incluindo a ressecção do córtex piriforme temporal.
- Posicionamento e abordagem
- Seguindo as verificações pré-operatórias padrão e as medidas de segurança, posicione o paciente em decúbito dorsal, eleve o ombro ipsilateral com um rolo e vire a cabeça para o lado contralateral.
- Flexione a cabeça lateralmente para garantir que a eminência malar seja o ponto mais alto do campo cirúrgico e fixe os pinos (dispositivo de fixação do crânio de 3 pontos - veja exemplos, incluindo aqueles compatíveis com salas intraoperatórias [iMRI] na Tabela de Materiais).
NOTA: O posicionamento é fundamental para permitir o acesso adequado às estruturas do lobo mesial e temporal posterior, particularmente a flexão lateral, para garantir que a eminência malar seja o ponto mais alto do campo cirúrgico. - Infiltre o anestésico local nos locais dos pinos e na incisão da pele.
- Registre o espaço do paciente no sistema de neuronavegação usando uma combinação de fiduciais de pele e rastreamento de superfície (específico para a marca do sistema de neuronavegação utilizado). Confirme a precisão do registro em relação a pontos de referência anatômicos/ósseos palpáveis ou visíveis.
- Marque a linha do cabelo e a raiz do zigoma (identificado por palpação manual). Identifique e marque o curso da fissura de Sylvian usando a neuronavegação e a incisão frontotemporal curvilínea planejada da pele em 'ponto de interrogação'.
- Remova os pelos ao longo da incisão planejada na pele usando máquinas de cortar cabelo elétricas.
- Faça uma incisão frontotemporal de 1 cm anterior ao tragus, curvando-se em forma de ponto de interrogação, para evitar lesões no ramo frontotemporal do nervo facial. Identifique e preserve a artéria temporal superficial, se possível. O posicionamento e a marcação da incisão na pele são mostrados na Figura 4.
- Cubra e prenda as bordas da ferida com swabs mastóideos embebidos em antimicrobianos e clipes de Raney.
- Incisar o músculo temporal e elevá-lo em um retalho miocutâneo ou interfascial/subfascial (evitando lesão no ramo frontotemporal do nervo facial).
- Enrole o retalho cutâneo em gaze embebida em solução antimicrobiana e retraia-o anteriormente (evitando o uso de instrumentos de fixação de metal se em salas de ressonância magnética i).
- Crie 2 orifícios de rebarba no crânio com uma broca perfurante: o primeiro logo acima da raiz do zigoma para maximizar a exposição inferior, o segundo frontal inferior para facilitar a visualização da fissura de Sylvian.
- Realizar uma craniotomia frontotemporal padrão 60,61,62, expondo o giro temporal superior e médio 1 cm acima da fissura de Sylvian.
- Perfure as margens anterior e inferior da craniotomia para permitir fácil acesso ao assoalho da fossa temporal média, bem como ao pólo temporal anteriormente. Se forem encontradas células aéreas da mastóide, sele-as com cera óssea e cola de fibrina ao encontrá-las e no final do procedimento antes de fechar as camadas superficiais ao osso.
NOTA: É importante garantir que a craniotomia permita o acesso ao assoalho da fossa craniana média, pois esta será a abordagem do corno temporal do ventrículo lateral através do sulco colateral. Também é importante vedar completamente quaisquer células aéreas mastóides encontradas para evitar um vazamento pós-operatório de LCR e sintomas resultantes e possíveis infecções. - Abra a dura-máter em forma de U com a base refletida anteriormente e estendida de forma estrelada. Engate a dura-máter para longe do campo operatório com suturas (como seda 3-0).
- Libere o LCR do assoalho da fossa craniana média e da face anterior da fossa craniana média.
NOTA: A etapa de liberação do LCR é importante para permitir espaço de trabalho suficiente para acessar cirurgicamente o assoalho da fossa craniana média e o sulco colateral por baixo, sem retração e tensão no lobo temporal basal.
- Remoção neocortical lateral
- Coagular a pia dos giros temporais médio e inferior (MTG e ITG, respectivamente) em uma linha perpendicular à base do crânio e alinhada com a projeção anterior do corno temporal do ventrículo lateral (confirmada no sistema de neuronavegação). Adapte a extensão ântero-posterior dessa linha caso a caso, dependendo da evidência pré-cirúrgica de envolvimento neocortical lateral no início/propagação da convulsão.
NOTA: A extensão ântero-posterior da ressecção neocortical lateral deve levar em consideração a evidência pré-operatória (ou a falta dela) de seu envolvimento na propagação da convulsão, e isso é adaptado para cada paciente. - Empregue uma abordagem transcortical no ITG para expor o assoalho da fossa craniana média e identificar o sulco colateral, que é lateral ao giro parahipocampal e medial ao giro fusiforme.
- Coagular a pia do giro temporal superior (STG) anterior à incisão neocortical lateral acima, paralela à direção da fissura de Sylvian. Esta é perpendicular à linha descrita no passo 2.16 e se estende anteriormente ao pólo temporal.
- Desenvolver o plano entre o STG e a fissura de Sylvian usando técnicas de dissecção subpial, protegendo os ramos da artéria cerebral média, e levar essa dissecção até a parte horizontal da fissura de Sylvian até o nível do sulco limitante inferior da ínsula.
NOTA: Deve-se tomar cuidado para manter a integridade da pia do STG que margeia a fissura de Sylvian durante a realização da dissecção subpial na etapa 2.2.4, pois isso protege os ramos da artéria cerebral média na fissura, bem como outras estruturas, como o nervo oculomotor e a artéria comunicante posterior (etapa 2.2.14) e o trato óptico (etapa 2.3) posteriormente na operação. - Integre o microscópio com o sistema de neuronavegação.
- Confirme a precisão das sobreposições de objetos das máscaras anatômicas descritas na seção 1 e visualize-as no HUD do microscópio.
- Incline a linha de ressecção posterior anteriormente superiormente para minimizar a ressecção do STG e estenda-a progressivamente através do MTG e ITG, através do giro fusiforme até o sulco colateral.
- Verifique a relação da margem de ressecção posterior com o sistema de neuronavegação com a máscara de radiação óptica (SO) visualizada.
- Visualize a extensão anterior máxima da máscara cirúrgica no microscópio e certifique-se de que ela seja posterior à margem de ressecção no HUD do microscópio para garantir que não haja danos à sala cirúrgica, o que resultaria em um déficit de campo visual no pós-operatório, conforme demonstrado na Figura 5.
NOTA: A etapa 2.2.9 é uma etapa crítica para evitar um déficit de campo visual pós-operatório devido a danos na alça de Meyer da radiação óptica. Se houver muita mudança cerebral e o cirurgião quiser minimizar ainda mais o risco de danos à radiação óptica, ou se as projeções no HUD do microscópio não estiverem funcionando corretamente, os autores sugerem o uso do ponteiro de neuronavegação para direcionar a abordagem à ponta mais anterior do corno temporal do ventrículo lateral, pois isso minimiza o risco de lesão na sala de cirurgia. - Siga o sulco colateral superiormente até que o corno temporal seja encontrado (confirme isso no sistema de neuronavegação), conforme mostrado na Figura 6. A parede do corno temporal pode ser identificada por epêndimo tingido de azul.
NOTA: Em indivíduos em que a patologia não é esclerose hipocampal e a cabeça do hipocampo é volumosa, o ventrículo pode ser difícil de encontrar. Nesses casos, uma opção de solução de problemas é usar o ponteiro de neuronavegação na base da fossa temporal medial, onde não há deslocamento, para descobrir onde a ponta do ventrículo está se projetando. Normalmente é útil procurar isso em um plano coronal. Se o ventrículo não puder ser encontrado, sugerimos primeiro remover o pólo e depois encontrar o ventrículo com o aspirador ultrassônico. - Divida as leptomeninges temporais basais lateralmente à exposição do corno temporal.
- Abra o ventrículo anteriormente para expor a cabeça do hipocampo (como demonstrado na Figura 6).
- Estenda a margem de ressecção posterior para unir a desconexão ao ventrículo e isso permite a desconexão do bloqueio neocortical.
- Mobilize o pólo temporal seguindo a linha de dissecção na margem da borda tentorial. Tome cuidado para não realizar a desconexão sobre a borda do tentório para evitar lesões nas estruturas mesiais, incluindo o nervo oculomotor e a artéria comunicante posterior.
NOTA: Para reduzir o risco de danificar estruturas na cisterna cruralis, siga a forma da borda do tentório sem ultrapassar a borda da tenda. O uncus permanecerá no lugar e pode ser tomado como uma amostra separada.
- Coagular a pia dos giros temporais médio e inferior (MTG e ITG, respectivamente) em uma linha perpendicular à base do crânio e alinhada com a projeção anterior do corno temporal do ventrículo lateral (confirmada no sistema de neuronavegação). Adapte a extensão ântero-posterior dessa linha caso a caso, dependendo da evidência pré-cirúrgica de envolvimento neocortical lateral no início/propagação da convulsão.
- Ressecção temporal mesial, incluindo o córtex piriforme temporal
- Limpe o tecido do uncus com dissecção e uso do aspirador ultrassônico mesialmente até que o nervo oculomotor e a artéria comunicante posterior estejam visíveis. Interrompa a extensão da ressecção posterior quando o pé (a extensão mais mesial da cabeça do hipocampo) for visualizado.
- Realizar a ressecção da amígdala com o aspirador ultrassônico, limitado superiormente pela pia do sulco endorinal, e até que o trato óptico seja visualizado, e mesialmente pelo plano pial das cisternas basais.
NOTA: Tome cuidado para preservar a haste temporal e não entrar no lobo frontal ao executar a etapa 2.3.2. Às vezes, devido à mudança cerebral, a neuronavegação pode superestimar a extensão da ressecção mesialmente; Nesse sentido, a ressecção é segura para continuar até que o trato óptico seja visualizado através do PIA, e isso representa o limite mesial da ressecção. Isso também é descrito em Usui et al.63A margem dorsal da amígdala é comumente descrita como aproximada por uma linha imaginária que conecta o ponto coroidal à bifurcação da artéria cerebral média proximal64. - Certifique-se de que a porção temporal do córtex piriforme seja ressecada removendo qualquer tecido residual por meio de dissecção subpial progredindo inferiormente do lado temporal da fissura de Sylvian até que a veia do sulco circular inferior da ínsula seja visualizada. Esta é uma margem de ressecção semelhante à descrita por Usui et al. na ressecção de lesões amígdalo-uncais63.
NOTA: Se o córtex uncus (na etapa 2.3.1) ou piriforme for difícil de remover (às vezes, eles podem ser muito aderentes à pia-máter), os autores sugerem o uso de um dissector Rhoton em vez do aspirador ultrassônico para minimizar a lesão da pia-máter. - Confirme a ressecção da porção temporal do córtex piriforme usando a máscara anatômica descrita na etapa 1.4 sobreposta ao HUD do microscópio, conforme demonstrado na Figura 7.
- Ressecção hipocampal
- Coloque linteens (ou cottonoids largos semelhantes) para retrair o plexo coróide (e a artéria coroidal anterior) mesialmente para facilitar a visualização da fímbria hipocampal.
- Desconecte a fímbria hipocampal de sua inserção aracnóide, expondo o sulco hipocampal que carrega a arcada vascular arterial do corno de Amon.
- Desconecte o hipocampo de sua cauda (limitando essa ressecção aos 55% anteriores do hipocampo nas ressecções do hemisfério dominante da linguagem na tentativa de minimizar os déficits de memória verbal, conforme descrito em16, ou estenda tão posteriormente quanto o nível do tectum do mesencéfalo em ressecções do hemisfério não dominante da linguagem).
- Desconecte a cabeça do hipocampo do hipocampo. Coagular a arcada arterial do hipocampo conforme necessário.
- Remova o hipocampo desconectado em bloco.
- Realize a dissecção subpial do giro parahipocampal e do subículo e garanta a hemostasia na cavidade cirúrgica resultante. Remova o pé hipocampo, visualizando e protegendo o tronco cerebral.
NOTA: Deve-se ter cuidado ao executar a etapa 2.4.7, pois não há limite pial protetor entre o pes e o tronco encefálico neste nível.
- Imagem intraoperatória e fechamento
- Remova todos os itens metálicos do campo cirúrgico, cubra a ferida e realize uma ressonância magnética intraoperatória, geralmente incluindo sequências volumétricas T1, T2, FLAIR e DWI.
- Revise a imagem intraoperatória com um neurorradiologista consultor juntamente com dois neurocirurgiões consultores de epilepsia, para garantir que a quantidade desejada de estruturas do lobo temporal mesial (incluindo a porção temporal do córtex piriforme, bem como as quantidades variáveis de hipocampo, conforme descrito acima na etapa 2.36) foram ressecadas com sucesso. Revise também a imagem DWI para garantir que nenhuma área de isquemia tenha sido causada durante o procedimento.
- Uma vez confirmado o acima, transfira o paciente de volta para a mesa de operação e confirme a hemostasia na cavidade cirúrgica em normotensão para o paciente.
- Feche a ferida de forma padrão, substituindo o retalho ósseo, fixando-o com placas e parafusos em 3 pontos, e um fechamento padrão das camadas muscular, fáscia e pele com suturas, deixando um dreno da ferida cirúrgica no local por 24 horas.
NOTA: Os cuidados pós-operatórios são no centro dos autores, geralmente na unidade neurocirúrgica de alta dependência nas primeiras 24 horas, seguidos por uma redução para uma enfermaria especializada em neurocirurgia quando a unidade de alta dependência achar apropriado. Os pacientes são monitorados por suas observações neurológicas, têm sangue pós-operatório, incluindo uréia e eletrólitos, hemograma completo e diferenciais, e geralmente recebem alta aproximadamente 72 horas após a cirurgia. Eles são então acompanhados ambulatorialmente em 4-6 semanas e em 3-4 meses e 1 ano de pós-operatório, no mínimo, com imagens intervaladas.
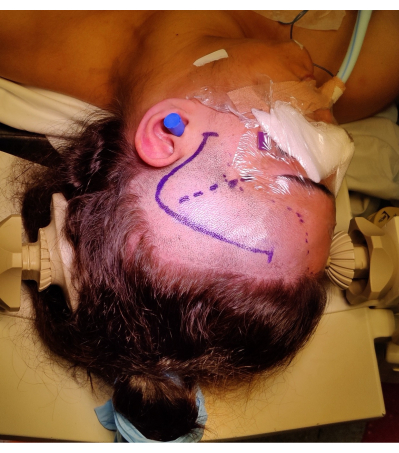
Figura 4: Imagem do posicionamento do paciente para um ATLR direito, demonstrando a marcação do 'ponto de interrogação' incisão na pele frontotemporal direita, linha do cabelo e fissura de Sylvian. Não está retratado o rolo do ombro esquerdo sob o ombro esquerdo do paciente para permitir o ângulo do posicionamento da cabeça sem colocar pressão indevida no pescoço do paciente e não impedir o retorno venoso. As imagens foram capturadas e incluídas com o consentimento do paciente. Clique aqui para ver uma versão maior desta figura.
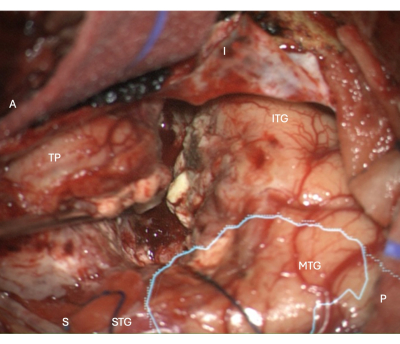
Figura 5: Imagem intraoperatória do microscópio demonstrando a margem de ressecção neocortical lateral em um ATLR direito, com a máscara anatômica sobreposta da radiação óptica (ciano) - demonstrando que a margem de ressecção é anterior à SO. Os rótulos demonstram a orientação da visão operativa: A = anterior, P = posterior, I = inferior, S = superior, STG = giro temporal superior, MTG = giro temporal médio, ITG = giro temporal inferior, TP = Pólo Temporal. Clique aqui para ver uma versão maior desta figura.
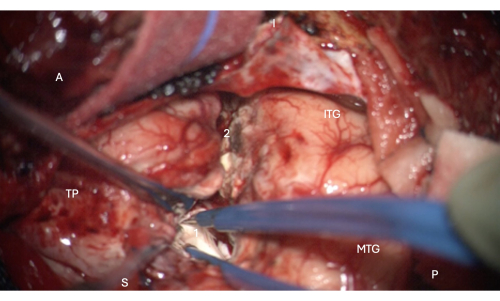
Figura 6: Imagem intraoperatória do microscópio demonstrando a entrada na porção anterior do corno temporal do ventrículo lateral, mostrando a cabeça do hipocampo dentro dele (branco pálido, 1). Marcadores: A = anterior, P = posterior, I = inferior, S = superior, MTG = giro temporal médio, ITG = giro temporal inferior, 2 = margem de ressecção neocortical lateral, seguindo o sulco colateral superiormente na profundidade para encontrar o corno temporal do ventrículo lateral, TP = Polo Temporal. Clique aqui para ver uma versão maior desta figura.
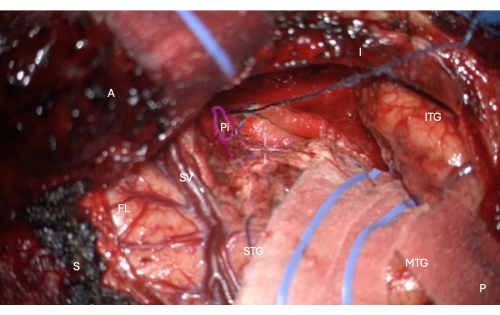
Figura 7: Imagem intraoperatória do microscópio demonstrando sobreposição de HUD da máscara anatômica da porção temporal do córtex piriforme (contorno rosa, rotulado Pi). Esta figura demonstra a ressecção completa - não há tecido cerebral remanescente, apenas o limite pial do sulco mesial endorinal para a ressecção, protegido nesta imagem com o hambúrguer longitudinal sobrejacente na imagem, logo acima da mira branca central do microscópio HUD. Marcadores: A = anterior, P = posterior, I = inferior, S = superior, STG = giro temporal superior, MTG = giro temporal médio, ITG = giro temporal inferior, FL = lobo frontal, SV = veias sylvianas (sobrepostas à fissura sylviana), Pi = porção temporal do córtex piriforme. Clique aqui para ver uma versão maior desta figura.
Resultados
Este protocolo e as técnicas cirúrgicas foram aplicados em um estudo em andamento, interrogando os efeitos da ressecção do córtex piriforme temporal e seu impacto na liberdade de convulsões após ATLR para DRmTLE. O objetivo deste estudo é determinar prospectivamente se a liberdade de convulsões após a remoção do córtex piriforme temporal realmente melhora a liberdade de convulsões na DRmTLE, como sugere o crescente corpo de dados retrospectivos na literatura.
Discussão
Este protocolo fornece uma ressecção confiável e direcionada da porção temporal do córtex piriforme - postulada como uma estrutura crucial na epileptogênese e propagação da rede de epilepsia do lobo temporal mesial 16,17,24,25,30.
Os componentes da técnica ATLR padrão que realizamos em no...
Divulgações
Os autores Debayan Dasgupta e John S. Duncan recebem financiamento do Programa de Inovação Wellcome Trust (218380/Z/19/Z). Lawrence P. Binding é apoiado pela Epilepsy Research UK (número de concessão P1904). Os autores acima mencionados e Sjoerd B. Vos são parcialmente financiados pelo Instituto Nacional de Pesquisa em Saúde, University College London, Hospitals Biomedical Research Centre (NIHR, BRC, UCLH / UCL High Impact Initiative, BW.mn.BRC10269). Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses. Confirmamos que lemos a posição da Revista sobre questões envolvidas na publicação ética e afirmamos que este relatório é consistente com essas diretrizes.
Agradecimentos
Este trabalho foi apoiado pela Epilepsy Research UK (número de concessão P1904) e pelo Wellcome Trust Innovation Program (218380 / Z / 19 / Z). Este trabalho foi parcialmente financiado pelo Instituto Nacional de Pesquisa em Saúde, University College London, Hospitals Biomedical Research Centre (NIHR, BRC, UCLH / UCL High Impact Initiative, BW.mn.BRC10269). Os autores reconhecem as instalações e a assistência científica e técnica do National Imaging Facility, uma capacidade da National Collaborative Research Infrastructure Strategy (NCRIS), no Centro de Microscopia, Caracterização e Análise da Universidade da Austrália Ocidental. Esta pesquisa foi financiada no todo ou em parte pelo Wellcome Trust [WT 218380]. Para fins de Acesso Aberto, o autor aplicou uma licença de direitos autorais públicos CC BY a qualquer versão do Manuscrito Aceito pelo Autor decorrente desta submissão.
Materiais
| Name | Company | Catalog Number | Comments |
| Brainlab Neuronavigation System | Brianlab, Westchester, IL | https://www.brainlab.com/surgery-products/overview-neurosurgery-products/cranial-navigation/ | Intraoperative neuronavigation system |
| EpiNav Planning Software | N/A | N/A | Clinical Decision Support Tool, for research use, developed in academia at King's College London and University College London |
| Mayfield clamp | Integra | A1059 | Any 3 pin head immobilisation device can be used |
| Microsurgical instruments | As per local neurosurgical unit | ||
| MRI Scanner | GE, Milwaukee, WI, USA | 3T MRI GE MR750 | Any alternative 3T MRI scanner can be used |
| MRTrix3 | N/A | Reference 47 in the manuscript | MRtrix3 provides a set of tools to perform various advanced diffusion MRI analyses, including constrained spherical deconvolution (CSD), probabilistic tractography, track-density imaging, and apparent fibre density |
| NORAS coil | NORAS MRI Products | https://www.noras.de/en/mri-produkte/lucy-or-head-holder-8-ch-coil/#infos | Any MRI-safe head immobilisation device can be used |
| Perforator drill | Stryker | https://neurosurgical.stryker.com/products/elite/ | Any alternative neurosurgical perforator drill driver and bit can be used |
| Sutures - Vicryl Plus 2/- | Ethicon | ETVCP684H | Any alternative suture that the surgeon prefers can be used |
| Titanium bone plates and screws | As per local neurosurgical unit | ||
| Ultrasonic Aspirator | Integra | https://products.integralife.com/cusa-tissue-ablation/category/cusa-tissue-ablation | Any alternative that the surgeon prefers can be used |
Referências
- Marathe, K., et al. ablative and radiosurgical interventions for drug-resistant mesial temporal lobe epilepsy: A systematic review and meta-analysis of outcomes. Front Neurol. 12, 777845 (2021).
- Choi, H., et al. Epilepsy surgery for pharmacoresistant temporal lobe epilepsy: A decision analysis. JAMA. 300, 2497 (2008).
- Foldvary, N., et al. Seizure outcome after temporal lobectomy for temporal lobe epilepsy: A Kaplan-Meier survival analysis. Neurology. 54, 630-634 (2000).
- Spencer, S. S., et al. Predicting long-term seizure outcome after resective epilepsy surgery: The multicenter study. Neurology. 65, 912-918 (2005).
- Sperling, M. R., O'Connor, M. J., Saykin, A. J., Plummer, C. Temporal lobectomy for refractory epilepsy. JAMA. 276, 470-475 (1996).
- Wiebe, S. Effectiveness and safety of epilepsy surgery: What is the evidence. CNS Spectr. 9, 120-132 (2004).
- Gilliam, F., et al. Patient-oriented outcome assessment after temporal lobectomy for refractory epilepsy. Neurology. 53, 687-694 (1999).
- Markand, O. N., Salanova, V., Whelihan, E., Emsley, C. L. Health-related quality of life outcome in medically refractory epilepsy treated with anterior temporal lobectomy. Epilepsia. 41, 749-759 (2000).
- Jones, J. E., Berven, N. L., Ramirez, L., Woodard, A., Hermann, B. P. Long-term psychosocial outcomes of anterior temporal lobectomy. Epilepsia. 43, 896-903 (2002).
- Spencer, D. D., Spencer, S. S., Mattson, R. H., Williamson, P. D., Novelly, R. A. Access to the posterior medial temporal lobe structures in the surgical treatment of temporal lobe epilepsy. Neurosurgery. 15, 667-671 (1984).
- Vakharia, V. N., et al. Intraoperative overlay of optic radiation tractography during anteromesial temporal resection: A prospective validation study. J Neurosurg. 1, 1-10 (2021).
- Winston, G. P., et al. Preventing visual field deficits from neurosurgery. Neurology. 83, 604-611 (2014).
- Almairac, F., Herbet, G., Moritz-Gasser, S., de Champfleur, N. M., Duffau, H. The left inferior fronto-occipital fasciculus subserves language semantics: A multilevel lesion study. Brain Struct Funct. 220, 1983-1995 (2015).
- Binding, L. P., Dasgupta, D., Giampiccolo, D., Duncan, J. S., Vos, S. B. Structure and function of language networks in temporal lobe epilepsy. Epilepsia. 63, 1025-1040 (2022).
- Giampiccolo, D., Duffau, H. Controversy over the temporal cortical terminations of the left arcuate fasciculus: A reappraisal. Brain. 145, 1242-1256 (2022).
- Sone, D., et al. Optimal surgical extent for memory and seizure outcome in temporal lobe epilepsy. Ann Neurol. 91, 131-144 (2022).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690-700 (2019).
- Dasgupta, D., et al. Hippocampal resection in temporal lobe epilepsy: Do we need to resect the tail. Epilepsy Res. 190, 107086 (2023).
- Wu, C., et al. Effects of surgical targeting in laser interstitial thermal therapy for mesial temporal lobe epilepsy: A multicenter study of 234 patients. Epilepsia. 60, 1171-1183 (2019).
- Wiebe, S. A randomized, controlled trial of surgery for temporal-lobe epilepsy. N Engl J Med. 345 (5), 311-318 (2001).
- Brotis, A. G., et al. A meta-analysis on potential modifiers of LITT efficacy for mesial temporal lobe epilepsy: Seizure-freedom seems to fade with time. Clin Neurol Neurosurg. 205, 106644 (2021).
- Borger, V., et al. Resection of piriform cortex predicts seizure freedom in temporal lobe epilepsy. Ann Clin Transl Neurol. 8, 177-189 (2020).
- Borger, V., et al. Temporal lobe epilepsy surgery: Piriform cortex resection impacts seizure control in the long-term. Ann Clin Transl Neurol. 9 (8), 1206-1211 (2022).
- Hwang, B. Y., et al. Piriform cortex ablation volume is associated with seizure outcome in mesial temporal lobe epilepsy. Neurosurgery. 91, 414-421 (2022).
- Piper, R. J., et al. Extent of piriform cortex resection in children with temporal lobe epilepsy. Ann Clin Transl Neurol. 10, 1613-1622 (2023).
- Allison, A. C. The secondary olfactory areas in the human brain. J Anat. 88, 481-488 (1954).
- Ribas, G. C. The cerebral sulci and gyri. Neurosurg Focus. 28, E2 (2010).
- Young, J. C., Vaughan, D. N., Paolini, A. G., Jackson, G. D. Electrical stimulation of the piriform cortex for the treatment of epilepsy: A review of the supporting evidence. Epilepsy Behav. 88, 152-161 (2018).
- Mai, J. K., Majtanik, M., Paxinos, G. . Atlas of the Human Brain. , (2016).
- Vaughan, D. N., Jackson, G. D. The piriform cortex and human focal epilepsy. Front Neurol. 5, 259 (2014).
- Gale, K. Progression and generalization of seizure discharge: Anatomical and neurochemical substrates. Epilepsia. 29, S15-S34 (1988).
- Löscher, W., Ebert, U. The role of the piriform cortex in kindling. Prog Neurobiol. 50, 427-481 (1996).
- Piredda, S., Gale, K. A crucial epileptogenic site in the deep prepiriform cortex. Nature. 317, 623-625 (1985).
- McIntyre, D. C., Gilby, K. L. Mapping seizure pathways in the temporal lobe. Epilepsia. 49, 23-30 (2008).
- Fahoum, F., Lopes, R., Pittau, F., Dubeau, F., Gotman, J. Widespread epileptic networks in focal epilepsies: EEG-fMRI study. Epilepsia. 53, 1618-1627 (2012).
- Flanagan, D., Badawy, R. A. B., Jackson, G. D. EEG-fMRI in focal epilepsy: Local activation and regional networks. Clin Neurophysiol. 125, 21-31 (2014).
- Laufs, H., et al. Converging PET and fMRI evidence for a common area involved in human focal epilepsies. Neurology. 77, 904-910 (2011).
- Wieser, H. G., et al. Proposal for a new classification of outcome with respect to epileptic seizures following epilepsy surgery. Epilepsia. 42, 282-286 (2001).
- Dasgupta, D., Duncan, J. S. Optimizing epilepsy surgery. ISRCTN Registry. BMC. , (2020).
- Sparks, R., et al. Automated multiple trajectory planning algorithm for the placement of stereo-electroencephalography (SEEG) electrodes in epilepsy treatment. Int J CARS. 12, 123-136 (2017).
- Dasgupta, D. . Improving outcomes in anteromesial temporal lobe resections - A prospective surgical trial integrating multimodal imaging & novel hi-res tractography. , (2022).
- Winston, G. P., et al. Automated T2 relaxometry of the hippocampus for temporal lobe epilepsy. Epilepsia. 58, 1645-1652 (2017).
- Cardoso, M. J., et al. Geodesic information flows: Spatially-variant graphs and their application to segmentation and fusion. IEEE Trans Med Imaging. 34, 1976-1988 (2015).
- Winston, G. P., et al. Automated hippocampal segmentation in patients with epilepsy: Available free online. Epilepsia. 54, 2166-2173 (2013).
- Iqbal, S., et al. Volumetric analysis of the piriform cortex in temporal lobe epilepsy. Epilepsy Res. 185, 106971 (2022).
- Leon-Rojas, J. E., et al. Resection of the piriform cortex for temporal lobe epilepsy: a novel approach on imaging segmentation and surgical application. Br J Neurosurg. 1, 1-6 (2021).
- Tournier, J. -. D., et al. MRtrix3: A fast, flexible and open software framework for medical image processing and visualization. Neuroimage. 202, 116137 (2019).
- Cordero-Grande, L., Christiaens, D., Hutter, J., Price, A. N., Hajnal, J. V. Complex diffusion-weighted image estimation via matrix recovery under general noise models. Neuroimage. 200, 391-404 (2019).
- Vos, S. B., et al. The importance of correcting for signal drift in diffusion MRI. Magn Reson Med. 77, 285-299 (2017).
- Kellner, E., Dhital, B., Kiselev, V. G., Reisert, M. Gibbs-ringing artifact removal based on local subvoxel-shifts. Magn Reson Med. 76, 1574-1581 (2016).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. Neuroimage. 23, S208-S219 (2004).
- Andersson, J. L. R., Sotiropoulos, S. N. An integrated approach to correction for off-resonance effects and subject movement in diffusion MR imaging. Neuroimage. 125, 1063-1078 (2016).
- Leemans, A., Jones, D. K. The B-matrix must be rotated when correcting for subject motion in DTI data. Magn Reson Med. 61, 1336-1349 (2009).
- Tustison, N. J., et al. N4ITK: Improved N3 Bias Correction. IEEE Trans Med Imaging. 29, 1310-1320 (2010).
- Dhollander, T., Raffelt, D., Connelly, A. Unsupervised 3-tissue response function estimation from single-shell or multi-shell diffusion MR data without a co-registered T1 image. ISMRM Workshop on Breaking the Barriers of Diffusion MRI. 5, (2016).
- Binding, L. P., et al. Contribution of white matter fiber bundle damage to language change after surgery for temporal lobe epilepsy. Neurology. 100, e1621-e1633 (2023).
- Giampiccolo, D., et al. Thalamostriatal disconnection underpins long-term seizure freedom in frontal lobe epilepsy surgery. Brain. 146, 2377-2388 (2023).
- Smith, R. E., Tournier, J. -. D., Calamante, F., Connelly, A. Anatomically-constrained tractography: Improved diffusion MRI streamlines tractography through effective use of anatomical information. Neuroimage. 62, 1924-1938 (2012).
- Tournier, J. D., Calamante, F., Connelly, A. Improved probabilistic streamlines tractography by 2nd order integration over fibre orientation distributions. Proc 18th Annu Meet ISMRM. 1670, (2010).
- Yasargil, M. G., Fox, J. L. The microsurgical approach to intracranial aneurysms. Surg Neurol. 3, 7-14 (1975).
- Yasargil, M. G., et al. Microsurgical pterional approach to aneurysms of the basilar bifurcation. Surg. Neurol. 6, 83-91 (1976).
- Rao, D., Le, R. T., Fiester, P., Patel, J., Rahmathulla, G. An illustrative review of common modern craniotomies. J Clin Imaging Sci. 10, 81 (2020).
- Usui, N., Kondo, A., Nitta, N., Tottori, T., Inoue, Y. Surgical resection of amygdala and uncus. Neurol Med Chir (Tokyo). 58, 377-383 (2018).
- Vivas, A. C., Reintjes, S., Shimony, N., Vale, F. L. Surgery of the amygdala and uncus: A case series of glioneuronal tumors. Acta Neurochir. (Wien). 162, 795-801 (2020).
- Al-Otaibi, F., Baeesa, S. S., Parrent, A. G., Girvin, J. P., Steven, D. Surgical techniques for the treatment of temporal lobe epilepsy. Epilepsy Res Treat. 2012, 1-13 (2012).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados