Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Улучшение результатов резекции переднерезальной височной доли - демонстрация резекции височной грушевидной коры
В этой статье
Резюме
Здесь мы демонстрируем подход к интраоперационному нейрохирургическому контролю при резекции антеромезиальной височной доли, уделяя особое внимание использованию трактографии и анатомических масок для содействия безопасной резекции височной части грушевидной коры - области, которая все чаще рассматривается как важнейшая хирургическая мишень при лекарственно-устойчивой мезиальной височной эпилепсии.
Аннотация
Антеромезиальная резекция височной доли (ATLR) является полезным вариантом лечения лекарственно-устойчивой мезиальной височной эпилепсии (DRmTLE). Все больше данных свидетельствуют о том, что грушевидная кора играет решающую роль в возникновении и распространении судорог при DRmTLE, и что резекция височной части грушевидной коры связана со значительно улучшенными показателями свободы от приступов.
Здесь мы представляем резекцию височной части грушевидной коры в ATLR с использованием алгоритмов предоперационной вероятностной трактографии с высоким разрешением и объединенных анатомических масок интересующих структур в интраоперационную нейронавигацию и проекционный дисплей микроскопа (HUD).
Все пациенты, проходящие комплексную предоперационную оценку и обследование на предмет DRmTLE, предоставили информированное письменное согласие на запись интраоперационного видео процедуры. Пациенты были идентифицированы экспертной мультидисциплинарной командой эпилептологов, нейрохирургов эпилепсии, нейропсихологов, нейропсихиатров и электрофизиологов в крупном центре хирургии эпилепсии. Предоперационная визуализация включала в себя оконтуривание критических структур. Это включало в себя височную грушевидную кору и вероятностную трактографию с высоким разрешением для основных трактов, подверженных риску (например, оптическое излучение и нижний лобно-затылочный пучок). Они были совместно зарегистрированы с помощью предоперационного объемного нейронавигационного сканирования и загружены в интраоперационную нейронавигационную систему.
Здесь представлена пошаговая процедура ATLR, включающая резекцию височной части грушевидной коры. Протокол сочетает в себе передовую структурную и диффузионную МР-визуализацию и интраоперационные визуальные средства для интеграции анатомических масок критических структур серого вещества и трактов белого вещества в хирургический рабочий процесс в операционной.
Введение
Резекция переднерезальной височной доли (ATLR) является наиболее эффективным методом лечения лекарственно-устойчивой мезиальной височной эпилепсии (DRmTLE)1,2, с 50%-70% свободой от приступов и относительно низкой заболеваемостью 3,4,5. Также было показано, что процедура улучшает качество жизни 6,7,8, уровень занятости5 и психосоциальное благополучие9.
Каноническая ATLR, описанная Spencer et al.10, включает резекцию височного полюса, ункуса, миндалевидного тела, гиппокампа, парагиппокампальной извилины и веретенообразной извилины. Критические пути белого вещества, участвующие в зрении (оптическое излучение, в частности, петляМейера 11,12) и речи (например, нижний лобно-затылочный пучок13 и дугообразный пучок14,15), подвержены риску повреждения при доступе к височному рогу бокового желудочка. В следующем протоколе описан подход к предотвращению этих трактов белого вещества с использованием предоперационной вероятностной трактографии с высоким разрешением и объединенных анатомических масок представляющих интерес структур в интраоперационную нейронавигацию и микроскопический проекционный дисплей (HUD).
Традиционное понимание в этой области заключается в том, что максимальная резекция гиппокампа полезна для максимизации скорости освобождения от послеоперационных судорог. Тем не менее, недавние воксельные анализы случаев после ATLR показывают, что резекция височной части грушевидной коры при ATLR значительно увеличивает вероятность освобождения от судорог. Они также показали, что не было никакой связи между задней резекцией гиппокампа и свободой от судорог16,17. Соответственно, было предложено обновить технику Спенсера, ограничив резекцию гиппокампа передними 55% гиппокампа, в ATLR с доминантой в языковом полушарии, чтобы сохранить функцию памяти 16,18.
Несмотря на растущий интерес к использованию новых минимально инвазивных методов лечения, в частности лазерной интерстициальной термотерапии (ЛИТТ), хирургическая резекция остается стандартом лечения лекарственно-устойчивой фокальной эпилепсии1, и было показано, что эффективность ЛИТТ приводит к более низкой доле исходов приступов Энгеля 1 (58%-59%)1,19 по сравнению с ATLR (60%-70%)3, 4,5,20, и поэтому все еще является областью, требующей дальнейшего исследования21.
Появляется все больше доказательств, подтверждающих гипотезу о том, что грушевидная кора (рис. 1) является критической областью в размножении и/или эпилептогенезе приступов у взрослых 16,17,22,23,24 и детей25 лет с мезиальной височной эпилепсией. Грушевидная кора представляет собой ленту из трехслойного аллокортекса (аналогично расположению коры гиппокампа), которая драпируется вокруг энторинальной борозды мезиаль к височной ножке26,27, и поэтому образует слияние височной и лобной долей. Поэтому его легко можно рассматривать как состоящий из лобных и височных делений, подробно описанных в литературе 22,25,28,29,30.
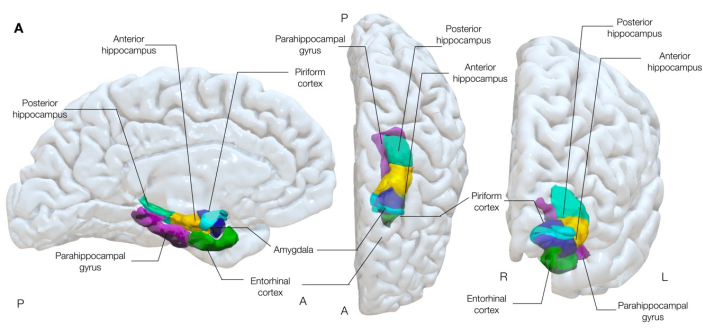
Рисунок 1: Полупрозрачное трехмерное изображение мезиальных височных структур мозга. На этом рисунке показаны анатомические связи грушевидной коры (голубого цвета) с анатомией окружающей мезиальной височной доли. Левый медиальный, верхний центр и правый передний виды. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Грушевидная кора является суперомезиальной по отношению к миндалевидному телу и долгое время в исследованиях на животных считалась общим узлом в сетях, которые распространяют эпилептогенные разряды31-33 и вызывают судороги после электрической стимуляции легче, чем соседние мезиальные структуры, включая миндалевидное тело и гиппокамп34. Его положение, с обширными связями с энторинальной, лимбической, орбитофронтальной и островковой корой, а также с таламусом, обонятельной луковицей, миндалевидным телом и гиппокампом, также играет роль ключевого пути распространения эпилептогенных разрядов при фокальной эпилепсии30.
Исследования ЭЭГ-фМРТ и позитронно-эмиссионной томографии (ПЭТ) также подтверждают важную роль грушевидной коры в DRmTLE, демонстрируя интериктальную активацию, а сниженное связывание рецептора γ-аминомасляной кислоты типа А (ГАМКА) в грушевидной коре связано с повышенной судорожной активностью 35,36,37.
Два важных недавних исследования визуализации в DRmTLE показали, что свобода послеоперационных припадков связана с большей степенью резекции грушевидной коры; Galovic et al. продемонстрировали в большой ретроспективной когорте, что удаление по крайней мере половины грушевидной коры улучшило шансы на избавление от приступов в 16 раз (95% ДИ, 5-47; p < 0,001)17. Также было продемонстрировано, что объемы резекции других мезиальных височных структур не были связаны с свободой от судорог, что было воспроизведено и подтверждено воксельным анализом, проведенным Sone et al., которые показали, что только резекция грушевидной коры в левой TLE была связана со свободой припадков16 (Рисунок 2).
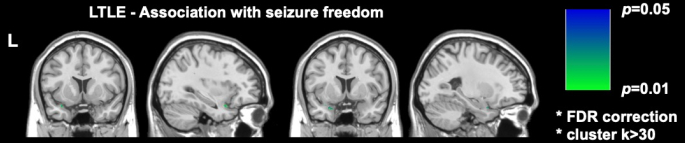
Рисунок 2: Воксельная связь со свободой послеоперационных припадков при левом TLE. Единственной областью, значимо коррелировавшей со свободой припадков, является височная часть грушевидной коры, p = 0,01 (зеленый цвет в корональных и сагиттальных Т1-взвешенных срезах МРТ). Адаптировано из Sone et al.16 с разрешения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Borger et al. также продемонстрировали в большой ретроспективной когорте, что только доля резецированной височной грушевидной коры связана с улучшением показателей свободы от приступов как через 1 год3 , так и при более длительном наблюдении (в среднем 3,75 года)23. Они также подтвердили, что объем резекции гиппокампа и миндалевидного тела не предсказывал свободу припадка.
Важность отделения грушевидной коры от аберрантной эпилептогенной сети при mTLE также была продемонстрирована при LITT, при этом Hwang et al. показали при 6-месячном наблюдении, что процентная абляция грушевидной коры была связана с исходами ILAE класса 138 (ОШ 1,051, 95% ДИ 1,001-1,117, p = 0,045), но эта тенденция не была значимой через 1 год5. Это, по-видимому, подтверждает новые данные о ЛИТТ, что существует положительное, но потенциально менее постоянное улучшение результатов судорог, что привело к тому, что ЛИТТ обычно используется в качестве процедуры «первого этапа», а резективная хирургия предлагается тем, у кого ЛИТТ не достигает свободы от приступов.
Таким образом, существуют убедительные доказательства того, что резекция височной части грушевидной коры является ключевой мишенью в достижении свободы от приступов при лекарственно-устойчивой мезиальной височной эпилепсии. Однако, как показала ретроспективная когорта из Галовича и др., эта лента энторинальной коры находится в трудном месте для хирургического воздействия при выполнении ATLR, а это означает, что если она не является прямым воздействием, она не всегда успешно удаляется. В этом исследовании мы показываем, как безопасно нацеливаться и резецировать височную часть грушевидной коры в рамках продолжающегося проспективного хирургического исследования, чтобы оценить его влияние на улучшение показателей снятия судорог после операции39.
Основное внимание в данном протоколе уделяется техническим аспектам получения и обработки изображений, хирургическому подходу и тому, как мы обеспечиваем резекцию височной части грушевидной коры в ATLR, интегрируя предоперационную вероятностную трактографию высокого разрешения и объединенные анатомические маски интересующих структур в интраоперационную нейронавигацию и проекционный дисплей микроскопа (HUD). В протоколе также используется специальная программная платформа40 для планирования, которая обеспечивает трехмерный просмотр и интеграцию мультимодальной визуализации для хирургического обзора и планирования, а также нейронавигационная система, обеспечивающая интеграцию с операционным микроскопом (особенности подробно описаны в таблице материалов).
Access restricted. Please log in or start a trial to view this content.
протокол
Эти методы и протоколы являются частью продолжающегося проспективного хирургического исследования, которое было одобрено Управлением исследований в области здравоохранения 10/09/2020, Комитет по этике исследований (REC) Лондон ссылка: 20/LO/0966. Протокол был проспективно зарегистрирован: ISRCTN72646265, 25/09/2020, доступен онлайн39 и был представлен на национальной конференции41.
Следующий протокол применяется ко всем пациентам, проходящим ATLR по поводу DRmTLE у пациентов в возрасте 18-70 лет (возрастная группа пациентов, прооперированных по этому показанию в нашем специализированном центре хирургии эпилепсии у взрослых), все они оперируются одними и теми же хирургами (AWM, AM). Все участники дали информированное согласие перед включением в исследование. Все участники прошли тщательную предоперационную оценку и обследования под руководством экспертной многопрофильной команды хирургической эпилепсии в Центре комплексной хирургии эпилепсии авторов, состоящей из нейрохирургов, неврологов эпилепсии, нейропсихологов, психиатров, нейрорадиологов и других специалистов по лечению эпилепсии. Перед операцией всем им были сделаны актуальные объемные МРТ T1, T2 и FLAIR, как указано в протоколе ниже, а также стандартная предоперационная кровь и осмотр бригадой нейроанестезиологов, что гарантировало их безопасность для проведения операции под общей анестезией. Коммерческие детали реагентов и оборудования, использованного в данном исследовании, приведены в Таблице материалов.
1. Получение и обработка изображений
ПРИМЕЧАНИЕ: Предоперационная магнитно-резонансная томография (МРТ) с высоким разрешением, 3 месяца и 1 год после хирургической магнитно-резонансной томографии (МРТ) обычно проводятся у людей, перенесших операцию по лечению эпилепсии в нашем центре. Данные МРТ были получены в период с марта 2020 года по март 2024 года на том же МРТ-сканере для согласованности. Стандартизированное получение изображений и многие компоненты обработки были ранее описаны в литературе и соответствующим образом упомянуты в протоколе, кратко изложенном ниже:
- Получите следующие последовательности МРТ:
- Стандартная 3D изометрическая (1 мм) T1-взвешенная последовательность с быстрым восстановлением испорченного градиента (IR-FSPGR) эхо [время эха (TE) 3,1 мс, время повторения (TR) = 7,4 мс, время инверсии = 400 мс, поле зрения (FOV) = 224 × 256 × 256 мм, матрица = 224 × 256 × 256, размер вокселя = 1,00 × 1,00 × 1,00 мм = 1,00 мм3, коэффициент ускорения параллельного изображения = 2] и;
- Корональная последовательность с двойным эхо быстрым восстановлением быстрым спиновым эхом протонной плотности/T2-взвешенной последовательности, используемая для релаксометрииT2 42 (TE = 30/119 мс, TR = 7600 мс, FOV = 220 × 220 мм, матрица = 512 × 512, толщина среза = 4 мм, размер вокселя = 0,43 × 0,43 × 4,00 мм = 0,74 мм3, коэффициент SENSE = 2).
- Используйте приведенную выше Т1-взвешенную последовательность в качестве входных данных для алгоритма геодезических информационных потоков (GIF v3) для парцелляции мозга на 162 анатомические области с помощью NiftyWeb43.
- Создание анатомических масок исследуемых структур с использованием парцелляций GIF (парагиппокампальная извилина, веретенообразная извилина, создание информации о профилировании гиппокампа и сегментация гиппокампа на передние 55% и задние 45% с помощью Hipposeg44), наложение их в программном обеспечении планирования на объемную предоперационную визуализацию пациента (как в шаге 1.1).
- Выполните автоматическую сегментацию грушевидной коры и разделите грушевидную кору на лобные и височные компоненты с помощью методов волюметрии, описанных в предыдущей работе нашей лаборатории 17,45,46. После создания наложите эти маски на предоперационную визуализацию пациента.
- Получите следующие изображения диффузионной МРТ:
- Многооболочечная съемка со стандартным разрешением (изотропное разрешение 2 мм, 11, 8, 32 и 64 градиентных направления при b-значениях 0, 300, 700, 2500 с/мм2) и;
- Многооболочечная съемка с высоким разрешением (изотропное разрешение 1,6 мм, 101 направление, 14 b0, b-значения: 300, 700 и 2500 с/мм2).
- Скорректировать полученные данные диффузии с помощью MRtrix3 (https://mrtrix.org)47 для:
- Шум с использованием "dwidenoise" в MRtrix348.
- Дрейф сигнала49.
- Звон Гиббса с использованием "mrdegibs" в MRtrix350.
- Искажение с использованием обратного фазокодирующего градиента с алгоритмом FSL TOPUP (https://fsl.fmrib.ox.ac.uk/fsl51).
- Вихревые токи и артефакты движения с использованием вихревого алгоритма FSL (https://fsl.fmrib.ox.ac.uk/fsl)52, вращение векторовb 53.
- Поле смещения с использованием алгоритма ANTs (https://mrtrix.org47,54).
- Используйте многооболочечную, многотканевую ограниченную сферическую деконволюцию (CSD)55 для оценки ответных функций для белого и серого вещества, а также спинномозговой жидкости (СМЖ).
- Выполните анатомически направленную автоматизированную трактографию для реконструкции представляющих интерес пучков волокон 12,56,57: оптическое излучение, нижний лобно-затылочный пучок (IFOF; языковые доминантные случаи) и средний продольный пучок (MLF; языковые недоминантные случаи). Выполните следующие действия.
- Извлеките корковые конечные точки для каждого пучка волокон и сгруппируйте их по начальному и конечному ROI.
- Создание исключающих областей коры головного мозга и ROI с использованием незавершающихся областей коры головного мозга.
- Выполнение трактографии58 с анатомически ограниченными ограничениями с помощью вероятностного алгоритма отслеживания волокон iFOD259 с использованием гибридной сегментации поверхности и объема в MRtrix347 с отбором максимум 5000 линий тока из 300 миллионов семян.
- Выполните трактографию на шаге 1.8.3 дважды для каждого пучка волокон, переключая ROI затравки и окончания.
- Преобразуйте полученные пучки волокон в вероятностные карты со значением 0,01 - используйте их в качестве дополнительных критериев исключения для удаления ложных линий тока.
- Просмотрите полученные пучки волокон (расширенные на 2 мм) и анатомические маски в программном обеспечении для планирования, чтобы убедиться в их анатомической точности (этот этап выполняется двумя нейрохирургами по эпилепсии в нашем отделении).
- Пространственно зарегистрируйте полученные анатомические маски серого вещества и тракта белого вещества на эталонном Т1-взвешенном МРТ-изображении на шаге 1.1 и загрузите в интраоперационную навигационную систему в операционной интраоперационной МРТ (iMRI).
- Получите взвешенные объемные МРТ-изображения T1, T2 и T2-FLAIR непосредственно перед операцией (< 24 ч) с помощью реперных точек зрения кожи головы пациента. Зарегистрируйте эти изображения друг для друга, а также взвешенное эталонное изображение и маски T1, описанные выше и показанные на рисунке 3.
- Зарегистрируйте пациента в нейронавигационной системе с помощью лазера с выравниванием поверхности и смарт-указкой.
- Проверьте точность совместной регистрации изображения и пациента с двумя нейрохирургами по эпилепсии до начала заболевания, чтобы убедиться в точности.
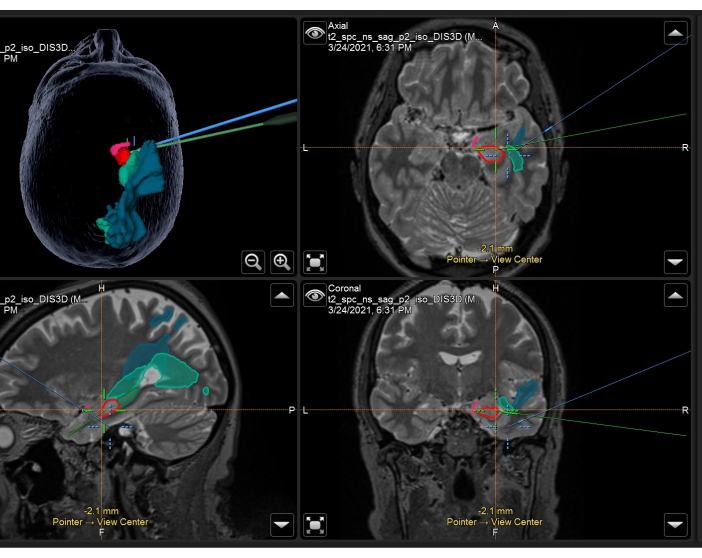
Рисунок 3: Скриншот нейронавигационной системы, демонстрирующей объемную Т2-взвешенную МРТ с наложенными анатомическими масками и трактами, используемую интраоперационно в правой ATLR. Верхняя левая панель: 3-мерная реконструкция головы пациента, демонстрация анатомических масок. Вверху справа: аксиальный, внизу слева: сагиттальный, и внизу справа: корональные изображения, также показывающие наложенные анатомические маски на Т2-взвешенном объемном МРТ. Анатомические маски отображаются: височная часть грушевидной коры (розовая), передняя 55% гиппокампа (красная), задняя 45% гиппокампа (темно-зеленая, видна только на сагиттальном изображении), оптическое излучение (средне-зеленая), средний продольный пучок (синий). Синее перекрестие — это интегрированное положение фокуса микроскопа, а зеленое перекрестие — это положение нейронавигационного указателя, используемого в операционном поле. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
2. Хирургическая техника
ПРИМЕЧАНИЕ: Приведенные ниже шаги обобщают практику в центре авторов и не предназначены для изложения единственного хирургического подхода к ATLR, а скорее для демонстрации того, как авторы стандартизировали подход к этой процедуре для обеспечения надежных и воспроизводимых резекций, включая резекцию височной грушевидной коры.
- Позиционирование и подход
- После стандартных предоперационных осмотров и мер безопасности расположите пациента в положении лежа на спине, поднимите ипсилатеральное плечо с помощью крена и поверните голову в контралатеральную сторону.
- Согните голову в боковом направлении, чтобы убедиться, что скуловое возвышение является самой высокой точкой операционного поля, и зафиксируйте штифтами (3-точечное устройство для фиксации черепа - см. примеры, в том числе совместимые с интраоперационными [iMRI] театрами в Таблице материалов).
ПРИМЕЧАНИЕ: Расположение имеет решающее значение для обеспечения адекватного доступа к мезиальным и задним височным структурам, особенно к латеральному сгибанию, чтобы гарантировать, что скуловое возвышение является самой высокой точкой операционного поля. - Инфильтрируйте местный анестетик в места установки штифтов и разрез кожи.
- Зарегистрируйте пространство пациента в нейронавигационной системе с помощью комбинации реперных точек зрения кожи и отслеживания поверхности (в зависимости от используемой марки нейронавигационной системы). Подтвердите точность регистрации по пальпируемым или видимым костным/другим анатомическим признакам.
- Отметьте линию роста волос и корень скуловой кости (определяется при ручной пальпации). Определите и отметьте ход сильвиевой трещины с помощью нейронавигации и запланированного криволинейного лобно-височного разреза кожи в виде вопросительного знака.
- Удаляйте волосы вдоль запланированного разреза кожи с помощью электрических машинок для стрижки волос.
- Выполните лобно-височный разрез на 1 см впереди козелка, изогнутый в виде вопросительного знака, чтобы предотвратить повреждение лобно-височной ветви лицевого нерва. По возможности определите и сохраните поверхностную височную артерию. Расположение и маркировка разреза кожи показаны на рисунке 4.
- Закройте и закрепите края раны с помощью пропитанных противомикробными манежками из сосцевидного отростка и зажимов Рани.
- Разрежьте височную мышцу и приподнимите ее либо миокожным, либо межфасциальным/субфасциальным лоскутом (предотвращая повреждение лобно-височной ветви лицевого нерва).
- Оберните кожный лоскут марлей, смоченной в антимикробном растворе, и втяните его спереди (избегая использования металлических инструментов для крепления, если вы находитесь в театрах iMRI).
- С помощью перфораторного сверла создайте 2 отверстия для заусенцев в черепной коробке: первое прямо над корнем скуловой мышцы, чтобы максимизировать нижнее обнажение, второе нижнее лобное, чтобы облегчить визуализацию сильвиевой щели.
- Выполнить стандартную лобно-височную трепанациючерепа 60,61,62, обнажив верхнюю и среднюю височную извилины на 1 см выше сильвиевой щели.
- Просверлите передний и нижний края краниотомии, чтобы обеспечить легкий доступ к дну средней височной ямки, а также к височному полюсу спереди. Если вы столкнулись с воздушными ячейками сосцевидного отростка, запечатайте их костным воском и фибриновым клеем как при встрече с ними, так и в конце процедуры перед закрытием слоев, поверхностных по отношению к кости.
ПРИМЕЧАНИЕ: Важно убедиться, что трепанация черепа обеспечивает доступ к дну средней черепной ямки, так как это будет доступ к височному рогу бокового желудочка через коллатеральную борозду. Также важно тщательно изолировать любые обнаруженные сосцевидные воздушные клетки, чтобы предотвратить послеоперационную утечку спинномозговой жидкости и вытекающие из нее симптомы и потенциальные инфекции. - Откройте твердую мозговую оболочку U-образным образом, основание отражается вперед и расширяется звездчатым образом. Отвлеките твердую мозговую оболочку от операционного поля швами (например, шелком 3-0).
- Освободите спинномозговую жидкость со дна средней черепной ямки и передней части средней черепной ямки.
ПРИМЕЧАНИЕ: Этап высвобождения спинномозговой жидкости важен для обеспечения достаточного рабочего пространства для хирургического доступа к дну средней черепной ямки и коллатеральной борозде снизу без втягивания и нагрузки на базальную височную долю.
- Латеральное удаление неокортикального слоя головного мозга
- Коагулируют pia средней и нижней височной извилин (MTG и ITG соответственно) по линии, перпендикулярной основанию черепа и на одной линии с передней проекцией височного рога бокового желудочка (подтверждено по данным нейронавигационной системы). Подбирайте передне-заднюю протяженность этой линии в каждом конкретном случае в зависимости от дохирургических признаков латерального вовлечения неокортекса в начало/распространение судорог.
ПРИМЕЧАНИЕ: Передне-задний объем латеральной неокортикальной резекции должен учитывать предоперационные доказательства (или их отсутствие) ее участия в распространении судорог, и они подбираются индивидуально для каждого пациента. - Используйте транскортикальный подход в ITG для обнажения дна средней черепной ямки и идентификации коллатеральной борозды, которая находится латерально по отношению к парагиппокампальной извилине и медиально по отношению к веретенообразной извилине.
- Коагулируют пии верхней височной извилины (СТГ) перед вышеуказанным боковым разрезом неокортекса, параллельно направлению сильвиевой щели. Она перпендикулярна линии, описанной в шаге 2.16, и простирается спереди к височному полюсу.
- Развивайте плоскость между СТГ и сильвиевой щелью с помощью техник субпиальной диссекции, защищая ветви средней мозговой артерии, и проводите это расслоение вниз к горизонтальной части сильвиевой щели до уровня нижней предельной борозды островковой доли.
ПРИМЕЧАНИЕ: При выполнении субпиальной диссекции в шаге 2.2.4 следует соблюдать осторожность в поддержании целостности pia STG, граничащей с сильвиевой щелью, поскольку это защищает ветви средней мозговой артерии в фиссуре, а также другие структуры, такие как глазодвигательный нерв и задняя соединительная артерия (шаг 2.2.14) и зрительный тракт (шаг 2.3) на более поздних этапах операции. - Интегрируйте микроскоп с нейронавигационной системой.
- Подтвердите точность наложения объектов анатомических масок, описанных в разделе 1, и визуализируйте их на ИЛС микроскопа.
- Наклоните заднюю линию резекции кпереди, чтобы свести к минимуму резекцию STG, и постепенно расширяйте ее через MTG и ITG, через веретенообразную извилину к коллатеральной борозде.
- Проверьте соотношение края задней резекции с нейронавигационной системой с визуализируемой маской оптического излучения (ОШ).
- Визуализируйте максимальную переднюю площадь маски операционной на микроскопе и убедитесь, что она находится позади края резекции на ИЛС микроскопа, чтобы гарантировать отсутствие повреждения операционной, которое может привести к дефициту поля зрения после операции, как показано на рисунке 5.
ПРИМЕЧАНИЕ: Шаг 2.2.9 является критически важным шагом для предотвращения послеоперационного дефицита поля зрения из-за повреждения петли Мейера оптического излучения. Если происходит большой сдвиг мозга и хирург хотел бы еще больше свести к минимуму риск повреждения оптического излучения, или если проекции на ИЛС микроскопа работают неправильно, авторы предлагают использовать указатель нейронавигации для направления подхода к крайнему переднему кончику височного рога бокового желудочка. так как это сводит к минимуму риск травм в операционной. - Следуйте за коллатеральной бороздой вверх до тех пор, пока не встретится височный рог (подтвердите это с помощью нейронавигационной системы), как показано на рисунке 6. Стенку височного рога можно определить по эпендиме с голубым оттенком.
ПРИМЕЧАНИЕ: У лиц, у которых патологией не является склероз гиппокампа, а головка гиппокампа объемная, желудочек может быть трудно обнаружить. В этих случаях одним из вариантов устранения неполадок является использование указателя нейронавигации на основании медиальной височной ямки, где нет смещения, чтобы найти, куда выступает кончик желудочка. Обычно полезно искать это в корональной плоскости. Если желудочек не может быть найден, мы предлагаем сначала удалить полюс, а затем найти желудочек с помощью ультразвукового аспиратора. - Разделите базальные височные лептоменинги латерально к обнажению височного рога.
- Откройте желудочек спереди, чтобы обнажить головку гиппокампа (как показано на рисунке 6).
- Удлините задний край резекции, чтобы соединить отсоединение с желудочком, и это позволит отсоединить неокортикальный блок.
- Мобилизуйте височный полюс по линии рассечения на краю тенториального края. Следите за тем, чтобы не выполнять отсоединение через край тенториума, чтобы избежать травм мезиальных структур, включая глазодвигательный нерв и заднюю коммуникативную артерию.
ПРИМЕЧАНИЕ: Чтобы снизить риск повреждения конструкций в цистерне cruralis, следите за формой края тенториума, не выходя за край палатки. Ункус останется на месте и может быть взят как отдельный экземпляр.
- Коагулируют pia средней и нижней височной извилин (MTG и ITG соответственно) по линии, перпендикулярной основанию черепа и на одной линии с передней проекцией височного рога бокового желудочка (подтверждено по данным нейронавигационной системы). Подбирайте передне-заднюю протяженность этой линии в каждом конкретном случае в зависимости от дохирургических признаков латерального вовлечения неокортекса в начало/распространение судорог.
- Мезиальная височная резекция, включая височную грушевидную кору
- Очистите ткани от ункуса с помощью диссекции и использования ультразвукового аспиратора мезиально до тех пор, пока глазодвигательный нерв и задняя соединительная артерия не станут видимыми. Остановите объем задней резекции, когда визуализируется pes (самая мезиальная часть головки гиппокампа).
- Выполняйте резекцию миндалевидного тела с помощью ультразвукового аспиратора, ограниченного сверху пиа эндоринальной борозды, и до тех пор, пока зрительный тракт не будет визуализирован, и мезиально пиальной плоскостью базальных цистерн.
ПРИМЕЧАНИЕ: При выполнении шага 2.3.2 следите за тем, чтобы сохранить височную ножку и не проникнуть в лобную долю. Иногда, из-за сдвига в мозге, нейронавигация может переоценивать объем резекции мезиально; В связи с этим резекцию безопасно продолжать до тех пор, пока зрительный тракт не будет визуализирован через PIA, и это представляет собой мезиальную границу резекции. Это также описано в Usui et al.63Дорсальный край миндалевидного тела обычно описывается как аппроксимированный воображаемой линией, соединяющей хориоидею с бифуркацией проксимальной средней мозговой артерии64. - Убедитесь, что височная часть грушевидной коры резецирована, удалив всю остаточную ткань с помощью субпиального рассечения, прогрессирующего вниз от височной стороны сильвиевой щели до тех пор, пока не будет визуализирована вена нижней круглой борозды островковой доли. Этот край резекции аналогичен описанному Usui et al. при резекции миндалярно-ункальных поражений63.
ПРИМЕЧАНИЕ: Если ункус (на шаге 2.3.1) или грушевидная кора трудно удалить (иногда они могут быть очень прилегающими к мозговой оболочке), авторы предлагают использовать диссектор Ротона, а не ультразвуковой аспиратор, чтобы свести к минимуму повреждение мозговой оболочки. - Подтвердите резекцию височной части грушевидной коры с помощью анатомической маски, описанной в шаге 1.4, наложенной на HUD микроскопа, как показано на рисунке 7.
- Резекция гиппокампа
- Поместите линтины (или аналогичные широкие коттоноиды) для втягивания сосудистого сплетения (и передней сосудистой артерии) мезиально, чтобы облегчить визуализацию фимбрийного гиппокампа.
- Отсоедините фимбрия гиппокампа от его паутинного прикрепления, обнажив борозду гиппокампа, которая несет артериальную сосудистую аркаду аммонова рога.
- Отсоедините гиппокамп от его хвоста (либо ограничив эту резекцию передними 55% гиппокампа при языковых резекциях доминантного полушария в попытке свести к минимуму дефицит вербальной памяти, как описано впункте 16, либо распространите его так же кзади, как уровень тектума среднего мозга при неязыковых резекциях доминантного полушария).
- Отсоедините головку гиппокампа от pes hippocampi. Коагулируйте артериальную аркаду гиппокампа по мере необходимости.
- Удалите отсоединенный гиппокамп единым блоком.
- Выполните субпиальную диссекцию парагиппокампальной извилины и субикулума и обеспечьте гемостаз в полученной хирургической полости. Удалите pes hippocampi, визуализируя и защищая ствол мозга.
ПРИМЕЧАНИЕ: При выполнении шага 2.4.7 следует соблюдать осторожность, так как на этом уровне отсутствует защитная граница между ПЭС и стволом мозга.
- Интраоперационная визуализация и закрытие
- Удалите все металлические предметы из операционного поля, закройте рану и выполните интраоперационное МРТ-сканирование, обычно включающее объемные последовательности T1, T2, FLAIR и DWI.
- Просмотрите интраоперационную визуализацию с помощью нейрорадиолога-консультанта вместе с двумя нейрохирургами-консультантами по эпилепсии, чтобы убедиться, что желаемое количество структур мезиальной височной доли (включая височную часть грушевидной коры, а также переменное количество гиппокампа, как описано выше в шаге 2.36) было успешно резецировано. Также просмотрите визуализацию DWI, чтобы убедиться, что во время процедуры не было вызвано никаких участков ишемии.
- Как только вышеуказанное подтвердится, переложите пациента обратно на операционный стол и подтвердите гемостаз в операционной полости при нормотензии для пациента.
- Закройте рану стандартным образом, заменив костный лоскут, закрепив его пластинами и винтами в 3 точках, и стандартное закрытие мышечного, фасциального и кожного слоев швами, оставив хирургический дренаж раны на месте на 24 часа.
ПРИМЕЧАНИЕ: Послеоперационный уход осуществляется в центре авторов, как правило, в нейрохирургическом отделении с высокой зависимостью в течение первых 24 часов, после чего следует переход в специализированное отделение нейрохирургии, когда отделение с высокой степенью зависимости сочтет это целесообразным. Пациенты находятся под наблюдением на предмет неврологических наблюдений, имеют послеоперационную кровь, включая мочевину и электролиты, общий анализ крови и дифференциальные анализы, и обычно выписываются примерно через 72 часа после операции. Затем они наблюдаются амбулаторно через 4-6 недель, а через 3-4 месяца и 1 год после операции как минимум с интервальной визуализацией.
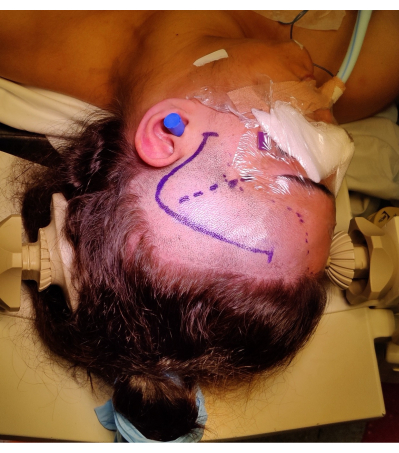
Рисунок 4: Изображение положения пациента для правой ATLR, демонстрирующее маркировку «вопросительного знака» на правом лобно-височной линии кожи, линии роста волос и сильвиевой щели. На рисунке не изображен перекат левого плеча под левым плечом пациента, чтобы обеспечить угол положения головы без чрезмерной нагрузки на шею пациента и не препятствуя венозному возврату. Изображения были сделаны и включены с согласия пациента. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
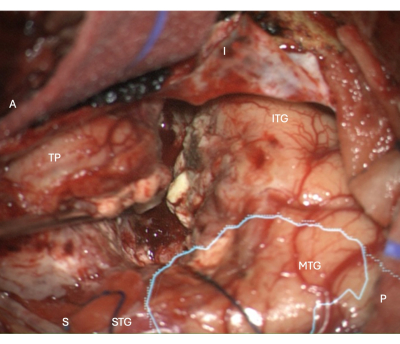
Рисунок 5: Интраоперационное изображение с микроскопа, демонстрирующее латеральный край неокортикальной резекции в правой ATLR с наложенной анатомической маской оптического излучения (голубой), демонстрирующей, что край резекции находится перед операционной. Метки демонстрируют ориентацию операционного вида: A = передняя, P = задняя, I = нижняя, S = верхняя, STG = верхняя височная извилина, MTG = средняя височная извилина, ITG = нижняя височная извилина, TP = височный полюс. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
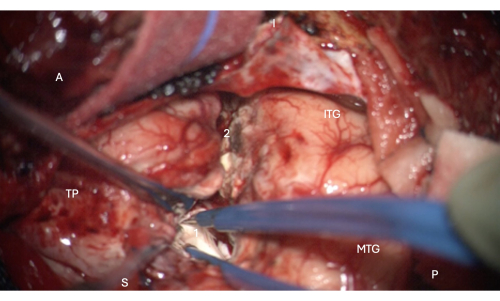
Рисунок 6: Интраоперационное изображение с микроскопа, демонстрирующее вход в переднюю часть височного рога бокового желудочка, показывающее головку гиппокампа внутри него (бледно-белый, 1). Метки: A = передняя, P = задняя, I = нижняя, S = верхняя, MTG = средняя височная извилина, ITG = нижняя височная извилина, 2 = боковой край неокортикальной резекции, следующий за коллатеральной бороздой вверх на глубине, чтобы найти височный рог бокового желудочка, TP = височный полюс. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
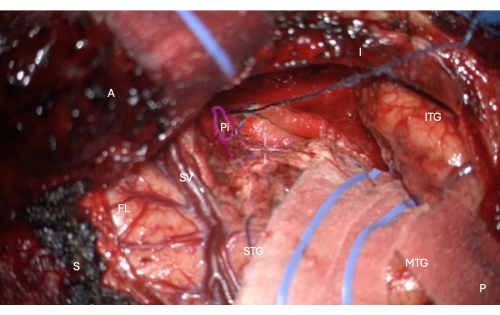
Рисунок 7: Интраоперационное изображение с микроскопа, демонстрирующее наложение HUD анатомической маски височной части грушевидной коры (розовый контур, помеченный Pi). На этом рисунке показана полная резекция - не осталось мозговой ткани, только пиальная граница эндоринальной борозды мезиала к резекции, защищенная на этом изображении с вышележащей продольной котлетой на изображении, прямо над центральным белым перекрестием микроскопа ИЛС. Метки: A = передняя, P = задняя, I = нижняя, S = верхняя, STG = верхняя височная извилина, MTG = средняя височная извилина, ITG = нижняя височная извилина, FL = лобная доля, SV = сильвиева вены (над сильвиевой щелью), Pi = височная часть грушевидной коры. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Access restricted. Please log in or start a trial to view this content.
Результаты
Этот протокол и хирургические методы были применены в рамках продолжающегося исследования, изучающего эффекты резекции височной грушевидной коры и ее влияние на свободу судорог после ATLR для DRmTLE. Целью данного исследования является перспективное определение того, д?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Этот протокол обеспечивает надежную, целенаправленную резекцию височной части грушевидной коры, которая считается ключевой структурой в эпилептогенезе и распространении сети мезиальной височной эпилепсии 16,17,24,25,30.
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы Дебаян Дасгупта и Джон С. Дункан получают финансирование от Инновационной программы Wellcome Trust (218380/Z/19/Z). Лоуренс. Биндинг поддержан Исследованием эпилепсии в Великобритании (номер гранта P1904). Вышеупомянутые авторы и Сьюрд Б. Вос частично финансируются Национальным институтом исследований в области здравоохранения, Университетским колледжем, Лондонским центром биомедицинских исследований (NIHR, BRC, UCLH/UCL High Impact Initiative, BW.mn.BRC10269). Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов. Мы подтверждаем, что ознакомились с позицией журнала по вопросам, связанным с этичными публикациями, и подтверждаем, что данный отчет соответствует этим руководящим принципам.
Благодарности
Эта работа была поддержана Исследованием эпилепсии в Великобритании (грант No P1904) и Инновационной программой Wellcome Trust (218380/Z/19/Z). Эта работа была частично профинансирована Национальным институтом исследований в области здравоохранения, Университетским колледжем, Лондонским центром биомедицинских исследований (NIHR, BRC, UCLH/UCL High Impact Initiative, BW.mn.BRC10269). Авторы отмечают возможности и научную и техническую помощь Национального центра визуализации, являющегося Национальной стратегией совместной исследовательской инфраструктуры (NCRIS), в Центре микроскопии, характеризации и анализа Университета Западной Австралии. Это исследование было полностью или частично профинансировано Wellcome Trust [WT 218380]. В целях открытого доступа автор применил публичную лицензию CC BY на авторское право на любую версию рукописи, принятой автором, возникшую в результате этой заявки.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Brainlab Neuronavigation System | Brianlab, Westchester, IL | https://www.brainlab.com/surgery-products/overview-neurosurgery-products/cranial-navigation/ | Intraoperative neuronavigation system |
| EpiNav Planning Software | N/A | N/A | Clinical Decision Support Tool, for research use, developed in academia at King's College London and University College London |
| Mayfield clamp | Integra | A1059 | Any 3 pin head immobilisation device can be used |
| Microsurgical instruments | As per local neurosurgical unit | ||
| MRI Scanner | GE, Milwaukee, WI, USA | 3T MRI GE MR750 | Any alternative 3T MRI scanner can be used |
| MRTrix3 | N/A | Reference 47 in the manuscript | MRtrix3 provides a set of tools to perform various advanced diffusion MRI analyses, including constrained spherical deconvolution (CSD), probabilistic tractography, track-density imaging, and apparent fibre density |
| NORAS coil | NORAS MRI Products | https://www.noras.de/en/mri-produkte/lucy-or-head-holder-8-ch-coil/#infos | Any MRI-safe head immobilisation device can be used |
| Perforator drill | Stryker | https://neurosurgical.stryker.com/products/elite/ | Any alternative neurosurgical perforator drill driver and bit can be used |
| Sutures - Vicryl Plus 2/- | Ethicon | ETVCP684H | Any alternative suture that the surgeon prefers can be used |
| Titanium bone plates and screws | As per local neurosurgical unit | ||
| Ultrasonic Aspirator | Integra | https://products.integralife.com/cusa-tissue-ablation/category/cusa-tissue-ablation | Any alternative that the surgeon prefers can be used |
Ссылки
- Marathe, K., et al. ablative and radiosurgical interventions for drug-resistant mesial temporal lobe epilepsy: A systematic review and meta-analysis of outcomes. Front Neurol. 12, 777845(2021).
- Choi, H., et al. Epilepsy surgery for pharmacoresistant temporal lobe epilepsy: A decision analysis. JAMA. 300, 2497(2008).
- Foldvary, N., et al. Seizure outcome after temporal lobectomy for temporal lobe epilepsy: A Kaplan-Meier survival analysis. Neurology. 54, 630-634 (2000).
- Spencer, S. S., et al. Predicting long-term seizure outcome after resective epilepsy surgery: The multicenter study. Neurology. 65, 912-918 (2005).
- Sperling, M. R., O'Connor, M. J., Saykin, A. J., Plummer, C. Temporal lobectomy for refractory epilepsy. JAMA. 276, 470-475 (1996).
- Wiebe, S. Effectiveness and safety of epilepsy surgery: What is the evidence. CNS Spectr. 9, 120-132 (2004).
- Gilliam, F., et al. Patient-oriented outcome assessment after temporal lobectomy for refractory epilepsy. Neurology. 53, 687-694 (1999).
- Markand, O. N., Salanova, V., Whelihan, E., Emsley, C. L. Health-related quality of life outcome in medically refractory epilepsy treated with anterior temporal lobectomy. Epilepsia. 41, 749-759 (2000).
- Jones, J. E., Berven, N. L., Ramirez, L., Woodard, A., Hermann, B. P. Long-term psychosocial outcomes of anterior temporal lobectomy. Epilepsia. 43, 896-903 (2002).
- Spencer, D. D., Spencer, S. S., Mattson, R. H., Williamson, P. D., Novelly, R. A. Access to the posterior medial temporal lobe structures in the surgical treatment of temporal lobe epilepsy. Neurosurgery. 15, 667-671 (1984).
- Vakharia, V. N., et al. Intraoperative overlay of optic radiation tractography during anteromesial temporal resection: A prospective validation study. J Neurosurg. 1, 1-10 (2021).
- Winston, G. P., et al. Preventing visual field deficits from neurosurgery. Neurology. 83, 604-611 (2014).
- Almairac, F., Herbet, G., Moritz-Gasser, S., de Champfleur, N. M., Duffau, H. The left inferior fronto-occipital fasciculus subserves language semantics: A multilevel lesion study. Brain Struct Funct. 220, 1983-1995 (2015).
- Binding, L. P., Dasgupta, D., Giampiccolo, D., Duncan, J. S., Vos, S. B. Structure and function of language networks in temporal lobe epilepsy. Epilepsia. 63, 1025-1040 (2022).
- Giampiccolo, D., Duffau, H. Controversy over the temporal cortical terminations of the left arcuate fasciculus: A reappraisal. Brain. 145, 1242-1256 (2022).
- Sone, D., et al. Optimal surgical extent for memory and seizure outcome in temporal lobe epilepsy. Ann Neurol. 91, 131-144 (2022).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690-700 (2019).
- Dasgupta, D., et al. Hippocampal resection in temporal lobe epilepsy: Do we need to resect the tail. Epilepsy Res. 190, 107086(2023).
- Wu, C., et al. Effects of surgical targeting in laser interstitial thermal therapy for mesial temporal lobe epilepsy: A multicenter study of 234 patients. Epilepsia. 60, 1171-1183 (2019).
- Wiebe, S. A randomized, controlled trial of surgery for temporal-lobe epilepsy. N Engl J Med. 345 (5), 311-318 (2001).
- Brotis, A. G., et al. A meta-analysis on potential modifiers of LITT efficacy for mesial temporal lobe epilepsy: Seizure-freedom seems to fade with time. Clin Neurol Neurosurg. 205, 106644(2021).
- Borger, V., et al. Resection of piriform cortex predicts seizure freedom in temporal lobe epilepsy. Ann Clin Transl Neurol. 8, 177-189 (2020).
- Borger, V., et al. Temporal lobe epilepsy surgery: Piriform cortex resection impacts seizure control in the long-term. Ann Clin Transl Neurol. 9 (8), 1206-1211 (2022).
- Hwang, B. Y., et al. Piriform cortex ablation volume is associated with seizure outcome in mesial temporal lobe epilepsy. Neurosurgery. 91, 414-421 (2022).
- Piper, R. J., et al. Extent of piriform cortex resection in children with temporal lobe epilepsy. Ann Clin Transl Neurol. 10, 1613-1622 (2023).
- Allison, A. C. The secondary olfactory areas in the human brain. J Anat. 88, 481-488 (1954).
- Ribas, G. C. The cerebral sulci and gyri. Neurosurg Focus. 28, E2(2010).
- Young, J. C., Vaughan, D. N., Paolini, A. G., Jackson, G. D. Electrical stimulation of the piriform cortex for the treatment of epilepsy: A review of the supporting evidence. Epilepsy Behav. 88, 152-161 (2018).
- Mai, J. K., Majtanik, M., Paxinos, G. Atlas of the Human Brain. , Academic Press. Amsterdam Heidelberg. (2016).
- Vaughan, D. N., Jackson, G. D. The piriform cortex and human focal epilepsy. Front Neurol. 5, 259(2014).
- Gale, K. Progression and generalization of seizure discharge: Anatomical and neurochemical substrates. Epilepsia. 29, S15-S34 (1988).
- Löscher, W., Ebert, U. The role of the piriform cortex in kindling. Prog Neurobiol. 50, 427-481 (1996).
- Piredda, S., Gale, K. A crucial epileptogenic site in the deep prepiriform cortex. Nature. 317, 623-625 (1985).
- McIntyre, D. C., Gilby, K. L. Mapping seizure pathways in the temporal lobe. Epilepsia. 49, 23-30 (2008).
- Fahoum, F., Lopes, R., Pittau, F., Dubeau, F., Gotman, J. Widespread epileptic networks in focal epilepsies: EEG-fMRI study. Epilepsia. 53, 1618-1627 (2012).
- Flanagan, D., Badawy, R. A. B., Jackson, G. D. EEG-fMRI in focal epilepsy: Local activation and regional networks. Clin Neurophysiol. 125, 21-31 (2014).
- Laufs, H., et al. Converging PET and fMRI evidence for a common area involved in human focal epilepsies. Neurology. 77, 904-910 (2011).
- Wieser, H. G., et al. Proposal for a new classification of outcome with respect to epileptic seizures following epilepsy surgery. Epilepsia. 42, 282-286 (2001).
- Dasgupta, D., Duncan, J. S. Optimizing epilepsy surgery. ISRCTN Registry. BMC. , Springer Nature. (2020).
- Sparks, R., et al. Automated multiple trajectory planning algorithm for the placement of stereo-electroencephalography (SEEG) electrodes in epilepsy treatment. Int J CARS. 12, 123-136 (2017).
- Dasgupta, D. Improving outcomes in anteromesial temporal lobe resections - A prospective surgical trial integrating multimodal imaging & novel hi-res tractography. , (2022).
- Winston, G. P., et al. Automated T2 relaxometry of the hippocampus for temporal lobe epilepsy. Epilepsia. 58, 1645-1652 (2017).
- Cardoso, M. J., et al. Geodesic information flows: Spatially-variant graphs and their application to segmentation and fusion. IEEE Trans Med Imaging. 34, 1976-1988 (2015).
- Winston, G. P., et al. Automated hippocampal segmentation in patients with epilepsy: Available free online. Epilepsia. 54, 2166-2173 (2013).
- Iqbal, S., et al. Volumetric analysis of the piriform cortex in temporal lobe epilepsy. Epilepsy Res. 185, 106971(2022).
- Leon-Rojas, J. E., et al. Resection of the piriform cortex for temporal lobe epilepsy: a novel approach on imaging segmentation and surgical application. Br J Neurosurg. 1, 1-6 (2021).
- Tournier, J. -D., et al. MRtrix3: A fast, flexible and open software framework for medical image processing and visualization. Neuroimage. 202, 116137(2019).
- Cordero-Grande, L., Christiaens, D., Hutter, J., Price, A. N., Hajnal, J. V. Complex diffusion-weighted image estimation via matrix recovery under general noise models. Neuroimage. 200, 391-404 (2019).
- Vos, S. B., et al. The importance of correcting for signal drift in diffusion MRI. Magn Reson Med. 77, 285-299 (2017).
- Kellner, E., Dhital, B., Kiselev, V. G., Reisert, M. Gibbs-ringing artifact removal based on local subvoxel-shifts. Magn Reson Med. 76, 1574-1581 (2016).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. Neuroimage. 23, S208-S219 (2004).
- Andersson, J. L. R., Sotiropoulos, S. N. An integrated approach to correction for off-resonance effects and subject movement in diffusion MR imaging. Neuroimage. 125, 1063-1078 (2016).
- Leemans, A., Jones, D. K. The B-matrix must be rotated when correcting for subject motion in DTI data. Magn Reson Med. 61, 1336-1349 (2009).
- Tustison, N. J., et al. N4ITK: Improved N3 Bias Correction. IEEE Trans Med Imaging. 29, 1310-1320 (2010).
- Dhollander, T., Raffelt, D., Connelly, A. Unsupervised 3-tissue response function estimation from single-shell or multi-shell diffusion MR data without a co-registered T1 image. ISMRM Workshop on Breaking the Barriers of Diffusion MRI. 5, (2016).
- Binding, L. P., et al. Contribution of white matter fiber bundle damage to language change after surgery for temporal lobe epilepsy. Neurology. 100, e1621-e1633 (2023).
- Giampiccolo, D., et al. Thalamostriatal disconnection underpins long-term seizure freedom in frontal lobe epilepsy surgery. Brain. 146, 2377-2388 (2023).
- Smith, R. E., Tournier, J. -D., Calamante, F., Connelly, A. Anatomically-constrained tractography: Improved diffusion MRI streamlines tractography through effective use of anatomical information. Neuroimage. 62, 1924-1938 (2012).
- Tournier, J. D., Calamante, F., Connelly, A. Improved probabilistic streamlines tractography by 2nd order integration over fibre orientation distributions. Proc 18th Annu Meet ISMRM. 1670, (2010).
- Yasargil, M. G., Fox, J. L. The microsurgical approach to intracranial aneurysms. Surg Neurol. 3, 7-14 (1975).
- Yasargil, M. G., et al. Microsurgical pterional approach to aneurysms of the basilar bifurcation. Surg. Neurol. 6, 83-91 (1976).
- Rao, D., Le, R. T., Fiester, P., Patel, J., Rahmathulla, G. An illustrative review of common modern craniotomies. J Clin Imaging Sci. 10, 81(2020).
- Usui, N., Kondo, A., Nitta, N., Tottori, T., Inoue, Y. Surgical resection of amygdala and uncus. Neurol Med Chir (Tokyo). 58, 377-383 (2018).
- Vivas, A. C., Reintjes, S., Shimony, N., Vale, F. L. Surgery of the amygdala and uncus: A case series of glioneuronal tumors. Acta Neurochir. (Wien). 162, 795-801 (2020).
- Al-Otaibi, F., Baeesa, S. S., Parrent, A. G., Girvin, J. P., Steven, D. Surgical techniques for the treatment of temporal lobe epilepsy. Epilepsy Res Treat. 2012, 1-13 (2012).
- Galovic, M., et al. Association of piriform cortex resection with surgical outcomes in patients with temporal lobe epilepsy. JAMA Neurol. 76, 690(2019).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены