Method Article
تشريح مبيض البعوض والأمعاء الوسطى والغدد اللعابية لتحليلات الميكروبيوم على مستوى الأعضاء
In This Article
Summary
تحمل المجتمعات الميكروبية في البعوض وعودا كبيرة لاستراتيجيات المكافحة الحيوية للنواقل. معظم المتعايشين غير قابلين للزراعة ، ويحتاجون إلى تحليلات ميتاجينومي. نصف طريقة لتشريح إناث البعوض وفصل المبايض والأمعاء الوسطى والغدد اللعابية لمنع التلوث المتبادل ، وتسهيل دراسات الميكروبيوم على مستوى الأعضاء ، وتعزيز فهم أدوار الكائنات الحية الدقيقة في بيولوجيا البعوض.
Abstract
يستمر العبء العالمي للأمراض التي ينتقل عن طريق البعوض، بما في ذلك الملاريا وحمى الضنك وغرب النيل وزيكا وأوسوتو والحمى الصفراء، في الازدياد، مما يشكل تهديدا كبيرا للصحة العمومية. مع ظهور مقاومة المبيدات الحشرية وغياب اللقاحات الفعالة ، تظهر استراتيجيات جديدة تركز على الجراثيم للبعوض. ومع ذلك ، فإن غالبية المتعايشين لا يزالون مقاومين للزراعة. وبالتالي ، فإن توصيف تنوع ووظيفة الجينومات البكتيرية في عينات البعوض يعتمد على علم الميتاجينوميات واستراتيجيات التجميع والتجميع اللاحقة. يمكن أن يوفر استنباط وتحليل الجينومات المجمعة بالميتاجينوم (MAGs) من الأعضاء المنفصلة بشكل ملحوظ معلومات أساسية حول الدور المحدد للميكروبات المرتبطة بالبعوض في المبايض (الأعضاء التناسلية) ، أو الأمعاء الوسطى (مفتاح هضم الطعام والمناعة) ، أو الغدد اللعابية (ضرورية لانتقال الأمراض المنقولة بالنواقل حيث يجب أن تستعمرها مسببات الأمراض لدخول اللعاب والوصول إلى مجرى الدم أثناء وجبة الدم). يمكن لهذه الجينومات المعاد بناؤها حديثا أن تمهد الطريق لتطوير استراتيجيات جديدة للمكافحة الحيوية للنواقل. ولتحقيق هذا الهدف، يلزم عزل أعضاء البعوض مع تجنب التلوث المتبادل بينها أو بالكائنات الحية الدقيقة الموجودة في أعضاء البعوض الأخرى. هنا ، نصف بروتوكول تشريح محسن وخالي من التلوث لدراسة ميكروبيوم البعوض على مستوى الأعضاء.
Introduction
ينشر البعوض مجموعة واسعة من مسببات الأمراض المسببة للأمراض ويشكل تهديدا خطيرا للصحة العامة. نظرا لزيادة انتشار مقاومة المبيدات الحشرية بين مجموعات البعوض وفي غياب لقاحات فعالة ضد هذه مسببات الأمراض ، تظهر طرق جديدة للمكافحة الحيوية تركز على ميكروبيوم البعوض. على وجه الخصوص ، تبرز بكتيريا Wolbachia داخل الخلايا ، والتي يمكن أن تتداخل مع انتقال مسببات الأمراض ومعالجة تكاثر المضيف ،1،2،3. بالإضافة إلى ذلك ، فإن المتعايشين الآخرين مع البعوض أساسيون لبقاء مضيفهم أو تطورهم أو جهازه المناعي ، وكذلك في الإصابة بمسببات الأمراض ونقلها ، ويظهرون وعدا كبيرا باستغلالهم لمكافحة الأمراض المنقولة بالنواقل4،5،6،7،8.
تمتد الكائنات الحية الدقيقة المرتبطة بالبعوض إلى جميع مجالات الحياة الميكروبية (بما في ذلك البكتيريا وحقيقيات النوى والفطريات) التي تتفاعل بشكل وثيق مع مضيفها ولكن أيضا مع بعضها البعض في مقصورات الجسم المختلفة9،10. لذلك ، فإن الفهم الأفضل للميكروبات ، وتنوعها الموسمي المحتمل11 ، والآليات التي يتفاعل بها أعضاؤها مباشرة في أنسجة البعوض المتميزة يمكن أن يساعد في تطوير طرق جديدة مستهدفة للتحكم البيولوجي أو تحسين الطرق الموجودة. ومع ذلك ، لا يزال غالبية المتعايشين يقاومون الزراعة ، مما يجعل توصيفهم مستحيلا.
وقد مكن ظهور طرق التسلسل من الجيل الثاني والثالث، جنبا إلى جنب مع أحدث أساليب التجميع والتجميع، من إعادة بناء الجينومات الميكروبية والوصول إلى التنوع والإمكانيات الوظيفية للميكروبات غير القابلة للزراعة. هنا ، نقدم طريقة لتشريح المبايض والأمعاء الوسطى والغدد اللعابية للإناث مع منع التلوث المتبادل. يمكن أن يتبع هذا البروتوكول استخراج الحمض النووي الجيني والترميز الشريطي اللاحق أو التسلسل الميتاجينومي للبندقية لاستكشاف تنوع ووظيفة ميكروبات البعوض على مستوى الأعضاء. نقدم مثالا على تشريح البعوض وبيانات الميكروبيوم ل Culex spp. عينات على الرغم من أن هذا البروتوكول يمكن أن يمتد إلى نواقل من أجناس أخرى مثل Anopheles أو الزاعجة.
Protocol
ملاحظة: يوضح الشكل 1 مخططا للطريقة يلخص الخطوات المختلفة للبروتوكول.
1. تحضير المواد
- قبل البدء في التجربة ، قم بإعداد محلول مبيض يحتوي على 0.5٪ كلور نشط (موصى به من قبل منظمة الصحة العالمية) لتطهير المعدات وطاولة العمل.
- في 900 مل من الماء ، قم بإذابة ثلاثة أقراص قابلة للذوبان ، يحتوي كل منها على 1.5 غرام من الكلور النشط. انتظر 15 دقيقة حتى تذوب الأقراص تماما ، مما ينتج عنه محلول مبيض بنسبة 0.5٪.
- ضع محلول التبييض بنسبة 0.5٪ في زجاجة رذاذ. بعد ذلك ، رش المحلول على جميع معدات التشريح ، بما في ذلك الشرائح المجهرية وطاولة العمل.
ملاحظة: يجب ترك المعدات وطاولة العمل لتجف لمدة ~ 10 دقائق قبل الاستخدام.
- لشطف البعوض قبل كل تشريح لمنع تلوث العينات بالبكتيريا الخارجية ، قم بإعداد أربعة أنابيب معقمة حديثا سعة 1.5 مل: اثنان يحتويان على 96٪ من الإيثانول واثنان آخران يحتويان على 1x PBS (محلول ملحي مخزن بالفوسفات).
- قم بإعداد الأنابيب لتخزين العينات بعد تشريح كل بعوضة: أربعة أنابيب معقمة سعة 1.5 مل ، يحتوي كل منها على 100 ميكرولتر من المخزن المؤقت للحفظ.
ملاحظة: قم بإعداد أنبوب واحد للغدد اللعابية ، وواحد للمبيضين ، وواحد للأمعاء الوسطى ، وواحد لجثة البعوض.
2. جمع البعوض
- اجمع واحتفظ بالأفراد البالغات على قيد الحياة (من الحقل أو المختبر ، 4-7 أيام) حتى التعقيم السطحي.
3. التعقيم السطحي للبعوض
ملاحظة: نظف الملقط والإبر واستخدم أنابيب جديدة ومعقمة بين كل عضو وفرد. إذا لم يكن المبيض متاحا ، فتأكد من تعقيم الملقط والإبر التشريح باللهب تماما بين تشريح كل فرد وعضو لمنع التلوث المتبادل للمواد البيولوجية. يجب أن تكون أدوات التشريح جافة ، بدون أي بقايا مبيض / إيثانول ، قبل الاستخدام التالي.
- لتجنب إفراغ الإناث لمحتوى أمعائها عند تعرضها للكحول ، قم بتخديرها على الثلج أو في الفريزر عند -20 درجة مئوية (لمدة 4 دقائق حتى لا تتجمد الأنسجة والأعضاء).
- انقل البعوض الفردي إلى أنبوب جديد معقم سعة 1.5 مل يحتوي على 1 مل من الإيثانول بنسبة 96٪. دوامة برفق (يدويا) لمدة 30 ثانية (هز البعوض جيدا في الأنبوب لفصل القشور والملوثات البكتيرية المحتملة على سطح الحشرات). اشطف مرتين باستخدام أنابيب تحتوي على الإيثانول.
- انقل البعوض إلى أنبوب جديد معقم سعة 1.5 مل مع 1 مل من محلول PBS المعقم 1x والدوامة برفق (يدويا) لمدة 30 ثانية (لتجنب ترسيب الحمض النووي بالإيثانول). اشطف مرتين باستخدام أنابيب تحتوي على 1x PBS معقمة.
4. تشريح البعوض
- ضع عدة قطرات صغيرة من 1x PBS المعقمة على الشريحة لتسهيل وضع البعوض وشطف الأعضاء المقطعة.
ملاحظة: يجب أن تكون قطرات PBS المعقمة كبيرة بما يكفي لاستيعاب أعضاء البعوض. - خذ البعوض الذي تم تنظيفه وضعه على قطرة من 1x PBS المعقم على شريحة المجهر.
- قم بتشريح الغدد اللعابية باستخدام ملقط وإبرة معقمة كما هو موضح أدناه.
- أمسك صدر البعوض بالملاقط لمنعه من الحركة. ثم ضع إبرة في الرقبة ، أسفل الرأس ، واسحب رأس البعوضة برفق لفصله عن الصدر.
ملاحظة: تقع الغدد اللعابية في الجزء العلوي من الصدر وتتصل بالرأس بواسطة القناة اللعابية. أثناء التشريح ، من الضروري عدم كسر هذه القناة لأن الغدد اللعابية لن تأتي مع الرأس عند سحبها من الصدر. هذا هو السبب في أنه من المهم أن يكون لديك بعوضة طازجة ، وليس بعوضة مجمدة. - عندما ينفصل الرأس عن الصدر ، لاحظ ظهور غدتين لعابتين ، تتكون كل منهما من ثلاثة فصوص. قم بقطع الغدد اللعابية على مستوى القناة اللعابية ، واسترجعها بإبرة ، وضعها في قطرة جديدة من 1x PBS المعقمة لشطفها ومنع التلوث بين الأعضاء.
- استرجع الغدد اللعابية باستخدام إبرة وضعها في أنبوب معقم جديد يحتوي على 100 ميكرولتر من محلول الحفظ.
- أمسك صدر البعوض بالملاقط لمنعه من الحركة. ثم ضع إبرة في الرقبة ، أسفل الرأس ، واسحب رأس البعوضة برفق لفصله عن الصدر.
- تشريح المبايض باستخدام ملقط وإبرة معقمة على النحو التالي.
- ضع البعوض على ظهره. باستخدام الملقط لتثبيت البعوضة من الصدر لمنع الحركة أثناء التشريح ، قم بثقب الجزء البطني الثالث (بدءا من الأسفل) بإبرة.
ملاحظة: اختياريا ، قم بإزالة أرجل وأجنحة البعوض لتسهيل التشريح. - أثناء ثقب الجزء الثالث من البطن ، اسحب البطن لأسفل لفتحه والكشف عن الأعضاء الداخلية. قم بإزالة أي قطع متبقية من الهيكل الخارجي للبعوض لتسهيل إطلاق الأعضاء.
ملاحظة: تظهر الأعضاء الموجودة في البطن مثل الأمعاء والأنابيب المالبيغي والمبيضين. - استرجع كلا المبيضين باستخدام ملقط معقم وضعهما في قطرة جديدة من 1x PBS المعقم على شريحة المجهر لشطفهما. أمسك المبايض وضعها في أنبوب 1.5 مل مع 100 ميكرولتر من المخزن المؤقت للحفظ.
- ضع البعوض على ظهره. باستخدام الملقط لتثبيت البعوضة من الصدر لمنع الحركة أثناء التشريح ، قم بثقب الجزء البطني الثالث (بدءا من الأسفل) بإبرة.
- الآن بعد أن أصبح البطن مفتوحا وانكشفت الأعضاء ، استرجع المعى المتوسط باستخدام ملقط و / أو إبرة معقمة جديدة.
- افصل المعى المتوسط عن الأمعاء الأمامية والأمعاء الخلفية. ثم قم بإزالة الأنابيب Malpighian من الأمعاء الوسطى. أمسك الأمعاء الوسطى باستخدام إبرة معقمة وضعها على قطرة معقمة جديدة 1x PBS لشطفها ومنع التلوث بين الأعضاء.
- انقله إلى قطرة معقمة جديدة 1x PBS. افتح الأمعاء الوسطى بالملقط لتحرير البكتيريا وإثرائها كما هو موضح في الملف التكميلي 1. أمسك الأمعاء الوسطى بالملقط والماصة جميع البكتيريا التي تحتوي على PBS لتخزين المادة بأكملها (السائل والأنسجة) في أنبوب جديد معقم سعة 1.5 مل مع 100 ميكرولتر من المخزن المؤقت للحفظ.
- أضف مرة أخرى 5 ميكرولتر من 1x PBS على المكان المستخدم سابقا في شريحة المجهر وقم بإعادة الماصة مباشرة إلى نفس الأنبوب سعة 1.5 مل لاسترداد البكتيريا التي ربما تكون عالقة بشريحة المجهر.
- استخدم ملقطا معقما للإمساك بالذبيحة (الجسم المتبقي) وتخزينها في أنبوب جديد معقم سعة 1.5 مل مع 100 ميكرولتر من المخزن المؤقت للحفظ.
- تخزين المواد حتى مزيد من المعالجة
- قم بتسمية الأنابيب التي تحمل "الأنواع ، العضو ، التاريخ ، اسم الباحث".
- قم بتخزين المبايض المقطعة والأمعاء الوسطى والغدد اللعابية والذبيحة عند -20 درجة مئوية حتى المعالجة.
- تتبع في جدول بيانات لجميع البيانات الوصفية المرتبطة بالعينات ، بما في ذلك الأنواع (أو مستوى الجنس فقط) ، وتاريخ التجميع ، والبلد ، والمقاطعة ، وخط العرض ، وخط الطول ، واسم الشخص الذي أجرى التشريح ، أو أنثى حاملة أم لا ، أو وجبة دم أم لا.
النتائج
x'تشريح البعوض
باتباع البروتوكول ، قمنا بجمع وعزل المبايض والأمعاء الوسطى والغدد اللعابية والذبيحة من عينتين من Culex pipiens molestus (بما في ذلك أنثى حاملة) من مستعمرة مختبرية. أكدنا التشريح النظيف بعد ملاحظة الأعضاء الكاملة (أي غير المكسورة) والمعزولة جيدا مع عدم وجود حطام متبقي تحت المجهر. يظهر الجسم كله والرأس والصدر والغدد اللعابية المشححة والمبيض والأمعاء الوسطى لعينة Culex pipiens molestus في الشكل 2. كما هو متوقع ، كانت الأمعاء الوسطى والغدد اللعابية أصغر من مبيض البعوض. يتم عرض بيض عينة Culex الحاملة ، جنبا إلى جنب مع أنابيب الأمعاء الوسطى والمالبيغيان ، في الشكل 3. وتجدر الإشارة إلى أن التشريح يكون أكثر عرضة للفشل عندما لا تكون المادة طازجة ومن المحتمل أن تنكسر الأنسجة (الشكل 4 ب ، ج). لذلك نقترح تشريح المواد مباشرة بعد التجميع (في أقل من 12 ساعة) عندما يكون ذلك ممكنا لأن الأنسجة لا تزال مرنة (الشكل 4 أ). وبالمثل ، يمكن إجراء تشريح المواد المجمدة ولكن هناك خطر أكبر بكثير من الفشل والتلوث المتبادل بين الأعضاء بسبب الأنسجة الهشة (الشكل 4).
بيانات الميكروبيوم
بالإضافة إلى ذلك ، قمنا بجمع وفصل الأمعاء الوسطى والمبيضين من ثلاث عينات فردية من Culex quinquefasciatus من نوميا ، كاليدونيا الجديدة ، باتباع نفس الإجراء. استخرجنا الحمض النووي من كل عضو ، وأعدنا عينات لتسلسل الجينوم الكامل ، وأجرينا تحليلات بيانات الميكروبيوم كما هو مفصل في الملف التكميلي 1. أظهر تحليل التنوع التصنيفي البكتيري على القراءات القصيرة غير المجمعة التي تمت تصفيتها بالجودة باستخدام PhyloFlash12 أصنافا سائدة مميزة في الأمعاء الوسطى مقارنة بالمبايض (الشكل 5 أ). والجدير بالذكر أن مجتمعات بكتيريا المبيض سيطرت عليها Wolbachia ، مع وجود إضافي لنمط النشوء Spirochaetaceae في مبيض الفرد 3 ، بينما أظهرت مجتمعات الأمعاء الوسطى تنوعا أوسع ، بما في ذلك Gammaproteobacteria و Spirochaetaceae و Firmicutes. من نفس بيانات التسلسل ، قمنا بإعادة بناء أربعة جينومات مجمعة من الميتاجينوم (MAGs) مع اكتمال > 80٪ والتكرار < 5٪ ، والتي تنتمي إلى فئات Spirochaetia و Alpha- و Gammaproteobacteria (الجدول 1).
كما هو متوقع ، لم تغطي MAGs المعاد بناؤها هنا التنوع التصنيفي الكامل الذي تنبأت به نتائج PhyloFlash بسبب أوجه القصور المحددة في إعادة بناء الجينوم باستخدام قراءات ميتاجينومية قصيرة. تم اكتشاف MAG المخصص ل Wolbachia (المرجع MAG 3 في الجدول 1) في جميع المبايض واثنين من الأمعاء الوسطى وكان له تغطية أعلى في المبايض (الشكل 5 ب). قمنا أيضا بإعادة بناء اثنين من MAGs ينتميان إلى عائلة Enterobacteriaceae ، بما في ذلك جنس Pantoea (المرجع MAG 1 و 2 في الجدول 1) ، في الأمعاء الوسطى التي تم الحصول عليها من أفراد Culex 2 و 3 ، والتي لم يتم اكتشافها في المبايض المقابلة (الشكل 5 ب). أخيرا ، قمنا أيضا بإعادة بناء جينوم بكتيري Spirochaetaceae واحد ، المرجع MAG 4 (الجدول 1) ، تم تعيينه للجنس BR149 الذي تم عزله بنجاح من Culex pipiens midguts بواسطة Graña-Miragliaوزملاؤه 13. ومن المثير للاهتمام ، أنه تم اكتشاف هذا MAG في الأمعاء الوسطى للأفراد 1 و 3 ، وكذلك في مبيض الفرد 3 (الشكل 5 ب).
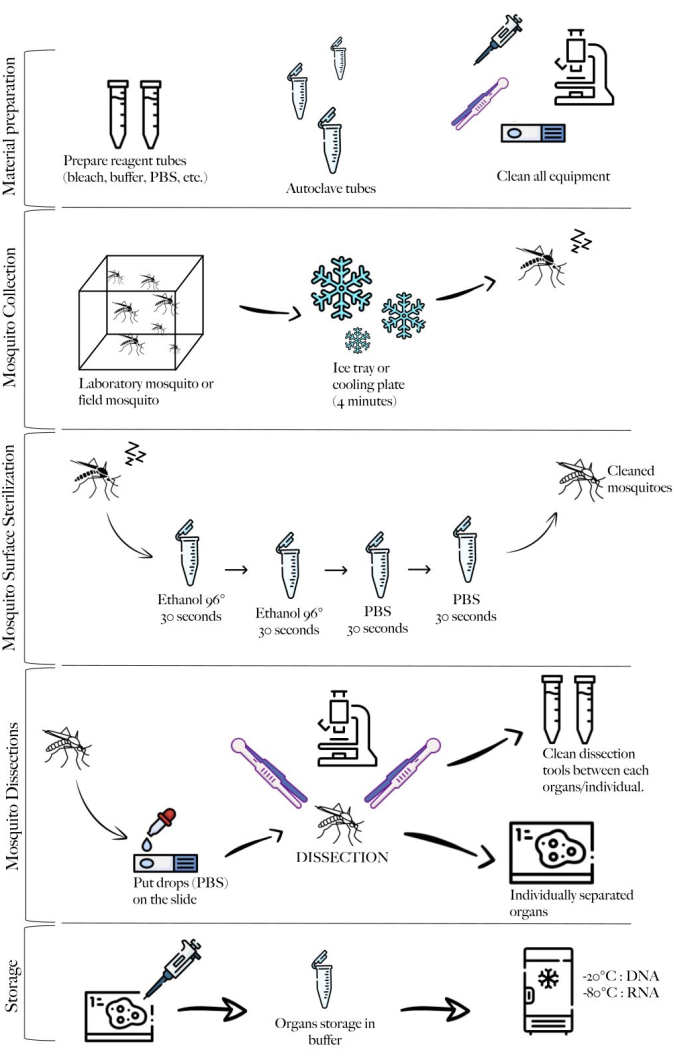
الشكل 1: تخطيطي للطريقة تلخص الخطوات المختلفة. تحضير المواد ، وجمع البعوض ، وتنظيف البعوض ، وتشريح البعوض ، والتخزين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
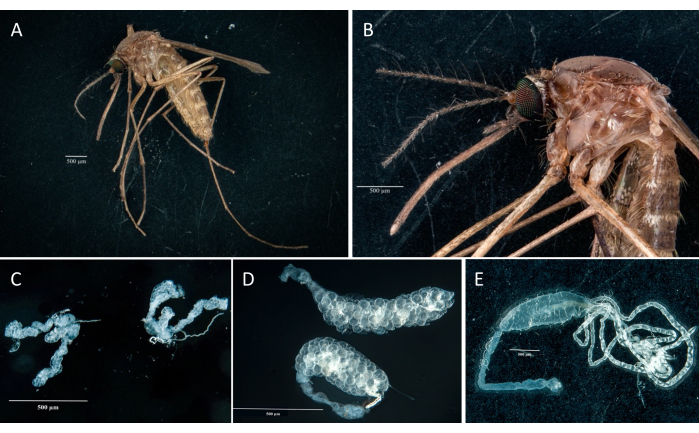
الشكل 2: Culex pipiens molestus أنثى. (أ) الجسم كله. (ب) الرأس والصدر. (ج) تشريح الغدد اللعابية. (د) تشريح المبايض. (ه) تشريح الأمعاء باستخدام أنابيب Malpighi. أشرطة المقياس = 500 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
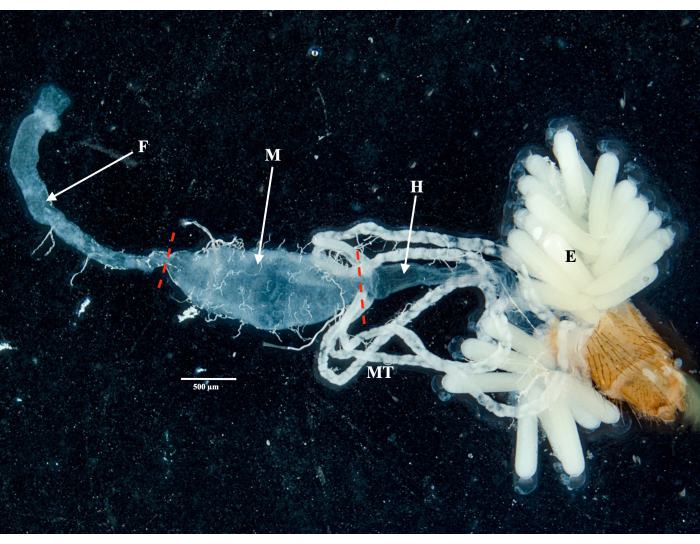
الشكل 3: تشريح البطن لأنثى Culex pipiens molestus الحاملة. يتم عرض الأمعاء الأمامية ، والأمعاء الوسطى ، والأمعاء الخلفية ، والأنابيب Malpighian ، وبيض العينة. تشير الشرطات الحمراء إلى مكان القطع لفصل المعى المتوسط عن الأمعاء الأمامية والأمعاء الخلفية. شريط المقياس = 500 ميكرومتر. الاختصارات: F = المعى الأمامي. م = الأمعاء الوسطى. ح = المعى الخلفي. ه = البيض. MT = أنابيب Malpighian. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
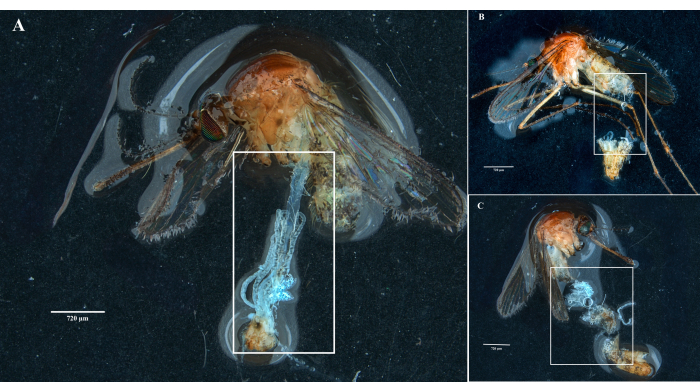
الشكل 4: تشريح عينات بعوض كوليكس الطازجة والمجمدة. توضح المستطيلات البيضاء (أ) أنسجة البعوض ذات الأعضاء السليمة من عينة تشريح حديثا و (ب ، ج) مادة بيولوجية مكسورة من العينات التي تم تجميدها قبل التشريح. أشرطة المقياس = 720 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
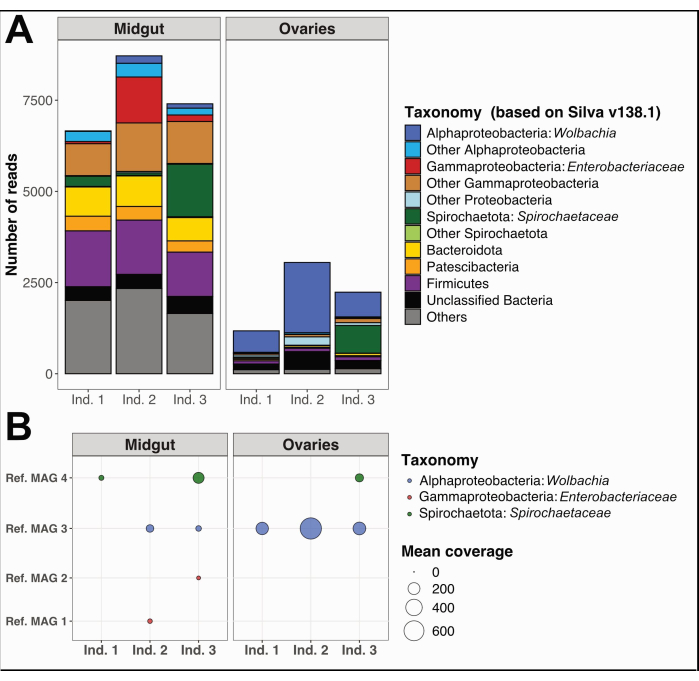
الشكل 5: مثال على تحليل الميكروبيوم على ثلاثة أفراد Culex quinquefasciatus . (أ) تصور التنوع البكتيري المقدر من خلال استخراج SSU rRNA يقرأ باستخدام PhyloFlash12 في الأمعاء الوسطى والمبايض للعينات الثلاث. (ب) متوسط تغطية MAGs المعاد بناؤها على العينات. الاختصارات: MAG = الجينوم المجمع بالميتاجين. الهند = الفرد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مجلة | المرجع MAG 4 | المرجع MAG 2 | المرجع MAG 1 | المرجع MAG 3 |
| الطول (bp) | 1,287,790 | 4,910,866 | 4,751,276 | 1,298,266 |
| عدد contigs | 9 | 162 | 149 | 123 |
| GC ٪ | 34.05 | 55.45 | 54.05 | 34.15 |
| الإنجاز (٪) | 84.5 | 97.18 | 98.59 | 91.55 |
| التكرار (٪) | 0 | 2.82 | 4.22 | 0 |
| المجال | بكتيريا | بكتيريا | بكتيريا | بكتيريا |
| شعبة | سبيروشايتوتا | البكتيريا البروتينية | البكتيريا البروتينية | البكتيريا البروتينية |
| فصل | سبيروشيتيا | Gammaproteobacteria | Gammaproteobacteria | ألفا بروتيوبكتيريا |
| ترتيب | WRBN01 | البكتيريا المعوية | البكتيريا المعوية | ريكتسياليس |
| أسرة | WRBN01 | البكتيريا المعوية | البكتيريا المعوية | أنابلازماتاسيا |
| جنس | BR149 | بانتويا | - | ولباخيا |
الجدول 1: MAGs المعاد بناؤها من أفراد Culex quinquefasciatus الثلاثة. حجم الجينوم ، وعدد contigs ، ونسبة GC ، وتقديرات الاكتمال ، والتكرار بناء على مجموعة الجينات الأساسية أحادية النسخة المتوفرة في Anvi'o17 والتصنيف الذي تم الحصول عليه باستخدام GTDB18.
الملف التكميلي 1: مثال تفصيلي لإجراء تحليل بيانات الميكروبيوم بدءا من جمع العينات واستخراج الحمض النووي وتسلسل الجينوم الكامل متبوعا بسير عمل المعلوماتية الحيوية لإعادة بناء الجينوم وتقدير نسبة القراءة بدائية النواة وحقيقية النواة الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
نوصي بإيلاء اهتمام خاص لتسلسل تسلخ الأعضاء ، بدءا من الغدد اللعابية. في الواقع ، لاحظنا أنه تم استخراجها بسهولة أكبر من الصدر لعينات Culex إذا تم الحفاظ على سلامة البعوض. يمكن أن يؤدي تلف البطن أو الصدر إلى تقليل الضغط في جسم البعوض ، مما يعيق الإجراء. ومع ذلك ، من الممكن أيضا القطع بين الصدر والبطن ثم سحب الغدد اللعابية من الرأس والصدر (AB Failloux ، التواصل الشخصي). بالإضافة إلى ذلك ، قد يكون اكتساب مهارات تشريح بارعة أمرا صعبا ، لذلك نقترح التدرب على عدد كاف من العينات قبل التجربة.
يعد عزل أعضاء البعوض مع تجنب التلوث المتبادل بطريقة منهجية أمرا بالغ الأهمية لمجموعة واسعة من تحليلات الجراثيم للبعوض في اتجاه مجرى النهر. سمحت دراسة ميتاجينومية تم حلها بواسطة الجينوم بعد تشريح المبايض المفردة من عينات Culex pipiens في جنوب فرنسا باكتشاف أول بلازميد من Wolbachia في Culex pipiens (pWCP14). باستخدام نهج مماثل ، قمنا بالتحقيق في توزيع وتواتر pWCP في عينات Culex pipiens و Culex quinquefasciatus من كل من المناطق القارية والجزرية في جميع أنحاء العالم ، عبر مختلف الظروف البيئية والمختبرية. بشكل عام ، كشفت البيانات عن عنصر بلازميد Wolbachia محفوظ بشكل ملحوظ في بعوض Culex ، مما يشير إلى دور حاسم لهذا العنصر المتحرك في بيولوجيا التعايشالداخلي 15 ، مما يستدعي مزيدا من التحليل.
هنا ، نقدم أمثلة إضافية لتحليلات ميكروبيوم البعوض على عينات الأمعاء الوسطى والمبيض التي تم الحصول عليها باستخدام هذا الإجراء المنهجي. لاحظنا اختلافا واضحا في الجراثيم بين الأنسجة (الشكل 5) ، مع كل من الأصناف البكتيرية المشتركة والخاصة بالأعضاء. كما هو متوقع ، تم الكشف عن وجود Wolbachia في كلا العضوين ، مع وفرة نسبية أعلى (بناء على قراءات قصيرة غير مجمعة) وتغطية متوسطة ل MAGs في مبيض البعوض مقارنة بالأمعاء الوسطى ، بما يتفق مع ملاحظة أن هذا التعايش الداخلي ينتقل عبر المبايض وينتشر لاحقا إلى الأنسجة الجسدية. على الرغم من أن هذه الدراسة اقتصرت على عينات من كاليدونيا الجديدة ، إلا أن هذا البروتوكول قد يسهل التحقيق في التباين الجيني ل Wolbachia على نطاق عالمي ، فضلا عن دوره في الأنماط الظاهرية المختلفة ، بما في ذلك تنظيم الكثافة لنفسه والحماية الفيروسية. علاوة على ذلك ، يوضح هذا العمل كيف يسمح إجراء التشريح المقدم هنا بفحص التنوع التصنيفي والقدرات الوظيفية المحتملة للمتعايش مع البعوض داخل عينات الأمعاء الوسطى.
حصلنا على جينومين من البكتيريا المعوية كانا موجودين فقط في عينتين من الأمعاء الوسطى ، مما يؤكد عدم وجود تلوث بين الأعضاء لهاتين العينتين. فيما يتعلق باللولبيات ، التي تم اكتشافها في كل من الأمعاء الوسطى والمبيض للفرد 3 ، لاحظ جمعة وزملاؤه ، 2020 وجود هذه البكتيريا على سطح طوافات البيض. اقترح المؤلفون أن المجتمعات البكتيرية الموجودة في طوافات البيض قد تكون موروثة من الأم في المقام الأول من المبايض ، بالنظر إلى أن طوافات البيض كانت محفوظة في ماء منزوع الأيونات وخالي من البكتيريا. ومع ذلك ، لم يتمكنوا من استبعاد إمكانية حدوث استعمار بكتيري بعد وضع البيض مباشرة وأوصوا بمزيد من الدراسة على ميكروبيوم المبيض16.
بينما تم تصميمه في البداية لعينات من مجمع أنواع Culex pipiens ، فإننا نتوقع قابلية تطبيق هذا البروتوكول على مجتمع أوسع من علماء الحشرات الطبية الذين يدرسون نواقل أخرى مثل Anopheles أو Aedes. من خلال العمل على مستوى الأعضاء الفردية ، قد تتيح هذه الطريقة إجراء مقارنات جينومية داخل وبين الأفراد ، مما يوفر رؤى حول التباين الجينومي المتعايش على نطاق دقيق ، مع إمكانية تطوير استراتيجيات مكافحة النواقل. يمكن أن تكون طريقة تشريح وعزل الغدد اللعابية والمبيض والأمعاء الوسطى ، مما يمنع التلوث الميكروبي المتبادل ، بروتوكولا مفيدا لدراسات ديناميكيات العدوى الفيروسية داخل هذه الأعضاء الثلاثة.
Disclosures
ويعلن أصحاب البلاغ أنه ليس لديهم تضارب في المصالح.
Acknowledgements
نشكر جيلبرت ليجوف على تعليم جوردان توتاغاتا كيفية تشريح الغدد اللعابية من البعوض وجوليانو موتشي للمساعدة في التقاط صور لأعضاء البعوض. نشكر Anna-Bella Failloux و Nonito Pages على المناقشة المفيدة حول البروتوكول. تم دعم هذا العمل من قبل ERC RosaLind منحة البداية "948135" إلى JR. نشكر منصة Vectopole (IRD ، مونبلييه) على تقديم الدعم الفني وتربية وصيانة مجموعات البعوض.
Materials
| Name | Company | Catalog Number | Comments |
| Alcohol 96° | Fisher scientific | 10332562 | |
| Binocular magnifier | |||
| Bleach | RAJA | 145517 | 150 tablets of 1.5 g |
| DNA prep kit | Illumina | Provided by MGX sequencing platform | Previously known as Nextera DNA Flex |
| DNA-RNA Shield (50 mL) | Zymo research | ZR1100-50 | Preservation buffer |
| DNeasy Blood and Tissue Kit | Qiagen | 69504 | DNA extraction kit |
| Filter tips 20 µL | Starlab | S1120-3810 | |
| Filter tips 200 µL | Starlab | S1120-8710 | |
| Filter tips 1000 µL | Starlab | S1122-1730-C | |
| Forceps | FST (Fine Science Tools) | 11252-20 | Dumont Forceps #5 |
| Library quantification kit | Roche | Provided by MGX sequencing platform | KAPA Library Quanitification Kits |
| Micropipettes 2-20 µL | Eppendorf | 6.291704 | |
| Micropipettes 20-200 µL | Eppendorf | 6.291703 | |
| Micropipettes 100-1000 µL | Eppendorf | 7.648488 | |
| Microscope slides | Epredia | J1800BMNZ | dimension : 75 mm x 50 mm |
| Needles | Terumo | AN*2719R1 | |
| NGS kit | Agilent | Provided by MGX sequencing platform | Fragment Analyzer Systems HS Genomic DNA 50kb Kit |
| NovaSeq 6000 | Illumina | Provided by MGX sequencing platform | Sequencer |
| PBS Phosphate Buffered Saline (Sterile) | Fisher scientific | 10212990 | |
| Permanent black marker | |||
| Sterile Eppendorf | Dutscher | 33871 | 1.5 mL |
| Support for needles | FST (Fine Science Tools) | 26016-12 | Moria MC1 Pin Holder 12 cm |
References
- Achee, N. L., et al. Alternative strategies for mosquito-borne arbovirus control. PLOS Negl Trop Dis. 13 (1), e0006822 (2019).
- Hoffmann, A. A., et al. Successful establishment of Wolbachia in Aedes populations to suppress dengue transmission. Nature. 476 (7361), 454-457 (2011).
- Porter, J., Sullivan, W. The cellular lives of Wolbachia. Nat Rev Microbiol. 21 (11), 750-766 (2023).
- Coon, K. L., Brown, M. R., Strand, M. R. Mosquitoes host communities of bacteria that are essential for development but vary greatly between local habitats. Mol Ecol. 25 (22), 5806-5826 (2016).
- Didion, E. M., et al. Microbiome reduction prevents lipid accumulation during early diapause in the northern house mosquito, Culex pipiens pipiens. J Insect Physiol. 134, 104295 (2021).
- Gabrieli, P., et al. Mosquito trilogy: Microbiota, immunity and pathogens, and their implications for the control of disease transmission. Front Microbiol. 12, 630438 (2021).
- Garrigós, M., Garrido, M., Panisse, G., Veiga, J., Martínez-de La Puente, J. Interactions between West Nile Virus and the microbiota of Culex pipiens vectors: A literature review. Pathogens. 12 (11), 1287 (2023).
- Zheng, R., et al. Holobiont perspectives on tripartite interactions among microbiota, mosquitoes, and pathogens. ISME J. 17 (8), 1143-1152 (2023).
- Flores, G. A. M., et al. Wolbachia dominance influences the Culex quinquefasciatus microbiota. Sci Rep. 13 (1), 18980 (2023).
- Hegde, S., et al. Interkingdom interactions shape the fungal microbiome of mosquitoes. Anim Microbiome. 6 (1), 11 (2024).
- Suo, P., et al. Seasonal variation of midgut bacterial diversity in Culex quinquefasciatus populations in Haikou city, Hainan province, China. Biology. 11 (8), 1166 (2022).
- Gruber-Vodicka, H. R., Seah, B. K. B., Pruesse, E. phyloFlash: Rapid small-subunit rRNA profiling and targeted assembly from metagenomes. mSystems. 5 (5), e00920-e00920 (2020).
- Graña-Miraglia, L., et al. Spirochetes isolated from arthropods constitute a novel genus Entomospira genus novum within the order Spirochaetales. Sci Rep. 10 (1), 17053 (2020).
- Reveillaud, J., et al. The Wolbachia mobilome in Culex pipiens includes a putative plasmid. Nat Commun. 10 (1), 1051 (2019).
- Ghousein, A., et al. pWCP is a widely distributed and highly conserved Wolbachia plasmid in Culex pipiens and Culex quinquefasciatus mosquitoes worldwide. ISME Commun. 3 (1), 40 (2023).
- Juma, E. O., Kim, C. -. H., Dunlap, C., Allan, B. F., Stone, C. M. Culex pipiens and Culex restuans egg rafts harbor diverse bacterial communities compared to their midgut tissues. Parasit Vectors. 13 (1), 532 (2020).
- Lee, M. D. GToTree: a user-friendly workflow for phylogenomics. Bioinformatics. 35 (20), 4162-4164 (2019).
- Parks, D. H., et al. A complete domain-to-species taxonomy for bacteria and Archaea. Nat Biotechnology. 38 (9), 1079-1086 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved