Method Article
Вскрытие яичников, средней кишки и слюнных желез комаров для анализа микробиома на уровне органов
В этой статье
Резюме
Микробные сообщества комаров имеют большие перспективы для стратегий биоконтроля переносчиков. Большинство симбионтов не поддаются культивированию, требуя метагеномного анализа. Мы описываем метод препарирования самок комаров и разделения яичников, средней кишки и слюнных желез, предотвращая перекрестное загрязнение, облегчая изучение микробиома на уровне органов и улучшая понимание роли микроорганизмов в биологии комаров.
Аннотация
Глобальное бремя болезней, передаваемых комарами, включая малярию, денге, лихорадку Западного Нила, Зика, Усуту и желтую лихорадку, продолжает расти, представляя значительную угрозу общественному здравоохранению. С ростом устойчивости к инсектицидам и отсутствием эффективных вакцин появляются новые стратегии, ориентированные на микробиоту комаров. Тем не менее, большинство симбионтов остаются устойчивыми к культивированию. Таким образом, характеристика разнообразия и функций бактериальных геномов в образцах комаров опирается на метагеномику и последующие стратегии сборки и биннинга. Сбор и анализ собранных с помощью метагенома геномов (МАГ) из отделенных органов может, в частности, получить ключевую информацию о специфической роли микробов, ассоциированных с комарами, в яичниках (репродуктивных органах), средней кишке (ключ к перевариванию пищи и иммунитету) или слюнных железах (что необходимо для передачи трансмиссивных заболеваний, поскольку патогены должны колонизировать их, чтобы попасть в слюну и попасть в кровоток во время приема крови). Эти недавно реконструированные геномы могут затем проложить путь для разработки новых стратегий биоконтроля векторов. Для этого необходимо изолировать органы комара, избегая при этом перекрестного загрязнения между ними или микроорганизмами, присутствующими в других органах комара. В этой статье мы описываем оптимизированный и не вызывающий загрязнения протокол вскрытия для изучения микробиома комаров на уровне органов.
Введение
Комары распространяют широкий спектр патогенных микроорганизмов, вызывающих заболевания, и представляют серьезную угрозу для здоровья населения. В связи с возросшей распространенностью устойчивости к инсектицидам среди популяций комаров и в отсутствие эффективных вакцин против этих патогенов появляются новые методы биоконтроля, ориентированные на микробиом комаров. В частности, выделяется внутриклеточная бактерия Wolbachia, которая может препятствовать передаче патогена и манипулировать репродукцией хозяина 1,2,3. Кроме того, другие симбионты комаров играют центральную роль в выживании, развитии или иммунной системе своего хозяина, а также в инфицировании и передаче патогенов, и демонстрируют большие перспективы для их использования в борьбе с трансмиссивными болезнями 4,5,6,7,8.
Микроорганизмы, ассоциированные с комарами, охватывают все области микробной жизни (включая бактерии, эукариоты и грибы), которые тесно взаимодействуют со своим хозяином, а также друг с другом в различных отсеках тела 9,10. Таким образом, более глубокое понимание микробиоты, ее потенциальныхсезонных колебаний и механизмов, с помощью которых ее члены непосредственно взаимодействуют в отдельных тканях комаров, может помочь в разработке новых целевых методов биоконтроля или совершенствовании существующих. Тем не менее, большинство симбионтов остаются устойчивыми к культивированию, что делает невозможным их характеристику.
Появление методов секвенирования второго и третьего поколений в сочетании с современными подходами к сборке и биннингу позволило реконструировать микробные геномы и получить доступ к разнообразию и функциональному потенциалу микробов, не поддающихся культивированию. В этой статье мы представляем метод вскрытия яичников, средней кишки и слюнных желез самок комаров с предотвращением перекрестного заражения. За этим протоколом может последовать экстракция геномной ДНК и последующее метабаркодирование или метагеномное секвенирование дробовика для изучения разнообразия и функций микробиоты комаров на уровне органов. Мы приводим пример вскрытия комаров и данные о микробиоме для образцов Culex spp., хотя этот протокол может быть распространен на переносчиков других родов, таких как Anopheles или Aedes.
протокол
ПРИМЕЧАНИЕ: На рисунке 1 показана схема метода, обобщающая различные этапы протокола.
1. Подготовка материала
- Перед началом эксперимента приготовьте раствор хлорной извести с 0,5% активного хлора (рекомендовано Всемирной организацией здравоохранения) для дезинфекции оборудования и верстака.
- В 900 мл воды растворить три растворимые таблетки, каждая из которых содержит 1,5 г активного хлора. Подождите 15 минут, пока таблетки полностью растворятся, в результате чего получится 0,5% раствор отбеливателя.
- Поместите 0,5% раствор отбеливателя в пульверизатор. Затем распылите раствор на все оборудование для препарирования, включая микроскопические предметные стекла и верстак.
ПРИМЕЧАНИЕ: Оборудование и верстак следует оставить сохнуть в течение ~10 минут перед использованием.
- Для промывания комаров перед каждым вскрытием с целью предотвращения заражения образцов внешними бактериями подготовьте четыре только что стерилизованные пробирки объемом 1,5 мл: две из них содержат 96% этанола и две другие содержат 1x PBS буфер (фосфатно-солевой буфер).
- Подготовьте пробирки для хранения образцов после вскрытия каждого комара: четыре стерильные пробирки объемом 1,5 мл, каждая из которых содержит 100 мкл консервационного буфера.
ПРИМЕЧАНИЕ: Подготовьте одну трубку для слюнных желез, одну для яичников, одну для средней кишки и одну для тушки комара.
2. Коллекция комаров
- Собирают и хранят взрослых особей женского пола живыми (в полевых условиях или в лаборатории, 4-7 дней) до поверхностной стерилизации.
3. Поверхностная стерилизация комаров
ПРИМЕЧАНИЕ: Очистите щипцы и иглы и используйте новые, стерилизованные трубки между каждым органом и человеком. Если отбеливатель недоступен, обязательно тщательно простерилизуйте щипцы и иглы между вскрытием каждого человека и органа, чтобы предотвратить перекрестное загрязнение биологического материала. Инструменты для препарирования должны быть сухими, без остатков отбеливателя/этанола перед следующим использованием.
- Чтобы избежать опорожнения содержимого кишечника самок при воздействии алкоголя, охладите их обезболиванием на льду или в морозильной камере при температуре -20 °C (в течение 4 минут, чтобы ткани и органы не замерзли).
- Перенесите отдельных комаров в новую стерилизованную пробирку объемом 1,5 мл с 1 мл 96% этанола. Осторожно (вручную) встряхните комара в трубке, чтобы отделить чешуйки и потенциальные бактериальные загрязнители на поверхности насекомых). Дважды промойте с помощью тюбиков, содержащих этанол.
- Перенесите комара в новую стерилизованную пробирку объемом 1,5 мл с 1 мл стерильного раствора 1x PBS и осторожно (вручную) сделайте вихрь в течение 30 с (во избежание осаждения ДНК этанолом). Дважды прополоскать пробирками, содержащими стерильный 1x PBS.
4. Вскрытие комаров
- Поместите несколько небольших капель стерильного 1x PBS на предметное стекло, чтобы облегчить размещение комара и промывание вскрытых органов.
ПРИМЕЧАНИЕ: Капли стерильного PBS должны быть достаточно большими, чтобы вместить органы комара. - Возьмите очищенный комар и положите его на каплю стерильного 1x PBS на предметном стекле микроскопа.
- Рассеките слюнные железы стерилизованными щипцами и иглой, как описано ниже.
- Держите грудную клетку комара пинцетом, чтобы он не двигался. Затем поместите иглу на шею, ниже головы, и осторожно потяните за голову комара, чтобы отделить ее от грудной клетки.
ПРИМЕЧАНИЕ: Слюнные железы расположены в верхней части грудной клетки и соединены с головой слюноотдельным протоком. Во время рассечения очень важно не сломать этот проток, так как слюнные железы не будут попадать вместе с головкой, когда вы вытягиваете ее из грудной клетки. Вот почему важно иметь свежего комара, а не замороженного. - Когда голова отделяется от грудной клетки, обратите внимание на появление двух слюнных желез, каждая из которых состоит из трех долей. Разрежьте слюнные железы на уровне слюнных протоков, извлеките их иглой и поместите в новую каплю стерильного 1x PBS для промывки и предотвращения межорганных загрязнений.
- Извлеките слюнные железы с помощью иглы и поместите их в новую стерилизованную пробирку, содержащую 100 μл консервационного буфера.
- Держите грудную клетку комара пинцетом, чтобы он не двигался. Затем поместите иглу на шею, ниже головы, и осторожно потяните за голову комара, чтобы отделить ее от грудной клетки.
- Рассекайте яичники стерилизованными щипцами и иглой следующим образом.
- Положите комара ему на спину. С помощью щипцов удерживать комара за грудную клетку, чтобы предотвратить движение во время вскрытия, проколоть иглой третий брюшной сегмент (начиная снизу).
ПРИМЕЧАНИЕ: По желанию удалите ноги и крылья комара, чтобы облегчить вскрытие. - Прокалывая третий брюшной сегмент, потяните вниз живот, чтобы раскрыть его и обнажить внутренние органы. Удалите все оставшиеся части экзоскелета комара, чтобы облегчить высвобождение органов.
ПРИМЕЧАНИЕ: Видны органы брюшной полости, такие как кишечник, мальпигиевые канальцы и яичники. - Извлеките оба яичника с помощью стерилизованных щипцов и поместите их в новую каплю стерильного 1x PBS на предметное стекло микроскопа, чтобы промыть их. Возьмите яичники и поместите их в пробирку объемом 1,5 мл со 100 мкл консервационного буфера.
- Положите комара ему на спину. С помощью щипцов удерживать комара за грудную клетку, чтобы предотвратить движение во время вскрытия, проколоть иглой третий брюшной сегмент (начиная снизу).
- Теперь, когда брюшная полость открыта и органы обнажены, извлеките среднюю кишку с помощью новых стерилизованных щипцов и/или иглы.
- Отделите среднюю кишку от передней и задней кишки; затем удалите мальпигиевые канальцы из средней кишки. Возьмите среднюю кишку с помощью стерильной иглы и поместите ее на новую стерильную каплю 1x PBS, чтобы промыть ее и предотвратить межорганное загрязнение.
- Переложите в новую стерильную каплю 1x PBS. Откройте среднюю кишку с помощью щипцов, чтобы освободить и обогатить бактерии, как описано в Дополнительном файле 1. Захватите среднюю кишку щипцами и пипеткой все бактерии, содержащие PBS, чтобы сохранить весь материал (жидкость и ткани) в новой стерилизованной пробирке объемом 1,5 мл со 100 мкл буфера для консервации.
- Добавьте еще раз 5 μL 1x PBS на ранее использованное место на предметном стекле микроскопа и непосредственно направьте PBS обратно пипеткой в ту же пробирку объемом 1,5 мл, чтобы извлечь бактерии, которые могли прилипнуть к предметному стеклу микроскопа.
- С помощью стерильных щипцов захватите тушу (оставшееся тело) и храните ее в новой стерилизованной пробирке объемом 1,5 мл со 100 мкл буфера для консервации.
- Хранение материала до дальнейшей обработки
- Пометьте пробирки надписями «Вид, Орган, Дата, Имя исследователя».
- Вскрытые яичники, среднюю кишку, слюнные железы и тушу хранят при температуре -20 °C до обработки.
- Отслеживайте в электронной таблице все связанные метаданные для образцов, включая вид (или только уровень рода), дату сбора, страну, провинцию, широту, долготу, имя человека, проводившего вскрытие, гравидную самку или нет, кровяную муку или нет.
Результаты
Вскрытие комаров
Следуя протоколу, мы собрали и изолировали яичники, среднюю кишку, слюнные железы и тушу двух экземпляров Culex pipiens molestus (включая гравидную самку) из лабораторной колонии. Мы подтвердили чистое вскрытие после наблюдения за целыми (то есть неповрежденными) и хорошо изолированными органами без остатков мусора под биноклем. Все тело, голова и грудная клетка, рассеченные слюнные железы, яичники и средняя кишка экземпляра Culex pipiens molestus показаны на рисунке 2. Как и ожидалось, средняя кишка и слюнные железы оказались на порядок меньше, чем яичники комаров. Яйца гравидного экземпляра Culex вместе с его средней кишкой и мальпигиевыми канальцами представлены на рисунке 3. Следует отметить, что рассечения более склонны к неудаче, когда материал не свежий и ткань может сломаться (Рисунок 4B, C). Поэтому мы рекомендуем препарировать материал сразу после сбора (менее чем через 12 часов), если это возможно, так как ткани все еще эластичны (Рисунок 4A). Аналогичным образом, можно проводить вскрытие замороженного материала, но существует гораздо более высокий риск отторжения и перекрестного загрязнения между органами из-за хрупких тканей (Рисунок 4).
Данные о микробиоме
Кроме того, мы собрали и отделили средние кишки и яичники трех отдельных экземпляров Culex quinquefasciatus из Нумеа, Новая Каледония, следуя той же процедуре. Мы извлекли ДНК из каждого органа, подготовили образцы для секвенирования всего генома и провели анализ данных микробиома, как подробно описано в Дополнительном файле 1. Анализ таксономического разнообразия бактерий на несобранных коротких чтениях, отфильтрованных по качеству, с использованием PhyloFlash12 показал отчетливые доминантные таксоны в средней кишке по сравнению с яичниками (рис. 5A). Примечательно, что в бактериальных сообществах яичников преобладали Wolbachia, с дополнительным присутствием филотипа Spirochaetaceae в яичниках особи 3, в то время как сообщества средней кишки демонстрировали более широкое разнообразие, включая Gammaproteobacteria, Spirochaetaceae и Firmicutes. По тем же данным секвенирования мы реконструировали четыре метагеномных собранных генома (МАГ) с завершенностью > 80% и избыточностью < 5%, принадлежащих к классам Spirochaetia, Alpha- и Gammaproteobacteria (табл. 1).
Как и ожидалось, реконструированные здесь MAG не охватывают все таксономическое разнообразие, предсказанное по результатам PhyloFlash, из-за специфических недостатков реконструкции генома с использованием метагеномных коротких ридов. MAG, присвоенный Wolbachia (см. MAG 3 в таблице 1), был обнаружен во всех яичниках и двух средних кишках и имел более высокий охват в яичниках (рис. 5B). Мы также реконструировали два MAG, принадлежащих к семейству Enterobacteriaceae , включая род Pantoea (Ref. MAG 1 и 2 в Таблице 1), в средних кишках, полученных от особей Culex 2 и 3, которые не были обнаружены в соответствующих яичниках (Рисунок 5B). Наконец, мы также реконструировали один бактериальный геном Spirochaetaceae , Ref. MAG 4 (Таблица 1), относящийся к роду BR149 , который был успешно выделен из средних кишек Culex pipiens Гранья-Мираглией и коллегами13. Интересно, что этот MAG был обнаружен в средних кишках особей 1 и 3, а также в яичниках особи 3 (рисунок 5B).
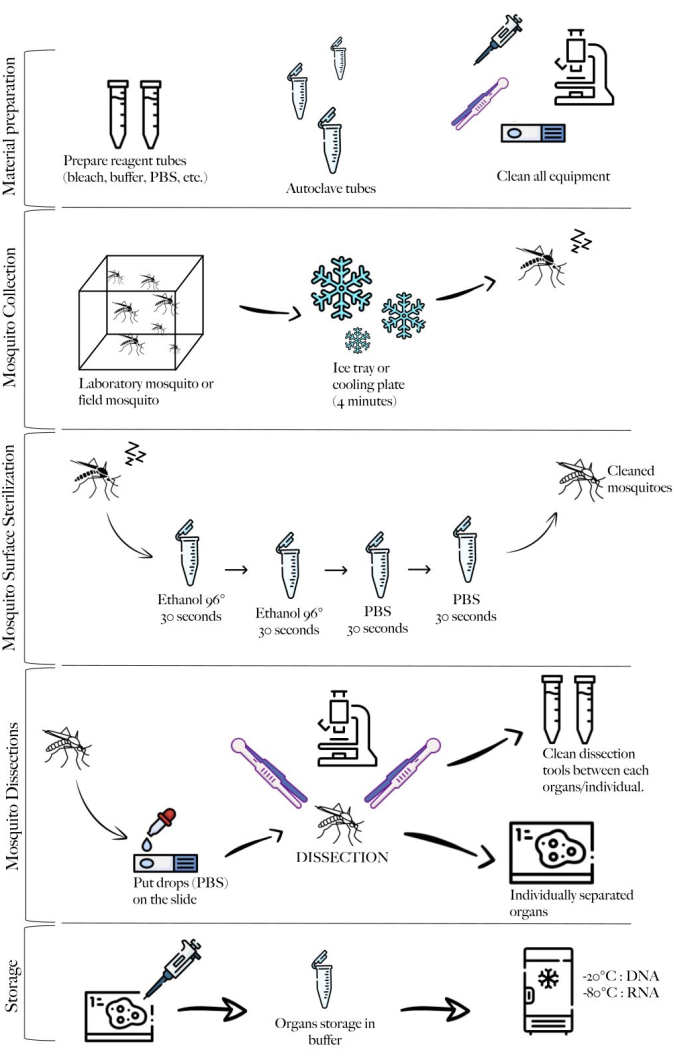
Рисунок 1: Схема метода, обобщающая различные шаги. Подготовка материала, сбор комаров, очистка от комаров, вскрытие и хранение комаров. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
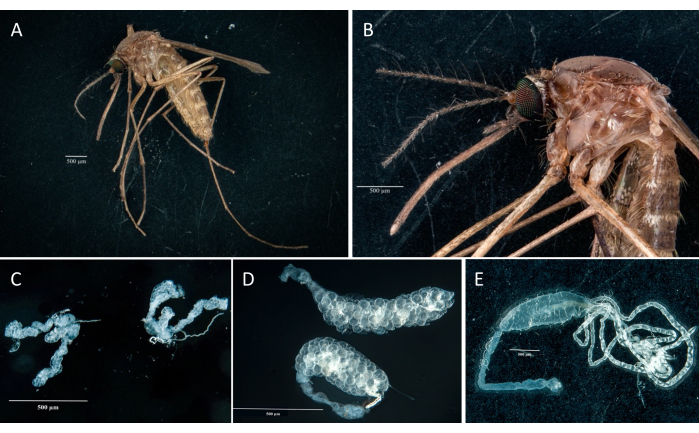
Рисунок 2: Самка Culex pipiens molestus . (А) Все тело. (В) Голова и грудная клетка. (В) Рассеченные слюнные железы. (D) Рассеченные яичники. (E) Рассеченная кишка с канальцами Malpighi. Масштабные линейки = 500 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
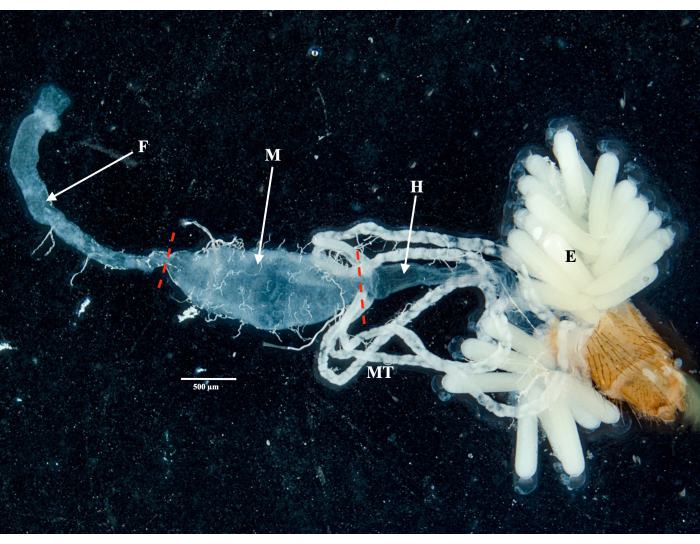
Рисунок 3: Рассеченное брюшко гравиидной самки Culex pipiens molestus . Показаны передняя кишка, средняя кишка, задняя кишка, мальпигиевые канальцы и яйца образца. Красными черточками обозначено, где нужно разрезать, чтобы отделить среднюю кишку от передней и задней кишки. Масштабная линейка = 500 мкм. Сокращения: F = передняя кишка; M = средняя кишка; H = задняя кишка; Е = яйца; MT = мальпигиевые канальцы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
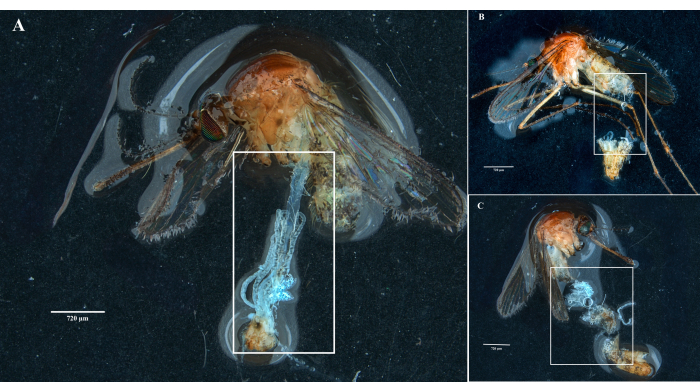
Рисунок 4: Вскрытие свежих и замороженных образцов комаров Culex. Белые прямоугольники иллюстрируют (А) ткани комара с неповрежденными органами из только что препарированного образца и (В,В) сломанный биологический материал из образцов, которые были заморожены перед вскрытием. Масштабные линейки = 720 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
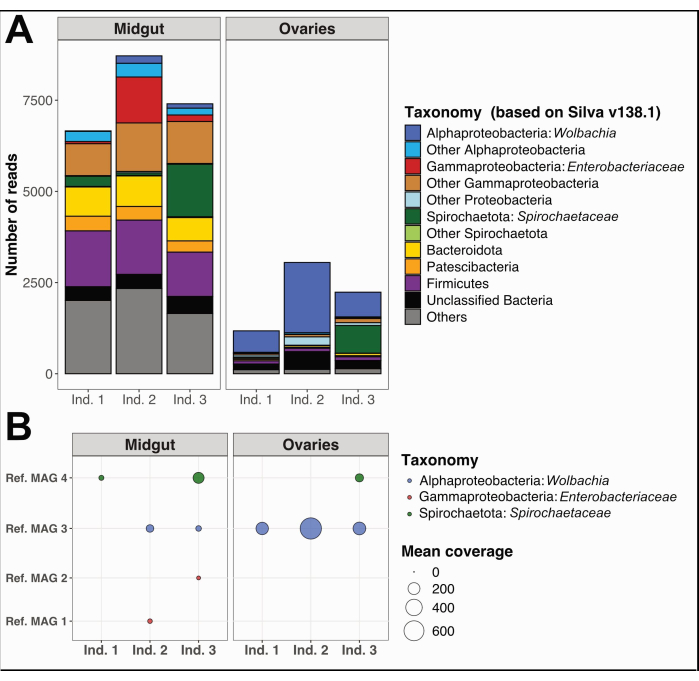
Рисунок 5: Пример анализа микробиома на трех особях Culex quinquefasciatus . (A) Визуализация бактериального разнообразия, оцененная с помощью экстракции считываний SSU рРНК с PhyloFlash12 в средних кишках и яичниках трех образцов. (B) Среднее покрытие реконструированных MAG по образцам. Сокращения: MAG = метагеном-собранный геном; Ind = Индивидуум. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| ЖУРНАЛ | Ссылка MAG 4 | Ссылка MAG 2 | Ссылка MAG 1 | Ссылка MAG 3 |
| Длина (bp) | 1,287,790 | 4,910,866 | 4,751,276 | 1,298,266 |
| Количество контигов | 9 | 162 | 149 | 123 |
| GC % | 34.05 | 55.45 | 54.05 | 34.15 |
| Завершение (%) | 84.5 | 97.18 | 98.59 | 91.55 |
| Избыточность (%) | 0 | 2.82 | 4.22 | 0 |
| Домен | Бактерии | Бактерии | Бактерии | Бактерии |
| Тип | Спирохетота | Протеобактерии | Протеобактерии | Протеобактерии |
| Класс | Спирохетия | Гаммапротеобактерии | Гаммапротеобактерии | Альфапротеобактерии |
| Порядок | WRBN01 | Энтеробактерии (Enterobacterales) | Энтеробактерии (Enterobacterales) | Риккетсиалы |
| Семья | WRBN01 | Энтеробактерии (Enterobacteriaceae) | Энтеробактерии (Enterobacteriaceae) | Анаплазматовые (Anaplasmataceae) |
| Род | БР149 | Пантоэя | - | Вольбахия |
Таблица 1: Реконструированные МАГ трех особей Culex quinquefasciatus . Размер генома, количество контиг, доля GC, оценки завершенности и избыточности основаны на коллекции основных генов с одной копией, доступной в Anvi'o17 , и таксономии, полученной с помощью GTDB18.
Дополнительный файл 1: Подробный пример процедуры анализа данных микробиома , начиная со сбора образцов, извлечения ДНК и секвенирования всего генома, за которым следует биоинформатический рабочий процесс для реконструкции генома и оценки прокариотических и эукариотических пропорций чтения Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Мы рекомендуем обратить особое внимание на последовательность диссекции органа, начиная со слюнных желез. Действительно, мы заметили, что их легче извлечь из грудной клетки образцов Culex , если целостность комара сохранялась. Повреждение брюшной полости или грудной клетки может снизить давление в теле комара, препятствуя процедуре. Тем не менее, также можно разрезать между грудной клеткой и брюшной полостью, а затем вытащить слюнные железы из головы и грудной клетки (А. Б. Файллу, личное сообщение). Кроме того, приобретение профессиональных навыков препарирования может быть сложной задачей, поэтому мы рекомендуем попрактиковаться на достаточном количестве образцов до начала эксперимента.
Изоляция органов комара при систематическом предотвращении перекрестного загрязнения имеет решающее значение для широкого спектра анализов микробиоты комаров. Метагеномное исследование с геномным разрешением, проведенное после вскрытия отдельных яичников из образцов Culex pipiens в Южной Франции, позволило обнаружить первую плазмиду Wolbachia у Culex pipiens (pWCP14). Используя аналогичный подход, мы исследовали распределение и частоту pWCP в образцах Culex pipiens и Culex quinquefasciatus как из континентальных, так и из островных районов по всему миру, в различных экологических и лабораторных условиях. В целом, данные показали удивительно консервативный плазмидный элемент Wolbachia у комаров Culex, что свидетельствует о решающей роли этого мобильного элемента в биологии эндосимбионтов15, что требует дальнейшего анализа.
Здесь мы приводим дополнительные примеры анализов микробиома комаров на образцах средней кишки и яичников, полученных с помощью этой систематической процедуры. Мы наблюдали четкую разницу в микробиоте между тканями (рис. 5) как с общими, так и с органоспецифическими бактериальными таксонами. Как и ожидалось, присутствие Wolbachia было обнаружено в обоих органах, с более высокой относительной численностью (на основе несобранных коротких прочтений) и средним охватом MAGs в яичниках комаров по сравнению со срединными кишками, что согласуется с наблюдением, что этот эндосимбионт передается через яичники и впоследствии распространяется в соматические ткани. Хотя это исследование было ограничено образцами из Новой Каледонии, этот протокол может облегчить изучение геномной изменчивости Wolbachia в глобальном масштабе, а также ее роли в различных фенотипах, включая регуляцию плотности и вирусную защиту. Кроме того, эта работа иллюстрирует, как представленная здесь процедура вскрытия позволяет изучить таксономическое разнообразие и потенциальные функциональные возможности симбионтов комаров в образцах средней кишки.
Мы получили два проекта геномов энтеробактерий, которые присутствовали только в двух образцах средней кишки, что подтверждает отсутствие контаминации между органами у этих двух образцов. Что касается спирохет, обнаруженных как в средней кишке, так и в яичниках особи 3, Juma и коллеги, в 2020 году наблюдали присутствие этих бактерий на поверхности яйцеклеток. Авторы предположили, что бактериальные сообщества, обнаруженные в яичных плотах, могут в первую очередь наследоваться по материнской линии от яичников, учитывая, что яичные плоты содержались в деионизированной и свободной от бактерий воде. Тем не менее, они не могли исключить возможность бактериальной колонизации, происходящей сразу после яйцекладки, и рекомендовали дальнейшее изучение микробиома яичников16.
Несмотря на то, что первоначально этот протокол был разработан для образцов видового комплекса Culex pipiens , мы предполагаем применимость этого протокола к более широкому сообществу медицинских энтомологов, изучающих других переносчиков, таких как Anopheles или Aedes. Работая на уровне отдельных органов, этот метод может обеспечить как внутри- так и межиндивидуальные геномные сравнения, предлагая понимание геномной изменчивости симбионтов в мелком масштабе с потенциалом для совершенствования стратегий борьбы с переносчиками. Этот метод диссекции и изоляции слюнных желез, яичников и средней кишки, предотвращающий микробное перекрестное загрязнение, также может быть полезным протоколом для изучения динамики вирусных инфекций в этих трех органах.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Мы благодарим Гилберта Легоффа за то, что он научил Джордана Тутагату препарировать слюнные железы комаров, и Джулиано Муччи за помощь с фотографиями органов комаров. Мы благодарим Анну-Беллу Файллу и Нонито Пейдж за полезное обсуждение протокола. Эта работа была поддержана стартовым грантом ERC RosaLind "948135" для JR. Мы благодарим платформу Vectopole (IRD, Монпелье) за оказание технической поддержки, а также за выращивание и поддержание популяций комаров.
Материалы
| Name | Company | Catalog Number | Comments |
| Alcohol 96° | Fisher scientific | 10332562 | |
| Binocular magnifier | |||
| Bleach | RAJA | 145517 | 150 tablets of 1.5 g |
| DNA prep kit | Illumina | Provided by MGX sequencing platform | Previously known as Nextera DNA Flex |
| DNA-RNA Shield (50 mL) | Zymo research | ZR1100-50 | Preservation buffer |
| DNeasy Blood and Tissue Kit | Qiagen | 69504 | DNA extraction kit |
| Filter tips 20 µL | Starlab | S1120-3810 | |
| Filter tips 200 µL | Starlab | S1120-8710 | |
| Filter tips 1000 µL | Starlab | S1122-1730-C | |
| Forceps | FST (Fine Science Tools) | 11252-20 | Dumont Forceps #5 |
| Library quantification kit | Roche | Provided by MGX sequencing platform | KAPA Library Quanitification Kits |
| Micropipettes 2-20 µL | Eppendorf | 6.291704 | |
| Micropipettes 20-200 µL | Eppendorf | 6.291703 | |
| Micropipettes 100-1000 µL | Eppendorf | 7.648488 | |
| Microscope slides | Epredia | J1800BMNZ | dimension : 75 mm x 50 mm |
| Needles | Terumo | AN*2719R1 | |
| NGS kit | Agilent | Provided by MGX sequencing platform | Fragment Analyzer Systems HS Genomic DNA 50kb Kit |
| NovaSeq 6000 | Illumina | Provided by MGX sequencing platform | Sequencer |
| PBS Phosphate Buffered Saline (Sterile) | Fisher scientific | 10212990 | |
| Permanent black marker | |||
| Sterile Eppendorf | Dutscher | 33871 | 1.5 mL |
| Support for needles | FST (Fine Science Tools) | 26016-12 | Moria MC1 Pin Holder 12 cm |
Ссылки
- Achee, N. L., et al. Alternative strategies for mosquito-borne arbovirus control. PLOS Negl Trop Dis. 13 (1), e0006822 (2019).
- Hoffmann, A. A., et al. Successful establishment of Wolbachia in Aedes populations to suppress dengue transmission. Nature. 476 (7361), 454-457 (2011).
- Porter, J., Sullivan, W. The cellular lives of Wolbachia. Nat Rev Microbiol. 21 (11), 750-766 (2023).
- Coon, K. L., Brown, M. R., Strand, M. R. Mosquitoes host communities of bacteria that are essential for development but vary greatly between local habitats. Mol Ecol. 25 (22), 5806-5826 (2016).
- Didion, E. M., et al. Microbiome reduction prevents lipid accumulation during early diapause in the northern house mosquito, Culex pipiens pipiens. J Insect Physiol. 134, 104295 (2021).
- Gabrieli, P., et al. Mosquito trilogy: Microbiota, immunity and pathogens, and their implications for the control of disease transmission. Front Microbiol. 12, 630438 (2021).
- Garrigós, M., Garrido, M., Panisse, G., Veiga, J., Martínez-de La Puente, J. Interactions between West Nile Virus and the microbiota of Culex pipiens vectors: A literature review. Pathogens. 12 (11), 1287 (2023).
- Zheng, R., et al. Holobiont perspectives on tripartite interactions among microbiota, mosquitoes, and pathogens. ISME J. 17 (8), 1143-1152 (2023).
- Flores, G. A. M., et al. Wolbachia dominance influences the Culex quinquefasciatus microbiota. Sci Rep. 13 (1), 18980 (2023).
- Hegde, S., et al. Interkingdom interactions shape the fungal microbiome of mosquitoes. Anim Microbiome. 6 (1), 11 (2024).
- Suo, P., et al. Seasonal variation of midgut bacterial diversity in Culex quinquefasciatus populations in Haikou city, Hainan province, China. Biology. 11 (8), 1166 (2022).
- Gruber-Vodicka, H. R., Seah, B. K. B., Pruesse, E. phyloFlash: Rapid small-subunit rRNA profiling and targeted assembly from metagenomes. mSystems. 5 (5), e00920-e00920 (2020).
- Graña-Miraglia, L., et al. Spirochetes isolated from arthropods constitute a novel genus Entomospira genus novum within the order Spirochaetales. Sci Rep. 10 (1), 17053 (2020).
- Reveillaud, J., et al. The Wolbachia mobilome in Culex pipiens includes a putative plasmid. Nat Commun. 10 (1), 1051 (2019).
- Ghousein, A., et al. pWCP is a widely distributed and highly conserved Wolbachia plasmid in Culex pipiens and Culex quinquefasciatus mosquitoes worldwide. ISME Commun. 3 (1), 40 (2023).
- Juma, E. O., Kim, C. -. H., Dunlap, C., Allan, B. F., Stone, C. M. Culex pipiens and Culex restuans egg rafts harbor diverse bacterial communities compared to their midgut tissues. Parasit Vectors. 13 (1), 532 (2020).
- Lee, M. D. GToTree: a user-friendly workflow for phylogenomics. Bioinformatics. 35 (20), 4162-4164 (2019).
- Parks, D. H., et al. A complete domain-to-species taxonomy for bacteria and Archaea. Nat Biotechnology. 38 (9), 1079-1086 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены